Propriétés/EffetsCode ATC
L01FF05
Mécanisme d'action
Tecentriq s.c. contient de l'atézolizumab et de la hyaluronidase humaine recombinante (rHuPH20).
La liaison du PD-L1 aux récepteurs PD-1 et B7.1 sur les cellules T provoque une suppression de l'activité cytotoxique des lymphocytes T par inhibition de la prolifération et de la production de cytokines par les lymphocytes T. Le PD-L1 peut être exprimé sur les cellules tumorales (TC) ainsi que les cellules immunitaires infiltrant les tumeurs (IC) et contribuer à inhiber la réponse immunitaire antitumorale dans le microenvironnement.
L'atézolizumab est un anticorps monoclonal humanisé de type immunoglobuline G1 (IgG1) à fragment Fc modifié, qui se lie directement à PD-L1 et provoque un blocage des interactions avec les récepteurs PD-1 et B7.1. Cela permet de lever l'inhibition de la réponse immunitaire médiée par la voie de signalisation PD-L1/PD-1 et entraîne une réactivation de la réponse immunitaire antitumorale. L'atézolizumab ne modifie pas l'interaction PD-L2/PD-1. Dans des modèles tumoraux syngéniques murins, le blocage de l'activité du PD-L1 a entraîné une diminution de la croissance tumorale.
La double inhibition des voies de signalisation PD-1/PD-L1 et MAPK ainsi que BRAF et MEK entrave la croissance tumorale dans les modèles de cancer chez les souris et améliore l'immunogénicité des tumeurs en augmentant la présentation de l'antigène ainsi que l'activation et l'infiltration des cellules T par rapport à la thérapie ciblée seule.
Localement et de manière transitoire, la hyaluronidase humaine recombinante (rHuPH20) dégrade l'acide hyaluronique (AH), un glycosaminoglycan présent naturellement dans tout l'organisme, dans le compartiment extracelluaire de l'espace sous-cutané, en clivant la liaison entre les deux sucres qui composent l'AH (N-acétylglucosamine et acide glucuronique).
Efficacité clinique
Forme pharmaceutique intraveineuse
Pour des informations détaillées sur les études cliniques ayant été réalisées avec Tecentriq i.v., veuillez consulter l'information professionnelle de Tecentriq i.v.
Cancer du poumon non à petites cellules
NSCLC prétraité par chimiothérapie
IMscin001
BP40657 (IMscin001), une étude de phase Ib/III ouverte, multicentrique, internationale et randomisée, a été réalisée pour évaluer la pharmacocinétique, l'efficacité et la sécurité de Tecentriq s.c. en comparaison avec Tecentriq i.v. chez des patients atteints de NSCLC localement avancé ou métastatique n'ayant pas encore reçu d'immunothérapie anticancéreuse (CIT) et chez des patients dont la maladie a progressé ou récidivé après une chimiothérapie précédente à base de platine. L'étude IMscin001 a été conçue pour démontrer la non-infériorité de l'atézolizumab s.c. comparé à l'atézolizumab i.v. en ce qui concerne le taux sérique résiduel (Cmin) et l'AUC prédite par le modèle, du jour 0 au jour 21 du cycle 1 d'atézolizumab (avant l'administration de la dose au cycle 2) (co-critère principal d'évaluation). Les critères d'évaluation secondaires descriptifs ont inclus la survie sans progression (PFS), le taux de réponse objective (ORR) et la survie globale (OS).
Dans la partie 2 (phase III), 371 patients au total ont été inclus et randomisés pour recevoir soit 1875 mg de Tecentriq s.c. q3w, soit 1200 mg de Tecentriq i.v. q3w. Une réduction de la dose n'était pas autorisée.
Ont été exclus de l'étude les patients présentant des antécédents connus de maladie auto-immune ou des métastases cérébrales évolutives ou corticodépendantes, ainsi que les patients ayant reçu des vaccins vivants atténués dans les 4 semaines précédant la randomisation ou encore ceux ayant utilisé des principes actifs immunostimulants systémiques dans les 4 semaines précédant la randomisation ou des médicaments immunosuppresseurs systémiques dans les 2 semaines précédant la randomisation.
L'âge médian de la population en intention de traiter (intention-to-treat) était de 64 ans (intervalle: de 27 à 85 ans) et 69% des patients étaient de sexe masculin. La majorité des patients étaient des Blancs (67%). Presque les deux tiers des patients (65%) avaient un carcinome non épidermoïde, 5% présentaient une mutation connue de l'EGFR, 2% présentaient des translocations connues de l'ALK, 40% étaient PD-L1-positifs (TC ≥1% et/ou IC ≥1%), 16% présentaient des métastases du SNC non actives à l'inclusion, 26% avaient un score de performance ECOG de 0 et 74% avaient un score de performance ECOG de 1, et la plupart des patients étaient fumeurs ou d'anciens fumeurs (70%).
La non-infériorité de l'exposition à l'atézolizumab dans Tecentriq s.c., comparé à l'atézolizumab i.v., a été démontrée (voir «Pharmacocinétique»). Les résultats d'une analyse d'efficacité post-hoc actualisée, avec une durée de survie médiane de 9,5 mois, sont résumés dans le tableau 5.
Tableau 5: Résumé des analyses d'efficacité actualisées (IMscin001)
|
Critère d'évaluation de l'efficacité
|
Tecentriq s.c.
|
Tecentriq i.v.
| |
ORR évalué et confirmé par l'investigateur (RECIST v1.1)*
|
n = 245
|
n = 124
| |
Nombre de répondeurs (%)
|
27 (11,0%)
|
13 (10,5%)
| |
PFS évaluée par l'investigateur (RECIST v1.1)*
|
n = 247
|
n = 124
| |
Nombre d'événements (%)
|
219 (88,7%)
|
107 (86,3%)
| |
Médiane (mois)
|
2,8
|
2,9
| |
OS*
|
n = 247
|
n = 124
| |
Nombre d'événements (%)
|
144 (58,3%)
|
79 (63,7)
| |
Médiane (mois)
|
10,7
|
10,1
|
ORR = taux de réponse objective; OS = survie globale; PFS = survie sans progression; RECIST = critères d'évaluation de la réponse pour les tumeurs solides version 1.1 (response evaluation criteria in solid tumors v1.1)
* Analyses descriptives
Efficacité de l'atézolizumab en présence d'anticorps dirigés contre le médicament
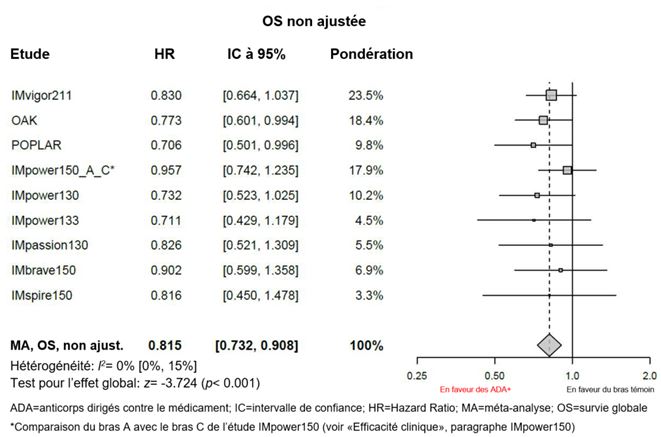
Des méta-analyses exploratoires, non ajustées, portant sur l'efficacité (sans ajustements de déséquilibres des caractéristiques initiales) ont été réalisées avec Tecentriq i.v. Selon ces méta-analyses, la valeur estimée du HR pour la survie globale (OS) était de 0,815 entre le sous-groupe ADA-positif et le bras témoin (IC à 95%: 0,732; 0,908) et la valeur estimée du HR pour l'OS était de 0,672 entre le sous-groupe ADA-négatif et le bras témoin (IC à 95%: 0,617; 0,732), voir graphiques 1 et 2.
Graphique 1: Méta-analyse sur l'OS (non ajustée) de patients ADA-positifs par rapport au bras témoin
Graphique 2: Méta-analyse sur l'OS (non ajustée) de patients ADA-négatifs par rapport au bras témoin
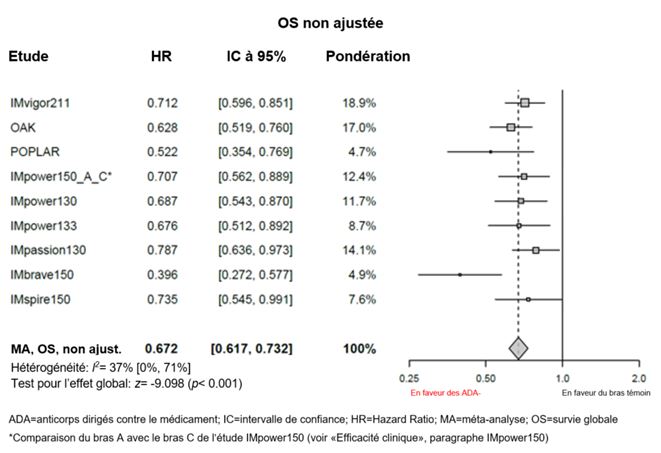
Dans l'étude IMscin001, l'incidence des anticorps anti-atézolizumab en lien avec le traitement était respectivement de 19,5% [43/221] et 13,9% [15/108] chez les patients ayant été traités par Tecentriq s.c. ou par Tecentriq i.v. L'incidence des anticorps anti-rHuPH20 en lien avec le traitement chez les patients traités par Tecentriq s.c. était de 5,4% (12/224).
L'OS médiane était de 12,6 mois (IC à 95%: 10,6; 16,5) chez les patients traités par Tecentriq s.c. qui étaient ADA-négatifs (n = 178) et de 6,9 mois (IC à 95%: 5,0; non estimable) chez les patients qui étaient ADA-positifs (n = 43) à un moment quelconque de l'étude.
|


