CompositionPrincipes actifs
Chlorhydrate de méthylphénidate.
Excipients
Comprimé à libération prolongée à 18 mg:
Noyau du comprimé: macrogol 200'000, macrogol 7'000'000, acide succinique, hypromellose, stéarate de magnésium, chlorure de sodium, silice colloïdale anhydre, oxyde de fer noir (E 172).
Pelliculage: acétate de cellulose, hypromellose, macrogol 3350, lactose monohydraté, dioxyde de titane, triacétine, oxyde de fer jaune, oxyde de fer rouge, acide phosphorique.
Un comprimé à libération prolongée contient 4 mg de lactose monohydraté et 9,4 mg de sodium.
Comprimé à libération prolongée à 27 mg:
Noyau du comprimé: macrogol 200'000, macrogol 7'000'000, acide succinique, hypromellose, stéarate de magnésium, chlorure de sodium, silice colloïdale anhydre, oxyde de fer noir (E 172).
Pelliculage: acétate de cellulose, hypromellose, macrogol 3350, lactose monohydraté, dioxyde de titane, triacétine, oxyde de fer noir, oxyde de fer rouge, acide phosphorique.
Un comprimé à libération prolongée contient 3,4 mg de lactose monohydraté et 9,4 mg de sodium.
Comprimé à libération prolongée à 36 mg:
Noyau du comprimé: macrogol 200'000, macrogol 7'000'000, acide succinique, hypromellose, stéarate de magnésium, chlorure de sodium, silice colloïdale anhydre, oxyde de fer noir (E 172).
Pelliculage: acétate de cellulose, hypromellose, macrogol 3350, lactose monohydraté, dioxyde de titane, triacétine, acide phosphorique.
Un comprimé à libération prolongée contient 6,6 mg de lactose monohydraté et 18,9 mg de sodium.
Comprimé à libération prolongée à 54 mg:
Noyau du comprimé: macrogol 200'000, macrogol 7'000'000, acide succinique, hypromellose, stéarate de magnésium, chlorure de sodium, silice colloïdale anhydre, oxyde de fer noir (E 172).
Pelliculage: acétate de cellulose, hypromellose, macrogol 3350, lactose monohydraté, dioxyde de titane, triacétine, oxyde de fer rouge, acide phosphorique.
Un comprimé à libération prolongée contient 6,8 mg de lactose monohydraté et 18,9 mg de sodium.
Indications/Possibilités d’emploiMéthylphénidate Spirig HC retard est indiqué pour traiter un trouble déficitaire de l'attention/hyperactivité (TDA-H) persistant depuis l'enfance, dans le cadre d'une stratégie thérapeutique globale.
Le traitement ne doit être commencé que par des médecins spécialisés dans les troubles du comportement de l'enfant et de l'adolescent ou de l'adulte et doit également être surveillé par ceux-ci.
L'efficacité de méthylphénidate dans le traitement du TDA-H a été documentée dans des études cliniques contrôlées sur des enfants et des adolescents âgés de 6 à 17 ans et sur des adultes âgés de 18 à 65 ans, qui montraient les critères DSM-IV du TDA-H.
Une partie des enfants chez qui un TDA-H a été diagnostiqué, présentent également des symptômes à l'âge adulte. Chez l'adulte, les symptômes doivent donc déjà avoir commencé dans l'enfance lorsqu'un traitement est initié. L'emploi de Méthylphénidate Spirig HC retard devrait se limiter aux patientes et patients qui ont besoin d'un médicament dont l'effet dure de la prise matinale jusqu'au soir.
Méthylphénidate Spirig HC retard devrait être utilisé, en tant que partie d'un programme thérapeutique complet, lorsque les mesures thérapeutiques pour stabiliser le comportement à elles seules n'ont pas suffi. Le programme thérapeutique complet pour traiter le TDA-H peut comprendre des mesures psychologiques, éducationnelles et sociales.
Le diagnostic devrait être posé suivant les critères DSM actuels ou la classification ICD.
Un traitement par Méthylphénidate Spirig HC retard n'est pas indiqué chez tous les enfants et adolescents atteints de TDA-H et la décision d'utiliser un médicament doit reposer sur une évaluation très soigneuse du degré de gravité des symptômes du patient. Les stimulants ne sont pas prévus pour être utilisés chez des patients qui montrent des symptômes secondaires dus à leur environnement et/ou d'autres troubles psychiatriques primaires, psychoses comprises. Des mesures éducationnelles adaptées sont essentielles et une prise en charge psychosociale est souvent bénéfique.
L'étiologie spécifique de ce syndrome est inconnue. Un diagnostic adéquat ne peut pas être posé par un seul test diagnostique. Il exige l'emploi de ressources médicales, psychologiques, pédagogiques et sociales. L'apprentissage peut être entravé, mais pas obligatoirement. Le traitement par Méthylphénidate Spirig HC retard peut atténuer les principaux symptômes du TDA-H tels qu'une distraction modérée à sévère, une attention diminuant rapidement, une impulsivité, une hyperactivité motrice et un trouble du comportement social.
Posologie/Mode d’emploiExamens préconisés avant le début du traitement
Avant de commencer le traitement par Méthylphénidate Spirig HC retard, il est nécessaire d'effectuer un examen cardiovasculaire, comprenant la tension artérielle et la fréquence cardiaque, et de noter ceux-ci. Comme il n'existe pas de données à long terme, des examens cardiovasculaires réguliers devraient être effectués en présence d'un profil de facteurs de risque (voir «Mises en garde et précautions»).
Par ailleurs, il convient de mesurer le poids et la taille du patient avant le début du traitement et de les noter sur une courbe de croissance.
Posologie usuelle
Enfants et adolescents (dès 6 ans) et adultes
Le traitement ne doit être initié que par un médecin ayant de l'expérience dans le traitement des troubles de comportement chez les enfants, les adolescents et les adultes et doit être également surveillé par lui.
Méthylphénidate Spirig HC retard s'administre une fois par jour par oral. Comme il est prouvé que l'effet dure pendant douze heures à partir de la prise, le produit doit être pris une fois par jour le matin.
Schéma d'administration
Patients prenant le méthylphénidate pour la première fois
La dose initiale journalière recommandée de Méthylphénidate Spirig HC retard pour les patients qui ne prennent pas de méthylphénidate actuellement, ou à qui l'on administre d'autres stimulants que le méthylphénidate, est de 18 mg une fois par jour pour les enfants et adolescents et de 18 ou 36 mg une fois par jour pour les adultes.
Patients prenant déjà du méthylphénidate actuellement
La dose journalière de Méthylphénidate Spirig HC retard recommandée pour les patients prenant actuellement déjà le méthylphénidate trois fois par jour à des posologies de 10 à 60 mg/jour est indiquée dans le tableau suivant:
Tableau 1: Passage à Méthylphénidate Spirig HC retard pour les patients prenant déjà du méthylphénidate
|
Dose journalière de méthylphénidate
prise jusqu'à présent
|
Dose de Méthylphénidate Spirig HC retard
recommandée
| |
5 mg de méthylphénidate 3× par jour
|
18 mg 1× jour le matin
| |
10 mg de méthylphénidate 3× par jour
|
36 mg 1× jour le matin
| |
15 mg de méthylphénidate 3× par jour
|
54 mg 1× jour le matin
| |
20 mg de méthylphénidate 3× par jour
|
72 mg 1× jour le matin
|
Ajustement de la posologie/titration
La détermination de la posologie pour les patients prenant actuellement du méthylphénidate dans un autre contexte doit se faire après évaluation clinique.
En général on peut augmenter la dose par paliers de 18 mg à intervalles hebdomadaires.
Les doses journalières supérieures à 54 mg chez l'enfant et supérieures à 72 mg chez l'adolescent et l'adulte ne sont pas recommandées.
Traitement au long cours
Il n'existe pas d'analyses systématiques au moyen d'études contrôlées en ce qui concerne l'emploi à long terme du méthylphénidate, surtout en ce qui concerne le potentiel de dépendance et d'autres effets indésirables (voir aussi «Mises en garde et précautions» et «Effets indésirables»). La nécessité d'un traitement au long cours devrait être vérifiée régulièrement et le produit arrêté pour tester l'état des patients sans prise de médicament.
Passage de Méthylphénidate Spirig HC retard à une autre préparation de méthylphénidate à libération prolongée
D'autres formulations de méthylphénidate à libération prolongée avec d'autres profils de libération présentent éventuellement aussi d'autres profils d'efficacité et de tolérance que Méthylphénidate Spirig HC retard. Il est recommandé de ne procéder à une substitution que sous surveillance médicale additionnelle.
Réduction de la dose et arrêt
En cas de réactions paradoxales (aggravation des symptômes) ou d'autres effets indésirables, la posologie doit être réduite ou, si c'est nécessaire, le produit doit être arrêté complètement.
Posologies spéciales
Patients âgés (>65 ans)
L'utilisation de Méthylphénidate Spirig HC retard chez les patients âgés de plus de 65 ans n'a pas été étudiée dans des études contrôlées.
Enfants (<6 ans) et adolescents
L'utilisation de Méthylphénidate Spirig HC retard chez les patients de moins de 6 ans n'a pas été étudiée dans des études contrôlées. Méthylphénidate Spirig HC retard ne doit pas être utilisé chez les patients de moins de 6 ans.
En l'absence d'amélioration des symptômes après une augmentation de la dose pendant 1 mois, le médicament doit être arrêté.
Méthylphénidate Spirig HC retard doit être arrêté de temps en temps (mais au plus tard après 12 mois) et le bénéfice du traitement doit être réévalué.
Mode d'administration
Les comprimés à libération prolongée de Méthylphénidate Spirig HC retard doivent être pris entiers avec du liquide. Ils ne doivent être ni croqués, ni écrasés, ni coupés en morceaux car le principe actif se trouve à l'intérieur d'une enveloppe non absorbable, au travers de laquelle il est libéré de façon contrôlée et continuelle (voir «Mises en garde et précautions»).
Méthylphénidate Spirig HC retard peut être pris avec ou sans nourriture (voir «Pharmacocinétique»).
Contre-indications·Crises d'angoisse, de tension psychique et d'agitation prononcées, car le méthylphénidate peut renforcer ces symptômes;
·diagnostic ou antécédents de dépression grave, anorexie mentale, symptômes psychotiques, tendance suicidaire, manie, schizophrénie ou trouble de la personnalité borderline car le méthylphénidate peut aggraver ces états;
·abus d'alcool et de drogues;
·antécédents familiaux ou diagnostic de syndrome de Gilles de la Tourette;
·glaucome;
·lors d'une augmentation de volume de la prostate et impossibilité de complètement vider la vessie;
·phéochromocytome;
·hyperthyroïdie;
·troubles du rythme cardiaque;
·présence de maladies cardio-vasculaires incluant hypertension sévère, insuffisance cardiaque, angine de poitrine, malformation cardiaque congénitale hémodynamiquement significative, cardiomyopathies, infarctus du myocarde, arythmies et canalopathies (affections provoquées par un dysfonctionnement des canaux ioniques) potentiellement fatales;
·artériopathie oblitérante;
·affections cérébrovasculaires préexistantes, telles qu'anévrysmes cérébraux, anomalies vasculaires y compris vascularite et AVC;
·traitement par les inhibiteurs de la monoamine-oxydase (IMAO) et pendant au moins 14 jours après l'arrêt d'un IMAO (cela pourrait entraîner une hypertension artérielle aiguë) (voir «Interactions»);
·hypersensibilité connue au principe actif ou à l'un des excipients mentionnés la composition.
Mises en garde et précautionsDes cas de décès soudains ont été rapportés chez les enfants et des adultes traités par des stimulants, y compris le méthylphénidate, et ayant des anomalies cardiaques structurelles. De tels événements ont également été observés dans des cas isolés chez des patients porteurs supposés de maladies cardiovasculaires préexistantes. En conséquence, le méthylphénidate ne sera pas administré chez les patients ayant des anomalies cardiaques structurelles ou des antécédents de maladies cardiovasculaires.
Pour identifier l'existence de maladies cardiaques, on devrait effectuer chez les patients qu'on prévoit de traiter par le méthylphénidate une anamnèse soigneuse (y compris l'anamnèse familiale de décès subits ou d'arythmies ventriculaires) et un examen physique. Si les premiers résultats indiquent une maladie de ce type, d'autres examens cardiologiques (par ex. électrocardiogramme, échocardiogramme) doivent être faits.
Le statut cardiovasculaire doit être surveillé. La tension et la fréquence cardiaque doivent être vérifiées et documentées à chaque ajustement de la dose ou à des intervalles appropriés (mais au moins tous les 6 mois) et après si c'est indiqué cliniquement.
Chez les enfants et les adultes qui montreraient pendant un traitement par le méthylphénidate des symptômes comme palpitations, douleurs dans la poitrine lors d'efforts physiques, syncopes ou d'autres symptômes laissant supposer une maladie cardiaque, un examen cardiologique doit être effectué immédiatement.
Méthylphénidate Spirig HC retard ne doit pas être utilisé chez les patients de moins de six ans. Il n'existe pas de données suffisantes sur l'efficacité et la sécurité et sur la posologie chez l'enfant de moins de six ans.
Les stimulants à effet sur le système nerveux central, méthylphénidate compris, ont été mis en relation avec le déclenchement ou l'aggravation de tics moteurs ou verbaux. Pendant le traitement par le méthylphénidate, les patients doivent être surveillés en ce qui concerne la survenue de tics ou d'un syndrome de Gilles de la Tourette lors de chaque adaptation posologique et lors de chaque consultation; le traitement doit être interrompu si la clinique l'impose.
On a rapporté des cas d'inhibition de la croissance (prise de poids réduite et/ou augmentation réduite de la taille) en rapport avec le traitement à long terme d'enfants par le méthylphénidate. Des études de suivi chez des enfants âgés de 7 à 10 ans suggèrent que les enfants prenant constamment du méthylphénidate (p.ex. 7 jours par semaine pendant 1 an) peuvent présenter un ralentissement transitoire de la vitesse de croissance (en moyenne, réduction de la croissance en taille de 2 cm et réduction de la prise de poids de 2,7 kg sur 3 ans). Pour cette raison, les enfants et les adolescents ayant besoin d'un traitement à long terme devraient faire l'objet d'une surveillance très stricte (au moins tous les 6 mois) en ce qui concerne leur taille, leur poids et leur appétit et ces derniers devraient être notés sur une courbe de croissance. Le traitement devrait être interrompu chez les patients dont la croissance ou la prise de poids ne correspondent pas aux attentes.
Il existe des indices cliniques montrant que des troubles psychiatriques (y compris comportement de dépendance et comportement suicidaire) ainsi qu'une perte de poids et d'appétit surviennent plus fréquemment lors de l'administration de médicaments à base de méthylphénidate. De telles modifications ou des signes d'usage détourné ou d'abus du médicament doivent être recherchés attentivement à chaque consultation et à chaque ajustement de la dose.
Il convient d'attirer l'attention des patients sur le fait que les comprimés à libération prolongée de Méthylphénidate Spirig HC retard doivent être pris entiers avec un peu de liquide. Ils ne doivent être ni croqués, ni écrasés, ni coupés en morceaux. Le principe actif se trouve à l'intérieur d'une enveloppe non-absorbable, au travers de laquelle il est libéré de façon contrôlée et continuelle. L'enveloppe est éliminée du corps avec les autres composants insolubles du noyau du comprimé; il n'y a donc pas lieu de s'inquiéter si le patient découvre dans ses selles un objet ressemblant à un comprimé.
Comme les comprimés à libération prolongée de Méthylphénidate Spirig HC retard ne sont pas déformables et ne changent pas sensiblement de forme même dans le tractus gastro-intestinal, Méthylphénidate Spirig HC retard ne devrait normalement pas être donné à des patients ayant une grave sténose gastro-intestinale préexistante ou un rétrécissement gastro-intestinal (pathologique ou iatrogène), une dysphagie ou une difficulté marquée à avaler des comprimés. On a rapporté quelques cas rares de symptômes d'obstruction chez des patients ayant un rétrécissement gastro-intestinal connu en liaison avec la prise de médicaments aux formules non déformables et à libération prolongée d'actifs. En raison de la structure du comprimé à libération prolongée permettant la libération contrôlée de l'actif, Méthylphénidate Spirig HC retard ne devrait être donné qu'aux patients capables d'avaler le comprimé à libération prolongée en entier.
Méthylphénidate Spirig HC retard ne doit pas être utilisé pour traiter des dépressions sévères, ni pour la prévention ou le traitement d'états de fatigue normaux.
La plus grande prudence est recommandée en cas d'administration de stimulants pour traiter le TDA-H chez des patients pouvant présenter un trouble bipolaire associé, mais se trouvant à ce moment-là en euthymie ou en intervalle d'entretien, car un épisode maniaque pourrait être déclenché. Avant de commencer un traitement par les stimulants, il faut vérifier très soigneusement chez les patients présentant des symptômes dépressifs associés s'il n'existe pas chez eux un risque de trouble bipolaire. Ceci implique le relevé d'une anamnèse psychiatrique détaillée, y compris une anamnèse familiale des suicides, troubles bipolaires et dépressions.
Des symptômes psychotiques (par ex. hallucinations) ou maniaques ont été observés chez des patients ayant un antécédent de maladie psychotique ou de manie sous traitement par Méthylphénidate Spirig HC retard aux posologies usuelles. Dans le cas où de tels symptômes apparaîtraient, il faudrait vérifier soigneusement si Méthylphénidate Spirig HC retard joue un rôle causal; l'arrêt du traitement peut être approprié (voir «Effets indésirables»).
Chez les patients commençant un traitement par Méthylphénidate Spirig HC retard, il faut faire attention à l'apparition ou au renforcement de comportements agressifs. Une surveillance attentive est nécessaire. L'agressivité est souvent liée au TDA-H; cependant on a signalé une apparition ou un renforcement inattendus de l'agressivité pendant le traitement par méthylphénidate. Un arrêt du traitement peut être envisagé (voir «Effets indésirables»).
Comme avec d'autres substances sérotoninergiques, un syndrome sérotoninergique peut également survenir sous méthylphénidate (voir «Interactions»).
Des cas isolés d'érection pénienne douloureuse de longue durée (priapisme) ayant nécessité une intervention médicale immédiate, ou parfois même chirurgicale, ont été rapportés aussi bien chez des adultes que chez des enfants et des adolescents (voir «Effets indésirables»). Les cas de priapisme n'ont pour la plupart d'entre eux pas été observés au début du traitement, mais sont survenus après que le médicament a été pris pendant un certain temps déjà, souvent à la suite d'une augmentation des doses. Un priapisme a également été observé au cours de périodes sans traitement par méthylphénidate (pause thérapeutique ou arrêt du traitement). Les patients qui développent des érections douloureuses anormalement prolongées (plus de deux heures) ou fréquentes doivent immédiatement consulter un médecin. Le personnel médical doit explicitement informer les patients et leurs parents sur ce problème et sur son caractère d'urgence.
Affections cérébrovasculaires
Des affections cérébrovasculaires telles que vascularite/artérite cérébrale, occlusion cérébrovasculaire et hémorragie cérébrale ont été rapportées lors de l'utilisation de méthylphénidate (voir «Effets indésirables»). Leur dépistage précoce sur la base d'indices clairs peut permettre l'arrêt immédiat de Méthylphénidate Spirig HC retard et est essentiel pour l'instauration d'un traitement précoce. Ces indices clairs sont des symptômes neurologiques d'apparition récente en rapport avec une ischémie ou une hémorragie cérébrale, tels que des céphalées intenses, une sensation d'engourdissement, une faiblesse unilatérale, une paralysie ainsi que des troubles de la coordination, de la vision, de la parole ou de la mémoire.
Le traitement par Méthylphénidate Spirig HC retard n'est pas recommandé chez les patients présentant des affections cérébrovasculaires préexistantes (p.ex. anévrysme, malformations/anomalies vasculaires) (voir «Contre-indications»).
L'expérience clinique laisse supposer que l'administration de méthylphénidate à des patients présentant des troubles psychotiques peut exacerber les symptômes de troubles comportementaux ou de troubles de la pensée.
Les examens de laboratoire des études cliniques chez les enfants ont montré que tant méthylphénidate à libération continue du principe actif que le méthylphénidate administré trois fois par jour augmentaient, par rapport au placebo, le pouls au repos de 2 à 6 battements par minute en moyenne, ainsi que la tension artérielle systolique et diastolique d'environ 1 à 4 mmHg. Dans les études contrôlées par un placebo chez les adultes on a observé au point final une augmentation moyenne du pouls au repos de 4 à 6 battements par minute contre un changement moyen d'environ –2 à 3 battements par minute sous placebo. Au point final, les changements moyens de la tension artérielle sous méthylphénidate allaient de –1 à 1 mmHg (systolique) et de 0 à 1 mmHg (diastolique), tandis qu'ils étaient sous placebo de –1 à 1 mmHg (systolique) et de –2 à 0 mmHg (diastolique).
La prudence est donc recommandée en cas de traitement de patients dont l'état général pourrait être affecté par une élévation de la tension ou de la fréquence du pouls.
La prudence est recommandée chez les patients ayant des antécédents de dépendance à un médicament. L'abus chronique peut entraîner une accoutumance marquée et une dépendance psychique avec divers degrés de comportement anormal. Des épisodes manifestement psychotiques peuvent se produire, surtout lors d'usage abusif par voie parentérale.
Lors de l'arrêt d'une utilisation abusive, une surveillance très étroite est nécessaire, car de graves dépressions peuvent alors apparaître. En cas d'arrêt après une utilisation thérapeutique chronique, les symptômes du trouble de base peuvent être démasqués et exiger un traitement complémentaire.
Une surveillance attentive du patient est indispensable à l'arrêt du médicament car des manifestations de sevrage sont possibles et une dépression ou une hyperactivité chronique peuvent alors être révélées. Certains patients nécessitent éventuellement un suivi prolongé.
Il existe des indices cliniques selon lesquels le méthylphénidate pourrait abaisser le seuil des crises chez les patients ayant des antécédents de crises épileptiques, ou présentant un EEG anormal sans crises épileptiques ou, dans des cas très rares, chez des patients sans crises épileptiques antérieures et sans indications dans l'EEG. Le médicament doit être arrêté si des convulsions se manifestent.
Dans de rares cas, des symptômes de troubles de la vision se sont produits. On a rapporté alors des troubles de l'accommodation et une vision floue.
Pendant un traitement à long terme, des examens hématologiques périodiques sont recommandés (hémogramme différentiel complet et numération des plaquettes).
La décision, après anamnèse détaillée et examen complet, de prescrire Méthylphénidate Spirig HC retard dans les troubles hyperkinétiques devrait dépendre de l'évaluation du degré de sévérité des symptômes et de l'âge de l'enfant. La décision ne devrait pas être prise seulement en raison de l'existence d'un ou de plusieurs troubles comportementaux manifestes. Si les symptômes sont liés à des réactions de stress aiguës, Méthylphénidate Spirig HC retard n'est en général pas indiqué.
Prudence lors de l'utilisation d'agonistes alpha-2 centraux, tels que la clonidine (voir «Interactions»).
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre Méthylphénidate Spirig HC retard.
Sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par comprimé à libération prolongée, c'est-à-dire qu'il est essentiellement «sans sodium».
InteractionsInteractions pharmacocinétiques
Méthylphénidate Spirig HC retard ne doit pas être administré aux patients traités par inhibiteurs de la MAO (traitement actuel ou durant les deux semaines précédentes) (voir «Contre-indications»).
A cause d'une élévation possible de la tension artérielle, Méthylphénidate Spirig HC retard sera administré avec prudence lors de son association à des agents vasopresseurs.
La survenue d'un syndrome sérotoninergique a été rapportée après l'utilisation concomitante de méthylphénidate et d'autres médicaments sérotoninergiques.
Les médicaments sérotoninergiques comprennent par exemple les triptans, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine-noradrénaline (IRSN), le lithium, le fentanyl et ses analogues, le tramadol, le dextrométhorphane, le tapentadol, la mépéridine, la méthadone, la pentazocine et le millepertuis (Hypericum perforatum) tout comme les principes actifs inhibant le métabolisme de la sérotonine (y compris les IMAO comme le bleu de méthylène), le principe actif antibiotique linézolide et les précurseurs de la sérotonine comme par exemple les suppléments de tryptophane.
L'administration concomitante de Méthylphénidate Spirig HC retard et d'un de ces médicaments sérotoninergiques n'est pas recommandée car elle peut provoquer le développement d'un syndrome sérotoninergique.
Le syndrome sérotoninergique est une situation potentiellement fatale. Les symptômes peuvent par exemple comprendre des modifications de l'état mental, une instabilité du système nerveux autonome, des symptômes neuromusculaires, des convulsions et/ou des symptômes gastro-intestinaux. Dans sa forme la plus sévère, le syndrome sérotoninergique peut ressembler à un syndrome malin des neuroleptiques.
Il est important de reconnaître rapidement ces symptômes. En cas de suspicion d'un syndrome sérotoninergique, le méthylphénidate doit être immédiatement arrêté et un traitement approprié doit être instauré.
Anesthésiques halogénés: il y a un risque d'augmentation soudaine de la pression artérielle au cours d'opérations. Il ne faudrait pas prendre de méthylphénidate le jour de l'intervention lorsqu'une intervention chirurgicale est planifiée.
Influence de Méthylphénidate Spirig HC retard sur la pharmacocinétique d'autres substances
Des rapports indiquent que le méthylphénidate peut inhiber le métabolisme d'anticoagulants de type coumarine, d'anticonvulsivants (p.ex. phénobarbital, phénytoïne ou primidone) et de certains antidépresseurs (antidépresseurs tricycliques et inhibiteurs sélectifs de la recapture de la sérotonine). Lors de l'instauration ou de l'arrêt d'un traitement par le méthylphénidate, il peut s'avérer nécessaire d'ajuster la dose de ce médicament co-administré et de déterminer les concentrations plasmatiques du principe actif (ou le temps de coagulation dans le cas de la coumarine).
Des effets indésirables graves (dont une mort subite) ont été signalés en cas d'utilisation simultanée de clonidine et de méthylphénidate. La sécurité de l'utilisation du méthylphénidate en association avec la clonidine ou d'autres α2-agonistes à effet central n'a pas été étudiée systématiquement jusqu'à présent.
Interactions pharmacodynamiques
Méthylphénidate Spirig HC retard peut diminuer l'effet hypotenseur des antihypertenseurs.
L'alcool peut renforcer les effets indésirables sur le système nerveux central des psychotropes, Méthylphénidate Spirig HC retard compris. Il est donc conseillé de renoncer à l'alcool pendant le traitement.
Substances dopaminergiques incluant les antipsychotiques: Comme l'un des principaux effets du méthylphénidate est d'augmenter les taux extracellulaires de dopamine, Méthylphénidate Spirig HC retard peut être associé à des interactions pharmacodynamiques lorsqu'il est administré avec des agonistes dopaminergiques directs ou indirects (y compris des substances dopaminergiques et des antidépresseurs tricycliques), ou alors avec des antagonistes dopaminergiques, y compris des antipsychotiques. La prudence est recommandée chez les patients traités par Méthylphénidate Spirig HC retard et un antipsychotique, car des symptômes extrapyramidaux pourraient survenir lors de l'administration concomitante de ces médicaments ou lors de l'ajustement de la posologie de l'un de ces médicaments ou des deux médicaments.
Grossesse, allaitementGrossesse
Méthylphénidate Spirig HC retard ne doit pas être utilisé pendant la grossesse sauf si c'est absolument nécessaire.
Les résultats d'une étude de cohorte portant sur au total d'environ 3400 femmes exposées au cours du premier trimestre de la grossesse ne montrent pas d'augmentation du risque global d'anomalies congénitales. Par rapport aux grossesses non exposées, une faible augmentation de la fréquence de malformations cardiaques a été observée (risque relatif ajusté combiné, 1,3; IC à 95 %, 1,0 - 1,6), correspondant à trois enfants supplémentaires nés avec des malformations cardiaques pour 1000 femmes exposées au méthylphénidate pendant le premier trimestre de grossesse.
Des cas de toxicité cardiorespiratoire néonatale, notamment des tachycardies et des détresses respiratoires fœtales, ont été rapportés dans le cadre des notifications spontanées.
Allaitement
Le méthylphénidate a été mis en évidence dans le lait maternel. Sur la base d'échantillons de lait maternel de cinq mères, les concentrations de méthylphénidate présentes dans le lait maternel ont entraîné des doses correspondant à 0,16 à 0,7% de la dose maternelle corrigée en fonction du poids chez le nourrisson et un rapport de la quantité dans le lait maternel sur la quantité dans le plasma maternel de 1,1, à 2,7. Par mesure de précaution, on devrait conseiller aux mères qui allaitent de ne pas prendre Méthylphénidate Spirig HC retard.
Effet sur l’aptitude à la conduite et l’utilisation de machinesOn sait que méthylphénidate peut occasionner des vertiges. La prudence est donc recommandée en cas de conduite automobile, de conduite de machines ou d'autres activités potentiellement dangereuses. Les patients devraient être avertis en conséquence jusqu'à ce qu'ils soient suffisamment sûrs que Méthylphénidate Spirig HC retard n'a pas d'influence négative sur leur aptitude à exercer ces activités.
Effets indésirablesDans les paragraphes suivants, la fréquence est indiquée comme suit: très fréquents (≥1/10), fréquents (<1/10 et ≥1/100), occasionnels (<1/100 et ≥1/1000), rares (<1/1000 et ≥10'000), très rares (<1/10'000)
Des effets indésirables considérés comme des effets de classe ont été observés lors de l'emploi de médicaments contenant du méthylphénidate.
Les effets indésirables observés le plus fréquemment sont:
Infections et infestations: rhinopharyngite.
Troubles du métabolisme et de la nutrition: anorexie, diminution de l'appétit, diminution modérée de la prise de poids et de la croissance en taille en cas d'utilisation prolongée chez l'enfant.
Affections psychiatriques: insomnie, nervosité, anorexie, labilité affective, agression, agitation, anxiété, dépression, irritabilité, comportement anormal.
Affections du système nerveux: céphalées, vertiges, dyskinésie, hyperactivité psychomotrice, somnolence.
Affections cardiaques: arythmie, tachycardie, palpitations.
Affections vasculaires: hypertension.
Affections respiratoires, thoraciques et médiastinales: toux, douleurs pharyngées et laryngées.
Affections gastro-intestinales: douleurs abdominales, diarrhée, nausées, troubles gastriques et vomissements, sécheresse buccale.
Affections de la peau et du tissu sous-cutané: alopécie, prurit, éruption cutanée, urticaire.
Affections musculosquelettiques et du tissu conjonctif: arthralgie.
Troubles généraux et anomalies au site d'administration: pyrexie, retard de croissance lors d'une utilisation prolongée chez l'enfant.
Investigations: modifications de la pression artérielle et de la fréquence cardiaque (le plus souvent une élévation), perte de poids.
Indépendamment de leur fréquence, il faut informer aussi les patients des effets indésirables suivants, cliniquement significatifs ou sévères, survenant avec les médicaments contenant du méthylphénidate:
Affections psychiatriques: suicide, tentative de suicide, idées suicidaires, comportement répétitif, hallucinations tactiles.
Affections du système nerveux: mouvements choréo-athétosiques, tics ou aggravation de tics existants, troubles nerveux réversibles, migraine, syndrome malin des neuroleptiques.
Affections oculaires: troubles de l'accommodation.
Affections cardiaques: mort subite cardiaque, infarctus du myocarde.
Affections vasculaires: troubles ou hémorragie cérébrovasculaires, vascularite, syndrome de Raynaud, sensation de froid périphérique (mains ou pieds froids).
Affections gastro-intestinales: insuffisance hépatique.
Affections de la peau et du tissu sous-cutané: dermatite exfoliative, syndrome de Steven-Johnson, érythème polymorphe, exanthème médicamenteux.
Troubles du rein et des voies urinaires: hématurie.
Affections des organes de reproduction et du sein: gynécomastie.
En outre, des effets indésirables ont été rapportés en relation avec l'utilisation de méthylphénidate:
Données provenant des études cliniques
Les effets indésirables figurant ci-dessous ont été rapportés dans le cadre d'études faites soit chez l'enfant ou l'adolescent, soit chez l'adulte et peuvent s'appliquer aux deux populations de patients.
Patients pédiatriques
La tolérance de méthylphénidate a été étudiée dans quatre études cliniques en double-aveugle contrôlées par placebo sur 639 patients pédiatriques (enfants et adolescents) atteints de TDA-H. Les informations de ce paragraphe sont tirées de données regroupées.
Dans le tableau 2 sont listés les effets indésirables qui ont été signalés dans ces études chez ≥1% des patients pédiatriques traités par méthylphénidate (enfants et adolescents).
Tableau 2: Effets indésirables signalés dans quatre études cliniques en double-aveugle contrôlées par un placebo chez ≥1% des patients pédiatriques traités par méthylphénidate (enfants et adolescents)
|
Système/classe organique
Effet indésirable
|
Méthylphénidate
(n= 321)
%
|
Placebo
(n= 318)
%
| |
Infections et infestations
| |
Rhinopharyngite
|
2,8
|
2,2
| |
Affections psychiatriques
| |
Insomnie*
|
2,8
|
0,3
| |
Affections du système nerveux
| |
Vertiges
|
1,9
|
0
| |
Affections respiratoires, thoraciques et médiastinales
| |
Toux
|
1,9
|
0,9
| |
Douleurs pharyngo-laryngées
|
1,2
|
0,9
| |
Affections gastro-intestinales
| |
Douleurs épigastriques
|
6,2
|
3,8
| |
Vomissements
|
2,8
|
1,6
| |
Troubles généraux et anomalies au site d'administration
| |
Pyrexie (fièvre)
|
2,2
|
0,9
|
* Comprend les troubles du sommeil au début du traitement (méthylphénidate = 0,6%) et l'insomnie au cours du traitement (méthylphénidate = 2,2%).
La plupart des effets indésirables avaient un degré de gravité léger à moyen.
Patients adultes
La tolérance de méthylphénidate a été étudiée sur 905 patients adultes atteints de TDA-H qui avaient pris part à trois études cliniques en double-aveugle contrôlées par un placebo. Les informations de ce paragraphe viennent de données regroupées.
Les effets indésirables qui ont été signalés dans ces études par ≥1% des patients méthylphénidate sont présentés dans le tableau 3.
Tableau 3: effets indésirables indiqués par ≥1% des patients adultes sous méthylphénidate dans 3 études cliniques en double-aveugle contrôlées par un placebo.
|
Système/classe organique
Effet indésirable
|
Méthylphénidate
(n= 596)
%
|
Placebo
(n= 309)
%
| |
Infections et infestations
| |
Infection du tractus respiratoire supérieur
|
1,7
|
1,0
| |
Sinusite
|
1,3
|
1,0
| |
Troubles du métabolisme et de la nutrition
| |
Diminution de l'appétit
|
24,8
|
6,1
| |
Perte de l'appétit
|
4,2
|
1,3
| |
Affections psychiatriques
| |
Insomnie
|
13,3
|
7,8
| |
Anxiété
|
8,4
|
2,9
| |
Troubles du début du sommeil
|
5,7
|
2,6
| |
Humeur dépressive
|
4,4
|
2,6
| |
Excitation
|
4,0
|
0
| |
Agitation
|
3,2
|
0,6
| |
Nervosité
|
2,3
|
0,6
| |
Bruxisme
|
1,5
|
0,6
| |
Dépression
|
1,5
|
0,6
| |
Faiblesse affective
|
1,3
|
0,6
| |
Diminution de la libido
|
1,3
|
0,6
| |
Attaques de panique
|
1,3
|
0,3
| |
Tension
|
1,3
|
0,3
| |
Agressivité
|
1,2
|
0,6
| |
Confusion
|
1,0
|
0,3
| |
Affections du système nerveux
| |
Céphalées
|
24,2
|
18,8
| |
Sensations de vertiges
|
7,4
|
5,5
| |
Tremblements
|
3,4
|
0,6
| |
Paresthésies
|
1,2
|
0
| |
Céphalées de tension
|
1,0
|
0,3
| |
Affections oculaires
| |
Trouble de l'accommodation
|
1,3
|
0
| |
Vision floue
|
1,3
|
1,0
| |
Affections de l'oreille et du labyrinthe
| |
Vertige
|
2,0
|
0,3
| |
Affections cardiaques
| |
Tachycardie
|
6,0
|
0
| |
Palpitations
|
4,5
|
0,6
| |
Affections vasculaires
| |
Hypertension
|
2,2
|
1,6
| |
Bouffées de chaleur
|
1,3
|
0,6
| |
Affections respiratoires, thoraciques et médiastinales
| |
Douleurs pharyngo-laryngées
|
1,5
|
1,3
| |
Toux
|
1,2
|
1,0
| |
Dyspnée
|
1,2
|
0,6
| |
Affections gastro-intestinales
| |
Sécheresse de la bouche
|
15,1
|
3,6
| |
Nausée
|
14,3
|
4,9
| |
Dyspepsie
|
2,0
|
1,9
| |
Vomissements
|
1,8
|
0,6
| |
Constipation
|
1,5
|
0,6
| |
Affections de la peau et du tissu sous-cutané
| |
Transpiration excessive
|
5,7
|
1,3
| |
Affections musculosquelettiques et du tissu conjonctif
| |
Tension musculaire
|
1,3
|
0
| |
Crampes musculaires
|
1,0
|
0,3
| |
Affections des organes de reproduction et du sein
| |
Dysfonction érectile
|
1,0
|
0,3
| |
Troubles généraux et anomalies au site d'administration
| |
Irritabilité
|
5,2
|
2,9
| |
Fatigue
|
4,7
|
4,2
| |
Soif
|
1,8
|
0,6
| |
Asthénie
|
1,2
|
0
| |
Investigations
| |
Perte de poids
|
8,7
|
3,6
| |
Augmentation de la fréquence cardiaque
|
3.0
|
1,9
| |
Augmentation de la pression artérielle
|
2,5
|
1,9
| |
Augmentation de l'alanine aminotransférase
|
1,0
|
0
|
La plupart des effets indésirables avaient un degré de gravité léger à moyen.
Données d'études ouvertes – Effets indésirables signalés avec une fréquence ≥1%
La tolérance de méthylphénidate a été étudiée dans douze études cliniques ouvertes sur 3782 patients pédiatriques et adultes atteints de TDA-H. Les informations de ce paragraphe se basent sur des données regroupées.
Dans le tableau 4 sont listés les effets indésirables du médicament qui ont été indiqués dans ces études par ≥1% des patients traités par méthylphénidate et qui n'ont pas été cités dans les tableaux 2 et 3.
Tableau 4: effets indésirables du médicament indiqués par ≥1% des patients traités par méthylphénidate dans douze études ouvertes
|
Système/classe organique
Effet indésirable
|
Méthylphénidate
(n= 3782)
%
| |
Affections psychiatriques
| |
Tics
|
2,0
| |
Fluctuations d'humeur
|
1,1
| |
Affections du système nerveux
| |
Somnolence
|
1,0
| |
Affections gastro-intestinales
| |
Diarrhée
|
2,4
| |
Symptômes abdominaux
|
1,3
| |
Douleurs abdominales
|
1,2
| |
Affections de la peau et du tissu sous-cutané
| |
Exanthème
|
1,3
| |
Troubles généraux et anomalies au site d'administration
| |
Nervosité («remue sans cesse»)
|
1,4
|
La majorité des effets indésirables étaient d'une sévérité légère à modérée.
Données d'études en double-aveugle et d'études ouvertes – Effets indésirables signalés avec une fréquence <1%
Les autres effets indésirables du médicament apparus dans les études cliniques en double-aveugle et dans les études ouvertes avec une fréquence <1% chez les patients pédiatriques et adultes traités par méthylphénidate sont listés ci-dessous.
Affections hématologiques et du système lymphatique
Leucopénie.
Affections psychiatriques
Colère, troubles du sommeil, hypervigilance, tristesse, fluctuations d'humeur.
Affections du système nerveux
Hyperactivité psychomotrice, sédation, léthargie.
Affections oculaires
Yeux secs.
Affections de la peau et du tissu sous-cutané
Exanthème maculaire.
Investigations
Souffle cardiaque.
La plupart des effets indésirables avaient un degré de gravité léger à moyen.
Effets indésirables identifiés après la mise sur le marché
Ci-dessous sont listés les effets indésirables qui ont été identifiés en tant que tels après la mise sur le marché de méthylphénidate. Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante:
«très fréquents» (≥1/10),
«fréquents» (≥1/100 à <1/10),
«occasionnels» (≥1/1000 à <1/100),
«rares» (≥1/10 000 à <1/1000),
«très rares» (<1/10 000), cas isolés compris.
Affections hématologiques et du système lymphatique
Très rares: leucopénie, pancytopénie, thrombopénie, purpura thrombocytopénique.
Affections du système immunitaire
Rares: réactions d'hypersensibilité comme angio-œdème, réactions anaphylactiques, gonflement auriculaire, troubles bulleux et desquamation, urticaire, prurit, éruption cutanée, exanthème.
Affections psychiatriques
Très rares: confusion, désorientation, hallucinations, hallucinations auditives, hallucinations visuelles, manie, nervosité, agitation, psychose induite par les médicaments, logorrhée, troubles de la libido.
Affections su système nerveux
Très rares: convulsions, crises d'épilepsie (Grand Mal), dyskinésie, affections cérébrovasculaires (y compris vascularite/artérite cérébrale, hémorragie cérébrale, occlusion cérébrovasculaire).
Affections oculaires
Très rares: diplopie, mydriase, vision trouble, troubles de la vision.
Affections cardiaques
Très rares: palpitations, angine de poitrine, bradycardie, extrasystoles, tachycardie supraventriculaire, extrasystoles ventriculaires.
Affections vasculaires
Très rares: syndrome de Raynaud.
Affections hépatobiliaires
Très rares: élévation de la phosphatase alcaline dans le sang, augmentation de la concentration de bilirubine, troubles de la fonction hépatique allant de l'augmentation des transaminases jusqu'à un coma hépatique, insuffisance hépatique aiguë.
Affections de la peau et du tissu sous-cutané
Très rares: chute de cheveux, érythème, transpiration excessive.
Affections musculosquelettiques et du tissu conjonctif
Très rares: arthralgie, myalgie, spasmes musculaires.
Affections des organes de reproduction et du sein
Rares: gynécomastie.
Très rares: priapisme.
Troubles généraux et anomalies au site d'administration
Rares: diminution de la réponse thérapeutique.
Très rares: douleurs dans la cage thoracique, troubles thoraciques, diminution de l'efficacité du médicament, hyperpyrexie.
Investigations
Rares: perte de poids.
Très rares: diminution du compte de thrombocytes, compte de leucocytes anormal.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageLors du traitement de patients présentant un surdosage, il faut également tenir compte de la fraction à libération retardée de la formulation de méthylphénidate.
Signes et symptômes
Parmi les signes et symptômes d'un surdosage de méthylphénidate résultant principalement d'une hyperstimulation du système nerveux central et sympathique, on trouve: vomissements, agitation, secousses musculaires, convulsions, grand mal, confusion, hallucinations (auditives et/ou visuelles), transpiration excessive, céphalées, pyrexie, tachycardie, palpitations, augmentation de la fréquence cardiaque, arythmies sinusales, hypertension, mydriase, sécheresse de la bouche et rhabdomyolyse.
Traitement
Le traitement consiste à prendre les mesures de soutien adéquates, en empêchant le patient de se blesser et le protégeant de tout stimulus extérieur qui viendrait aggraver l'hyperstimulation existante. L'efficacité du charbon actif n'a pas été démontrée. Des soins intensifs sont indispensables pour le maintien des fonctions circulatoire et respiratoire. Pour réduire une pyrexie éventuelle, il peut s'avérer nécessaire de rafraîchir le patient par des mesures externes.
L'efficacité de la dialyse péritonéale et de l'hémodialyse n'a pas été établie lors de surdosage de méthylphénidate.
Au cours du traitement de patients surdosés, il faut tenir compte de la libération retardée du méthylphénidate à partir de la formule de méthylphénidate.
Propriétés/EffetsCode ATC
N06BA04
Mécanisme d'action
Mécanisme d'action/Pharmacodynamique
Le chlorhydrate de méthylphénidate est un stimulant du système nerveux central. Son mode d'action sur le TDA-H n'est pas connu. On suppose que le méthylphénidate bloque la réabsorption de la noradrénaline et de la dopamine dans les neurones présynaptiques et renforce la libération de ces monoamines dans l'espace extra-neuronique. Le méthylphénidate est un mélange racémique d'isomères d et l, l'isomère d étant plus actif du point de vue pharmacologique que l'isomère l.
Efficacité clinique
Études cliniques
L'efficacité de méthylphénidate dans le traitement du TDA-H a été démontrée dans 4 études randomisées, en double aveugle, contrôlées contre placebo menées chez des enfants et des adolescents et dans 2 études en double aveugle, contrôlées contre placebo menées chez des adultes qui présentaient les critères d'un TDA-H selon le DSM-IV.
Adultes
Deux études en double aveugle, contrôlées contre placebo, menées chez 627 adultes âgés de 18 à 65 ans ont été réalisées. En ce qui concerne les études contrôlées, il s'agissait d'une étude de titration de la dose avec groupes parallèles, multicentrique, de 7 semaines (étude 02-159) et d'une étude à dose fixe avec groupes parallèles, multicentrique, de 5 semaines (étude 3002) dans lesquelles méthylphénidate utilisé une fois par jour (36 à 108 mg/jour ou 18, 36 et 72 mg/jour) a été comparé avec un placebo.
Dans l'étude 02-159, la variation du critère d'évaluation primaire, l'échelle AISR (Adult ADHD Investigator Rating Scale; échelle destinée à l'évaluation du TDA-H par l'investigateur chez l'adulte), a été évaluée à la fin de la semaine 7 chez des adultes âgés de 18 à 65 ans atteints de TDA-H. Cette étude a comparé méthylphénidate à des doses comprises entre 36 mg/jour et 108 mg/jour, et un placebo. Sur les 226 patients inclus dans cette étude de 7 semaines, 110 ont été randomisés dans le groupe traité par méthylphénidate et 116 dans le groupe placebo. La dose initiale était de 36 mg/jour, mais la dose a été augmentée par paliers de 18 mg/jour (36 à 108 mg/jour), en fonction de la survenue de certains critères d'amélioration en présence d'une tolérance acceptable. Lors de l'évaluation par l'investigateur au cours du dernier rendez-vous de l'étude, une réponse significativement meilleure au score moyen de la variation (moyenne des moindres carrés, SEM) de l'échelle AISR a été observée pour les adultes qui avaient pris méthylphénidate, par rapport aux adultes qui avaient pris le placebo.
L'étude 3002 était une étude dose-réponse multicentrique, en double aveugle, randomisée, contrôlée contre placebo, avec groupes parallèles (durée de 5 semaines) et 3 groupes à dose fixe (18, 36 et 72 mg). Les patients chez qui un TDA-H avait été diagnostiqué ont été randomisés pour recevoir soit méthylphénidate à des doses de 18 mg (n=101), 36 mg (n=102), ou 72 mg/jour (n=102), soit un placebo (n=96). Après 5 semaines, les patients adultes des trois groupes qui avaient reçu méthylphénidate ont présenté une réponse significativement meilleure au score global de l'échelle CAARS-SS (Conners' Adult ADHD Rating Scale – Self Report – Short Form (échelle de Conners pour l'évaluation du TDA-H chez les adultes)), par rapport aux patients qui avaient pris le placebo.
Adolescents
Une étude randomisée, en double aveugle, multicentrique, contrôlée contre placebo (étude 01-146) menée chez 177 patients âgés de 13 à 18 ans atteints de TDA-H a évalué dans quelle mesure des améliorations peuvent être observées après un traitement par méthylphénidate à des doses allant jusqu'à 72 mg/jour (1,4 mg/kg/jour), en comparaison avec un placebo. Sur 220 patients ayant été inclus dans la phase de titration ouverte de 4 semaines, 177 patients sont passés à une dose individualisée (au maximum 72 mg/jour), selon que certains critères d'amélioration de l'échelle d'évaluation du TDA-H étaient ou non satisfaits et qu'une tolérance acceptable était constatée lors de l'évaluation globale de l'efficacité. Les patients qui remplissaient ces critères ont ensuite été randomisés pour recevoir leur dose individualisée de méthylphénidate (18-72 mg/jour, n=87) ou le placebo (n=90) durant une phase en double aveugle de deux semaines. À la fin de cette phase, les scores moyens de l'évaluation par l'investigateur obtenus sur l'échelle de l'évaluation du TDA-H présentaient des résultats significativement meilleurs pour les adolescents qui avaient pris méthylphénidate que pour ceux qui avaient pris le placebo.
Enfants
Trois études en double aveugle, contrôlées contre principe actif et placebo, ont été réalisées chez 416 enfants âgés de 6 à 12 ans. Dans les études contrôlées, méthylphénidate utilisé une fois par jour (18, 36 ou 54 mg), le méthylphénidate utilisé trois fois par jour sur une période de 12 heures (dose journalière totale: 15, 30 ou 45 mg) et un placebo ont été comparés dans deux études croisées monocentriques de 3 semaines (études C-98-003 et C-97-025) et dans une étude comparative en groupes parallèles, multicentrique, de 4 semaines (étude C-98-005). Les trois études étaient conçues de façon à démontrer une supériorité de méthylphénidate par rapport au placebo.
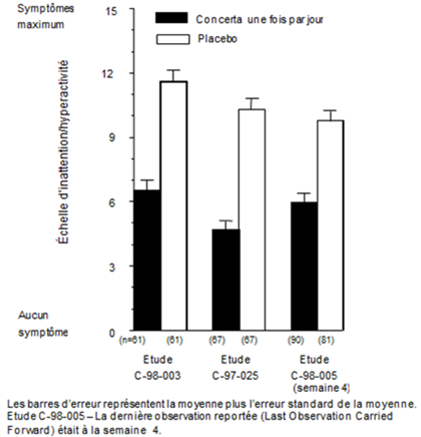
Dans les études C-98-003, C-97-025 et C-98-005, les symptômes de TDA-H ont été évalués par les enseignants à l'aide de l'échelle de Conners pour l'inattention/hyperactivité avec agression (IOWA). Dans les trois études contrôlées, les enfants qui avaient reçu méthylphénidate présentaient unanimement un classement significativement meilleur au niveau de la sous-échelle inattention/hyperactivité en comparaison avec le placebo. Les valeurs pour méthylphénidate et le placebo des trois études sont illustrées dans la figure 1.
Figure 1. Evaluation moyenne de l'inattention/hyperactivité des enfants par leur enseignant au moyen de l'échelle de Conners pour l'IOWA lors de l'utilisation de méthylphénidate
PharmacocinétiqueAbsorption
Le méthylphénidate est absorbé rapidement. Après administration orale de méthylphénidate à des adultes, les concentrations plasmatiques augmentent rapidement et atteignent le premier maximum au bout de 1 à 2 heures, pour continuer à augmenter légèrement ensuite pendant plusieurs heures. Au bout de 6 à 8 heures, la concentration plasmatique atteint son pic, à partir duquel une lente diminution du taux plasmatique de méthylphénidate s'amorce. Administré une fois par jour, méthylphénidate réduit par sa libération continue du principe actif les fluctuations entre concentrations hautes et basses, comme elles se manifestent en cas d'administration de méthylphénidate trois fois par jour, ce qui se retrouve dans les profils des concentrations plasmatiques moyennes en fonction du temps. La biodisponibilité relative de méthylphénidate administré une fois par jour et du méthylphénidate administré 3 fois par jour est comparable.
Les moyennes des paramètres pharmacocinétiques de 36 adultes après administration de méthylphénidate (18 mg une fois par jour) et du chlorhydrate de méthylphénidate (5 mg 3 fois par jour) étaient comparables en termes de Cmax (ng/ml), Tmax (h), AUCinf (ng h/ml) et demi-vie (h).
On n'a constaté aucune différence entre les paramètres pharmacocinétiques de méthylphénidate après administration une fois et plusieurs fois par jour, ce qui laisse supposer qu'il n'y a aucune accumulation significative de substance active dans le corps. La zone sous la courbe (AUC) tout comme la demi-vie t½ montrent, après administration plusieurs fois par jour, des valeurs semblables à celles obtenues après la première dose de méthylphénidate.
Méthylphénidate à libération continue du principe actif est presque complètement résorbé, comme avec le méthylphénidate non retard. En raison du métabolisme de premier passage, la disponibilité systémique du méthylphénidate varie individuellement de 11 à 51%.
Proportionnalité de la dose
Après administration de méthylphénidate en doses uniques de 18, 36 et 54 mg/jour à des adultes en bonne santé, les valeurs Cmax et AUC(0-inf) du d-méthylphénidate étaient proportionnelles à la dose, tandis que Cmax et AUC(0-inf) du l-méthylphénidate ne l'étaient pas. Lors de l'administration de méthylphénidate, les concentrations plasmatiques du l-isomère, pharmacologiquement moins actif, atteignaient à peu près 1/40ème de celles du d-isomère actif. Ceci est dû à l'effet de premier passage énantiomère-sélectif.
Des doses uniques ou répétées une fois par jour de 54 à 144 mg/jour de méthylphénidate ont provoqué sur des adultes sains des augmentations linéaires et proportionnelles à la dose de la Cmax et de l'AUCinf du méthylphénidate global (MPH) et de son métabolite le plus important: l'acide (alpha)-phényl-pipéridine-acétique. La clairance de la dose unique et de l'état d'équilibre (jour 4) et les paramètres de la demi-vie étaient semblables, ce qui indique que le méthylphénidate ne dépend pas du temps dans la pharmacocinétique. La relation entre le métabolite (l'acide [alpha]-phényl-pipéridine-acétique) et la substance de départ (MPH) était constante à des posologies de 54 à 144 mg/jour autant en dose unique qu'en doses répétées.
Dans une étude à doses répétées chez des patients adolescents atteints de TDA-H âgés de 13 à 16 ans, recevant des doses de méthylphénidate entre 18 et 72 mg/jour, l'augmentation de la Cmax et l'AUCTAU du d-méthylphénidate et/ou du méthylphénidate total était proportionnelle à la dose.
Distribution
Les concentrations plasmatiques de méthylphénidate chutent biexponentiellement après administration orale. La demi-vie du méthylphénidate chez les adultes après administration de méthylphénidate était d'environ 3,5 heures.
Métabolisme
Chez l'homme, le méthylphénidate est d'abord métabolisé par scission du groupe ester en acide (alpha)-phényl-pipéridine-acétique (PPAA), qui n'a qu'un faible effet pharmacologique, sinon aucun. Le métabolisme de méthylphénidate administré une fois par jour, déterminé par la dégradation en PPAA, est semblable à celui du méthylphénidate administré trois fois par jour. Le métabolisme d'une dose unique de méthylphénidate par jour montre des valeurs semblables à celui de plusieurs doses répétées par jour.
Élimination
Après administration orale de méthylphénidate avec marquage radioactif à des personnes, on a pu déceler 90% de la radioactivité dans l'urine. Le métabolite le plus important dans l'urine était le PPAA; il correspondait à environ 80% de la dose.
Effet d'aliments pris simultanément
On n'a constaté aucune différence ni dans les paramètres pharmacocinétiques, ni dans les paramètres pharmacodynamiques, quand méthylphénidate était pris après un petit-déjeuner riche en graisses. Il n'y a aucune indication que la biodisponibilité puisse être influencée par la prise concomitante d'aliments.
Cinétique pour certains groupes de patients
Sexe: chez les adultes sains à qui méthylphénidate a été administré, les valeurs moyennes corrigées en fonction de la dose pour AUC(0-inf) étaient de 36,7 ng·h/ml pour les hommes et de 37,1 ng·h/ml pour les femmes. Aucune différence n'a pu être constatée entre les deux groupes.
Ethnie: chez les adultes à qui méthylphénidate a été administré, les valeurs moyennes corrigées en fonction de la dose pour AUC(0-inf) étaient cohérentes dans les divers groupes ethniques; mais il se peut également qu'on n'ait pas pu démontrer de différences ethniques en raison des chiffres de population trop faibles.
Age: la pharmacocinétique de méthylphénidate n'a pas été étudiée chez les enfants de moins de 6 ans.
Troubles de la fonction hépatique
Il n'existe aucune expérience sur l'emploi de méthylphénidate chez des patients insuffisants hépatiques.
Troubles de la fonction rénale
Il n'existe aucune expérience sur l'emploi de méthylphénidate chez des patients insuffisants rénaux. Après administration orale de méthylphénidate avec marquage radioactif à des personnes, celui-ci a été en grande partie métabolisé et environ 80% de la radioactivité ont été éliminés par les reins sous forme de PPAA. Comme la clairance rénale n'a pas une grande importance pour la clairance du méthylphénidate, on suppose qu'une insuffisance rénale n'a qu'un effet limité sur la pharmacocinétique de méthylphénidate.
Données précliniquesCarcinogénicité
Dans une étude de carcinogénicité à vie sur des souris, le chlorhydrate de méthylphénidate administré à une posologie d'environ 60 mg/kg/jour a entraîné une augmentation des adénomes hépatocellulaires et, mais seulement chez les mâles, des hépatoblastomes. Cette dose est en mg/kg nettement plus élevée que la posologie recommandée pour les humains. L'administration unique en bolus d'une telle dose a entraîné chez les souris une exposition systémique au méthylphénidate plus élevée. Dans l'ensemble on n'a constaté aucune augmentation de tumeurs hépatiques malignes. La race de souris utilisée est sujette au développement de tumeurs hépatiques et la force probante de ces résultats pour les humains n'est pas certaine.
Dans une étude à vie d'objectif semblable sur des rats et avec une posologie allant jusqu'à 45 mg/kg/jour, on n'a trouvé aucune indication de carcinogénicité.
Dans une étude de 24 semaines sur la souche de souris transgénique p53±, aucun indice de carcinogénicité n'a été mis en évidence à des posologies allant jusqu'à 74 mg/kg/jour de chlorhydrate de méthylphénidate.
Aucun effet toxique n'a été observé chez les chiens dans deux études séparées de 30 jours au cours desquelles méthylphénidate était donné en doses orales de 72 mg/jour (jusqu'à 8,6 mg/kg/jour) pour l'une et de 144 mg/jour (jusqu'à 22 mg/kg/jour) pour la seconde.
Dans le test in-vitro d'Ames (Reverse Mutation Assay) et dans l'essai in-vitro Mouse Lymphoma Cell Forward Mutation Assay, aucun effet mutagène du méthylphénidate n'a été décelable. L'échange de chromatides sœurs (sister chromatid exchange) et les transformations chromosomiques (chromosome aberrations) ont montré dans un test in-vitro sur des cultures cellulaires d'ovules du hamster chinois des valeurs plus élevées, même si ce n'était qu'après des doses cytotoxiques élevées. Le méthylphénidate s'est révélé négatif in-vivo dans le test micronucleus de la moelle épinière des souris.
Toxicité sur la reproduction
A des dosages de 200 mg/kg/jour, des effets tératogènes du chlorhydrate de méthylphénidate ont été détectés chez les lapines. Ce dosage correspond à environ 100 fois la dose maximale journalière en mg/kg recommandée chez les humains.
Chez les rats, aucun effet tératogène n'a été observé à des dosages de chlorhydrate de méthylphénidate allant jusqu'à 30 mg/kg/jour. Cela correspond, sur la base des données pharmacologiques, à environ 9 à 12 fois l'exposition systémique au méthylphénidate rapportée dans les études sur des volontaires et des patients avec la posologie maximale recommandée de méthylphénidate.
Dans une étude de reproduction continue pendant 18 semaines sur des souris, le chlorhydrate de méthylphénidate, administré à des dosages allant jusqu'à 160 mg/kg/jour, n'a montré aucune diminution de la fertilité.
Remarques particulièresStabilité
Le médicament ne doit être conservé que jusqu'à la date écrite avec la mention «EXP» sur l'emballage.
Conditions de stockage particulières
Conserver à une température ne dépassant pas 30 °C, dans l'emballage d'origine pour protéger le contenu contre l'humidité et hors de portée des enfants.
Numéro d’autorisation69315 (Swissmedic).
PrésentationMéthylphénidate Spirig HC retard comprimés à libération prolongée 18 mg: 30 (A+)
Méthylphénidate Spirig HC retard comprimés à libération prolongée 18 mg: 60 (A+)
Méthylphénidate Spirig HC retard comprimés à libération prolongée 27 mg: 30 (A+)
Méthylphénidate Spirig HC retard comprimés à libération prolongée 27 mg: 60 (A+)
Méthylphénidate Spirig HC retard comprimés à libération prolongée 36 mg: 30 (A+)
Méthylphénidate Spirig HC retard comprimés à libération prolongée 36 mg: 60 (A+)
Méthylphénidate Spirig HC retard comprimés à libération prolongée 54 mg: 30 (A+)
Méthylphénidate Spirig HC retard comprimés à libération prolongée 54 mg: 60 (A+)
Titulaire de l’autorisationSpirig HealthCare SA, 4622 Egerkingen.
Mise à jour de l’informationAoût 2023.
|

