CompositionPrincipes actifs
Palipéridone (sous forme de palmitate de palipéridone).
Excipients
Polysorbate 20, macrogol 4000, acide citrique monohydraté, phosphate disodique, phosphate monosodique monohydraté, hydroxyde de sodium, eau pour préparations injectables.
1 seringue préremplie de 25 mg contient 0,92 mg de sodium.
1 seringue préremplie de 50 mg contient 1,84 mg de sodium.
1 seringue préremplie de 75 mg contient 2,75 mg de sodium.
1 seringue préremplie de 100 mg contient 3,67 mg de sodium.
1 seringue préremplie de 150 mg contient 5,51 mg de sodium.
Indications/Possibilités d’emploiPalipéridone Spirig HC retard est indiqué pour le traitement aigu et d'entretien de la schizophrénie.
Posologie/Mode d’emploiAdultes (≥18 ans)
Chez les patients qui n'ont jamais pris de palipéridone par voie orale ou de rispéridone par voie orale ou injectable, il est recommandé de déterminer la tolérance de la palipéridone orale ou de la rispéridone orale avant d'instaurer un traitement par Palipéridone Spirig HC retard, suspension injectable à libération prolongée.
Instauration du traitement
Le schéma thérapeutique recommandé pour l'instauration de Palipéridone Spirig HC retard comporte une dose de 150 mg le 1er jour du traitement, suivie d'une dose de 100 mg après une semaine, toutes deux administrées dans le muscle deltoïde.
Traitement d'entretien
La dose d'entretien mensuelle recommandée est de 75 mg; certains patients peuvent aussi bénéficier de doses plus faibles ou plus élevées dans l'intervalle recommandé allant de 25 à 150 mg, en fonction de la tolérance individuelle du patient et/ou de l'efficacité. Après la deuxième dose initiale, les doses d'entretien mensuelles peuvent être administrées dans le muscle deltoïde ou dans le muscle fessier.
La dose d'entretien de Palipéridone Spirig HC retard peut éventuellement être ajustée mensuellement afin d'obtenir la dose efficace la plus faible possible. Il faut tenir compte des propriétés de libération retardée de Palipéridone Spirig HC retard (cf. «Pharmacocinétique») lors des ajustements posologiques car l'effet de l'ajustement posologique peut n'être complet qu'après plusieurs mois.
Le rapport bénéfice-risque doit être vérifié. Si le traitement par Palipéridone Spirig HC retard est arrêté, il faut tenir compte de ses propriétés de libération retardée (cf. «Pharmacocinétique»). Comme recommandé pour d'autres médicaments antipsychotiques, la nécessité de poursuivre l'administration de médicaments agissant contre les symptômes extrapyramidaux moteurs (EPS) doit être réévaluée régulièrement.
Passage d'un autre antipsychotique à Palipéridone Spirig HC retard
Il n'existe pas de données recueillies systématiquement chez des patients schizophrènes concernant spécifiquement la substitution d'autres antipsychotiques par Palipéridone Spirig HC retard ou sur l'utilisation simultanée avec d'autres antipsychotiques. Chez les patients n'ayant jamais reçu auparavant de palipéridone orale ou de rispéridone orale ou injectable, la tolérance de la palipéridone orale ou de la rispéridone orale doit être évaluée avant de commencer le traitement par Palipéridone Spirig HC retard, suspension injectable à libération prolongée (cf. «Posologie/Mode d'emploi»).
Les antipsychotiques oraux préalablement utilisés peuvent être arrêtés par paliers au début du traitement par Palipéridone Spirig HC retard, suspension injectable à libération prolongée. Le traitement par Palipéridone Spirig HC retard doit être débuté comme décrit ci-dessus. Chez les patients qui reçoivent un traitement par antipsychotiques injectables à action prolongée à l'état d'équilibre, le traitement par Palipéridone Spirig HC retard peut être commencé à la place de l'administration de l'injection suivante prévue. L'administration de Palipéridone Spirig HC retard devra ensuite être poursuivie tous les mois. Le schéma d'instauration posologique de la première semaine, décrit au début du présent chapitre «Posologie/Mode d'emploi», n'est alors pas nécessaire.
Les patients ayant reçu auparavant différentes doses de palipéridone sous forme de comprimés à libération prolongée peuvent bénéficier d'une exposition à la palipéridone similaire à l'état d'équilibre avec un traitement d'entretien mensuel par les doses de Palipéridone Spirig HC retard figurant dans le tableau 1:
Tableau 1: Doses de palipéridone sous forme de comprimés à libération prolongée et de Palipéridone Spirig HC retard, suspension injectable à libération prolongée requises pour atteindre une exposition à la palipéridone similaire à l'état d'équilibre avec un traitement d'entretien
|
Forme galénique
|
Dose préalable de palipéridone en comprimés à libération prolongée
|
Palipéridone Spirig HC retard en injection
| |
Fréquence d'administration
|
Une fois par jour
|
Une fois toutes les 4 semaines
| |
Dose (mg)
|
3 mg
|
25 à 50 mg éq.
| |
6 mg
|
75 mg éq.
| |
9 mg
|
100 mg éq.
| |
12 mg
|
150 mg éq.
|
Les patients ayant reçu auparavant différentes doses de rispéridone sous forme de dépôt peuvent atteindre une exposition à la palipéridone similaire à l'état d'équilibre avec un traitement d'entretien mensuel par les doses suivantes de Palipéridone Spirig HC retard:
Posologies de rispéridone dépôt et de Palipéridone Spirig HC retard, suspension injectable à libération prolongée requises pour atteindre une exposition à la palipéridone similaire à l'état d'équilibre
|
Posologie précédente de rispéridone sous forme de dépôt
|
Palipéridone Spirig HC retard
| |
25 mg toutes les 2 semaines
|
50 mg une fois par mois
| |
37,5 mg toutes les 2 semaines
|
75 mg une fois par mois
| |
50 mg toutes les 2 semaines
|
100 mg une fois par mois
|
L'arrêt des médicaments antipsychotiques utilisés jusque-là doit être effectué conformément aux informations professionnelles correspondantes. Il faut tenir compte de la libération retardée du principe actif lors de l'arrêt de Palipéridone Spirig HC retard. Comme pour les autres médicaments antipsychotiques, il est recommandé de réévaluer périodiquement la nécessité de poursuivre l'administration de médicaments destinés au traitement de symptômes extrapyramidaux moteurs (EPS) persistants.
Patients présentant des troubles de la fonction hépatique
Palipéridone Spirig HC retard, suspension injectable à libération prolongée n'a pas été étudié chez les patients atteints d'insuffisance hépatique. D'après une étude réalisée avec la palipéridone orale, aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. Comme la palipéridone n'a pas été étudiée chez les patients insuffisants hépatiques sévères (cf. «Pharmacocinétique»), il faut faire preuve de prudence chez ces patients.
Patients présentant des troubles de la fonction rénale
Palipéridone Spirig HC retard n'a pas fait l'objet d'études systématiques chez des patients atteints d'insuffisance rénale (cf. «Pharmacocinétique»). Les doses initiales recommandées de Palipéridone Spirig HC retard chez les patients présentant une insuffisance rénale légère (clairance de la créatinine ≥50 et <80 ml/min) sont de 100 mg le 1er jour du traitement et de 75 mg après une semaine, ces doses étant toutes deux administrées dans le muscle deltoïde. Par la suite, des injections mensuelles de 50 mg sont administrées dans le muscle deltoïde ou fessier en adaptant cette dose dans un intervalle allant de 25 à 100 mg en fonction de la tolérance individuelle du patient et/ou de l'efficacité.
L'utilisation de Palipéridone Spirig HC retard n'est pas recommandée chez les patients présentant une insuffisance rénale modérée ou sévère (clairance de la créatinine <50 ml/min) (cf. «Mises en garde et précautions»).
Patients âgés
Le nombre de patients âgés de plus de 65 ans inclus dans les études cliniques portant sur palipéridone est insuffisant. Il n'est donc pas possible de juger si ce groupe de patients présente une réponse à Palipéridone Spirig HC retard différente de celle des patients plus jeunes.
Les recommandations posologiques pour les patients âgés dont la fonction rénale est normale (clairance de la créatinine ≥80 ml/min) correspondent à celles s'appliquant aux adultes dont la fonction rénale est normale (cf. premier paragraphe du chapitre «Posologie/Mode d'emploi»). La fonction rénale des patients âgés étant cependant susceptible d'être diminuée, il se peut qu'un ajustement de la posologie soit nécessaire en fonction de l'état de la fonction rénale (cf. «Posologie/Mode d'emploi/Patients présentant des troubles de la fonction rénale»).
Le risque de mortalité globale et d'événements cérébrovasculaires est accru chez les patients âgés atteints de démence et traités par des antipsychotiques atypiques. Leur utilisation chez de tels patients atteints de démence n'est pas recommandée (cf. «Mises en garde et précautions»).
Enfants et adolescents
La sécurité et l'efficacité de Palipéridone Spirig HC retard n'ont pas été étudiées chez les patients de moins de 18 ans. Palipéridone Spirig HC retard ne doit donc pas être utilisé dans ce groupe d'âge.
Autres groupes de patients
Aucun ajustement de la dose de Palipéridone Spirig HC retard n'est recommandé en fonction du sexe, de l'origine ethnique ou du tabagisme (femmes enceintes ou allaitantes, cf. «Grossesse, Allaitement»).
Administration retardée d'une dose
Eviter d'omettre des doses
Il est recommandé d'administrer la deuxième dose initiale de Palipéridone Spirig HC retard une semaine après la première dose. Pour éviter d'omettre la deuxième dose, cette dernière peut être administrée 2 jours avant ou après le délai d'une semaine. De même, après les doses initiales, il est recommandé d'administrer mensuellement la troisième injection et les injections suivantes. Pour éviter d'omettre une dose mensuelle, les patients peuvent recevoir l'injection jusqu'à 7 jours avant ou après le délai d'un mois.
Si le rendez-vous pour la seconde injection de Palipéridone Spirig HC retard (jour 8 ± 2 jours) est manqué, la reprise recommandée du traitement dépend de la durée écoulée depuis la première injection reçue par le patient.
Oubli de la seconde dose initiale (<4 semaines après la première injection)
Si moins de 4 semaines se sont écoulées depuis la première injection, le patient devra recevoir la seconde injection de 100 mg dans le muscle deltoïde le plus rapidement possible. Une troisième injection de 75 mg de Palipéridone Spirig HC retard dans le muscle deltoïde ou fessier devra être administrée 5 semaines après la première injection (quelle que soit la date de la seconde injection). Par la suite, le cycle mensuel normal des injections dans le muscle deltoïde ou fessier de doses allant de 25 à 150 mg sera appliqué en fonction de la tolérance individuelle du patient et/ou de l'efficacité.
Oubli de la seconde dose initiale (4 à 7 semaines après la première injection)
Si 4 à 7 semaines se sont écoulées depuis la première injection de Palipéridone Spirig HC retard, poursuivre le traitement par deux injections de 100 mg comme suit:
1.une injection dans le muscle deltoïde le plus rapidement possible,
2.une autre injection dans le muscle deltoïde une semaine plus tard,
3.poursuite du cycle mensuel normal des injections dans le muscle deltoïde ou fessier de doses allant de 25 à 150 mg en fonction de la tolérance individuelle du patient et/ou de l'efficacité.
Oubli de la seconde dose initiale (>7 semaines après la première injection)
Si plus de 7 semaines se sont écoulées depuis la première injection de Palipéridone Spirig HC retard, recommencer le traitement comme décrit ci-dessus dans le schéma d'instauration recommandé pour Palipéridone Spirig HC retard.
Omission d'une dose d'entretien (1 mois à 6 semaines)
Après l'administration des doses initiales, les injections de Palipéridone Spirig HC retard doivent être mensuelles. Si moins de 6 semaines se sont écoulées depuis la dernière injection, la dose d'entretien stable omise doit être administrée dès que possible et les injections suivantes doivent être effectuées de nouveau tous les mois.
Omission d'une dose d'entretien (>6 semaines à 6 mois)
Si plus de 6 semaines se sont écoulées depuis la dernière injection de Palipéridone Spirig HC retard, procéder comme suit:
Chez les patients qui ont reçu une dose ajustée comprise entre 25 et 100 mg
1.une injection dans le muscle deltoïde le plus rapidement possible de la même dose que celle que le patient recevait précédemment,
2.une autre injection dans le muscle deltoïde (même dose) une semaine plus tard (jour 8),
3.poursuite du cycle mensuel normal des injections dans le muscle deltoïde ou fessier de doses allant de 25 à 150 mg en fonction de la tolérance individuelle du patient et/ou de l'efficacité.
Chez les patients qui ont reçu une dose ajustée de 150 mg
1.une injection d'une dose de 100 mg dans le muscle deltoïde le plus rapidement possible,
2.une autre injection d'une dose de 100 mg dans le muscle deltoïde une semaine plus tard (jour 8),
3.poursuite du cycle normal mensuel des injections dans le muscle deltoïde ou fessier de doses allant de 25 à 150 mg en fonction de la tolérance individuelle du patient et/ou de l'efficacité.
Omission d'une dose d'entretien (>6 mois)
Si plus de 6 mois se sont écoulés depuis la dernière injection de Palipéridone Spirig HC retard, il faut commencer l'administration des doses conformément au schéma thérapeutique recommandé pour l'instauration de Palipéridone Spirig HC retard décrit ci-dessus.
Mode d'administration
Palipéridone Spirig HC retard est destiné uniquement à l'administration intramusculaire. L'injection doit être lente et profonde dans le tissu musculaire. Toutes les injections doivent être faites par un professionnel de la santé. La dose doit être administrée en une seule injection. La dose ne doit pas être répartie en plusieurs injections. Palipéridone Spirig HC retard ne doit pas être administré par voie intravasculaire ou sous-cutanée.
La taille de l'aiguille recommandée pour l'injection de Palipéridone Spirig HC retard dans le muscle deltoïde dépend du poids du patient. Pour les patients pesant ≥90 kg, une aiguille de calibre 22 G et de 3,8 cm de longueur est recommandée. Pour les patients pesant <90 kg, une aiguille de calibre 23 G et de 2,5 cm de longueur est recommandée. Les injections dans le muscle deltoïde doivent se faire alternativement dans le muscle deltoïde d'un bras puis dans celui de l'autre.
Pour l'administration de Palipéridone Spirig HC retard dans le muscle fessier, une aiguille de calibre 22 G et de 3,8 cm de longueur est recommandée. L'injection doit être pratiquée dans le quadrant supéro-externe du muscle fessier. Les injections dans le muscle fessier doivent se faire alternativement dans l'un des muscles fessiers puis dans l'autre.
Etant donné que la palipéridone est le principal métabolite actif de la rispéridone, la prudence est de rigueur lors de l'administration combinée de Palipéridone Spirig HC retard, suspension injectable à libération prolongée et de rispéridone ou de palipéridone par voie orale pendant des périodes prolongées en raison de l'exposition accrue (voir «Mises en garde et précautions»). Les données sont limitées en ce qui concerne la sécurité de l'utilisation simultanée de Palipéridone Spirig HC retard et d'autres antipsychotiques.
Contre-indicationsPatients présentant une hypersensibilité connue à la palipéridone, à la rispéridone (la palipéridone est un métabolite actif de la rispéridone) ou à l'un des excipients selon la composition.
Patients atteints de démence ayant des symptômes parkinsoniens à type de rigidité, bradykinésie et troubles posturaux de type parkinsonien.
Patients atteints de démence avec suspicion d'une démence à corps de Lewy (outre les symptômes typiques de la démence, présence d'au moins deux des trois symptômes suivants: parkinsonisme/hallucinations visuelles/évolution fluctuante).
Mises en garde et précautionsIntervalle QT
La palipéridone administrée par voie orale peut allonger l'intervalle QT.
Comme avec d'autres antipsychotiques, la prudence est de rigueur lorsque Palipéridone Spirig HC retard est prescrit chez des patients présentant des maladies cardio-vasculaires connues, un syndrome du QT long congénital et des antécédents familiaux d'allongement du QT, ainsi qu'en cas d'utilisation simultanée avec d'autres médicaments susceptibles d'allonger l'intervalle QT (cf. «Effets indésirables»).
Réactions d'hypersensibilité
Bien que la tolérance de la palipéridone ou de la rispéridone administrées par voie orale doive être évaluée avant le début du traitement par Palipéridone Spirig HC retard, suspension injectable à libération prolongée, de très rares cas de réactions anaphylactiques sont survenus pendant la surveillance post-commercialisation chez des patients ayant préalablement bien toléré la rispéridone ou la palipéridone administrées par voie orale (voir «Posologie/Mode d'emploi» et «Effets indésirables»).
L'apparition de réactions d'hypersensibilité impose l'arrêt de l'utilisation de Palipéridone Spirig HC retard; des mesures de soutien générales doivent être instaurées en fonction de l'indication clinique et le patient doit être surveillé jusqu'à la disparition des symptômes (voir «Contre-indications» et «Effets indésirables»).
Syndrome malin des neuroleptiques
Un syndrome malin des neuroleptiques (SMN), caractérisé par une hyperthermie, une rigidité musculaire, des signes d'instabilité du système nerveux autonome, des troubles de la conscience et une élévation des taux sériques de la créatine phosphokinase, a été rapporté en relation avec des antipsychotiques, y compris la palipéridone. Les autres signes cliniques peuvent être une myoglobinurie (rhabdomyolyse) et une insuffisance rénale aiguë. En présence d'indices cliniques de SMN, il faut arrêter tous les antipsychotiques, y compris Palipéridone Spirig HC retard.
Dyskinésie tardive/Symptômes extrapyramidaux
Les médicaments ayant des propriétés antidopaminergiques sont associés à l'induction d'une dyskinésie tardive qui peut se manifester par des mouvements rythmiques involontaires, surtout de la langue et/ou du visage. En présence de symptômes d'une dyskinésie tardive, il faut envisager l'interruption de la prise de tous les antipsychotiques, y compris Palipéridone Spirig HC retard.
Symptômes extrapyramidaux et psychostimulants
La prudence est recommandée chez les patients recevant simultanément des psychostimulants (p.ex. du méthylphénidate) et de la palipéridone, car des symptômes extrapyramidaux sont susceptibles de survenir lors de l'ajustement posologique de l'un des médicaments ou des deux médicaments. Il convient d'envisager l'arrêt progressif de l'un des traitements ou des deux traitements (voir «Interactions»).
Hyperglycémie et diabète
Une hyperglycémie, un diabète et l'exacerbation d'un diabète préexistant ont été rapportés pendant le traitement par palipéridone. L'évaluation de la relation entre l'utilisation d'antipsychotiques atypiques et des anomalies du glucose est compliquée par la possibilité d'une augmentation du risque de base de diabète chez les patients schizophrènes et par l'incidence croissante du diabète dans la population générale. Vu ces facteurs de confusion, la relation entre l'utilisation d'antipsychotiques atypiques et la survenue d'effets indésirables liés à une hyperglycémie n'est pas complètement élucidée. Les études épidémiologiques suggèrent cependant qu'il existe un risque accru de survenue d'effets indésirables liés à une hyperglycémie chez les patients traités par des antipsychotiques atypiques. Tous les patients traités par des antipsychotiques atypiques, y compris par Palipéridone Spirig HC retard, doivent être surveillés à la recherche de symptômes d'une hyperglycémie et d'un diabète (cf. «Effets indésirables»).
Prise de poids
Une prise de poids a été rapportée lors de l'utilisation d'antipsychotiques atypiques. Il convient de surveiller le poids corporel à intervalles réguliers.
Hypotension orthostatique
En raison de son activité α-bloquante, la palipéridone peut induire une hypotension orthostatique chez certains patients. Palipéridone Spirig HC retard doit être utilisé avec prudence chez les patients présentant une maladie cardiovasculaire connue (p.ex. insuffisance cardiaque, infarctus du myocarde ou ischémie, troubles de la conduction), une maladie cérébrovasculaire ou un état prédisposant à une hypotension (p.ex. déshydratation, hypovolémie et traitement par antihypertenseurs).
Hyperprolactinémie
Comme d'autres antagonistes des récepteurs dopaminergiques D2, la palipéridone entraîne une augmentation du taux de prolactine qui persiste en cas d'administration prolongée. Son effet sur la prolactinémie est similaire à celui de la rispéridone et plus important que celui d'autres médicaments antipsychotiques. Les conséquences d'une hyperprolactinémie peuvent être une galactorrhée, une aménorrhée, une gynécomastie ou une impuissance. Une hyperprolactinémie chronique peut provoquer une diminution de la densité osseuse.
Tumeurs prolactinodépendantes
Palipéridone Spirig HC retard ne doit pas être utilisé en présence de tumeurs prolactinodépendantes, p.ex. de prolactinomes de l'hypophyse ou de tumeurs éventuellement prolactinodépendantes telles que les tumeurs des cellules mammaires épithéliales.
Crises épileptiques
Comme tous les antipsychotiques, Palipéridone Spirig HC retard doit être utilisé avec prudence chez les patients présentant des antécédents de crises épileptiques ou d'autres états susceptibles de s'accompagner d'une diminution du seuil épileptogène.
Insuffisance rénale
Les concentrations plasmatiques de la palipéridone sont augmentées chez les patients atteints d'insuffisance rénale. Un ajustement de la dose peut donc s'avérer nécessaire chez certains patients. Palipéridone Spirig HC retard n'est pas recommandé chez les patients présentant une insuffisance rénale modérée ou sévère (clairance de la créatinine <50 ml/min) (cf. «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Insuffisance hépatique
Aucune donnée n'est disponible chez des patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh). La prudence est recommandée lorsque le palmitate de palipéridone est utilisé chez ces patients.
Patients âgés atteints de démence
Palipéridone Spirig HC retard n'a pas été étudié chez les patients âgés atteints de démence. L'utilisation chez des patients âgés atteints de démence n'est pas recommandée. Dans les études cliniques menées avec d'autres antipsychotiques atypiques, un risque accru de décès et d'événements cérébrovasculaires a été rapporté (cf. ci-dessous «Evénements cérébrovasculaires» et «Posologie/Mode d'emploi, patients âgés» et «Effets indésirables, patients âgés»).
Les expériences faites avec la rispéridone sont considérées comme valables pour la palipéridone également (principal métabolite actif de la rispéridone).
Augmentation de la mortalité globale
Dans une méta-analyse portant sur 17 études cliniques contrôlées, des patients âgés atteints de démence et traités par d'autres antipsychotiques atypiques, incluant la rispéridone, l'aripiprazole, l'olanzapine et la quétiapine, ont présenté une augmentation du risque de mortalité comparé au groupe placebo. Chez les patients traités par la rispéridone, la mortalité était de 4% contre 3,1% avec le placebo. L'âge moyen des patients décédés était de 86 ans (intervalle: 67-100 ans). Cet effet de classe ayant été observé, Palipéridone Spirig HC retard n'a pas été étudié chez les patients âgés atteints de démence et il ne doit pas être utilisé dans ce groupe de patients (cf. «Posologie/Mode d'emploi, patients âgés»).
Evénements cérébrovasculaires
Au cours d'études cliniques randomisées et contrôlées contre placebo, un risque env. 3 fois plus élevé d'effets indésirables cérébrovasculaires, en partie d'issue fatale, a été observé dans la population de patients déments traités par certains antipsychotiques atypiques, dont la rispéridone, l'aripiprazole et l'olanzapine. Palipéridone Spirig HC retard ne doit pas être utilisé chez des patients âgés atteints de démence et présentant des facteurs de risque d'accident vasculaire cérébral (cf. «Posologie/Mode d'emploi, patients âgés»).
Leucopénie, neutropénie et agranulocytose
Des cas de leucopénie, de neutropénie et d'agranulocytose ont été observés lors de l'utilisation d'antipsychotiques (y compris palipéridone) dans les études cliniques et/ou depuis la commercialisation. De très rares cas d'agranulocytose ont été observés depuis la commercialisation (<1/10'000 patients). Pendant les premiers mois de traitement, il convient de surveiller les patients présentant une diminution cliniquement significative du nombre de leucocytes dans l'anamnèse ou une leucopénie/neutropénie d'origine médicamenteuse; en l'absence d'autres facteurs causals, l'interruption du traitement par Palipéridone Spirig HC retard doit être envisagée dès les premiers signes d'une baisse significative des leucocytes.
Chez les patients avec neutropénie cliniquement significative, l'apparition de fièvre ou d'autres signes d'infection doit être soigneusement surveillée; il faut immédiatement instaurer un traitement si des symptômes de ce type apparaissent. Chez les patients présentant une neutropénie marquée (nombre absolu de neutrophiles <1× 109/l), le traitement par Palipéridone Spirig HC retard doit être interrompu et le nombre de leucocytes régulièrement surveillé.
Thromboembolie veineuse
Des cas de thromboembolies veineuses (TEV) ont été rapportés en lien avec l'utilisation d'antipsychotiques (cf. «Effets indésirables»). Comme les patients traités par des antipsychotiques présentent souvent des facteurs de risque acquis de TEV, tout facteur de risque potentiel de TEV doit être identifié avant et pendant le traitement par Palipéridone Spirig HC retard et des mesures préventives doivent être mises en œuvre.
Maladie de Parkinson et démence à corps de Lewy
(Cf. «Contre-indications»).
Les antipsychotiques, dont Palipéridone Spirig HC retard, ne doivent être prescrits aux patients atteints d'une maladie de Parkinson ou d'une démence à corps de Lewy (DLB) qu'après une évaluation médicale du rapport bénéfice-risque. Sous Palipéridone Spirig HC retard, ces deux groupes de patients peuvent présenter un risque plus élevé de syndrome malin des neuroleptiques et une sensibilité accrue aux antipsychotiques. Une telle augmentation de la sensibilité peut se manifester non seulement par des symptômes extrapyramidaux moteurs, mais aussi par une confusion, un émoussement affectif, une diminution de la capacité de jugement et des troubles de l'équilibre avec chutes fréquentes.
Tendance suicidaire et tentative de suicide
Une maladie psychotique est associée à un risque accru de tendance suicidaire/tentative(s) de suicide. Le traitement médicamenteux doit s'accompagner d'une surveillance étroite des patients à haut risque.
Priapisme
Selon certains rapports, les médicaments ayant des effets α-bloquants adrénergiques peuvent provoquer un priapisme. Depuis la commercialisation de la palipéridone, des cas de priapisme ont été rapportés (cf. «Effets indésirables»). Les patients doivent donc être informés de ce risque et de la nécessité de consulter immédiatement un spécialiste en cas d'érection prolongée et douloureuse.
Régulation de la température corporelle
Les antipsychotiques peuvent perturber la capacité de l'organisme à réduire la température centrale du corps. La prudence est donc recommandée lors de la prescription de Palipéridone Spirig HC retard à des patients exposés à des situations liée à une augmentation de la température centrale (p.ex. exercice physique intense, exposition à une température extrêmement élevée, traitement concomitant par des médicaments à action anticholinergique ou déshydratation).
Effet antiémétique
Un effet antiémétique a été observé au cours d'études précliniques réalisées avec la palipéridone. Cet effet, lorsqu'il survient chez l'homme, peut masquer les signes d'un surdosage de certaines substances ou de maladies telles qu'une obstruction intestinale, un syndrome de Reye et une tumeur cérébrale.
Administration
Eviter toute injection intravasculaire ou sous-cutanée accidentelle de Palipéridone Spirig HC retard.
Syndrome de l'iris hypotonique peropératoire
Des cas de syndrome d'iris hypotonique peropératoire (IFIS) ont été observés lors d'opérations de la cataracte chez des patients traités par des médicaments dotés d'un effet antagoniste sur les récepteurs α1a-adrénergiques, tel que Palipéridone Spirig HC retard.
L'IFIS peut augmenter le risque de complications oculaires pendant et après l'intervention. Avant l'intervention, le chirurgien ophtalmologue doit être informé de la prise actuelle ou antérieure de médicaments dotés d'un effet antagoniste sur les récepteurs α1a-adrénergiques. Le bénéfice potentiel de l'interruption du traitement par les antagonistes α1 avant l'opération de la cataracte n'a pas été étudié et doit être évalué par rapport au risque d'une interruption du traitement antipsychotique.
La prudence est de mise en cas de substitution du traitement par une autre forme pharmaceutique et/ou par un autre médicament contenant le même principe actif. Le patient doit alors faire l'objet d'une surveillance appropriée.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par seringue préremplie, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsLa prudence est recommandée lors de la prescription simultanée de Palipéridone Spirig HC retard avec des médicaments connus pour allonger l'intervalle QT, par exemple les antiarythmiques de classe IA (p.ex. quinidine, disopyramide) et de classe III (p.ex. amiodarone, sotalol), certains antihistaminiques, certains autres antipsychotiques et certains antipaludéens (p.ex. méfloquine).
Le palmitate de palipéridone étant hydrolysé en palipéridone (cf. «Pharmacocinétique»), il faut tenir compte des résultats des études réalisées avec la palipéridone orale lors de l'évaluation du potentiel d'interactions entre principes actifs.
Autres interactions
Administration simultanée de Palipéridone Spirig HC retard et de rispéridone ou de palipéridone par voie orale
La rispéridone administrée par voie orale ou intramusculaire est métabolisée en palipéridone dans une proportion variable. Comme la palipéridone est le métabolite actif principal de la rispéridone, une exposition accrue peut se produire lors de l'utilisation combinée de Palipéridone Spirig HC retard et de rispéridone/palipéridone.
Au cours des études conduites après la commercialisation, des effets médicamenteux indésirables en partie plus fréquents ont été observés lors de l'utilisation de palipéridone suspension injectable à libération prolongée et de rispéridone ou de palipéridone administrée par voie orale par rapport à l'utilisation de palipéridone seul. La prudence est donc de rigueur, en particulier lors d'une utilisation combinée pendant une durée prolongée.
Les données sont limitées en ce qui concerne la sécurité de l'utilisation simultanée de Palipéridone Spirig HC retard et d'autres antipsychotiques.
Utilisation simultanée de Palipéridone Spirig HC retard et de psychostimulants
L'utilisation de psychostimulants (p.ex. méthylphénidate) en combinaison avec la palipéridone peut, en cas de modification de l'un des traitements ou des deux traitements, entraîner l'apparition de symptômes extrapyramidaux (voir «Mises en garde et précautions»).
Effet de Palipéridone Spirig HC retard sur d'autres médicaments
Aucune interaction pharmacocinétique cliniquement significative entre la palipéridone et les médicaments métabolisés par les isoenzymes du cytochrome P450 n'est escomptée. Des études in vitro réalisées sur des microsomes hépatiques humains ont montré que la palipéridone n'inhibait pas sensiblement le métabolisme des médicaments métabolisés par les isoenzymes du cytochrome P450 (incluant les CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4, et CYP3A5) jusqu'à des concentrations de 250 ng/ml. On admet donc que la palipéridone ne devrait pas inhiber de manière cliniquement significative la clairance des médicaments métabolisés par ces voies métaboliques. Par ailleurs, la palipéridone n'a probablement pas de propriétés d'induction enzymatique.
Des études in-vitro ont montré que la palipéridone était un substrat de la P-gp et à concentrations élevées, un inhibiteur faible de la P-gp. Aucune donnée in vivo n'est disponible et la pertinence clinique n'est pas connue.
Compte tenu des effets primaires de la palipéridone sur le SNC (cf. «Effets indésirables»), il faut fait preuve de prudence lors de l'utilisation de Palipéridone Spirig HC retard en association avec d'autres médicaments agissant sur le SNC comme p.ex. les anxiolytiques, la plupart des antipsychotiques, les somnifères, les opiacés ou l'alcool. La palipéridone peut diminuer l'effet de la lévodopa et d'autres agonistes dopaminergiques. Lorsqu'une telle association est considérée comme nécessaire, il convient de prescrire le traitement en question à la posologie efficace la plus basse possible, notamment au stade terminal de la maladie de Parkinson.
Compte tenu de son potentiel d'induction d'une hypotension orthostatique (cf. «Mises en garde et précautions»), il se peut que des effets additifs soient observés lors de l'administration de Palipéridone Spirig HC retard avec d'autres médicaments présentant ce même potentiel comme p.ex. d'autres antipsychotiques ou des tricycliques.
La prudence est recommandée lorsque la palipéridone est associée à d'autres médicaments connus pour diminuer le seuil épileptogène (c.-à-d. phénothiazines ou butyrophénones, tricycliques ou ISRS, tramadol, méfloquine, etc.).
L'administration concomitante de comprimés à libération prolongée de palipéridone à l'état d'équilibre (12 mg une fois par jour) et de comprimés à libération prolongée de valproate de sodium/acide valproïque (de 500 mg à 2000 mg une fois par jour) n'a pas affecté la pharmacocinétique à l'état d'équilibre du valproate.
Aucune étude d'interactions n'a été menée avec Palipéridone Spirig HC retard et le lithium. Une interaction pharmacocinétique entre Palipéridone Spirig HC retard et le lithium est peu probable.
Effet d'autres médicaments sur Palipéridone Spirig HC retard
La palipéridone n'est pas un substrat du CYP1A2, du CYP2A6, du CYP2C9, du CYP2C19 ou du CYP3A5. Des interactions avec des inhibiteurs ou des inducteurs de ces isoenzymes sont donc improbables. Les études in vitro indiquent une faible implication du CYP2D6 et du CYP3A4 dans la dégradation de la palipéridone. Par contre, aucun examen in vitro ou in vivo n'indique que ces isoenzymes jouent un rôle important dans la dégradation de la palipéridone. Des études in vitro ont montré que la palipéridone était un substrat de la glycoprotéine-P (P-gp).
La palipéridone est métabolisée dans une faible mesure par le CYP2D6 (cf. «Pharmacocinétique» «Métabolisme»). Dans une étude d'interactions, dans laquelle des sujets témoins sains ont reçu de la palipéridone orale associée avec de la paroxétine, un puissant inhibiteur du CYP2D6, aucun effet cliniquement significatif n'a été observé sur la pharmacocinétique de la palipéridone.
L'administration simultanée de palipéridone orale à libération retardée une fois par jour et de 200 mg de carbamazépine deux fois par jour a entraîné une diminution d'environ 37% de la Cmax moyenne et de l'AUC de la palipéridone à l'état d'équilibre. Cette diminution est due, pour une large part, à une augmentation de 35% de la clairance rénale de la palipéridone résultant probablement d'un effet combiné entre l'induction de la P-gp rénale par la carbamazépine et une dégradation légèrement accrue due à l'induction du CYP3A. La diminution mineure de la quantité de principe actif inchangé excrétée dans l'urine suggère que l'administration simultanée de carbamazépine n'a que peu d'effets sur le métabolisme par le CYP ou sur la biodisponibilité de la palipéridone. A des doses plus importantes de carbamazépine, des diminutions plus conséquentes des concentrations plasmatiques de palipéridone pourraient survenir. Au début d'un traitement par la carbamazépine, la posologie de Palipéridone Spirig HC retard devra être réévaluée et éventuellement augmentée. Inversement, à l'arrêt d'un traitement par la carbamazépine, la posologie de Palipéridone Spirig HC retard devra être réévaluée et diminuée si nécessaire.
La palipéridone, sous forme cationique à pH physiologique, est principalement excrétée par les reins sous forme inchangée et ce, environ pour moitié par filtration et pour moitié par sécrétion active. L'administration simultanée de triméthoprime, une substance connue pour son inhibition du transport cationique rénal actif de médicaments, n'a pas eu d'effets sur la pharmacocinétique de la palipéridone.
L'administration concomitante d'une dose unique d'un comprimé à libération prolongée de 12 mg de palipéridone et de comprimés à libération prolongée de valproate de sodium/acide valproïque (deux comprimés à 500 mg une fois par jour) a entraîné une élévation d'env. 50% de la Cmax et de l'AUC de la palipéridone. Aucun effet sur la clairance systémique n'ayant été observé, aucune interaction cliniquement significative entre les comprimés à libération prolongée de valproate de sodium/acide valproïque et l'injection intramusculaire de Palipéridone Spirig HC retard n'est attendue. Cette interaction n'a pas été étudiée jusqu'ici avec Palipéridone Spirig HC retard.
Grossesse, allaitementGrossesse
La sécurité du palmitate de palipéridone injecté par voie intramusculaire ou de la palipéridone administrée par voie orale pour l'utilisation pendant la grossesse n'a pas été étudiée.
Une étude de cohorte rétrospective d'observation, basée sur une banque de données américaine comportant des prestations de soins de santé remboursées, avait comparé le risque de malformations congénitales chez les enfants nés vivants chez des femmes ayant utilisé des antipsychotiques ou non au cours du premier trimestre de la grossesse. Lors de cette étude, une évaluation concrète de la palipéridone, le métabolite actif de la rispéridone, n'avait pas été effectuée. Après ajustement prenant en compte les variantes confondantes dans la banque de données, le risque de malformations congénitales en cas d'utilisation de rispéridone était augmenté par rapport à la non-utilisation d'antipsychotiques (risque relatif = 1,26, IC 95%: 1,02-1,56). Aucun mécanisme biologique susceptible d'expliquer cette constatation n'avait pu être identifié et, lors des études précliniques, aucun effet tératogène n'avait été observé. En se fondant sur les résultats de cette unique étude d'observation, aucune relation causale entre l'exposition in utero à la rispéridone et les malformations congénitales n'a été mise en évidence.
Les nouveau-nés dont les mères ont reçu des antipsychotiques (dont la palipéridone) pendant le troisième trimestre de la grossesse présentent un risque de symptômes extrapyramidaux moteurs et/ou de symptômes de sevrage après la naissance. Ces symptômes chez les nouveau-nés peuvent comprendre une agitation, une augmentation ou une diminution inhabituelle du tonus musculaire, des tremblements, une somnolence, des difficultés respiratoires ou des problèmes d'alimentation. Ces complications peuvent avoir un degré de sévérité variable. Dans certains cas, ils ont été auto-limitants; dans d'autres cas, les nouveau-nés ont nécessité une surveillance en service de soins intensifs ou une hospitalisation prolongée.
La palipéridone étant décelable dans le plasma pendant jusqu'à 126 jours après l'administration d'une dose unique de palipéridone suspension injectable à libération prolongée, il convient de tenir compte de la longue efficacité de palipéridone dans les réflexions. Une exposition maternelle à Palipéridone Spirig HC retard avant et pendant la grossesse peut provoquer des effets indésirables chez le nouveau-né.
Aucun effet tératogène n'a été constaté au cours de l'expérimentation animale mais d'autres types d'effets toxiques pour la reproduction ont été observés. Une légère augmentation de la mortalité fœtale a été rapportée chez les animaux de laboratoire ayant reçu une dose orale élevée de palipéridone (cf. «Données précliniques»).
Ce médicament ne doit pas être administré pendant la grossesse, sauf en cas de nécessité absolue. Si un arrêt du traitement s'avère nécessaire pendant la grossesse, l'arrêt du traitement ne doit, dans la mesure du possible, pas être abrupt. Les effets de Palipéridone Spirig HC retard sur le travail et l'accouchement chez l'être humain sont inconnus.
Allaitement
Les expérimentations animales réalisées avec la palipéridone et les études menées chez l'homme avec la rispéridone ont montré que la palipéridone est excrétée dans le lait. Les concentrations atteintes dans le lait maternel de ces deux substances ont été comparables à celles mesurées dans le plasma sanguin. Palipéridone Spirig HC retard ne doit pas être utilisé pendant l'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machinesPalipéridone Spirig HC retard peut avoir une influence sur les activités nécessitant une vigilance intellectuelle et entraîner des effets sur la vision (cf. «Effets indésirables»). Il faut donc avertir les patients de ne pas conduire de véhicule et de ne pas utiliser de machines tant qu'ils ne connaissent pas leur capacité de réaction individuelle.
Effets indésirablesLes effets indésirables sont présentés dans la section qui suit. Les effets indésirables sont des événements indésirables pour lesquels un lien plausible avec l'utilisation du palmitate de palipéridone est supposé sur la base d'une évaluation approfondie des informations disponibles au sujet de l'événement indésirable. Dans des cas isolés, un lien causal avec le palmitate de palipéridone ne peut pas être établi de manière fiable. En outre, comme les études cliniques sont exécutées dans des conditions variées, la fréquence des effets indésirables qui ont été observés au cours des études cliniques avec un médicament ne peut pas être directement comparée à la fréquence observée au cours des études cliniques menées avec un autre médicament, et elle ne correspond pas forcément à la fréquence de leur survenue observée en pratique clinique.
La palipéridone est le métabolite actif de la rispéridone. Les profils des effets secondaires des deux substances (y compris formulations orales et injectables) ont de ce fait une importance réciproque.
Résumé du profil de sécurité
La sécurité de la suspension injectable à libération prolongée de palmitate de palipéridone (injection mensuelle, injection trimestrielle et injection semestrielle (cette dernière n'est pas autorisée en Suisse)) a été évaluée dans des études cliniques chez 7565 patients atteints de schizophrénie et de trouble schizoaffectif.
La sécurité des comprimés à libération prolongée de palipéridone a été évaluée dans des études cliniques chez 2159 patients atteints de schizophrénie, de trouble schizoaffectif et de trouble bipolaire I.
La sécurité de la rispéridone (toutes les formulations) a été évaluée dans des études cliniques chez 12 195 patients atteints de schizophrénie, de trouble schizoaffectif, de trouble bipolaire, de trouble du spectre autistique, de troubles du comportement, chez des patients présentant un handicap mental léger à modéré, une démence, des troubles du comportement social, une démence de type Alzheimer, une maladie d'Alzheimer avec psychose ou des psychoses chroniques.
Les effets indésirables les plus fréquents (≥5%) rapportés au cours des études cliniques ont été: insomnie (12.0%), réactions au site d'injection (9.6%), prise de poids (9.6%), infections des voies respiratoires supérieures (9.4%), céphalées (8.8%), anxiété (7.4%), akathisie (6.7%) et parkinsonisme (6.1%).
Tous les effets indésirables qui sont survenus avec la palipéridone et/ou la rispéridone sont mentionnés ci-dessous. Ils sont classés par groupes de fréquence, les données relatives aux fréquences se rapportant uniquement aux études cliniques menées avec la suspension injectable à libération prolongée de palmitate de palipéridone (injection mensuelle, injection trimestrielle et injection semestrielle (cette dernière n'est pas autorisée en Suisse)). Les effets secondaires rapportés pour le palmitate de palipéridone non pas lors des études cliniques, mais après l'autorisation de mise sur le marché, sont mentionnés dans la catégorie de fréquence fréquence inconnue. Il en est de même pour tous les effets indésirables observés pour la rispéridone (toutes les formes pharmaceutiques) ou la palipéridone orale dans les études cliniques ou après l'autorisation de mise sur le marché.
Les indications de fréquence utilisées sont les suivantes: très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1000, <1/100), rares (≥1/10 000, <1/1000), très rares (<1/10 000) et «fréquence inconnue» (les données cliniques disponibles ne permettent pas d'estimer la fréquence de l'effet indésirable).
Infections et infestations
Fréquents: infections des voies respiratoires supérieures, infections des voies urinaires, grippe.
Occasionnels: pneumonie, bronchite, infections des voies respiratoires, sinusite, cystite, otite, infection oculaire, amygdalite, onychomycose, cellulite, acrodermatite, abcès sous-cutané.
Affections hématologiques et du système lymphatique
Occasionnels: diminution du nombre de leucocytes, anémie, neutropénie, thrombocytopénie, augmentation du nombre de granulocytes éosinophiles.
Fréquence inconnuea: agranulocytose, baisse de l'hématocrite.
Affections du système immunitaire
Occasionnels: réactions d'hypersensibilité.
Fréquence inconnuea: réaction anaphylactique.
Affections endocriniennes
Fréquents: hyperprolactinémieb.
Rares: sécrétion inadéquate de l'hormone antidiurétique, glucosurie.
Troubles du métabolisme et de la nutrition
Fréquents: hyperglycémie, prise de poids, perte de poids, diminution de l'appétit, augmentation des triglycérides.
Occasionnels: diabèted, hyperinsulinémie, augmentation de l'appétit, anorexie, augmentation de la cholestérolémie, polydipsie.
Rares: acidocétose diabétique, hypoglycémie.
Fréquence inconnuea: intoxication à l'eau, .
Affections psychiatriques
Très fréquents: insomniee.
Fréquents: agitation, dépression, anxiété.
Occasionnels: troubles du sommeil, manie, diminution de la libido, confusion, nervosité, cauchemars, anorgasmie.
Rares: catatonie, somnambulisme, perte d'affectivité.
Fréquence inconnuea: trouble alimentaire lié au sommeil (prise alimentaire incontrôlée lors du somnambulisme).
Affections du système nerveux
Très fréquents: céphalées.
Fréquents: parkinsonismec, akathisiec, somnolence, dystoniec, vertiges, dyskinésiec, tremblements.
Occasionnels: dyskinésie tardive, convulsionse, syncope, hyperactivité psychomotrice, vertige postural, troubles de l'attention, dysarthrie, dysgueusie, hypoesthésie, paresthésie, ischémie cérébrovasculaire.
Rares: syndrome malin des neuroleptiques, absence de réponse à la stimulation, perte de conscience, diminution du degré de conscience, troubles de l'équilibre, troubles de la coordination, tremblements au niveau de la tête.
Fréquence inconnuea: coma diabétique.
Affections oculaires
Occasionnels: vision floue, conjonctivite, sécheresse oculaire.
Rares: glaucome, trouble de la motricité oculaire, révulsion oculaire, photophobie, sécrétion lacrymale accrue, hyperémie oculaire.
Fréquence inconnuea: syndrome de l'iris hypotonique peropératoire.
Affections de l'oreille et du labyrinthe
Occasionnels: vertiges, acouphènes, otalgie.
Affections cardiaques
Fréquents: bradycardie, tachycardie.
Occasionnels: bloc auriculo-ventriculaire, trouble de la conduction, fibrillation auriculaire, allongement de l'intervalle QT à l'électrocardiogramme, syndrome de tachycardie orthostatique posturale, anomalies à l'électrocardiogramme, palpitations.
Rares: arythmies sinusales.
Affections vasculaires
Fréquents: hypertension.
Occasionnels: hypotension, hypotension orthostatique, embolie pulmonaire.
Rares: thrombose veineuse profonde, flush.
Fréquence inconnuea: ischémie.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux, nez bouché.
Occasionnels: dyspnée, stase pulmonaire, respiration haletante, douleurs pharyngolaryngées, épistaxis, stase dans les voies respiratoires.
Rares: syndrome d'apnée du sommeil, râle pulmonaire.
Fréquence inconnuea: hyperventilation, pneumonie d'aspiration, dysphonie.
Affections gastro-intestinales
Fréquents: douleur abdominale, vomissements, nausées, constipation, diarrhée, dyspepsie, douleurs dentaires.
Occasionnels: troubles abdominaux, gastro-entérite, dysphagie, sécheresse buccale, flatulence, gonflement de la langue.
Rares: pancréatite, obstruction intestinale, incontinence fécale, fécalome, chéilite.
Fréquence inconnuea: iléus.
Affections hépatobiliaires
Fréquents: augmentation des transaminases.
Occasionnels: augmentation des taux de gamma-glutamyl-transférase, augmentation des enzymes hépatiques.
Fréquence inconnuea: ictère.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée.
Occasionnels: urticaire, prurit, alopécie, eczéma, sécheresse cutanée, érythème, acné.
Rares: exanthème médicamenteux, hyperkératose, dermatite séborrhéique, pellicules.
Fréquence inconnuea: syndrome de Stevens-Johnson/nécrolyse épidermique toxique, angio-œdème, modification de la couleur de la peau.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: douleurs musculosquelettiques, dorsalgies, arthralgie.
Occasionnels: augmentation des taux de créatine phosphokinase, crampes musculaires, raideur articulaire, faiblesse musculaire, gonflement des articulations,.
Rares: rhabdomyolyse.
Fréquence inconnuea: posture anormale, douleurs de la nuque.
Affections du rein et des voies urinaires
Occasionnels: incontinence urinaire, pollakiurie, dysurie.
Rares: rétention urinaire.
Affections gravidiques, puerpérales et périnatales
Très rares: symptômes extrapyramidaux moteurs et/ou phénomènes de sevrage chez le nouveau-né (cf. «Grossesse, Allaitement»).
Affections des organes de reproduction et du sein
Fréquents: aménorrhée, galactorrhée, troubles menstruelse.
Occasionnels: dysfonction érectile, troubles de l'éjaculation, gynécomastie, dysfonction sexuelle, troubles mammaires, douleur mammaires, écoulement vaginal, augmentation du volume mammaire,.
Rares: priapisme, gonflement mammaire, écoulement mammaire.
Fréquence inconnuea: retard de règles.
Troubles généraux et anomalies au site d'administration
Fréquents: pyrexie, asthénie, fatigue, réactions au site d'injection.
Occasionnels: œdème facial, œdèmee, démarche anormale, augmentation de la température corporelle, douleur thoracique, symptômes thoraciques, sensation de maladie, induration, frissons.
Rares: hypothermie, , soif, syndrome de sevrage médicamenteux, abcès au site d'injection, cellulite au site d'injection, kyste au site d'injection, hématome au site d'injection.
Fréquence inconnuea: température corporelle diminuée, nécrose au site d'injection, ulcère au site d'injection.
Lésions, intoxications et complications liées aux procédures
Occasionnels: chute.
a La fréquence des effets indésirables est qualifiée comme «inconnue» car ils n'ont pas été observés lors d'essais cliniques portant sur le palmitate de palipéridone. Ils proviennent soit de rapports spontanés post-commercialisation et la fréquence ne peut être déterminée, soit de données issues d'essais cliniques et/ou de rapports post-commercialisation portant sur la rispéridone (quelle que soit la formulation) ou la palipéridone orale.
b Une hyperprolactinémie peut dans certains cas provoquer une gynécomastie, des troubles menstruels, une aménorrhée et une galactorrhée. Se référer à «Hyperprolactinémie» ci-dessous.
c Se référer à « Symptômes extrapyramidaux » ci-dessous.
d Dans les études contrôlées contre placebo, un diabète a été rapporté chez 0,32% des patients traités par palipéridone, comparé à un taux de 0,39% dans le groupe placebo. L'incidence totale dans toutes les études cliniques a été de 0,47% chez tous les patients traités par palipéridone.
e L'effet indésirable insomnie inclut troubles de l'endormissement et réveils nocturnes; les convulsions incluent: crises de grand mal; les œdèmes incluent: œdèmes généralisés, œdèmes périphériques, œdèmes prenant le godet («pitting edema»); les troubles menstruels incluent: irrégularité menstruelle, oligoménorrhée.
Description de certains effets indésirables et informations complémentaires
Suspension injectable à libération prolongée de palmitate de palipéridone, injection mensuelle
La sécurité de la suspension injectable à libération prolongée de palmitate de palipéridone (injection mensuelle) a été évaluée dans des études cliniques chez 4484 patients atteints de schizophrénie ou de trouble schizoaffectif. Les effets indésirables médicamenteux les plus fréquents (≥5%) ont été: insomnie (14,4%), céphalées (9,9%), infection des voies aériennes supérieures (7,3%), états anxieux (7,0%), réactions au site d'injection (7,0%), prise de poids (6,4%), parkinsonisme (6,2%) et akathisie (6,5%).
Les effets indésirables suivant ont été signalés plus fréquemment avec la suspension injectable à libération prolongée de palmitate de palipéridone (injection mensuelle) que dans les données de sécurité groupées pour l'injection mensuelle, l'injection trimestrielle et l'injection semestrielle (cette dernière n'est pas autorisée en Suisse), telles que décrites dans la liste des effets indésirables ci-dessus:
Très fréquents: bouche sèche, prurit.
Occasionnels: trouble de l'équilibre, hyperhémie oculaire, arythmie sinusale, incontinence fécale.
Suspension injectable à libération prolongée de palmitate de palipéridone, injection trimestrielle
La sécurité de la suspension injectable à libération prolongée de palmitate de palipéridone (injection trimestrielle) a été évaluée dans des études cliniques chez 1191 patients atteints de schizophrénie ou de trouble schizoaffectif. Les effets indésirables médicamenteux les plus fréquents (≥5%) ont été: prise de poids (13,5%), infection des voies aériennes supérieures (10,7%), états anxieux (7,6%), céphalées (6,7%), insomnie (6,0%) et réactions au site d'injection (5,3%).
Les effets indésirables suivant ont été signalés plus fréquemment avec la suspension injectable à libération prolongée de palmitate de palipéridone (injection trimestrielle) que dans les données de sécurité groupées pour l'injection mensuelle, l'injection trimestrielle et l'injection semestrielle (cette dernière n'est pas autorisée en Suisse), telles que décrites dans la liste des effets indésirables ci-dessus:
Très fréquents: infection des voies aériennes supérieures, prise de poids.
Fréquents: douleur pharyngolaryngée.
Occasionnels: glucose dans les urines, acidocétose diabétique, augmentation de la sécrétion lacrymale, chéilite.
Suspension injectable à libération prolongée de palmitate de palipéridone, injection semestrielle (non autorisée en Suisse)
La sécurité de la suspension injectable à libération prolongée de palmitate de palipéridone (injection semestrielle, non autorisée en Suisse) a été évaluée dans des études cliniques chez 478 patients atteints de schizophrénie ou de trouble schizoaffectif. Les effets indésirables médicamenteux les plus fréquents (≥5%) ont été: infection des voies aériennes supérieures (11,5%), réactions au site d'injection (10,7%), prise de poids (9,0%), céphalées (6,7%) et parkinsonisme (5,0%).
Les effets indésirables suivant ont été signalés plus fréquemment avec la suspension injectable à libération prolongée de palmitate de palipéridone (injection semestrielle, non autorisée en Suisse) que dans les données de sécurité groupées pour l'injection mensuelle, l'injection trimestrielle et l'injection semestrielle telles que décrites dans la liste des effets indésirables ci-dessus:
Très fréquents: urticaire, réactions au site d'injection.
Fréquents: anémie, diabète, gastroentérite, taux de créatine phosphokinase augmenté.
Occasionnels: tremblement de la tête, occlusion intestinale, dermite séborrhéique, priapisme.
Effets de classe
Allongements du QT, arythmies ventriculaires (fibrillation ventriculaire, tachycardie ventriculaire), cas de mort subite, arrêt cardiaque et torsades de pointes sont possibles sous traitement par des antipsychotiques. Des cas de thromboembolie veineuse, y compris embolie pulmonaire et thrombose veineuse profonde affectant la jambe, ont été rapportés sous antipsychotiques (cf. «Mises en garde et précautions»).
Symptômes extrapyramidaux moteurs (SEP)
Les données regroupées de deux études de 13 semaines, en double aveugle, contrôlées contre placebo, à doses fixes, dans la schizophrénie (cf. «Propriétés/Effets, mécanisme d'action», R092670-PSY3003, R092670-PSY3004) n'ont pas montré de différence entre palipéridone et le placebo en ce qui concerne les SEP liés au traitement. L'évaluation des SEP incluait une analyse combinée des groupes de SEP suivants: dyskinésie (dyskinésie, choréoathétose, chorée, athétose et myoclonie), dystonie (incluant dystonie, hypertonie musculaire, spasmes cervicales, torticolis, contractions musculaires involontaires, tétanie, blépharospasme, crise oculogyre, paralysie de la langue, spasme facial, laryngospasme, myotonie, opisthotonus, spasme oropharyngé, pleurothotonus, spasme de la langue, risus sardonicus et trismus), parkinsonisme (incluant salivation, raideur musculo-squelettique, parkinsonisme, hypersécrétion salivaire, phénomène de la roue dentée, bradykinésie, hypokinésie, faciès figé, tension musculaire, akinésie, rigidité de la nuque, rigidité musculaire, démarche parkinsonienne, réflexe palpébral anormal et tremblement parkinsonien de repos), akathisie (incluant akathisie, impatience, hyperkinésie et syndrome des jambes sans repos) et tremblements. Les résultats étaient comparables dans toutes les phases de l'étude sur la prévention à long terme des récidives.
Dans une étude de 9 semaines, en double aveugle, contrôlée contre placebo (R092670-SCH-201), l'incidence du parkinsonisme et de l'akathisie était plus élevée sous 100 mg de palipéridone (resp. 18% et 11%) que sous 50 mg de palipéridone (resp. 9% et 5%) et sous placebo (resp. 7% et 4%).
Dans l'étude de 13 semaines avec une dose initiale de 150 mg (R092670-PSY-3007), l'incidence des SEP nécessitant un traitement était comparable à celle du groupe placebo (8%), mais s'est révélé dose-dépendante: 6% (150/25 mg), 10% (150/100 mg) et 11% (150/150 mg).
Dystonie
Effet de classe: des symptômes d'une dystonie (une contraction anormalement prolongée de groupes musculaires) peuvent survenir chez des patients y étant sensibles pendant les premiers jours du traitement et en cas de fortes doses de médicaments antipsychotiques. Un risque accru de dystonie aiguë est notamment observé chez les hommes et les patients jeunes.
Prise de poids
Dans l'étude de 13 semaines avec une dose initiale de 150 mg, la proportion de patients ayant répondu au critère de prise de poids (une augmentation ≥7% du poids corporel par rapport au poids au début de l'étude) était plus élevée dans les groupes palipéridone que dans le groupe placebo. La proportion de patients présentant une augmentation notable du poids ≥7% a mis en évidence une tendance dose-dépendante. Dans le groupe placebo, l'incidence était de 5% contre 6%, 8% et 13% dans les groupes ayant reçu respectivement 25 mg, 100 mg et 150 mg de palipéridone.
Dans les deux études de 13 semaines, en double aveugle, contrôlées contre placebo, à doses fixes (données regroupées), les pourcentages de patients ayant répondu au critère de prise de poids de ≥7% du poids corporel, étaient de 6%, 9% et 10% dans les groupes traités respectivement par 25, 50 et 100 mg de palipéridone, comparativement à 2% dans le groupe placebo. Dans l'étude de 9 semaines, en double aveugle, contrôlée contre placebo, à doses fixes, 8% et 6% des patients traités respectivement par 50 et 100 mg et 4% des patients du groupe placebo répondaient à ce critère.
Pendant la phase ouverte de transition/entretien de 33 semaines de l'étude sur la prévention à long terme des récidives, 12% des patients traités par palipéridone répondaient à ce critère (prise de poids ≥7% depuis la phase en double aveugle jusqu'à la fin de l'étude); la modification moyenne du poids (écart type) par rapport au début de la phase ouverte était de +0,7 (4,79) kg. Dans la phase en double aveugle de durée variable, ce critère était atteint par 6% des patients traités par palipéridone (durée moyenne de 171 jours [de 1 à 407 jours]), et par 3% dans le groupe placebo (durée moyenne de 105 jours [de 8 à 441 jours]); la modification moyenne du poids (écart type) par rapport au début de la phase en double aveugle était de +0,5 (3,83) kg lors du traitement par palipéridone et de -1,0 (3,08) kg lors de l'administration du placebo. Des résultats similaires ont été obtenus dans la phase de prolongation de cette étude.
Hyperprolactinémie
Une hyperprolactinémie peut dans certains cas provoquer une gynécomastie, des troubles menstruels, une aménorrhée et une galactorrhée.
Les données regroupées des deux études de 13 semaines, en double aveugle, contrôlées contre placebo, à doses fixes, (cf. «Propriétés/Effets, mécanisme d'action») ont montré une augmentation moyenne de la prolactinémie chez les patients des deux sexes ayant reçu palipéridone (cf. «Mises en garde et précautions»). Les résultats de cette étude de 13 semaines avec une dose initiale de 150 mg, de l'étude de 9 semaines en double aveugle, contrôlée contre placebo à doses fixes et de la phase en double aveugle de l'étude sur la prévention à long terme des récidives ont donné des résultats comparables.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes données de surdosage ne sont disponibles qu'avec la forme orale.
Signes et symptômes
En général, les caractéristiques cliniques d'un surdosage auxquelles on peut s'attendre sont celles résultant d'une exacerbation des effets pharmacologiques connus de la palipéridone (c.-à-d. obnubilation et sédation, tachycardie et hypotension, allongement de l'intervalle QT et symptômes extrapyramidaux). Des torsades de pointes et une fibrillation ventriculaire ont été rapportées en rapport avec un surdosage de palipéridone orale. En cas de surdosage aigu, il faut envisager la possibilité d'une intoxication par plusieurs médicaments.
Traitement
Lorsque l'on évalue les besoins thérapeutiques et le rétablissement, il faut prendre en considération le fait qu'il s'agit d'une forme à libération retardée et que la palipéridone a une longue demi-vie. Il n'existe pas d'antidote spécifique. Des mesures générales de soutien des fonctions vitales doivent être mises en œuvre. Il faut libérer les voies aériennes et les garder dégagées, assurer une oxygénation et une ventilation adéquates. Il faut immédiatement instaurer un monitorage de la fonction cardio-circulatoire, y compris une surveillance par ECG continu, pour détecter d'éventuelles arythmies. Une hypotension et une insuffisance cardio-circulatoire doivent être traitées par des mesures appropriées telles qu'une administration intraveineuse de solutés et/ou l'administration d'agents sympathomimétiques. En cas de symptômes extrapyramidaux moteurs sévères, il convient d'administrer des agents anticholinergiques. Le patient doit faire l'objet d'une surveillance étroite jusqu'à son rétablissement.
Propriétés/EffetsCode ATC
N05AX13
Palipéridone Spirig HC retard contient un mélange racémique de palipéridone (+) et (-).
Mécanisme d'action / Pharmacodynamique
La palipéridone, le principe actif de Palipéridone Spirig HC retard, est un agent psychotrope qui appartient à la classe chimique des dérivés du benzisoxazole (antipsychotique atypique).
Le palmitate de palipéridone est hydrolysé en palipéridone (cf. «Données précliniques»). La palipéridone est un antagoniste des récepteurs dopaminergiques D2 à action centrale qui a une activité antagoniste marquée sur les récepteurs sérotoninergiques 5HT2A. La palipéridone exerce en outre un effet antagoniste sur les récepteurs adrénergiques α1 et α2 et sur les récepteurs histaminergiques H1. La substance ne présente aucune affinité pour les récepteurs cholinergiques muscariniques ni pour les récepteurs adrénergiques β1 et β2. L'activité pharmacologique des énantiomères (+) et (-) de la palipéridone est qualitativement et quantitativement similaire.
Tout comme le mécanisme d'action des autres médicaments efficaces dans le traitement de la schizophrénie, celui de la palipéridone est inconnu. Il a néanmoins été avancé que l'effet thérapeutique du médicament dans la schizophrénie pourrait être médié par un effet antagoniste s'exerçant à la fois sur les récepteurs dopaminergiques de type 2 (D2) et sur les récepteurs sérotoninergiques de type 2 (5HT2A). Un effet antagoniste sur des récepteurs autres que les récepteurs D2 et 5HT2A pourrait être responsable de certains autres effets de la palipéridone.
Efficacité clinique
L'efficacité de palipéridone dans le traitement aigu de la schizophrénie a été démontrée dans quatre études à court terme (une sur 9 semaines et trois sur 13 semaines) en double aveugle, randomisées, contrôlées contre placebo, à doses fixes, menées chez des patients adultes hospitalisés qui avaient présenté une récidive aiguë et répondaient aux critères DSM-IV pour la schizophrénie. Les doses fixes de palipéridone utilisées dans ces études ont été administrées aux jours 1, 8 et 36 dans l'étude de 9 semaines et en plus au jour 64 dans les études de 13 semaines, c.-à-d. à une semaine d'intervalle pour les deux premières doses et à quatre semaines d'intervalle pour les doses d'entretien.
L'efficacité a été évaluée à l'aide de l'échelle PANSS (Positive and Negative Syndrome Scale), un inventaire validé de plusieurs items portant sur cinq facteurs et utilisé pour évaluer les symptômes positifs, les symptômes négatifs, les pensées désorganisées, l'hostilité/excitation incontrôlée et l'anxiété/dépression. La capacité fonctionnelle a été étudiée sur l'échelle PSP (Personal and Social Performance). Le PSP est une échelle validée notée par le médecin, évaluant le fonctionnement personnel et social dans le domaine des activités sociales utiles. Dans une étude de 13 semaines (R092670-PSY-3007) (n= 636), ayant comparé trois doses fixes de palipéridone (injection de la dose initiale de 150 mg dans le muscle deltoïde, suivie de 3 doses de 25 mg/4 semaines, de 100 mg/4 semaines ou de 150 mg/4 semaines dans le muscle deltoïde ou fessier) à un placebo, les trois doses de palipéridone se sont avérées supérieures au placebo quant à l'amélioration du score total PANSS. Dans cette étude, les groupes traités par 100 mg/4 semaines et 150 mg/4 semaines ont montré une supériorité statistique par rapport au placebo pour ce qui est du score PSP, mais non le groupe ayant reçu 25 mg/4 semaines.
Dans une autre étude de 13 semaines (R092670-PSY-3003) (n= 349), ayant comparé trois doses fixes de palipéridone (50 mg/4 semaines, 100 mg/4 semaines et 150 mg/4 semaines) à un placebo, seule la dose de 100 mg de palipéridone toutes les 4 semaines s'est avérée supérieure au placebo pour l'amélioration du score total PANSS. Dans cette étude, les groupes traités par 50 mg/4 semaines et 100 mg/4 semaines ont montré une supériorité par rapport au placebo quant à l'amélioration du score PSP. Bien qu'une dose de 150 mg ait été utilisée dans un groupe thérapeutique de cette étude, le nombre de patients ayant reçu cette dose était trop faible pour que l'on puisse tirer des conclusions définitives sur son efficacité.
Dans une troisième étude de 13 semaines (R092670-PSY-3004) (n= 513), ayant comparé trois doses fixes de palipéridone (25 mg/4 semaines, 50 mg/4 semaines et 100 mg/4 semaines) à un placebo, les trois doses de palipéridone se sont avérées supérieures au placebo quant à l'amélioration du score total PANSS. Dans cette étude, aucun des groupes posologiques de la palipéridone n'a obtenu de significativité statistique par rapport au placebo quant à l'amélioration du score PSP.
Dans l'étude de 9 semaines (R092670-PSY-201) (n= 197), ayant comparé deux doses fixes de palipéridone (50 mg/4 semaines et 100 mg/4 semaines) à un placebo, les deux doses de palipéridone se sont avérées supérieures au placebo quant à l'amélioration du score total PANSS.
L'efficacité de palipéridone à maintenir la maîtrise des symptômes de la schizophrénie et à retarder l'apparition de récidives schizophréniques a été démontrée dans une étude à plus long terme, en double aveugle, contrôlée contre placebo, à doses variables, menée chez 849 jeunes adultes ou adultes d'âge moyen répondant aux critères DSM-IV de la schizophrénie. Cette étude (R092670-PSY-3001) s'est composée d'une phase ouverte de traitement aigu (9 semaines), d'une phase de stabilisation (24 semaines) et d'une phase randomisée contrôlée contre placebo pour observer les récidives ainsi que d'une phase ouverte d'observation ultérieure de 52 semaines. Dans cette étude, palipéridone a été administré tous les mois à des doses de 25, 50, 75 et 100 mg, la dose de 75 mg n'ayant été autorisée que dans l'extension ouverte de 52 semaines. Les patients ont reçu initialement des doses flexibles (25-100 mg) de palipéridone pendant une période de transition de 9 semaines, suivie d'une période d'entretien de 24 semaines, au cours de laquelle les patients devaient avoir un score PANSS ≤75 pour pouvoir être inclus dans celle-ci. Des adaptations posologiques ont été autorisées uniquement pendant les douze premières semaines de la période d'entretien. Au cours de la phase en double aveugle de durée variable, les patients ont été randomisés pour recevoir soit la même dose de palipéridone (durée moyenne: 171 jours [1 jour-407 jours]) que celle qu'ils avaient également reçu pendant la phase de stabilisation toutes les 4 semaines, soit un placebo (durée moyenne: 105 jours [8 jours–441 jours]). Au total, 410 patients stabilisés ont été randomisés et traités dans les groupes palipéridone ou dans le groupe placebo jusqu'à la survenue d'une récidive des symptômes de schizophrénie. Une récidive était définie comme la durée jusqu'à la première survenue d'au moins un des symptômes ou événements suivants: hospitalisation en psychiatrie, augmentation ≥25% du score total PANSS (si le score initial était >40) ou de 10 points (si le score initial était ≤40) lors de deux évaluations successives, automutilation délibérée, comportement violent, tentative de suicide/homicide ou score ≥5 (si le score maximal initial était ≤3) ou ≥6 (si le score maximal initial était de 4) lors de deux évaluations successives des items individuels PANSS P1 (idées délirantes), P2 (pensées confuses), P3 (comportement hallucinatoire), P6 (méfiance/délire de persécution), P7 (hostilité) ou G8 (manque de coopération). Le critère d'efficacité primaire était le délai jusqu'à l'apparition de la récidive. Une analyse intermédiaire planifiée à l'avance (après la survenue de 68 événements de récidive) a mis en évidence un délai jusqu'à l'apparition d'une récidive significativement plus long chez les patients traités par palipéridone que chez les patients du groupe placebo (cf. figure 1). L'étude a été prématurément arrêtée, car le maintien de l'efficacité avait été démontré.
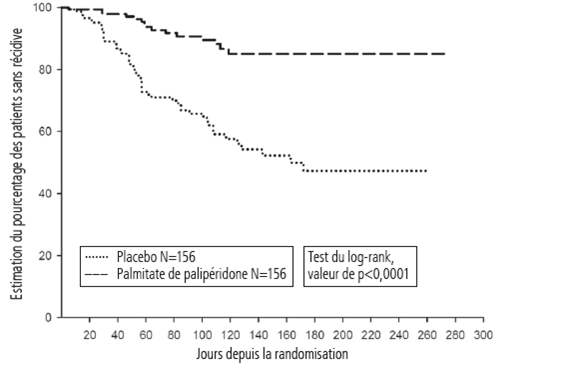
Figure 1: Courbe de Kaplan-Meier de l'intervalle sans récidive – Analyse intermédiaire (analyse intermédiaire en intention de traiter)
Le résultat des analyses basées sur les données finales, y compris sur toutes les données recueillies jusqu'à la fin de l'étude, a été concordant avec celui de l'analyse primaire d'efficacité basée sur les données intermédiaires.
Une analyse de sous-groupes de patients n'a pas mis en évidence de différences cliniquement significatives quant à la réponse en fonction du sexe, de l'âge ou de l'origine ethnique.
PharmacocinétiqueAbsorption
En raison de sa solubilité extrêmement faible, le palmitate de palipéridone se dissout lentement après injection intramusculaire, avant d'être hydrolysé en palipéridone et absorbé dans la circulation sanguine. Après administration d'une dose intramusculaire unique, la concentration plasmatique de la palipéridone augmente de manière continue jusqu'à atteindre son pic après un tmax moyen de 13 jours. La libération du principe actif débute déjà le 1er jour et dure jusqu'à 126 jours.
Après injection intramusculaire de doses uniques (25-150 mg) dans le muscle deltoïde, la Cmax observée était en moyenne 28% supérieure à celle observée après une injection dans le muscle fessier. Les deux injections initiales dans le muscle deltoïde, de 150 mg le jour 1 et de 100 mg le jour 8, favorisent l'obtention rapide d'une concentration thérapeutique. Le profil de libération et le schéma posologique de Palipéridone Spirig HC retard entraînent des concentrations thérapeutiques persistantes. L'exposition totale à la palipéridone après l'administration de palipéridone suspension injectable à libération prolongée était proportionnelle à la dose dans un intervalle posologique de 25 à 150 mg et la Cmax a augmenté moins que proportionnellement à la dose à une posologie supérieure à 50 mg. Le rapport pic/vallée moyen à l'état d'équilibre pour une dose de palipéridone de 100 mg était de 1,8 après administration dans le muscle fessier et de 2,2 après administration dans le muscle deltoïde. La demi-vie moyenne de la palipéridone après administration de palipéridone suspension injectable à libération prolongée dans un intervalle posologique de 25 à 150 mg était comprise entre 25 et 49 jours.
Après administration de palmitate de palipéridone, il se produit une interconversion des énantiomères (+) et (-) de la palipéridone et le rapport AUC(+)/(-) à l'état d'équilibre est d'environ 1,6 à 1,8.
Distribution
Selon une analyse de population, le volume apparent de distribution de la palipéridone est de 391 l. La liaison aux protéines plasmatiques de la palipéridone racémique est de 74%. Le principe actif se lie essentiellement à la α1-glycoprotéine acide et à l'albumine.
Métabolisme
Une semaine après l'administration d'une dose orale unique de 1 mg de palipéridone à libération immédiate marquée au 14C, 59% de la dose a été excrétée sous forme inchangée dans les urines, ce qui indique que la palipéridone n'est pas fortement métabolisée dans le foie. Environ 80% de la radioactivité administrée a été retrouvée dans les urines et 11% dans les fèces. Quatre voies métaboliques ont été identifiées in vivo, dont aucune n'a été responsable de plus de 6,5% de la dose: désalkylation, hydroxylation, déshydrogénation et division du benzisoxazol. Bien que les études in vitro semblent indiquer une implication du CYP2D6 et du CYP3A4 dans le métabolisme de la palipéridone, rien n'indique in vivo que ces isoenzymes jouent un rôle significatif dans le métabolisme de la palipéridone. Bien qu'il existe de grandes différences dans la population générale en ce qui concerne la capacité à métaboliser les substrats du CYP2D6, les analyses de pharmacocinétique de population n'ont montré aucune différence nette entre les métaboliseurs rapides (extensive metabolisers) et les métaboliseurs lents (poor metabolisers) des substrats du CYP2D6 en ce qui concerne la clairance apparente de la palipéridone après son administration orale. Des études in vitro réalisées sur des microsomes hépatiques humains ont montré que la palipéridone n'a pas sensiblement inhibé le métabolisme des principes actifs métabolisés par les isoenzymes du cytochrome P450, incluant les CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4, et CYP3A5.
Des études in vitro ont montré que la palipéridone est un substrat de la P-gp et, à des concentrations élevées, un inhibiteur faible de la P-gp. Des données in vivo ne sont pas disponibles et la pertinence clinique n'est pas connue.
Injection de palmitate de palipéridone à longue durée d'action versus palipéridone orale à libération retardée
La formulation de Palipéridone Spirig HC retard, suspension injectable à libération prolongée est conçue pour libérer la palipéridone sur une période d'un mois, tandis que la palipéridone orale à libération retardée est administrée tous les jours. Le schéma d'instauration du traitement par Palipéridone Spirig HC retard (150 mg/100 mg dans le muscle deltoïde le jour 1/le jour 8) vise à atteindre rapidement les concentrations de palipéridone à l'état d'équilibre lorsque le traitement est instauré sans supplémentation orale.
Après l'instauration du traitement par palipéridone, la concentration plasmatique totale était généralement dans la même étendue de concentration que celle observée avec 6-12 mg de palipéridone orale à libération retardée. Avec l'utilisation du schéma d'instauration du traitement par palipéridone suspension injectable à libération prolongée les patients sont restés dans la fenêtre d'exposition correspondant à la palipéridone orale à libération retardée à 6-12 mg, même les jours où la concentration a atteint son minimum avant l'administration de la dose suivante (jour 8 et jour 36). La variabilité interindividuelle de la pharmacocinétique de la palipéridone libérée après administration de palipéridone suspension injectable à libération prolongée était plus faible que celle observée avec les comprimés de palipéridone orale à libération retardée. Compte tenu de la différence entre les profils pharmacocinétiques moyens des deux préparations, il faut faire preuve de prudence lors de la comparaison directe de leurs propriétés pharmacocinétiques.
Élimination
Une semaine après l'administration d'une dose orale unique de 1 mg de palipéridone à libération immédiate marquée au 14C, 59% de la dose a été excrétée sous forme inchangée dans les urines, cf. «Métabolisme».
Cinétique pour certains groupes de patients
Origine ethnique
Une analyse pharmacocinétique de population de données provenant d'études réalisées avec la palipéridone orale n'a montré aucune différence liée à l'ethnie en ce qui concerne la pharmacocinétique de la palipéridone après utilisation de palipéridone suspension injectable à libération prolongée.
Sexe
Bien que les femmes aient présenté une absorption plus lente que les hommes dans les analyses pharmacocinétiques de population, aucune différence cliniquement significative n'a été constatée entre les hommes et les femmes.
Tabagisme
Il ressort des études in vitro avec des enzymes hépatiques humains que la palipéridone n'est pas un substrat du CYP1A2; le tabagisme ne devrait donc pas avoir d'influence sur la pharmacocinétique de la palipéridone.
Une analyse pharmacocinétique de population a montré une exposition à la palipéridone légèrement plus faible chez les fumeurs que chez les non-fumeurs. La différence n'a toutefois vraisemblablement pas d'incidence clinique.
Troubles de la fonction hépatique
Palipéridone Spirig HC retard, suspension injectable à libération prolongée n'a pas été étudié chez les patients insuffisants hépatiques. Sur la base d'une étude menée avec la palipéridone orale chez des patients atteints d'insuffisance hépatique modérée (classe B de Child-Pugh), aucun ajustement de la dose n'est nécessaire chez les patients atteints d'insuffisance hépatique légère à modérée. Dans une étude réalisée chez des sujets présentant une insuffisance hépatique modérée (classe B de Child-Pugh), les concentrations plasmatiques de palipéridone libre étaient comparables à celles chez les sujets sains. On ne dispose d'aucune expérience chez des patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh).
Troubles de la fonction rénale
Palipéridone Spirig HC retard, suspension injectable à libération prolongée n'a pas fait l'objet d'études systématiques chez les patients insuffisants rénaux. La dose de Palipéridone Spirig HC retard doit être réduite chez les patients atteints d'insuffisance rénale légère. L'utilisation de Palipéridone Spirig HC retard n'est pas recommandée chez les patients atteints d'insuffisance rénale modérée à sévère (cf. «Posologie/Mode d'emploi»). Dans des études portant sur la palipéridone orale, des patients atteints d'insuffisance rénale de gravité variable ont reçu un comprimé unique de 3 mg de palipéridone à libération retardée. L'élimination de la palipéridone a diminué parallèlement à la diminution de la fonction rénale. Chez les participants de l'étude, la clairance totale de la palipéridone a été réduite de 32% en cas d'insuffisance rénale légère (ClCr = 50 à <80 ml/min), de 64% en cas d'insuffisance rénale modérée (ClCr = 30 à <50 ml/min) et de 71% en cas d'insuffisance rénale sévère (ClCr = 10 à <30 ml/min), ce qui correspond à une exposition (AUCinf) en moyenne 1,5, 2,6 et 4,8 fois supérieure à celle observée chez les sujets sains. La demi-vie terminale d'élimination de la palipéridone était respectivement de 24, 40, et 51 heures chez les participants de l'étude présentant une insuffisance rénale légère, modérée, et sévère, en comparaison à 23 heures chez les participants de l'étude avec une fonction rénale normale (ClCr ≥80 ml/min).
D'après un nombre limité d'observations réalisées avec palipéridone chez des patients insuffisants rénaux légers et d'après des simulations pharmacocinétiques, le traitement par Palipéridone Spirig HC retard doit, chez les patients insuffisants rénaux légers, être instauré avec une dose de 100 mg le 1er jour du traitement et de 75 mg après une semaine (administrée les deux fois dans le muscle deltoïde), puis être poursuivi par des injections mensuelles (toutes les 4 semaines) de 50 mg dans le muscle deltoïde ou fessier, dose à adapter dans un intervalle allant de 25 à 100 mg en fonction de la tolérance individuelle du patient et/ou de l'efficacité (cf. «Posologie/Mode d'emploi»).
Patients âgés (de 65 ans et plus)
Il n'est pas recommandé d'ajuster la posologie sur la seule base de l'âge. Etant donné la diminution de la clairance de la créatinine liée à l'âge, il se peut cependant qu'un ajustement de la posologie s'avère nécessaire (cf. «Insuffisance rénale» et «Posologie/Mode d'emploi»).
Données précliniquesToxicité en cas d'administration répétée
Des études de toxicité à doses répétées ont montré que le palmitate de palipéridone injecté par voie intramusculaire (≥20 mg/kg/mois chez le rat et ≥5 mg/kg/mois chez le chien) et la palipéridone administrée par voie orale (≥0,63 mg/kg/jour chez le rat) entraînent, comme d'autres antagonistes dopaminergiques D2, des effets médiés par la prolactine, p.ex. sur les glandes mammaires et les organes génitaux. En raison de l'absence de dose sans effet indésirable observé (no-observed-effect levels), aucune marge de sécurité n'a pu être déterminée chez le rat. La marge de sécurité basée sur l'exposition a été environ 1,6 fois plus élevée chez les chiens traités par le palmitate de palipéridone par voie intramusculaire.
Génotoxicité
Le test de mutation inverse d'Ames, le test sur le lymphome de souris in vitro ainsi que le test du micronoyau chez le rat in vivo n'ont pas mis en évidence de potentiel mutagène de la palipéridone ou du palmitate de palipéridone.
Cancérogénicité
Le potentiel cancérogène du palmitate de palipéridone injecté par voie intramusculaire a été évalué dans une étude de cancérogénicité d'une durée de 24 mois réalisée chez le rat. Une augmentation statistiquement significative des adénocarcinomes mammaires a été constatée chez les rats femelles à des doses de 10, 30 et 60 mg/kg/mois. Des rats mâles ont présenté une augmentation statistiquement significative des adénomes et des carcinomes mammaires à des doses de 30 et 60 mg/kg/mois. En raison de l'absence de dose sans effet indésirable observé (no-observed-effect levels), aucune marge de sécurité basée sur l'exposition n'a pu être déterminée.
Le potentiel carcinogène de la palipéridone, le métabolite actif de la rispéridone, a été évalué sur la base d'études menées avec la rispéridone chez la souris et le rat. Les souris ont été traitées par la rispéridone pendant 18 mois et les rats pendant 25 mois, à des doses d'env. 0,63, 2,5 et 10 mg/kg/jour. Une augmentation statistiquement significative des adénomes de l'hypophyse, des adénomes du pancréas endocrine et des adénocarcinomes mammaires a été observée. Après administration chronique d'antipsychotiques chez des rongeurs, l'augmentation de l'incidence des tumeurs des glandes mammaires, de l'hypophyse et du pancréas endocrine est bien documentée dans la littérature scientifique. On suppose que cette augmentation est due à l'antagonisme dopaminergique D2 durable. La pertinence de ces observations de tumeurs chez les rongeurs pour le risque chez l'être humain est inconnue.
Toxicité sur la reproduction
Les études sur le développement embryonnaire et fœtal n'ont montré aucun effet tératogène après administration orale d'une dose atteignant jusqu'à 10 mg/kg/jour de palipéridone chez le rat et jusqu'à 5 mg/kg/jour chez le lapin. Le nombre de fœtus de lapin survivants a été plus faible à une dose de 5 mg/kg/jour, laquelle induit aussi une toxicité maternelle. Après administration intramusculaire répétée de palmitate de palipéridone chez des rattes gestantes, aucune embryotoxicité ou tératogénicité n'a été observée jusqu'à la dose maximale (160 mg/kg/jour) correspondant à 4,1 fois le niveau d'exposition chez l'être humain à la dose maximale recommandée de 150 mg.
Fertilité
Bien qu'un traitement par la palipéridone orale ait entraîné des effets médiés par la prolactine et le SNC, aucun effet sur la fertilité de rats mâles et femelles n'a été observé. Le nombre d'embryons vivants des rats femelles a été diminué à une dose toxique pour la mère de 2,5 mg/kg/jour. Chez le chien, une diminution de la motilité des spermatozoïdes et de la concentration plasmatique de testostérone a été décrite pour la rispéridone orale après l'administration de doses équivalentes à la dose maximale recommandée de rispéridone chez l'être humain. Chez le rat femelle (mais non chez le rat mâle), une altération du comportement d'accouplement a été constaté sous rispéridone, tandis qu'aucun effet sur la fertilité n'a été observé.
Remarques particulièresIncompatibilités
Palipéridone Spirig HC retard ne doit pas être mélangé avec d'autres médicaments ou solvants.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques concernant le stockage
Ne pas conserver au-dessus de 30 °C et hors de portée des enfants.
Remarques concernant la manipulation
Le set d'injection contient une seringue préremplie et 2 aiguilles de sécurité (une aiguille de calibre 22 G et de 3,8 cm de longueur et une aiguille de calibre 23 G et de 2,5 cm de longueur) pour injection intramusculaire.
Palipéridone Spirig HC retard est destiné exclusivement à un usage unique.
|
|
|
1. Secouer vigoureusement la seringue pendant au moins 10 secondes afin d'obtenir une suspension homogène.
| |
|
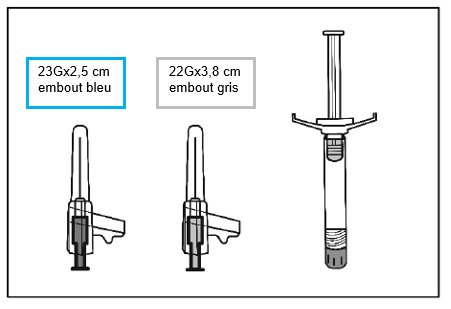
|
2. Choisir l'aiguille appropriée.
Pour l'injection dans le MUSCLE DELTOIDE utiliser l'aiguille 23-G de 2,5 cm de longueur (aiguille à embout bleu) si le patient pèse <90 kg; utiliser l'aiguille 22-G de 3,8 cm de longueur (aiguille à embout gris) si le patient pèse ≥90 kg.
Pour l'injection dans le MUSCLE FESSIER, utiliser l'aiguille 22-G de 3,8 cm de longueur (aiguille à embout gris).
| |
|
|
3. Tenir la seringue à la verticale vers le haut et retirer l'obturateur en caoutchouc de la seringue en le tournant légèrement dans le sens des aiguilles d'une montre.
| |
|

|
4. Ouvrir la poche contenant l'aiguille de sécurité, en la repliant à moitié. Tenir le capuchon de l'aiguille par la poche en plastique partiellement repliée. Fixer l'aiguille de sécurité sur le raccord Luer de la seringue en la tournant légèrement dans le sens des aiguilles d'une montre.
| |
|
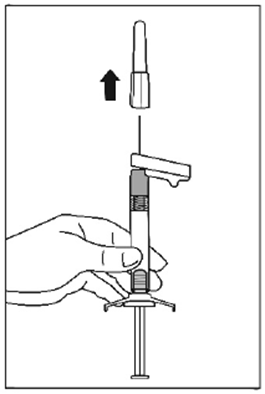
|
5. Retirer le capuchon de l'aiguille en tirant tout droit. Ne pas tourner le capuchon pour éviter que l'aiguille ne se détache à nouveau de la seringue.
| |
|
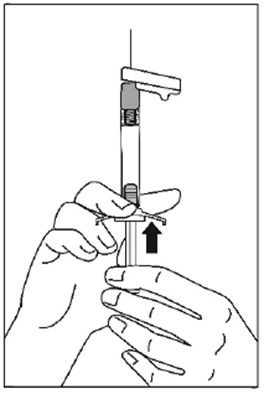
|
6. Tenir à la verticale la seringue, aiguille vers le haut, pour éliminer les bulles d'air. Pousser à cet effet prudemment le piston.
|
7. Injecter lentement par voie intramusculaire profonde la totalité du contenu de la seringue dans le muscle deltoïde ou le muscle fessier choisi du patient. Ne pas administrer par voie intravasculaire ou sous-cutanée.
|
|
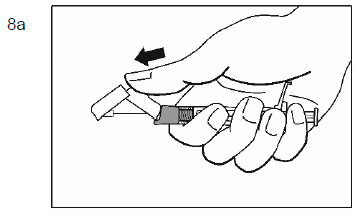
|
8. Une fois l'injection terminée, activer le système de protection de l'aiguille en s'aidant du pouce ou d'un doigt de la main qui tient la seringue (8a, 8b), ou en l'appuyant sur une surface plane (8c). Le système de protection de l'aiguille est complètement activé lorsqu'un déclic se fait entendre. Eliminer la seringue et l'aiguille dans les règles de l'art.
| |
|
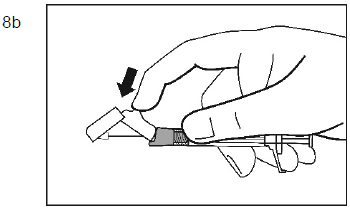
| |
|
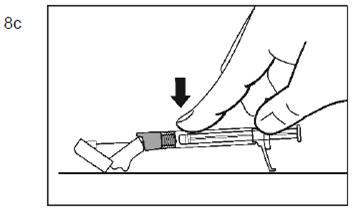
|
Numéro d’autorisation69356 (Swissmedic).
PrésentationPalipéridone Spirig HC retard, suspension injectable à libération prolongée en seringues préremplies de 25 mg/0,25 ml, 50 mg/0,5 ml, 75 mg/0,75 ml, 100 mg/1 ml, 150 mg/1,5 ml: 1 seringue préremplie et deux aiguilles pour injection (22 G, 23 G) [B]
Titulaire de l’autorisationSpirig HealthCare SA, 4622 Egerkingen
Mise à jour de l’informationMars 2023
|










