CompositionPrincipes actifs
Tirzépatide
Excipients
Monohydrogénophosphate de sodium heptahydraté
Chlorure de sodium
Acide chlorhydrique et hydroxyde de sodium (pour ajustement du pH)
Eau pour préparations injectables
Teneur totale en sodium: 1.8-1.9 mg/0.5 ml
Forme galénique et quantité de principe actif par unitéSolution injectable dans un stylo pré-rempli
Un stylo pré-rempli pour usage unique contient 2.5 mg, 5 mg, 7.5 mg, 10 mg, 12.5 mg ou 15 mg de tirzépatide dans 0.5 ml de solution.
Solution injectable dans un flacon perforable
Un flacon perforable pour usage unique contient 2.5 mg, 5 mg, 7.5 mg, 10 mg, 12.5 mg ou 15 mg de tirzépatide dans 0.5 ml de solution.
Indications/Possibilités d’emploiDiabète de type 2
Mounjaro est indiqué chez les adultes pour le traitement du diabète de type 2 insuffisamment contrôlé, en complément à un régime alimentaire et de l'exercice:
·en monothérapie, en cas de contre-indication ou d'intolérance à la metformine.
·en association avec d'autres médicaments hypoglycémiants.
Voir la rubrique « Efficacité clinique » pour les résultats obtenus avec les associations examinées dans des études cliniques.
Régulation chronique du poids
Mounjaro est indiqué en complément d'un régime hypocalorique et d'une augmentation de l'activité physique dans la régulation chronique du poids, notamment pour la perte de poids et le maintien du poids, chez des adultes avec un indice de masse corporelle (IMC) initial:
·≥30 kg/m2 (obésité) ou
·≥27 kg/m2 et <30 kg/m2 (surpoids) en présence d'au moins une comorbidité due au poids (par exemple, une hypertension artérielle, une dyslipidémie, un syndrome d'apnées obstructives du sommeil, une maladie cardiovasculaire, un prédiabète ou un diabète de type 2).
Posologie/Mode d’emploiLa dose initiale de tirzépatide est de 2.5 mg une fois par semaine. Après 4 semaines, la dose sera augmentée à 5 mg une fois par semaine. Si nécessaire, la dose peut être augmentée par paliers de 2.5 mg après un minimum de 4 semaines à la dose en cours.
La dose maximale est de 15 mg une fois par semaine.
Lorsque le tirzépatide est ajouté à un traitement en cours de metformine et/ou d'un inhibiteur du SGLT2 (cotransporteur du sodium-glucose-2), la dose en cours de metformine et/ou de l'inhibiteur du SGLT2 peut être conservée. Lorsque le tirzépatide est ajouté à un traitement en cours d'une sulfonylurée ou d'insuline, une diminution de la dose de sulfonylurée ou d'insuline devrait être envisagée, afin de réduire le risque d'hypoglycémie. Il est nécessaire que le patient effectue une autosurveillance de la glycémie, pour ajuster la dose de sulfonylurée ou d'insuline. Il est recommandé de réduire progressivement la dose d'insuline.
Si nécessaire, le jour de l'administration hebdomadaire peut être modifié, pour autant que l'administration de la dernière dose remonte au moins à 3 jours (72 heures).
Instructions posologiques particulières (voir aussi la rubrique «Pharmacocinétique»)
Aucun ajustement de la dose en fonction de l'âge, du sexe, de la race, de l'appartenance ethnique et du poids corporel n'est nécessaire.
Patients âgés
Aucun ajustement de la dose n'est nécessaire.
Patients souffrant d'insuffisance rénale
Aucun ajustement de la dose n'est nécessaire, y compris pour une insuffisance rénale terminale.
Patients présentant des troubles de la fonction hépatique
Aucun ajustement de la dose n'est nécessaire.
Enfants et adolescents
La sécurité et l'efficacité du tirzépatide chez les enfants et les adolescents âgés de moins de 18 ans n'ont pas encore été établies. Aucune donnée n'est disponible.
Prise retardée
Si une injection a été omise, elle sera rattrapée aussi vite que possible dans les 4 jours (96 heures). Si plus de 4 jours se sont écoulés, la dose omise n'est plus prise en compte et l'injection suivante se fera lors du prochain jour prévu. Dans tous les cas, le patient peut alors reprendre son rythme d'application habituel.
Mode d'administration
L'administration peut se faire à toute heure de la journée, indépendamment des repas.
Mounjaro est injecté par voie sous-cutanée dans l'abdomen, la cuisse ou le haut du bras.
Les sites d'injection doivent être alternés à chaque administration.
Avant de s'administrer le médicament, les patients doivent être informés de lire attentivement le mode d'emploi figurant dans la notice d'emballage du stylo pré-rempli ou le «Mode d'emploi/Manipulation» figurant dans la notice d'emballage du flacon perforable.
Contre-indicationsHypersensibilité au principe actif ou à l'un des excipients.
Mises en garde et précautionsPatients souffrant de cancer médullaire de la thyroïde
Des études menées chez des rongeurs avec des agonistes du récepteur du GLP-1 et le tirzépatide montrent un risque accru de tumeurs thyroïdiennes à cellules C (voir la rubrique « Données précliniques »). On ignore s'il y a une augmentation analogue du risque de tumeurs thyroïdiennes à cellules C, y compris du cancer médullaire thyroïdien (medullary thyroid carcinoma, MTC), chez l'être humain. Des patients souffrant de MTC ou de syndrome de néoplasie endocrinienne multiple de type 2 (NEM 2) n'ont pas été inclus dans des études cliniques avec le tirzépatide. On n'administrera donc le tirzépatide à ces patients qu'après évaluation approfondie du rapport bénéfice/risque d'un traitement.
Pancréatite aiguë
Le tirzépatide n'a pas été étudié chez des patients ayant des antécédents de pancréatite et il doit être utilisé avec prudence chez ces patients.
Des cas de pancréatite aiguë ont été rapportés chez des patients traités avec le tirzépatide.
Les patients doivent être informés des symptômes caractéristiques de la pancréatite aiguë. En cas de suspicion de pancréatite, le traitement de tirzépatide doit être interrompu. Si le diagnostic de pancréatite est confirmé, le tirzépatide sera arrêté définitivement. La seule élévation des enzymes pancréatiques en l'absence d'autres symptômes de pancréatite aiguë n'est pas prédictive d'une pancréatite aiguë.
Hypoglycémie
Les patients traités avec le tirzépatide en association avec une sulfonylurée ou l'insuline, peuvent présenter un risque augmenté d'hypoglycémie. La réduction de la dose de sulfonylurée ou d'insuline peut abaisser le risque d'hypoglycémie.
Effets gastro-intestinaux
L'utilisation du tirzépatide peut être associée à des effets secondaires gastro-intestinaux, notamment des nausées, des vomissements et des diarrhées. Ces événements peuvent provoquer une déshydratation, ce qui peut entraîner une détérioration de la fonction rénale, y compris une insuffisance rénale aiguë. Les patients qui sont traités avec le tirzépatide, en particulier ceux qui ont déjà une fonction rénale diminuée, doivent être informés de ce fait et prendre des mesures afin de prévenir une déshydratation.
Maladies gastro-intestinales sévères
Le tirzépatide n'a pas été étudié chez des patients souffrant de maladies gastro-intestinales sévères, dont la gastroparésie sévère, et il devra être utilisé avec prudence chez ces patients.
Rétinopathie diabétique
Le tirzépatide doit être utilisé avec prudence chez les patients souffrant de rétinopathie diabétique non proliférante nécessitant un traitement aigu et chez les patients souffrant de rétinopathie diabétique proliférante ou d'œdème maculaire diabétique et une surveillance appropriée doit être appliquée. En particulier chez les patients souffrant de rétinopathie diabétique, une chute trop forte et rapide de la glycémie peut provoquer initialement une détérioration de la rétinopathie.
Affections aiguës de la vésicule biliaire
Des résultats d'études cliniques et des données post-commercialisation relatives aux agonistes du récepteur du GLP-1 suggèrent un risque accru de maladies aiguës de la vésicule biliaire. Dans des études cliniques contrôlées versus placebo du programme de développement du tirzépatide, de tels événements (cholélithiase, colique biliaire et cholécystectomie) sont survenus chez 0.6% des patients traités avec le tirzépatide, alors qu'aucun cas (0%) n'a été rapporté dans le groupe témoin sous placebo. En cas de suspicion de cholélithiase, une investigation diagnostique approfondie et des contrôles de suivi appropriés sont recommandés.
Teneur en sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par unité de dose, c.-à-d. qu'il est essentiellement « sans sodium ».
InteractionsLe tirzépatide retarde la vidange gastrique mesurée sur la base de la pharmacocinétique du paracétamol et il a de ce fait des incidences potentielles sur l'absorption de médicaments associés administrés par voie orale. Il faut en tenir compte en particulier pour les médicaments administrés en concomitance avec le tirzépatide, dont l'efficacité dépend des concentrations seuils, et ceux dont la fenêtre thérapeutique est étroite (par exemple la warfarine, la digoxine).
Selon des modèles pharmacocinétiques basés sur la physiologie, on ne doit pas s'attendre à ce que le traitement de tirzépatide exerce une influence cliniquement significative sur des médicaments administrés par voie orale (par ex. warfarine, metformine, lisinopril, métoprolol, digoxine, paracétamol, norelgestromine, éthinylestradiol, sitagliptine et atorvastatine). Des ajustements de la dose de médicaments administrés par voie orale de façon concomitante ne sont pas nécessaires.
Paracétamol
Après l'administration d'une dose unique de tirzépatide (5 mg), la concentration maximale de paracétamol (Cmax) a été réduite de 50 % et la valeur moyenne du temps requis pour atteindre la concentration plasmatique la plus élevée (tmax) a été atteinte une heure plus tard. Après quatre semaines d'administration concomitante, il n'est pas apparu d'effets notables sur la Cmax et sur le tmax du paracétamol. L'exposition totale au paracétamol (AUC) n'a pas été influencée. Lors d'une administration concomitante avec le tirzépatide, aucun ajustement de la dose de paracétamol n'est nécessaire.
Contraceptifs oraux
L'administration de contraceptifs oraux combinés (0.035 mg d'éthinylestradiol plus 0.25 mg de norgestimate, un promédicament de la norelgestromine) en présence d'une dose unique de tirzépatide (5 mg) a entraîné une réduction de la Cmax et de l'aire sous la courbe de la concentration en fonction du temps (AUC) des contraceptifs oraux. La Cmax de l'éthinylestradiol a été réduite de 59 % et l'AUC de 20 % avec un retard du tmax de 4 heures. La Cmax de la norelgestromine a été réduite de 55 % et l'AUC de 23 %, avec un retard du tmax de 4.5 heures. La Cmax du norgestimate a été réduite de 66 % et l'AUC de 20 %, avec un retard du tmax de 2.5 heures.
L'utilisation du tirzépatide peut diminuer l'efficacité de contraceptifs hormonaux pris par voie orale. En cas de contraception avec des contraceptifs hormonaux pris par voie orale, il est conseillé de passer à une méthode contraceptive non orale ou d'utiliser en plus une méthode de barrière pendant 4 semaines au minimum après le début du traitement avec le tirzépatide ou après chaque augmentation de la dose.
Grossesse, allaitementGrossesse
Il n'y a pas de données ou il n'existe que des données limitées sur l'utilisation du tirzépatide chez la femme enceinte. Les études effectuées chez l'animal ont montré une toxicité sur la reproduction (voir « Données précliniques »). Le tirzépatide ne doit pas être utilisé pendant la grossesse. Il est recommandé aux femmes en âge de procréer de pratiquer la contraception pendant le traitement avec le tirzépatide. Le tirzépatide ne doit pas être utilisé pour la réduction du poids pendant la grossesse.
Allaitement
On ignore si le tirzépatide est excrété dans le lait maternel. Un risque pour le nourrisson ne peut pas être exclu.
Une décision doit être prise soit d'interrompre l'allaitement soit d'interrompre l'utilisation du tirzépatide, en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Fertilité
On ne connaît pas les effets du tirzépatide sur la fertilité humaine.
Les études chez l'animal avec le tirzépatide n'ont pas montré d'effets délétères directs sur la fertilité. Chez la rate, il y a eu des effets indirects sur la fertilité (voir « Données précliniques »).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude n'a été menée sur les effets sur l'aptitude à la conduite de véhicules et à l'utilisation de machines. Lorsque le tirzépatide est utilisé en association avec une sulfonylurée ou l'insuline, les patients doivent être informés des précautions à prendre pour prévenir une hypoglycémie lors de la conduite de véhicules ou de l'utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
Diabète de type 2
Dans 7 études de phase 3 terminées, 5 119 patients ont reçu le tirzépatide seul ou en association avec d'autres médicaments hypoglycémiants. Les effets secondaires les plus fréquemment rapportés dans des études cliniques ont été des troubles gastro-intestinaux, incluant des nausées, des diarrhées et des vomissements. En général, ces effets étaient principalement d'intensité légère à modérée et survenaient plus fréquemment pendant l'augmentation de la dose puis diminuaient au fil du temps.
Régulation chronique du poids
Dans deux études achevées de phase 3, 2 519 patients avaient reçu le tirzépatide seul ou en association avec d'autres médicaments hypoglycémiants. Les effets indésirables les plus fréquemment rapportés étaient des troubles gastro-intestinaux, notamment la nausée (très fréquent), la diarrhée (très fréquent), la constipation (très fréquent) et les vomissements (très fréquent). Ces réactions étaient généralement légères ou modérées, elles sont survenues plus fréquemment lors d'une augmentation de la dose et elles ont régressé au cours du temps.
Liste des effets indésirables
Dans les évaluations des études cliniques, les effets secondaires suivants ont été constatés et ils sont présentés selon la terminologie MedDRA par classe de système d'organes et par ordre décroissant de fréquence (très fréquents: ≥1/10; fréquents: de ≥1/100 à <1/10; occasionnels: de ≥1/1 000 à <1/100; rares: de ≥1/10 000 à <1/1 000; très rares: <1/10 000).
Affections du système immunitaire
Fréquents: Réactions d'hypersensibilité
Affections du système nerveux
Fréquents : Vertiged
Affections vasculaires
Fréquents : Hypotensiond
Affections gastro-intestinales
Très fréquents: nausée (18-28%), diarrhée (15-21%), constipationd (13.6%), vomissementsd (10.8%)
Fréquents: douleurs abdominales, vomissementsa, dyspepsie, constipationa, météorisme, éructations, flatulence, reflux gastro-œsophagien
Troubles du métabolisme et de la nutrition
Féquents: Baisse de l'appétita
Hypoglycémie chez des patients atteints de diabète de type 2b
Très fréquents:
Hypoglycémieb en cas d'utilisation concomitante avec une sulfonylurée ou l'insuline:
·avec une sufonylurée (10-14%).
·avec l'insuline basale (14-19%).
Fréquents:
Hypoglycémieb en cas d'utilisation avec la metformine et un iSGLT2c
Occasionnels:
Hypoglycémieb en cas d'utilisation avec la metformine
Affections de la peau et du tissu sous-cutané
Fréquents: Chute de cheveuxd
Troubles généraux et anomalies au site d'administration
Fréquents : fatigue, réactions au site d'injection.
a Uniquement dans l'indication de diabète de type 2
b Une hypoglycémie significative sur le plan clinique a été définie comme un glucose sanguin <3.0 mmol/l (<54 mg/dl) ou une hypoglycémie sévère (nécessitant l'aide d'une tierce personne)
c Inhibiteur du co-transporteur sodium-glucose
d Uniquement dans l'indication de régulation chronique du poids
Les effets indésirables suivants sont basés sur des annonces spontanées faites après la mise sur le marché du tirzépatide:
Rares: Réaction anaphylactique et angio-œdèmes
Description d'effets indésirables spécifiques et informations complémentaires
Réactions d'hypersensibilité
Dans les essais contrôlés versus placebo sur le diabète de type 2, des réactions d'hypersensibilité ont été rapportées avec le tirzépatide. Les réactions étaient parfois sévères (par exemple urticaire et eczéma). Des réactions d'hypersensibilité ont été rapportées chez 3.2 % des patients traités par tirzépatide et chez 1.7% des patients traités par placebo.
Des réactions d'hypersensibilité avec le tirzépatide ont été rapportées dans les essais contrôlés versus placebo sur la régulation chronique du poids. Les réactions étaient parfois sévères (p.ex. dermatite et éruption cutanée). Des réactions d'hypersensibilité ont été rapportées chez 5.1% des patients qui recevaient le tirzépatide par rapport à 3.1% des patients qui recevaient le placebo.
Hypoglycémie chez des patients atteints de diabète de type 2
Le risque d'une hypoglycémie sévère sous tirzépatde est faible. Dans les études cliniques, 10 (0.20%) patients ont rapporté 12 épisodes d'hypoglycémie sévère. Parmi ces 10 patients, 5 (0.10%) étaient sous insuline glargine ou une sulfonylurée comme traitement de fond et chacun a rapporté 1 épisode.
Une hypoglycémie cliniquement significative est survenue chez 10 à 14% (de 0.14 à 0.16 événement/année-patient) des patients, lorsque le tirzépatide était utilisé en plus d'une sulfonylurée, et chez 14 à 19% (de 0.43 à 0.64 événement/année-patient) des patients, lorsque le tirzépatide était utilisé en plus de l'insuline basale.
Le taux d'hypoglycémies significatives sous tirzépatide utilisé en monothérapie ou en combinaison avec d'autres antidiabétiques oraux s'est élevé jusqu'à une valeur de 0.03 événement/année-patient.
Effets secondaires gastro-intestinaux
Les événements gastro-intestinaux ont été généralement légers à modérés. L'incidence de nausées, de vomissements et de diarrhées était plus élevée pendant la période d'augmentation de la dose et a diminué au cours du temps.
Immunogénicité
L'incidence observée des anticorps anti-médicaments (ADAs) dépend fortement de la sensibilité et de la spécificité du test utilisé. Les différences dans les méthodes de test empêchent des comparaisons significatives de l'incidence des ADAs dans les études décrites ci-dessous avec celle observée dans d'autres études, y compris celles du tirzépatide ou des agonistes des récepteurs du glucagon-like peptide-1 (GLP-1).
Diabète de type 2
Dans sept études cliniques de phase 3, 2 570 (51.1%) patients traités avec le tirzépatide ont développé des anticorps anti-médicament (AAM). Dans ces études, les AAM formés ont présenté une réactivité croisée avec le polypeptide insulinotrope natif dépendant du glucose (GIP) ou le GLP-1 natif chez respectivement 34% et 14% des patients traités avec le tirzépatide.
Sur les 2 570 patients traités avec le tirzépatide, 1.9% et 2.1% avaient des anticorps neutralisants dirigés contre l'activité du tirzépatide respectivement sur le GIP et les récepteurs du GLP-1, et 0.9% et 0.4% présentaient des anticorps neutralisants respectivement contre le GIP et le GLP-1. Il n'a été constaté aucun signe d'altération du profil pharmacocinétique ni aucune influence sur l'efficacité d'emploi du tirzépatide liés au développement d'AAM.
Les patients traités par le tirzépatide ayant développé des anticorps anti-tirzépatide étaient plus susceptibles de présenter des réactions d'hypersensibilité ou des réactions au site d'injection que les patients qui n'ayant pas développé de tels anticorps.
Régulation chronique du poids
Tout au long de 2 études cliniques de phase 3, 64.5% des patients obèses ou en surpoids ont développé des ADAs. Parmi les patients obèses ou en surpoids traités avec le tirzépatide, 2.8% et 2.7% avaient des anticorps neutralisants dirigés contre l'activité du tirzépatide sur les récepteurs du GIP et du GLP-1, 0.8% et 0.1% avaient des anticorps neutralisants dirigés contre le GIP ou le GLP-1 natif.
L'annonce d'effets secondaires présumés après autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn cas de surdosage, un traitement de soutien approprié doit être mis en place en fonction des symptômes cliniques du patient. Compte tenu de la demi-vie du tirzépatide (environ 5 jours), l'observation et le traitement de ces symptômes peuvent prendre un certain temps.
Propriétés/EffetsCode ATC
A10BX16
Mécanisme d'action
Diabète de type 2 et régulation chronique du poids
Le tirzépatide est un agoniste des récepteurs du GIP et du GLP-1 à action prolongée. C'est un peptide composé de 39 acides aminés et d'une portion diacide gras de C20 qui permet la liaison à l'albumine et prolonge la demi-vie.
Le tirzépatide se lie avec une haute sélectivité aux récepteurs du GIP et du GLP-1- humains et il a une forte affinité pour les récepteurs du GIP et du GLP-1. L'activité du tirzépatide sur le récepteur du GIP est similaire à celle de l'hormone GIP native. L'activité du tirzépatide sur le récepteur du GLP-1 est inférieure à celle de l'hormone GLP-1 native.
Le tirzépatide améliore la sensibilité à l'insuline.
Le tirzépatide diminue l'ingestion de nourriture.
Diabète sucré
Le tirzépatide augmente la sensibilité au glucose des cellules β. Il améliore la première et la seconde phase de sécrétion de l'insuline et abaisse les concentrations plasmatiques de glucagon, ces deux effets s'exerçant en fonction de la concentration de glucose.
Le tirzépatide retarde la vidange gastrique, cet effet diminue avec le temps.
Régulation chronique du poids
Des récepteurs du GIP et du GLP-1 ont tous deux été trouvés dans des régions du cerveau importantes pour la régulation de l'appétit.
Le tirzépatide régule l'appétit et diminue l'ingestion de nourriture. Le tirzépatide diminue le poids corporel et la masse corporelle.
Des études menées chez l'animal montrent que le tirzépatide module la consommation d'énergie.
Pharmacodynamique
Contrôle glycémique
Le tirzépatide améliore le contrôle glycémique en abaissant la concentration de glucose mesurée à jeun et postprandiale chez des patients souffrant de diabète de type 2 par le biais de divers mécanismes.
Glycémie à jeun
Le traitement avec le tirzépatide a induit des baisses significatives de la glycémie à jeun par rapport à la valeur initiale (la différence entre la valeur initiale et la valeur finale a été de - 2.4 mmol/l à -3.8 mmol/l). À partir d'une période de deux semaines, des baisses significatives de la glycémie à jeun sont apparues par rapport à la valeur initiale. L'amélioration de la glycémie à jeun s'est maintenue pendant la durée la plus longue d'une étude de 104 semaines.
Glycémie postprandiale
Le traitement avec le tirzépatide a entraîné des baisses significatives de la glycémie postprandiale moyenne 2 heures après l'administration (moyenne des trois repas par jour), par rapport à la valeur initiale (la différence entre la valeur initiale et la valeur finale a été de -3.35 mmol/l à -4.85 mmol/l)
Sécrétion d'insuline
Dans une étude de clamp hyperglycémique menée chez des patients souffrant de diabète de type 2, la sécrétion d'insuline sous tirzépatide a été comparée à celle induite par un placebo et par le sémaglutide 1 mg, un agoniste sélectif du récepteur du GLP-1. Le tirzépatide 15 mg a amélioré le taux de la première et de la seconde phase de sécrétion d'insuline de 466 % et de 302 % par rapport à la valeur initiale. Sous placebo, le taux de la première et de la seconde phase de sécrétion d'insuline n'a pas changé et, sous sémaglutide, les taux ont augmenté respectivement de 298% et de 223 %.
Sensibilité à l'insuline
Le tirzépatide 15 mg a amélioré de 63 % la sensibilité à l'insuline du corps entier, évaluée par la valeur M, une mesure de l'absorption tissulaire du glucose à l'aide d'un clamp euglycémique hyperinsulinémique. La valeur M est restée inchangée sous placebo et, sous sémaglutide 1 mg, elle a augmenté de 35 %.
Le tirzépatide abaisse le poids corporel chez des patients obèses et en surpoids et chez des patients souffrant de diabète de type 2 (indépendamment du poids corporel), ce qui peut contribuer à l'amélioration de la sensibilité à l'insuline. La réduction de l'apport alimentaire avec le tirzépatide contribue à la perte de poids. La diminution du poids corporel est principalement due à une perte de masse graisseuse.
Concentration de glucagon
Le tirzépatide a réduit les concentrations de glucagon à jeun et postprandiales. Le tirzépatide 15 mg a réduit la concentration de glucagon à jeun de 28 % et l'AUC du glucagon de 43 % après un repas mixte, comparativement à une absence de variation pour le placebo et à une diminution de 22 % du glucagon à jeun et de 29 % de l'AUC sous sémaglutide 1 mg.
Vidange gastrique
Le tirzépatide retarde la vidange gastrique, ce qui peut ralentir l'absorption de glucose après un repas et avoir un effet bénéfique sur la glycémie postprandiale. Le tirzépatide ralentit l'absorption de glucose après un repas et réduit ainsi les concentrations prostprandiales de glucose. Le ralentissement est le plus important après la première utilisation et il diminue avec le temps. La réduction des concentrations postprandiales de glucose était nettement plus prononcée chez les sujets atteints de diabète de type 2 que chez les sujets obèses ou en surpoids sans diabète de type 2.
Enzymes pancréatiques
Diabète de type 2
Dans les études de phase 3 contrôlées avec un placebo, le traitement de tirzépatide a provoqué une élévation moyenne de l'amylase pancréatique de 33% à 38% et de la lipase de 31% à 42% par rapport à la valeur initiale. Les patients sous placebo ont présenté une élévation de l'amylase de 4% par rapport à la valeur initiale et aucun changement n'a été observé pour la lipase. À elle seule, une élévation des enzymes pancréatiques en l'absence d'autres symptômes d'une pancréatite aiguë n'est pas prédictive d'une pancréatite aiguë.
Régulation chronique du poids
Le traitement avec le tirzépatide a entraîné une élévation moyenne de l'amylase pancréatique de 20% à 25% et de la lipase de 28% à 35% par rapport à la valeur initiale.
Électrophysiologie cardiaque (intervalle QTc)
À un dosage allant jusqu'à 15 mg, le tirzépatide ne provoque pas d'allongement de l'intervalle QTc.
Efficacité clinique
Diabète de type 2
Contrôle glycémique et poids corporel
La sécurité d'emploi et l'efficacité du tirzépatide ont été évaluées dans cinq études globales, randomisées et contrôlées de phase 3 (SURPASS 1 - 5) qui ont inclus au total 6 263 patients souffrant de diabète de type 2, dont 4 199 ont été traités avec le tirzépatide. Le critère principal pour la démonstration de l'efficacité glycémique a été la variation (baisse) de la HbA1c. Les critères secondaires déterminants ont été la variation (baisse) du poids corporel et le glucose sérique à jeun (fasting serum glucose, FSG), ainsi que la proportion de patients ayant atteint la valeur cible de la HbA1c (taux de répondeurs). Toutes les études ont examiné le tirzépatide 5, 10 et 15 mg, en utilisant le schéma posologique suivant. La dose initiale était de 2.5 mg par semaine et elle pouvait être augmentée à chaque fois de 2.5 mg toutes les 4 semaines, jusqu'à l'obtention de la dose cible assignée (5, 10 ou 15 mg).
Dans toutes les études, le traitement avec le tirzépatide a provoqué une baisse de la HbA1c et du poids corporel supérieure à celle mesurée dans le bras témoin (placebo, sémaglutide, insuline dégludec ou insuline glargine), sur une période de traitement de 40 à 104 semaines. Les résultats des études individuelles sont décrits ci-dessous en détail sur la base d'une population en intention de traiter modifiée (modified Intent-to-Treat, mITT) (tous les patients randomisés qui ont reçu ≥1 dose du médicament à l'étude, à l'exclusion de ceux qui ont arrêté le traitement en raison d'une inclusion par erreur). Pour l'estimation de l'efficacité, un modèle mixte pour mesures répétées a été utilisé.
SURPASS 1 – Monothérapie
Dans une étude contrôlée versus placebo, en double aveugle d'une durée de 40 semaines, 478 patients (âge moyen au début de l'étude ~54 ans), présentant un contrôle glycémique inadéquat (HbA1c moyenne au début de l'étude ~7.94%) avec un régime alimentaire et de l'exercice physique, ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou un placebo. À l'inclusion, la durée moyenne du diabète des patients était d'environ 4.7 ans.
Tableau 1. SURPASS 1: Résultats à la semaine 40
|
|
Tirzépatide
5 mg
|
Tirzépatide
10 mg
|
Tirzépatide
15 mg
|
Placebo
| |
Population mITT (n)
|
121
|
121
|
120
|
113
| |
HbA1c (%)
|
À l'inclusion
(moyenne)
|
7.97
|
7.88
|
7.88
|
8.08
| |
Changement depuis l'inclusion
|
-1.87##
|
-1.89##
|
-2.07##
|
+0.04
| |
Différence par rapport au placebo
[IC à 95%]
|
-1.91**
[-2.18, -1.63]
|
-1.93**
[-2.21, -1.65]
|
-2.11**
[-2.39, -1.83]
|
-
| |
HbA1c (mmol/mol)
|
À l'inclusion
(moyenne)
|
63.6
|
62.6
|
62.6
|
64.8
| |
Changement depuis l'inclusion
|
-20.4##
|
-20.7##
|
-22.7##
|
+0.4
| |
Différence par rapport au placebo
[IC à 95%]
|
-20.8**
[-23.9, -17.8]
|
-21.1**
[-24.1, -18.0]
|
-23.1**
[-26.2, -20.0]
|
-
| |
Patients (%) atteignant la HbA1c cible
|
<7%
|
86.8**
|
91.5**
|
87.9**
|
19.6
| |
≤6.5%
|
81.8††
|
81.4††
|
86.2††
|
9.8
| |
<5.7%
|
33.9**
|
30.5**
|
51.7**
|
0.9
| |
Poids corporel (kg)
|
À l'inclusion
(moyenne)
|
87.0
|
85.7
|
85.9
|
84.4
| |
Changement depuis l'inclusion
|
-7.0##
|
-7.8##
|
-9.5##
|
-0.7
| |
Différence par rapport au placebo
[IC à 95%]
|
-6.3**
[-7.8, -4.7]
|
-7.1**
[-8.6, -5.5]
|
-8.8**
[-10.3, -7.2]
|
-
|
* p <0.05, ** p <0.001 pour la supériorité, ajusté pour tests multiples.
†p <0.05, †† p <0.001 par rapport au placebo, non ajusté pour tests multiples.
#p <0.05,## p <0.001 par rapport à l'inclusion, non ajusté pour tests multiples.
SURPASS 2 - Traitement en association avec la metformine
Dans une étude ouverte d'une durée de 40 semaines contrôlée versus comparateur actif (en double aveugle pour l'attribution de la dose de tirzépatide), 1 879 patients ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou du sémaglutide 1 mg une fois par semaine, tous en association avec la metformine. À l'inclusion, la durée moyenne du diabète des patients était de 9 ans.
Tableau 2. SURPASS 2: Résultats à la semaine 40
|
|
Tirzépatide
5 mg
|
Tirzépatide
10 mg
|
Tirzépatide
15 mg
|
Sémaglutide
1 mg
| |
Population mITT (n)
|
470
|
469
|
469
|
468
| |
HbA1c (%)
|
À l'inclusion
(moyenne)
|
8.33
|
8.31
|
8.25
|
8.24
| |
Changement depuis l'inclusion
|
-2.09##
|
-2.37##
|
-2.46##
|
-1.86##
| |
Différence par rapport au sémaglutide
[IC à 95%]
|
-0.23**
[-0.36, -0.10]
|
-0.51**
[-0.64, -0.38]
|
-0.60**
[-0.73, -0.47]
|
-
| |
HbA1c (mmol/mol)
|
À l'inclusion
(moyenne)
|
67.5
|
67.3
|
66.7
|
66.6
| |
Changement depuis l'inclusion
|
-22.8##
|
-25.9##
|
-26.9##
|
-20.3
| |
Différence par rapport au sémaglutide
[IC à 95%]
|
-2.5**
[-3.9, -1.1]
|
-5.6**
[-7.0 -4.1]
|
-6.6**
[-8.0 -5.1]
|
N/A
| |
Patients (%) atteignant une HbA1c cible
|
<7%
|
85.5*
|
88.9**
|
92.2**
|
81.1
| |
≤6.5%
|
74.0†
|
82.1††
|
87.1††
|
66.2
| |
<5.7%
|
29.3††
|
44.7**
|
50.9**
|
19.7
| |
Poids corporel (kg)
|
À l'inclusion
(moyenne)
|
92.6
|
94.9
|
93.9
|
93.8
| |
Changement depuis l'inclusion
|
-7.8##
|
-10.3##
|
-12.4##
|
-6.2##
| |
Différence par rapport au sémaglutide
[IC à 95%]
|
-1.7**
[-2.6, -0.7]
|
-4.1**
[-5.0, -3.2]
|
-6.2**
[-7.1, -5.3]
|
-
|
* p <0.05, ** p <0.001 pour la supériorité, ajusté pour tests multiples.
† p <0.05, †† p <0.001 par rapport au sémaglutide 1 mg, non ajusté pour tests multiples.
# p <0.05, ## p <0.001 par rapport à l'inclusion, non ajusté pour tests multiples.
SURPASS 3 – En association avec la metformine, avec ou sans iSGLT2
Dans une étude ouverte d'une durée de 52 semaines contrôlée versus comparateur actif, 1 444 patients ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou de l'insuline dégludec, tous en association avec la metformine avec ou sans iSGLT2. À l'inclusion, 32% des patients utilisaient un iSGLT2. Les patients traités avec l'insuline dégludec ont démarré à une dose de 10 U/jour qui a été ajustée par la suite selon un algorithme ciblant une glycémie à jeun <5 mmol/l. À l'inclusion, la durée moyenne du diabète des patients était de 8 ans.
Tableau 3. SURPASS 3: Résultats à la semaine 52
|
|
Tirzépatide
5 mg
|
Tirzépatide
10 mg
|
Tirzépatide
15 mg
|
Insuline dégludeca
titrée
| |
Population mITT (n)
|
358
|
360
|
358
|
359
| |
HbA1c (%)
|
À l'inclusion (moyenne)
|
8.17
|
8.19
|
8.21
|
8.13
| |
Changement depuis l'inclusion
|
-1.93##
|
-2.20##
|
-2.37##
|
-1.34##
| |
Différence par rapport à l'insuline dégludec
[IC à 95%]
|
-0.59**
[-0.73, -0.45]
|
-0.86**
[-1.00, -0.72]
|
-1.04**
[-1.17, -0.90]
|
-
| |
HbA1c (mmol/mol)
|
À l'inclusion (moyenne)
|
65.8
|
66.0
|
66.3
|
65.4
| |
Changement depuis l'inclusion
|
-21.1##
|
-24.0##
|
-26.0##
|
-14.6##
| |
Différence par rapport à l'insuline dégludec
[IC à 95%]
|
-6.4**
[-7.9, -4.9]
|
-9.4**
[-10.9, -7.9]
|
-11.3**
[-12.8, -9.8]
|
-
| |
Patients (%) atteignant la HbA1c cible
|
<7%
|
82.4**
|
89.7**
|
92.6**
|
61.3
| |
≤6.5%
|
71.4††
|
80.3††
|
85.3††
|
44.4
| |
< 5.7 %
|
25.8††
|
38.6††
|
48.4††
|
5.4
| |
Poids corporel (kg)
|
À l'inclusion (moyenne)
|
94.5
|
94.3
|
94.9
|
94.2
| |
Changement depuis l'inclusion
|
-7.5##
|
-10.7##
|
-12.9##
|
+2.3##
| |
Différence par rapport à l'insuline dégludec
[IC à 95%]
|
-9.8**
[-10.8, -8.8]
|
-13.0**
[-14.0, -11.9]
|
-15.2**
[-16.2, -14.2]
|
-
|
a La dose moyenne d'insuline dégludec à la semaine 52 était de 49 unités/jour.
* p <0.05, ** p <0.001 pour la supériorité, ajusté pour tests multiples.
† p <0.05, †† p <0.001 par rapport à l'insuline dégludec, non ajusté pour tests multiples.
# p <0.05, ## p <0.001 par rapport à l'inclusion, non ajusté pour tests multiples.
Surveillance continue du glucose (CGM)
Un sous-groupe de patients (N = 243) a participé à une mesure des profils du glucose sur 24 heures enregistrés en aveugle pour la CGM. À la semaine 52, les patients sous tirzépatide (évaluation combinée de 10 mg et 15 mg) ont passé significativement plus de temps dans la zone euglycémique, définie par des valeurs de glucose entre 71 et 140 mg/dl (de 3.9 à 7.8 mmol/l), par rapport aux patients sous insuline dégludec, avec 73% versus 48% de la période de 24 heures dans la zone euglycémique.
Au bout de 52 semaines, les patients sous les trois dosages de tirzépatide passaient une plus grande partie de la période de 24 heures avec une glycémie dans la zone de 71 à 180 mg/dl (de 3.9 à 10.0 mmol/l) par rapport aux patients sous insuline dégludec: tirzépatide (zone): de 84.9% à 91.2%; insuline dégludec, 75.0%.
Teneur en graisse du foie (liver fat content, LFC) et tissu adipeux
Un sous-groupe de patients (N = 296) a participé à une estimation de la LFC, du tissu adipeux viscéral (visceral adipose tissue, VAT) et du tissu adipeux abdominal sous-cutané (abdominal subcutaneous adipose tissue, ASAT), évalués par tomographie de résonance magnétique. À la semaine 52, les patients sous tirzépatide (évaluation combinée de 10 mg et 15 mg) ont présenté une réduction moyenne statistiquement significativement plus grande de la LFC par rapport aux patients sous insuline dégludec, -8.09% versus -3.38%, à partir de valeurs à l'inclusion de 15.67% et 16.58%. Les patients sous tirzépatide 5 mg, 10 mg et 15 mg ont présenté une réduction significativement plus grande du volume de VAT (respectivement -1.10, -1.53 et -1.65 l) et d'ASAT (respectivement -1.40, -2.25 et -2.05 l) par rapport à des valeurs totales respectives à l'inclusion de 6.6 l et 10.4 l, à chaque fois au bout de 52 semaines, en comparaison avec une augmentation sous insuline dégludec (0.38 et 0.63 l).
SURPASS 4 – En association avec 1-3 antidiabétiques oraux (metformine, sulfonylurées ou iSGLT2)
Dans une étude ouverte contrôlée versus comparateur actif allant jusqu'à 104 semaines (critère principal d'évaluation à 52 semaines), 2 002 patients souffrant de diabète de type 2 et avec un risque cardiovasculaire augmenté ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou de l'insuline glargine une fois par jour en complément de leur traitement par la metformine (95%) et/ou des sulfonyurées (54%) et/ou un iSGLT2 (25%). Les patients traités par l'insuline glargine ont démarré à une dose de 10 U/jour qui a été ajustée par la suite selon un algorithme ciblant une glycémie à jeun <5.6 mmol/l. À l'inclusion, la durée moyenne du diabète des patients était de 12 ans.
Tableau 4. SURPASS 4: Résultats à la semaine 52
|
|
Tirzépatide
5 mg
|
Tirzépatide
10 mg
|
Tirzépatide
15 mg
|
Insuline glarginea
titrée
| |
Population mITT (n)
|
328
|
326
|
337
|
998
| |
52 semaines
| |
HbA1c (%)
|
À l'inclusion (moyenne)
|
8.52
|
8.60
|
8.52
|
8.51
| |
Changement depuis l'inclusion
|
-2.24##
|
-2.43##
|
-2.58##
|
-1.44##
| |
Différence par rapport à l'insuline glargine [IC à 95%]
|
-0.80**
[-0.92, -0.68]
|
-0.99**
[-1.11, -0.87]
|
-1.14**
[-1.26, -1.02]
|
-
| |
HbA1c (mmol/mol)
|
À l'inclusion (moyenne)
|
69.6
|
70.5
|
69.6
|
69.5
| |
Changement depuis l'inclusion
|
-24.5##
|
-26.6##
|
-28.2##
|
-15.7##
| |
Différence par rapport à l'insuline glargine [IC à 95 %]
|
-8.8**
[-10.1, -7.4]
|
-10.9**
[-12.3, -9.6]
|
-12.5**
[-13.8, -11.2]
|
-
| |
Patients (%) atteignant la HbA1c cible
|
<7%
|
81.0**
|
88.2**
|
90.7**
|
50.7
| |
≤6.5%
|
66.0††
|
76.0††
|
81.1††
|
31.7
| |
< 5.7 %
|
23.0††
|
32.7††
|
43.1††
|
3.4
| |
Poids corporel (kg)
|
À l'inclusion (moyenne)
|
90.3
|
90.7
|
90.0
|
90.3
| |
Changement depuis l'inclusion
|
-7.1##
|
-9.5##
|
-11.7##
|
+1.9##
| |
Différence par rapport à l'insuline glargine [IC à 95%]
|
-9.0**
[-9.8, -8.3]
|
-11.4**
[-12.1, -10.6]
|
-13.5**
[-14.3, -12.8]
|
-
|
a La dose moyenne d'insuline glargine à la semaine 52 était de 44 unités/jour.
* p <0.05, ** p <0.001 pour la supériorité, ajusté pour tests multiples.
† p <0.05, †† p <0.001 par rapport à l'insuline glargine, non ajusté pour tests multiples.
# p <0.05, ## p <0.001 par rapport à l'inclusion, non ajusté pour tests multiples.
SURPASS 5 – En association avec de l'insuline basale, avec ou sans metformine
Dans une étude contrôlée versus placebo, en double aveugle, d'une durée de 40 semaines, 475 patients présentant un contrôle glycémique insuffisant sous insuline glargine avec ou sans metformine, ont été randomisés pour recevoir du tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou un placebo. La dose d'insuline glargine a été ajustée selon un algorithme ciblant une glycémie à jeun <5.6 mmol/l. Chez les patients qui avaient une valeur de HbA1c de ≤8.0%, la dose d'insuline glargine a été réduite de 20% au cours de la première semaine (jusqu'à l'administration de la deuxième dose de tirzépatide). Chez les patients qui avaient une valeur de HbA1c initiales de >8.0%, la dose d'insuline glargine n'a pas été réduite. À l'inclusion, la durée moyenne du diabète des patients était de 13 ans.
Tableau 5. SURPASS 5: Résultats à la semaine 40
|
|
Tirzépatide
5 mg
|
Tirzépatide
10 mg
|
Tirzépatide
15 mg
|
Placeboa
| |
Population mITT (n)
|
116
|
118
|
118
|
119
| |
HbA1c (%)
|
À l'inclusion
(moyenne)
|
8.29
|
8.34
|
8.22
|
8.39
| |
Changement depuis l'inclusion
|
-2.23##
|
-2.59##
|
-2.59##
|
-0.93##
| |
Différence par rapport au placebo [IC à 95%]
|
-1.30**
[-1.52, -1.07]
|
-1.66**
[-1.88, -1.43]
|
-1.65**
[-1.88, -1.43]
|
-
| |
HbA1c (mmol/mol)
|
À l'inclusion
(moyenne)
|
67.1
|
67.7
|
66.4
|
68.2
| |
Changement depuis l'inclusion
|
-24.4##
|
-28.3##
|
-28.3##
|
-10.2##
| |
Différence par rapport au placebo [IC à 95 %]
|
-14.2**
[-16.6, -11.7]
|
-18.1**
[-20.6, -15.7]
|
-18.1**
[-20.5, -15.6]
|
-
| |
Patients (%) atteignant la HbA1c cible
|
<7%
|
93.0**
|
97.4**
|
94.0**
|
33.9
| |
≤6.5%
|
80.0††
|
94.7††
|
92.3††
|
17.0
| |
<5.7%
|
26.1††
|
47.8††
|
62.4††
|
2.5
| |
Poids corporel (kg)
|
À l'inclusion
(moyenne)
|
95.5
|
95.4
|
96.2
|
94.1
| |
Changement depuis l'inclusion
|
-6.2##
|
-8.2##
|
-10.9##
|
+1.7#
| |
Différence par rapport au placebo [IC à 95%]
|
-7.8**
[-9.4, -6.3]
|
-9.9**
[-11.5, -8.3]
|
-12.6**
[-14.2, -11.0]
|
-
|
a La dose médiane générale d'insuline glargine à l'inclusion était de 34 unités/jour. La dose médiane d'insuline glargine à la semaine 40 était respectivement de 38, 36, 29 et 59 unités/jour sous tirzépatide 5 mg, 10 mg, 15 mg et placebo.
* p <0.05, ** p <0.001 pour la supériorité, ajusté pour tests multiples.
† p <0.05, †† p <0.001 par rapport au placebo, non ajusté pour tests multiples.
# p <0.05, ## p <0.001 par rapport à l'inclusion, non ajusté pour tests multiples.
Régulation chronique du poids
La sécurité d'emploi et l'efficacité du tirzépatide pour la régulation chronique du poids (diminution et maintien du poids) en complément d'un régime hypocalorique et d'une augmentation de l'activité physique ont été examinées dans deux études de phase 3 randomisées, en double aveugle, contrôlées versus placebo, menées chez des patients sans diabète de type 2 (SURMOUNT-1) et avec un diabète de type 2 (SURMOUNT-2).
SURMOUNT-1
Dans une étude en double aveugle contrôlée versus placebo sur 72 semaines, 2 539 patients adultes (67.5% de femmes) obèses (IMC ≥30 kg/m2) ou en surpoids (IMC ≥27 kg/m2 à <30 kg/m2) et avec au moins une maladie associée due à l'obésité telle qu'une dyslipidémie traitée ou non traitée, une hypertension, des apnées obstructives du sommeil ou une maladie cardiovasculaire, ont été randomisés pour recevoir le tirzépatide 5 mg, 10 mg ou 15 mg une fois par semaine ou un placebo. Les patients atteints de diabète de type 2 manifeste étaient exclus. Cependant, 40.6 % des participants à l'étude souffraient de prédiabète. L'âge moyen des patients était de 45 ans. Le poids corporel moyen au début de l'étude était de 104.8 kg et l'IMC moyen de 38 kg/m2.
Dans l'étude SURMOUNT-1, le dosage du tirzépatide ou du placebo correspondant (matching) a été augmenté à 5 mg, 10 mg ou 15 mg sous-cutanés une fois par semaine sur 20 semaines, avec phase d'entretien subséquente.
La baisse du poids sous tirzépatide a commencé rapidement et s'est poursuivie sur toute l'étude. À la fin du traitement (semaine 72), la baisse de poids sous tirzépatide était supérieure et cliniquement significative par rapport au placebo (voir Tableau 7 et Figure 6). À la semaine 72, 89%, 96% et 96% des patients qui recevaient 5 mg, 10 mg et 15 mg de tirzépatide avaient atteint une baisse de poids de ≥5%, par rapport à 28% des patients sous placebo (p <0.001 pour toutes les comparaisons avec le placebo). Dans les groupes du tirzépatide, les patients qui ont présenté une baisse de poids de ≥10%, ≥15% et ≥20% par rapport à la valeur initiale étaient plus nombreux que dans le groupe du placebo (p <0.001).
Tabelle 7. SURMOUNT-1: Résultats à la semaine 72
|
|
Tirzépatide
5 mg
|
Tirzépatide
10 mg
|
Tirzépatide
15 mg
|
Placebo
| |
Population mITT (n)
|
630
|
636
|
630
|
643
| |
Poids corporel
| |
Valeur initiale (kg)
|
102.9
|
105.9
|
105.5
|
104.8
| |
Variation (%) vs valeur initiale
|
-16.0††
|
-21.4††
|
-22.5††
|
-2.4
| |
Différence (%) vs placebo
[IC à 95%]
|
-13.5**
[-14.6, -12.5]
|
-18.9**
[-20.0, -17.8
|
-20.1**
[-21.2, -19.0]
|
-
| |
Différence vs (kg) valeur initiale
|
-16.1††
|
-22.2††
|
-23.6††
|
-2.4††
| |
Difflrence (kg) vs placebo
[IC à 95%]
|
-13.8##
[-15.0, -12.6]
|
-19.8##
[-21.0, -18.6]
|
-21.2##
[-22.4, -20.0]
|
-
| |
Patients (%) ayant obtenu une baisse de poids
| |
≥5%
|
89.4**
|
96.2**
|
96.3**
|
27.9
| |
≥10%
|
73.4##
|
85.9**
|
90.1**
|
13.5
| |
≥15%
|
50.2##
|
73.6**
|
78.2**
|
6.0
| |
≥20%
|
31.6##
|
55.5**
|
62.9**
|
1.3
| |
Tour de taille (cm)
| |
Valeur initiale
|
113.2
|
114.9
|
114.4
|
114.0
| |
Variation vs valeur initiale
|
-14.6††
|
-19.4††
|
-19.9††
|
-3.4††
| |
Différence vs placebo
[IC à 95%]
|
-11.2##
[-12.3, -10.0]
|
-16.0**
[-17.2, -14.9]
|
-16.5**
[-17.7, -15.4]
|
-
|
##p <0.001 versus placebo, sans ajustement pour la multiplicité.
**p <0.001 versus placebo, avec ajustement pour la multiplicité.
††p <0.001 versus valeur initiale.
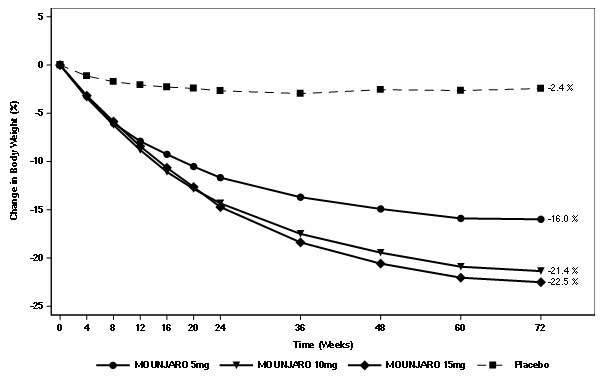
Figure 6. Variation moyenne du poids corporel (%) par rapport à la valeur initiale jusqu'à la semaine 72
Dans le sous-groupe avec un prédiabète au début de l'étude (N=1 032), un retour à la normoglycémie jusqu'à la semaine 72 été observé chez 95.3% des patients traités avec le tirzépatide, contre 61.9% des patients sous traitement placebo.
SURMOUNT-2
Dans une étude en double aveugle, contrôlée versus placebo sur 72 semaines, 938 patients adultes avec un IMC de ≥27 kg/m2 et un diabète de type 2 ont été randomisés pour recevoir le tirzépatide 10 mg ou 15 mg une fois par semaine ou un placebo. L'âge moyen des patients était de 54 ans et 50.7% étaient des femmes. Le poids corporel moyen au début de l'étude était de 100.7 kg et l'IMC moyen de 36.1 kg/m2.
Le dosage du tirzépatide ou du placebo correspondant (matching) a été augmenté à 10 mg ou 15 mg sous-cutanés une fois par semaine sur 20 semaines, avec phase d'entretien subséquente.
La baisse du poids sous tirzépatide a commencé rapidement et s'est poursuivie sur toute l'étude. À la fin du traitement (semaine 72), la baisse de poids était supérieure et cliniquement significative par rapport au placebo (voir Tableau 8 et Figure 7). À la semaine 72, 81.6% et 86.4% des patients qui recevaient 10 mg et 15 mg de tirzépatide avaient atteint une baisse de poids de ≥5%, par rapport à 30.6% des patients sous placebo (P <0.001 pour toutes les comparaisons avec le placebo). Dans les groupes du tirzépatide, les patients qui ont présenté une baisse de poids de ≥10%, ≥15% et ≥20% par rapport à la valeur initiale étaient plus nombreux que dans le groupe du placebo (p <0.001).
Tableau 8. SURMOUNT-2: Résultats à la semaine 72
|
|
Tirzépatide
10 mg
|
Tirzépatide
15 mg
|
Placebo
| |
Population mITT (n)
|
312
|
311
|
315
| |
Poids corporel
| |
Valeur initiale (kg)
|
101.1
|
99.5
|
101.7
| |
Variation (%) vs valeur initiale
|
-13.4††
|
-15.7††
|
-3.3††
| |
Différence (%) vs placebo
[IC à 95%]
|
-10.1**
[-11.5, -8.8]
|
-12.4**
[-13.7, -11.0]
|
-
| |
Différence vs (kg) valeur initiale
|
-13.5††
|
-15.6††
|
-3.2††
| |
Différence (kg) vs placebo
[IC à 95%]
|
-10.3**
[-11.7, -8.8]
|
-12.4**
[-13.8, -11.0]
|
-
| |
Patients (%) ayant obtenu une baisse de poids
| |
≥5%
|
81.6**
|
86.4**
|
30.6
| |
≥10%
|
63.4**
|
69.6**
|
8.7
| |
≥15%
|
41.4**
|
51.8**
|
2.6
| |
≥20%
|
23.0**
|
34.0**
|
1.0
| |
Tour de taille (cm)
| |
Valeur initiale
|
114.3
|
114.6
|
116.1
| |
Variation vs valeur initiale ab
|
-11.2††
|
-13.8††
|
-3.4††
| |
Différence vs placebo
[IC à 95%]
|
-7.8**
[-9.2, -6.4]
|
-10.4**
[-11.8, -8.9]
|
-
|
##p <0.001 versus placebo, sans ajustement pour la multiplicité.
**p <0.001 versus placebo, avec ajustement pour la multiplicité.
††p <0.001 versus valeur initiale.
Pendant l'étude, 9.3% et 13.8% des patients randomisés pour recevoir le tirzépatide 10 mg et 15 mg ont arrêté le traitement, par rapport à 14.9% des patients sous placebo.
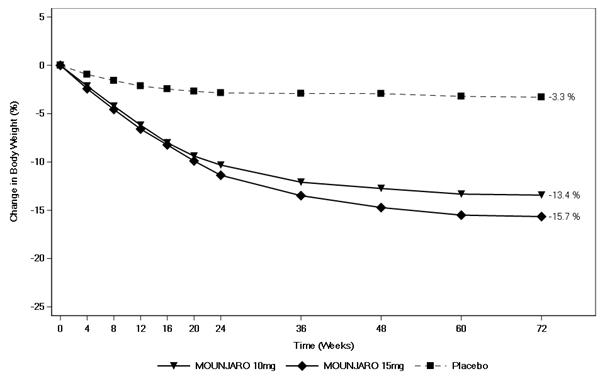
Figure 7. Variation moyenne du poids corporel (%) par rapport à la valeur initiale jusqu'à la semaine 72
Autres informations
Variation de la composition corporelle
Les variations de la composition corporelle ont été examinées dans une étude sur SURMOUNT-1 par absorption biphotonique à rayons X (DEXA). Les examens de l'étude par DEXA ont montré que le traitement par le tirzépatide était associé à une plus importante réduction de la masse graisseuse que de la Lean-Body-Mass, ce qui a entraîné une amélioration de la composition du corps par rapport au placebo à la semaine 72. En outre, cette réduction de la masse graisseuse totale s'accompagnait d'une réduction de la graisse viscérale. Ces résultats permettent de supposer que la majeure partie de la baisse de poids était globalement imputable à une réduction du tissu graisseux, y compris de la graisse viscérale.
Évaluation cardiovasculaire
Diabète de type 2
Le risque cardiovasculaire a été évalué dans une méta-analyse des études de phases 2 et 3. Le critère composite (major adverse cardiac event, MACE-4) comprenait le décès dû à des causes cardiovasculaires, l'infarctus du myocarde non fatal, l'accident vasculaire cérébral non fatal ou l'hospitalisation pour angor instable. Tous les événements survenus ont été soumis à un comité d'adjudication composé de spécialistes en cardiologie.
Dans une méta-analyse primaire, 116 patients au total (tirzépatide: 60 [n = 4 410]; tous comparateurs confondus: 56 [n = 2 169]) ont présenté au moins un MACE-4 confirmé par adjudication: les résultats ont montré que le tirzépatide n'était pas associé à un risque accru d'événements cardiovasculaires par rapport aux comparateurs regroupés (HR: 0.81; IC: 0.52 à1.26).
Une analyse supplémentaire a été menée spécifiquement pour l'étude SURPASS-4, qui a inclus des patients présentant une maladie CV établie. Au total, 109 patients (tirzépatide: 47 [n = 995]; insuline glargine: 62 [n = 1 000]) ont présenté au moins un MACE-4 confirmé par adjudication: les résultats ont montré que le tirzépatide n'était pas associé à un risque accru d'événements CV par rapport à l'insuline glargine (HR: 0.74; IC: 0.51 à1.08).
Régulation chronique du poids
Pour l'étude SURMOUNT-1, l'évaluation a porté sur un total de 14 patients (tirzépatide: 9 (0.47%) sur 1 896; placebo: 5 (0.78%) sur 643), chez lesquels au moins un MACE confirmé par adjudication était survenu. Les pourcentages de patients avec un MACE confirmé par adjudication étaient similaires sous placebo et tirzépatide.
L'étude SURMOUNT-2 a été évaluée. Chez 11 patients au total (tirzépatide: 7 (1.12%) sur 623; placebo: 4 (1.27%) sur 315), au moins un MACE confirmé par adjudication était survenu. Les pourcentages de patients avec un MACE confirmé par adjudication étaient similaires sous placebo et tirzépatide.
Pression artérielle
Diabète de type 2
Dans les études de phase 3 contrôlées versus placebo, le traitement avec le tirzépatide a entraîné une diminution moyenne de la pression artérielle systolique et diastolique de 6 à 9 mmHg et de 3 à 4 mmHg, respectivement. Les patients sous placebo ont présenté une diminution moyenne de la pression artérielle systolique et diastolique de 2 mmHg.
Régulation chronique du poids
Le traitement avec le tirzépatide a entraîné une baisse moyenne de la pression systolique et diastolique repectivement de 7 à 8 mmHg et de 4 à 5 mmHg. Chez les patients sous placebo, la pression systolique et diastolique a baissé respectivement en moyenne de 1 mmHg.
Fréquence cardiaque
Diabète de type 2
Dans les études de phase 3 contrôlées versus placebo, le traitement avec le tirzépatide a entraîné une élévation moyenne de la fréquence cardiaque de 2 à 4 battements par minute. Les patients sous placebo ont présenté une élévation moyenne de la fréquence cardiaque de 1 battement par minute.
Régulation chronique du poids
Le traitement avec le tirzépatide a entraîné une augmentation moyenne de la fréquence cardiaque de 1 à 3 battements par minute. Les patients sous placebo ont présenté une augmentation moyenne de la fréquence cardiaque de 0 battement par minute.
Populations spéciales
L'efficacité du tirzépatide pour le traitement du diabète de type 2 n'a pas été affectée par l'âge, le sexe, la race, l'origine ethnique, la région ni par l'IMC à l'inclusion, l'HbA1c, la durée du diabète et le niveau d'altération de la fonction hépatique ou rénale.
L'efficacité du tirzépatide pour la régulation chronique du poids n'a pas été affectée par l'âge, le sexe, la race, l'origine ethnique, la région, l'IMC à l'inclusion, ou la présence ou l'absence d'un prédiabète.
PharmacocinétiqueAbsorption
La concentration maximale de tirzépatide est atteinte 8 à 72 heures après administration. L'exposition à l'état d'équilibre est atteinte après 4 semaines en administration hebdomadaire. L'exposition au tirzépatide augmente de manière proportionnelle à la dose.
Une exposition similaire a été obtenue avec une administration sous-cutanée de tirzépatide dans l'abdomen, la cuisse ou le haut du bras.
La biodisponibilité absolue du tirzépatide administré par voie sous-cutanée est de 80 %.
Distribution
Le volume de distribution apparent moyen à l'état d'équilibre du tirzépatide après administration sous-cutanée chez des patients souffrant de diabète de type 2 est d'environ 10.3 l.
Le tirzépatide est fortement lié à l'albumine plasmatique (99 %).
Métabolisme
Le tirzépatide est métabolisé par clivage protéolytique de la chaîne peptidique, bêtaoxydation du fragment diacide gras en C20 et hydrolyse des amides.
Élimination
La clairance apparente moyenne du tirzépatide dans la population est de 0.06 l/h avec une demi-vie d'élimination d'environ 5 jours, ce qui permet de l'administrer une fois par semaine.
Le tirzépatide est éliminé par métabolisme. Les principales voies d'élimination des métabolites du tirzépatide sont l'urine et les selles. Le tirzépatide intact n'a été détecté ni dans les urines ni dans les selles.
Cinétique pour certains groupes de patients
Âge, sexe, race, origine ethnique
L'âge, le sexe, la race ou l'origine ethnique n'ont aucune influence cliniquement pertinente sur la pharmacocinétique (PC) du tirzépatide. Cette évaluation repose sur une analyse pharmacocinétique de population.
Diabète de type 2
La pharmacocinétique du tirzépatide est similaire chez les sujets atteints de diabète de type 2 et chez les sujets obèses ou en surpoids qui n'ont pas de diabète de type 2
Troubles de la fonction hépatique
Un trouble de la fonction hépatique n'a pas d'influence sur la PC du tirzépatide. La PC du tirzépatide a été évaluée après administration d'une dose unique de 5 mg chez des patients présentant divers degrés d'insuffisance hépatique (légère, modérée, sévère) en comparaison avec des sujets ayant une fonction hépatique normale.
Troubles de la fonction rénale
Un trouble de la fonction rénale n'a pas d'influence sur la PC du tirzépatide. La PC du tirzépatide après administration d'une dose unique de 5 mg a été évaluée chez des patients présentant divers degrés d'insuffisance rénale (légère, modérée, sévère, ESRD) en comparaison avec des sujets ayant une fonction rénale normale. Cela a également été montré pour des patients présentant à la fois un diabète de type 2 et un trouble de la fonction rénale d'après les données d'études cliniques. Cette évaluation repose sur une analyse pharmacocinétique de population.
Patients âgés
L'âge n'a eu aucun effet cliniquement significatif sur les propriétés pharmacocinétiques et pharmacodynamiques du tirzépatide.
Enfants et adolescents
Le tirzépatide n'a pas été étudié chez les patients pédiatriques.
Poids corporel
Des analyses pharmacocinétiques ont décrit une relation inverse entre le poids corporel et l'exposition au tirzépatide, bien qu'il n'y ait pas eu d'effet cliniquement significative du poids sur le contrôle glycémique.
Données précliniquesSur la base des études conventionnelles de pharmacologie de sécurité, de toxicité en cas d'administration répétée ou de génotoxicité, les données non cliniques ne permettent pas d'identifier des dangers particuliers pour l'être humain.
Carcinogénicité
Dans le cadre d'une étude de cancérogénicité menée sur 2 ans, des rats mâles et femelles ont reçu du tirzépatide à des dosages de 0.15, 0.50 et 1.5 mg/kg (soit 0.12, 0.36 et 1.02 fois la dose maximale recommandée chez l'être humain (MRHD) sur la base de l'AUC), administrés deux fois par semaine par injection sous-cutanée. Le tirzépatide a provoqué une augmentation des tumeurs à cellules C de la glande thyroïde (adénomes et carcinomes) à toutes les doses par rapport aux témoins. La signification de ces résultats pour l'être humain est inconnue.
Dans une étude de carcinogénicité de 6 mois chez des souris transgéniques rasH2, le tirzépatide à des doses de 1, 3 et 10 mg/kg (soit 1.2, 3.4 et 10.6 fois la dose maximale hebdomadaire recommandée chez l'être humain (MRHD) sur la base de l'AUC) administrées par injection sous-cutanée deux fois par semaine, n'a entraîné aucune augmentation de l'incidence des néoplasies, quelle que soit la dose administrée.
Toxicité sur la reproduction
Les études chez l'animal avec le tirzépatide n'ont pas mis en évidence d'effets délétères directs sur la fertilité.
Dans des études sur la fertilité et le développement embryonnaire précoce, des rats mâles et femelles ont reçu des doses de 0.5, 1.5 et 3 mg/kg (soit 0.3, 1 et 2 fois la dose hebdomadaire maximale de 15 mg recommandée chez l'être humain (MRHD) sur la base de l'AUC), administrées deux fois par semaine par injection sous-cutanée. Aucun effet du tirzépatide sur la morphologie des spermatozoïdes, le comportement d'accouplement, la fertilité et la conception n'a été constaté. Chez les rates femelles, une augmentation du nombre d'animaux femelles présentant un allongement du diœstrus ou une diminution du nombre moyen de corps jaunes a été constaté, ce qui a entraîné une réduction du nombre moyen de sites d'implantation et d'embryons viables. Ces effets ont été considérés comme étant secondaires aux effets pharmacologiques du tirzépatide sur la prise de nourriture et le poids corporel.
Dans les études de reproduction, une augmentation de l'incidence des malformations externes, viscérales et squelettiques, ainsi que des variations du développement viscéral et squelettique ont été observées chez les rats. Des réductions de la croissance fœtale ont été observées chez les rats et les lapins. Tous les effets sur le développement se sont produits à des doses toxiques pour la mère. L'exposition des animaux était inférieure à la MRHD sur la base de l'AUC. Dans des études menées chez de jeunes animaux, tout comme dans les études chez des rats adultes, les effets du tirzépatide sur la croissance et le développement des jeunes animaux se limitaient à l'effet pharmacologique sur le poids corporel et la prise alimentaire. Chez des animaux de sexe masculin et féminin, des retards de la séparation balano-préputiale et de l'ouverture vaginale ont été observés, qui ont été imputés aux effets du tirzépatide sur le poids corporel et non pas considérés comme une réaction directe au tirzépatide.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2ºC - 8ºC).
Ne pas congeler.
Conserver dans l'emballage d'origine à l'abri de la lumière.
Stockage temporaire
Mounjaro peut être conservé en dehors du réfrigérateur jusqu'à 21 jours à une température ne dépassant pas 30°C.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Stylo pré-rempli:
Le stylo pré-rempli est à usage unique.
Suivre attentivement les instructions d'utilisation du stylo pré-rempli jointes à l'emballage.
Mounjaro doit être contrôlé visuellement avant l'emploi et éliminé en cas de présence de particules ou de colorations.
S'il a été congelé, Mounjaro ne doit plus être utilisé.
Flacon perforable:
Le flacon perforable est à usage unique.
Les instructions pour l'injection de Mounjaro prélevé d'un flacon perforable sont décrites dans la notice d'emballage et elles doivent être soigneusement suivies.
Mounjaro doit être contrôlé visuellement avant l'emploi et éliminé en cas de présence de particules ou de colorations.
S'il a été congelé, Mounjaro ne doit plus être utilisé.
Numéro d’autorisation68726, 69415 (Swissmedic)
PrésentationMounjaro 2,5 mg solution injectable en stylo pré-rempli à usage unique: 4 stylos (B)
Mounjaro 5 mg solution injectable en stylo pré-rempli à usage unique: 4 stylos (B)
Mounjaro 7.5 mg solution injectable en stylo pré-rempli à usage unique: 4 stylos (B)
Mounjaro 10 mg solution injectable en stylo pré-rempli à usage unique: 4 stylos (B)
Mounjaro 12.5 mg solution injectable en stylo pré-rempli à usage unique: 4 stylos (B)
Mounjaro 15 mg solution injectable en stylo pré-rempli à usage unique: 4 stylos (B)
Mounjaro 2.5 mg solution injectable en flacon perforable à usage unique: 1 flacon et 4 flacons (B)
Mounjaro 5 mg solution injectable en flacon perforable à usage unique: 1 flacon et 4 flacons (B)
Mounjaro 7.5 solution injectable en flacon perforable à usage unique: 1 flacon et 4 flacons (B)
Mounjaro 10 mg solution injectable en flacon perforable à usage unique: 1 flacon et 4 flacons (B)
Mounjaro 12.5 mg solution injectable en flacon perforable à usage unique: 1 flacon et 4 flacons (B)
Mounjaro 15 mg solution injectable en flacon perforable à usage unique: 1 flacon et 4 flacons (B)
Titulaire de l’autorisationEli Lilly (Suisse) S.A. Vernier/Genève
Mise à jour de l’informationAvril 2024
|


