CompositionPrincipes actifs
Lidocaini hydrochloridum anhydricum (ut Lidocaini hydrochloridum monohydricum)
Excipients
Natrii chloridum, Natrii hydroxidum, Acidum hydrochloridum concentratum, Aqua ad iniectabile.
Lidocaine Aguettant 10 mg/ml contient 3,2 mg de sodium par ml (32 mg de sodium par seringue préremplie à 10 ml).
Lidocaine Aguettant 20 mg/ml contient 2,3 mg de sodium par ml (23 mg de sodium par seringue préremplie à 10 ml)
Indications/Possibilités d’emploiLidocaine Aguettant est indiqué dans l'anesthésie par infiltration et l'anesthésie par blocs nerveux périphériques.
Lidocaine Aguettant 10 mg/ml est indiqué pour les adultes et les enfants de plus de 2 ans.
Lidocaine Aguettant 20 mg/ml est indiqué pour les adultes.
Posologie/Mode d’emploiLidocaine Aguettant doit uniquement être utilisé par, ou sous la responsabilité de, médecins expérimentés dans les techniques d'anesthésie régionale et de réanimation. Des équipements de réanimation doivent être disponibles lors de l'administration d'anesthésiques locaux.
Posologie
Il convient d’administrer la concentration et la dose les plus faibles produisant l'effet requis.
Adultes
La dose doit être ajustée en fonction de la réponse du patient, du site d'administration et de la durée prévue de l'intervention chirurgicale.
La dose totale habituelle de lidocaïne à envisager est de 3 à 5 mg/kg, ce qui correspond à des volumes de 2 à 20 mL (à 10 mg/mL) et de 1 à 10 mL (à 20 mg/mL).
En général, la dose totale maximale recommandée de lidocaïne ne doit pas dépasser 200 mg chez l'adulte pour l'infiltration et le bloc nerveux périphérique, mais selon l'intervention et les facteurs du patient, des doses maximales plus élevées peuvent s'avérer nécessaires.
Le volume de la solution utilisée joue un rôle dans la taille de la zone de diffusion de l'anesthésie.
Populations spéciales
Patients âgés
Pour les patients âgés, les doses sont calculées individuellement en fonction de l'âge et du poids corporel du patient. Les doses peuvent nécessiter une adaptation car le débit cardiaque et le débit sanguin hépatique diminuent avec l'âge, ce qui indique une diminution de la clairance de la lidocaïne (voir la rubrique « Pharmacocinétique »).
Patients atteints d’une insuffisance rénale
Les patients doivent être surveillés car une insuffisance rénale peut entraîner des effets toxiques en raison de l'accumulation de métabolites actifs (voir les rubriques « Mises en garde et précautions » et « Pharmacocinétique »). La dose peut nécessiter une adaptation en raison de la réduction de la clairance et de l'augmentation de la demi-vie de la lidocaïne.
Patients atteints d’une insuffisance hépatique
Il peut être nécessaire de réduire la dose de moitié chez les patients atteints d'une insuffisance cardiaque ou hépatique (voir la rubrique « Mises en garde et précautions »).
Patients atteints d’une insuffisance cardiaque
Il peut être nécessaire de réduire la dose de moitié chez les patients atteints d'une insuffisance cardiaque ou hépatique (voir la rubrique « Mises en garde et précautions »).
Autre population spéciale
Il peut être nécessaire de réduire les doses chez les patients dont l’état général est altéré, ou chez ceux dont la capacité de liaison aux protéines est réduite (par exemple en cas d’insuffisance rénale, d’insuffisance hépatique, de cancer, ou de grossesse).
Population pédiatrique
La lidocaïne ne doit pas être utilisée chez les enfants de moins de deux ans, car il existe, à l’heure actuelle, peu de données soutenant la sécurité d'emploi et l'efficacité de ce médicament dans cette population de patients.
Il convient d’exercer une prudence particulière lors du traitement des enfants de 2 à 4 ans.
Seule la faible concentration (10 mg/mL) doit être utilisée.
Les doses sont calculées individuellement en fonction de l'âge du patient, de son poids corporel et de la nature de l'intervention. La posologie habituelle pour les enfants (de plus de 2 ans) est de 3 à 4 mg/kg de poids corporel d'une solution de 10 mg/mL. Pour le calcul, le poids-âge moyen doit être pris en compte pour les enfants en surpoids.
Pour les jeunes enfants, la dose administrée peut représenter un volume inférieur à une demi-seringue. Chez les jeunes enfants, la dose requise, ne dépassant pas 3 à 4 mg/kg, doit être calculée et la dose excédentaire doit être vidée de la seringue avant l'injection à l'enfant. Pour la dose restant dans la seringue, des injections lentes et progressives sont recommandées.
Mode d’administration
Injection par infiltration (intradermique, sous-cutanée ou sous-muqueuse) dans la zone environnante des nerfs périphériques.
Lidocaine Aguettant est une seringue préremplie prête à être administrée qui n'est pas conçue pour être utilisée avec un pousse-seringue électronique (pour une perfusion continue ou une administration péridurale en bolus répétés contrôlés par le patient).
Contre-indicationsHypersensibilité à la substance active, aux anesthésiques locaux à liaison amide ou à l’un des excipients.
Mises en garde et précautionsLa lidocaïne doit être utilisée avec prudence chez les patients souffrant :
·d'épilepsie : les patients atteints de troubles épileptiques cérébraux doivent faire l'objet d'une surveillance très étroite afin de déceler toute manifestation de symptômes nerveux centraux. En outre, de faibles doses de lidocaïne peuvent augmenter l'état de préparation convulsive ;
·d'une insuffisance rénale ou hépatique ;
·de myasthénie grave ;
·d'un blocage du système de la conduction cardiaque dû au fait que les anesthésiques locaux peuvent supprimer la conduction auriculo-ventriculaire ;
·d’une réduction de la fonction cardiovasculaire ;
·de bradycardie ;
·de dépression respiratoire ;
·les personnes âgées et les patients généralement affaiblis ;
·d'une coagulopathie ou traités par des anticoagulants (par ex. l'héparine), des AINS ou des substituts plasmatiques car une lésion accidentelle des vaisseaux sanguins peut entraîner des saignements graves.
Une administration intravasculaire par inadvertance ou un surdosage peuvent provoquer des concentrations sanguines élevées de lidocaïne responsables de symptômes toxiques aigus du système nerveux central et cardiovasculaire.
Des injections intravasculaires accidentelles dans la tête et le cou peuvent provoquer des symptômes cérébraux même à faible dose.
Il faut également faire preuve de prudence si l'anesthésique local doit être injecté dans un tissu enflammé (infecté) en raison d'une absorption systémique accrue due à un débit sanguin plus élevé et d'une diminution de l'effet dû à un pH plus faible du tissu infecté.
Après la commercialisation, quelques cas de chondrolyse ont été rapportés chez des patients qui recevaient en post-opératoire une perfusion intra-articulaire continue d'anesthésiques locaux. La majorité des cas de chondrolyse rapportés concernaient l'articulation de l'épaule. En raison de la multitude de facteurs contributifs et de l'incohérence des données relatives au mode d'action publiées dans les articles scientifiques, il n'a pas pu être établi de lien de causalité.
Un bloc paracervical peut parfois entraîner une bradycardie ou une tachycardie fœtale et il est nécessaire de surveiller attentivement la fréquence cardiaque fœtale (voir rubrique « Grossesse, Allaitement »).
Sodium
Lidocaine Aguettant 10 mg/ml contient 32 mg de sodium par seringue, ce qui équivaut à 1,6 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Lidocaine Aguettant 20 mg/ml contient 23 mg de sodium par seringue, ce qui équivaut à 1,2 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
InteractionsInteractions pharmacodynamiques
Antiarhythmiques de classe I
Une administration simultanée de lidocaïne et d'autres antiarythmiques de classe I doit être évitée en raison d'un risque d'effets indésirables cardiaques graves.
Autres antiarhythmiques
Si la lidocaïne est associée à d'autres antiarythmiques tels que les bêta-bloquants ou les inhibiteurs calciques, l'effet inhibiteur sur la conduction auriculo-ventriculaire et intraventriculaire et sur la contractilité peut être renforcé.
Association avec d’autres anesthésiques locaux
L'association de différents anesthésiques locaux peut entraîner des effets additifs sur le système cardiovasculaire et sur le système nerveux central.
Relaxants musculaires
L'effet des relaxants musculaires (par ex. le suxaméthonium) est prolongé par la lidocaïne.
Sédatifs, hypnotiques
La lidocaïne doit être administrée avec précaution aux patients recevant des sédatifs qui affectent également la fonction du SNC et qui peuvent donc altérer la toxicité de la lidocaïne. Il peut se produire un effet additif entre l'effet anesthésique local et les sédatifs ou hypnotiques.
Anesthétisques volatils
Si de la lidocaïne et des anesthésiques volatils sont administrés simultanément, les effets dépressifs des deux peuvent être intensifiés.
Médicamenst pouvant abaisser le seuil convulsif
Comme la lidocaïne elle-même peut réduire le seuil convulsif, son administration concomitante avec d'autres médicaments abaissant le seuil convulsif (par ex. le tramadol ou le bupropion) peut augmenter le risque de convulsions.
Médicaments pouvant élever le seuil convulsif
L'administration simultanée de diazépam élève le seuil convulsif de la lidocaïne. Ceci doit être pris en compte lorsqu'on surveille les patients pour déceler d’éventuels signes de toxicité de la lidocaïne.
Vasoconstricteurs:
L'effet anesthésique local est prolongé par une association avec un vasoconstricteur, par exemple l'adrénaline. Si la lidocaïne est administrée en tant qu’agent antiarythmique, l'administration d'autres médicaments contenant de l'adrénaline ou de la noradrénaline peut entraîner une potentialisation des effets indésirables cardiaques.
Interactions pharmacocinétiques
La lidocaïne est principalement métabolisée par les isoenzymes CYP 3A4 et CYP 1A2 du cytochrome P 450 (voir la rubrique « Pharmacocinétique »). Une administration concomitante avec des substances actives qui sont des substrats, des inhibiteurs ou des inducteurs d'enzymes hépatiques, des isoenzymes CYP3A4 et CYP1A2, peut avoir une influence sur la pharmacocinétique de la lidocaïne et donc aussi sur son effet.
Inhibiteurs du CYP 3A4 et/ou CYP 1A2
Une administration concomitante de lidocaïne et d'inhibiteurs du CYP3A4 et/ou du CYP1A2 peut entraîner une accélération des concentrations plasmatiques de lidocaïne. Il a été signalé une augmentation des concentrations plasmatiques avec, par exemple :
•L'amiodarone (inhibiteur du CYP3A4) : L'amiodarone diminue la puissance du métabolisme hépatique de la lidocaïne, ce qui entraîne un risque d'augmentation du taux de lidocaïne et, par conséquent, une augmentation de la toxicité neurologique et cardiovasculaire. Un suivi clinique, un ECG, et enfin un contrôle de la concentration plasmatique de lidocaïne doivent être réalisés. Au besoin, le taux plasmatique de la lidocaïne doit être surveillée pendant et après le traitement par l'amiodarone.
•La cimétidine (inhibiteur du CYP3A4 et du CYP1A2) : La cimétidine utilisée à des doses égales ou supérieures à 800 mg/jour : augmentation de la concentration plasmatique de lidocaïne avec augmentation subséquente de la toxicité neurologique et cardiovasculaire. Un suivi clinique, un ECG, et enfin un contrôle de la concentration plasmatique de lidocaïne doivent être réalisés. Au besoin, le taux plasmatique de la lidocaïne doit être surveillée pendant et après le traitement par la cimétidine.
•La fluvoxamine (inhibiteur du CYP3A4 et du CYP1A2) : Hausse du taux de lidocaïne, augmentant ainsi le risque de toxicité neurologique et cardiovasculaire. Un suivi clinique, un ECG, et enfin un contrôle de la concentration plasmatique de lidocaïne doivent être réalisés. Au besoin, le taux plasmatique de la lidocaïne doit être surveillée pendant et après l'association.
•Bêtabloquants (excepté l'esmololol) : Lidocaïne intraveineuse : hausse du taux de lidocaïne, avec augmentation subséquente de la toxicité neurologique et cardiovasculaire. Un suivi clinique, un ECG, et enfin un contrôle de la concentration plasmatique de lidocaïne doivent être réalisés. Au besoin, le taux plasmatique de la lidocaïne doit être surveillée pendant et après le traitement par les bêtabloquants.
•Autres inhibiteurs connus du CYP3A4 : inhibiteurs de la protéase (par ex. ritonavir), antibiotiques macrolides (par ex. érythromycine), antifongiques (par ex. kétoconazole, itraconazole).
•Autres inhibiteurs connus du CYP1A2 : ciprofloxacine.
Inducteurs du CYP 3A4 et/ou CYP 1A2
Les substances actives induisant le CYP3A4 et/ou le CYP 1A2 telles que les barbituriques (principalement le phénobarbital), la carbamazépine, la phénytoïne ou la primidone, accélèrent la clairance plasmatique de la lidocaïne et réduisent ainsi l'efficacité de la lidocaïne.
Autres interactions pharmacocinétiques
Les médicaments qui modifient le métabolisme, le débit sanguin hépatique, le débit cardiaque ou la distribution périphérique de la lidocaïne peuvent influencer les concentrations plasmatiques de lidocaïne.
Médicaments provoquant l'hypokaliémie
Les effets électrophysiologiques de la lidocaïne dépendent fortement de la concentration extracellulaire en potassium et peuvent être presque complètement bloqués par l'hypokaliémie. Une utilisation concomitante de médicaments pouvant provoquer une hypokaliémie grave (par ex. acétazolamide, diurétiques de l'anse et thiazides) doit donc être évitée ou utilisée sous une surveillance étroite de la concentration sérique en potassium.
Grossesse, AllaitementGrossesse
Il n'existe pas de données appropriées sur l'utilisation de la lidocaïne chez les femmes enceintes.
La lidocaïne traverse la barrière placentaire (voir la rubrique « Pharmacocinétique »). On peut supposer qu'un grand nombre de femmes enceintes et de femmes en âge de procréer ont reçu de la lidocaïne. Aucune perturbation spécifique du processus de reproduction n'a été signalée à ce jour, par exemple, aucune incidence accrue de malformations ou d'effets directs ou indirects sur le fœtus. Toutefois, les risques pour l'homme ne sont pas encore complètement étudiés.
Les études réalisées chez l’animal ont démontré une toxicité pour la reproduction (voir la rubrique « Donnés précliniques »).
Il convient d'évaluer soigneusement le rapport bénéfice-risque d'une utilisation de courte durée pendant la grossesse et lors de l'accouchement. Le bloc paracervical ou pudendal par la lidocaïne augmente le risque de réactions telles qu'une bradycardie/tachycardie chez le fœtus. Il est donc impératif de surveiller attentivement la fréquence cardiaque du fœtus.
Allaitement
La lidocaïne est excrétée en petites quantités dans le lait maternel humain. Il est peu probable qu'elle ait un effet délétère sur le nourrisson lorsqu'elle est utilisée aux doses recommandées. L'allaitement peut donc être poursuivi pendant le traitement par la lidocaïne.
Fertilité
On ne dispose d'aucune donnée humaine sur l'effet de la lidocaïne sur la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLidocaine Aguettant à une certaine influence sur l’aptitude à la conduite ou l’utilisation des machines. Après l'injection d'anesthésiques locaux, une perte sensorielle transitoire et/ou un blocage moteur peuvent se produire. Les patients ne doivent pas conduire de véhicules ou utiliser de machines jusqu’à disparation des effets.
Effets indésirablesRésumé du profil de sécurité d’emploi
La fréquence et la gravité des effets indésirables de la lidocaïne dépendent de la dose, du mode d'administration et de la sensibilité individuelle du patient.
Les effets indésirables liés aux anesthésiques locaux sont rares en l'absence de surdosage, d'absorption systémique rapide anormale ou d'injection intravasculaire accidentelle ; dans de tels cas, ils peuvent être très graves, notamment sur les fonctions cardiaque et neurologique.
Les effets indésirables provoqués par la lidocaïne peuvent être difficiles à distinguer des effets physiologiques du bloc nerveux (par ex. hypotension, bradycardie), des affections provoqués directement (par ex. lésions nerveuses) ou indirectement par l'aiguille.
Des symptômes de toxicité locale peuvent survenir après l'administration de lidocaïne. On peut s'attendre à des effets indésirables systémiques à des concentrations plasmatiques de lidocaïne supérieures à 5- 10 mg/l. Ils se manifestent à la fois sous forme de symptômes du SNC et de symptômes cardiovasculaires.
Les effets indésirables possibles après une administration de lidocaïne comme anesthésique local sont en grande partie identiques à ceux produits par d'autres anesthésiques locaux à liaison amide.
Liste des effets indésirables
Les effets indésirables énumérés dans la présente rubrique appartiennent aux catégories de fréquence suivantes : Très fréquents (≥ 1/10) ; fréquents (≥ 1/100 à < 1/10) ; occasionnels (≥ 1/1 000 à < 1/100) ; rares (≥ 1/10 000 à <1/1 000) ; très rares (<1/10 000) ; fréquence inconnue (ne peut être estimées sur la base des données disponibles).
Le tableau suivant énumère les effets indésirables associés à l'utilisation de la lidocaïne comme anesthésique.
|
Classe de systèmes d’organes
|
Très fréquents
|
Fréquents
|
Occasionnels
|
Rares
|
Très rares
|
Fréquence inconnue
| |
Affections hématologiques et du système lymphatique
|
|
|
|
|
|
Méthémo-globinémie
| |
Affections du système immunitaire
|
|
|
|
réaction allergique*, réactions anaphylactoïdes, broncho-spasme et, dans les cas graves, choc ana-phylactique.
|
|
| |
Affections du système nerveux
|
|
Paresthésie, perte de conscience.
Symptômes neuro-logiques transitoires.
|
|
Neuropathie, convulsions (surdose), anesthésie persistante, parésie, céphalées accompagnées d'acouphènes et photophobie.
Lésions du nerf crânien, surdité neuro-sensorielle. Les applications régionales dans la région thoracique ou dans la région de la tête et/ou du cou peuvent induire un blocage sympathique entraînant des symptômes transitoires tels qu'un syndrome de Horner, un syndrome d'Harlequin.
|
|
| |
Affections oculaires :
|
|
|
|
Vision double
|
|
| |
Affections cardiaques
|
|
bradycardie
|
|
Arythmie, dépression myocardique ou éven-tuellement arrêt cardiaque (surdose ou injection intravasculaire accidentelle).
|
|
| |
Affections vasculaires
|
|
hypotension, hypertension
|
|
|
|
| |
Affections respiratoires, thoraciques et médiastinales
|
|
|
|
Dépression respiratoire
|
|
| |
Affections gastro-intestinales
|
nausées
|
vomissements
|
|
|
|
| |
Affections de la peau et du tissu sous-cutané
|
|
|
|
éruption cutanée, urticaire, œdème
|
|
|
* Les tests cutanés pour l'allergie à la lidocaïne ne sont pas considérés comme étant fiables.
Population pédiatrique
On prévoit que la fréquence, le type et la gravité des effets indésirables chez les enfants seront les mêmes que chez les adultes.
Autres populations spéciales
Chez les patients âgés, l'incidence des effets indésirables peut être plus élevée.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn fonction de la sensibilité individuelle, des réactions toxiques se produisent à partir d'une concentration d'environ 5 à 10 mg de lidocaïne par litre de sang veineux.
La concentration plasmatique létale pour les humains est de l'ordre de 6 à 33 mg de lidocaïne par litre.
Une surdose ou une injection intravasculaire accidentelle peut produire des concentrations plasmatiques excessives de lidocaïne, ce qui engendre des signes de toxicité aiguë, pouvant entraîner des effets indésirables très graves. Les effets toxiques de la lidocaïne dépendent du niveau de la concentration plasmatique ; plus la concentration plasmatique est élevée et plus son augmentation est rapide, plus les réactions toxiques seront fréquentes et graves. Ces réactions toxiques concernent le système nerveux central et le système cardiovasculaire.
Symptômes
De faibles surdoses toxiques de lidocaïne entraînent une stimulation du SNC. Un surdosage important, produisant des concentrations plasmatiques toxiques élevées, provoque une dépression des fonctions centrales.
Une toxicité du système nerveux central est une réponse progressive avec des symptômes et des signes de gravité croissante.
Les premiers symptômes observés sont les suivants : étourdissements, vertiges, agitation, hallucination, euphorie, appréhension, bâillements, logorrhée, céphalées, nausées, vomissements, paresthésie labiale, engourdissement de la langue, acouphène et dysarthrie, déficience auditive et visuelle.
D'autres symptômes subjectifs du système nerveux central comprennent : désorientation, sensation occasionnelle de somnolence. Des cas de tachycardie, d'hypertension et de bouffées vasomotrices ont été également rapportés.
Ces signes d'alarme nécessitent une surveillance attentive : contractions musculaires, tremblements, frissons et convulsions généralisées. L'administration simultanée de diazépam élève le seuil épileptogène de la lidocaïne. Ceci doit être pris en compte lorsqu'on surveille les patients pour déceler d’éventuels signes de toxicité de la lidocaïne.
En cas d'administration de doses très élevées : dépression généralisée du système nerveux central, dépression respiratoire, coma et arrêt respiratoire.
Une toxicité cardiovasculaire peut être observée dans les cas graves : troubles du rythme cardiaque tels qu'une extrasystole ventriculaire, fibrillation ventriculaire, pouls impalpable, pâleur, bradycardie majeure, troubles de la conduction auriculo-ventriculaire, diminution de la contractilité cardiaque, hypotension et arrêt cardiaque.
Traitement
Si des signes de toxicité aiguë apparaissent pendant l'administration de l'anesthésique local, l'administration de l'anesthésique doit être immédiatement interrompue. Un intralipide doit être administré afin de prévenir une hypoxie et une acidose qui potentialisent la toxicité systémique de l'anesthésique local et qui exacerbent la progression vers le collapsus cardiovasculaire et les convulsions.
Si des convulsions surviennent, une oxygénation doit être maintenue et la circulation doit être assistée. Au besoin, un anticonvulsif doit être administré. L'utilisation d'une émulsion lipidique intraveineuse doit être envisagée.
Si une dépression cardiovasculaire est évidente (hypotension, bradycardie), il faudra envisager un traitement de substitution intravasculaire par des vasopresseurs, chronotropes et/ou inotropes.
En cas d'arrêt circulatoire, une réanimation cardiopulmonaire immédiate doit être initiée. Pour obtenir un résultat positif, des efforts de réanimation prolongés peuvent s'avérer nécessaires.
Les patients présentant des signes manifestes de toxicité systémique de l'anesthésique local devront être surveillés pendant au moins 12 heures, car la dépression cardiovasculaire peut persister ou réapparaître après le traitement.
Les analeptiques à action centrale sont contre-indiqués.
Il n’existe pas d’antidote spécifique.
La lidocaïne ne peut être éliminée par hémodialyse.
Propriétés/EffetsCode ATC
N01BB02
Mécanisme d’action
Pharmacodynamique
La lidocaïne est un anesthésique local de type amide.
La lidocaïne réduit la perméabilité des membranes cellulaires pour les cations, en particulier pour les ions sodium, et également pour les ions potassium à des concentrations plus élevées. Cela conduit, en fonction de la concentration de lidocaïne, à une excitabilité réduite des fibres nerveuses car l'augmentation de la perméabilité du sodium produisant le potentiel d'action est ralentie. La molécule de lidocaïne pénètre, depuis l’intérieur de la cellule, dans le canal sodique ouvert et le bloque en se liant à un récepteur spécifique. Un effet direct de l'incorporation de la lidocaïne dans la membrane cellulaire est beaucoup moins pertinent.
Comme la lidocaïne, avant d'atteindre son site d'action, doit passer dans la cellule, son effet dépend de son pKa et du pH de l'environnement, c'est-à-dire de la proportion de la base libre qui est le fragment migrant principalement à travers les membranes lipophiles des fibres nerveuses.
Dans les tissus enflammés, l'effet anesthésique local est réduit en raison du pH plus bas de ces régions.
Efficacité clinique
Aucune donnée disponible.
PharmacocinétiqueAbsorption
Les concentrations plasmatiques dépendent du site et de la méthode d'administration. Toutefois, il existe un faible rapport entre la quantité d'anesthésique local injecté et les pics plasmatiques.
Les concentrations maximales sont atteintes dans les 30 minutes, et chez la majorité des patients elles sont atteintes en 10 à 20 minutes.
Après une injection intramusculaire de 400 mg de chlorhydrate de lidocaïne monohydraté pour le bloc intercostal, la concentration plasmatique maximale (Cmax) a été déterminée à 6,48 mg/l, atteinte après 5 à 15 min (tmax).
Après une administration sous-cutanée, les valeurs de Cmax ont atteint 4,91 mg/l (injection vaginale) ou 1,95 mg/l (injection abdominale), respectivement. Dans une étude comportant 5 volontaires en bonne santé, après anesthésie par infiltration maxillaire-buccale avec 36 mg de lidocaïne, en utilisant une solution à 20 mg/ml la valeur Cmax a atteint 0,31 mg/l.
Distribution
La lidocaïne suit une cinétique d'élimination biphasique. Après une administration intraveineuse, la substance active est d'abord rapidement distribuée du compartiment central vers les tissus et organes intensément perfusés (phase de distribution alpha). Cette phase est suivie d'une redistribution dans les muscles squelettiques et le tissu adipeux. La demi-vie pendant la phase de distribution alpha est d'environ 4 à 8 minutes. Il est prévu que la distribution dans les tissus périphériques se produise dans les 15 minutes.
Le taux de liaison aux protéines plasmatiques est d'environ 60 à 80 % chez les adultes. Elle dépend de la concentration de substance active et de la concentration d'alpha-1-glycoprotéine acide (AGP). L'AGP est une protéine de phase aiguë qui se lie à la lidocaïne libre et peut être augmentée, par exemple après un traumatisme, une intervention chirurgicale ou des brûlures, selon l'état pathophysiologique du patient. Au contraire, il a été démontré que les concentrations d'AGP sont faibles chez les nouveau-nés et les patients souffrant d'une insuffisance hépatique, ce qui entraîne une réduction marquée de la liaison de la lidocaïne aux protéines plasmatiques.
Le volume de distribution à l'état d’équilibre est de 91 litres. Le volume de distribution peut être modifié chez les patients souffrant d'autres pathologies, comme par exemple une insuffisance cardiaque, une insuffisance hépatique ou une insuffisance rénale.
Métabolisme
La lidocaïne est rapidement métabolisée dans le foie par les mono-oxygénases, principalement par N-désalkylation oxydative, hydroxylation au niveau du cycle aromatique et hydrolyse de la liaison amide. Les dérivés hydroxylés subissent une conjugaison.
Au total, environ 90 % de la lidocaïne est métabolisée en 4-hydroxy-2,6-xylidine, en 4-hydroxy-2,6-xylidine glucuronide et, dans une moindre mesure, en métabolites actifs monoéthylglycine xylidide (MEGX) et glycine xylidide (GX).
Ces derniers peuvent s'accumuler pendant des perfusions de plus longue durée ou en présence d'une insuffisance rénale grave en raison de leur demi-vie plus longue que celle de la lidocaïne elle-même. En présence de pathologies hépatiques, le taux métabolique peut être réduit de 10 à 50 % de la normale.
Les résultats obtenus avec des microsomes hépatiques humains et des isoformes CYP humaines recombinantes ont démontré que les enzymes CYP1A2 et CYP3A4 sont les principales isoformes CYP impliquées dans la N-dééthylation de la lidocaïne.
Élimination
Moins de 10 % de la lidocaïne est excrétée sous forme inchangée dans l'urine, la proportion restante l'étant sous forme de métabolites.
La demi-vie d'élimination est de 1,5 à 2 heures chez les adultes et d'environ 3 heures chez les nouveau-nés. La demi-vie d'élimination peut augmenter en cas d'insuffisance cardiaque grave (jusqu'à 4 à 12 heures) ou de maladie hépatique chronique (jusqu'à 4,5 à 6 heures).
Les temps de demi-vie des métabolites actifs monoéthylglycine xylidide (MEGX) et glycine xylidide (GX) sont respectivement de 2 à 6 heures et de 10 heures. Comme leur demi-vie plasmatique est plus longue que celle de la lidocaïne, une accumulation de métabolites, en particulier de GX, peut se produire pendant une perfusion prolongée.
En outre, la vitesse d'élimination dépend du pH et peut être augmentée par acidification de l'urine. La clairance plasmatique est d'environ 0,95 mL/min.
Le flux sanguin hépatique semble limiter le taux de métabolisme de la lidocaïne.
Cinétique pour certains groupes de patients
Patients atteints d’une insuffisance rénale
La demi-vie plasmatique de la lidocaïne semble inchangée, à l'exception d'une certaine accumulation de GX pendant une perfusion de 12 heures ou plus. Cette accumulation semble être associée à une administration à long terme du médicament. Toutefois, chez les patients atteints d'une insuffisance rénale grave, la clairance de la lidocaïne est réduite de moitié environ et la demi-vie de la lidocaïne est environ deux fois plus longue que chez les patients en bonne santé.
Patients atteints d’une insuffisance hépatique
La demi-vie plasmatique de la lidocaïne et de ses métabolites peut être prolongée, et il faut s'attendre à des effets importants sur la pharmacocinétique et les exigences posologiques de la lidocaïne chez les patients présentant une altération de la perfusion hépatique, par exemple après un infarctus aigu du myocarde, en présence d'une insuffisance cardiaque, d'une maladie hépatique ou d'une insuffisance cardiaque congestive.
Patients âgés
La demi-vie d'élimination et le volume de distribution peuvent paraître prolongés ou augmentés respectivement chez les patients âgés en raison d'une diminution du débit cardiaque et/ou du débit sanguin hépatique.
Femme enceinte ou allaitante
La lidocaïne traverse le placenta par simple diffusion et atteint le fœtus en quelques minutes après son administration.
Après le bloc paracervical, des concentrations nettement plus élevées de lidocaïne ont été mesurées dans le sang ombilical.
Le fœtus est capable de métaboliser la lidocaïne. Les concentrations dans le sang fœtal représentent environ 60 % des concentrations dans le sang maternel. En raison d'une plus faible liaison aux protéines plasmatiques dans le sang fœtal, la concentration de lidocaïne libre pharmacologiquement active est 1,4 fois plus élevée que la concentration maternelle.
La lidocaïne n'est sécrétée dans le lait maternel qu'en petites quantités.
Population pédiatrique
Chez les nouveau-nés, les niveaux d'α-1-glycoprotéine acide sont faibles et la liaison protéinique peut être réduite. Comme la fraction libre peut être plus élevée, l'utilisation de la lidocaïne chez les nouveau-nés n'est pas recommandée.
Données précliniquesLors des études menées chez l'animal, la toxicité rapportée après l'administration de doses élevées de lidocaïne consistait en des effets sur le système nerveux central et sur le système cardiovasculaire.
Génotoxicité
La lidocaïne n'a pas démontré de potentiel génotoxique lors d'essais de génotoxicité in vitro et in vivo. En revanche, la 2,6-xylidine, un métabolite de la lidocaïne, a présenté une activité génotoxique.
Carcinogénicité
Il n'a pas été mené d'études visant à évaluer le potentiel cancérigène de la lidocaïne. Dans une étude sur la cancérogénicité menée chez le rat avec exposition trans-placentaire et traitement post-partum des animaux sur 2 ans avec des doses élevées de 2,6-xylidine, des tumeurs malignes et bénignes ont été observées, principalement dans la cavité nasale (ethmoturbinalia). L'importance clinique de ces résultats n'a pas été déterminée.
Toxicité sur la reproduction
Lors d'études de toxicité sur la fonction de reproduction menées chez le lapin, des effets embryotoxiques ou fœtotoxiques de la lidocaïne ont été détectés à des doses de 25 mg/kg administrées en sous-cutané. Chez le rat, la lidocaïne n'a pas eu d'effet sur le développement post-natal de la progéniture à des doses inférieures à la plage toxique pour les mères. Il n'a pas été observé d'altération de la fertilité de rats mâles ou femelles après administration de lidocaïne.
Remarques particulièresIncompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur
l’emballage.
Après ouverture, le médicament doit être utilisé immédiatement.
Remarques particulières concernant le stockage
Tenir hors de portée des enfants.
À usage unique pour un seul patient. Jeter la seringue après utilisation. Ne pas utiliser si l’embout de scellage de la seringue préremplie est brisé.
Conserver la seringue préremplie dans son blister non ouvert jusqu'à l'utilisation. Conserver à 15-30°C. Ne pas congeler.
Remarques concernant la manipulation
Remarques concernant la manipulation
La seringue préremplie doit être préparée soigneusement de la façon suivante
La seringue préremplie est à usage unique, c’est-à-dire destinée à un seul patient. Jeter la seringue préremplie après utilisation. NE PAS RÉUTILISER.
Le contenu du blister non ouvert et non endommagé est stérile, et par conséquent il ne doit être ouvert qu’au moment de l’utilisation.
Le produit doit être inspecté visuellement avant l’administration pour déceler la présence de particules et d’une coloration anormale. Seule une solution limpide et incolore dépourvue de particules ou de précipité doit être utilisée.
Le médicament ne doit pas être utilisé si le dispositif d’inviolabilité sur la seringue est rompu.
La surface externe de la seringue préremplie est stérile jusqu’à l’ouverture du blister.
Lorsqu'il est manipulé en utilisant une technique aseptique, ce médicament peut être placé sur un champ stérile.
|
1) Retirer la seringue préremplie du blister stérile.
| |
2
|
|
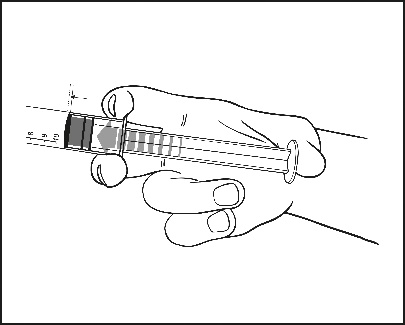
2) Presser la tige du piston pour libérer le joint. Le procédé de stérilisation a pu entraîner une adhérence du joint sur le corps de la seringue préremplie.
| |
3
|
|
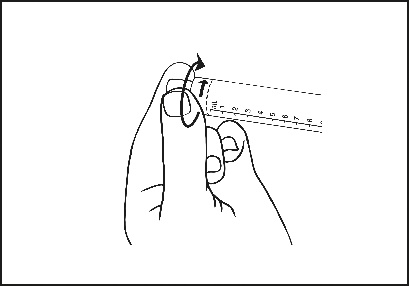
3) Dévisser l'embout protecteur pour rompre l’embout de scellage. Ne pas toucher l’embout de connexion Luer afin d'éviter toute contamination.
| |
4
|
|
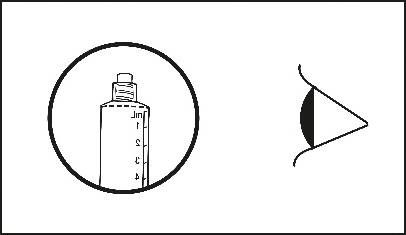
4) Vérifier que l’embout de scellage de la seringue préremplie a bien été totalement retiré. Dans le cas contraire, replacer le protège embout et dévisser à nouveau.
| |
5
|

|
5) Purger l’air de la seringue en poussant légèrement le piston.
| |
6) Connecter la seringue préremplie à la voie d'accès ou à l'aiguille. Pousser lentement le piston pour injecter le volume requis.
|
Numéro d’autorisation69435 (Swissmedic).
PrésentationLidocaine Aguettant 10 mg/ml : 10 seringues préremplies de 10 ml (B)
Lidocaine Aguettant 20 mg/ml : 10 seringues préremplies de 10 ml (B)
Titulaire de l’autorisationAguettant Suisse SA, Thônex
Mise à jour de l’informationDécembre 2023
|




