Propriétés/EffetsCode ATC
D11AH10
Mécanisme d’action
Le lébrikizumab est un anticorps monoclonal d’immunoglobuline (IgG4) qui se lie avec une haute affinité à l’interleukine (IL)‐13 et inhibe sélectivement la signalisation de l’IL‐13 par la voie du récepteur alpha de l’IL‐4 (IL‐4Rα) et de l’hétérodimère du récepteur alpha 1 de l’IL-13 (IL‐13Rα1), inhibant ainsi les effets de l’IL‐13 en aval. L’inhibition de la signalisation de l’IL-13 devrait être bénéfique dans les maladies pour lesquelles l’IL-13 est un facteur clé de la pathogenèse de la maladie. Le lébrikizumab n’empêche pas la liaison de l’IL-13 au récepteur alpha 2 de l’IL-13 (IL-13Rα2 ou récepteur leurre), ce qui permet l’internalisation de l’IL-13 dans la cellule.
Pharmacodynamique
Dans les études cliniques, le lébrikizumab a réduit les taux sériques de périostine, d’immunoglobulines E (IgE) totales, de ligand de chimiokine CC(CCL)17 [chimiokine régulée par le thymus et par activation (TARC)], de CCL18 [[chimiokine régulée par le poumon et par activation (PARC)] et de CCL13 [protéine chimiotactique des monocytes-4 (MCP-4)]. La diminution des médiateurs de l’inflammation de type 2 apporte une preuve indirecte de l’inhibition de la voie de l’IL-13 par le lébrikizumab.
Efficacité clinique
Adultes et adolescents atteints de dermatite atopique
L’efficacité et la sécurité du lébrikizumab en monothérapie (ADvocate 1, ADvocate 2) et en association avec un CST (ADhere) ont été évaluées dans trois études pivot randomisées en double aveugle, contrôlées contre placebo chez 1062 adultes et adolescents (âgés de 12 à 17 ans et pesant ≥40 kg) atteints de dermatite atopique modérée à sévère, définie par un score d’indice de surface et de sévérité de l’eczéma (Eczema Area and Severity Index, EASI) ≥16, un score d’évaluation globale par l’investigateur (Investigator’s Global Assessment, IGA) ≥3 et une surface corporelle atteinte (Body Surface Area, BSA) ≥10%. Les patients inclus dans les trois études présentaient auparavant une réponse insuffisante au traitement par voie topique ou bien les traitements par voie topique ne leur étaient pas médicalement recommandés (ce dernier critère ne s’appliquait pas à l’étude ADhere).
Dans les trois études, les patients ont reçu une dose initiale de 500 mg de lébrikizumab (deux injections de 250 mg) aux semaines 0 et 2, puis 250 mg toutes les deux semaines (Q2S) jusqu’à la semaine 16 ou un placebo équivalent selon un rapport de 2:1. Dans ADhere, les patients de l’étude ont également reçu un CST de puissance faible à modérée ou un ICT concomitant sur les lésions actives. Les patients étaient autorisés à recevoir un traitement de secours selon l’appréciation de l’investigateur pour contrôler les symptômes intolérables de la dermatite atopique. Les patients nécessitant un traitement de secours systémique ont arrêté le traitement à l’étude.
Les patients ayant obtenu un score IGA de 0 ou 1 ou une réduction d’au moins 75% de la réponse EASI (EASI 75) sans avoir reçu de traitement de secours étaient randomisés à nouveau en aveugle pour recevoir (i) du lébrikizumab 250 mg toutes les 2 semaines (Q2S), (ii) du lébrikizumab 250 mg toutes les 4 semaines (Q4S) ou (iii) un placebo pendant 52 semaines.
Dans les études ADvocate 1 et ADvocate 2, après avoir terminé l’étude de 52 semaines, et dans l’étude ADhere, après avoir terminé l’étude de 16 semaines, les patients avaient la possibilité de poursuivre le traitement dans une étude distincte d’extension à long terme (ADjoin).
Critères d’évaluation
Dans les trois études, les co-critères d’évaluation primaires étaient le pourcentage de patients présentant un score IGA 0 ou 1 («sans lésion» ou «lésion minime») avec une réduction de ≥2 points par rapport à l’inclusion, et le pourcentage de patients présentant une réduction d’au moins 75% du score EASI (EASI 75) entre l’inclusion et la semaine 16. Les critères d’évaluation secondaires majeurs comprenaient le pourcentage de patients ayant obtenu une réduction d’au moins 90% du score EASI (EASI 90), le pourcentage de patients avec une amélioration par rapport à l’inclusion d’au moins 4 points sur l’échelle d’évaluation numérique de prurit (Pruritus Numerical Rating Scale, Pruritus NRS), le pourcentage de patients avec une amélioration par rapport à l’inclusion d’au moins 4 points sur l’indice de qualité de vie en dermatologie (Dermatology Life Quality Index, DLQI) et l’impact des démangeaisons sur le sommeil (échelle de perte de sommeil). La variation par rapport à l’inclusion du score de mesure de l’eczéma par le patient (Patient Oriented Eczema Measure, POEM) constituait un autre critère d’évaluation secondaire.
Patients
Caractéristiques à l’inclusion
Les caractéristiques démographiques et les données initiales des patients des études ADvocate 1, ADvocate 2 et ADhere sont présentées dans le tableau 2.
Tableau 2. Données démographiques et caractéristiques à l’inclusion par étude
|
|
ADvocate 1 N = 424
|
ADvocate 2 N = 427
|
ADhere N = 211
| |
Âge (moyenne, années)
|
35,5
|
36,2
|
37,2
| |
Adolescents (12 à 17 ans) (%)
|
13,0
|
11,0
|
21,8
| |
Patients âgés (≥65 ans) (%)
|
7,3
|
7,7
|
9,5
| |
Poids (moyenne, kg)
|
77,7
|
76,5
|
76,2
| |
Femmes (%)
|
50,5
|
49,4
|
48,8
| |
Origine ethnique
|
|
|
| |
Blanc (%)
|
68,2
|
59,3
|
61,6
| |
Asiatique (%)
|
16,5
|
28,6
|
14,7
| |
Noir (%)
|
11,6
|
8,2
|
13,3
| |
IGA 3 (DA modérée) (%)
|
59,7
|
63,2
|
69,2
| |
IGA 4 (DA sévère) (%)
|
40,3
|
36,8
|
30,8
| |
Traitement systémique précédent (%)*
|
54,0
|
55,5
|
47,4
| |
EASI (moyenne)
|
29,6
|
29,7
|
27,3
| |
Score NRS de prurit (moyenne)
|
7,3
|
7,1
|
7,1
| |
DLQI (moyenne)
|
15,4
|
15,5
|
14,4
| |
Échelle de perte de sommeil (moyenne)
|
2,3
|
2,2
|
2,0
| |
POEM (moyenne)
|
20,8
|
20,8
|
19,5
|
*Corticostéroïdes, cyclosporine, photothérapie et dupilumab (ADhere uniquement)
Réponse clinique
Études en monothérapie (ADvocate 1 et ADvocate 2) – phase d’induction, semaine 0 à 16
Dans l’étude ADvocate 1 et ADvocate 2, un pourcentage significativement plus élevé de patients du groupe lébrikizumab 250 mg Q2S ont obtenu un score IGA 0 ou 1, avec une amélioration ≥2 points par rapport à l’inclusion, une réponse EASI 75, une réponse EASI 90 et une amélioration de ≥4 points sur le score NRS du prurit à la semaine 16 par rapport au placebo (voir tableau 3).
Tableau 3. Résultats d’efficacité du lébrikizumab en monothérapie à la semaine 16 dans les études ADvocate 1 et ADvocate 2
|
|
ADvocate 1
|
ADvocate 2
| |
|
Semaine 16
| |
|
Placebo
N = 141
|
LEB 250 mg Q2S
N = 283
|
Placebo
N = 146
|
LEB
250 mg Q2S
N = 281
| |
IGA 0 ou 1, %a
|
12,7
|
43,1*
|
10,8
|
33,2*
| |
EASI 75, %b
|
16,2
|
58,8*
|
18,1
|
52,1*
| |
EASI 90, %b
|
9,0
|
38,3*
|
9,5
|
30,7*
| |
NRS du prurit (amélioration ≥4 points), %c
|
13,0
|
45,9*
|
11,5
|
39,8*
|
LEB = lébrikizumab; N = nombre de patients
a Patients présentant un score IGA de 0 ou 1 («sans lésion» ou «lésion minime») avec une réduction >2 points par rapport à l’inclusion sur une échelle IGA de 0 à 4
b Patients présentant une réduction de 75% ou 90% de la réponse EASI entre l’inclusion et la semaine 16.
c Le pourcentage est calculé par rapport au nombre de patients présentant un score NRS de prurit à l’inclusion dans l’étude ≥4.
*p<0,001 par rapport au placebo
Dans les deux études, les patients randomisés dans le groupe lébrikizumab ont été moins nombreux à avoir recours à un traitement de secours (corticostéroïdes topiques, corticostéroïdes systémiques, immunosuppresseurs) que les patients randomisés dans le groupe placebo (14,7% contre 36,6%, respectivement dans les deux études).
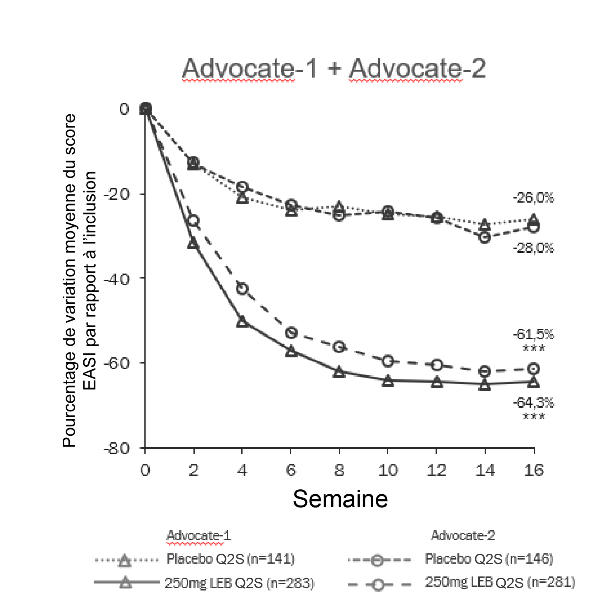
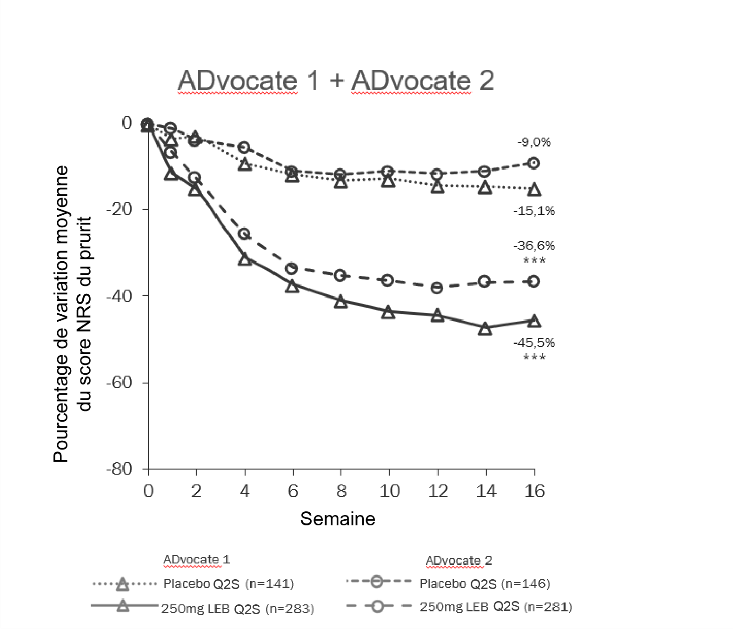
La figure 1 et la figure 2 montrent le pourcentage de variation moyenne de la réponse EASI et du score NRS du prurit entre l’inclusion et la semaine 16.
|
Figure 1. Pourcentage de variation moyenne de la réponse EASI entre l’inclusion et la semaine 16 dans les études ADvocate 1 et 2
|
Figure 2. Pourcentage de variation moyenne du score NRS du prurit entre l’inclusion et la semaine 16 dans les études ADvocate 1 et 2
| |
|
|
|
|
***p<0,001 par rapport au placebo
Les effets du traitement dans les sous-groupes (poids, âge, sexe, origine ethnique, sévérité de la maladie et utilisation antérieure de traitements systémiques) dans les études ADvocate 1 et ADvocate 2 étaient conformes aux résultats de l’ensemble de la population de l’étude pendant la phase d’induction.
Études en monothérapie (ADvocate 1 et ADvocate 2) – Période d’entretien, semaines 16 à 52
Pour évaluer le maintien de la réponse, 157 patients de l’étude ADvocate 1 et 134 patients de l’étude ADvocate 2, traités par le lébrikizumab 250 mg Q2S et ayant atteint un score IGA de 0 ou 1 ou une réponse EASI 75 à la semaine 16 sans traitement de secours topique ou systémique, ont été randomisés une nouvelle fois en aveugle selon un rapport de 2:2:1. Les patients ont reçu en aveugle pendant 36 semaines supplémentaires soit (i) du lébrikizumab 250 mg Q2S, soit (ii) du lébrikizumab 250 mg Q4S, soit (iii) un placebo. La durée totale de l’étude était de 52 semaines (voir tableau 4).
Tableau 4. Résultats d’efficacité du lébrikizumab en monothérapie à la semaine 52 chez les patients répondant au traitement à la semaine 16 dans les études ADvocate 1 et ADvocate 2 (analyse groupée)
|
|
ADvocate 1 et ADvocate 2 (regroupées)
| |
|
Semaine 52
| |
|
Placebod
(retrait du LEB)
N = 60
|
LEB 250 mg
Q2S
N= 113
|
LEB 250 mg
Q4S
N = 118
| |
IGA 0 ou 1, %a
|
47,9
|
71,2*
|
76,9**
| |
EASI 75, %b
|
66,4
|
78,4
|
81,7*
| |
EASI 90, %b
|
41,9
|
64,0*
|
66,4**
| |
NRS du prurit (amélioration ≥4 points), %c
|
66,3
|
84,6
|
84,7
|
a Patients présentant un score IGA 0/1 avec une amélioration ≥2 points par rapport à l’inclusion à la semaine 16, qui présentaient toujours un score IGA 0/1 avec une amélioration ≥2 points à la semaine 52.
b Patients ayant obtenu une réponse EASI 75 à la semaine 16 et qui présentaient toujours une réponse EASI 75 à la semaine 52 ou patients ayant obtenu une réponse EASI 75 à la semaine 16 et qui présentaient une réponse EASI 90 à la semaine 52.
c Le pourcentage est calculé par rapport au nombre de patients présentant un score NRS de prurit à l’inclusion dans l’étude ≥4.
d Patients répondant au lébrikizumab 250 mg Q2S à la semaine 16 (IGA 0 ou 1 ou EASI 75) et à nouveau randomisés dans le groupe placebo.
*p<0,05; **p<0,01 par rapport au placebo.
Étude avec CST concomitant (ADhere)
Dans l’étude ADhere, entre l’inclusion et la semaine 16, un pourcentage significativement plus élevé de patients randomisés dans le groupe lébrikizumab 250 mg Q2S + CST a obtenu un score IGA de 0 ou 1, une réponse EASI 75 et des améliorations ≥4 points du score NRS de prurit, par rapport aux patients recevant le placebo + CST (voir tableau 5).
Tableau 5. Résultats d’efficacité du traitement concomitant avec lébrikizumab et CST à la semaine 16 dans l’étude ADhere
|
|
ADhere
| |
|
Semaine 16
| |
|
Placebo + CST
N = 66
|
LEB
250 mg Q2S + CST
N = 145
| |
IGA 0 ou 1, %a
|
22,1
|
41,2*
| |
EASI 75, %b
|
42,2
|
69,5**
| |
EASI 90, %b
|
21,7
|
41,2**
| |
NRS du prurit (amélioration ≥4 points), %c
|
31,9
|
50,6*
|
a Patients présentant un IGA de 0 ou 1 («sans lésion» ou «lésion minime») avec une réduction de ≥2 points par rapport à la valeur initiale sur une échelle IGA de 0 à 4
b Patients présentant une réduction de l’EASI de 75% ou 90% entre la référence et la semaine 16.
c Le pourcentage est calculé par rapport au nombre de patients présentant un NRS du prurit de référence ≥4.
*p<0,05; **p<0,001 vs Placebo
Dans l’étude ADhere, les patients ayant reçu 250 mg de lébrikizumab Q2S + CTS de la semaine 0 à la semaine 16 ont moins souvent eu recours au CTS que ceux ayant reçu un placebo + CST (1,4% respectivement 4,5%).
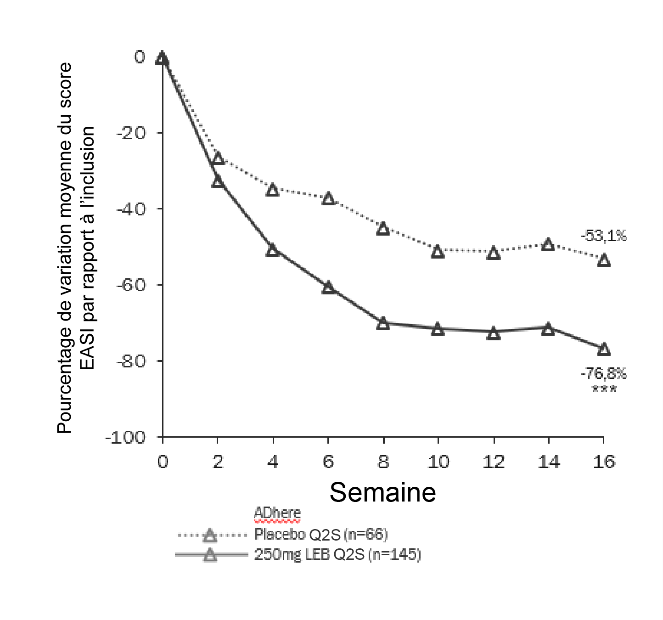
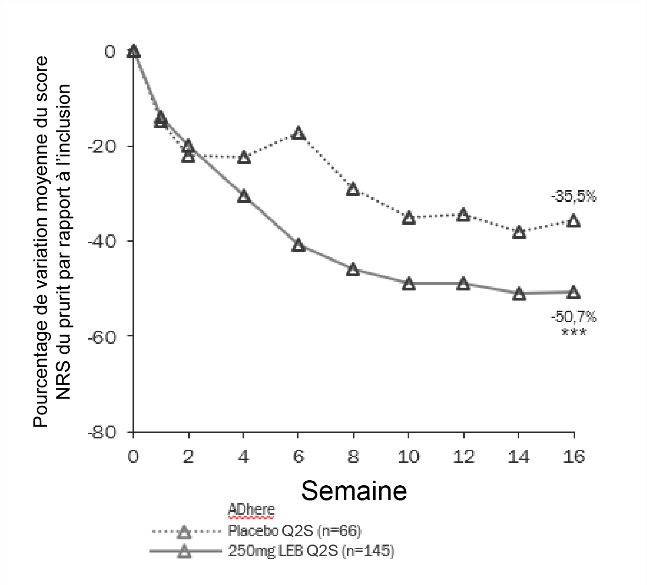
La figure 3 et la figure 4 montrent le pourcentage de variation moyenne du score EASI par rapport à la valeur initiale et le pourcentage de variation moyenne du score NRS du prurit par rapport à la valeur initiale jusqu’à la semaine 16.
|
Figure 3. Pourcentage de variation moyenne des moindres carrés du score EASI par rapport à la valeur initiale de l’étude ADhere
|
Figure 4. Pourcentage de variation moyenne des moindres carrés du score NRS du prurit par rapport à la valeur initiale de l’étude ADhere
| |
|
|
|
|
***p<0,001 par rapport au placebo ***p<0,001 par rapport au placebo
Dans l’étude ADhere, les effets du traitement dans les sous-groupes (poids, âge, sexe, origine ethnique, degré de gravité de la maladie et utilisation préalable de traitements systémiques) étaient conformes aux résultats de l’ensemble de la population étudiée.
Les patients qui étaient répondeurs à la semaine 16 dans l’étude ADhere et qui sont entrés dans l’étude ADjoin étaient traités soit par lébrikizumab 250 mg Q2S, soit par lébrikizumab 250 mg Q4S et ont maintenu leurs réponses jusqu’à 56 semaines (75,4% respectivement 86,8% pour un score IGA de 0 ou 1 et 85,6% respectivement 81,2% pour la réponse EASI 75).
Résultats rapportés par le patient et qualité de vie liée à la santé
Dans les deux études en monothérapie (ADvocate 1 et ADvocate 2), le lébrikizumab 250 mg Q2S a amélioré de manière significative les résultats rapportés par les patients en termes degré de sévérité de la maladie (POEM), de l’impact des démangeaisons sur le sommeil (échelle de perte de sommeil) et de la qualité de vie liée à la santé (DLQI) à la semaine 16 par rapport au placebo. Une proportion significativement plus importante de patients traités par le lébrikizumab ont présenté des améliorations cliniquement significatives du DLQI (défini comme une réduction de ≥4 points par rapport à la référence), du POEM et de l’échelle de perte de sommeil de la référence à la semaine 16 par rapport au groupe placebo (voir tableau 6).
Dans l’étude CST (ADhere), le lébrikizumab 250 mg Q2S + CST a amélioré l’impact des démangeaisons sur le sommeil (échelle de perte de sommeil), le degré de sévérité de la maladie (POEM) rapporté par le patient et la qualité de vie liée à la santé (DLQI) à la semaine 16 par rapport au placebo + CST (voir tableau 6).
Tableau 6. Résultats rapportés par le patient (résultats de la qualité de vie liés à la santé) du lébrikizumab en monothérapie à la semaine 16 dans l’étude ADvocate 1 et ADvocate 2 ou avec traitement concomitant par CST à la semaine 16 dans l’étude ADhere
|
|
ADvocate 1
|
ADvocate 2
|
ADhere
| |
|
Semaine 16
| |
|
Placebo
N = 141
|
LEB 250 mg Q2S
N = 283
|
Placebo
N = 146
|
LEB 250 mg Q2S
N = 281
|
Placebo + CST
N = 66
|
LEB 250 mg Q2S + CST
N = 145
| |
DLQI (adultes) (amélioration ≥4 points), %a
|
33,8
|
75,6**
|
33,6
|
66,3**
|
58,7
|
77,4*
| |
Échelle de perte de sommeil (Sleep-Loss-Scale) (amélioration ≥2 points), %b
|
4,7
|
39.0**
|
8,2
|
28,0**
|
18,4
|
34,5*
| |
POEM; variation de la moyenne des LS par rapport à l’inclusion (± ET)
|
-3,9
(± 0,72)
|
-11,3**
(± 0,47)
|
-3,5
(± 0,77)
|
-9,5**
(± 0,52)
|
-6,24
(± 1,04)
|
-10,23**
(± 0,73)
|
LS = least squares (moindres carrés), ET = écart-type
a Participants avec DLQI ≥4 points par rapport à l’inclusion
b Participants avec ≥2 points dans l’échelle de perte de sommeil par rapport à l’inclusion
*p<0,05; **p<0,001 par rapport au placebo
Adolescents (de 12 à 17 ans)
Dans les études en monothérapie ADvocate 1 et ADvocate 2, l’âge moyen des patients adolescents était de 14,6 ans, le poids moyen de 68,2 kg et de 56,9% étaient des jeunes filles. Dans ces études, 63,7% avaient un score IGA initial de 3 (dermatite atopique modérée), 36,3% avaient un score IGA initial (à l’inclusion) de 4 (dermatite atopique sévère) et 47,1% avaient déjà reçu un traitement systémique. Dans l’étude avec traitement concomitant par CST (ADhere), l’âge moyen des patients adolescents était de 14,6 ans, le poids moyen de 62,2 kg et 50,0% étaient des jeunes filles. Dans cette étude, 76,1% avaient un score IGA initial de 3 (dermatite atopique modérée), 23,9% un score IGA initial de 4 (dermatite atopique sévère) et 23,9% avaient déjà reçu un traitement systémique.
Les résultats d’efficacité à la semaine 16 chez les patients adolescents sont présentés dans le tableau 7.
Tableau 7. Résultats d’efficacité du lébrikizumab en monothérapie dans les études ADvocate 1, ADvocate 2 et du lébrikizumab associé à un CST dans l’étude ADhere à la semaine 16 chez les patients adolescents
|
|
ADvocate 1
|
ADvocate 2
|
ADhere
| |
|
Semaine 16
| |
|
Placebo
N = 18
|
LEB
250 mg Q2S
N = 37
|
Placebo
N = 17
|
LEB
250 mg Q2S
N = 30
|
Placebo + CST
N = 14
|
LEB
250 mg Q2S + CST
N = 32
| |
IGA 0 ou 1, %a
|
22.2
|
48.6
|
5.9
|
44.1**
|
28.6
|
57.3
| |
EASI 75, %a
|
22.2
|
62.2**
|
12.0
|
61.7**
|
57.1
|
88.0*
| |
EASI 90, %a
|
16.7
|
45.9*
|
6.1
|
34.3*
|
28.6
|
55.1
| |
NRS du prurit (amélioration ≥4 points), %b
|
22.8
|
54.3*
|
0.3
|
42.1
|
13.8
|
45.8
| |
a
À la semaine 16, les patients présentant un score IGA de 0 à 1 («sans lésion» ou «lésion minime») avec une réduction ≥2 points par rapport à l’inclusion sur une échelle IGA de 0 à 4 ou une réduction de 75% ou 90% de la réponse EASI entre l’inclusion et la semaine 16.
b Le pourcentage est calculé par rapport au nombre de patients présentant un score NRS du prurit à l’inclusion ≥4.
*p<0,05; **p<0,01 par rapport au placebo.
|
Les patients adolescents traités par lébrikizumab ou lébrikizumab + CST ont obtenu des améliorations cliniquement significatives de la sévérité de la maladie et ont maintenu une réponse jusqu’à la semaine 52. Des données supplémentaires issues de l’étude ADore à bras unique portant sur le lébrikizumab chez 206 adolescents confirment l’efficacité du lébrikizumab chez les patients adolescents jusqu’à 52 semaines de traitement.
|




