CompositionPrincipes actifs
Toxine botulinique de type A (150 kD) à partir de Clostridium botulinum (souche I01).
Excipients
Phosphate disodique dihydraté, phosphate monosodique dihydraté, chlorure de potassium, chlorure de sodium, polysorbate 80, Ltryptophane, eau pour préparations injectables.
Un flacon contient 5,4 mg de sodium, 0,18 mg de potassium et 1,6 mg de polysorbate 80.
Indications/Possibilités d’emploiRelfydess est utilisé pour l'amélioration temporaire de l'apparence:
·des rides glabellaires modérées à sévères observées lors du froncement maximal des sourcils
·des rides canthales latérales modérées à sévères observées lors d'un sourire forcé
seul ou en association chez l'adulte de moins de 65 ans, lorsque la sévérité de ces rides entraîne un retentissement psychologique important chez le patient.
Posologie/Mode d’emploiRelfydess doit être administré uniquement par des médecins ayant les qualifications adéquates, une bonne expérience de ce traitement et disposant de l'équipement nécessaire.
Les unités de toxine botulinique sont différentes d'un médicament à l'autre. Les unités sont spécifiques à Relfydess et ne sont pas interchangeables avec d'autres préparations à base de toxine botulinique.
Un flacon de Relfydess doit être utilisé uniquement pour le traitement d'un seul patient lors d'une seule séance d'injection. Tout excédent de produit non utilisé doit être éliminé après le traitement.
Les doses et les intervalles entre chaque traitement dépendent de l'évaluation de la réponse individuelle du patient. L'intervalle entre deux traitements par Relfydess ne doit pas être inférieur à 12 semaines.
Lors du traitement par Relfydess, seul ou combiné, des rides glabellaires et des rides canthales latérales chez des patients adultes, la prise en compte de la dose cumulée est nécessaire lorsque d'autres produits à base de toxine botulinique sont utilisés ou ont été utilisés pour traiter d'autres indications autorisées par ces produits.
Les points d'injection recommandés pour les rides glabellaires sont décrits à la figure 1, les points d'injection pour les rides canthales latérales sont décrits à la figure 2.
Posologie usuelle
Relfydess est prêt à l'emploi avec une concentration de 10 unités par 0,1 ml et ne nécessite aucune reconstitution.
Tableau 1: instructions posologiques pour Relfydess
|
Traitement(s)
|
Dose totale recommandée
|
Dose par injection
| |
Rides glabellaires
|
50 unités/0,5 ml
|
5 injections de 10 unités/0,1 ml:
2 injections de chaque côté du muscle corrugator et 1 injection dans le muscle procérus près de l'angle nasofrontal (voir Figure 1)
| |
Rides canthales latérales
|
60 unités/0,6 ml
|
6 injections de 10 unités/0,1 ml:
3 injections de chaque côté du muscle orbiculaire de l'œil (voir Figure 2)
| |
Traitement combiné des rides glabellaires et des rides canthales latérales
|
110 unités/1,1 ml
|
Un total de 11 injections de 10 unités/0,1 ml pour le traitement combiné des rides glabellaires et des rides canthales latérales
|
Rides glabellaires
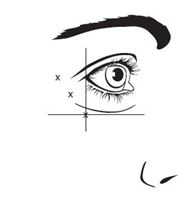
La dose totale recommandée pour le traitement des rides glabellaires chez l'adulte est de 50 unités/0,5 ml administrée par injection intramusculaire, à diviser de manière équitable (10 unités/0,1 ml par injection) en 5 sites d'injection intramusculaire (voir Figure 1): 2 injections de chaque côté du muscle corrugator et 1 injection dans le muscle procérus près de l'angle nasofrontal.
Afin de diminuer le risque de ptose des paupières, les mesures suivantes doivent être prises en compte:
·Éviter les injections à proximité du muscle releveur de la paupière supérieure, en particulier chez les patients dotés de puissants complexes abaisseurs des sourcils
·Les injections latérales dans le muscle corrugator doivent être effectuées à au moins 1 cm au-dessus de la crête osseuse supraorbitaire
·S'assurer que la dose injectée (volume) est exacte
·Éviter d'injecter à moins de 1 cm au-dessus de la partie centrale des sourcils
Figure 1: points d'injection pour les rides glabellaires

Rides canthales latérales
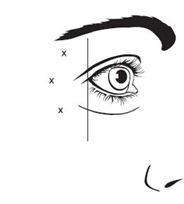
La dose totale recommandée pour le traitement des rides canthales latérales chez l'adulte est de 60 unités/0,6 ml administrée par injection intramusculaire à diviser de manière équitable en 10 unités/0,1 ml dans chacun des 6 points d'injection intramusculaire (voir Figure 2: option 1 et option 2): 3 injections (30 unités/0,3 ml) de chaque côté du muscle orbiculaire de l'œil. Les injections doivent être réalisées avec l'aiguille orientée vers le haut et éloignée de l'œil, dans le muscle orbiculaire de l'œil latéral. Si des rides dans la région canthale latérale apparaissent à la fois au-dessus et en dessous du canthus latéral, injecter selon l'option 1. Si les rides dans la région canthale latérale sont principalement en dessous du canthus latéral, injecter selon l'option 2.
Figure 2: points d'injection pour les rides canthales latérales
|
Option 1: au-dessus et en dessous du canthus latéral
|
Option 2: En dessous du canthus latéral
| |
|
|
|
|
Le repérage anatomique des rides canthales latérales peut être facilité s'il est effectué par l'observation et la palpation lors d'un sourire forcé. Il faut veiller à ne réaliser d'injection dans le muscle zygomatique majeur/mineur afin d'éviter une déformation latérale de la bouche et un sourire asymétrique.
Traitement combiné des rides glabellaires et des rides canthales latérales
Pour le traitement combinant les rides glabellaires et les rides canthales latérales, la dose unitaire et l'administration doivent respecter la dose totale de 110 unités/1,1 ml de Relfydess.
La dose recommandée pour le traitement des rides glabellaires est de 50 unités/0,5 ml (10 unités/0,1 ml par injection dans chacun des 5 points d'injection intramusculaires). La dose recommandée pour le traitement des rides canthales latérales est de 60 unités/0,6 ml (10 unités/0,1 ml dans chacun des 6 points d'injection intramusculaires).
Informations générales
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
En cas d'échec thérapeutique ou de diminution de l'effet après des injections répétées, il convient d'envisager d'autres méthodes thérapeutiques. En cas d'échec du traitement après la première séance, il y a lieu:
·d'analyser les causes de l'échec, telles qu'erreur dans les muscles injectés, technique d'injection inappropriée et formation d'anticorps neutralisant la toxine
·de réévaluer la pertinence du traitement par la toxine botulinique de type A
Durée du traitement
La sécurité et l'efficacité d'injections répétées de Relfydess ont été évaluées pour une période allant jusqu'à 12 mois et pour 7 cycles de traitement répétés au maximum.
Patients âgés
Les données cliniques sur l'utilisation de Relfydess chez les patients de plus de 65 ans sont limitées. L'utilisation de Relfydess chez les personnes de plus de 65 ans n'est pas recommandée.
Enfants et adolescents
La sécurité et l'efficacité de Relfydess pour les personnes de moins de 18 ans n'ont pas été établies. L'utilisation de Relfydess chez les personnes de moins de 18 ans n'est pas recommandée.
Contre-indicationsRelfydess ne doit pas être utilisé en cas:
·d'hypersensibilité au principe actif ou à l'un des excipients selon la composition
·d'infections au niveau des sites d'injection prévus
·de myasthénie grave, de syndrome de Lambert Eaton ou de sclérose latérale amyotrophique
Mises en garde et précautionsGénéralités
Il faut veiller à ne pas injecter Relfydess dans un vaisseau sanguin.
L'utilisation de Relfydess n'est pas recommandée chez les personnes de moins de 18 ans et de plus de 65 ans.
Comme pour toute injection intramusculaire, l'utilisation de Relfydess est déconseillée chez les patients présentant un temps de saignement prolongé.
Réactions d'hypersensibilité
Des cas de réactions d'hypersensibilité graves et/ou immédiates ont été signalés pour les produits à base de toxine botulinique. Ces réactions comprennent l'anaphylaxie, les maladies sériques, l'urticaire, l'œdème des tissus mous et la dyspnée. Si une telle réaction survient, l'injection ultérieure de Relfydess doit être interrompue et un traitement médical approprié doit être instauré sans tarder, dans la mesure où l'équipement et les médicaments nécessaires pour traiter l'anaphylaxie sont disponibles.
Diffusion locale et à distance de l'effet de la toxine
Des données de sécurité post-commercialisation d'autres produits à base de toxine botulinique autorisés suggèrent que des effets de la toxine botulinique peuvent être observés au-delà du site d'injection local. Les symptômes sont cohérents avec le mécanisme d'action des toxines botuliniques et peuvent inclure l'asthénie, la faiblesse musculaire généralisée, la diplopie, la vision floue, le ptosis, la dysphagie, la dysphonie, la dysarthrie, l'incontinence urinaire et les difficultés respiratoires. Ces symptômes sont survenus quelques heures à quelques semaines après l'injection.
Les troubles de la déglutition et les troubles respiratoires peuvent mettre la vie en danger et des cas de décès en lien avec la diffusion des effets de la toxine ont été rapportés. Les patients ayant des antécédents de troubles de la déglutition ou de troubles respiratoires peuvent être plus susceptibles de présenter ces complications. En particulier, après un traitement par toxine botulinique, des cas très rares de décès ont été signalés chez des patients présentant des troubles de la déglutition, une pneumopathie ou une asthénie importante. Par conséquent, le traitement chez ces patients doit se faire uniquement sous la supervision d'un médecin spécialiste et doit être effectué seulement si le bénéfice du traitement est supérieur aux risques.
Les patients ou les aidants doivent être informés de la nécessité de consulter immédiatement un médecin en cas d'apparition de troubles de la déglutition et de l'élocution ou de troubles respiratoires.
Un cas de diffusion de l'effet de la toxine à distance du site d'injection est survenu dans le cadre du programme de développement clinique de Relfydess.
Troubles neuromusculaires préexistants
Relfydess doit être utilisé avec prudence chez les patients présentant un risque de déficit marqué de la transmission neuromusculaire. Ces patients peuvent présenter une sensibilité accrue aux principes actifs tels que la toxine botulinique, et une faiblesse musculaire excessive (incluant des effets systémiques de dysphagie sévère et des atteintes respiratoires) peut apparaître après le traitement. Dans certains de ces cas, la dysphagie a persisté pendant plusieurs mois et a nécessité la mise en place d'une sonde gastrique.
Affections préexistantes au site d'injection
La prudence s'impose lorsque Relfydess est utilisé en présence d'une inflammation au(x) site(s) d'injection proposé(s) ou lorsque le(s) muscle(s) ciblé(s) présente(nt) une faiblesse excessive ou une atrophie.
La prudence s'impose lorsque Relfydess est utilisé chez un patient présentant une asymétrie faciale prononcée, un ptosis, un dermatochalasis excessif, des cicatrices cutanées profondes ou une peau grasse épaisse.
Réactions indésirables ophtalmiques
Une sécheresse oculaire, une faible production lacrymale, une réduction des clignements et des troubles cornéens peuvent survenir lors de l'utilisation de toxines botuliniques. Si les symptômes de sécheresse oculaire (p.ex. irritation oculaire, photophobie ou troubles visuels) persistent, le patient doit être adressé à un ophtalmologue.
Atrophie musculaire
Une atrophie musculaire est probable après un traitement répété de toxine botulinique secondaire à une paralysie flasque des muscles traités.
Formation d'anticorps
Les injections à intervalles trop rapprochés ou à doses trop élevées peuvent augmenter le risque de formation d'anticorps neutralisant la toxine botulinique. Sur le plan clinique, la formation d'anticorps neutralisants est susceptible d'altérer l'efficacité des traitements ultérieurs.
Excipients
Ce médicament contient moins de 1 mmol (39 mg) de potassium par flacon, c.-à-d. qu'il est essentiellement «sans potassium». Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c.-à-d. qu'il est essentiellement «sans sodium».
Ce médicament contient 1,6 mg de polysorbate 80 par flacon, ce qui équivaut à 1,1 mg/ml. Les polysorbates peuvent provoquer des réactions allergiques.
InteractionsAucune étude d'interaction n'a été effectuée.
Le traitement concomitant par Relfydess et d'autres produits à base de toxine botulinique, les aminoglycosides ou autres médicaments agissant sur la transmission neuromusculaire (p.ex. les agents curarisants), les médicaments anticholinergiques et les myorelaxants ne doit être effectué qu'avec prudence, car l'effet de Relfydess peut être potentialisé.
Grossesse, allaitementGrossesse
Il n'existe pas de données appropriées sur l'utilisation de la toxine botulinique de type A chez la femme enceinte. Il n'y a pas suffisamment d'études expérimentales animales évaluant la toxicité sur la reproduction (voir «Données précliniques»). Le risque potentiel chez l'homme n'est pas connu. Relfydess ne doit pas être utilisé pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception.
Allaitement
On ne sait pas si Relfydess est excrété dans le lait maternel. L'excrétion de Relfydess dans le lait n'a pas été étudiée chez l'animal. Relfydess ne doit pas être utilisé pendant l'allaitement.
Fertilité
Il n'existe pas de données cliniques évaluant l'effet de Relfydess sur la fertilité. Aucune étude animale évaluant la fertilité n'a été effectuée. Les études expérimentales animales réalisées avec d'autres préparations contenant de la toxine botulinique de type A ont mis en évidence une diminution de la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesIl a été rapporté que d'autres produits à base de toxine botulinique avaient une légère influence ou une certaine influence sur l'aptitude à la conduite ou l'utilisation de machines. Il existe un risque potentiel de faiblesse musculaire localisée ou de troubles visuels liés à l'utilisation de Relfydess susceptibles d'altérer temporairement l'aptitude à la conduite de véhicules ou l'utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
La majorité des effets indésirables rapportés après un traitement par Relfydess dans les études pivots de phase IIII contrôlées contre placebo étaient d'intensité légère à modérée. Les effets indésirables les plus fréquemment signalés étaient les ecchymoses au site d'injection et les céphalées qui étaient survenues chez environ 2 % des sujets.
En général, les réactions liées à la technique de traitement/d'injection se sont produites dans le mois suivant l'injection et étaient transitoires.
Les effets indésirables proviennent des études pivots de phase III contrôlées contre placebo réalisées avec Relfydess et sont présentés pour chaque terme préférentiel selon les classes de systèmes d'organes (SOC) de la classification MedDRA.
Dans le cadre du traitement combiné des rides glabellaires et des rides canthales latérales, la nature et la fréquence des effets indésirables étaient comparables à celles qui ont été observées lorsque les patients étaient traités pour une seule des indications.
Liste des effets indésirables
La fréquence des réactions indésirables est classée comme suit:
très fréquent (≥1/10); fréquent (≥1/100 à < 1/10); occasionnel (≥1/1000 à < 1/100); rare (≥1/10 000 à < 1/1000); très rare (< 1/10 000); fréquence inconnue (ne peut être estimée sur la base des données disponibles).
Tableau 2: rides glabellaires modérées à sévères
Les effets indésirables listés ci-après ont été observés chez les patients ayant reçu Relfydess pour l'amélioration temporaire de l'apparence des rides glabellaires modérées à sévères.
|
Classe de systèmes d'organes
|
Fréquence
|
Réactions indésirables
| |
Affections du système nerveux
|
Fréquent
|
Céphalées
| |
Affections oculaires
|
Fréquent
|
Ptose des paupières
| |
Affections de la peau et du tissu sous-cutané
|
Occasionnel
|
Ptose sourcilière
| |
Affections musculo-squelettiques et systémiques
|
Occasionnel
|
Faiblesse musculaire
| |
Troubles généraux et anomalies au site d'administration
|
Fréquent
|
Ecchymoses au site d'injection
|
Tableau 3: rides canthales latérales modérées à sévères
Les effets indésirables listés ci-après ont été observés chez les patients ayant reçu Relfydess pour l'amélioration temporaire de l'apparence des rides canthales latérales modérées à sévères.
|
Classe de systèmes d'organes
|
Fréquence
|
Réactions indésirables
| |
Affections du système nerveux
|
Fréquent
|
Céphalées
| |
Affections musculo-squelettiques et systémiques
|
Occasionnel
|
Faiblesse musculaire
| |
Troubles généraux et anomalies au site d'administration
|
Fréquent
|
Ecchymoses au site d'injection
| |
Occasionnel
|
Douleurs au site d'injection
|
EIST apparentés* (réactions au site d'injection)
En outre, les effets indésirables survenus au cours du traitement (EIST) suivants ont été mentionnés en lien avec des réactions au site d'injection chez des sujets traités par Relfydess (ayant reçu ≥50 unités) dans le «pool de toutes les études contrôlées contre placebo»: prurit au site d'injection, tuméfaction, érythème, gêne, hématome, hypersensibilité et sensation de chaleur.
EIST apparentés* (élévation latérale des sourcils)
Un EIST apparenté d'intensité légère se manifestant sous forme d'élévation latérale des sourcils (effet Méphisto) a été signalé dans le cadre d'une étude à long terme en ouvert chez un sujet. Cet évènement a régressé après trois semaines. Il en découle une incidence globale de 0,06 % (1/1708 sujets) pour l'élévation latérale des sourcils dans le pool de sécurité des études de phase III, au cours desquelles les sujets ont reçu ≥50 unités.
* considérés par l'investigateur pour chaque évènement indésirable isolé comme étant en lien avec Relfydess
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageSignes et symptômes
L'administration de doses excessives de toxine botulinique est susceptible de produire une paralysie neuromusculaire importante et profonde. Un surdosage peut entraîner un risque accru de pénétration de la toxine botulinique dans la circulation sanguine et provoquer des complications qui sont apparentées aux effets d'une intoxication orale par la toxine botulinique (p.ex. dysphagie et dysphonie).
Il est possible que les symptômes de surdosage ne se manifestent pas immédiatement après l'injection. En cas d'injection ou d'ingestion accidentelle, le patient doit être mis sous observation médicale pendant plusieurs semaines afin de rechercher d'éventuels signes et/ou symptômes de faiblesse excessive ou de paralysie musculaire.
Traitement
Une hospitalisation doit être envisagée chez les patients présentant des symptômes manifestes de surdosage à la toxine botulinique.
En cas de surdosage, une surveillance médicale du patient doit être instaurée pour rechercher d'éventuels signes et/ou symptômes de faiblesse musculaire excessive ou de paralysie musculaire. Des soins de soutien généraux sont recommandés et, si nécessaire, un traitement symptomatique sera mis en œuvre. Si le surdosage induit une paralysie des muscles respiratoires, une assistance respiratoire peut s'avérer nécessaire.
Propriétés/EffetsCode ATC
M03AX01
Mécanisme d'action
Le mécanisme d'action connu des produits à base de toxine botulinique de type A consiste à bloquer la libération d'acétylcholine au niveau de la synapse des neurones présynaptiques. La chaîne lourde de la toxine botulique de type A permet la fixation et l'internalisation de la toxine protéique, tandis que la chaîne légère est une enzyme qui clive la protéine associée au synaptosome de 25 kDa (SNAP-25).
Après injection intramusculaire, la toxine induit une paralysie partielle du muscle concerné, ce qui réduit de manière transitoire l'activité du muscle entraînant une diminution temporaire des rides glabellaires ou des rides canthales latérales. Les produits à base de toxine botulinique de type A ont une longue durée d'action chez les animaux et les humains qui est détectée pendant des semaines voire des mois. La fonction musculaire se rétablit peu à peu lorsque les fibres nerveuses repoussent en formant de nouvelles terminaisons nerveuses afin d'innerver les muscles et d'inverser la dénervation induite par l'administration de la toxine.
Pharmacodynamique
L'un des effets connus des produits à base de toxine botulinique de type A est le blocage de la libération d'acétylcholine au niveau de la synapse des neurones présynaptiques.
Efficacité clinique
Les données décrites ci-dessous résultent des études de phase III contrôlées contre placebo READY-1, READY-2 et READY-3. Un total de 1 012 patients a été inclus dans 3 études pivots, dont 806 patients ont été traités par Relfydess et 206 patients par placebo. 902 patients supplémentaires ont également été traités par Relfydess dans le cadre d'une étude de sécurité à long terme en ouvert (étude READY-4). 1 708 patients au total ont été traités par Relfydess au cours de toutes les études de phase III.
La fonction psychologique des sujets a été observée au moyen de l'échelle FACE-Q™ qui permet de déterminer le bien-être psychique (comprenant les évaluations des sujets concernant l'estime de soi, les sentiments positifs, le sentiment de bien-être, le sentiment de bonheur, la satisfaction de soi-même, l'acceptation de soi, la confiance en soi, le pouvoir de séduction et l'image flatteuse de soi).
L'échelle FLTSQ (Facial Line Treatment Satisfaction Questionnaire - questionnaire de satisfaction du traitement des rides du visage) a été utilisée pour déterminer la satisfaction des sujets concernant l'apparence des rides glabellaires et/ou des rides canthales latérales (les sujets ont évalué s'ils se sentaient bien en adoptant certaines expressions ou positions du visage, si les rides sont visibles, si la peau est lisse, si elle a un aspect jeune, si elle a bel aspect pour son âge, si elle est décontractée, si elle a un aspect séduisant, si elle est reposée et si elle est régénérée), mais également pour déterminer la satisfaction des sujets vis-à-vis du traitement (les sujets ont évalué s'ils sont satisfaits du renouvellement du traitement, des recommandations thérapeutiques, des résultats attendus, de l'aspect naturel du visage, du choix du traitement adéquat, des résultats du traitement, mais aussi du résultat du traitement en lui-même et de l'amélioration induite par le traitement).
Les réponses sur l'échelle FACE-Q™ évaluant la fonction psychologique et sur l'échelle FLTSQ ont indiqué que les sujets traités par Relfydess ont présenté une amélioration de la fonction psychologique et étaient plus satisfaits de leur traitement et de leur apparence que les sujets sous placebo à tous les moments post-traitement. Selon l'évaluation au moyen des échelles FACE-Q™ et FLTSQ, la fonction psychologique positive et la satisfaction des sujets se sont maintenues pendant 6 mois après le traitement.
Les patients recevant Relfydess (1 699 au total) ont été testés à l'inclusion à la recherche de formation d'anticorps anti-médicament, puis après chaque traitement. Aucun patient n'a été testé positif aux anticorps neutralisants de la toxine.
Rides glabellaires (études READY-1 et READY-3)
Au cours de deux études pivots de phase III, multicentriques, en double aveugle, contrôlées contre placebo, 451 patients ont été traités pour des rides glabellaires à la dose recommandée de 50 unités. L'étude READY-1 a évalué le traitement par Relfydess des rides glabellaires uniquement; l'étude READY-3 a évalué le traitement combiné des rides glabellaires et des rides canthales latérales. Les résultats de l'étude READY-3 sont décrits pour les patients qui ont reçu Relfydess pour le traitement combiné des rides glabellaires et des rides canthales latérales.
Le critère principal d'efficacité était la proportion de répondeurs, définie comme l'obtention d'un score de 0 ou 1 sur l'échelle à 4 points GL-ILA (Investigator Live Assessment - évaluation en direct par l'investigateur) évaluant la sévérité des rides glabellaires au froncement maximal des sourcils lors de la visite prévue à 1 mois. La majorité des sujets aussi bien dans le groupe Relfydess que dans le groupe placebo présentaient des rides glabellaires sévères à l'inclusion selon l'évaluation du médecin investigateur (74,5 % et 75,8 % respectivement).
Le succès du traitement évalué par le médecin investigateur en termes d'intensité de la sévérité des rides glabellaires (échelle à 4 points GL-ILA [0 = aucun, 1 = légère, 2 = modérée, 3 = sévère] au froncement maximal des sourcils) était statistiquement significativement supérieur (p < 0,001) dans le groupe Relfydess comparé au groupe placebo après un mois (Tableau 4).
Tableau 4: évaluation par le médecin investigateur du succès du traitement des rides glabellairesa (% et nombre de sujets) à 1 moisb dans les études cliniques en double aveugle, contrôlées contre placebo
|
Étude
|
Relfydess 50 unités rides glabellaires
|
Relfydess 50 unités rides glabellaires et 60 unités rides canthales latérales
|
Placebo
| |
Étude READY-1, rides glabellaires uniquement
|
96,3 %
N = 199
|
-
|
4,5 %
N = 67
| |
Étude READY-3 rides canthales latérales et rides glabellaires
|
94,3 %
N = 106
|
96,3 %
N = 108
|
1,8 %
N = 55
|
a Obtention d'un score de 0 ou 1 en termes de sévérité des rides glabellaires sur l'échelle GL-ILA
b Critère principal d'efficacité au jour 30; p < 0,001
Les analyses en sous-groupes du critère principal d'efficacité, à savoir les taux de réponse sur la base de l'échelle à 4 points GL-ILA au froncement maximal des sourcils à 1 mois, ont démontré l'efficacité de Relfydess indépendamment de l'âge, de la race, d'un traitement antérieur par la toxine botulinique ou de la sévérité initiale évaluée sur l'échelle GL-ILA au froncement maximal des sourcils.
Chez les sujets ayant obtenu un score de 0 ou 1 sur l'échelle photographique à 4 points GL-ILA et sur l'échelle statique à 4 points GL-SLA au froncement maximal des sourcils, le nombre moyen de jours jusqu'à la baisse du score de 0 ou 1 était de 168 jours (24 semaines) dans l'étude READY-1 et de 140 jours (20 semaines) dans l'étude READY-3.
1 mois après l'injection, une amélioration d'au moins un grade au niveau des rides glabellaires au froncement maximal des sourcils a été observée chez 98 % des patients traités par Relfydess dans l'étude READY-1 et l'étude READY-3 sur la base de l'évaluation de la sévérité des rides glabellaires par les médecins investigateurs. 6 mois après l'injection, 58 % des patients traités par Relfydess de l'étude READY-1 et 46 % de l'étude READY-3 présentaient toujours une amélioration en comparaison avec les patients traités par placebo (10 % dans l'étude READY-1 et 4 % dans l'étude READY-3, p < 0,001).
Pour ces sujets de l'étude READY-1, le nombre médian de jours jusqu'au retour au score initial en termes de sévérité des rides glabellaires n'a pas pu être calculé, la moitié des sujets n'ayant pas atteint à nouveau le score initial d'ici la fin de l'étude (≥24 semaines). 75 % des sujets du groupe Relfydess ont atteint à nouveau le score initial après 169 jours (> 24 semaines). Chez les sujets de l'étude READY-3, le nombre médian de jours jusqu'au retour au score initial était de 179 jours (26 semaines) dans le pool de traitement des rides glabellaires du groupe Relfydess, de 172 jours (25 semaines) dans le groupe Relfydess-rides glabellaires/placebo rides canthales latérales et de 189 jours (27 semaines) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales.
Une amélioration de la sévérité des rides glabellaires a été constatée par le médecin investigateur dans le groupe Relfydess en comparaison avec le groupe placebo sur une période de 6 mois (Figure 3).
Figure 3: évaluation par le médecin investigateur et les sujets du taux de réponse obtenu avec Relfydess pour les rides glabellaires (obtention d'un score de aucuna ou légèreb en termes d'intensité de la sévérité des rides glabellaires) en comparaison avec le placebo au fil du temps (étude READY-1)c, d
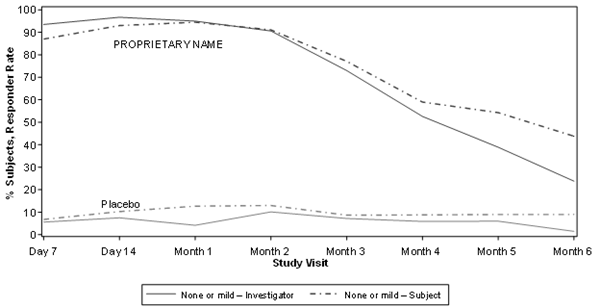
a Aucun point = 0
b Évaluation d'une sévérité d'intensité légère = 1
c Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points GL-ILA au froncement maximal des sourcils dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 6
d Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points GL-SLA au froncement maximal des sourcils dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 6
En cas de traitement combiné des rides canthales latérales, la réponse (obtention d'un score de 0 ou de 1 sur l'échelle GL-ILA au froncement maximal des sourcils) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales était statistiquement significativement supérieur par rapport au groupe placebo-rides glabellaires/placebo-rides canthales latérales pendant l'ensemble des 6 mois suivant le traitement.
Rides canthales latérales (études READY-2 et READY-3)
Au cours de deux études pivots de phase III, multicentriques, en double aveugle, contrôlées contre placebo, 471 patients ont été traités pour des rides canthales latérales à la dose recommandée de 60 unités. L'étude READY-2 a évalué Relfydess uniquement pour le traitement des rides canthales latérales; l'étude READY-3 a évalué le traitement combiné des rides glabellaires et des rides canthales latérales. Les résultats de l'étude READY-3 sont décrits pour les patients qui ont reçu Relfydess pour le traitement combiné des rides glabellaires et des rides canthales latérales.
Le critère principal d'efficacité était la proportion de sujets ayant obtenu un score de 0 ou 1 sur l'échelle à 4 points LCL-ILA (LCL-Investigator Live Assessment - évaluation en direct par l'investigateur) en termes de sévérité des rides canthales latérales au sourire forcé, à la visite à 1 mois. Environ 40 % des sujets aussi bien dans le groupe Relfydess que dans le groupe placebo présentaient bilatéralement des rides canthales latérales symétriques sévères à l'inclusion selon l'évaluation du médecin investigateur (42,3 % et 42,7 % respectivement).
Le succès du traitement évalué par le médecin investigateur (LCL-Investigator Live Assessment - évaluation en direct par l'investigateur en termes d'intensité de la sévérité des rides canthales latérales sur l'échelle à 4 points [0 = aucun, 1 = légère, 2 = modérée, 3 = sévère] au sourire forcé) était statistiquement significativement supérieur (p < 0,001) dans le groupe Relfydess comparé au groupe placebo après un mois (Tableau 5).
Tableau 5: évaluation par l'investigateur du succès du traitement des rides canthales latéralesa (% et nombre de sujets) à 1 moisb dans des études cliniques en double aveugle et contrôlées contre placebo
|
Étude
|
Relfydess 60 unités rides canthales latérales
|
Relfydess 60 unités rides canthales latérales et 50 unités rides glabellaires
|
Placebo
| |
Étude READY-2, rides canthales latérales uniquement
|
87,2 %
N = 204
|
-
|
11,9 %
N = 69
| |
Étude READY-3 rides canthales latérales et rides glabellaires
|
78,1 %
N = 117
|
83,3 %
N = 108
|
19,3 %
N = 55
|
a a obtenu un score de 0 ou 1 en termes de sévérité des rides canthales latérales sur l'échelle LCL-ILA
b Critère principal d'efficacité au jour 30; p < 0,001
Les analyses en sous-groupes du critère principal d'efficacité, à savoir les taux de répondeurs sur la base de l'échelle photographique à 4 points LCL--ILA au sourire forcé à 1 mois ont démontré l'efficacité de Relfydess indépendamment de l'âge, de la race, d'un traitement antérieur par la toxine botulinique ou de la sévérité initiale sur l'échelle LCL-ILA au sourire forcé.
Chez les sujets ayant obtenu un score de 0 ou de 1 sur l'échelle à 4 points LCL-ILA et sur l'échelle statique à 4 points LCL-SLA au sourire forcé, le nombre médian de jours jusqu'à la baisse du score de 0 ou de 1 était de 144 jours (21 semaines) dans le pool rides canthales latérales du groupe Relfydess, de 162 jours (23 semaines) dans l'étude READY-2, de 140 jours (20 semaines) dans le groupe placebo-rides glabellaires/Relfydess-rides canthales latérales et de 142 jours (20 semaines) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales de l'étude READY-3.
1 mois après l'injection, une amélioration d'au moins un grade au niveau des rides canthales latérales au sourire forcé a été observée chez 93 % des patients traités par Relfydess dans l'étude READY-2 et l'étude READY-3 sur la base de l'évaluation de la sévérité des rides canthales latérales par le médecin investigateur. 6 mois après l'injection, 36 % des patients traités par Relfydess de l'étude READY-2 et 33 % de l'étude READY-3 présentaient toujours une amélioration en comparaison avec les patients traités par placebo (15 % dans l'étude READY-2 et 13 % dans l'étude READY-3, p < 0,003).
Chez ces sujets, le nombre médian de jours jusqu'au retour au score initial en termes de sévérité des rides canthales latérales était de 173 jours (25 semaines) dans le pool de traitement des rides canthales latérales du groupe Relfydess et dans l'étude READY-2, de 168 jours (24 semaines) dans le groupe placebo-rides glabellaires/Relfydess-rides canthales latérales et de 174 jours (25 semaines) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales de l'étude READY-3. Dans l'étude READY-2, 75 % des sujets du groupe Relfydess avaient atteint à nouveau le score initial après 147 jours (21 semaines) et après 141 jours (20 semaines) dans le groupe rides canthales latérales. Dans l'étude READY-3, 75 % des sujets du groupe placebo-rides glabellaires/Relfydess-rides canthales latérales avaient atteint à nouveau le score initial après 139 jours (20 semaines) et les sujets du groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales après 147 jours (21 semaines).
L'amélioration de la sévérité des rides canthales latérales évaluée par les médecins investigateurs et les sujets a été démontrée pendant une période allant au-delà de 6 mois dans le groupe Relfydess en comparaison avec le groupe placebo (Figure 4).
Figure 4: évaluation par les investigateurs et les sujets du taux de réponse obtenu avec Relfydess pour les rides canthales latérales (obtention d'un score de aucuna ou légèreb en termes d'intensité de la sévérité des rides canthales latérales) en comparaison avec le placebo au fil du temps (étude READY-2)c, d

a Aucun point = 0
b Évaluation d'une sévérité d'intensité légère = 1
c Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points LCL-ILA au sourire forcé dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 5; mois 6, valeur p = 0,002
d Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points LCL-SLA au sourire forcé dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 6.
En cas de traitement combiné des rides glabellaires, la réponse (obtention d'un score de 0 ou de 1 sur l'échelle LCL-ILA au sourire forcé) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales était statistiquement significativement supérieur par rapport au groupe placebo-rides glabellaires/placebo-rides canthales latérales à tous les moments post-traitement sauf à 6 mois (p = 0,052).
Étude en ouvert (étude READY-4)
L'étude READY-4 était une étude en ouvert, de phase IIII, multicentrique évaluant la sécurité d'injections répétées de Relfydess pour le traitement à long terme des rides glabellaires et des rides canthales latérales modérées à sévères (avec un intervalle d'au moins 12 semaines entre les cycles de traitement).
Dans l'étude READY-4, l'administration de Relfydess allant jusqu'à 110 U.I. et la réalisation jusqu'à un total de 7 traitements des rides glabellaires et/ou des rides canthales latérales pendant une période d'étude de 52 semaines ont mis en évidence des résultats favorables en termes d'efficacité aussi bien pour les rides glabellaires que pour les rides canthales latérales, indépendamment du fait qu'elles aient été traitées concomitamment ou séparément les unes des autres.
PharmacocinétiqueAbsorption
Il n'est pas attendu que Relfydess soit présent dans le sang périphérique à des concentrations mesurables après injection intramusculaire à la dose recommandée. Par conséquent, aucune étude pharmacocinétique n'a été réalisée.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Cinétique pour certains groupes de patients
Aucune donnée.
Données précliniquesLes données précliniques issues des études conventionnelles sur la toxicité aiguë et la toxicité en administration répétée n'ont pas révélé de risque particulier pour l'homme.
Mutagénicité et carcinogénicité
Aucune étude évaluant le potentiel génotoxique ou carcinogène de Relfydess n'a été effectuée.
Toxicité sur la reproduction
Aucune étude de fertilité et d'embryotoxicité n'a été effectuée avec Relfydess. Toutefois, après des doses élevées d'autres produits à base de toxine botulinique de type A, une altération de la fertilité des mâles et des femelles a été observée chez le rat. Des effets embryofœtaux ont été observés dans des études de reproduction effectuées avec une autre toxine botulinique de type A. Les effets sur le développement périnatal/postnatal n'ont pas été étudiés.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C). Ne pas congeler.
Conserver le récipient dans l'emballage d'origine pour le protéger de la lumière.
Tenir hors de portée des enfants.
Le flacon non ouvert peut être conservé protégé de la lumière à une température maximale de 25°C pendant 24 heures.
Remarques concernant la manipulation
Immédiatement après avoir traité le patient, toute solution résiduelle de Relfydess présente dans l'ampoule ou dans la seringue doit être inactivée avec une solution diluée d'hypochlorite de sodium ou une solution d'hydroxyde de sodium.
Tout médicament non utilisé ou déchet doit être éliminé conformément aux prescriptions locales.
Recommandations en cas d'incident lors de la manipulation de la toxine botulinique:
·Toute projection du produit doit être essuyée avec un tissu absorbant sec
·Les surfaces contaminées seront nettoyées à l'aide d'hypochlorite de sodium ou d'hydroxyde de sodium, puis séchées
·En cas de bris de flacon, procéder comme indiqué ci-dessus, ramasser soigneusement les particules de verre et essuyer le produit en évitant les coupures cutanées
·En cas de contact avec la peau, laver la zone touchée avec de l'eau et du savon
·En cas de contact avec les yeux, rincer abondamment avec de l'eau ou avec une solution ophtalmique de lavage oculaire
·En cas de contact du produit avec une blessure, une coupure ou une peau lésée, rincer abondamment avec de l'eau et consulter un médecin
Ces instructions d'utilisation, de manipulation et d'élimination doivent être strictement respectées.
Numéro d’autorisation69620 (Swissmedic)
PrésentationEmballage contenant 1 flacon de solution injectable de 100 unités/ml. [A]
Emballage contenant 10 flacons de solution injectable de 100 unités/ml. [A]
Titulaire de l’autorisationIpsen Pharma Schweiz GmbH, 6300 Zoug
Mise à jour de l’informationOctobre 2024
|





