Propriétés/EffetsCode ATC
M03AX01
Mécanisme d'action
Le mécanisme d'action connu des produits à base de toxine botulinique de type A consiste à bloquer la libération d'acétylcholine au niveau de la synapse des neurones présynaptiques. La chaîne lourde de la toxine botulique de type A permet la fixation et l'internalisation de la toxine protéique, tandis que la chaîne légère est une enzyme qui clive la protéine associée au synaptosome de 25 kDa (SNAP-25).
Après injection intramusculaire, la toxine induit une paralysie partielle du muscle concerné, ce qui réduit de manière transitoire l'activité du muscle entraînant une diminution temporaire des rides glabellaires ou des rides canthales latérales. Les produits à base de toxine botulinique de type A ont une longue durée d'action chez les animaux et les humains qui est détectée pendant des semaines voire des mois. La fonction musculaire se rétablit peu à peu lorsque les fibres nerveuses repoussent en formant de nouvelles terminaisons nerveuses afin d'innerver les muscles et d'inverser la dénervation induite par l'administration de la toxine.
Pharmacodynamique
L'un des effets connus des produits à base de toxine botulinique de type A est le blocage de la libération d'acétylcholine au niveau de la synapse des neurones présynaptiques.
Efficacité clinique
Les données décrites ci-dessous résultent des études de phase III contrôlées contre placebo READY-1, READY-2 et READY-3. Un total de 1 012 patients a été inclus dans 3 études pivots, dont 806 patients ont été traités par Relfydess et 206 patients par placebo. 902 patients supplémentaires ont également été traités par Relfydess dans le cadre d'une étude de sécurité à long terme en ouvert (étude READY-4). 1 708 patients au total ont été traités par Relfydess au cours de toutes les études de phase III.
La fonction psychologique des sujets a été observée au moyen de l'échelle FACE-Q™ qui permet de déterminer le bien-être psychique (comprenant les évaluations des sujets concernant l'estime de soi, les sentiments positifs, le sentiment de bien-être, le sentiment de bonheur, la satisfaction de soi-même, l'acceptation de soi, la confiance en soi, le pouvoir de séduction et l'image flatteuse de soi).
L'échelle FLTSQ (Facial Line Treatment Satisfaction Questionnaire - questionnaire de satisfaction du traitement des rides du visage) a été utilisée pour déterminer la satisfaction des sujets concernant l'apparence des rides glabellaires et/ou des rides canthales latérales (les sujets ont évalué s'ils se sentaient bien en adoptant certaines expressions ou positions du visage, si les rides sont visibles, si la peau est lisse, si elle a un aspect jeune, si elle a bel aspect pour son âge, si elle est décontractée, si elle a un aspect séduisant, si elle est reposée et si elle est régénérée), mais également pour déterminer la satisfaction des sujets vis-à-vis du traitement (les sujets ont évalué s'ils sont satisfaits du renouvellement du traitement, des recommandations thérapeutiques, des résultats attendus, de l'aspect naturel du visage, du choix du traitement adéquat, des résultats du traitement, mais aussi du résultat du traitement en lui-même et de l'amélioration induite par le traitement).
Les réponses sur l'échelle FACE-Q™ évaluant la fonction psychologique et sur l'échelle FLTSQ ont indiqué que les sujets traités par Relfydess ont présenté une amélioration de la fonction psychologique et étaient plus satisfaits de leur traitement et de leur apparence que les sujets sous placebo à tous les moments post-traitement. Selon l'évaluation au moyen des échelles FACE-Q™ et FLTSQ, la fonction psychologique positive et la satisfaction des sujets se sont maintenues pendant 6 mois après le traitement.
Les patients recevant Relfydess (1 699 au total) ont été testés à l'inclusion à la recherche de formation d'anticorps anti-médicament, puis après chaque traitement. Aucun patient n'a été testé positif aux anticorps neutralisants de la toxine.
Rides glabellaires (études READY-1 et READY-3)
Au cours de deux études pivots de phase III, multicentriques, en double aveugle, contrôlées contre placebo, 451 patients ont été traités pour des rides glabellaires à la dose recommandée de 50 unités. L'étude READY-1 a évalué le traitement par Relfydess des rides glabellaires uniquement; l'étude READY-3 a évalué le traitement combiné des rides glabellaires et des rides canthales latérales. Les résultats de l'étude READY-3 sont décrits pour les patients qui ont reçu Relfydess pour le traitement combiné des rides glabellaires et des rides canthales latérales.
Le critère principal d'efficacité était la proportion de répondeurs, définie comme l'obtention d'un score de 0 ou 1 sur l'échelle à 4 points GL-ILA (Investigator Live Assessment - évaluation en direct par l'investigateur) évaluant la sévérité des rides glabellaires au froncement maximal des sourcils lors de la visite prévue à 1 mois. La majorité des sujets aussi bien dans le groupe Relfydess que dans le groupe placebo présentaient des rides glabellaires sévères à l'inclusion selon l'évaluation du médecin investigateur (74,5 % et 75,8 % respectivement).
Le succès du traitement évalué par le médecin investigateur en termes d'intensité de la sévérité des rides glabellaires (échelle à 4 points GL-ILA [0 = aucun, 1 = légère, 2 = modérée, 3 = sévère] au froncement maximal des sourcils) était statistiquement significativement supérieur (p < 0,001) dans le groupe Relfydess comparé au groupe placebo après un mois (Tableau 4).
Tableau 4: évaluation par le médecin investigateur du succès du traitement des rides glabellairesa (% et nombre de sujets) à 1 moisb dans les études cliniques en double aveugle, contrôlées contre placebo
|
Étude
|
Relfydess 50 unités rides glabellaires
|
Relfydess 50 unités rides glabellaires et 60 unités rides canthales latérales
|
Placebo
| |
Étude READY-1, rides glabellaires uniquement
|
96,3 %
N = 199
|
-
|
4,5 %
N = 67
| |
Étude READY-3 rides canthales latérales et rides glabellaires
|
94,3 %
N = 106
|
96,3 %
N = 108
|
1,8 %
N = 55
|
a Obtention d'un score de 0 ou 1 en termes de sévérité des rides glabellaires sur l'échelle GL-ILA
b Critère principal d'efficacité au jour 30; p < 0,001
Les analyses en sous-groupes du critère principal d'efficacité, à savoir les taux de réponse sur la base de l'échelle à 4 points GL-ILA au froncement maximal des sourcils à 1 mois, ont démontré l'efficacité de Relfydess indépendamment de l'âge, de la race, d'un traitement antérieur par la toxine botulinique ou de la sévérité initiale évaluée sur l'échelle GL-ILA au froncement maximal des sourcils.
Chez les sujets ayant obtenu un score de 0 ou 1 sur l'échelle photographique à 4 points GL-ILA et sur l'échelle statique à 4 points GL-SLA au froncement maximal des sourcils, le nombre moyen de jours jusqu'à la baisse du score de 0 ou 1 était de 168 jours (24 semaines) dans l'étude READY-1 et de 140 jours (20 semaines) dans l'étude READY-3.
1 mois après l'injection, une amélioration d'au moins un grade au niveau des rides glabellaires au froncement maximal des sourcils a été observée chez 98 % des patients traités par Relfydess dans l'étude READY-1 et l'étude READY-3 sur la base de l'évaluation de la sévérité des rides glabellaires par les médecins investigateurs. 6 mois après l'injection, 58 % des patients traités par Relfydess de l'étude READY-1 et 46 % de l'étude READY-3 présentaient toujours une amélioration en comparaison avec les patients traités par placebo (10 % dans l'étude READY-1 et 4 % dans l'étude READY-3, p < 0,001).
Pour ces sujets de l'étude READY-1, le nombre médian de jours jusqu'au retour au score initial en termes de sévérité des rides glabellaires n'a pas pu être calculé, la moitié des sujets n'ayant pas atteint à nouveau le score initial d'ici la fin de l'étude (≥24 semaines). 75 % des sujets du groupe Relfydess ont atteint à nouveau le score initial après 169 jours (> 24 semaines). Chez les sujets de l'étude READY-3, le nombre médian de jours jusqu'au retour au score initial était de 179 jours (26 semaines) dans le pool de traitement des rides glabellaires du groupe Relfydess, de 172 jours (25 semaines) dans le groupe Relfydess-rides glabellaires/placebo rides canthales latérales et de 189 jours (27 semaines) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales.
Une amélioration de la sévérité des rides glabellaires a été constatée par le médecin investigateur dans le groupe Relfydess en comparaison avec le groupe placebo sur une période de 6 mois (Figure 3).
Figure 3: évaluation par le médecin investigateur et les sujets du taux de réponse obtenu avec Relfydess pour les rides glabellaires (obtention d'un score de aucuna ou légèreb en termes d'intensité de la sévérité des rides glabellaires) en comparaison avec le placebo au fil du temps (étude READY-1)c, d
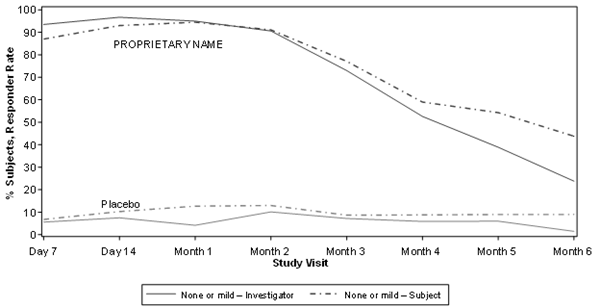
a Aucun point = 0
b Évaluation d'une sévérité d'intensité légère = 1
c Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points GL-ILA au froncement maximal des sourcils dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 6
d Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points GL-SLA au froncement maximal des sourcils dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 6
En cas de traitement combiné des rides canthales latérales, la réponse (obtention d'un score de 0 ou de 1 sur l'échelle GL-ILA au froncement maximal des sourcils) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales était statistiquement significativement supérieur par rapport au groupe placebo-rides glabellaires/placebo-rides canthales latérales pendant l'ensemble des 6 mois suivant le traitement.
Rides canthales latérales (études READY-2 et READY-3)
Au cours de deux études pivots de phase III, multicentriques, en double aveugle, contrôlées contre placebo, 471 patients ont été traités pour des rides canthales latérales à la dose recommandée de 60 unités. L'étude READY-2 a évalué Relfydess uniquement pour le traitement des rides canthales latérales; l'étude READY-3 a évalué le traitement combiné des rides glabellaires et des rides canthales latérales. Les résultats de l'étude READY-3 sont décrits pour les patients qui ont reçu Relfydess pour le traitement combiné des rides glabellaires et des rides canthales latérales.
Le critère principal d'efficacité était la proportion de sujets ayant obtenu un score de 0 ou 1 sur l'échelle à 4 points LCL-ILA (LCL-Investigator Live Assessment - évaluation en direct par l'investigateur) en termes de sévérité des rides canthales latérales au sourire forcé, à la visite à 1 mois. Environ 40 % des sujets aussi bien dans le groupe Relfydess que dans le groupe placebo présentaient bilatéralement des rides canthales latérales symétriques sévères à l'inclusion selon l'évaluation du médecin investigateur (42,3 % et 42,7 % respectivement).
Le succès du traitement évalué par le médecin investigateur (LCL-Investigator Live Assessment - évaluation en direct par l'investigateur en termes d'intensité de la sévérité des rides canthales latérales sur l'échelle à 4 points [0 = aucun, 1 = légère, 2 = modérée, 3 = sévère] au sourire forcé) était statistiquement significativement supérieur (p < 0,001) dans le groupe Relfydess comparé au groupe placebo après un mois (Tableau 5).
Tableau 5: évaluation par l'investigateur du succès du traitement des rides canthales latéralesa (% et nombre de sujets) à 1 moisb dans des études cliniques en double aveugle et contrôlées contre placebo
|
Étude
|
Relfydess 60 unités rides canthales latérales
|
Relfydess 60 unités rides canthales latérales et 50 unités rides glabellaires
|
Placebo
| |
Étude READY-2, rides canthales latérales uniquement
|
87,2 %
N = 204
|
-
|
11,9 %
N = 69
| |
Étude READY-3 rides canthales latérales et rides glabellaires
|
78,1 %
N = 117
|
83,3 %
N = 108
|
19,3 %
N = 55
|
a a obtenu un score de 0 ou 1 en termes de sévérité des rides canthales latérales sur l'échelle LCL-ILA
b Critère principal d'efficacité au jour 30; p < 0,001
Les analyses en sous-groupes du critère principal d'efficacité, à savoir les taux de répondeurs sur la base de l'échelle photographique à 4 points LCL--ILA au sourire forcé à 1 mois ont démontré l'efficacité de Relfydess indépendamment de l'âge, de la race, d'un traitement antérieur par la toxine botulinique ou de la sévérité initiale sur l'échelle LCL-ILA au sourire forcé.
Chez les sujets ayant obtenu un score de 0 ou de 1 sur l'échelle à 4 points LCL-ILA et sur l'échelle statique à 4 points LCL-SLA au sourire forcé, le nombre médian de jours jusqu'à la baisse du score de 0 ou de 1 était de 144 jours (21 semaines) dans le pool rides canthales latérales du groupe Relfydess, de 162 jours (23 semaines) dans l'étude READY-2, de 140 jours (20 semaines) dans le groupe placebo-rides glabellaires/Relfydess-rides canthales latérales et de 142 jours (20 semaines) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales de l'étude READY-3.
1 mois après l'injection, une amélioration d'au moins un grade au niveau des rides canthales latérales au sourire forcé a été observée chez 93 % des patients traités par Relfydess dans l'étude READY-2 et l'étude READY-3 sur la base de l'évaluation de la sévérité des rides canthales latérales par le médecin investigateur. 6 mois après l'injection, 36 % des patients traités par Relfydess de l'étude READY-2 et 33 % de l'étude READY-3 présentaient toujours une amélioration en comparaison avec les patients traités par placebo (15 % dans l'étude READY-2 et 13 % dans l'étude READY-3, p < 0,003).
Chez ces sujets, le nombre médian de jours jusqu'au retour au score initial en termes de sévérité des rides canthales latérales était de 173 jours (25 semaines) dans le pool de traitement des rides canthales latérales du groupe Relfydess et dans l'étude READY-2, de 168 jours (24 semaines) dans le groupe placebo-rides glabellaires/Relfydess-rides canthales latérales et de 174 jours (25 semaines) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales de l'étude READY-3. Dans l'étude READY-2, 75 % des sujets du groupe Relfydess avaient atteint à nouveau le score initial après 147 jours (21 semaines) et après 141 jours (20 semaines) dans le groupe rides canthales latérales. Dans l'étude READY-3, 75 % des sujets du groupe placebo-rides glabellaires/Relfydess-rides canthales latérales avaient atteint à nouveau le score initial après 139 jours (20 semaines) et les sujets du groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales après 147 jours (21 semaines).
L'amélioration de la sévérité des rides canthales latérales évaluée par les médecins investigateurs et les sujets a été démontrée pendant une période allant au-delà de 6 mois dans le groupe Relfydess en comparaison avec le groupe placebo (Figure 4).
Figure 4: évaluation par les investigateurs et les sujets du taux de réponse obtenu avec Relfydess pour les rides canthales latérales (obtention d'un score de aucuna ou légèreb en termes d'intensité de la sévérité des rides canthales latérales) en comparaison avec le placebo au fil du temps (étude READY-2)c, d

a Aucun point = 0
b Évaluation d'une sévérité d'intensité légère = 1
c Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points LCL-ILA au sourire forcé dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 5; mois 6, valeur p = 0,002
d Taux de répondeurs statistiquement significativement supérieur (se basant sur l'échelle à 4 points LCL-SLA au sourire forcé dans le groupe Relfydess) par rapport au placebo (valeur p < 0,001) à tous les moments jusqu'au mois 6.
En cas de traitement combiné des rides glabellaires, la réponse (obtention d'un score de 0 ou de 1 sur l'échelle LCL-ILA au sourire forcé) dans le groupe Relfydess-rides glabellaires/Relfydess-rides canthales latérales était statistiquement significativement supérieur par rapport au groupe placebo-rides glabellaires/placebo-rides canthales latérales à tous les moments post-traitement sauf à 6 mois (p = 0,052).
Étude en ouvert (étude READY-4)
L'étude READY-4 était une étude en ouvert, de phase IIII, multicentrique évaluant la sécurité d'injections répétées de Relfydess pour le traitement à long terme des rides glabellaires et des rides canthales latérales modérées à sévères (avec un intervalle d'au moins 12 semaines entre les cycles de traitement).
Dans l'étude READY-4, l'administration de Relfydess allant jusqu'à 110 U.I. et la réalisation jusqu'à un total de 7 traitements des rides glabellaires et/ou des rides canthales latérales pendant une période d'étude de 52 semaines ont mis en évidence des résultats favorables en termes d'efficacité aussi bien pour les rides glabellaires que pour les rides canthales latérales, indépendamment du fait qu'elles aient été traitées concomitamment ou séparément les unes des autres.
|


