CompositionPrincipes actifs
Antigenum F praefusionis stabilitum RSV subgrupi A1,2, antigenum F praefusionis stabilitum RSV subgrupi B1,2.
1 glycoprotéine F stabilisée en forme préfusion.
2 produits dans des cellules ovariennes de hamster chinois génétiquement modifiées.
Excipients
Trometamolum, trometamoli hydrochloridum, saccharum, mannitolum, polysorbatum 80, natrii chloridum (corresp. 0.43 mg de sodium par dose), acidum hydrochloridum (q.s. ad pH), aqua ad iniectabile.
Indications/Possibilités d’emploiAbrysvo est indiqué pour:
·La protection passive contre les maladies des voies respiratoires inférieures causées par le virus respiratoire syncytial (VRS) chez les nourrissons de la naissance jusqu'à l'âge de 6 mois à la suite de l'immunisation de la mère entre la 32e et la 36e semaine de grossesse (voir «Mises en garde et précautions» et «Propriétés/Effets»).
·L'immunisation active des personnes âgées de 60 ans et plus pour la prévention des maladies des voies respiratoires inférieures causées par le VRS.
L'utilisation de ce vaccin doit être conforme aux recommandations officielles.
Posologie/Mode d’emploiPersonnes enceintes
Une dose unique de 0.5 ml doit être administrée entre la 32e et la 36e semaine de grossesse (voir «Mises en garde et précautions» et «Propriétés/Effets»).
La nécessité d'une nouvelle vaccination lors des grossesses ultérieures n'a pas été démontrée.
Personnes âgées de 60 ans et plus
Une dose unique de 0.5 ml doit être administrée.
Population pédiatrique
La sécurité et l'efficacité d'Abrysvo chez les enfants (de la naissance à moins de 18 ans) n'ont pas encore été établies. Des données très limitées sont disponibles chez les adolescentes enceintes et leurs nourrissons (voir «Propriétés/Effets»).
Mode d'administration
Abrysvo doit être injecté par voie intramusculaire dans le muscle deltoïde de la partie supérieure du bras.
Le vaccin ne doit pas être mélangé avec d'autres vaccins ou médicaments.
Pour les instructions concernant la reconstitution et la manipulation du médicament avant administration, voir «Remarques concernant la manipulation».
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom commercial et le numéro de lot du produit administré doivent être clairement documentés.
Contre-indicationsHypersensibilité aux principes actifs ou à l'un des excipients (voir «Composition»).
Mises en garde et précautionsHypersensibilité et anaphylaxie
Un traitement médical approprié et une surveillance doivent toujours être disponibles en cas de réaction anaphylactique consécutive à l'administration du vaccin.
Risque potentiel de naissances prématurées
Dans deux études cliniques menées chez des femmes enceintes, un déséquilibre numérique a été constaté en comparaison du placebo concernant les naissances prématurées chez les femmes ayant reçu Abrysvo. Les données disponibles ne sont pas suffisantes pour établir ou exclure un lien de causalité entre les naissances prématurées et Abrysvo. Afin d'éviter le risque potentiel de naissance prématurée lors de l'utilisation d'Abrysvo avant la 32e semaine de grossesse, Abrysvo doit être administré chez les personnes enceintes entre la 32e et la 36e semaine de grossesse, comme indiqué. Les femmes enceintes présentant un risque accru de naissance prématurée étaient généralement exclues des études cliniques avec Abrysvo (voir «Grossesse, Allaitement» et «Effets indésirables»).
Réactions anxieuses
Des réactions anxieuses, notamment des réactions vaso-vagales (syncope), une hyperventilation ou des réactions liées au stress peuvent survenir en lien avec la vaccination en tant que réaction psychogène à l'injection avec une aiguille. Il est important que des mesures soient mises en place afin d'éviter toute blessure en cas d'évanouissement.
Maladie concomitante
La vaccination doit être reportée chez les personnes souffrant d'une maladie fébrile aiguë. Toutefois, la présence d'une infection légère, telle qu'un rhume, ne doit pas entraîner le report de la vaccination.
Thrombopénie et troubles de la coagulation
Abrysvo doit être administré avec précaution chez les personnes présentant une thrombopénie ou un trouble de la coagulation, car des saignements ou des ecchymoses peuvent survenir après une injection intramusculaire chez ces personnes.
Personnes immunodéprimées
L'efficacité et la sécurité du vaccin n'ont pas été étudiées chez les personnes immunodéprimées, notamment celles traitées par immunosuppresseurs. L'efficacité d'Abrysvo pourrait être plus faible chez les personnes immunodéprimées.
Personnes à moins de 24 semaines de grossesse
Abrysvo n'a pas été étudié chez les personnes enceintes se trouvant à moins de 24 semaines de grossesse.
Limites de l'efficacité vaccinale
Comme avec tout vaccin, il se peut que toutes les personnes vaccinées n'obtiennent pas une réponse immunitaire protectrice.
Excipients revêtant un intérêt particulier
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose de 0.5 ml, c.-à-d. qu'il est essentiellement «sans sodium».
InteractionsAdministration concomitante avec d'autres vaccins
Dans une étude randomisée avec des adultes âgés de 65 ans et plus (N=1'403, randomisation 1:1), l'administration concomitante d'Abrysvo avec un vaccin saisonnier contre la grippe (QIV, antigène de surface, inactivé, avec adjuvant) a été évaluée. Les critères de non-infériorité de la réponse immunitaire lors d'une administration concomitante par rapport à une administration séparée ont été remplis. Cependant, des titres de neutralisation des anticorps VRS A et B numériquement plus faibles et des titres d'inhibition de l'hémagglutination des virus grippaux A et B numériquement plus faibles ont été observés lors de l'administration concomitante d'Abrysvo et du vaccin inactivé de la grippe avec adjuvant par rapport à l'administration séparée. La pertinence clinique de ces observations n'est pas connue.
L'administration concomitante d'Abrsyvo avec un vaccin diphtérie-tétanos-coqueluche acellulaire (DTPa) a été étudiée. Il n'y a eu aucun problème de sécurité lorsqu'Abrysvo a été administré en même temps que le DTPa à des femmes non enceintes en bonne santé (N=141). Les réponses immunitaires au VRS A, au VRS B, à la diphtérie et au tétanos lors de la co-administration étaient non inférieures à celles après une administration séparée. Cependant, les réponses immunitaires aux composants de la coqueluche ont été plus faibles lors de la co-administration par rapport à l'administration séparée; la non-infériorité n'a pu être démontrée pour aucun des antigènes acellulaires de la coqueluche (toxine pertussique [PT], hémagglutinine filamenteuse [FHA] et pertactine [PRN]), car la limite inférieure de l'IC à 95% pour le rapport MGC n'était pas supérieure à 0.67 entre le groupe d'administration concomitante et le groupe d'administration séparée. La limite inférieure de l'IC à 95% pour le rapport MGC était de 0.64 pour la PT, de 0.50 pour la FHA et de 0.48 pour la PRN. La pertinence clinique de cette observation n'est pas connue.
Un intervalle d'au moins deux semaines est recommandé entre l'administration d'Abrysvo et l'administration d'un vaccin diphtérie-tétanos-coqueluche acellulaire (DTPa).
Chez les femmes enceintes, l'administration concomitante d'Abrysvo avec un DTPa ou des vaccins antigrippaux n'a pas été étudiée.
Grossesse, allaitementGrossesse
Les données sur les femmes enceintes (plus de 4'000 résultats de grossesse après exposition) n'indiquent aucun risque de malformation ni aucune toxicité fœtale/néonatale.
Les résultats des études effectuées chez l'animal portant sur Abrysvo n'ont pas indiqué d'effets délétères directs ou indirects en ce qui concerne la toxicité pour la reproduction (voir «Données précliniques»).
Dans une étude de phase 3 (Étude C3671008), les effets indésirables maternels observés dans le mois suivant la vaccination étaient similaires dans le groupe Abrysvo (13.8%) et dans le groupe placebo (13.1%). Les effets indésirables graves survenus chez les femmes enceintes dans le groupe Abrysvo et dans le groupe placebo étaient la pré-éclampsie (1.8% contre 1.4%), l'hypertension (0.4% contre 0.2%), l'hypertension artérielle gravidique (1.1% contre 1.0%), la rupture prématurée des membranes (0.4% contre 0.4%), la rupture prématurée des membranes avant terme (0.4% contre 0.3%), le décès maternel (<0.1% contre 0%) et le décès fœtal (0.3% contre 0.3%).
Aucun signal de sécurité n'a été détecté chez les nourrissons jusqu'à l'âge de 24 mois. L'incidence des événements indésirables survenus dans le mois suivant la naissance chez les nourrissons était similaire dans le groupe Abrysvo (37%) et dans le groupe placebo (35%).
Les principales anomalies à la naissance, évaluées dans le groupe Abrysvo en comparaison du placebo, incluaient la naissance prématurée (202/3'568 [5.6%] contre 169/3'558 [4.7%]), le faible poids à la naissance (181 [5.1%] contre 155 [4.3%]) et les anomalies congénitales (174 [5.0%] contre 203 [6.2%]).
Les données disponibles ne sont pas suffisantes pour établir ou exclure un lien de causalité entre les naissances prématurées et Abrysvo (voir «Mises en garde et précautions» et «Effets indésirables»).
Afin de limiter le risque potentiel de naissance prématurée, Abrysvo doit être administré chez les personnes enceintes entre la 32e et la 36e semaine de grossesse.
Allaitement
On ignore si Abrysvo passe dans le lait maternel. Abrysvo n'a montré aucun effet nocif chez les nouveau-nés allaités par des mères vaccinées.
Fertilité
Aucune donnée n'est disponible concernant l'effet d'Abrysvo sur la fertilité humaine.
Les études chez l'animal n'ont pas montré d'indices en faveur d'effets nocifs directs ou indirects en lien avec la fertilité des femelles (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesAbrysvo n'a aucune influence ou a une influence négligeable sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesRésumé du profil de sécurité
La sécurité d'administration d'une dose unique d'Abrysvo à des femmes enceintes entre la 24e et la 36e semaine de grossesse (n=3'682) et à des personnes âgées de 60 ans et plus (n=18'575) a été évaluée dans des études cliniques de phase 3.
Personnes enceintes
Chez les femmes enceintes entre la 24e et la 36e semaine de grossesse, les effets indésirables les plus fréquemment rapportés étaient une douleur au site d'injection (41%), des céphalées (31%) et des myalgies (27%). La majorité des réactions locales et systémiques chez les mères participantes étaient de sévérité légère à modérée et se sont résolues dans les 2 à 3 jours suivant leur apparition.
Personnes âgées de 60 ans et plus
Chez les personnes âgées de 60 ans et plus, l'effet indésirable le plus fréquemment rapporté était la douleur au site d'injection (11%). La majorité des effets indésirables étaient de sévérité légère à modérée et se sont résolus dans les 1 à 2 jours suivant leur apparition.
Liste des effets indésirables
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1'000 à <1/100), «rares» (≥1/10'000 à <1/1'000), «très rares» (<1/10'000), «fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Tableau 1 Effets indésirables survenus après l'administration d'Abrysvo
|
Classe de systèmes d'organes
|
Effets indésirables
Personnes enceintes ≤49 ans
|
Effets indésirables
Personnes ≥60 ans
| |
Affections du système immunitaire
| |
Hypersensibilité
|
|
Très rares
| |
Affections du système nerveux
| |
Céphalées
|
Très fréquents (31.0%)
|
| |
Syndrome de Guillain-Barré
|
|
Raresa
| |
Affections musculosquelettiques et du tissu conjonctif
| |
Myalgie
|
Très fréquents (26.5%)
|
| |
Troubles généraux et anomalies au site d'administration
| |
Douleur au site d'injection
|
Très fréquents (40.6%)
|
Très fréquents (10.7%)
| |
Rougeur au site d'injection
|
Fréquents
|
Fréquents
| |
Gonflement au site d'injection
|
Fréquents
|
Fréquents
|
a Dans une étude menée chez des personnes âgées de 60 ans et plus, un cas de syndrome de Guillain-Barré et un cas de syndrome de Miller-Fisher ont été rapportés et sont respectivement survenus 7 et 8 jours après l'administration d'Abrysvo; ces cas ont été évalués par le médecin-investigateur comme étant potentiellement liés au vaccin administré. Ces deux cas présentaient des facteurs confondants ou une autre étiologie. Un cas supplémentaire, survenu 8 mois après l'administration d'Abrysvo, a été évalué par le médecin-investigateur comme étant non lié au vaccin administré. Un cas de syndrome de Guillain-Barré a été rapporté dans le groupe placebo 14 mois après l'administration.
Naissances prématurées dans les études cliniques
Dans deux études cliniques menées chez des femmes enceintes vaccinées entre la 24e et la 36e semaine de grossesse, un déséquilibre numérique a été constaté en comparaison du placebo concernant les naissances prématurées chez les femmes ayant reçu Abrysvo.
L'étude C3671003 est une étude de phase 2, randomisée, contrôlée par placebo et en insu de l'observateur ayant évalué la sécurité de deux niveaux de dose (120 µg et 240 µg) d'Abrysvo en cas d'administration à des femmes enceintes. Abrysvo (120 µg) a été administré à 115 mères participantes et 114 nourrissons sont nés de ces mères participantes. Dans cette étude, des naissances prématurées sont survenues chez 5.3% (6 sur 114) des sujets du groupe Abrysvo et chez 2.6% (3 sur 116) des sujets du groupe placebo.
Dans l'étude de phase 3 C3671008 qui a suivi, des naissances prématurées sont survenues chez 5.7% (IC à 95%: 4.9, 6.5; 202 sur 3'568) des sujets du groupe Abrysvo et chez 4.7% (IC à 95%: 4.1, 5.5; 169 sur 3'558) des sujets du groupe placebo. Parmi les prématurés, 83 nourrissons du groupe Abrysvo et 80 nourrissons du groupe placebo sont restés hospitalisés ou ont été réhospitalisés alors qu'ils étaient encore des nouveau-nés (jusqu'à 30 jours après la naissance). Les données disponibles ne sont pas suffisantes pour établir ou exclure un lien de causalité entre les naissances prématurées et Abrysvo. Un déséquilibre numérique a également été observé, en rapport avec les naissances prématurées, dans le sous-groupe de nourrissons nés des participantes à l'Étude C3671008 qui avaient été vaccinées entre la 32e et la 36e semaine de grossesse. Une naissance prématurée y est survenue chez 4.2% (68/1'631) des sujets du groupe Abrysvo et chez 3.7% (59/1'610) des sujets du groupe placebo (voir «Mises en garde et précautions» et «Grossesse, Allaitement»).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageUn surdosage avec Abrysvo est peu probable en raison de la présentation en dose unique.
Il n'existe pas de traitement spécifique en cas de surdosage avec Abrysvo. En cas de surdosage, la personne doit faire l'objet d'une surveillance et recevoir un traitement symptomatique approprié.
Propriétés/EffetsCode ATC
J07BX05
Mécanisme d'action
Abrysvo contient deux antigènes F du VRS recombinants stabilisés en forme préfusion représentant les sous-groupes VRS-A et VRS-B. L'antigène F en forme préfusion est la cible principale des anticorps neutralisants qui empêchent l'infection par le VRS. Après administration intramusculaire, les antigènes F en forme préfusion déclenchent une réponse immunitaire qui protège contre les maladies des voies respiratoires inférieures associées au VRS.
Chez les nourrissons nés de mères vaccinées avec Abrysvo pendant la grossesse, la protection contre les maladies des voies respiratoires inférieures associées au VRS est due au transfert transplacentaire d'anticorps neutralisant le VRS. Les adultes âgés de 60 ans et plus sont protégés par une immunisation active.
Pharmacodynamique
Aucune donnée.
Efficacité clinique
Nourrissons de la naissance à l'âge de 6 mois par immunisation active des personnes enceintes
L'Étude C3671008 est une étude de phase 3, multicentrique, randomisée (1:1), en double aveugle, contrôlée par placebo, visant à évaluer l'efficacité d'une dose unique d'Abrysvo dans la prévention des maladies des voies respiratoires inférieures associées au VRS chez les nourrissons dont les mères ont été vaccinées entre la 24e semaine et la 36e semaine de grossesse.
Au cours de cette étude, 3'695 femmes enceintes, dans le cadre de grossesses simples et sans complications, ont été randomisées dans le groupe Abrysvo et 3'697 dans le groupe placebo.
Parmi les femmes enceintes ayant reçu Abrysvo, 65% étaient blanches, 20% étaient noires ou afro-américaines et 29% étaient hispaniques/latino-américaines. L'âge médian était de 29 ans (intervalle: 16 à 45 ans), 0.2% des participantes avaient moins de 18 ans et 4.3% moins de 20 ans. L'âge gestationnel médian au moment de la vaccination était de 31 semaines et 2 jours (intervalle: 24 semaines et 0 jour à 36 semaines et 4 jours). L'âge gestationnel médian du nourrisson à la naissance était de 39 semaines et 1 jour (intervalle: 27 semaines et 3 jours à 43 semaines et 6 jours).
L'efficacité vaccinale (EV) a été définie comme la réduction du risque relatif du critère d'évaluation dans le groupe Abrysvo par rapport au groupe placebo pour les nourrissons dont la mère a reçu le médicament expérimental attribué. Deux critères d'efficacité principaux ont été évalués en parallèle: la maladie sévère des voies respiratoires inférieures traitée médicalement due au VRS et la maladie des voies respiratoires inférieures traitée médicalement due au VRS dans les 90, 120, 150 ou 180 jours après la naissance.
Une maladie des voies respiratoires inférieures associée au VRS a été définie comme une maladie à VRS confirmée par réaction en chaîne par polymérase à transcription inverse (RT-PCR) lors d'une visite médicale et présentant un ou plusieurs des symptômes respiratoires suivants: respiration rapide (fréquence respiratoire ≥60/min à un âge <2 mois [<60 jours], ≥50/min à un âge entre ≥2 mois et <12 mois ou ≥40/min à un âge entre ≥12 mois et 24 mois), faible saturation en oxygène (SpO2 <95%) et tirage sous-costal. La maladie sévère des voies respiratoires inférieures associée au VRS a été définie comme une maladie répondant aux critères du VRS pour une maladie des voies respiratoires inférieures, plus au moins un des symptômes suivants: respiration très rapide (fréquence respiratoire ≥70/min à un âge <2 mois [<60 jours], ≥60/min à un âge entre ≥2 mois et <12 mois ou ≥50/min à un âge entre ≥12 mois et 24 mois), faible saturation en oxygène (SpO2 <93%), supplémentation en oxygène à haut débit par canule nasale ou ventilation mécanique, traitement en unité de soins intensifs pendant >4 heures et/ou absence de réponse/inconscience.
Dans la population étudiée, les résultats concernant l'efficacité vaccinale ont satisfait au critère statistique de succès (limite inférieure de l'IC à >20%) pour la réduction de la maladie sévère des voies respiratoires inférieures traitée médicalement due au VRS à tous les intervalles dans les 180 jours. Les résultats concernant l'efficacité vaccinale n'ont pas satisfait au critère statistique de succès pour la réduction de la maladie des voies respiratoires inférieures traitée médicalement due au VRS. Cependant, une efficacité cliniquement significative a été observée dans les 90 à 180 jours après la naissance.
L'efficacité vaccinale chez les nourrissons de la naissance à l'âge de 180 jours dont les mères ont été vaccinées entre la 32e et la 36e semaine de grossesse est basée sur une analyse post-hoc. L'efficacité vaccinale est présentée dans les tableaux 2 et 3.
Tableau 2 Efficacité vaccinale d'Abrysvo contre la maladie sévère des voies respiratoires inférieures traitée médicalement causée par le VRS chez les nourrissons de la naissance à l'âge de 6 mois par immunisation active des mères pendant la grossesse à l'âge gestationnel de 32 à 36 semaines – Étude C3671008a
|
Période
|
Abrysvo
Nombre de cas
n=1'572b
|
Placebo
Nombre de cas
n=1'539b
|
EV (%)
(IC)c
| |
90 jours
|
1
|
11
|
91.1 (38.8, 99.8)
| |
180 jours
|
6
|
25
|
76.5 (41.3, 92.1)
|
IC = intervalle de confiance; EV = efficacité vaccinale
a L'analyse descriptive post-hoc des sous-groupes n'a pas été corrigée pour les comparaisons multiples; les résultats à 90 jours et à 180 jours sont présentés.
b Population d'efficacité évaluable.
c IC à 95%
Tableau 3 Efficacité vaccinale d'Abrysvo contre la maladie des voies respiratoires inférieures traitée médicalement causée par le VRS chez les nourrissons de la naissance à l'âge de 6 mois par immunisation active des mères pendant la grossesse à l'âge gestationnel de 32 à 36 semaines – Étude C3671008a
|
Période
|
Abrysvo
Nombre de cas
n=1'572b
|
Placebo
Nombre de cas
n=1'539b
|
EV (%)
(IC)c
| |
90 jours
|
14
|
21
|
34.7 (-34.6, 69.3)
| |
180 jours
|
24
|
55
|
57.3 (29.8, 74.7)
|
IC = intervalle de confiance; EV = efficacité vaccinale
a L'analyse descriptive post-hoc des sous-groupes n'a pas été corrigée pour les comparaisons multiples; les résultats à 90 jours et à 180 jours sont présentés.
b Population d'efficacité évaluable.
c IC à 95%
Immunisation active des personnes âgées de 60 ans et plus
L'Étude C3671013 est une étude de phase 3, multicentrique, randomisée, en double aveugle, contrôlée par placebo, visant à évaluer l'efficacité d'Abrysvo dans la prévention des maladies des voies respiratoires inférieures associées au VRS chez les personnes âgées de 60 ans et plus.
La maladie des voies respiratoires inférieures associée au VRS a été définie comme une maladie à VRS confirmée par RT-PCR, accompagnée d'au moins 2 ou au moins 3 des symptômes respiratoires suivants dans les 7 jours après le premier symptôme, et durant plus d'1 jour au cours du même épisode de la maladie: toux, respiration sifflante, production d'expectorations, essoufflement ou tachypnée (≥25 respirations/min ou accélération de 15% par rapport à la valeur initiale au repos) nouveaux ou s'aggravant.
Les participants ont été randomisés (1:1) pour recevoir Abrysvo (n=18'488) ou un placebo (n=18'479). Le recrutement a été stratifié par âge: 60 à 69 ans (63%), 70 à 79 ans (32%) et ≥80 ans (5%). Les personnes présentant des maladies chroniques sous-jacentes stables ont été éligibles pour cette étude et 52% des participants présentaient au moins une maladie préspécifiée; 16% des participants atteints de maladies cardio-pulmonaires chroniques stables telles que l'asthme (9%), la bronchopneumopathie chronique obstructive (7%) ou l'insuffisance cardiaque congestive (2%) ont été recrutés. Les personnes immunodéprimées ont été exclues de la participation.
L'objectif principal était l'évaluation de l'efficacité vaccinale (EV), définie comme la réduction du risque relatif de premier épisode de maladie des voies respiratoires inférieures associée au VRS dans le groupe Abrysvo par rapport au groupe placebo au cours de la première saison de VRS.
Parmi les participants ayant reçu Abrysvo, 51% étaient des hommes et 80% étaient blancs, 12% étaient noirs ou afro-américains et 41% étaient hispaniques/latino-américains. L'âge médian des participants était de 67 ans (intervalle: 59 à 95 ans).
À la fin de la première saison de VRS, l'analyse des résultats a démontré une efficacité statistiquement significative d'Abrysvo en comparaison du placebo pour la réduction des maladies des voies respiratoires inférieures associées au VRS accompagnée de ≥2 symptômes et de ≥3 symptômes.
Les informations relatives à l'efficacité vaccinale sont présentées dans le tableau 4.
Tableau 4 Efficacité vaccinale d'Abrysvo contre les maladies à VRS des voies respiratoires inférieures – immunisation active des personnes âgées de 60 ans et plus – Étude C3671013
|
Critère d'efficacité
|
Abrysvo
Nombre de cas
n=18'058
|
Placebo
Nombre de cas
n=18'076
|
EV (%)
(IC à 95%)
| |
Premier épisode de maladie des voies respiratoires inférieures associée au VRS accompagnée de ≥2 symptômes
|
15
|
43
|
65.1 (35.9, 82.0)
| |
Premier épisode de maladie des voies respiratoires inférieures associée au VRS accompagnée de ≥3 symptômes
|
2
|
18
|
88.9 (53.6, 98.7)
|
IC = intervalle de confiance, VRS = virus respiratoire syncytial, EV = efficacité vaccinale.
PharmacocinétiqueAbsorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesLes données précliniques issues des études conventionnelles sur la toxicité en administration répétée et la toxicité pour la reproduction et le développement n'ont pas révélé de risque particulier pour l'homme.
Remarques particulièresIncompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Le flacon non ouvert est stable pendant 5 jours lorsqu'il est conservé à des températures comprises entre 8 et 30 °C. À la fin de cette période, Abrysvo doit être utilisé ou éliminé. Ces informations sont destinées à guider les professionnels de santé en cas d'écarts de température temporaires uniquement.
Stabilité après ouverture
Abrysvo doit être administré immédiatement après reconstitution ou dans les 4 heures qui suivent s'il est conservé à une température comprise entre 15 et 30 °C. Ne pas congeler.
La stabilité chimique et physique pendant l'utilisation a été démontrée pendant 4 heures à 15-30 °C. Pour des raisons microbiologiques, le produit doit être utilisé immédiatement. S'il n'est pas utilisé immédiatement, le délai d'utilisation et les conditions de stockage relèvent de la responsabilité de l'utilisateur.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C).
Ne pas congeler. Éliminer le produit si l'emballage a été congelé.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Abrysvo doit être reconstitué avant l'administration en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon contenant la poudre à l'aide de l'adaptateur pour flacon.
Le vaccin doit être reconstitué uniquement avec le solvant fourni.
Préparation de l'administration
|
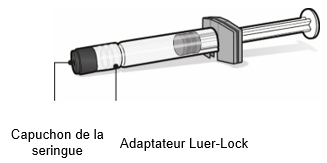
Seringue préremplie contenant le solvant pour Abrysvo
|
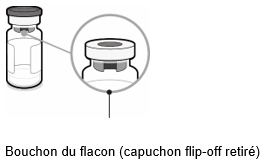
Flacon contenant les antigènes pour Abrysvo (poudre)
|
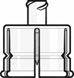
Adaptateur pour flacon
| |
|
|
|
|
|
|
|
|
|
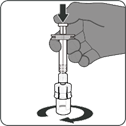
Étape 1. Fixer l'adaptateur pour flacon
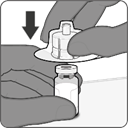
·Retirer le cache supérieur de l'emballage de l'adaptateur pour flacon et retirer la capsule amovible du flacon.
·Tout en conservant l'adaptateur pour flacon dans son emballage, le centrer sur le bouchon du flacon et l'insérer bien droit d'une simple pression vers le bas. Veiller à ne pas pousser l'adaptateur pour flacon de biais pour éviter tout risque de fuites. Retirer l'emballage.
| |
|
|
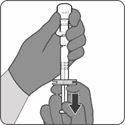
Étape 2. Reconstituer le composant en poudre (antigènes) pour former Abrysvo
·Pour toutes les étapes d'assemblage de la seringue, tenir la seringue uniquement par l'adaptateur Luer-Lock. Cela empêchera l'adaptateur Luer-Lock de se détacher pendant l'utilisation.
·Tourner le capuchon de la seringue pour le retirer, puis tourner la seringue pour la connecter à l'adaptateur pour flacon. Arrêter de tourner lorsqu'une résistance se fait sentir.
·Injecter tout le contenu de la seringue dans le flacon. Maintenir la tige du piston enfoncée et faire tournoyer délicatement le flacon dans un mouvement circulaire jusqu'à dissolution complète de la poudre (env. 1 à 2 minutes). Ne pas agiter.
| |
|
|
Étape 3. Prélever le vaccin reconstitué
·Retourner complètement le flacon et prélever lentement la totalité du contenu dans la seringue pour obtenir une dose de 0.5 ml d'Abrysvo.
·Dévisser la seringue de l'adaptateur pour flacon.
·Fixer une aiguille stérile adaptée à l'injection intramusculaire.
|
Le vaccin préparé est une solution limpide et incolore. Avant l'administration, effectuer un contrôle visuel du vaccin pour vérifier l'absence de grosses particules et de colorations. Ne pas utiliser le vaccin si de grosses particules ou des colorations sont constatées.
Numéro d’autorisation69691 (Swissmedic).
PrésentationEmballage contenant 1 flacon de poudre, 1 seringue préremplie de solvant, 1 adaptateur pour flacon avec 1 aiguille pour injection. [B]
Emballage contenant 5 flacons de poudre, 5 seringues préremplies de solvant, 5 adaptateurs pour flacon avec 5 aiguilles pour injection. [B]
Emballage contenant 10 flacons de poudre, 10 seringues préremplies de solvant, 10 adaptateurs pour flacon avec 10 aiguilles pour injection. [B]
Titulaire de l’autorisationPfizer AG, Zürich.
Mise à jour de l’informationAvril 2024
LLD V003
|






