Propriétés/EffetsCode ATC
D11AH12
Mécanisme d’action
Le némolizumab est un anticorps anti-IgG2 monoclonal humanisé qui inhibe la transduction du signal de l’interleukine-31 (IL-31) en se liant sélectivement au récepteur alpha de l’interleukine-31 (IL-31 RA). L’IL-31 est une cytokine naturelle impliquée dans le prurit, l’inflammation, le dysfonctionnement épidermique et la fibrose. Le némolizumab inhibe les réactions induites par l’IL-31, notamment la libération de chimiokines et de cytokines pro-inflammatoires.
Pharmacodynamique
Efficacité clinique
1) Efficacité clinique et sécurité chez les adultes et adolescents atteints de dermatite atopique
L’efficacité et la sécurité de Nemluvio en cas de traitement de fond topique concomitant ont été évaluées dans deux études pivot randomisées, en double aveugle et contrôlées par placebo (ARCADIA 1 et ARCADIA 2) qui incluaient un total de 1728 participants âgés d’au moins 12 ans, atteints de dermatite atopique modérée à sévère et insuffisamment contrôlée par les traitements topiques. Le degré de sévérité de la maladie était défini par un score IGA (Investigator’s Global Assessment) de 3 (modéré) et 4 (sévère) à l’évaluation globale de la dermatite atopique, un score EASI (Eczema Area and Severity Index) ≥16, une surface corporelle atteinte (BSA) ≥10% et un score PP-NRS (Peak Pruritus Numeric Rating Scale) ≥4.
Les patients inclus dans les études ont reçu soit une première injection sous-cutanée de némolizumab 60 mg, puis des injections de 30 mg toutes les 4 semaines (1x/4 sem.), soit le placebo correspondant. Des corticostéroïdes topiques (CT) et/ou des inhibiteurs de la calcineurine topiques (ICT) de puissance faible et/ou moyenne (selon la classification américaine) étaient administrés en concomitance dans les groupes némolizumab et placebo pendant au moins 14 jours avant la référence et ont été poursuivis pendant l’étude. Selon l’activité de la maladie, ces traitements concomitants pouvaient être diminués progressivement et/ou arrêtés à la discrétion du médecin investigateur.
Après 16 semaines, les patients ayant obtenu une réponse EASI-75 ou un succès selon le score IGA ont intégré la période d’entretien de l’étude pendant 32 semaines supplémentaires afin d’évaluer le maintien de la réponse obtenue à la semaine 16. Les patients répondeurs à Nemluvio ont été randomisés à nouveau pour recevoir soit Nemluvio 30 mg toutes les 8 semaines, soit le placebo toutes 4 semaines (tous les groupes ont continué le traitement par CT/ICT). Les patients randomisés pour recevoir le placebo au cours de la période initiale de traitement et qui avaient obtenu la même réponse clinique à la semaine 16 ont continué à recevoir le placebo toutes les 4 semaines. Les patients non-répondeurs à la semaine 16, les patients ayant présenté une perte de réponse clinique pendant la période d’entretien et les patients ayant terminé la période d’entretien ont eu la possibilité d’être inclus dans l’étude en ouvert (ARCADIA LTE) et de recevoir un traitement par Nemluvio 30 mg toutes les 4 semaines pendant au maximum 200 semaines.
Critères d’évaluation
Dans les études ARCADIA 1 et ARCADIA 2, les critères d’évaluation primaires étaient les suivants :
§Pourcentage de patients présentant un succès selon le score IGA (défini comme un score IGA de 0 [absence d’atteintes] ou 1 [atteintes à peine visibles] et une réduction ≥2 points par rapport à l’inclusion) à la semaine 16
§Pourcentage de patients ayant obtenu une réponse EASI-75 (amélioration ≥75% du score EASI par rapport à l’inclusion) à la semaine 16
Les principaux critères d’évaluation secondaires comprenaient une amélioration du score PP-NRS ≥4 par rapport à la référence aux semaines 1, 2, 4 et 16, un score PP-NRS <2 à la semaine 4 et à la semaine 16, une amélioration du score SD-NRS (Sleep Disturbance Numeric Rating Scale) ≥4 par rapport à la référence à la semaine 16, les patients avec à la fois une réponse EASI-75 et une amélioration du score PP-NRS ≥4 par rapport à la référence à la semaine 16 et les patients avec à la fois un succès selon le score IGA et une amélioration du score PP-NRS ≥4 par rapport à la référence à la semaine 16.
Caractéristiques à l’inclusion
Dans ces études, à l’inclusion, 51,0% des patients étaient des hommes, 79,9% étaient blancs et 15,4% étaient âgés de 12 à 17 ans. À l’inclusion, 70% des patients avaient un score IGA de 3 (DA modérée) et 30% un score IGA de 4 (DA sévère). Le score EASI moyen à l’inclusion était de 27,5, le score PP-NRS hebdomadaire à l’inclusion était de 7,1 (prurit sévère) et le score SD-NRS hebdomadaire à l’inclusion était de 5,8. Globalement, 63,3% des patients avaient reçu auparavant d’autres traitements systémiques pour la dermatite atopique.
Efficacité clinique – ARCADIA 1 et ARCADIA 2 – Adultes et adolescents – Période d’induction, semaine 0 à semaine 16
La supériorité de Nemluvio par rapport au placebo était statistiquement significative en ce qui concerne les co-critères primaires d’évaluation cutanée, à savoir le succès selon le score IGA et la réponse EASI-75 sur 16 semaines (Tableau 2). Les résultats pour les deux co-critères primaires d’évaluation étaient homogènes dans la population atteinte de prurit sévère (score PP-NRS à la référence ≥7).
Tableau 2 – Résultats d’efficacité pour Nemluvio (30 mg 1x/4 sem.) avec traitement concomitant par CT/ICT dans les études ARCADIA 1 et ARCADIA 2 à la semaine 16
|
|
ARCADIA 1
|
ARCADIA 2
| |
Nemluvio + CT/ICT
|
Placebo +
CT/ICT
|
Nemluvio + CT/ICT
|
Placebo +
CT/ICT
| |
Nombre de patients randomisés et traités (PP-NRS à l’inclusion ≥4)
|
620
|
321
|
522
|
265
| |
% de patients avec IGA de 0 ou 1 a
|
35,6#
|
24,6
|
37,7#
|
26,0
| |
% de patients avec EASI-75a
|
43,5*
|
29,0
|
42,1#
|
30,2
|
a Les patients qui ont reçu un traitement de secours ou pour lesquels des données étaient manquantes ont été considérés comme non-répondeurs
* Valeur p <0,0001, #valeur p <0,001La valeur p ajustée par strate est basée sur le test CMH stratifié selon le score PP-NRS et le score IGA à l’inclusion
Figure 1 – Pourcentage de patients présentant un succès selon le score IGA et une réponse EASI-75 entre l’inclusion et la semaine 16 dans les études ARCADIA 1 et ARCADIA 2
Une amélioration significative du prurit chez les patients traités par Nemluvio dans les études ARCADIA 1 et ARCADIA 2 par rapport au placebo, basée une l’amélioration du score PP-NRS ≥4 par rapport à l’inclusion, a été observée à partir de la semaine 1 et s’est maintenue jusqu’à la semaine 16 (Tableau 3). Les résultats étaient homogènes dans la population atteinte de prurit sévère (score PP-NRS initial ≥7).
Tableau 3 – Résultats d’efficacité concernant le prurit pour Nemluvio avec traitement concomitant par CT/ICT dans les études ARCADIA 1 et ARCADIA 2 jusqu’à la semaine 16
|
|
ARCADIA 1
|
ARCADIA 2
| |
Nemluvio + CT/ICT
|
Placebo + CT/ICT
|
Nemluvio + CT/ICT
|
Placebo + CT/ICT
| |
Nombre de patients randomisés et traités (PP-NRS à l’inclusion ≥4)a
|
620
|
321
|
522
|
265
| |
% de patients avec amélioration du PP-NRS ≥4a
| |
À la semaine 1
|
4,7§
|
1,2
|
6,7*
|
0,4
| |
À la semaine 2
|
17,7*
|
3,1
|
16,9*
|
1,9
| |
À la semaine 4
|
27,4*
|
6,5
|
26,1*
|
5,3
| |
À la semaine 16
|
42,7*
|
17,8
|
41,0*
|
18,1
| |
% de patients avec PP-NRS <2a
| |
À la semaine 4
|
16,0*
|
3,7
|
15,9*
|
2,6
| |
À la semaine 16
|
30,6*
|
11,2
|
28,4*
|
11,3
|
a Les patients qui ont reçu un traitement de secours ou pour lesquels des données étaient manquantes ont été considérés comme non-répondeurs
* Valeur p 0,0001, # valeur p <0,001, § valeur p <0,05 La valeur p ajustée par strate est basée sur le test CMH stratifié selon le score PP-NRS et le score IGA à l’inclusion
L’échelle numérique d’évaluation des troubles du sommeil (SD-NRS) est une échelle d’évaluation quotidienne utilisée par les patients pour rapporter la sévérité de la perte de sommeil associée à la dermatite atopique. Une amélioration significative des troubles du sommeil a été observée à la semaine 16 par rapport au placebo (Tableau 4). Les résultats étaient homogènes dans la population atteinte de prurit sévère (score PP-NRS initial ≥7).
Tableau 4 – Efficacité concernant les troubles du sommeil pour Nemluvio avec traitement concomitant par CT/ICT dans les études ARCADIA 1 et ARCADIA 2 jusqu’à la semaine 16
|
|
ARCADIA 1
|
ARCADIA 2
| |
Nemluvio + CT/ICT
|
Placebo + CT/ICT
|
Nemluvio + CT/ICT
|
Placebo + CT/ICT
| |
Nombre de patients randomisés et traités (PP-NRS à l’inclusion ≥4)a
|
620
|
321
|
522
|
265
| |
% de patients avec amélioration du SD-NRS ≥4a
Variation moyenne par rapport à l’inclusion (%)
|
37,9*
-64,6
|
19,9
-38,1
|
33,5*
-59,7
|
16,2
-35,4
|
a Les participants qui ont reçu un traitement de secours ou pour lesquels des données étaient manquantes ont été considérés comme non-répondeurs
* Valeur p <0,0001La valeur p ajustée par strate est basée sur le test CMH stratifié selon le score PP-NRS et le score IGA à l’inclusion
Adolescents atteints de dermatite atopique (12 à 17 ans)
Les résultats d’efficacité des études ARCADIA 1 et ARCADIA 2 à la semaine 16 pour les participants pédiatriques âgés de 12 à 17 ans sont représentés dans le Tableau 5. Les résultats dans la population de patients pédiatriques étaient globalement cohérents avec les résultats dans la population de patients adultes. Les résultats pour les co-critères primaires et les principaux critères d’évaluation secondaires étaient homogènes dans la population atteinte de prurit sévère (score PP-NRS à la référence ≥7).
Tableau 5 – Résultats d’efficacité pour le némolizumab (30 mg 1x/4 sem.) avec traitement concomitant par CT/ICT dans les études ARCADIA 1 et ARCADIA 2 à la semaine 16 chez les patients pédiatriques âgés de 12 à 17 ans
|
|
ARCADIA 1 ET ARCADIA 2
| |
Nemluvio + CT/ICT
|
Nemluvio + CT/ICT
| |
Nombre de patients traités de randomisés (PP-NRS à la référence ≥4)
|
179
|
90
| |
% de patients avec IGA de 0 ou 1 a
|
48,9*
|
34,4
| |
% de patients avec EASI-75a
|
53,4§
|
43,3
|
a Les patients qui ont reçu un traitement de secours ou pour lesquels des données étaient manquantes ont été considérés comme non-répondeurs
≠ valeur p <0,0001, # valeur p <0,001, * valeur p <0,05, ∞ valeur p =0,0591, § valeur p =0,1824
La valeur p stratifiée est basée sur le test CMH stratifié selon le score PP-NRS et le score IGA à l’inclusion
Efficacité clinique – ARCADIA 1 et ARCADIA 2 – Adultes et adolescents – Période d’entretien, semaine 16 à semaine 48
La réponse clinique chez les répondeurs au némolizumab (score IGA 0/1 ou réponse EASI-75 à la semaine 16) a été évaluée entre la semaine 16 et la semaine 48 lors des études ARCADIA 1 et ARCADIA 2. Pour la période de traitement d’entretien, 338 répondeurs au némolizumab ont été de nouveau randomisés pour recevoir du némolizumab 30 mg 1x/8 sem. ou le placebo 1x/4 sem. (arrêt du némolizumab) associé à un traitement concomitant par CT/ICT. À la semaine 48, 60,4% des patients ont obtenu un score IGA de 0/1 et 75,7% une réponse EASI-75 dans le groupe némolizumab 30 mg 1x/8 sem. + CT/ICT, contre respectivement 49,7% et 63,9% dans le groupe placebo 1x/4 sem. + CT/ICT.
2) Efficacité clinique et sécurité chez les adultes atteints de prurigo nodulaire
L’efficacité et la sécurité de Nemluvio en monothérapie ont été évaluées dans deux études pivots randomisées, en double aveugle et contrôlées par placebo (OLYMPIA 1 et OLYMPIA 2) qui incluaient au total 560 patients âgés d’au moins 18 ans et atteints de prurigo nodulaire. La sévérité de la maladie était définie par un score IGA à l’évaluation globale des nodules de prurigo nodulaire sur une échelle de sévérité de 0 à 4. Les patients inclus dans ces deux études présentaient un score IGA ≥3, un prurit sévère défini par une moyenne hebdomadaire du score sur l’échelle d’évaluation numérique du pic de prurit (PP-NRS) ≥7 sur une échelle de 0 à 10, et au moins 20 lésions nodulaires. Les études OLYMPIA 1 et OLYMPIA 2 évaluaient l’effet de Nemluvio en monothérapie sur les signes et symptômes du prurigo nodulaire et ciblaient l’amélioration des lésions cutanées et du prurit sur 16 semaines. L’étude OLYMPIA 1 comprenait une période de traitement de 24 semaines et l’étude OLYMPIA 2 une période de traitement de 16 semaines.
Les participants qui terminaient les études OLYMPIA 1 et OLYMPIA 2 avaient la possibilité d’être inclus dans l’étude en ouvert (OLUMPIA LTE) et de recevoir Nemluvio toutes les 4 semaines pendant une durée maximale de 184 semaines.
Dans le groupe qui recevaient Nemluvio en monothérapie, les patients pesant moins de 90 kg ont reçu des injections sous-cutanées de Nemluvio 60 mg (2 injections de 30 mg) à la semaine 0, puis des injections de 30 mg toutes les 4 semaines, et les patients pesant au moins 90 kg ont reçu des injections sous-cutanées de Nemluvio 60 mg (2 injections de 30 mg) à la semaine 0, puis toutes les 4 semaines.
Critères d’évaluation
Dans les études OLYMPIA 1 et OLYMPIA 2, les deux critères d’évaluation primaires étaient identiques:
§Pourcentage de patients présentant une amélioration ≥4 par rapport à l’inclusion du score sur l’échelle d’évaluation numérique du pic de prurit (NRS) à la semaine 16
§Pourcentage de patients présentant un succès selon le score IGA (défini comme un score IGA de 0 [absence d’atteintes] ou 1 [atteintes à peine visibles] et une amélioration ≥2 points par rapport à l’inclusion) à la semaine 16.
Les principaux critères d’évaluation secondaires comprenaient une amélioration ≥4 du score PP-NRS à la semaine 4 par rapport à l’inclusion, un score PP-NRS <2 à la semaine 4 et à la semaine 16, une amélioration ≥4 du score SD-NRS à la semaine 4 et à la semaine 16 par rapport à l’inclusion.
Caractéristiques à l’inclusion
Dans ces études, à l’inclusion, 59,6% des patients étaient des femmes, 81,4% étaient blancs et 25,4% étaient âgés de plus de 65 ans. Le score PP-NRS moyen hebdomadaire à l’inclusion correspondait à une moyenne (ET) de 8,4 (0,9). À l’inclusion, 58% des patients avaient un score IGA de 3 (PN modéré) et 42% un score IGA de 4 (PN sévère).
Efficacité clinique
Études en monothérapie (OLYMPIA 1 et OLYMPIA 2) – Semaine 0 à semaine 16
Les résultats des études pivots OLYMPIA 1 et OLYMPIA 2 évaluant le traitement par Nemluvio sont présentés dans le Tableau 7 et montrent une amélioration significative chez les patients traités par Nemluvio par rapport au placebo à la fois pour les critères d’évaluation primaires (Figure 2 et Figure 3) et pour les principaux critères d’évaluation secondaires.
Tableau 6 – Résultats d’efficacité pour le némolizumab en monothérapie (1x/4 sem.) dans les études OLYMPIA 1 et OLYMPIA 2
|
|
OLYMPIA 1
|
OLYMPIA 2
| |
Nemluvio
|
Placebo
|
Nemluvio
|
Placebo
| |
Nombre de patients randomisés
|
190
|
96
|
183
|
91
| |
% de patients avec amélioration du PP-NRS ≥4 par rapport à l’inclusiona
| |
Semaine 4
|
41,1*
|
6,3
|
41,0*
|
7,7
| |
Semaine 16
|
58,4*
|
16,7
|
56,3*
|
20,9
| |
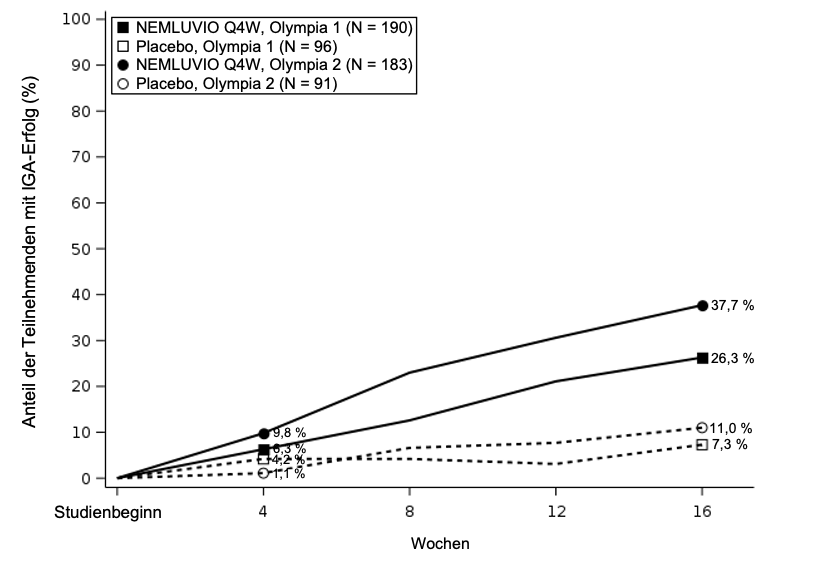
% de patients avec IGA de 0 ou 1 à la semaine 16a
|
26,3#
|
7,3
|
37,7*
|
11
| |
% de patients avec PP-NRS <2a
| |
Semaine 4
|
21,6*
|
1,0
|
19,7*
|
2,2
| |
Semaine 16
|
34,2*
|
4,2
|
35,0*
|
7,7
| |
% de patients avec amélioration du SD-NRS ≥4 par rapport à l’inclusiona
| |
Semaine 4
|
31,1*
|
5,2
|
37,2*
|
9,9
| |
Semaine 16
|
50,0*
|
11,5
|
51,9*
|
20,9
|
a Lorsque des patients recevaient un traitement de secours, une stratégie de variable composite était appliquée: les données de base au moment de l’administration du traitement de secours/après le traitement de secours étaient définies comme la pire valeur possible, et la réponse était dérivée de la valeur des données de base. Les patients pour lesquels des résultats étaient manquants ont été considérés comme non-répondeurs
b Non ajusté en fonction de la multiplicité
* Valeur p <0,0001, # valeur p =0,0025, ajustée par strate à l’aide des variables de stratification randomisées (centre d’analyse et poids corporel à l’inclusion [<90 kg, ≥90 kg])
§ Valeur p <0,0001 ajustée par strate vs placebo (ANCOVA MI-MAR)
|
Figure 2 – Pourcentage de patients présentant une amélioration ≥4 du score PP-NRS entre l’inclusion et la semaine 16
| |
| |
Figure 3 – Pourcentage de répondeurs IGA entre l’inclusion et la semaine 16
| |
|
|
|

