CompositionPrincipe actif
Faricimabum (produit par génie génétique à l'aide de cellules CHO [ovaire de hamster chinois]).
Excipients
L-histidinum, acidum aceticum, L-methioninum, polysorbatum 20 (produit à partir de maïs génétiquement modifié), natrii chloridum, saccharum (produit à partir de betterave sucrière génétiquement modifiée), aqua ad iniectabile.
Une dose unique (0,05 ml de solution injectable) contient 0,028 mg de sodium.
Indications/Possibilités d’emploiTraitement de la forme néovasculaire (humide) de la dégénérescence maculaire liée à l'âge (DMLAn).
Traitement de l'œdème maculaire diabétique (OMD).
Traitement d'un œdème maculaire secondaire à une occlusion veineuse rétinienne (occlusion d'une branche veineuse rétinienne [OBVR] et occlusion de la veine centrale de la rétine [OVCR]).
Posologie/Mode d’emploiGénéralités
Uniquement destiné à l'injection intravitréenne. Vabysmo doit être administré par un médecin qualifié, expérimenté dans l'administration d'injections intravitréennes. Chaque flacon ou seringue préremplie ne doit être utilisé(e) que pour traiter un seul œil.
Forme néovasculaire (humide) de la dégénérescence maculaire liée à l'âge (DMLAn)
La dose recommandée de Vabysmo est de 6 mg (0,05 ml) administrés en injection intravitréenne toutes les 4 semaines (environ tous les 28 ± 7 jours ou une fois par mois). Le traitement peut ensuite être individualisé dans le cadre d'un schéma thérapeutique T&E («Treat-and-extend»). Selon l'évaluation médicale de l'épaisseur de la rétine centrale (Central Subfield Thickness, CST) et/ou de l'acuité visuelle du patient, l'intervalle entre les injections peut être prolongé jusqu'à un maximum de 16 semaines (4 mois).
En cas de détérioration de la CST et/ou de l'acuité visuelle, l'intervalle de traitement doit à nouveau être raccourci en conséquence (voir «Propriétés/Effets, Pharmacodynamique»).
Chez certains patients, des injections toutes les 4 semaines (environ tous les 28 ± 7 jours ou une fois par mois) peuvent s'avérer nécessaires.
La surveillance entre les rendez-vous pour l'administration de la dose se fera en fonction de l'état du patient/de la patiente et du jugement du médecin.
Œdème maculaire diabétique (OMD)
La dose recommandée de Vabysmo est de 6 mg (0,05 ml) administrés en injection intravitréenne toutes les 4 semaines (environ tous les 28 ± 7 jours ou une fois par mois) lors des 4 premières injections. Le traitement peut ensuite être individualisé dans le cadre d'un schéma T&E («Treatandextend»). Selon l'évaluation médicale de la CST et/ou de l'acuité visuelle du patient, l'intervalle entre les injections peut être prolongé jusqu'à un maximum de 16 semaines (4 mois). En cas de détérioration de la CST et/ou de l'acuité visuelle, l'intervalle de traitement doit à nouveau être raccourci en conséquence (voir «Propriétés/Effets, Pharmacodynamique»).
La surveillance entre les rendez-vous pour l'administration de la dose se fera en fonction de l'état du patient/de la patiente et du jugement du médecin, mais une surveillance mensuelle entre les injections n'est pas nécessaire.
Œdème maculaire secondaire à une occlusion veineuse rétinienne (OBVR et OVCR)
La dose recommandée de Vabysmo est de 6 mg (0,05 ml) administrés en injection intravitréenne toutes les 4 semaines (environ tous les 28 ± 7 jours ou une fois par mois); trois injections mensuelles consécutives ou plus peuvent être nécessaires jusqu'à l'obtention de l'acuité visuelle maximale et/ou la disparition de tout signe d'activité de la maladie. Le traitement peut ensuite être individualisé dans le cadre d'un schéma T&E («Treat-and-extend»). Selon l'évaluation médicale de la CST et/ou de l'acuité visuelle du patient, l'intervalle entre les injections peut être prolongé. En cas de détérioration de la CST et/ou de l'acuité visuelle, l'intervalle de traitement doit être raccourci en conséquence et toute nouvelle prolongation de l'intervalle de traitement après stabilisation doit être soigneusement évaluée (voir «Propriétés/Effets, Pharmacodynamique»). Des intervalles entre les injections supérieurs à 4 mois n'ont pas été évalués.
La surveillance entre les rendez-vous pour l'administration de la dose se fera en fonction de l'état du patient/de la patiente et du jugement du médecin, mais une surveillance mensuelle entre les injections n'est pas nécessaire.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Durée du traitement
Vabysmo est destiné au traitement à long terme.
Ajustement de la posologie du fait d'effets indésirables/d'interactions
Aucun ajustement de la posologie de Vabysmo n'est recommandé.
Patients présentant des troubles de la fonction hépatique
Aucune étude spécifique n'a été réalisée chez des patients présentant des troubles de la fonction hépatique (voir «Pharmacocinétique, Cinétique pour certains groupes de patients»).
Mais aucun ajustement posologique n'est nécessaire chez les patients présentant des troubles de la fonction hépatique.
Patients présentant des troubles de la fonction rénale
Aucune étude spécifique n'a été réalisée chez des patients présentant des troubles de la fonction rénale (voir «Pharmacocinétique, Cinétique pour certains groupes de patients»).
Mais aucun ajustement posologique n'est nécessaire chez les patients présentant des troubles de la fonction rénale.
Patients âgés
Dans les six études cliniques de phase III, environ 58% des patients (1496/2571) ayant reçu un traitement par Vabysmo après la randomisation étaient âgés de ≥65 ans. L'analyse pharmacocinétique de population a montré un effet de l'âge sur la pharmacocinétique oculaire du faricimab, qui n'a cependant pas été considéré comme cliniquement significatif. Ces études n'ont révélé aucune différence importante en termes d'efficacité ou de sécurité du faricimab à un âge avancé. Chez les patients dont l'âge est ≥65 ans, aucun ajustement posologique n'est nécessaire (voir «Pharmacocinétique, Cinétique pour certains groupes de patients»).
Enfants et adolescents
La sécurité et l'efficacité de Vabysmo n'ont pas été évaluées chez les patients pédiatriques.
Groupes de patients particuliers
Aucun ajustement posologique particulier n'est nécessaire dans les populations étudiées (p.ex. personnes âgées ou en fonction du sexe ou de l'ethnie).
Prise retardée
En cas d'omission ou de retard de l'administration d'une injection, le patient/la patiente doit être examiné(e) par un médecin dès que possible. Le traitement doit ensuite être poursuivi selon le jugement du médecin.
Vabysmo doit être arrêté si les résultats visuels et/ou anatomiques indiquent que la poursuite du traitement n'apporte pas de bénéfice au patient/à la patiente.
Mode d'administration
Avant l'administration, Vabysmo doit être soumis à un contrôle visuel visant à rechercher des particules solides et un changement de coloration.
Immédiatement après l'injection intravitréenne, les patients doivent être surveillés afin de détecter une éventuelle augmentation de la pression intraoculaire, par exemple en vérifiant la perfusion de la tête du nerf optique ou en réalisant une tonométrie. Un équipement stérile pour une éventuelle paracentèse doit être disponible.
Après une injection intravitréenne, les patients doivent être informés de la nécessité de signaler sans délai tout symptôme évocateur d'une endophtalmie (p.ex. perte de vision, douleurs oculaires, rougeur oculaire, photophobie, troubles visuels).
Les remarques concernant l'utilisation contiennent des instructions détaillées sur l'administration de Vabysmo (voir «Instructions d'emploi»).
Contre-indicationsVabysmo est contre-indiqué chez les patients présentant une infection oculaire ou périoculaire.
Vabysmo est contre-indiqué chez les patients présentant une inflammation intraoculaire active.
Vabysmo est contre-indiqué chez les patients présentant une hypersensibilité connue au faricimab ou à l'un des excipients. Les réactions d'hypersensibilité peuvent se manifester sous la forme d'éruption cutanée, de prurit, d'urticaire, d'érythème ou d'inflammation intraoculaire sévère.
Mises en garde et précautionsRéactions liées à l'injection intravitréenne
Les injections intravitréennes, y compris celles de Vabysmo, ont été associées à une endophtalmie, une inflammation intraoculaire, un décollement de rétine rhegmatogène, une déchirure rétinienne et une cataracte iatrogène, d'origine traumatique. Des techniques d'injection aseptiques adéquates doivent toujours être utilisées lors de l'administration de Vabysmo. Les patients doivent être informés de la nécessité de signaler sans délai tout symptôme (tels que douleur, perte de vision, photophobie, vision floue, mouches volantes ou rougeurs) évocateur d'une endophtalmie ou de l'un des événements mentionnés ci-dessus, afin de permettre un traitement immédiat et approprié.
Une augmentation passagère de la pression intraoculaire (PIO) a été observée dans les 60 minutes suivant des injections intravitréennes, y compris celles de Vabysmo. Des précautions particulières sont nécessaires chez les patients atteints d'un glaucome insuffisamment traité (Vabysmo ne doit pas être injecté si la PIO est ≥30 mmHg). Dans tous les cas, la pression intraoculaire ainsi que la perfusion de la tête du nerf optique et/ou l'acuité visuelle doivent être surveillées et, le cas échéant, traitées de manière appropriée.
Effets systémiques
Des rapports font état d'effets indésirables systémiques, y compris d'événements thromboemboliques artériels, et il existe un risque théorique que ceux-ci puissent être liés à l'inhibition du VEGF. Dans les études cliniques sur le faricimab, une faible incidence d'événements thromboemboliques artériels a été observée chez les patients atteints de DMLAn, d'OMD, d'OBVR et d'OVCR.
Immunogénicité
Le principe actif de Vabysmo est une protéine thérapeutique. Il existe donc un risque de réaction immunitaire à Vabysmo. Les patients doivent être informés de la nécessité de signaler tout signe ou symptôme d'une inflammation intraoculaire, par exemple une perte de vision, des douleurs oculaires, une augmentation de la sensibilité à la lumière, des mouches volantes ou l'aggravation d'une rougeur oculaire existante, car il pourrait s'agir de signes cliniques d'hypersensibilité.
Traitement bilatéral
La sécurité et l'efficacité de Vabysmo n'ont pas été évaluées lors de l'administration dans les deux yeux.
Administration concomitante d'autres médicaments anti-VEGF
Aucune donnée n'est disponible concernant l'administration concomitante de Vabysmo et de médicaments anti-VEGF dans le même œil.
Interruption du traitement
Le traitement doit être interrompu dans un premier temps chez les patients suivants:
·Chez les patients présentant un décollement de rétine rhegmatogène, des trous maculaires au stade 3 ou 4, une déchirure rétinienne; le traitement ne doit pas être repris avant qu'une correction appropriée n'ait été réalisée.
·Chez les patients présentant une diminution, liée au traitement, de la meilleure acuité visuelle corrigée (MAVC) de ≥30 lettres par rapport à la dernière évaluation de l'acuité visuelle; le traitement sera poursuivi au plus tôt lors du rendez-vous suivant prévu pour le traitement.
·Chez les patients ayant subi une chirurgie intraoculaire dans les 28 jours précédents ou chez lesquels une telle chirurgie est prévue dans les 28 prochains jours; le traitement sera poursuivi au plus tôt lors du rendez-vous suivant prévu pour le traitement.
Déchirure de l'épithélium pigmentaire rétinien
Les facteurs de risque associés au développement d'une déchirure de l'épithélium pigmentaire rétinien à la suite d'un traitement de la DMLAn par un agent anti-VEGF incluent un décollement étendu et/ou important de l'épithélium pigmentaire. La prudence est de rigueur lors de l'instauration d'un traitement par Vabysmo chez des patients présentant ces facteurs de risque de déchirure de l'épithélium pigmentaire rétinien.
Groupes de patients chez lesquels les données sont limitées
Les données concernant le traitement de patients atteints d'OMD avec un taux d'HbA1c supérieur à 10%, une rétinopathie diabétique (RD) proliférante à haut risque, ou de patients atteints de DMLAn, d'OMD, d'OBVR et d'OVCR avec une infection systémique active sont limitées. Il n'existe également aucune donnée concernant le traitement par Vabysmo de patients atteints de diabète, d'OBVR et d'OVCR présentant une hypertension artérielle non contrôlée. Ce manque d'informations doit être pris en considération par le médecin lors du traitement de tels patients.
Abus médicamenteux et dépendance au médicament
Rien n'indique que Vabysmo soit associé à un risque d'utilisation abusive du médicament ou de dépendance.
Remarques complémentaires
Vabysmo, solution injectable par voie intravitréenne, contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu'il est essentiellement «sans sodium».
Dans le cadre des mesures de réduction du risque, Roche met à disposition du matériel de formation et des brochures d'information destinés aux spécialistes et aux patients.
InteractionsAucune étude d'interactions n'a été réalisée avec Vabysmo.
Grossesse, allaitementFemmes en âge de procréer
Les femmes en âge de procréer doivent utiliser des méthodes de contraception efficaces pendant le traitement par Vabysmo et jusqu'à 3 mois après l'administration de la dernière dose de Vabysmo.
Grossesse
Il n'existe aucune donnée concernant l'emploi de Vabysmo chez la femme enceinte.
Une étude menée chez des guenons cynomolgus gravides n'a révélé aucun effet indésirable (voir «Données précliniques, Toxicité sur la reproduction»).
Il a été démontré que l'inhibition du VEGF est à l'origine de malformations, d'une résorption embryofœtale et d'un poids fœtal réduit. L'inhibition du VEGF a aussi des effets avérés sur le développement folliculaire, la fonction du corps jaune et la fertilité. Il n'existe aucune étude spécifique sur les effets d'une inhibition de l'Ang-2 sur la grossesse. Selon des données non cliniques, l'inhibition de l'Ang-2 peut avoir des effets comparables à ceux d'une inhibition du VEGF. Après administration intraoculaire de Vabysmo, l'exposition systémique est très faible.
On ignore si le faricimab traverse la barrière placentaire ou s'il peut nuire à l'enfant à naître lorsqu'il est utilisé chez la femme enceinte. En raison du mécanisme d'action des inhibiteurs du VEGF et de l'Ang-2, il existe un risque potentiel d'altération de la fertilité féminine et du développement embryofœtal. Bien que l'exposition systémique soit très faible après une administration intraoculaire, le faricimab ne doit pas être utilisé pendant la grossesse, à moins que l'état clinique de la femme ne justifie le recours au traitement.
Accouchement
La sécurité d'emploi de Vabysmo pendant le travail et l'accouchement n'a pas été évaluée.
Allaitement
On ignore si Vabysmo est excrété dans le lait maternel humain. Aucune étude n'a été réalisée pour évaluer les effets de Vabysmo sur la production de lait ou sa présence dans le lait maternel. Étant donné que de nombreux médicaments passent dans le lait maternel et qu'il existe un potentiel d'absorption et de troubles de la croissance et du développement du nourrisson, la prudence est recommandée lors de l'administration de Vabysmo pendant l'allaitement. Le bénéfice de l'allaitement pour le développement et la santé de l'enfant doit être évalué par rapport à la nécessité clinique du traitement par Vabysmo pour la mère et à l'ensemble des effets indésirables possibles de Vabysmo pour l'enfant allaité.
Fertilité
Aucune étude n'a été réalisée sur la reproduction ou la fertilité. Dans une étude menée avec le faricimab à des doses allant jusqu'à 3 mg/œil (8 à 10 fois l'exposition clinique sur la base de l'AUC) administrées pendant 6 mois à des singes cynomolgus, aucun effet sur les organes reproducteurs n'a été constaté. L'inhibition du VEGF a des effets avérés sur le développement folliculaire, la fonction du corps jaune et la fertilité. En raison du mécanisme d'action des inhibiteurs du VEGF et de l'Ang-2, il existe un risque potentiel d'altération de la fertilité féminine et du développement embryofœtal. L'exposition systémique étant faible après une administration intraoculaire, ce risque est cependant considéré comme faible.
Effet sur l’aptitude à la conduite et l’utilisation de machinesVabysmo peut avoir une légère influence sur l'aptitude à la conduite ou l'utilisation de machines du fait de possibles troubles visuels temporaires après l'injection intravitréenne ou l'examen oculaire y étant associé. Les patients ne doivent pas conduire de véhicules ou utiliser des machines tant qu'ils n'ont pas récupéré une fonction visuelle suffisante.
Effets indésirablesRésumé du profil de sécurité issu d'études cliniques
Les données de sécurité suivantes proviennent d'études de phase III contrôlées contre traitement actif (aflibercept).
La population d'analyse de la sécurité comprenait au total 4489 patients provenant des six études cliniques de phase III (2567 patients traités par Vabysmo; 664 atteints de DMLAn, 1262 atteints d'OMD et 641 atteints d'OBVR/OVCR). Les effets indésirables les plus graves étaient les suivants: cataracte grave (0,8%), uvéite (0,5%), endophtalmie (0,4%), hyalite (0,4%), déchirure rétinienne (0,2%), décollement de rétine rhegmatogène (0,1%) et cataracte d'origine traumatique (< 0,1%).
Les effets indésirables les plus fréquemment rapportés chez les patients traités par Vabysmo étaient les suivants: cataracte (10%), hémorragie conjonctivale (7%), décollement du corps vitré (4%), augmentation de la pression intraoculaire (4%), opacités vitréennes (4%), douleurs oculaires (3%) et déchirure de l'épithélium pigmentaire rétinien (seulement DMLAn) (3%).
Liste des effets indésirables
Les données de sécurité mentionnées ci-dessous comprennent tous les effets indésirables issus des six études cliniques de phase III dans les indications DMLAn, OMD, OBVR et OVCR ainsi que de la surveillance après la mise sur le marché, avec une imputabilité possiblement liée à la procédure d'injection ou au médicament. Les réactions indésirables sont répertoriées par classe de système d'organes MedDRA et indiquées en utilisant la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à < 1/10), «occasionnels» (≥1/1000 à < 1/100), «rares» (≥1/10'000 à < 1/1000) et fréquence inconnue (ne peut être estimée sur la base des données disponibles).
Tableau 1: Résumé des effets indésirables
|
Effets indésirables
|
Vabysmo
N = 2567
|
Catégorie de fréquence
| |
Affections oculaires
| |
Cataracte
|
9,7%
|
Fréquents
| |
Hémorragie conjonctivale
|
6,7%
|
Fréquents
| |
Décollement du corps vitré
|
4,2%
|
Fréquents
| |
Augmentation de la pression intraoculaire
|
3,5%
|
Fréquents
| |
Opacités vitréennes (mouches volantes)
|
3,5%
|
Fréquents
| |
Déchirure de l'EPR (seulement DMLAn)
|
2,9%
|
Fréquents
| |
Douleurs oculaires
|
2,5%
|
Fréquents
| |
Abrasion de la cornée
|
0,9%
|
Occasionnels
| |
Irritation oculaire
|
0,8%
|
Occasionnels
| |
Larmoiement accru
|
0,8%
|
Occasionnels
| |
Prurit oculaire
|
0,7%
|
Occasionnels
| |
Gêne oculaire
|
0,7%
|
Occasionnels
| |
Hyperémie oculaire
|
0,7%
|
Occasionnels
| |
Vision floue
|
0,7%
|
Occasionnels
| |
Iritis
|
0,6%
|
Occasionnels
| |
Baisse de l'acuité visuelle
|
0,6%
|
Occasionnels
| |
Uvéite
|
0,5%
|
Occasionnels
| |
Endophtalmie
|
0,4%
|
Occasionnels
| |
Sensation de corps étranger
|
0,4%
|
Occasionnels
| |
Hémorragie du corps vitré
|
0,4%
|
Occasionnels
| |
Hyalite
|
0,4%
|
Occasionnels
| |
Iridocyclite
|
0,3%
|
Occasionnels
| |
Hyperémie conjonctivale
|
0,2%
|
Occasionnels
| |
Douleurs liées à la procédure
|
0,2%
|
Occasionnels
| |
Déchirure de la rétine
|
0,2%
|
Occasionnels
| |
Décollement de rétine rhegmatogène
|
0,1%
|
Occasionnels
| |
Cataracte d'origine traumatique
|
< 0,1%
|
Rares
| |
Baisse passagère de l'acuité visuelle
|
< 0,1%
|
Rares
| |
Vascularite rétinienne*
|
-
|
Fréquence inconnue
| |
Vasculite rétinienne occlusive*
|
-
|
Fréquence inconnue
|
* Il s'agit d'effets indésirables identifiés sur la base de déclarations spontanées après la mise sur le marché. Comme ces données reposent sur des renseignements fournis volontairement par des individus issus d'une population de taille incertaine, il n'est pas possible d'estimer leur fréquence de manière fiable.
Description d'effets indésirables spécifiques et informations complémentaires
Après administration intravitréenne d'inhibiteurs du VEGF, il existe un risque théorique d'événements thromboemboliques artériels, y compris d'accident vasculaire cérébral et d'infarctus du myocarde. Dans les études cliniques menées avec Vabysmo chez des patients atteints de DMLAn, d'OMD, d'OBVR et d'OVCR, l'incidence des événements thromboemboliques était faible. En tenant compte de toutes les indications, aucune différence notable n'a été observée entre les groupes traités par Vabysmo et ceux traités par le comparateur.
Effets indésirables identifiés après la mise sur le marché
De rares cas de vascularite rétinienne et/ou de vasculite rétinienne occlusive ont été rapportés après la mise sur le marché. Des vascularites rétiniennes et des vasculites rétiniennes occlusives ont également été rapportées chez des patients recevant d'autres traitements administrés par voie intravitréenne (IVT).
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes doses supérieures à celles requises pour le traitement recommandé n'ont pas été évaluées. Un surdosage avec un volume d'injection supérieur à celui recommandé peut provoquer une augmentation de la pression intraoculaire.
En cas de surdosage, la pression intraoculaire doit être surveillée et le cas échéant traitée si le médecin traitant le juge nécessaire.
Propriétés/EffetsCode ATC
S01LA09
Mécanisme d'action
Le faricimab est un anticorps bispécifique humanisé de type immunoglobuline G1 (IgG1) qui agit en inhibant deux voies de signalisation distinctes par neutralisation de l'Ang-2 (angiopoïétine-2) et du VEGF-A (facteur de croissance de l'endothélium vasculaire A). L'Ang-2 provoque une instabilité vasculaire en favorisant la déstabilisation de l'endothélium, la perte de péricytes et l'angiogenèse pathologique et en potentialisant ainsi les fuites vasculaires et les inflammations. En outre, elle sensibilise les vaisseaux sanguins à l'activité du VEGF-A, ce qui accroît encore la déstabilisation vasculaire. L'Ang-2 et le VEGF-A augmentent de manière synergique la perméabilité vasculaire et stimulent la néovascularisation. En inhibant l'Ang-2 et le VEGF-A, le faricimab réduit la perméabilité et l'inflammation vasculaires, inhibe l'angiogenèse pathologique et rétablit la stabilité vasculaire.
Pharmacodynamique
Une suppression des concentrations oculaires médianes d'Ang-2 libre et de VEGF-A libre par rapport à la valeur initiale a été observée à partir du 7e jour dans les six études de phase III décrites ci-dessous.
DMLAn
Les réductions de l'épaisseur moyenne du sous-champ central de la fovéa (Central Subfield Thickness, CST) entre l'inclusion et la semaine 48 étaient similaires lors de l'administration de Vabysmo et lors de celle de l'aflibercept. Dans les études TENAYA et LUCERNE, la réduction moyenne de la CST entre l'inclusion et les visites visant à examiner le critère d'évaluation principal (moyenne des semaines 40, 44 et 48) était respectivement de -137 μm et -137 μm lors de l'utilisation de Vabysmo à des intervalles de 8 (q8w), 12 (q12w) et 16 semaines (q16w), contre -129 μm et -131 μm lors de l'utilisation de l'aflibercept. Ces réductions moyennes de la CST se sont maintenues tout au long de la 2e année. Vabysmo et l'aflibercept ont eu un effet comparable sur la réduction du liquide intrarétinien (LIR), du liquide sous-rétinien (LSR) et du décollement de l'épithélium pigmentaire (DEP). Lors des visites visant à examiner le critère d'évaluation principal, les pourcentages de patients sans LIR dans les études TENAYA et LUCERNE étaient respectivement de 76% à 82% et de 78% à 85% sous le traitement par Vabysmo contre 74% à 85% et 78% à 84% sous le traitement par l'aflibercept. Les pourcentages de patients sans LSR dans les deux études étaient respectivement de 70% à 79% et de 66% à 78% sous le traitement par Vabysmo contre 66% à 78% et 62% à 76% sous le traitement par l'aflibercept. Les pourcentages de patients sans DEP dans les deux études étaient respectivement de 3% à 8% et de 3% à 6% sous le traitement par Vabysmo contre 8% à 10% et 7% à 9% sous le traitement par l'aflibercept. Ces réductions du LIR, du LSR et du DEP se sont maintenues durant la 2e année (semaines 104 à 108).
Dans les deux études, les modifications de la surface totale des lésions liées à une néovascularisation choroïdienne (NVC) et les diminutions de la surface de NVC avec fuites de sang et de liquide entre l'inclusion et la semaine 48 étaient comparables chez les patients traités par Vabysmo et chez les patients traités par l'aflibercept.
OMD
Dans les deux études YOSEMITE et RHINE, la réduction de la CST moyenne par rapport à la valeur initiale entre la semaine 4 et la semaine 100 a été numériquement plus élevée chez les patients traités par Vabysmo toutes les 8 semaines (q8w) et chez ceux ayant reçu Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w, que chez les patients traités par l'aflibercept q8w. Dans les deux études, le pourcentage de patients sans LIR et sans OMD (défini comme l'obtention d'une CST inférieure à 325 µm, mesurée par OCT) au cours du temps était plus élevé dans les bras sous Vabysmo que dans le bras sous aflibercept. Dans les deux études, les réductions du LSR observées au cours du temps ont été similaires dans les bras sous Vabysmo et dans le bras sous aflibercept. Dans l'étude YOSEMITE, la réduction moyenne de la CST entre l'inclusion et les visites visant à examiner le critère d'évaluation principal (moyenne des semaines 48, 52 et 56) était de 207 µm chez les patients traités par Vabysmo q8w et de 197 µm chez ceux ayant reçu Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w, contre 170 µm chez les patients traités par l'aflibercept q8w; dans l'étude RHINE, les chiffres correspondants étaient de 196 µm, 188 µm et 170 µm. Ces réductions moyennes de la CST se sont maintenues tout au long de la 2e année. Dans l'étude YOSEMITE, le pourcentage de patients sans OMD lors des visites visant à examiner le critère d'évaluation principal (min.-max.) était de 77% à 87% chez les patients traités par Vabysmo q8w et de 80% à 82% chez ceux ayant reçu Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w, contre 64% à 71% chez les patients traités par l'aflibercept q8w; dans l'étude RHINE, les chiffres correspondants étaient de 85% à 90%, 83% à 87% et 71% à 77%. Les résultats se sont maintenus tout au long de la 2e année.
Dans l'étude YOSEMITE, les pourcentages de patients sans LIR lors des visites visant à examiner le critère d'évaluation principal (moyenne des semaines 48, 52 et 56) étaient de 42% à 48% chez les patients traités par Vabysmo q8w et de 34% à 43% chez ceux ayant reçu Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w, contre 22% à 25% chez les patients traités par l'aflibercept q8w; dans l'étude RHINE, les chiffres correspondants étaient de 39% à 43%, 33% à 41% et de 23% à 29%. Ces résultats se sont maintenus tout au long de la 2e année.
OBVR et OVCR
Dans les études de phase III menées chez des patients atteints d'une occlusion d'une branche veineuse rétinienne (OBVR; BALATON) et d'une occlusion de la veine centrale de la rétine/occlusion veineuse hémicentrale (OVCR/OVHC; COMINO), des réductions de la CST moyenne ont été observées entre l'inclusion et la semaine 24 lors de l'administration de Vabysmo toutes les 4 semaines (q4w) et étaient comparables à celles observées sous aflibercept q4w. La réduction moyenne de la CST entre l'inclusion et la semaine 24 était de 311,4 μm sous Vabysmo q4w contre 304,4 μm sous aflibercept q4w dans l'étude BALATON et de 461,6 μm sous Vabysmo q4w contre 448,8 μm sous aflibercept q4w dans l'étude COMINO. Ces réductions de la CST se sont maintenues jusqu'à la semaine 72 comprise, lorsque les patients sont passés à un schéma de traitement par Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w.
Dans les deux études, le pourcentage de patients sans LIR, sans LSR et sans œdème maculaire (défini comme l'obtention d'une CST inférieure à 325 µm) au cours du temps était comparable dans le bras sous Vabysmo et dans le bras sous aflibercept jusqu'à la semaine 24 comprise. Ces résultats se sont maintenus jusqu'à la semaine 72 comprise, lorsque les patients sont passés à un schéma de traitement par Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w.
Dans l'étude BALATON, le pourcentage de patients sans œdème maculaire à la semaine 24 a été de 95,3% dans le bras sous Vabysmo q4w contre 93,9% dans le bras sous aflibercept q4w; le pourcentage de patients sans LIR a été de 72,5% dans le bras sous Vabysmo q4w contre 66% dans le bras sous aflibercept q4w. Le pourcentage de patients sans LSR a été de 91,3% dans le bras sous Vabysmo q4w contre 90,3% dans le bras sous aflibercept q4w.
Dans l'étude COMINO, le pourcentage de patients sans œdème maculaire à la semaine 24 a été de 93,7% dans le bras sous Vabysmo q4w contre 92,0% dans le bras sous aflibercept q4w. Le pourcentage de patients sans LIR a été de 76,2% dans le bras sous Vabysmo q4w contre 70,8% dans le bras sous aflibercept q4w; le pourcentage de patients sans LSR a été de 96,4% dans le bras sous Vabysmo q4w contre 93,4% dans le bras sous aflibercept q4w.
Efficacité clinique
Traitement de la forme néovasculaire de la dégénérescence maculaire liée à l'âge (DMLAn)
La sécurité et l'efficacité du faricimab ont été évaluées dans deux études (TENAYA et LUCERNE) à 2 bras, randomisées (1:1), multicentriques, en double aveugle, menées chez des patients atteints de DMLAn, en comparaison d'un traitement anti-VEGF. Le traitement (respectivement 6 mg de faricimab et 2 mg d'aflibercept) a été administré en injection intravitréenne, initialement toutes les 4 semaines. Dans le bras recevant l'aflibercept, après 3 injections initiales d'aflibercept, l'intervalle entre les injections était de 8 semaines (q8w) pour le reste de l'étude. Dans le bras recevant le faricimab, après 4 doses initiales, l'intervalle entre les injections était ajusté individuellement. L'intervalle entre les injections définitif (fixe) était de 8 semaines (q8w), de 12 semaines (q12w) ou au maximum de 16 semaines (q16w) en fonction de la variation définie selon le protocole de l'étude de la CST mesurée par SD-OCT et/ou de la variation de la MAVC mesurée à l'aide du score en lettres ETDRS, et en fonction de l'évaluation clinique de la présence/absence d'hémorragie maculaire par le médecin traitant aux semaines 20 et 24. À partir de la semaine 60, les patients du bras sous Vabysmo sont passés à un schéma thérapeutique extensible dans lequel l'intervalle entre les injections pouvait à chaque fois être augmenté par paliers de 4 semaines au maximum (jusqu'à q16w) ou diminué par paliers de 8 semaines au maximum (jusqu'à q8w), sur la base d'une évaluation objective automatisée de critères visuels et anatomiques prédéfinis pour l'activité de la maladie. Les patients du bras recevant l'aflibercept conservaient l'intervalle q8w pendant toute la durée de l'étude. Les deux études avaient une durée respective de 112 semaines.
Les études ont inclus au total 1329 patients naïfs de traitement, dont 1135 (85%) ont participé sans interruption aux études jusqu'à la semaine 112. Au total, 1326 patients ont reçu au moins une dose (664 patients dans le bras recevant le faricimab). L'âge moyen [intervalle] de la population étudiée était de 75,9 ans [de 50 à 99 ans].Le critère principal d'évaluation de l'efficacité était la variation moyenne de la MAVC par rapport à la valeur initiale au cours de la première année (sur la base de la moyenne des semaines 40, 44 et 48), laquelle a été déterminée à l'aide du tableau de lettres de l'Early Treatment Diabetic Retinopathy Study (ETDRS) à une distance de 4 mètres. L'hypothèse primaire (non-infériorité) a été confirmée dans les deux études: les patients traités par Vabysmo avec un intervalle entre les injections allant jusqu'à q16w et les patients traités par l'aflibercept q8w présentaient lors de la 1re année une variation moyenne comparable de la MAVC par rapport à leur valeur initiale respective. Dans les deux bras de traitement, de nettes améliorations de la vision par rapport à la valeur initiale ont été observées jusqu'à la semaine 112. Les résultats détaillés des deux études sont présentés ci-dessous dans les tableaux 2 et 3 ainsi que dans la figure 1.
Pourcentage de patients dans les groupes avec un intervalle de traitement personnalisé à la semaine 48 dans les études TENAYA et LUCERNE:
·q16w: 46%, 45%
·q12w: 34%, 33%
·q8w: 20%, 22%
Pourcentage de patients dans les groupes avec un intervalle de traitement personnalisé à la semaine 112 dans les études TENAYA et LUCERNE:
• q16w: 59%, 67%
• q12w: 15%, 14%
·q8w: 26%, 19%
Tableau 2: Résultats d'efficacité lors des visites visant à examiner le critère d'évaluation principala ainsi qu'à 2 ansb dans l'étude TENAYA
|
Résultats d'efficacité
|
TENAYA
| |
|
Année 1
|
Année 2
| |
|
Vabysmo avec un intervalle allant jusqu'à q16w
N = 334
|
Aflibercept q8w
N = 337
|
Vabysmo avec intervalle allant jusqu'à q16w
N = 334
|
Aflibercept q8w
N = 337
| |
Variation moyenne de la MAVC par rapport à la valeur initiale, mesurée à l'aide du score en lettres ETDRS (IC à 95%)
|
5,8
(4,6, 7,1)
|
5,1
(3,9, 6,4)
|
3,7
(2,1, 5,4)
|
3,3
(1,7, 4,9)
| |
Pourcentage de patients avec un gain de ≥15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95%)
|
20,0%
(15,6%, 24,4%)
|
15,7%
(11,9%, 19,6%)
|
22,5%
(17,8%, 27,2%)
|
16,9%
(12,7%, 21,1%)
| |
Pourcentage de patients ayant évité une perte de ≥15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95%)
|
95,4%
(93,0%, 97,7%)
|
94,1%
(91,5%, 96,7%)
|
92,1%
(89,1%, 95,1%)
|
88,6%
(85,1%, 92,2%)
|
a Moyenne des semaines 40, 44 et 48. b Moyenne des semaines 104, 108, 112.
MAVC: meilleure acuité visuelle corrigée.
ETDRS: Early Treatment Diabetic Retinopathy Study.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Tableau 3: Résultats d'efficacité lors des visites visant à examiner le critère d'évaluation principala ainsi qu'à 2 ansb dans l'étude LUCERNE
|
Résultats d'efficacité
|
LUCERNE
| |
|
Année 1
|
Année 2
| |
|
Vabysmo avec un intervalle allant jusqu'à q16w
N = 331
|
Aflibercept q8w
N = 327
|
Vabysmo avec un intervalle allant jusqu'à q16w
N = 331
|
Aflibercept q8w
N = 327
| |
Variation moyenne de la MAVC par rapport à la valeur initiale, mesurée à l'aide du score en lettres ETDRS (IC à 95%)
|
6,6
(5,3, 7,1)
|
6,6
(5,3, 7,8)
|
5,0
(3,4, 6,6)
|
5,2
(3,6, 6,8)
| |
Pourcentage de patients avec un gain de ≥15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95%)
|
20,2%
(15,9%, 24,6%)
|
22,2%
(17,7%, 26,8%)
|
22,4%
(17,8%, 27,1%)
|
21,3%
(16,8%, 25,9%)
| |
Pourcentage de patients ayant évité une perte de ≥15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95%)
|
95,8%
(93,6%, 98,0%)
|
97,3%
(95,5%, 99,1%)
|
92,9%
(90,1%, 95,8%)
|
93,2%
(90,2%, 96,2%)
|
a Moyenne des semaines 40, 44 et 48. b Moyenne des semaines 104, 108, 112.
MAVC: meilleure acuité visuelle corrigée.
ETDRS: Early Treatment Diabetic Retinopathy Study.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Figure 1: Études de phase III regroupées dans la DMLAn (TENAYA et LUCERNE): courbe de variation de la MAVC dans l'œil étudié entre l'inclusion et la semaine 112: méthode MMRM (évaluation primaire) (population en ITT)
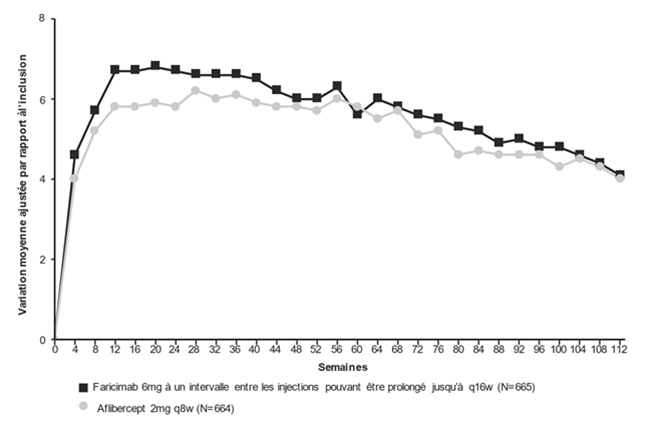
Dans les deux études TENAYA et LUCERNE, les améliorations de la MAVC et de la CST à la semaine 60 par rapport à l'inclusion étaient comparables dans les deux bras de traitement et concordaient avec celles observées à la semaine 48.
Les résultats d'efficacité dans tous les sous-groupes évaluables (p.ex. définis en fonction de l'âge, du sexe, de l'ethnie, de l'acuité visuelle à l'inclusion, du type de lésion, de la taille de la lésion) de chaque étude ainsi que de l'analyse regroupée correspondaient aux résultats observés dans la population globale.
Dans les deux études, l'administration de Vabysmo à un intervalle allant jusqu'à q16w a entraîné des améliorations cliniquement significatives s'agissant du résultat combiné du questionnaire sur la fonction visuelle du National Eye Institute (National Eye Institute Visual Function Questionnaire ou NEI VFQ-25) entre l'inclusion et la semaine 48, lesquelles étaient comparables à celles observées lors de l'administration d'aflibercept q8w. À la semaine 48, les patients inclus dans les bras sous Vabysmo des études TENAYA et LUCERNE ont obtenu une amélioration du résultat combiné du NEI VFQ-25 de ≥4 points par rapport à la valeur initiale.
Traitement de l'œdème maculaire diabétique (OMD)
La sécurité et l'efficacité du faricimab ont été évaluées sur une période de 2 ans dans deux études (YOSEMITE et RHINE) à 3 bras, randomisées (1:1:1), multicentriques, en double aveugle, menées chez des patients atteints d'OMD, en comparaison d'un traitement anti-VEGF. Les patients des trois bras de l'étude ont reçu des injections intravitréennes de 6 mg de faricimab q8w (après 6 injections mensuelles au début du traitement), de 6 mg de faricimab à un intervalle personnalisé entre les injections d'au maximum q16w (après 4 injections mensuelles au début du traitement) ou de 2 mg d'aflibercept q8w (après 5 injections mensuelles au début du traitement). Dans le bras recevant le faricimab à un intervalle entre les injections pouvant être prolongé jusqu'à q16w, le traitement a été administré selon un schéma standardisé T&E. Selon la variation de la CST mesurée par OCT et/ou la variation de la MAVC mesurée à l'aide du score en lettres ETDRS, l'intervalle personnalisé entre les injections dans le groupe recevant le faricimab a pu être prolongé de 4 semaines à chaque rendez-vous pour l'administration de la préparation à l'étude, ou être raccourci de 4 ou 8 semaines (voir «Posologie/Mode d'emploi»).
Les études ont inclus au total 1891 patients (dont environ 94% atteints de diabète sucré de type 2), parmi lesquels 1622 patients (85,8%) ont terminé complètement les études (jusqu'à la semaine 100). Au total, 1887 patients ont été traités avec au moins une dose jusqu'à la fin de la semaine 56 (1262 par Vabysmo). L'âge moyen [intervalle] des patients examinés était de 62,2 ans [de 24 à 91 ans]. La population de l'étude a englobé des patients naïfs d'anti-VEGF (78%) et des patients ayant déjà reçu un traitement anti-VEGF (22%).Le critère principal d'évaluation de l'efficacité était la variation moyenne de la MAVC entre l'inclusion et la fin de la première année (moyenne des semaines 48, 52 et 56), laquelle a été déterminée à l'aide du tableau de lettres de l'Early Treatment Diabetic Retinopathy Study (ETDRS) à une distance de 4 mètres. Dans les deux études, l'hypothèse primaire (non-infériorité) a été confirmée dans les deux bras de traitement: les patients traités par Vabysmo q8w ou par Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w et les patients traités par l'aflibercept q8w présentaient à 1 an une variation moyenne comparable de la MAVC par rapport à leur valeur initiale respective. Ces améliorations de la vision se sont maintenues tout au long de la 2e année.
Après 4 doses mensuelles initiales, les patients du bras sous Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w pouvaient avoir reçu au total au moins 6 et au plus 21 injections jusqu'à la semaine 96 comprise. Dans les études YOSEMITE et RHINE, à la semaine 52, respectivement 74% et 71% des patients des bras sous Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w avaient atteint un intervalle entre les injections de q16w ou q12w (q16w chez 53% et 51%, q12w chez 21% et 20%). Respectivement 75% et 84% des patients inclus dans les études YOSEMITE et RHINE ont conservé un intervalle entre les injections ≥ q12w sans raccourcissement inférieur à q12w jusqu'à la semaine 96 comprise; respectivement 70% et 82% des patients traités avec un intervalle entre les injections de q16w à la semaine 52 ont conservé l'intervalle q16w sans raccourcissement jusqu'à la semaine 96 comprise. À la semaine 96, 78% des patients des bras sous Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w avaient atteint un intervalle entre les injections de q16w ou q12w dans les deux études (q16w chez 60% et 65%, q12w chez 18% et 14%). Chez respectivement 4% et 6% des patients inclus dans les études YOSEMITE et RHINE, l'intervalle a été prolongé à q8w et les patients ont conservé un intervalle entre les injections ≤ q8w jusqu'à la semaine 96 comprise; respectivement 3% et 5% n'ont conservé qu'un intervalle q4w jusqu'à la fin de la semaine 96.
Les tableaux 4, 5, 6, 7 et la figure 2 ci-dessous présentent les résultats détaillés des analyses des études YOSEMITE et RHINE.
Tableau 4: Résultats d'efficacité lors des visites à 1 ana et à 2 ansb visant à examiner le critère d'évaluation principal dans l'étude YOSEMITE
|
Résultats d'efficacité
|
YOSEMITE
| |
|
Année 1
|
Année 2
| |
|
Vabysmo
q8w
N = 315
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 313
|
Aflibercept q8w
N = 312
|
Vabysmo
q8w
N = 315
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 313
|
Aflibercept
q8w
N = 312
| |
Variation moyenne de la MAVC mesurée à l'aide du score en lettres ETDRS par rapport à la valeur initiale (IC à 97,5% durant l'année 1 et à 95% durant l'année 2)
|
10,7
(9,4, 12,0)
|
11,6
(10,3, 12,9)
|
10,9
(9,6, 12,2)
|
10,7
(9,4, 12,1)
|
10,7
(9,4, 12,1)
|
11,4
(10,0, 12,7)
| |
Pourcentage de patients avec un gain en termes de MAVC d'au moins 15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95% durant les années 1 et 2)
|
29,2%
(23,9%, 34,5%)
|
35,5%
(30,1%, 40,9%)
|
31,8%
(26,6%, 37,0%)
|
37,2%
(31,4%, 42,9%)
|
38,2%
(32,8%, 43,7%)
|
37,4%
(31,7%, 43,0%)
| |
Pourcentage de patients ayant évité une perte en termes de MAVC d'au moins 15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95% durant les années 1 et 2)
|
98,1%
(96,5%, 99,7%)
|
98,6%
(97,2%, 100,0%)
|
98,9%
(97,6%, 100,0%)
|
97,6%
(95,7%, 99,5%)
|
97,8%
(96,1%, 99,5%)
|
98,0%
(96,2%, 99,7%)
|
a Moyenne des semaines 48, 52, 56. b Moyenne des semaines 92, 96, 100.
MAVC: meilleure acuité visuelle corrigée.
ETDRS: Early Treatment Diabetic Retinopathy Study.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Remarque: les données présentées relatives au pourcentage pondéré selon le test CMH pour le bras recevant l'aflibercept se rapportent à la comparaison entre Vabysmo q8w et l'aflibercept. Les données correspondantes relatives au pourcentage pondéré selon le test CMH pour la comparaison entre Vabysmo avec un intervalle entre les injections pouvant être prolongé et l'aflibercept sont cependant similaires à celles présentées ci-dessus.
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale (échelle d'évaluation d'une rétinopathie diabétique issue de l'Early Treatment Diabetic Retinopathy Study).
Tableau 5: Pourcentage de patients avec une amélioration du score à l'ETDRS-DRSS de ≥2 niveaux par rapport à la valeur initiale à la semaine 52 et à la semaine 96 dans l'étude YOSEMITE (population évaluable pour la RD)
|
Résultats d'efficacité
|
YOSEMITE
| |
|
52 semaines
|
96 semaines
| |
|
Vabysmo q8w
N = 237
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 242
|
Aflibercept q8w
N = 229
|
Vabysmo q8w
N = 220
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 234
|
Aflibercept q8w
N = 221
| |
Pourcentage de patients avec une amélioration du score à l'ETDRS-DRSS de ≥2 niveaux par rapport à la valeur initiale (pourcentage pondéré selon le test CMH)
|
46,0%
|
42,5%
|
35,8%
|
51,4%
|
42,8%
|
42,2%
|
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Remarque: les données présentées relatives au pourcentage pondéré selon le test CMH pour le bras recevant l'aflibercept se rapportent à la comparaison entre Vabysmo q8w et l'aflibercept. Les données correspondantes relatives au pourcentage pondéré selon le test CMH pour la comparaison entre le faricimab avec un intervalle entre les injections pouvant être prolongé et l'aflibercept sont cependant similaires à celles présentées ci-dessus.
Tableau 6: Résultats d'efficacité lors des visites à 1 ana et à 2 ansb visant à examiner le critère d'évaluation principal dans l'étude RHINE
|
Résultats d'efficacité
|
RHINE
| |
|
Année 1
|
Année 2
| |
|
Vabysmo q8w
N = 317
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 319
|
Aflibercept q8w
N = 315
|
Vabysmo q8w
N = 317
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 319
|
Aflibercept q8w
N = 315
| |
Variation moyenne de la MAVC mesurée à l'aide du score en lettres ETDRS par rapport à la valeur initiale (IC à 97,5% durant l'année 1 et à 95% durant l'année 2)
|
11,8
(10,6, 13,0)
|
10,8
(9,6, 11,9)
|
10,3
(9,1, 11,4)
|
10,9
(9,5, 12,3)
|
10,1
(8,7, 11,5)
|
9,4
(7,9, 10,8)
| |
Pourcentage de patients avec un gain en termes de MAVC d'au moins 15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95% durant les années 1 et 2)
|
33,8%
(28,4%, 39,2%)
|
28,5%
(23,6%, 33,3%)
|
30,3%
(25,0%, 35,5%)
|
39,8%
(34,0%, 45,6%)
|
31,1%
(26,1%, 36,1%)
|
39,0%
(33,2%, 44,8%)
| |
Pourcentage de patients ayant évité une perte en termes de MAVC d'au moins 15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95% durant les années 1 et 2)
|
98,9%
(97,6%, 100,0%)
|
98,7%
(97,4%, 100,0%)
|
98,6%
(97,2%, 99,9%)
|
96,6%
(94,4%, 98,8%)
|
96,8%
(94,8%, 98,9%)
|
97,6%
(95,7%, 99,5%)
|
a Moyenne des semaines 48, 52, 56. b Moyenne des semaines 92, 96, 100.
MAVC: meilleure acuité visuelle corrigée.
ETDRS: Early Treatment Diabetic Retinopathy Study.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Remarque: les données présentées relatives au pourcentage pondéré selon le test CMH pour le bras recevant l'aflibercept se rapportent à la comparaison entre Vabysmo q8w et l'aflibercept. Les données correspondantes relatives au pourcentage pondéré selon le test CMH pour la comparaison entre Vabysmo avec un intervalle entre les injections pouvant être prolongé et l'aflibercept sont cependant similaires à celles présentées ci-dessus.
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale (échelle d'évaluation d'une rétinopathie diabétique issue de l'Early Treatment Diabetic Retinopathy Study).
Tableau 7: Pourcentage de patients avec une amélioration du score à l'ETDRS-DRSS de ≥2 niveaux par rapport à la valeur initiale à la semaine 52 et à la semaine 96 dans l'étude RHINE (population évaluable pour la RD)
|
Résultats d'efficacité
|
RHINE
| |
|
52 semaines
|
96 semaines
| |
|
Vabysmo q8w
N = 231
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 251
|
Aflibercept q8w
N = 238
|
Vabysmo q8w
N = 214
|
Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w
N = 228
|
Aflibercept q8w
N = 203
| |
Pourcentage de patients avec une amélioration du score à l'ETDRS-DRSS de ≥2 niveaux par rapport à la valeur initiale (pourcentage pondéré selon le test CMH)
|
44,2%
|
43,7%
|
46,8%
|
53,5%
|
44,3%
|
43,8%
|
ETDRS-DRSS: Early Treatment Diabetic Retinopathy Study Diabetic Retinopathy Severity Scale.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Remarque: les données présentées relatives au pourcentage pondéré selon le test CMH pour le bras recevant l'aflibercept se rapportent à la comparaison entre Vabysmo q8w et l'aflibercept. Les données correspondantes relatives au pourcentage pondéré selon le test CMH pour la comparaison entre Vabysmo avec un intervalle entre les injections pouvant être prolongé et l'aflibercept sont cependant similaires à celles présentées ci-dessus.
Figure 2: Études de phase III regroupées dans l'OMD (YOSEMITE et RHINE): courbe de variation de la MAVC dans l'œil étudié entre l'inclusion et la semaine 100: méthode MMRM (évaluation primaire) (population en ITT)
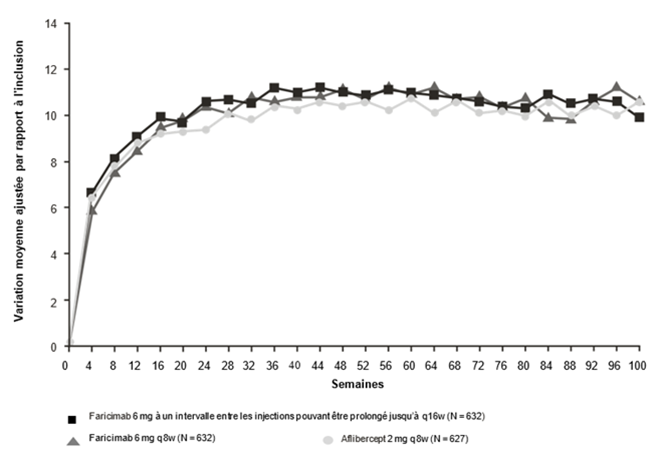
Les résultats d'efficacité chez les patients naïfs de traitement anti-VEGF avant l'inclusion dans l'étude ainsi que dans tous les autres sous-groupes évaluables (p.ex. définis en fonction de l'âge, du sexe, de l'ethnie, du taux d'HbA1c à l'inclusion, de l'acuité visuelle à l'inclusion) de chaque étude correspondaient aux résultats observés dans la population globale respective.
L'efficacité thérapeutique ne dépendait pas du contrôle glycémique. Les résultats obtenus sous le traitement par le faricimab étaient comparables chez les patients dont le taux d'HbA1c s'est amélioré ou détérioré de > 0,5% ou est resté dans les limites de 0,5% de la valeur initiale au cours du temps.
Traitement d'un œdème maculaire secondaire à une OBVR ou à une OVCR
La sécurité et l'efficacité du faricimab ont été évaluées dans deux études multicentriques, menées chez des patients atteints d'œdème maculaire secondaire à une OBVR (BALATON) ou une OVCR/OVHC (COMINO). Ces deux études comprenaient une phase initiale de traitement, de 24 semaines, randomisée (1:1) et contrôlée contre traitement actif (aflibercept). Tous les patients (y compris ceux traités initialement par l'aflibercept) ont ensuite été traités par le faricimab selon un schéma d'administration personnalisé jusqu'à la semaine 68 (dernière visite lors de la semaine 72). Sur la base de l'activité de la maladie (estimée à l'aide d'une évaluation objective et automatisée de critères visuels et anatomiques prédéfinis), l'intervalle entre les injections pouvait à chaque fois être augmenté par paliers de 4 semaines jusqu'à q16w au maximum ou au besoin (détérioration de la CST et/ou de l'acuité visuelle) diminué à nouveau par paliers de 4, 8 ou 12 semaines. Chez les patients pour lesquels une réduction de l'intervalle de traitement avait été nécessaire, cet intervalle n'était pas à nouveau prolongé après stabilisation de l'activité de la maladie, à l'exception des patients pour lesquels l'intervalle entre les injections était minimal (4 semaines).
Au total, 1282 patients (553 dans l'étude BALATON et 729 dans l'étude COMINO) ont été inclus dans les deux études et 1276 patients ont été traités par au moins une dose jusqu'à la semaine 24 incluse (641 par Vabysmo).
Les deux études ont démontré l'efficacité du traitement concernant le critère principal d'évaluation défini comme la variation de la MAVC entre l'inclusion et la semaine 24 et mesuré à l'aide du score en lettres ETDRS. Dans les deux études, les patients traités par Vabysmo q4w ont présenté à la semaine 24 une variation moyenne de la MAVC par rapport à la valeur initiale non inférieure à celle observée chez les patients traités par l'aflibercept q4w et ces améliorations de la vision se sont maintenues jusqu'à la semaine 72 comprise, lorsque les patients sont passés à un schéma de traitement par Vabysmo avec un intervalle entre les injections pouvant être prolongé jusqu'à q16w.
Entre la semaine 24 et la semaine 68, 81,5% des patients inclus dans l'étude BALATON et 74,0% des patients inclus dans l'étude COMINO ayant reçu Vabysmo 6 mg à un intervalle pouvant être prolongé jusqu'à q16w ont atteint un intervalle entre les injections de q16w ou de q12w. Parmi ces patients, 72,1% de ceux inclus dans l'étude BALATON et 61,6% de ceux inclus dans l'étude COMINO ont terminé au moins un cycle avec un intervalle entre les injections de q12w et ont conservé un intervalle entre les injections de q16w ou de q12w sans raccourcissement de l'intervalle inférieur à q12w jusqu'à la semaine 68 comprise; 1,2% des patients inclus dans l'étude BALATON et 2,5% des patients inclus dans l'étude COMINO n'ont conservé qu'un intervalle q4w jusqu'à la semaine 68 comprise.
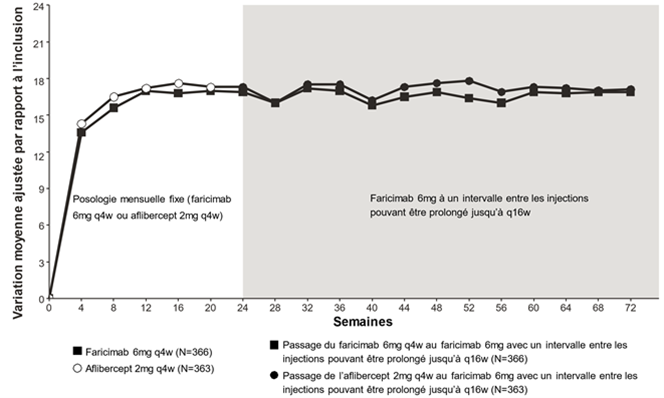
Les tableaux 8 et 9, la figure 3 et la figure 4 ci-dessous présentent les résultats détaillés de ces deux études.
Tableau 8: Résultats d'efficacité concernant le critère principal d'évaluation à la semaine 24 ainsi qu'à la fin de l'étude BALATON
|
Résultats d'efficacité
|
BALATON
| |
|
24 semaines
|
72 semainesa
| |
|
Vabysmo
N = 276
|
Aflibercept
N = 277
|
Passage de Vabysmo q4w à Vabysmo avec un intervalle entre les injections pouvant être prolongé
N = 276
|
Passage de l'aflibercept q4w à Vabysmo avec un intervalle entre les injections pouvant être prolongé
N = 277
| |
Variation moyenne de la MAVC mesurée à l'aide du score en lettres ETDRS par rapport à la valeur initiale (IC à 95%)
|
16,9
(15,7, 18,1)
|
17,5
(16,3, 18,6)
|
18,1
(16,9, 19,4)
|
18,8
(17,5, 20,0)
| |
Pourcentage de patients avec un gain en termes de MAVC d'au moins 15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95%)
|
56,1%
(50,4%, 61,9%)
|
60,4%
(54,7%, 66,0%)
|
61,5%
(56,0%, 67,0%)
|
65,8%
(60,3%, 71,2%)
|
a Moyenne des semaines 64, 68, 72.
MAVC: meilleure acuité visuelle corrigée.
ETDRS: Early Treatment Diabetic Retinopathy Study.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Tableau 9: Résultats d'efficacité concernant le critère principal d'évaluation à la semaine 24 ainsi qu'à la fin de l'étude COMINO
|
Résultats d'efficacité
|
COMINO
| |
|
24 semaines
|
72 semainesa
| |
|
Vabysmo
N = 366
|
Aflibercept
N = 363
|
Passage de Vabysmo q4w à Vabysmo avec un intervalle entre les injections pouvant être prolongé
N = 366
|
Passage de l'aflibercept q4w à Vabysmo avec un intervalle entre les injections pouvant être prolongé
N = 363
| |
Variation moyenne de la MAVC mesurée à l'aide du score en lettres ETDRS par rapport à la valeur initiale (IC à 95%)
|
16,9
(15,4, 18,3)
|
17,3
(15,9, 18,8)
|
16,9
(15,2, 18,6)
|
17,1
(15,4, 18,8)
| |
Pourcentage de patients avec un gain en termes de MAVC d'au moins 15 lettres par rapport à la valeur initiale (pourcentage pondéré selon le test CMH, IC à 95%)
|
56,6%
(51,7%, 61,5%)
|
58,1%
(53,3%, 62,9%)
|
57,6%
(52,8%, 62,5%)
|
59,5%
(54,7%, 64,3%)
|
a Moyenne des semaines 64, 68, 72.
MAVC: meilleure acuité visuelle corrigée.
ETDRS: Early Treatment Diabetic Retinopathy Study.
IC: intervalle de confiance.
CMH: méthode de Cochran–Mantel–Haenszel; test statistique qui génère l'estimation d'une association avec un résultat binaire et qui est utilisé pour analyser des variables catégorielles.
Figure 3: Étude de phase III BALATON: courbe de variation de la MAVC entre l'inclusion et la semaine 72: méthode MMRM (évaluation primaire) (population en ITT)
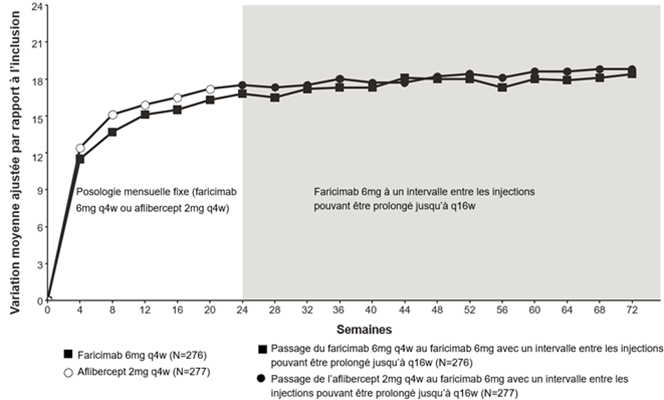
Figure 4: Étude de phase III COMINO: courbe de variation de la MAVC entre l'inclusion et la semaine 72: méthode MMRM (évaluation primaire) (population en ITT)
Patients âgés
Dans les six études cliniques de phase III, environ 58% des patients (1496/2571) ayant reçu un traitement par Vabysmo après la randomisation étaient âgés de ≥65 ans. L'analyse pharmacocinétique de population a montré un effet de l'âge sur la pharmacocinétique oculaire du faricimab, qui n'a pas été considéré comme cliniquement significatif (voir «Posologie/Mode d'emploi, Patients âgés» et «Pharmacocinétique, Patients âgés»).
Pédiatrie
La sécurité et l'efficacité de Vabysmo n'ont pas été évaluées chez les patients pédiatriques.
Informations complémentaires
Immunogénicité
Les patients traités par Vabysmo peuvent présenter une réaction immunitaire (voir «Mises en garde et précautions»).
Après une administration de Vabysmo allant jusqu'à 112 (DMLAn), 100 (OMD) et 72 (OBVR/OVCR) semaines, des anticorps anti-faricimab liés au traitement ont été mis en évidence chez environ 13,8%, 9,6% et 14,4% des patients atteints de DMLAn, d'OMD ou d'OBVR/OVCR qui avaient reçu du faricimab après la randomisation. La signification clinique des anticorps anti-faricimab en termes de sécurité n'est pas élucidée à l'heure actuelle. Une incidence accrue d'effets indésirables s'accompagnant d'une inflammation intraoculaire a été observée chez les patients présentant des anticorps anti-faricimab. Toutefois, l'incidence globale de la positivité des anticorps anti-faricimab et des inflammations intraoculaires est d'environ 1% dans la population totale des études. Les anticorps anti-faricimab n'ont pas été associés à des effets sur l'efficacité clinique ou la pharmacocinétique systémique.
PharmacocinétiqueAbsorption
Vabysmo est administré par voie intravitréenne (IVT) pour provoquer une action locale dans l'œil. Aucune étude clinique avec d'autres voies d'administration n'a été réalisée.
Sur la base d'une analyse pharmacocinétique de population (incluant la DMLAn et l'OMD, N = 2246), on estime que les concentrations plasmatiques maximales (Cmax) de faricimab libre (non lié au VEGF-A ni à l'Ang-2) sont atteintes approximativement 2 jours après l'administration de la dose. Les Cmax plasmatiques moyennes (± ET) de faricimab libre sont approximativement de 0,23 (0,07) µg/ml et 0,22 (0,07) µg/ml respectivement chez les patients atteints de DMLAn et d'OMD. On prévoit qu'une administration répétée (q8w) permet d'atteindre des concentrations plasmatiques résiduelles moyennes de faricimab libre comprises entre 0,002 et 0,003 µg/ml.
Le faricimab a présenté (sur la base de la Cmax et de l'AUC) une pharmacocinétique proportionnelle à la dose dans l'intervalle posologique de 0,5 mg à 6 mg. Des estimations de l'exposition dans le modèle pharmacocinétique de population n'ont révélé aucune accumulation du faricimab dans le corps vitré ou le plasma après une administration mensuelle.
L'analyse pharmacocinétique réalisée chez les patients atteints de DMLAn, d'OMD, d'OBVR et d'OVCR (N = 2977) a montré que la pharmacocinétique du faricimab est comparable chez ces patients.
Distribution
Pas de données.
Métabolisme
Le métabolisme du faricimab n'a pas été directement étudié. On suppose que le faricimab, comme les molécules d'IgG endogènes, est catabolisé dans les lysosomes en petits peptides et en acides aminés.
Élimination
Le profil de concentration plasmatique du faricimab en fonction du temps a diminué parallèlement au profil de concentration-temps dans le corps vitré et l'humeur aqueuse. La demi-vie oculaire moyenne estimée et la demi-vie systémique apparente du faricimab sont toutes deux d'environ 7,5 jours.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Aucune étude spécifique n'a été réalisée sur la pharmacocinétique chez les patients présentant des troubles de la fonction hépatique.
Troubles de la fonction rénale
Aucune étude spécifique n'a été réalisée sur la pharmacocinétique chez les patients présentant des troubles de la fonction rénale. Les analyses pharmacocinétiques réalisées chez les patients provenant de toutes les études cliniques, incluant 1115 patients atteints de troubles légers de la fonction rénale, 669 atteints de troubles modérés de la fonction rénale et 54 atteints de troubles sévères de la fonction rénale, n'ont montré aucune différence en termes de pharmacocinétique systémique du faricimab après administration intravitréenne de Vabysmo.
Patients âgés
Dans les six études cliniques de phase III, environ 58% des patients (1496/2571) ayant reçu un traitement par Vabysmo après la randomisation étaient âgés de ≥65 ans. L'analyse pharmacocinétique de population a montré un effet de l'âge sur la pharmacocinétique oculaire du faricimab, qui n'a cependant pas été considéré comme cliniquement significatif.
Enfants et adolescents
La sécurité et l'efficacité de Vabysmo n'ont pas été évaluées chez les patients pédiatriques.
Autres facteurs démographiques
L'analyse pharmacocinétique de population a montré une influence du poids corporel sur la pharmacocinétique oculaire et systémique du faricimab. Cet effet ayant été considéré comme cliniquement non significatif, aucun ajustement posologique n'est nécessaire.
Sur la base d'une analyse pharmacocinétique de population, l'appartenance ethnique et le sexe n'ont pas d'influence sur la pharmacocinétique systémique de Vabysmo.
Données précliniquesGénotoxicité
Aucune étude n'a été réalisée pour établir le potentiel mutagène du faricimab.
Carcinogénicité
Aucune étude n'a été réalisée pour établir le potentiel carcinogène du faricimab.
Fertilité
Une étude menée avec le faricimab à des doses allant jusqu'à 3 mg/œil (8 à 10 fois l'exposition clinique sur la base de l'AUC) pendant 6 mois chez le singe cynomolgus n'a révélé aucun effet sur les organes reproducteurs.
Toxicité sur la reproduction
Une étude portant sur le développement embryofœtal, menée chez des guenons cynomolgus gravides ayant reçu à partir du 20e jour de gestation 5 injections intraveineuses hebdomadaires de 1 mg/kg ou de 3 mg/kg de Vabysmo, n'a montré aucun effet sur la gestation ou sur les fœtus. L'exposition sérique (Cmax) chez le singe à la DSENO (dose sans effet nocif observable) de 3 mg/kg était plus de 500 fois supérieure à celle observée chez l'être humain à la dose de 6 mg administrée par injection intravitréenne toutes les 4 semaines.
Remarques particulièresPréparation de l'administration
Vabysmo est une solution stérile, limpide à opalescente, incolore à jaune brunâtre, sans conservateurs.
Vabysmo doit être soumis à un contrôle visuel à la sortie du réfrigérateur et avant l'administration. Ne pas utiliser si des particules solides, une turbidité ou un changement de coloration sont visibles. Ne pas utiliser non plus si l'emballage, le flacon, l'aiguille-filtre de transfert, la seringue préremplie ou l'aiguille-filtre pour injection sont endommagés ou si leur date de péremption est dépassée.
Le contenu du flacon et de la seringue préremplie est stérile et est à usage unique.
Recourir à une technique aseptique pour préparer l'injection intravitréenne.
Incompatibilités
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé à d'autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8 °C). Ne pas secouer. Ne pas congeler.
Conserver le récipient dans son carton pour le protéger de la lumière.
Conserver hors de portée des enfants.
Avant l'utilisation, le flacon non ouvert ou la barquette scellée non ouverte contenant la seringue préremplie peuvent être conservés à température ambiante (de 20 °C à 25 °C), dans le carton d'origine, pendant une durée maximale de 24 heures.
Veiller à réaliser l'injection immédiatement après avoir préparé la dose.
Remarques concernant la manipulation
Pour les instructions posologiques, voir «Posologie/Mode d'emploi».
Pour de plus amples informations sur l'administration, voir «Instructions d'emploi».
Élimination des médicaments non utilisés/périmés
Le rejet de médicaments dans l'environnement doit être réduit au minimum. Les médicaments ne doivent pas être éliminés avec les eaux usées. Éviter toute élimination avec les déchets ménagers.
Les points suivants doivent être strictement respectés en ce qui concerne l'utilisation et l'élimination de seringues et d'autres objets tranchants à usage médical:
·Les aiguilles et les seringues ne doivent en aucun cas être réutilisées.
·Placer toutes les aiguilles et les seringues utilisées dans un récipient pour objets pointus (récipient jetable permettant d'éviter les blessures par piqûre).
Le médicament non utilisé et/ou les déchets doivent être éliminés conformément aux exigences nationales.
Numéro d’autorisation68395, 69709 (Swissmedic).
PrésentationVabysmo 28,8 mg/0,24 ml, solution injectable dans un flacon, avec 1 aiguille-filtre: 1 [B]
Vabysmo 21 mg/0,175 ml, solution injectable dans une seringue préremplie, avec 1 aiguille-filtre pour injection: 1 [B]
Titulaire de l’autorisationRoche Pharma (Suisse) SA, Bâle.
Mise à jour de l’informationDécembre 2024.
Instructions d'emploi
Les informations qui suivent sont uniquement destinées au personnel médical et aux professionnels de la santé.
Instructions d'emploi du flacon:
|
Avant de commencer:
| |
|

|
·Lire attentivement toutes les instructions d'emploi avant d'administrer Vabysmo.
| |
|

|
·Le kit de Vabysmo contient un flacon en verre et une aiguille-filtre de transfert. Le flacon en verre contient seulement une dose unique. L'aiguille-filtre est réservée à un usage unique.
| |
|

|
·Vabysmo doit être conservé au réfrigérateur entre 2 °C et 8 °C.
Ne pas congeler.
Ne pas secouer.
| |
|

|
·Laisser revenir Vabysmo à température ambiante (20 °C à 25 °C) avant de poursuivre l'utilisation. Laisser à cet effet le flacon dans son carton pour le protéger de la lumière.
| |
|
·Le flacon de Vabysmo peut rester à température ambiante pendant 24 heures au maximum.
| |
|

|
·Le flacon de Vabysmo doit être soumis à un contrôle visuel avant l'utilisation. Vabysmo est une solution liquide, limpide à opalescente, incolore à jaune brunâtre.
Ne pas utiliser si des particules solides, une turbidité ou un changement de coloration sont visibles.
Ne pas utiliser si l'emballage, le flacon et/ou l'aiguille-filtre de transfert sont ouverts ou endommagés, ou si leur date de péremption est dépassée (Fig. A).
| |
|
Recourir à une technique aseptique pour préparer l'injection intravitréenne.
| |
|
Figure A
| |
Remarque concernant l'utilisation du flacon
| |
1
|
Préparer les objets suivants:
| |
|
·Un flacon de Vabysmo (fourni).
| |
|
·Une aiguille-filtre de transfert, émoussée, stérile, de taille 18 G × 1½ pouce, soit env. 1,2 mm × 40 mm, à filtre de 5 microns (fournie).
| |
|
·Une seringue Luer-Lock stérile de 1 ml ayant une graduation à 0,05 ml (non fournie).
| |
|
·Une aiguille pour injection stérile de 30 G × ½ pouce (non fournie).
À noter qu'il est recommandé d'utiliser une aiguille pour injection de 30 G afin d'éviter de devoir exercer une force plus importante lors de l'injection, comme le nécessiterait une aiguille d'un diamètre inférieur.
| |
|
·Tampon imbibé d'alcool (non fourni).
| |
2
|
Afin de garantir que la totalité du liquide se trouve au fond du flacon, il convient de poser le flacon verticalement sur une surface plane après l'avoir sorti de son emballage (pendant env. 1 minute) (Fig. B). Tapoter délicatement le flacon avec le doigt (Fig. C), car du liquide pourrait adhérer à la partie supérieure du flacon.
| |
|
|
Figure B
|
|
Figure C
| |
3
|
Retirer le capuchon amovible (flip-off) du flacon (Fig. D) et essuyer le septum du flacon avec un tampon imbibé d'alcool (Fig. E).
| |
|
|
Figure D
|
|
Figure E
| |
Prélever le médicament du flacon dans la seringue
| |
4
|
Fixer solidement l'aiguille-filtre de transfert de 18 G × 1½ pouce, fournie dans le kit, sur une seringue Luer-Lock de 1 ml en utilisant une technique aseptique (Fig. F).
| |
|

Figure F
| |
5
|
Enfoncer l'aiguille-filtre de transfert au centre du septum du flacon dans des conditions aseptiques (Fig. G), l'insérer complètement dans le flacon, puis incliner légèrement le flacon afin que l'aiguille touche le bord du fond du flacon (Fig. H).
| |
|
|
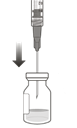
Figure G
|
|

Figure H
| |
6
|
Tenir le flacon légèrement incliné et prélever lentement la totalité du liquide du flacon (Fig. I). Laisser le biseau de l'aiguille-filtre de transfert immergée dans le liquide pour éviter d'aspirer de l'air.
| |
|
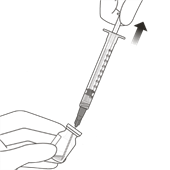
Figure I
| |
Fixer l'aiguille pour injection
| |
7
|
Veiller à tirer suffisamment le piston de la seringue lors du prélèvement du liquide du flacon de manière à pouvoir complètement vider l'aiguille-filtre de transfert (Fig. I).
| |
8
|
Retirer l'aiguille-filtre de transfert de la seringue et l'éliminer conformément aux dispositions locales.
| |
|
Ne pas utiliser l'aiguille-filtre de transfert pour l'injection intravitréenne.
| |
9
|
Fixer solidement une aiguille pour injection de 30 G × ½ pouce sur la seringue Luer-Lock en utilisant une technique aseptique (Fig. J).
| |
|

Figure J
| |
Éliminer les bulles d'air et ajuster la dose du médicament
| |
10
|
Retirer avec précaution le capuchon protecteur en plastique de l'aiguille en le tirant dans l'axe.
| |
11
|
Tenir la seringue avec la pointe de l'aiguille dirigée vers le haut et vérifier l'absence de bulles d'air dans la seringue. En présence de bulles d'air, tapoter délicatement la seringue avec le doigt pour faire remonter les bulles (Fig. K).
| |
|
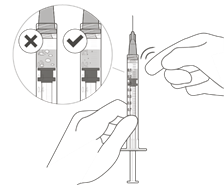
Figure K
| |
12
|
Expulser avec précaution l'air de la seringue et de l'aiguille. Puis pousser lentement le piston jusqu'à ce que l'extrémité antérieure de la butée en caoutchouc se trouve au niveau de la graduation de 0,05 ml. La seringue est maintenant prête pour l'injection (Fig. L). Veiller à effectuer l'injection immédiatement après avoir préparé la dose.
| |
|
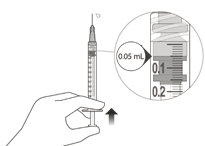
Figure L
| |
13
|
Effectuer lentement l'injection jusqu'à ce que la butée en caoutchouc touche complètement la partie antérieure de la seringue, afin de délivrer le volume de 0,05 ml. Vérifier que l'intégralité de la dose a été administrée. C'est le cas lorsque la butée en caoutchouc touche complètement la partie antérieure de la seringue après l'injection.
Éliminer tout déchet ou médicament non utilisé conformément aux dispositions locales.
|
Instructions d'emploi de la seringue préremplie:
|
Avant de commencer:
| |
|

|
·Lire attentivement toutes les instructions d'emploi avant d'administrer Vabysmo.
| |
|
Le carton de Vabysmo contient:
| |
|

|
·Une seringue préremplie stérile dans une barquette scellée. La seringue préremplie est destinée à une dose unique uniquement.
| |
|

|
·Une aiguille-filtre stérile pour injection à paroi extra-fine (Extra Thin Wall, ETW) de 30 G × ½ pouce avec filtre intégré dans l'embout. L'aiguille-filtre pour injection est réservée à un usage unique.
| |
|
Seule l'aiguille-filtre pour injection fournie doit être utilisée pour l'injection du médicament,
car celle-ci, en raison de sa qualité, permet une utilisation ophtalmologique sûre du médicament.
| |
|

|
·Vabysmo doit être conservé au réfrigérateur entre 2 °C et 8 °C.
| |
|
Ne pas congeler.
| |
|

|
·Laisser revenir Vabysmo à température ambiante (20 °C à 25 °C) avant de poursuivre l'utilisation.
| |
|

|
·Laisser la barquette scellée dans le carton d'origine jusqu'à l'administration, afin de protéger la seringue préremplie de la lumière. La seringue préremplie peut être conservée dans le carton d'origine à température ambiante pendant 24 heures au maximum.
| |
|

|
·Vabysmo doit être soumis à un contrôle visuel avant l'utilisation.
| |
|
Ne pas utiliser si le sceau du carton a été ouvert ou endommagé.
| |
|
Ne pas utiliser si l'emballage, la seringue préremplie et/ou l'aiguille-filtre pour injection ont été ouverts ou endommagés ou si leur date de péremption est dépassée.
| |
|
Ne pas utiliser si l'aiguille-filtre pour injection fait défaut.
| |
|
Ne pas retirer le repose-doigt de la seringue.
| |
|
Ne pas utiliser si le capuchon de la seringue ne se trouve plus sur l'embout Luer-Lock.
| |
|
Ne pas utiliser si des particules solides, une turbidité ou un changement de coloration sont visibles. Vabysmo est une solution liquide, limpide à opalescente, incolore à jaune brunâtre.
| |
Contenu du carton
| |
|
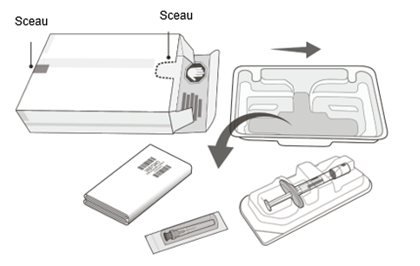
Figure A
| |
Description du produit
| |
|
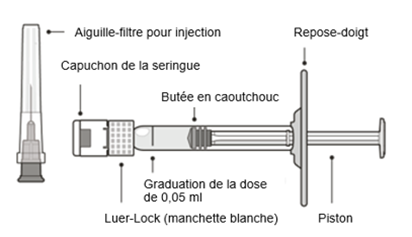
Figure B
| |
Recourir à une technique aseptique pour retirer la seringue de la barquette qui la contient (étape 1) et lors de toutes les étapes suivantes.
| |
Remarque: la dose doit être ajustée sur la graduation de la dose de 0,05 ml.
| |
Ouvrir la barquette et en sortir la seringue préremplie
| |
1
|
Retirer le couvercle de la barquette et sortir la seringue préremplie en utilisant une technique aseptique.
| |
2
|
Saisir la seringue au niveau de la manchette blanche; rompre le capuchon de la seringue (Fig. C).
| |
|
Ne pas retirer le capuchon en le faisant tourner.
|
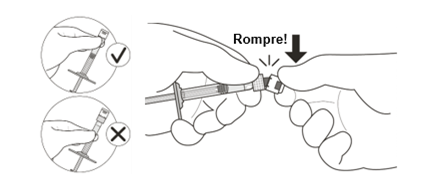
Figure C
| |
Fixer l'aiguille-filtre pour injection
| |
3
|
Retirer l'aiguille-filtre pour injection de son emballage en utilisant une technique aseptique.
| |
4
|
Fixer solidement l'aiguille-filtre pour injection sur l'embout Luer-Lock de la seringue en utilisant une technique aseptique (Fig. D).
|
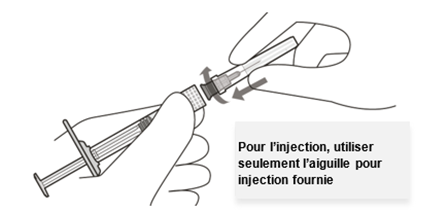
Figure D
| |
5
|
Retirer avec précaution le capuchon protecteur de l'aiguille en le tirant dans l'axe de l'aiguille.
| |
Éliminer les bulles d'air
| |
6
|
Tenir la seringue avec la pointe de l'aiguille-filtre pour injection dirigée vers le haut et vérifier l'absence de bulles d'air dans la seringue.
| |
7
|
En présence de bulles d'air, tapoter délicatement la seringue avec le doigt pour faire remonter les bulles d'air (Fig. E).
| |
|
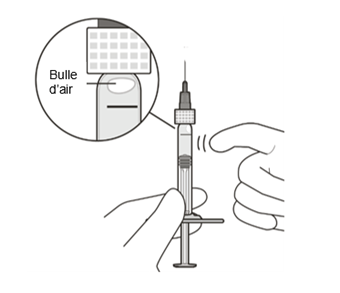
Figure E
| |
Ajuster la dose de médicament et expulser l'air de la seringue et de l'aiguille
| |
8
|
Tenir la seringue à hauteur des yeux et pousser lentement le piston jusqu'à ce que l'extrémité antérieure de la butée en caoutchouc se trouve au niveau de la graduation de 0,05 ml (Fig. F). Cela permet d'expulser l'air de la seringue et de l'aiguille et d'ajuster la dose à 0,05 ml.
| |
|
Veiller à réaliser l'injection immédiatement après la préparation de la dose.
|
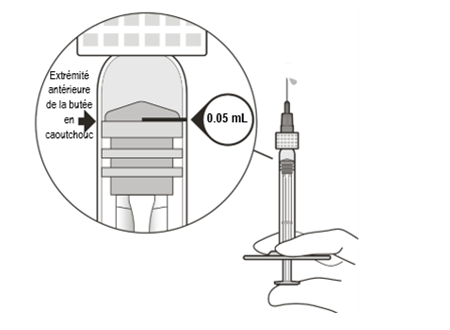
Figure F
| |
Procédure d'injection
| |
9
|
Réaliser la procédure d'injection en utilisant une technique aseptique.
Effectuer lentement l'injection jusqu'à ce que la butée en caoutchouc touche complètement la partie antérieure de la seringue, afin de délivrer le volume de 0,05 ml.
Ne pas remettre le capuchon protecteur sur l'aiguille-filtre pour injection et ne pas retirer l'aiguille-filtre pour injection de la seringue.
Éliminer tout déchet ou médicament non utilisé conformément aux dispositions locales.
|
|


































