Propriétés/EffetsCode ATC
V10XX04
Propriétés physiques
Lutathera/Lutathera CA avec lutécium (177Lu) se désintègre en hafnium (177Hf) stable avec une demi-vie de 6,647 jours en émettant majoritairement des rayonnements β d'une énergie maximale de 0,498 MeV. L'énergie bêta moyenne est de 0,13 MeV. Des rayonnements photoniques (γ) de 0,113 MeV (6,2%) et 0,208 MeV (11%) sont également émis.
Lutathera CA est préparé en utilisant du 176Lu qui contient une petite quantité de l'isomère nucléaire lutécium métastable (177mLu). L'isomère 177mLu a une demi-vie de 160,44 jours. L'isomère 177mLu se désintègre partiellement (22,8%) par transition isomérique avec émission gamma et conversion électronique à l'état fondamental de Lu-177, et partiellement (77,2%) par émission bêta (40,8 keV) en hafnium-177 métastable (177mHf) qui se désintègre immédiatement par de multiples émissions gamma et conversion électronique en 177Hf stable. Tout déchet radioactif résultant de l'utilisation du lutécium (177Lu) oxodotréotide doit tenir compte de la présence et de la quantité de cet isomère particulier pour une élimination appropriée.
Mécanisme d'action
Le lutécium (177Lu) oxodotréotide a une haute affinité pour les récepteurs de la somatostatine de sous-type 2 (sst2). Il se fixe spécifiquement aux cellules malignes qui surexpriment les récepteurs sst2.
Le lutécium-177 est un radionucléide émetteur β moins dont la distance maximum de pénétration dans les tissus est d'environ 2,2 mm (moyenne de pénétration de 0,67 mm), ce qui est provoque la mort des cellules tumorales ciblées tout en ayant un effet limité sur les cellules voisines saines.
Pharmacodynamique
À la concentration utilisée (environ 10 μg/ml au total pour les formes libre et radiomarquée), le peptide oxodotréotide n'exerce aucun effet pharmacodynamique cliniquement significatif.
Efficacité clinique
Étude NETTER-1
L'étude NETTER-1 de phase III était une étude randomisée, multicentrique, ouverte, contrôlée versus comparateur, comparant le traitement par Lutathera CA (4 doses de 7400 MBq chacune, une dose toutes les 8 semaines [± 1 semaine]) administré en concomitance avec une solution d'acides aminés et avec les meilleurs soins de soutien possibles (octréotide 30 mg à libération prolongée [LP] après chaque dose de Lutathera CA et toutes les 4 semaines après la fin du traitement par Lutathera CA pour le contrôle des symptômes, remplacé par de l'octréotide à courte durée d'action durant les 4 à 6 semaines précédant l'administration de Lutathera CA) à une dose élevée d'octréotide LP (60 mg toutes les 4 semaines) chez les patients présentant des tumeurs carcinoïdes de l'intestin moyen, inopérables, progressives, surexprimant des récepteurs de la somatostatine. Le critère d'évaluation principal de l'étude était la survie sans progression (SSP) évaluée par les critères d'évaluation de la réponse des tumeurs solides (critères RECIST V1.1), basée sur une évaluation radiologique indépendante en aveugle. Les critères d'évaluation secondaires de l'efficacité incluaient le taux de réponse objective (TRO), la survie globale (SG), le temps avant la progression de la tumeur (TPT), la sécurité et la tolérance du médicament ainsi que la qualité de vie liée à la santé (QdVLS).
Au moment de l'analyse principale, 229 patients ont été randomisés pour recevoir soit Lutathera CA (n = 116) soit la dose élevée de 60 mg de l'octréotide LP (n = 113). La randomisation était stratifiée par le score à la scintigraphie Octreoscan® (grades 2, 3 et 4) et la plus longue durée à dose constante d'octréotide reçue par le patient avant la randomisation (soit ≤6 ou > 6 mois). Les critères démographiques ainsi que les caractéristiques des patients et des pathologies étaient bien équilibrés entre les deux bras, avec un âge médian de 64 ans et un taux de 82,1% de patients blancs par rapport à la population totale.
Les résultats de l'analyse finale per protocole (date limite le 24 juillet 2015) sont présentés dans le tableau 7.
Tableau 7: SSP observée dans le cadre de l'étude NETTER-1 de phase III chez les patients atteints de tumeurs carcinoïdes progressives de l'intestin moyen – (ensemble d'analyse complet (EAC), n = 229)
|
|
Traitement
| |
|
Lutathera CA et octréotide LP
|
Dose élevée d'octréotide LP
| |
N
|
116
|
113
| |
Patients présentant des événements
|
21
|
70
| |
Patients exclus
|
95
|
43
| |
Médiane en mois (IC à 95%)
|
Non atteint
|
8,5 (5,8; 9,1)
| |
Valeur p du test du log-rank
|
< 0,0001
| |
Hazard ratio (IC à 95%)
|
0,177 (0,108; 0,289)
|
N = nombre de patients, IC = indice de confiance, LP: libération prolongée.
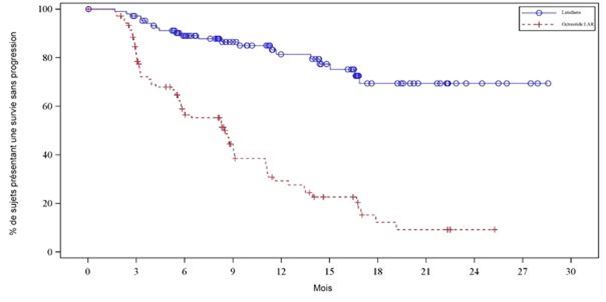
Le graphique de Kaplan-Meier de la SSP pour l'ensemble d'analyse complet (EAC) est présenté à la figure 3.
Figure 3: Courbes de Kaplan-Meier de la SSP pour les patients atteints de tumeurs carcinoïdes progressives de l'intestin moyen – (étude NETTER-1 de phase III; EAC, n = 229)
Les résultats de SG de l'analyse intermédiaire (date limite le 24 juillet 2015) et de l'analyse finale (date limite le 18 janvier 2021) sont présentés dans le tableau 8.
Au moment de l'analyse finale de la SG, qui a eu lieu 5 ans après la randomisation du dernier patient (n = 231, date limite le 24 juillet 2015), la durée médiane de suivi dans chaque bras de l'étude était de 76 mois. Les résultats finaux pour la SG n'ont pas atteint le niveau de significativité statistique.
Dans le bras recevant la dose élevée d'octréotide LP, 22,8% des patients avaient reçu un traitement subséquent par ligand radiomarqué (dont lutécium (177Lu) oxodotréotide) dans les 24 mois suivant la randomisation et 36% avant la date limite finale pour la SG, ce qui, avec d'autres facteurs, a pu avoir une influence sur la SG dans ce sous-groupe de patients.
Tableau 8: Résultats de l'étude NETTER-1 de phase III pour la survie globale des patients atteints de tumeurs carcinoïdes progressives de l'intestin moyen (EAC)
|
|
LUTATHERA CA et octréotide LP
|
Dose élevée d'octréotide LP
| |
Analyse intermédiaire de la survie globale (24 juillet 2015) – N = 229*
| |
Décès (%)
|
17 (14,7%)
|
31 (27,4%)
| |
Médiane en mois (IC à 95%)
|
NA (NE; NE)
|
27,4 (20,1; NE)
| |
Hazard ratioa,b (IC à 99,9915%)
|
0,46 (0,14; 1,51)
| |
Analyse finale de la survie globale (18 janvier 2021) – N = 231**
| |
Décès (%)
|
73 (62,4%)
|
69 (60,5%)
| |
Médiane en mois (IC à 95%)
|
48,0 (37,4; 55,2)
|
36,3 (25,9; 51,7)
| |
Hazard ratioa,b,c (IC à 95%)
|
0,84 (0,60; 1,17)
| |
Analyse finale de la survie globale par temps de survie moyen restreint (RMST = Restricted Mean Survival Time) après 60 mois (18 janvier 2021) – N = 231**
| |
Décès (%)
|
65 (55,6)
|
63 (55,3)
| |
RMST (IC à 95%)
|
41,2 (37,6; 44,9)
|
36,1 (31,9; 40,4)
| |
Différence (IC à 95%)
|
5,1 (-0,5; 10,7)
| |
a:
Hazard ratio fondé sur un modèle de Cox non stratifié
b: Statistiquement non significatif selon les critères de significativité prédéfinis
c: HR fondé sur les risques non proportionnels
*: L'analyse a été réalisée chez 116 patients du groupe Lutathera CA et 113 patients du groupe recevant la dose élevée d'octréotide LP (N = 229).
**: L'analyse a été réalisée chez 117 patients du groupe Lutathera CA et 114 patients du groupe recevant la dose élevée d'octréotide LP (N = 231).
NA = non atteint
NE = non évaluable
|
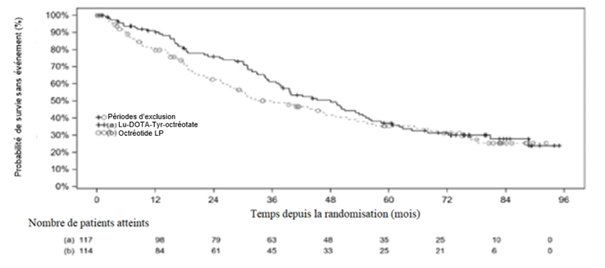
La courbe de Kaplan-Meier de la SG pour l'ensemble d'analyse complet (EAC) à la date limite du 18 janvier 2021 est représentée à la figure 4.
Figure 4: Courbes de Kaplan-Meier de la SG pour les patients atteints de tumeurs carcinoïdes progressives de l'intestin moyen - date limite du 18 janvier 2021 (étude NETTER-1 de phase III; EAC, n = 231)
En présence de risques non proportionnels, au moment de l'analyse finale de la SG, une analyse supplémentaire de la sensibilité (Restricted Mean Survival Time) a été réalisée pour estimer l'effet du traitement de manière plus approfondie (voir tableau 8).
La qualité de vie liée à la santé (QdVLS) a été évaluée à l'aide du questionnaire de qualité de vie de l'Organisation européenne pour la recherche et le traitement du cancer (EORTC QLQ-C30) (instrument générique) et de son module tumeur neuroendocrine (EORTC QLQ-GI.NET-21).
Les résultats indiquent une amélioration de la qualité de vie globale liée à la santé jusqu'à la semaine 84 pour les patients du bras de traitement par Lutathera CA par rapport aux patients du bras de traitement par dose élevée d'octréotide LP.
Tumeurs neuroendocrines gastroentéropancréatiques (TNE-GEP) exprimant les récepteurs de la somatostatine
L'efficacité de Lutathera CA chez des patients atteints de tumeurs neuroendocrines (TNE) gastroentéropancréatiques (GEP) et bronchiques exprimant les récepteurs de la somatostatine a été évaluée dans l'étude clinique Erasmus monocentrique, non comparative, ouverte, dans laquelle le protocole thérapeutique de Lutathera CA consistait en 4 administrations par voie intraveineuse de 7400 MBq chacune, en association avec une solution d'acides aminés. Lutathera CA était initialement administré dans le cadre d'un programme compassionnel suivant un protocole général de radiothérapie à récepteur peptidique, mené dans un seul centre aux Pays-Bas. Un protocole ultérieur spécifique à Lutathera CA a été rédigé huit ans après l'initiation de ce programme, permettant une collecte rétrospective des données même en l'absence de description spécifique de l'effectif total et de l'hypothèse testée. Au total, 360 patients présentant à l'initiation du traitement une tumeur neuroendocrine gastroentéropancréatique et bronchique (de l'intestin moyen 183, du pancréas 133, des bronches 19, de l'intestin postérieur 13, de l'intestin antérieur autre que bronchique et pancréatique 12) ont été suivis à long terme. La moyenne d'âge était de 60 ans dont 51% d'hommes, 99,4% présentaient une fixation tumorale à l'Octreoscan ≥2 (5,6% (2)/62,8% (3)/31,1% (4)), 71,4% avaient un indice de Karnofsky ≥90 et 52% une médication concomitante avec des analogues de la somatostatine. Le taux de réponse objective déterminée par l'investigateur en tant que critère majeur d'efficacité, était de 45% (IC à 95%: 40; 50). La médiane de la durée de réponse était de 16,3 mois (IC à 95%: 12,2; 17,8). Le taux de réponse objective le plus élevé a été observé chez les patients atteints de tumeurs neuroendocrines pancréatiques (61%, IC à 95%: 52; 69) et le taux de réponse le plus faible chez les patients atteints de tumeurs neuroendocrines de l'intestin moyen (33%, IC à 95%: 27; 41).
|


