NuvaRing® avec applicateur
Qu'est-ce que NuvaRing et quand doit-il être utilisé?
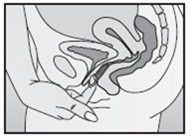
NuvaRing est un contraceptif utilisé dans le vagin. Il s'agit d'un anneau synthétique (anneau vaginal) souple, transparent et presque incolore, dont le diamètre externe est de 54 mm et la section transversale de 4 mm.
NuvaRing contient deux hormones sexuelles féminines, de l'étonogestrel (un progestatif) et de l'éthinylestradiol (un estrogène). L'anneau vaginal libère ces hormones dans la circulation sanguine. Ces hormones sont libérées en faibles quantités, c'est pourquoi NuvaRing est un contraceptif hormonal faiblement dosé. Comme NuvaRing libère deux hormones différentes, on le désigne par le terme «contraceptif hormonal combiné» (CHC).
Utilisé conformément aux prescriptions, NuvaRing protège contre la grossesse de plusieurs manières: en général, il empêche la maturation d'un ovule fécondable. En outre, la glaire du col de l'utérus reste épaisse, ce qui rend l'ascension des spermatozoïdes plus difficile. Enfin, la muqueuse utérine n'est pas préparée à une grossesse. Les changements hormonaux produits par les CHC peuvent en outre conduire à une plus grande régularité de votre cycle et à des règles moins abondantes et plus courtes.
NuvaRing doit exclusivement être utilisé sur prescription médicale.
Informations importantes sur les contraceptifs hormonaux combinés (CHC)
·utilisés correctement, les CHC sont une des méthodes contraceptives réversibles les plus fiables;
·les CHC augmentent légèrement le risque de formation de caillots sanguins dans les veines et les artères, en particulier au cours de la première année d'utilisation ou lors de la reprise d'un CHC après une interruption d'au moins 4 semaines;
·soyez attentive à l'apparition de symptômes évocateurs d'un caillot sanguin et adressez-vous à votre médecin si vous avez des symptômes qui vous le font suspecter (voir partie «Caillots sanguins»).
De quoi faut-il tenir compte en dehors du traitement?
Avant de commencer à utiliser NuvaRing, veuillez lire les informations sur les caillots sanguins figurant sous la rubrique «Quelles sont les précautions à observer lors de l'utilisation de NuvaRing?». Il est particulièrement important de lire les informations relatives aux symptômes annonciateurs d'un possible caillot (voir «Signes évocateurs d'un possible caillot sanguin»).
Avant que vous ne commenciez à prendre des produits hormonaux à visée contraceptive, votre médecin devra s'informer avec précision de vos antécédents médicaux personnels et familiaux (maladies dont vous avez souffert ou survenues dans votre famille) et réaliser un examen général et gynécologique approfondi et exclure une grossesse.
Durant l'utilisation de NuvaRing, il est recommandé de pratiquer des examens médicaux de contrôle à intervalles réguliers. Votre médecin mettra en balance les risques éventuellement existants (p.ex. âge, poids, intervention chirurgicale, modification de votre état de santé et/ou de vos risques) avec les bénéfices attendus et décidera avec vous de la poursuite ou non d'une contraception avec NuvaRing.
On a constaté que le cancer de la muqueuse utérine (revêtement interne de l'utérus) et des ovaires est moins fréquent chez les utilisatrices de pilules combinées que chez les non-utilisatrices. Cette observation pourrait également être valable pour NuvaRing, mais elle n'a pas encore été confirmée.
De même, quand vous remplacez un autre contraceptif par NuvaRing ou avez l'intention de commencer à utiliser NuvaRing très peu de temps après un accouchement ou une fausse couche, vous devez également impérativement consulter votre médecin (voir aussi «Comment utiliser NuvaRing?»). Jusqu'à 12 semaines après l'accouchement, le risque de formation de caillots sanguins est plus élevé. Il vous faudra donc demander à votre médecin quand vous pouvez reprendre NuvaRing.
NuvaRing est un médicament. En cas d'accident ou d'intervention chirurgicale, informez les médecins que vous utilisez NuvaRing.
Les moyens de contraception hormonaux tels que NuvaRing n'offrent aucune protection contre les infections à VIH (SIDA) ni contre les maladies sexuellement transmissibles.
Quand NuvaRing ne doit-il pas être utilisé?
NuvaRing ne doit pas être utilisé si vous présentez l'une des situations suivantes. Si tel est le cas, il vous faut impérativement en informer votre médecin, qui déterminera avec vous quelle autre méthode de contraception sera la plus adaptée pour vous:
·existence ou antécédents de caillot sanguin au niveau des jambes (thrombose veineuse profonde), des poumons (embolie pulmonaire) ou d'un autre organe;
·antécédents d'infarctus du myocarde ou d'accident vasculaire cérébral;
·existence ou antécédents d'angine de poitrine (maladie qui cause de fortes douleurs dans la poitrine ou une sensation de pression derrière le sternum, en particulier lors d'un effort physique et qui peut être annonciatrice d'un infarctus du myocarde);
·antécédents d'un accident ischémique transitoire (aussi dénommé AIT: symptômes passagers d'un accident vasculaire cérébral);
·trouble connu de la coagulation, p.ex. déficit en protéine C, déficit en protéine S, déficit en antithrombine III, mutation du facteur V de Leiden ou anticorps anti-phospholipides;
·présence de plusieurs facteurs de risque de façon concomitante favorisant la formation d'un caillot sanguin, comme p.ex. surpoids avec un âge >35 ans (voir chapitre «Quelles sont les précautions à observer lors de l'utilisation de NuvaRing?» - «Facteurs favorisant la formation de caillots sanguins dans une artère» et «Facteurs favorisant la formation de caillots sanguins dans une veine»);
·forme particulière de migraine (dite «migraine avec aura», qui est accompagnée de troubles de la sensibilité, de la perception et/ou des mouvements) dont vous souffrez ou avez souffert;
·diabète (diabète sucré) avec symptômes vasculaires (atteinte des vaisseaux sanguins);
·hypertension artérielle sévère (forte augmentation de la pression artérielle);
·hyperlipidémies sévères (forte augmentation du cholestérol ou des triglycérides) dans le sang;
·graves maladies du foie (p.ex. jaunisse) actuellement ou dans le passé, tant que les examens de la fonction du foie ne sont pas normalisés;
·hépatite C et prise de médicaments antiviraux contenant de l'ombitasvir/paritaprévir/ritonavir, du dasabuvir, du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir (voir le paragraphe «Interactions avec d'autres médicaments»);
·tumeurs du foie actuelles ou passées;
·cancer du sein ou de l'utérus actuel ou passé, s'il dépend des hormones sexuelles;
·saignements vaginaux inexpliqués;
·pancréatite actuelle ou passée, liée à une augmentation importante des graisses dans le sang (triglycérides);
·hypersensibilité à l'un des composants de NuvaRing.
Quelles sont les précautions à observer lors de l'utilisation de NuvaRing?
Cette information destinée aux patientes relate certaines situations dans lesquelles la fiabilité de NuvaRing peut être diminuée. Dans de telles situations, vous ne devez pas avoir de relations sexuelles ou vous devez utiliser une méthode contraceptive non hormonale supplémentaire, par ex. un préservatif masculin ou une autre méthode barrière de contraception. Ne pas utiliser la méthode du calendrier ou des températures. Ces méthodes peuvent s'avérer non fiables car NuvaRing modifie la température corporelle et le renouvellement de la glaire cervicale.
En cas d'apparition d'un ou de plusieurs des troubles suivants, vous devez immédiatement consulter votre médecin (voir aussi Tableau «Signes évocateurs d'un possible caillot sanguin»):
·survenue de migraines ou de maux de tête d'une intensité inhabituelle.
·apparition soudaine de difficultés respiratoires ou d'une toux d'origine indéterminée.
·douleurs inexpliquées dans les jambes, avec ou sans gonflement.
·troubles brusques de la vision, de l'audition, du langage ou autres troubles de la perception.
·apparition soudaine de douleurs aiguës dans la poitrine ou la cage thoracique, avec ou sans irradiation dans le bras.
·apparition soudaine de vertiges, d'une sensation de grande faiblesse, de troubles de la sensibilité.
·perte de connaissance.
·au moins 4 semaines avant une intervention chirurgicale prévue ou pendant la convalescence faisant suite à un accident ou une opération.
·forte augmentation de la pression artérielle (confirmée par plusieurs mesures).
·jaunisse.
·grossesse ou suspicion de grossesse.
Si vous souffrez ou avez souffert des maladies suivantes ou si elles s'aggravent ou apparaissent pour la première fois au cours de l'utilisation de NuvaRing, il est important que vous en informiez votre médecin:
·si vous avez des règles irrégulières, certaines modifications au niveau de la poitrine, un ou des cas de cancer du sein dans votre famille ou des tumeurs bénignes de l'utérus (myomes);
·si vous observez une accumulation de liquide dans les tissus («œdèmes»);
·si vous avez une affection rénale sévère;
·si vous souffrez d'épilepsie ou de danse de Saint Guy (chorée mineure);
·si vous avez des dépressions;
·si vous avez des taux de lipides sanguins élevés (hypertriglycéridémie) ou que des membres de votre famille en souffrent. L'utilisation de CHC en cas d'hypertriglycéridémie entraîne une augmentation du risque de pancréatite (inflammation du pancréas);
·si vous souffrez de phlébite (thrombophlébite superficielle);
·si vous avez des varices;
·si vous avez une maladie du foie (p.ex. une jaunisse) ou des inflammations de la vésicule biliaire (p.ex. calculs biliaires);
·si vous avez une maladie de Crohn ou une colite ulcéreuse (inflammation chronique de l'intestin);
·si vous avez un lupus érythémateux disséminé (LED; une maladie qui modifie votre système immunitaire);
·si vous avez un syndrome hémolytique et urémique (SHU; qui entraîne des troubles de la coagulation et une insuffisance rénale);
·si vous avez une anémie falciforme (une maladie rare du sang);
·si vous avez développé un herpès au cours d'une précédente grossesse (herpès gravidique);
·si vous avez un trouble de l'ouïe (otosclérose);
·si vous souffrez d'un trouble du métabolisme de l'hémoglobine (porphyrie);
·si vous présentez ou avez présenté (surtout pendant une grossesse antérieure) un chloasma (taches pigmentées brun jaune sur la peau, en particulier au niveau du visage), vous devez éviter toute exposition intense au soleil ou aux rayons ultraviolets;
·si un angio-œdème héréditaire et/ou acquis a été diagnostiqué chez vous par le passé, ou si vous avez une réaction allergique pendant l'utilisation de NuvaRing (ou en avez eu une par le passé), et si vous constatez chez vous des symptômes tels qu'enflure du visage, des lèvres, de la langue et/ou de la gorge, qui provoquent des difficultés à avaler et éventuellement à respirer (angio-œdème et/ou réaction anaphylactique). Les produits contenant des estrogènes peuvent induire ou aggraver les symptômes d'un angio-œdème héréditaire ou acquis;
·si vous présentez un trouble médical qui peut compliquer l'utilisation de NuvaRing: p.ex. constipation, prolapsus du rectum, de la vessie ou de l'utérus ou douleurs lors des rapports sexuels.
CAILLOTS SANGUINS
Le terme thrombose désigne la formation de caillots sanguins susceptibles d'obstruer un vaisseau. Pendant l'utilisation d'un contraceptif hormonal combiné (CHC) comme NuvaRing, votre risque de formation d'un caillot sanguin est plus élevé que si vous ne le prenez pas.
Les caillots sanguins peuvent se former
·dans les veines (on parle alors de «thrombose veineuse», de «thromboembolie veineuse» ou de TEV)
·dans les artères (on parle alors de «thrombose artérielle», de «thromboembolie artérielle» ou de TEA).
Le plus fréquemment, la thrombose se forme dans les veines profondes de la jambe (thrombose veineuse profonde). Lorsque le caillot se détache de la paroi de la veine, il peut se déplacer et obstruer une artère pulmonaire, produisant ce qu'on appelle une embolie pulmonaire. Très rarement, des caillots de sang peuvent aussi apparaître dans les vaisseaux du cœur, pouvant alors provoquer un infarctus. Les caillots qui obstruent les vaisseaux dans le cerveau peuvent être à l'origine d'un accident vasculaire cérébral. De très rares cas de formation de caillots dans d'autres parties du corps comme le foie, les intestins, les reins ou les yeux ont été rapportés.
Enfin, les événements thromboemboliques veineux ou artériels peuvent avoir des conséquences lourdes et durables sur la santé, voire une issue fatale.
Signes évocateurs d'un possible caillot sanguin
En cas d'apparition de l'un des signes suivants, vous devez immédiatement consulter un médecin:
|
Un de ces signes est-il apparu chez vous? |
De quoi pourriez-vous souffrir? |
|
Tuméfaction d'une jambe ou le long d'une veine de la jambe ou au niveau du pied, surtout si elle s'accompagne de: |
Thrombose veineuse profonde des membres inférieurs |
|
·Essoufflement subit et inexpliqué ou respiration rapide; |
Embolie pulmonaire |
|
·Perte subite de la vision ou |
Thrombose rétinienne (caillot sanguin dans une veine ou une artère de l'œil) |
|
·Douleurs dans la poitrine, malaise, sensation de pression, sensation de pesanteur; |
Infarctus du myocarde (crise cardiaque) |
|
·Perte subite de sensibilité ou de force au niveau du visage, d'un bras ou d'une jambe, surtout d'un seul côté du corps; |
Accident vasculaire cérébral |
|
·Tuméfaction, coloration bleutée d'un bras ou d'une jambe; |
Caillot sanguin obstruant d'autres vaisseaux sanguins |
Quand le risque de formation d'un caillot sanguin dans une veine est-il accru?
Le risque de développer une thromboembolie veineuse est le plus élevé au cours de la première année d'utilisation. Ce risque accru existe dès la première utilisation de NuvaRing ou lors de la reprise d'une contraception hormonale combinée après une interruption de 4 semaines ou plus. Les données d'une grande étude indiquent que ce risque élevé existe surtout pendant les 3 premiers mois.
Après la première année, le risque diminue mais reste toujours légèrement plus élevé que si vous n'utilisiez pas NuvaRing.
Si vous arrêtez d'utiliser NuvaRing le risque de formation de caillots sanguins revient en quelques semaines au niveau de base sans contraception hormonale combinée.
Quel est le degré de risque de formation d'un caillot dans une veine?
Le risque global de caillot sanguin dans une jambe ou dans les poumons (thrombose veineuse profonde ou embolie pulmonaire) avec NuvaRing est faible, mais il est nettement plus élevé que chez les femmes ne prenant pas NuvaRing.
Sur 10'000 femmes qui n'utilisent aucun CHC et qui ne sont pas enceintes, environ 2 développeront un caillot sanguin sur une période d'un an.
Sur 10'000 femmes qui utilisent un CHC contenant de l'étonogestrel, comme NuvaRing, environ 6 à 12 développeront un caillot sanguin sur une période d'un an. Sur 10'000 femmes qui utilisent un CHC contenant du lévonorgestrel, de la noréthistérone ou du norgestimate, environ 5 à 7 développeront un caillot sanguin sur une période d'un an.
Dans les deux cas, le nombre de caillots sanguins par année est inférieur à celui attendu pendant une grossesse ou après un accouchement.
Le risque de formation d'un caillot sanguin est plus ou moins élevé selon vos propres antécédents médicaux (voir partie ci-dessous «Facteurs favorisant la formation de caillots sanguins dans une veine»).
Facteurs favorisant la formation de caillots sanguins dans une veine
Le risque de formation de caillots sanguins dans une veine (p.ex. thrombose veineuse profonde, embolie pulmonaire) augmente avec:
·l'âge (en particulier au-delà d'environ 35 ans);
·le surpoids (indice de masse corporelle supérieur à 30 kg/m2);
·la survenue d'un caillot (thrombose d'une jambe ou d'une autre partie du corps, embolie pulmonaire) chez un parent ou un frère/une sœur à un âge jeune (moins de 50 ans). Dans ce cas, et lors de troubles connus ou présumés héréditaires de la coagulation chez vous ou une personne de votre proche parenté, un spécialiste de la coagulation devrait être consulté avant le début de l'utilisation de NuvaRing. Si une thrombophilie est décelée (trouble de la coagulation favorisant une thrombose), l'utilisation de NuvaRing est contre-indiquée (voir «Quand NuvaRing ne doit-il pas être utilisé?»);
·une immobilisation prolongée, une intervention chirurgicale lourde, toute intervention chirurgicale ou plâtre au niveau des jambes et les blessures graves. Dans ces cas, l'utilisation de NuvaRing doit être interrompue (4 semaines au minimum avant une intervention chirurgicale planifiée). Le médecin décidera de la date de la reprise de NuvaRing (au moins 2 semaines après la récupération complète de la mobilité);
·une position assise prolongée, comme lors de vols long-courriers (>4 heures), en particulier si vous présentez d'autres facteurs de risque.
Après l'accouchement, les femmes présentent pendant plusieurs semaines (jusqu'à 12 semaines) un risque plus élevé de développer des caillots sanguins dans une veine. Il est important de demander à votre médecin quand vous pourrez reprendre NuvaRing.
D'autres facteurs de risque sont le lupus érythémateux disséminé, le syndrome hémolytique et urémique, la maladie de Crohn, la colite ulcéreuse, l'anémie falciforme et le cancer.
Si vous présentez ou pensez présenter l'un des points susmentionnés, même si vous n'en êtes pas sûre, il est important d'en informer votre médecin. Il décidera s'il faut suspendre l'utilisation de NuvaRing.
Quand le risque de formation d'un caillot sanguin dans une artère est-il accru?
Un caillot sanguin dans une artère peut également causer des problèmes graves, comme par exemple un infarctus du myocarde ou un accident vasculaire cérébral.
Facteurs favorisant la formation de caillots sanguins dans une artère
Le risque d'infarctus du myocarde ou d'accident vasculaire cérébral lié à l'utilisation de NuvaRing est très faible, mais augmente avec:
·l'âge (en particulier au-delà d'environ 35 ans);
·le tabagisme. Il est conseillé d'arrêter de fumer en cas d'utilisation de NuvaRing. Si vous ne parvenez pas à arrêter de fumer et que vous êtes âgée de plus de 35 ans, votre médecin peut vous conseiller une autre méthode de contraception;
·le surpoids (indice de masse corporelle supérieur à 30 kg/m2);
·si vous souffrez d'hypertension artérielle (augmentation de la pression artérielle);
·si l'un de vos proches parents a eu un infarctus du myocarde ou un accident vasculaire cérébral à un âge jeune (moins de 50 ans). Dans ce cas, vous pourriez également présenter un risque accru d'infarctus du myocarde ou d'accident vasculaire cérébral;
·si vous, ou un membre de votre proche parenté, avez un taux de graisses élevé dans le sang (cholestérol ou triglycérides);
·si vous souffrez de migraines, en particulier de migraines avec aura;
·si vous souffrez de problèmes cardiaques (maladies des valves cardiaques, troubles du rythme cardiaque appelé «fibrillation auriculaire»);
·si vous souffrez de diabète.
D'autres facteurs de risque sont l'hyperhomocystéinémie et le lupus érythémateux disséminé.
Si vous présentez plus d'un des facteurs de risque précités ou si l'un d'eux est particulièrement sévère, le risque de caillot peut être encore plus élevé.
Informez votre médecin de toute modification d'un des points susmentionnés pendant l'utilisation de NuvaRing, par exemple si vous commencez à fumer, si l'un de vos proches a développé une thrombose de cause inexpliquée ou si vous prenez beaucoup de poids.
Maladies tumorales
Une fréquence légèrement plus élevée de cancer du sein a été constatée chez les femmes qui prennent des CHC tels que NuvaRing, par rapport aux femmes du même âge qui n'en prennent pas. Cette différence disparaît toutefois 10 ans après l'arrêt de la prise de ces préparations. On ignore si la différence est due aux CHC. Il est possible que ces femmes aient fait l'objet d'un suivi médical plus approfondi et plus fréquent, d'où le dépistage plus précoce du cancer du sein.
De rares cas de tumeurs bénignes du foie et encore plus rarement de tumeurs malignes du foie ont été rapportés chez des femmes prenant la pilule. Ces tumeurs peuvent entraîner des hémorragies internes. Consultez immédiatement votre médecin si vous ressentez des douleurs vives dans la partie haute de l'abdomen.
Quelques études ont montré que chez les femmes utilisant de manière prolongée des CHC tels que NuvaRing, les cas de cancers du col de l'utérus sont plus fréquents. Le principal facteur de risque du cancer du col de l'utérus est toutefois l'infection durable par le papillomavirus humain (infection par le HPV). On ignore dans quelle mesure l'utilisation sur une longue durée de CHC tels que NuvaRing a pu contribuer à l'augmentation de la fréquence des cancers du col observée dans les études ou si d'autres facteurs, comme le comportement sexuel (p.ex. le changement fréquent de partenaire sexuel avec l'augmentation du risque de transmission du virus), pourraient expliquer cette augmentation.
Affections psychiatriques
Certaines femmes qui utilisent des contraceptifs hormonaux comme NuvaRing signalent des dépressions ou des humeurs dépressives. Les dépressions peuvent être graves et occasionnellement entraîner des pensées suicidaires. Si vous présentez des fluctuations d'humeur et des symptômes dépressifs, faites-vous conseiller le plus rapidement possible par un médecin.
Autres précautions
Les hormones contenues dans NuvaRing peuvent influencer les résultats de certaines analyses biologiques effectuées sur des prélèvements de sang. Informez par conséquent votre médecin que vous prenez NuvaRing s'il vous prescrit une analyse de sang.
Quand devez-vous consulter votre médecin aussi vite que possible?
En cas de modification quelconque de votre état de santé (voir également «Quand NuvaRing ne doit-il pas être utilisé?» et «Quelles sont les précautions à observer lors de l'utilisation de NuvaRing?»).
·si vous souhaitez changer de méthode contraceptive,
·si vous cessez d'utiliser NuvaRing pendant quelque temps et souhaitez dorénavant l'utiliser à nouveau,
·si vous avez prolongé de plus d'une semaine l'intervalle sans anneau vaginal ou si vous avez retiré l'anneau vaginal pendant plus de 3 heures lors de la première semaine d'utilisation et que vous aviez eu un rapport sexuel au cours des 7 jours précédents,
·si vous n'avez pas retiré NuvaRing pendant une période supérieure à 4 semaines (avant d'insérer un nouvel anneau vaginal, vous devez consulter votre médecin),
·si vous n'avez pas eu vos règles deux fois de suite ou si vous suspectez une grossesse (avant d'insérer un nouvel anneau vaginal, vous devez consulter votre médecin),
·si vous devez prendre d'autres médicaments (voir également «Interactions avec d'autres médicaments»).
Dans de très rares cas, l'anneau vaginal peut s'incruster dans le tissu vaginal. Si cela se produit chez vous, contactez votre médecin pour faire retirer l'anneau vaginal.
Syndrome du choc toxique (SCT)
Le syndrome du choc toxique est une affection bactérienne rarissime mais grave. Le SCT a été mis en relation avec l'utilisation de tampons et de certains moyens contraceptifs formant barrière. Des cas de SCT affectant des utilisatrices de NuvaRing ont été rapportés. Quelques symptômes du SCT ressemblent beaucoup à ceux de la grippe, mais l'aggravation peut être très rapide. Consultez immédiatement votre médecin ou présentez-vous aux urgences si vous ressentez les symptômes suivants (ou seulement certains d'entre eux): fièvre forte et subite (39 °C ou plus), vomissements, diarrhée, éruption cutanée ressemblant à un coup de soleil, douleurs musculaires, vertiges, perte de conscience ou faiblesse au moment de vous lever.
Interactions avec d'autres médicaments
La prise simultanée de certains médicaments peut diminuer l'effet contraceptif de NuvaRing ou provoquer des saignements inattendus (hémorragies en cours de cycle, suintements hémorragiques): p.ex. médicaments destinés au traitement de l'épilepsie (barbituriques, carbamazépine, felbamate, oxcarbazépine, phénytoïne, primidone, topiramate), de l'infection par le VIH (inhibiteurs de protéase ou inhibiteurs non nucléosidiques de la transcriptase inverse, p.ex. éfavirenz, nelfinavir, névirapine, ritonavir) et de l'infection par le virus de l'hépatite C (VHC) (p.ex. bocéprévir, télaprévir), de la tuberculose (rifampicine, rifabutine), de l'hypertension artérielle dans les vaisseaux sanguins du poumon (bosentan) et au traitement de certains types particuliers de somnolence excessive (modafinil), et par la prise prolongée (plus de 10 jours) de certains antibiotiques utilisés pour le traitement de certaines infections ou de médicaments contenant la préparation végétale millepertuis (voir ci-dessous).
Si vous utilisez l'un des médicaments susmentionnés sur une courte période, vous pouvez continuer à utiliser NuvaRing. Pendant le traitement et pendant les 28 jours qui suivent son arrêt, vous devrez cependant utiliser une méthode de contraception non hormonale supplémentaire, p.ex. des préservatifs masculins. Demandez conseil à ce sujet à votre médecin ou votre pharmacien.
Si le traitement par l'autre médicament se prolonge au-delà des trois semaines d'utilisation de l'anneau vaginal, il faut insérer l'anneau vaginal suivant immédiatement après le précédent, sans respecter l'intervalle libre habituel (voir «Comment utiliser NuvaRing?»). Votre médecin ou votre pharmacien vous dira comment procéder.
Si vous devez prendre un antibiotique sur une longue durée (c.-à-d. plus de 10 à 14 jours pour une inflammation des os ou une borréliose p.ex.), veuillez svp vous informer auprès de votre médecin ou de votre pharmacien sur la procédure à suivre par la suite.
Si vous utilisez NuvaRing, vous ne devez pas prendre en même temps une spécialité à base de millepertuis (Hypericum) contre les dépressions, car son effet contraceptif peut s'en trouver atténué. Certains cas d'irrégularités des règles et des cas isolés de grossesse non souhaitée ont été signalés.
Certains médicaments ainsi que le jus de pamplemousse peuvent entraîner une augmentation de la concentration sanguine de NuvaRing. Informez votre médecin si vous prenez l'un des médicaments suivants ou du jus de pamplemousse:
·antifongiques contenant p.ex. de l'itraconazole, du posaconazole, du voriconazole, ou du fluconazole,
·certains antibiotiques appelés macrolides contenant de la clarithromycine ou de l'érythromycine,
·des médicaments contre le VIH tels que ceux contenant du cobicistat,
·certains médicaments pour le traitement de maladies cardio-vasculaires (contenant du diltiazem ou du vérapamil)
Si vous êtes diabétique, l'utilisation de contraceptifs hormonaux tels que NuvaRing peut modifier votre besoin en médicaments hypoglycémiants (y compris l'insuline).
NuvaRing peut également modifier, en l'augmentant ou en la diminuant, l'efficacité d'autres médicaments, p.ex. de la ciclosporine et de la lamotrigine, un antiépileptique (cela pourrait augmenter la fréquence des épisodes convulsifs. C'est pourquoi votre médecin doit surveiller le taux sanguin de lamotrigine au début de l'utilisation de NuvaRing et lorsque vous arrêtez l'utilisation de NuvaRing). D'autres médicaments peuvent être concernés: des médicaments contre la douleur, des antidépresseurs, des médicaments contre la malaria, des calmants, des médicaments pour le cœur, des médicaments contenant de la cortisone, des anticoagulants et des médicaments contre l'asthme.
N'utilisez pas NuvaRing si vous avez une hépatite C et prenez l'une des associations de principes actifs ombitasvir/paritaprévir/ritonavir, avec ou sans dasabuvir, glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir, car cela peut entraîner une augmentation des paramètres sanguins de la fonction hépatique (augmentation de l'enzyme hépatique ALAT). Cela vaut particulièrement si vous prenez ces médicaments en même temps que la ribavirine, un principe actif qui peut entraîner des malformations congénitales. NuvaRing ne doit être réutilisé que lorsque vos valeurs hépatiques se sont normalisées (voir paragraphe «Quand NuvaRing ne doit-il pas être utilisé?»). Demandez donc à votre médecin quand vous pouvez recommencer à utiliser NuvaRing après l'arrêt de la prise de cette association de principes actifs.
En raison des interactions possibles avec d'autres médicaments, il est important que vous informiez tout autre médecin ou dentiste qui vous prescrit un autre médicament du fait que vous utilisez NuvaRing. Il est également important d'informer le médecin qui vous prescrit NuvaRing des médicaments ou des préparations à base de plantes que vous prenez déjà, y compris en automédication.
L'utilisation de spermicides ou d'antifongiques vaginaux (p.ex. ovules) n'altère pas l'effet contraceptif de NuvaRing. Lors de l'utilisation concomitante de préparations vaginales telles que des lubrifiants ou des produits pour traiter une infection, des ruptures de l'anneau vaginal se sont produites (voir «Comment utiliser NuvaRing?», paragraphe «Rupture de l'anneau vaginal»).
Pendant que vous utilisez NuvaRing, vous ne devriez pas utiliser de méthode barrière féminine (diaphragme vaginal, cape cervicale ou préservatif féminin) comme méthode de contraception de recours. NuvaRing peut compromettre le placement et le positionnement corrects d'un diaphragme, d'une cape cervicale ou d'un préservatif féminin.
Vous pouvez utiliser des tampons lors de l'utilisation de NuvaRing. Insérez NuvaRing avant de mettre un tampon. Lors du retrait du tampon, vous devez être prudente et veiller à ce que l'anneau vaginal ne glisse pas accidentellement à l'extérieur. Si cela arrive, rincez l'anneau vaginal à l'eau froide ou tiède et réinsérez-le immédiatement.
Veuillez informer votre médecin ou votre pharmacien si vous souffrez d'une autre maladie, vous êtes allergique ou vous prenez déjà d'autres médicaments (même en automédication!).
NuvaRing peut-il être utilisé pendant la grossesse ou l'allaitement?
Il ne faut pas utiliser NuvaRing en cas de grossesse suspectée ou certaine. En cas de grossesse débutant pendant l'utilisation de NuvaRing, il faut retirer l'anneau vaginal.
Il est déconseillé d'employer NuvaRing pendant l'allaitement car la production de lait peut être diminuée et la qualité du lait altérée. Si vous souhaitez néanmoins le faire, demandez conseil à votre médecin.
Comment utiliser NuvaRing?
Quand et comment faut-il insérer et retirer NuvaRing?
Vous pouvez placer vous-même NuvaRing dans le vagin et le retirer. Votre médecin vous donnera les explications nécessaires la première fois que vous utiliserez NuvaRing. L'anneau vaginal vaginal doit être inséré le jour adéquat (voir «Insertion du premier anneau vaginal») et rester en place dans le vagin pendant 3 semaines consécutives. Vous devriez vérifier régulièrement si l'anneau vaginal est encore en place dans le vagin (p.ex. avant et après le rapport sexuel), afin de vous assurer que vous êtes protégée contre une grossesse.
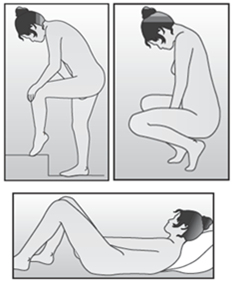
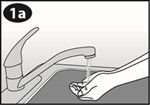
Lavez-vous les mains avant l'insertion ou le retrait de l'anneau vaginal. Choisissez la position qui vous semble la plus confortable, p.ex. debout avec une jambe surélevée, en position accroupie ou en position couchée. Extrayez NuvaRing du sachet. Tenez l'anneau vaginal entre le pouce et l'index, comprimez les deux côtés de l'anneau vaginal l'un sur l'autre et introduisez l'anneau vaginal dans le vagin (voir figures 1-4). Alternativement, vous pouvez choisir d'utiliser l'Applicateur NuvaRing comme aide pour la mise en place de l'anneau vaginal (voir instructions d'utilisation ci-dessous). Une fois que NuvaRing est en place, vous ne devez pas le sentir. Si vous éprouvez une sensation désagréable, changez prudemment la position de NuvaRing (enfoncez p.ex. l'anneau vaginal un peu plus profondément dans le vagin), jusqu'à ce que son positionnement soit confortable. La position exacte de l'anneau vaginal dans le vagin n'a pas d'importance.
Il est conseillé de vérifier de temps à autre que l'anneau vaginal est bien en place, p.ex. après avoir fait du sport ou de la natation et éventuellement après un rapport sexuel.
Au bout de trois semaines, il faut retirer NuvaRing en passant l'index sous le bord antérieur ou en maintenant le bord entre l'index et le majeur, avant d'extraire l'anneau vaginal (voir figure 5). Remettre l'anneau vaginal usagé dans le sachet refermable et le jeter dans une poubelle (ne pas le jeter dans les toilettes) en veillant à ce qu'il soit hors de vue et de portée des enfants et des animaux domestiques. Ensuite, il faut rester une semaine sans utiliser l'anneau vaginal.
L'anneau vaginal doit rester sans interruption dans le vagin pendant trois semaines consécutives après le jour de l'insertion. Au bout de trois semaines, il faut retirer l'anneau vaginal le même jour de la semaine et à peu près à la même heure que lors de l'insertion (par exemple, si vous avez inséré NuvaRing un mercredi à 22 heures, il faut retirer l'anneau vaginal 3 semaines plus tard, le mercredi vers 22 heures.)
Pendant l'interruption d'une semaine, il se produit habituellement, 2 à 3 jours après le retrait de l'anneau vaginal, une hémorragie de privation.
Après l'interruption d'une semaine, introduire un nouvel anneau vaginal dans le vagin, le même jour de la semaine et à peu près à la même heure que lors du cycle précédent, même si l'hémorragie de privation n'a pas encore cessé. Inscrivez dans votre agenda la date d'insertion et de retrait de NuvaRing, afin de ne pas oublier. A la dernière page de cette notice d'emballage vous trouverez des autocollants aide-mémoire afin que vous vous rappeliez les dates auxquelles vous devez retirer votre NuvaRing et en insérer un nouveau au bon moment.
Si vous respectez bien la procédure décrite ci-dessus, votre hémorragie de privation surviendra toutes les 4 semaines, à peu près les mêmes jours.
Comment insérer NuvaRing avec les doigts:
|
|
Lavez-vous les mains avant d'insérer l'anneau vaginal. Extrayez NuvaRing du sachet. |
|
Installez-vous confortablement pour insérer l'anneau vaginal. |
|
|
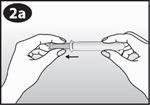
Comprimez l'anneau vaginal. | ||
|
|
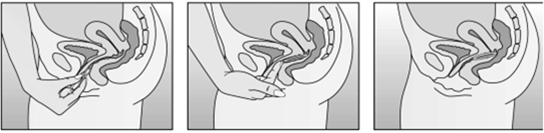
D'une main, insérez l'anneau vaginal dans le vagin (fig. 4A); au besoin, écartez les lèvres vulvaires avec l'autre main. Poussez l'anneau vaginal dans le vagin jusqu'à ce qu'il soit bien placé (fig. 4B). Laissez l'anneau vaginal en place pendant trois semaines (fig. 4C). | ||
|
|
|
Figure 5 | |
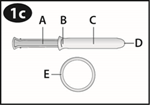
Informations importantes concernant l'Applicateur NuvaRing:
1.A usage facultatif pour aider à insérer NuvaRing.
2.NE réutilisez PAS l'applicateur; il est conçu pour un usage unique.
3.L'applicateur NE DOIT PAS être utilisé par plusieurs personnes.
4.Si vous laissez tomber accidentellement l'applicateur, lavez-le avec de l'eau froide ou tiède (PAS d'eau chaude).
5.Jeter l'applicateur avec les ordures ménagères immédiatement après usage.
6.Ne pas jeter l'applicateur dans les toilettes.
Comment insérer NUVARING avec l'applicateur:
1: Préparation
|
|
|
Lavez-vous les mains avant d'ouvrir l'emballage du NuvaRing et de l'applicateur. Ouvrir SEULEMENT immédiatement avant utilisation. NE PAS UTILISER si le contenu ou l'emballage est visiblement endommagé. |
|
|
|
L'applicateur est conçu pour être utilisé EXCLUSIVEMENT avec NuvaRing, et pas avec d'autres produits. |
|
|
|
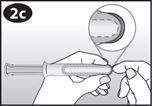
Regardez le schéma de l'applicateur pour vous familiariser avec ses différentes parties. |
2: Charger et positionner
|
|
|
Tirez doucement le piston jusqu'à ce qu'il s'arrête. |
|
|
|
Pincez les côtés opposés de l'anneau vaginal et insérez l'anneau vaginal dans l'ouverture du cylindre. |
|
|
|
Poussez doucement l'anneau vaginal dans le cylindre. La pointe de l'anneau vaginal doit rester légèrement hors de l'ouverture du cylindre. |
|
|
|
Choisissez la position la plus confortable pour vous afin d'insérer l'anneau vaginal, telles que: position allongée sur le dos, accroupie, ou debout avec une jambe relevée. |
3: Insérer et jeter
|
|
|
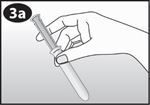
Placez votre pouce et le majeur sur l'extrémité renflée. |
|
|
|
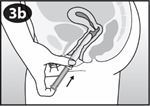
Introduisez doucement le cylindre dans le vagin jusqu'à ce que vos doigts (sur l'extrémité renflée) touchent votre corps. |
|
|
|
L'anneau vaginal est repoussé hors de l'applicateur. Retirez doucement l'applicateur. |
|
|
|
Assurez-vous que l'anneau vaginal n'est PAS resté dans l'applicateur. Jetez l'applicateur utilisé dans la poubelle. NE jetez PAS l'applicateur dans les toilettes. NE réutilisez PAS l'applicateur. |
Pendant que vous utilisez NuvaRing, vous ne devriez pas utiliser de méthode de barrière féminine (diaphragme vaginal, cape cervicale ou préservatif féminin) comme méthode de contraception de recours. NuvaRing peut compromettre le placement et le positionnement corrects d'un diaphragme, d'une cape cervicale ou d'un préservatif féminin.
Insertion du premier anneau vaginal
Si vous n'avez pas utilisé de contraceptif hormonal au cours du mois précédent:
Insérez le premier NuvaRing au premier jour de votre cycle naturel (le jour 1 est le premier jour des règles). Vous pouvez également commencer l'utilisation de NuvaRing entre le jour 2 et le jour 5. Cependant, si vous avez un rapport sexuel pendant les 7 premiers jours après l'introduction de NuvaRing, vous devez utiliser une méthode contraceptive non hormonale supplémentaire (p.ex. préservatif masculin). Cette recommandation ne doit être suivie que pendant l'utilisation du premier anneau vaginal.
Si vous avez utilisé une pilule combinée au cours du mois précédent:
Insérez NuvaRing au plus tard le lendemain de la suspension de la prise de votre pilule actuelle. Si votre boîte de pilules contient aussi des comprimés inactifs (comprimés de placebo), insérez NuvaRing au plus tard le lendemain de la prise du dernier comprimé inactif. Si vous n'êtes pas certaine de quel comprimé il s'agit, demandez conseil à votre médecin ou votre pharmacien. Ne prolongez jamais la pause sans hormone de votre pilule actuelle au-delà de la durée recommandée.
Si vous avez utilisé un patch contraceptif au cours du mois précédent:
Insérez NuvaRing au plus tard le lendemain de votre pause habituelle sans patch. Ne prolongez jamais la pause sans patch au-delà de la durée recommandée.
Si vous avez utilisé une minipilule (pilule contenant uniquement un progestatif) au cours du mois précédent:
Vous pouvez arrêter à tout moment la prise de la minipilule et insérer NuvaRing le lendemain à la même heure. Cependant, n'oubliez pas que, pendant les sept premiers jours suivant l'insertion de NuvaRing, vous devez utiliser une méthode contraceptive non hormonale supplémentaire (p.ex. préservatif masculin).
Si vous avez utilisé un produit injectable, un implant ou un dispositif intra-utérin (stérilet) libérant un progestatif au cours du mois précédent:
Commencez à utiliser NuvaRing le jour de la date prévue de l'injection suivante ou le jour du retrait de l'implant ou du stérilet. Cependant, n'oubliez pas que pendant les sept premiers jours suivant l'insertion de l'anneau vaginal, vous devez utiliser une méthode contraceptive non hormonale supplémentaire (p.ex. préservatif masculin).
Utilisation après une naissance ou après un avortement survenu au-delà des trois premiers mois de grossesse:
Après une naissance ou un avortement au-delà du troisième mois de grossesse, le risque de maladies thromboemboliques est augmenté; vous ne devez donc commencer à utiliser l'anneau vaginal qu'au plus tôt 4 semaines après l'accouchement ou l'avortement. Si vous commencez plus tard, vous devez utiliser une méthode contraceptive non hormonale supplémentaire (p.ex. préservatif masculin) pendant les 7 premiers jours d'emploi de NuvaRing. Si vous avez déjà eu des rapports sexuels, il faut exclure une grossesse ou attendre les premières règles naturelles avant de commencer à utiliser l'anneau vaginal.
Après l'accouchement, les femmes présentent pendant plusieurs semaines (jusqu'à 12 semaines) un risque plus élevé de formation de caillots sanguins. Il est par conséquent important de demander à votre médecin quand vous pouvez reprendre NuvaRing.
Si vous allaitez, reportez-vous à la rubrique «NuvaRing peut-il être utilisé pendant la grossesse ou l'allaitement?»
Utilisation après une fausse couche ou un avortement au cours des trois premiers mois de la grossesse:
Vous pouvez utiliser NuvaRing immédiatement. Vous n'avez pas besoin de recourir à d'autres mesures contraceptives. Si vous ne souhaitez pas l'utiliser immédiatement, respectez les directives énoncées au paragraphe «Si vous n'avez pas utilisé de contraceptif hormonal au cours du mois précédent». Dans l'intervalle, vous devez utiliser un contraceptif formant barrière.
Si vous avez utilisé plus d'un seul NuvaRing à la fois (surdosage):
Aucun incident sévère dû à une surdose d'hormones provenant de NuvaRing n'a été rapporté. Si vous avez inséré accidentellement plus d'un anneau vaginal, des nausées, des vomissements et des saignements vaginaux peuvent survenir. Ces derniers peuvent apparaître en cas de prise accidentelle de la préparation, même chez des jeunes filles qui n'ont pas encore eu leurs premières règles. Si vous constatez qu'un enfant est entré en contact avec les hormones de NuvaRing, consultez votre médecin ou votre pharmacien.
Fin de l'utilisation de NuvaRing
Vous pouvez à tout moment arrêter d'utiliser NuvaRing. Si vous ne désirez pas de grossesse, demandez à votre médecin d'autres méthodes de contrôle des naissances.
Si vous arrêtez d'utiliser NuvaRing afin de tomber enceinte, il est recommandé de manière générale d'attendre une menstruation naturelle avant de tenter de tomber enceinte. Cette précaution s'avère également utile lors du calcul de la date de l'accouchement.
Après l'arrêt de l'utilisation des contraceptifs hormonaux, la plupart des femmes constatent que leurs règles se normalisent dans un délai d'un ou deux mois. Toutefois, si votre cycle ne se normalise pas au cours des 2-3 premiers mois suivant l'arrêt de l'utilisation de l'anneau vaginal, vous devez consulter votre médecin.
Conduite à tenir si vous n'avez pas respecté le mode d'emploi recommandé
Si vous n'avez pas utilisé l'anneau vaginal pendant plus d'une semaine (oubli d'insérer un nouvel anneau vaginal après la période sans anneau vaginal)
Vous devez insérer un nouvel anneau vaginal dans le vagin aussitôt que vous remarquez que vous avez oublié de le faire. Si vous avez des rapports sexuels au cours des sept jours suivants, utilisez une méthode contraceptive supplémentaire de type mécanique (p.ex. préservatif masculin). Si vous avez eu des rapports sexuels pendant la période sans anneau vaginal, il se peut que vous soyez enceinte. Informez immédiatement votre médecin. Le risque de grossesse est d'autant plus grand que la durée écoulée sans anneau vaginal est longue.
Vous avez oublié de retirer l'anneau vaginal
Si vous avez laissé l'anneau vaginal dans le vagin pendant plus de 3 semaines et au maximum 4 semaines, l'effet contraceptif est encore suffisant. Respectez l'interruption habituelle d'une semaine sans anneau vaginal puis utilisez un nouvel anneau vaginal.
Si vous avez laissé l'anneau vaginal dans le vagin pendant plus de 4 semaines, son effet contraceptif peut être compromis et une grossesse est possible. Consultez votre médecin avant d'utiliser un nouvel anneau vaginal.
Si vous n'avez pas respecté les directives recommandées et que vous n'avez pas vos règles pendant la première interruption normale sans anneau vaginal, il se peut que vous soyez enceinte. Consultez votre médecin avant d'utiliser un nouvel anneau vaginal.
Expulsion accidentelle de l'anneau vaginal
Si NuvaRing n'a pas été inséré correctement, il peut glisser hors du vagin, par exemple lors du retrait d'un tampon, lors de la défécation, pendant un rapport sexuel ou lors d'un effort physique intense. Cela peut aussi se produire chez les femmes qui présentent certains états pathologiques (p.ex. constipation, prolapsus utérin, vésical ou rectal).
Afin de prévenir une grossesse, NuvaRing libère lentement des hormones dans le corps. Lorsque l'anneau vaginal est retiré du vagin pendant plus de 3 heures, la durée pendant laquelle aucune hormone n'est plus libérée est longue et il se peut que l'efficacité contraceptive soit alors diminuée. C'est pourquoi l'anneau vaginal ne doit pas rester hors du vagin pendant une durée supérieure à 3 heures par 24 heures.
Selon la durée pendant laquelle NuvaRing s'est trouvé hors du vagin, il peut encore conserver son effet contraceptif. Voir à ce propos ci-dessous des informations complémentaires.
Si l'anneau vaginal est resté hors du vagin pendant les intervalles suivants:
·moins de trois heures: l'effet contraceptif n'est pas réduit. Il faut réinsérer l'anneau vaginal le plus rapidement possible après l'avoir rincé à l'eau froide ou tiède (mais pas chaude!), mais uniquement si l'anneau vaginal est resté pendant moins de 3 heures hors du vagin.
·plus de trois heures lors de la 1re ou la 2e semaine d'utilisation: l'effet contraceptif peut être diminué. Réinsérez l'anneau vaginal aussitôt que vous remarquez l'expulsion, après l'avoir rincé à l'eau froide ou tiède (mais pas chaude!), et laissez-le sans interruption dans le vagin jusqu'à la fin de la 3e semaine. Si vous avez un rapport sexuel pendant les sept premiers jours après la réintroduction de l'anneau vaginal, vous devez utiliser une méthode de contraception supplémentaire de type mécanique (p.ex. préservatif masculin).
·plus de trois heures lors de la 3e semaine d'utilisation: l'effet contraceptif peut être diminué. Vous devez jeter cet anneau vaginal et choisir une des deux possibilités suivantes:
1.Réintroduisez immédiatement un nouvel anneau vaginal. Attention: dans ce cas, votre prochaine période d'utilisation de trois semaines commence. Il se peut que vous n'ayez pas de menstruation mais que des suintements hémorragiques ou des hémorragies en cours de cycle surviennent.
2.Attendez la menstruation et introduisez un nouvel anneau vaginal, mais pas plus tard que sept jours (7 x 24 heures) après le retrait ou l'expulsion du dernier anneau vaginal.
Attention: ne choisissez cette possibilité que si vous avez utilisé NuvaRing sans interruption au cours des 7 derniers jours.
·durée inconnue: il se peut que vous ne soyez pas protégée d'une grossesse. Effectuez un test de grossesse et consultez votre médecin avant d'insérer un nouvel anneau vaginal.
Rupture de l'anneau vaginal
Une rupture de NuvaRing peut survenir dans des cas très rares. Des lésions vaginales ont été rapportées en lien avec des ruptures de l'anneau vaginal.
Si vous remarquez une telle rupture de l'anneau vaginal, vous devez le jeter et le remplacer aussi vite que possible par un nouvel anneau vaginal. Pendant les 7 jours suivants, vous devez utiliser une méthode contraceptive supplémentaire (p.ex. préservatif masculin). Si vous avez eu un rapport sexuel avant de remarquer la rupture de l'anneau vaginal, vous devez consulter votre médecin.
Modification de la date des règles
Pour avancer la date de vos règles:
Si vous utilisez NuvaRing conformément aux modalités recommandées, vous aurez vos règles régulièrement toutes les quatre semaines. Si vous souhaitez modifier cette situation, il vous suffit de raccourcir la phase d'interruption sans anneau vaginal. Par exemple, si vos règles débutent généralement un vendredi et que vous souhaitez qu'à l'avenir elles commencent un mardi (trois jours plus tôt), vous devez insérer l'anneau vaginal suivant trois jours plus tôt que d'habitude. Ainsi, votre prochaine menstruation commencera à un jour différent, dans ce cas 3 jours plus tôt. Si vous respectez un intervalle libre (sans anneau vaginal) très court (p.ex. trois jours ou moins), il se peut que vous n'ayez pas d'hémorragie pendant cette période. Pendant l'utilisation de l'anneau vaginal suivant, il peut alors se produire un suintement hémorragique ou des hémorragies en cours de cycle. La période d'interruption sans anneau vaginal ne doit jamais durer plus d'une semaine. Vous pouvez toujours raccourcir la durée de l'interruption du traitement par l'anneau vaginal, mais ne devez jamais la prolonger.
Pour retarder la date de vos règles:
Pour retarder la date de vos règles dans des situations particulières, il suffit d'insérer l'anneau vaginal suivant dès le retrait de l'anneau vaginal en cours d'utilisation, sans respecter d'intervalle libre entre l'utilisation des deux anneaux vaginaux. Vous pouvez laisser le deuxième anneau vaginal en place pendant trois semaines. Cependant, pendant l'utilisation du deuxième anneau vaginal, il peut se produire des hémorragies en cours de cycle ou des suintements hémorragiques. Dès que vous souhaitez avoir vos règles, il suffit de retirer l'anneau vaginal. Laissez s'écouler l'intervalle libre habituel d'une semaine, puis insérez un nouvel anneau vaginal.
Conduite à tenir en cas d'anomalies des hémorragies
Survenue d'hémorragies imprévues
Pendant l'utilisation de NuvaRing, certaines femmes peuvent présenter des hémorragies imprévues (hémorragies en cours de cycle ou suintements hémorragiques) entre les règles, en particulier pendant les premiers mois de l'utilisation. Continuez cependant à utiliser l'anneau vaginal tout à fait normalement. Toutefois, si l'hémorragie anormale persiste, devient plus intense ou se reproduit, il faut consulter votre médecin.
Vous n'avez pas vos règles
NuvaRing a été correctement utilisé
Certaines femmes ne présentent pas d'hémorragie de privation pendant la suspension du traitement par l'anneau vaginal. Si vos règles sont absentes une seule fois, que vous avez utilisé NuvaRing correctement et n'avez employé aucun autre médicament, il est très peu probable que vous soyez enceinte. Continuez à utiliser NuvaRing normalement.
Par contre, si vos règles sont absentes deux fois de suite, il se peut que vous soyez enceinte. Informez immédiatement votre médecin. N'utilisez pas d'autre NuvaRing tant que votre médecin n'a pas exclu l'éventualité d'une grossesse.
NuvaRing n'a pas été correctement utilisé
Si vous n'avez pas correctement respecté les directives d'utilisation de NuvaRing et que vos règles ne surviennent pas pendant la phase sans anneau vaginal, il se peut que vous soyez enceinte. Avant d'utiliser à nouveau NuvaRing, vous devez consulter votre médecin.
Enfants et adolescentes
La sécurité et l'efficacité de NuvaRing n'ont pas été étudiées chez les adolescentes âgées de moins de 18 ans
Ne changez pas de votre propre chef le dosage prescrit. Adressez-vous à votre médecin ou à votre pharmacien si vous estimez que l'efficacité du médicament est trop faible ou au contraire trop forte.
Quels effets secondaires NuvaRing peut-il provoquer?
Veuillez informer votre médecin de tous les effets secondaires, en particulier des symptômes sévères ou persistants ou des modifications de votre état de santé si vous soupçonnez le CHC d'en être à l'origine. Les effets secondaires les plus sévères liés à l'utilisation des CHC sont décrits dans la rubrique «Quelles sont les précautions à observer lors de l'utilisation de NuvaRing?».
Le risque de formation de caillots sanguins dans les veines (thromboembolie veineuse) ou les artères (thromboembolie artérielle) est augmenté chez toutes les femmes utilisant NuvaRing.
Ce risque est encore plus élevé si vous présentez des facteurs ou des maladies qui eux-mêmes augmentent aussi ce risque (pour de plus amples informations sur les facteurs et les maladies qui augmentent le risque de caillot et sur les symptômes d'un caillot, reportez-vous à la partie «Caillots sanguins» sous la rubrique «Quelles sont les précautions à observer lors de l'utilisation de NuvaRing?»).
En plus des effets secondaires mentionnés au paragraphe «Quelles sont les précautions à observer lors de l'utilisation de NuvaRing?», on peut noter les effets secondaires suivants pendant l'utilisation de NuvaRing:
Fréquents (concerne 1 à 10 personnes sur 100)
Maux de tête, migraine, pertes vaginales, candidose vaginale, démangeaisons dans la région génitale, prise de poids, nausées, douleurs du ventre et du bas-ventre, sensibilité de la poitrine, dépression, menstruation douloureuse (dysménorrhée), acné, diminution du désir sexuel (libido), expulsion de l'anneau vaginal, sensation de corps étranger.
Occasionnels (concerne 1 à 10 personnes sur 1000)
Douleurs vaginales, sécheresse vaginale, odeur vaginale, sensation de brûlure dans le vagin, infections vaginales, troubles de la menstruation, crampes utérines, inflammation du col de l'utérus, polypes cervicaux, syndrome prémenstruel, gêne ou gonflement mammaire, nodules mammaires, éruption cutanée, chute de cheveux, eczéma, démangeaisons, urticaire, vertiges, sensibilité diminuée de la peau au toucher, anxiété, humeur modifiée, fluctuations d'humeur, vomissements, abdomen flatulent, diarrhée, constipation, augmentation de l'appétit, infection des voies urinaires, infection fongique, troubles urinaires, miction impérieuse, douleurs dorsales, crampes musculaires, douleurs dans les membres, asthénie, malaise, irritabilité, hypertension, troubles visuels, bouffée de chaleur, difficultés lors de l'introduction/du retrait de l'anneau vaginal, anneau vaginal rompu, douleurs ou hémorragies lors des rapports sexuels, rétention d'eau dans les tissus.
Rares (concerne 1 à 10 personnes sur 10 000)
Réactions allergiques (hypersensibilité), y compris enflure du visage, des lèvres, de la langue et/ou de la gorge qui provoquent des difficultés à respirer ou à avaler (angio-œdème et/ou réaction anaphylactique), lésion du vagin en lien avec un anneau vaginal rompu, galactorrhée (écoulement de lait), réactions locales au niveau du pénis chez le partenaire (p.ex. irritation, éruption, prurit), caillots sanguins dans une veine ou une artère, par exemple: dans une jambe ou un pied (c.-à-d. thrombose veineuse profonde), dans un poumon (c.-à-d. embolie pulmonaire), infarctus du myocarde, accident vasculaire cérébral ou symptômes passagers évocateurs d'un accident vasculaire cérébral, appelé accident ischémique transitoire.
Si vous remarquez des effets secondaires, veuillez en informer votre médecin ou pharmacien-ne. Ceci vaut en particulier pour les effets secondaires non mentionnés dans cette notice d'emballage.
A quoi faut-il encore faire attention?
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Il faut utiliser NuvaRing dans les 4 mois suivant la date de délivrance. Si la date de péremption précède l'échéance de quatre mois, c'est la date de péremption qu'il faut respecter.
Conserver à 2-30°C dans l'emballage d'origine, à l'abri de la lumière.
Conserver hors de portée des enfants. Si un enfant a été en contact avec NuvaRing, signalez-le au médecin.
N'utilisez pas le médicament si vous constatez une modification de la couleur de l'anneau vaginal ou d'autres signes visibles d'altération de la qualité.
Après avoir été retiré, NuvaRing doit être placé dans le sachet refermable et être éliminé ainsi avec les ordures ménagères, afin d'éviter que des personnes n'entrent en contact avec lui accidentellement. L'applicateur devrait être jeté avec les ordures ménagères traditionnelles. NuvaRing et l'applicateur ne doivent pas être jetés dans les toilettes. Pour de plus amples renseignements, consultez votre médecin ou votre pharmacien qui disposent d'une information détaillée destinée aux professionnels.
Que contient NuvaRing?
Principes actifs
11,7 mg d'étonogestrel et 2,7 mg d'éthinylestradiol
Excipients
Copolymère d'éthylène et d'acétate de vinyle et stéarate de magnésium.
Composition selon la notice étrangère.
Où obtenez-vous NuvaRing? Quels sont les emballages à disposition sur le marché?
En pharmacie, sur ordonnance médicale.
Emballage avec 1 anneau vaginal et 1 applicateur.
Emballage avec 3 anneaux vaginaux et 3 applicateurs. Chaque anneau vaginal est emballé dans un sachet que vous pouvez refermer. L'applicateur NuvaRing est un dispositif médical non stérile en plastique, destiné à un usage unique (c.-à-d. jetable). Chaque applicateur est emballé individuellement. L'applicateur a un marquage CE, gravé sur le dispositif médical.
Numéro d'autorisation
Numéro d'autorisation (Original)
56038 (Swissmedic).
Numéro d'autorisation (Importateur)
69705 (Swissmedic) (Portugal).
69706 (Swissmedic) (Italia).
69704 (Swissmedic) (Allemagne).
Titulaire de l'autorisation
Titulaire de l'autorisation (Original)
Organon GmbH, Lucerne.
Titulaire de l'autorisation (Importateur)
APS-Arzneimittel-Parallelimport-Service AG, 6330 Cham.