Composition
Principes actifs
Factor VII coagulationis humanus
Excipients
Natrii Citras, Natrii Chloridum (quantité totale de sodium env. 40.9 mg par flacon), Heparinum natricum (max. 300 U.I. par flacon)
Solvant: Aqua ad iniectabile
Indications/Possibilités d’emploi
Hémorragies aiguës et prévention hémorragique péri-opératoire dans le cas d'un déficit congénital et acquis en facteur VII. (Hypo- ou aproconvertinémie).
La préparation ne contient pas de facteur VIIa activé et ne devait pas être utilisée chez les patients hémophiles qui présentent un inhibiteur.
Posologie/Mode d’emploi
La préparation agit seulement après administration intraveineuse. On ne dispose que d'un nombre limité de données sur l'utilisation clinique de concentrés de facteur VII. Le traitement devra donc être instauré sous la surveillance d'un médecin expérimenté dans le traitement substitutif avec des facteurs de coagulation.
La posologie et la durée du traitement substitutif dépendent du degré de sévérité du déficit en facteur VII, de la localisation et de l'importance de l'hémorragie et de l'état clinique du patient. La détermination exacte de la posologie ne peut se faire que sur la base de contrôles réguliers du taux plasmatique de facteur VII et d'une surveillance continue de l'état clinique du patient.
Le nombre d'unités de facteur VII administrées est indiqué en unités internationales (U.I.) lesquelles sont dérivées du standard actuel de l'OMS pour les préparations de facteur VII.
L'activité plasmatique du facteur VII est indiquée soit en pourcentage (par rapport au plasma humain normal) soit en unités internationales (par rapport au standard international pour les concentrés de facteur VII). Une unité internationale (U.I.) d'activité du facteur VII correspond à la quantité de facteur VII présente dans 1 ml de plasma humain normal.
Le calcul de la dose nécessaire de facteur VII repose sur l'observation selon laquelle 1 U.I. de facteur VII par kg de poids corporel augmente l'activité plasmatique du facteur VII d'environ 1.9 % (0.019 UI/ml).
La dose nécessaire est calculée à l'aide de la formule suivante:
Nombre d'unités nécessaires = poids corporel (kg) × augmentation souhaitée en facteur VII (UI/ml) × 53* {inverse de la récupération observée (ml/kg)}
*(résultant de 1/0.019 = 52.6)
La dose et la fréquence des injections doivent toujours être adaptées à chaque cas en fonction de l'efficacité clinique observée. Les indications du tableau suivant peuvent servir de guide.
|
Hémorragie |
Activité plasmatique du facteur VII nécessaire en thérapeutique (UI/ml) |
Durée nécessaire du traitement pour maintenir le taux plasmatique |
|
Hémorragies légères et interventions chirurgicales mineures |
0.10 – 0.20 |
Dose unique (hémorragies légères) ou jusqu'à la cicatrisation complète (interventions chirurgicales mineures) |
|
Hémorragies sévères et interventions chirurgicales majeures |
0.20 – 0.25 |
8 à 10 jours ou jusqu'à la cicatrisation complète |
Les intervalles entre les doses sont déterminés par la courte demi-vie de 3 à 5 heures du facteur VII.
Lorsque des taux élevés de facteur VII doivent être maintenus pendant une période prolongée, des injections sont nécessaires toutes les 8 à 12 heures.
Posologies spéciales
Enfants
Les données disponibles sont insuffisantes pour recommander l'administration de Facteur VII NF Takeda chez l'enfant de moins de 6 ans.
Mode d'emploi
Reconstituer le produit comme décrit au paragraphe Dissolution de la poudre (voir «Remarques concernant la manipulation»). Facteur VII NF Takeda doit être administré lentement par voie intraveineuse. La vitesse d'administration ne doit pas dépasser 1-2 ml/min.
Contre-indications
·Hypersensibilité au facteur VII ou à l'un des excipients.
·Coagulopathie de consommation (CIVD) et/ou hyperfibrinolyse sans interruption préalable du trouble sous-jacent.
·Thrombocytopénie connue, induite par l'héparine.
·Allergie connue à l'héparine.
Mises en garde et précautions
Dans le contexte avec l'application de produits contenants du facteur VII, des réactions d'hypersensibilité, y compris réactions anaphylactiques, ont été rapportés. Des réactions d'hypersensibilité ont été observées également avec le Facteur VII NF Takeda. Les patients et/ou leurs soignants doivent être informés des premiers signes d'une réaction d'hypersensibilité tels qu'éruption urticarienne, urticaire (généralisé), sensation d'oppression dans la poitrine, stridor, hypotension artérielle et anaphylaxie. En cas d'apparition de ces symptômes, les patients doivent immédiatement interrompre le traitement et consulter leur médecin.
En cas de choc, le traitement actuel médical standard du choc doit être mis en oeuvre.
Comme dérivé plasmatique, le concentré du facteur VII contient aussi d'autres protéines humaines.
En se basant sur les expériences acquises avec des préparations de complexe prothrombinique, les patients traités par un concentré de facteur VII de la coagulation humain présentent un risque potentiel de thrombose ou de coagulopathie de consommation (CIVD). Des thromboses de la veine cérébrale, thromboses veineuses profondes et thrombophlébites ont été observés dans ce contexte. Etant donné le risque potentiel de complications thromboemboliques, la prudence s'impose lors de l'utilisation de fortes doses de concentré de facteur VII de la coagulation humain, chez les patients atteints de cardiopathie coronarienne ou d'infarctus du myocarde, chez les patients atteints d'affections hépatiques, chez les patients en postopératoire, chez les nouveau-nés et chez les patients présentant un risque de thrombose ou de coagulopathie de consommation. Dans tous ces cas, il faut mettre en balance le bénéfice potentiel d'un traitement par un concentré de facteur VII de la coagulation humain et le risque de ces complications. En cas de risque de thrombose, d'angine de poitrine ou d'infarctus du myocarde, l'utilisation n'est indiquée qu'en présence d'hémorragies mettant en jeu le pronostic vital. En cas d'administration du Facteur VII NF, les patients doivent être surveillés étroitement pour des signes et symptômes d'une coagulation intravasculaire disséminée ou d'un thromboembolisme.
Théoriquement, le traitement substitutif par Facteur VII NF Takeda peut entraîner la formation d'anticorps circulants qui inhibent le facteur VII. Dans la pratique clinique, un tel cas n'a cependant pas encore été déclaré à ce jour. En cas de survenue de ces inhibiteurs, l'état se manifeste sous forme d'une réponse clinique insuffisante.
Sodium
Un flacon perforable de Facteur VII NF Takeda contient env. 40.9 mg de sodium. Cela équivaut à 2.0 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte. Cela doit être pris en compte chez les patients contrôlant leur apport alimentaire en sodium.
Héparine
Peut provoquer des réactions allergiques et une baisse de la numération sanguine pouvant influer sur la coagulation. Les patients présentant des antécédents de réactions allergiques induites par l'héparine doivent éviter l'utilisation de médicaments contenant de l'héparine.
Facteur VII NF Takeda est produit à partir de plasma humain. Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection des donneurs, la recherche de marqueurs spécifiques d'infection sur chaque don et sur les pools de plasma et l'inclusion dans le procédé de fabrication d'étapes efficaces pour l'inactivation/élimination virale.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures de sécurité prises sont considérées comme efficaces contre les virus enveloppés tels que VIH, VHB et VHC ainsi que vis-à-vis du virus non enveloppés de l'hépatite A (VHA).
Les mesures prises peuvent être d'efficacité limitée vis-à-vis des virus non enveloppés tels que parvovirus B19.
L'infection par le parvovirus B19 peut être grave chez les femmes enceintes (infection foetale) et chez les sujets immunodéprimés ou présentant une augmentation de la production de globules rouges (par ex. anémie hémolytique) (voir «Grossesse, allaitement»).
Pour les patients qui reçoivent régulièrement des préparations dérivées de sang ou de plasmas humains, une vaccination contre l'hépatite A et l'hépatite B est recommandée par principe.
Lors de chaque administration de Facteur VII NF Takeda à un patient, il est recommandé de documenter le nom et le numéro de lot de la préparation pour pouvoir établir un rapport entre le patient et le lot du produit.
Interactions
Aucune interaction des facteurs VII de la coagulation humains avec d'autres médicaments n'est connue à ce jour.
Grossesse, allaitement
On ne dispose d'aucune étude clinique sur la sécurité de Facteur VII NF Takeda chez la femme enceinte. Il n'existe pas d'expérimentations animales suffisantes concernant l'incidence sur la grossesse, le développement embryonnaire, le développement fœtal et/ou le développement post-natal. Le risque potentiel pour l'être humain n'est pas connu.
Facteur VII NF Takeda ne doit donc être utilisé pendant la grossesse et l'allaitement qu'en cas d'indication clairement posée (voir les indications au paragraphe «Surdosage»).
Informations sur les infections par le parvovirus B19 cf. «Mises en garde et précautions».
Effet sur l’aptitude à la conduite et l’utilisation de machines
Il n'y a aucun d'impact connu sur l'aptitude à la conduite ou à l'utilisation de machines.
Effets indésirables
Les effets indésirables énumérés ci-dessous reposent sur les compte-rendus d'études cliniques et l'expérience de post-commercialisation, disponibles pour ce type de préparation. Leur fréquence a été déterminée en utilisant les critères suivants: très fréquent (> 10 %), fréquent (>1%, <10%), peu fréquent (>0,1%, <1%), rare (>0,01%, <0,1%), très rare (<0,01%) et fréquence inconnue (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Rare: réactions d'hypersensibilité ou allergiques (peuvent inclure urticaire, nausées, vomissements, dyspnée et chute de tension)
Très rare: anaphylaxie, urticaire (généralisé)
Affections du système nerveux
Rare: sensation vertigineuse, dysesthésie, céphalée comme expression d'une réaction d'hypersensibilité
Affections de la peau et du tissu sous-cutané
Fréquent: rash
Rare: démangeaisons, éruption cutanée fugace, exanthème urticarien
Troubles généraux et anomalies au site d'administration
Fréquent: fièvre, douleurs de poitrine, sensation d'état anomal
Rare: sensation d'oppression dans la poitrine, gène thoracique comme expression d'une réaction d'hypersensibilité
Affections hématologiques et du système lymphatique
Très rare: inhibition du facteur VII (anticorps antifacteur VII positives), coagulopathie de consommation
Affections vasculaires
Fréquent: bouffée congestive
Rare: bouffée de chaleur comme expression d'une réaction d'hypersensibilité
Très rare: Hypotension, choc, complications thromboemboliques, thrombose, thrombose veineuse profonde
Fréquence inconnue: thrombose de la veine cérébrale, thrombophlébite superficielle
Affections psychiatriques
Très rare: confusion, insomnie, agitation
Affections cardiaques
Très rare: arythmies
Rare: hypotension
Affections gastro-intestinales
Très rare: diarrhée, nausées
Affections respiratoires, thoraciques et médiastinales
Très rare: Stridor
Rare: bronchospasme, dyspnée
Les effets secondaires suivants se basent sur des rapports de la surveillance post-marketing des médicaments de la même classe: accident vasculaire cérébral, infarctus du myocarde, thrombose artérielle, embolie pulmonaire, coagulation intravasculaire disséminée, réactions anaphylactiques, urticaire, vomissement.
A l'occasion du traitement de substitution avec le facteur VII humain (y compris Facteur VII NF), des anticorps circulants dirigés contre le facteur VII peuvent survenir très rarement. Lors de l'apparition d'un tel inhibiteur, cet état peut se manifester par une réponse clinique insuffisante.
Pour d'informations concernant la sécurité virale voir «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Des cas d'infarctus du myocarde, de coagulopathie de consommation, de thrombose veineuse et d'embolie pulmonaire ont été mis en rapport avec l'administration de fortes doses de préparations contenant du facteur VII. C'est pourquoi le développement de complications thromboemboliques et d'une coagulopathie de consommation est accru dans le cas d'un surdosage survenant chez des patients présentant des facteurs de risque (lésion hépatique sévère, thrombophilie, angine de poitrine, infarctus du myocarde, grossesse, oxygénothérapie) de ces complications et surtout lors d'une administration supplémentaire de concentrés de complexe prothrombinique.
Propriétés/Effets
Code ATC
B02BD05
Mécanisme d'action
Le facteur VII est un facteur de la coagulation vitamine K-dépendant et est présent dans le plasma humain normal. C'est le proenzyme du facteur VIIa, sérine protéase active qui active la voie exogène de la coagulation sanguine. L'administration d'un concentré de facteur VII de la coagulation humain permet d'élever le taux plasmatique de facteur VII et peut corriger temporairement le trouble de la coagulation de patients présentant un déficit en facteur VII.
Pharmacocinétique
Après une administration intraveineuse de Facteur VII NF Takeda, le taux de récupération in vivo attendu est d'environ 60-100 %, avec une demi-vie de 3 – 5 heures.
(temps de séjour moyen 7.6 h, volume de distribution 2500 ml).
Données précliniques
Le facteur VII de la coagulation humain (qui est contenu dans Facteur VII NF Takeda) est un composant normal du plasma humain et se comporte comme un facteur VII endogène.
Les études de toxicité avec une administration unique montrent seulement les effets d'un surdosage auxquels il y a lieu de s'attendre lors de l'utilisation chez l'homme et ont donc un intérêt limité. Les études de toxicité chez l'animal avec une administration multiple ne sont pas réalisables à cause de l'interférence avec les anticorps qui se développent vis à vis de la protéine hétérologue.
Les essais cliniques n'ont montré aucun indice d'effets tumorigènes et mutagènes du facteur VII de la coagulation humain si bien que la réalisation d'études expérimentales, spécialement sur des espèces hétérologues, n'a pas été jugée nécessaire.
Remarques particulières
Incompatibilités
Facteur VII NF Takeda ne doit pas être mélangé avec d'autres médicaments avant son administration.
Le cas échéant, il est recommandé de rincer la voie d'abord veineuse commune avec une solution de sérum physiologique, avant et après l'utilisation de Facteur VII NF Takeda.
Influence sur les méthodes de diagnostic
En cas d'application de fortes doses de Facteur VII NF Takeda, il faut tenir compte de l'héparine contenue dans la préparation lorsque l'on fait des analyses de la coagulation sensibles à l'héparine. Le cas échéant, un effet de l'héparine sur les tests de la coagulation peut être neutralisé in vitro avec du sulfate de protamine.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «Exp.» sur le récipient.
Après la reconstitution, Facteur VII NF Takeda doit être utilisé immédiatement car la préparation ne contient pas de conservateur.
Remarques particulières concernant le stockage
Conserver à 2 °C – 8 °C (au réfrigérateur). Ne pas congeler.
Conserver le flacon dans son emballage afin de protéger le contenu de la lumière.
Pendant la durée de conservation, le produit peut être conservé uniquement à température ambiante (15-25°C) pendant une période n'excédant pas 6 mois. Le cas échéant, la date de fin de cette période de 6 mois doit être indiquée comme nouvelle date de péremption sur l'emballage original.
Après le stockage à 15-25°C le produit ne peut pas être conservé de nouveau à 2 – 8 °C, mais doit être consommé ou éliminé.
Tenir les médicaments hors de portée des enfants.
Remarques concernant la manipulation
Reconstituer Facteur VII NF Takeda immédiatement avant son administration. Utiliser seulement le set de perfusion mis à disposition. La solution doit être limpide ou légèrement opalescente. Ne pas utiliser de solutions troubles ou présentant un dépôt. Utiliser immédiatement la solution après la reconstitution.
Eliminer dans les règles de l'art les solutions non utilisées ainsi que les déchets.
Dissolution de la poudre
1.Réchauffer le solvant (eau pour préparations injectables) dans son flacon non ouvert à température ambiante (37 °C au max.).
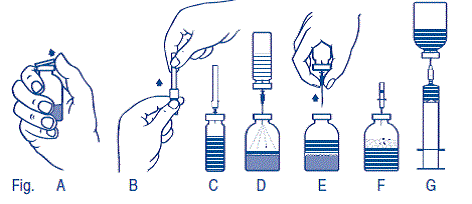
2.Retirer les capuchons protecteurs des flacons contenant la poudre et le solvant (fig. A) et désinfecter les bouchons en caoutchouc des deux flacons.
3.Enlever en tournant et en tirant le capuchon d'une des extrémités de l'aiguille de transfert jointe et enfoncer l'aiguille libérée dans le bouchon en caoutchouc du flacon de solvant (fig. B et C).
4.Enlever l'autre capuchon de l'aiguille de transfert. Ne pas toucher l'extrémité libre de l'aiguille!
5.Renverser le flacon de solvant et enfoncer l'aiguille de transfert montée au centre du bouchon en caoutchouc du flacon de poudre (fig. D). Le vide constitué dans le flacon de poudre aspire le solvant.
6.Retirer le flacon de solvant avec l'aiguille du flacon de poudre (fig. E). Accélérer le processus de dissolution en agitant légèrement le flacon de poudre.
7.Après la dissolution complète de la poudre, enfoncer l'aiguille d'aération jointe (fig. F), pour faire disparaître la mousse qui s'est éventuellement formée. Retirer l'aiguille d'aération.
Injection
1.Enlever en tournant et en tirant le capuchon de l'aiguille-filtre jointe, monter celle-ci sur la seringue stérile à usage unique et aspirer la solution dans la seringue (fig. G).
2.Séparer la seringue de l'aiguille-filtre et injecter la solution avec le nécessaire de perfusion fourni ou l'aiguille à usage unique par voie intraveineuse lente (2 ml/min au maximum).
3.Lors du traitement à domicile, il faut s'assurer que les aiguilles et seringues utilisées sont remises dans la trousse et rapportées.
Perfusion
Utiliser un nécessaire de perfusion à usage unique, muni d'un filtre adéquat lorsque l'administration se fait en perfusion.
Numéro d’autorisation
41304 (Swissmedic)
Présentation
Poudre de 600 U.I. de facteur VII et 10 ml d'eau pour préparations injectables.
Chaque emballage de Facteur VII NF Takeda contient: 1 flacon perforable de poudre pour solution injectable (IV), 1 flacon d'eau pour préparations injectables et 1 trousse pour dissolution et injection.
Catégorie de remise: B
Titulaire de l’autorisation
Takeda Pharma AG, 8152 Opfikon
Mise à jour de l’information
Mai 2025