Composition
Principe actif
Tirofiban sous forme de monohydrate de chlorhydrate de tirofiban
Excipients
Acide citrique, citrate de sodium dihydraté, chlorure de sodium, hydroxyde de sodium (pour l’ajustement du pH), acide chlorhydrique (pour l’ajustement du pH), eau pour préparations injectables Teneur en sodium par poche de perfusion de 250 ml : 918 mg.
Indications/Possibilités d’emploi
Aggrastat est indiqué en association avec l'héparine et l'acide acétylsalicylique chez l'adulte souffrant d'un syndrome coronaire aigu sans sus-décalage du segment ST (SCA NST).
Aggrastat est également indiqué pour la réduction du risque de survenue d'événements cardiovasculaires majeurs chez les patients avec un syndrome coronaire aigu devant bénéficier d'une intervention coronaire percutanée (ICP), y inclus une ICP primaire chez les patients avec un infarctus du myocarde avec sus-décalage du segment ST (IDM ST+).
Posologie/Mode d’emploi
Ce médicament est réservé à l'usage hospitalier, aux médecins spécialistes ayant une expérience de la prise en charge des syndromes coronaires aigus.
Posologie:
Chez les patients SCA NST pour lesquels une intervention coronaire percutanée est planifiée dans les quatre premières heures suivant le diagnostic ou chez les patients en phase aiguë d'infarctus du myocarde (IDM ST+) devant bénéficier d'une intervention coronaire percutanée primaire, Aggrastat devra être administré au début de l'intervention coronaire percutanée sous la forme d'un bolus initial de 25 microgrammes/kg injecté sur une période de 3 minutes, suivi d'une perfusion continue à une vitesse de 0,15 microgramme/kg/min pendant 12 à 24 heures et jusqu'à 48 heures.
Chez les patients bénéficiant d'une stratégie de prise en charge invasive précoce pour un syndrome coronaire aigu sans sus-décalage persistant du segment ST (SCA NST) et chez lesquels il n'est pas prévu de réaliser une coronarographie dans les 4 heures et jusqu'à 48 heures après le diagnostic, Aggrastat devrait être administré (en même temps que l'héparine) dès que le diagnostic est établi avec un taux initial de perfusion de 0,4 microgramme/kg/min par voie intraveineuse en l'espace de 30 minutes. Après la fin de la perfusion de la dose de charge, l'administration d'Aggrastat devrait être poursuivie avec une perfusion d'entretien de 0,1 microgramme/kg/min. La durée recommandée de la perfusion d'entretien est d'au moins 48 heures. La perfusion d'Aggrastat et d'héparine peut être poursuivie au cours d'une coronarographie, et doit être maintenue pendant au moins 12 heures, sans dépasser 24 heures après une intervention coronaire percutanée. La durée totale du traitement ne doit pas dépasser 108 heures.
Traitements concomitants (héparine, antiagrégant plaquettaire par voie orale)
En l'absence de contre-indication, tous les patients doivent recevoir de l'héparine et des antiagrégants plaquettaires par voie orale, dont l'aspirine, avant le début du traitement par Aggrastat. Ce traitement doit être poursuivi au moins pendant la durée de la perfusion d'Aggrastat.
Si une intervention coronaire percutanée est nécessaire, l'héparine doit être arrêtée après cette intervention, et le désilet doit être retiré après restauration d'une hémostase adéquate, c'est-à-dire lorsque l'ACT (Activated Clotting Time) est inférieur à 180 secondes ou 2 à 6 heures après l'arrêt de l'héparine (voir «Propriétés/Effets»).
Les directives concernant les adaptations de la dose en fonction du poids corporel figurent sur le tableau 1 ci-dessous:
Tableau 1 – Posologie
|
|
Dose de charge 0,4 microgramme/kg/min |
Bolus de 25 microgrammes/kg | ||||||
|
Patients normaux |
Insuffisance rénale sévère |
Patients normaux |
Insuffisance rénale sévère | |||||
|
Poids corporel |
Taux initial de perfusion pour 30 min |
Perfusion d'entretien |
Taux initial de perfusion pour 30 min |
Perfusion d'entretien |
Bolus |
Perfusion d'entretien |
Bolus |
Perfusion d'entretien |
|
30-37 |
16 |
4 |
8 |
2 |
17 |
6 |
8 |
3 |
|
38-45 |
20 |
5 |
10 |
3 |
21 |
7 |
10 |
4 |
|
46-54 |
24 |
6 |
12 |
3 |
25 |
9 |
13 |
5 |
|
55-62 |
28 |
7 |
14 |
4 |
29 |
11 |
15 |
5 |
|
63-70 |
32 |
8 |
16 |
4 |
33 |
12 |
17 |
6 |
|
71-79 |
36 |
9 |
18 |
5 |
38 |
14 |
19 |
7 |
|
80-87 |
40 |
10 |
20 |
5 |
42 |
15 |
21 |
8 |
|
88-95 |
44 |
11 |
22 |
6 |
46 |
16 |
23 |
8 |
|
96-104 |
48 |
12 |
24 |
6 |
50 |
18 |
25 |
9 |
|
105-112 |
52 |
13 |
26 |
7 |
54 |
20 |
27 |
10 |
|
113-120 |
56 |
14 |
28 |
7 |
58 |
21 |
29 |
10 |
|
121-128 |
60 |
15 |
30 |
8 |
62 |
22 |
31 |
11 |
|
129-137 |
64 |
16 |
32 |
8 |
67 |
24 |
33 |
12 |
|
138-145 |
68 |
17 |
34 |
9 |
71 |
25 |
35 |
13 |
|
146-153 |
72 |
18 |
36 |
9 |
75 |
27 |
37 |
13 |
Directives posologiques particulières
Patients souffrant d'insuffisance rénale sévère
Chez les patients souffrant d'insuffisance rénale sévère (clearance de la créatinine <30 ml/min), la dose d'Aggrastat doit être réduite de moitié (voir «Mises en garde et précautions, Insuffisance rénale sévère» et «Pharmacocinétique, Caractéristiques des patients, Insuffisance rénale»).
Patients souffrant d'insuffisance hépatique sévère
Chez les patients atteints d'une insuffisance hépatique sévère, il n'existe pas de données scientifiques.
Autres groupes de patients
Aucune adaptation de la dose n'est recommandée pour les patients âgés et les femmes.
Pédiatrie
On ne dispose d'aucune expérience chez les enfants et les adolescents (<18 ans).
Remarques concernant la manipulation: voir «Remarques particulières».
Contre-indications
Aggrastat est contre-indiqué chez les patients présentant une hypersensibilité à l'un des composants du médicament.
Etant donné que l'inhibition de l'agrégation plaquettaire augmente le risque de saignement, Aggrastat est contre-indiqué chez les patients avec une hémorragie interne active ou récente (dans les 30 jours précédant le traitement), cliniquement significative (par exemple saignement digestif), ainsi qu'en cas d'accident cérébral datant de moins de 30 jours ou tout antécédent d'accident vasculaire cérébral hémorragique, en cas de pathologie intracrânienne (p.ex. néoformation intracrânienne, malformation artérioveineuse ou d'anévrisme) dans les antécédents et chez les patients chez lesquels une thrombopénie est déjà apparue après un traitement avec Aggrastat.
De même pour des patients souffrant d' une hypertension artérielle maligne, des patients qui ont subi un traumatisme important ou une intervention chirurgicale majeure dans les six dernières semaine, des patients ayant une thrombopénie (numération plaquettaire <100'000/mm3), des troubles de la fonction plaquettaire ou des troubles de la coagulation (par exemple temps de Quick >1,3 fois la normale ou INR (International Normalized Ratio) >1,5), ainsi chez les patients souffrant d'une insuffisance hépatique sévère.
Mises en garde et précautions
On ne dispose pas d'un recul suffisant concernant l'utilisation d'Aggrastat dans les pathologies et circonstances suivantes, où une majoration du risque de saignement est néanmoins suspectée.
En conséquence, Aggrastat n'est pas recommandé dans les situations suivantes:
·réanimation cardio-respiratoire post-traumatique ou prolongée, biopsie d'organe ou lithotripsie dans les deux dernières semaines,
·traumatisme sévère ou chirurgie majeure datant de plus de 6 semaines mais de moins de 3 mois,
·ulcère gastro-duodénal évolutif dans les 3 derniers mois,
·hypertension sévère non contrôlée (pression artérielle systolique >180 mm Hg et/ou pression artérielle diastolique >110 mm Hg),
·péricardite aiguë,
·vascularite évolutive ou antécédents connus de vascularite,
·anamnèse, symptômes, ou suspicion de dissection aortique,
·rétinopathie hémorragique,
·saignement occulte dans les selles ou hématurie,
·contre-pulsion par ballonnet intra-aortique,
·traitement thrombolytique,
·utilisation concomitante de médicaments majorant de façon substantielle le risque hémorragique (voir «Interactions»)
L'administration d'Aggrastat requiert une prudence particulière dans les cas suivants:
·Apparition d'une hémorragie gastro-intestinale ou uro-génitale d'importance clinique au cours des 12 derniers mois;
·Coagulopathie connue, thrompocytopathie, thrombopénie dans l'anamnèse;
·Numération des plaquettes inférieure à 150'000/mm3;
·Affection cérébrovasculaire au cours de la dernière année;
·Interventions épidurales récentes, p.ex. anesthésie péridurale, ponction spinale;
·Hémodialyse chronique,
·ponction d'un vaisseau ne pouvant pas être comprimé, dans les 24 heures avant l'administration d'Aggrastat
·insuffisance cardiaque aiguë ou chronique sévère,
·choc cardiogénique,
·insuffisance hépatique légère à modérée,
·taux d'hémoglobine inférieur à 11 g/dl ou hématocrite <34%.
·administration concomitante d'inhibiteurs du récepteur P2Y12 non-thiénopyridines, d'adénosine, de dipyridamole, de sulfinpyrazone et de prostacycline.
Mesures de précaution en raison du risque d'hémorragie
Etant donné qu'Aggrastat inhibe l'agrégation plaquettaire, il doit être administré avec prudence lorsque d'autres médicaments (anticoagulants oraux) influençant l'hémostase sont utilisés en même temps. L'innocuité d'Aggrastat lorsqu'il est administré en même temps que des thrombolytiques n'a pas été démontrée.
Pendant le traitement avec Aggrastat, il convient de surveiller l'apparition éventuelle d'hémorragies chez les patients. Lorsqu'un traitement est nécessaire en raison de saignements, l'arrêt d'Aggrastat et une transfusion devraient être envisagés.
Des hémorragies mettant en jeu le pronostic vital ont été rapportées (voir sous «Effets indésirables»).
Contrôle des valeurs de laboratoire: la numération plaquettaire, l'hémoglobine et l'hématocrite devraient être contrôlées avant le début du traitement, au cours des 6 heures après le bolus ou la perfusion de la dose de charge et ensuite au moins une fois par jour pendant le traitement avec Aggrastat (ou plus souvent en cas de d'aggravation). Une surveillance plus précoce du taux de thrombocytes devrait être envisagée chez les patients ayant déjà reçu dans le passé des antagonistes du récepteur GP IIb/IIIa. Si la numération plaquettaire devient inférieure à 90'000/mm3, des contrôles supplémentaires devraient être effectués, afin d'exclure la présence d'une pseudothrombopénie. Lorsqu'une thrombopénie est confirmée, l'administration d'Aggrastat et d'héparine doit être arrêtée, et le patient doit être surveillé et traité en fonction de la situation.
En outre, le temps de céphaline activé (TCA) devrait être déterminé avant le traitement, l'effet anticoagulant de l'héparine devrait être surveillé avec soin au moyen de déterminations répétées du TCA et la dose devrait être adaptée en conséquence. Des hémorragies potentiellement fatales pourraient apparaître en particulier lorsque l'héparine est administrée en même temps que d'autres médicaments comme les antagonistes du récepteur GP IIb/IIIa, qui influencent l'hémostase.
Insuffisance rénale sévère
Au cours d'études cliniques, une diminution de la clearance plasmatique chez les patients atteints d'insuffisance rénale sévère (clearance de la créatinine <30 ml/min) a été constatée. Une réduction de la dose d'Aggrastat est nécessaire pour ces patients (voir «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Population pédiatrique
Il n'existe pas d'expérience avec Aggrastat chez l'enfant. Par conséquent, l'utilisation d'Aggrastat n'est pas recommandée chez ces patients.
Sodium
Ce médicament contient 918 mg de sodium par poche de perfusion de 250 ml, ce qui équivaut à 46% de l'apport alimentaire quotidien maximal recommandé par l OMS de 2 g de sodium par adulte.
Interactions
Aggrastat a été étudié à fond du point de vue de ses interactions avec le traitement antiagrégant plaquettaire oral, dont l'acide acétylsalicylique, et l'héparine.
L'administration d'Aggrastat associé à l'héparine et à l'acide acétylsalicylique a provoqué plus de saignements que l'héparine ou l'acide acétylsalicylique seuls (voir «Effets indésirables»). Lors de l'administration simultanée d'Aggrastat, d'héparine, d'aspirine et de clopidogrel, il y a eu une augmentation de l'incidence des saignements comparable à ce qui est observé avec l'association héparine, aspirine et clopidogrel.
La prudence est de mise lorsqu'Aggrastat est utilisé en même temps que d'autres médicaments influençant la coagulation sanguine (p.ex. la warfarine) (voir «Mises en garde et précautions, Précautions en raison du risque d'hémorragie»).
Au cours d'études cliniques, Aggrastat a été utilisé en même temps que des bêtabloquants, antagonistes du calcium, des anti-inflammatoires non stéroïdiens et des nitrates, sans qu'une interaction significative n'ait été observée.
Dans un sous-groupe de patients (n=762) de l'étude PRISM aucun effet cliniquement significatif sur la clearance du tirofiban n'a pu être mis en évidence avec les substances suivantes: acébutolol, acétaminophène, alprazolam, amlopdipine, des préparations à base d'aspirine, aténolol, bromazépam, captopril, diazépam, digoxine, diltiazem, docusate sodique, énalapril, furosémide, glibenclamide, héparine, insuline, isosorbide, lévothyroxine, lorazépam, lovastatine, métoclopramide, métoprolol, morphine, nifédipine, nitrates, oméprazole, oxazépam, chlorure de potassium, propranolol, ranitidine, simvastatine, sucralfate et témazépam.
Grossesse, Allaitement
Grossesse
Aucune étude contrôlée chez la femme enceinte n'est disponible. Aggrastat ne devrait être administré pendant la grossesse que si nécessité absolue.
Allaitement
On ignore si Aggrastat est sécrété dans le lait maternel. Durant l'utilisation d'Aggrastat, il ne faudrait pas allaiter.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Il n'existe aucun indice suggérant que l'Aggrastat influence l'aptitude à conduire ou l'utilisation de machines.
Effets indésirables
Résumé du profil de sécurité
L'effet indésirable le plus fréquemment rapporté pendant le traitement par Aggrastat, en utilisation concomitante avec l'héparine, l'aspirine et d'autres agents antiplaquettaires oraux, était le saignement, généralement muco-cutané mineur ou un saignement mineur au site de ponction.
Des saignements gastro-intestinaux, rétro-péritonéaux, intracrâniens, hémorroïdaux et post-opératoires, à type d'hématome épidural dans la région rachidienne, d'hémopéricarde et d'hémorragie pulmonaire (alvéolaire) ont également été rapportés. Lors des études pivots d'Aggrastat, les taux de saignements majeurs et intracrâniens selon la classification TIMI étaient respectivement <2,2% et <0,1%. L'effet indésirable le plus grave était l'hémorragie fatale.
Lors des études pivots, l'administration d'Aggrastat a été associée à une thrombocytopénie (numération plaquettaire <90'000/mm3), qui est survenue chez 1,5% des patients traités par Aggrastat et l'héparine. L'incidence des thrombocytopénies sévères (numération plaquettaire <50'000/mm3) était de 0,3%. Les effets indésirables les plus fréquemment observés lors de l'administration simultanée d'Aggrastat et d'aspirine, autres que des saignements, étaient des nausées (1,7%), de la fièvre (1,5%) et des céphalées (1,1%).
Tableau résumant les effets indésirables
Le tableau 2 présente une liste des effets indésirables établie à partir des données observées lors de six essais cliniques contrôlés en double insu (ayant recruté 1953 patients recevant Aggrastat plus de l'héparine), ainsi qu'à partir des données observées postérieurement à la commercialisation.
Les effets indésirables sont présentés dans le tableau ci-dessous en fonction du système d'organe et par fréquence, en utilisant les catégories suivantes: très fréquent (≥1/10), fréquent (≥1/100 et <1/10), peu fréquent (≥1/1'000 et <1/100), rare (≥1/10'000 et <1/1'000), très rare (<1/10'000), fréquence indéterminée (ne peut pas être estimée à partir des données disponibles). En raison du fait que les événements indésirables qui se produisent en post-commercialisation proviennent de déclarations spontanées d'une population de taille incertaine, il n'est pas possible de déterminer leur incidence exacte. Par conséquent, la fréquence de ces réactions indésirables est classée comme non connue.
Tableau 2: effets indésirables observés lors des essais cliniques et depuis la commercialisation
|
Système d'organe |
Très fréquent |
Fréquent |
Peu fréquent |
Fréquence indéterminée |
|
Affections hématologiques et du système lymphatique |
|
|
|
Diminution brutale et/ou sévère du nombre des plaquettes (<20'000/mm3) |
|
Affections du système immunitaire |
|
|
|
Réactions allergiques sévères incluant des réactions anaphylactiques |
|
Affections du système nerveux |
Céphalées |
|
|
Saignements intracrâniens, hématomes intrarachidiens épiduraux |
|
Affections cardiaques |
|
|
|
Hémopéricarde |
|
Affections vasculaires |
Hématomes |
|
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Hémoptysie, épistaxis |
|
Hémorragie pulmonaire (alvéolaire) |
|
Affections gastro-intestinales |
Nausées |
Hémorragie buccale, hémorragie gingivale |
Hémorragie gastrointestinale, hématémèse |
Saignement rétropéritonéal |
|
Affections de la peau et du tissu sous cutané |
Ecchymoses |
|
|
|
|
Affections du rein et des voies urinaires |
|
Hématurie |
|
|
|
Troubles généraux et anomalies au site d'administration |
|
Fièvre |
|
|
|
Lésions, intoxications et complications liées aux procédures |
Hémorragies post opératoires* |
Hémorragie au point de ponction des vaisseaux |
|
|
|
Investigations |
Saignements occultes dans les selles ou les urines |
Diminution de l'hématocrite, de l'hémoglobine, des plaquettes (<90'000/mm3) |
Thrombopénie <50'000/mm3 |
|
* Principalement liées au site de cathétérisation.
Description des effets indésirables sélectionnés
Saignements
Avec une perfusion de 0,4 microgramme/kg/min, et avec le bolus de 25 microgrammes/kg, les taux de complications hémorragiques majeures sont faibles et ne sont pas significativement plus élevés.
Dans l'étude PRISM-PLUS, qui utilisait le schéma de perfusion d'Aggrastat à 0,4 microgramme/kg/min, l'incidence de saignements majeurs selon la classification TIMI a été de 1,4% pour Aggrastat en association avec l'héparine et de 0,8% pour l'héparine seule. L'incidence de saignements mineurs selon la classification TIMI a été de 10,5% pour Aggrastat en association avec l'héparine et de 8,0% pour l'héparine seule. Le pourcentage de patients ayant reçu une transfusion a été de 4,0% pour Aggrastat en association avec l'héparine et de 2,8% pour l'héparine seule.
Avec le bolus d'Aggrastat de 25 microgrammes/kg, les données de l'étude ADVANCE montrent que le nombre de saignements est faible et ne semble pas augmenter significativement comparé au placebo. Dans les deux groupes, aucun saignement majeur selon la classification TIMI n'a été constaté et aucune transfusion n'a eu lieu. Les saignements mineurs selon la classification TIMI avec le bolus d'Aggrastat de 25 microgrammes/kg ont été de 4% comparé à 1% dans le groupe placebo, (p=0,19).
Dans l'étude ON-TIME 2, il n'y avait pas de différence significative de saignement majeur selon la classification TIMI (3,4% vs. 2,9%; p=0,58) ni de saignement mineur selon la classification TIMI (5,9% vs. 4,4%; p=0,206) entre le bolus de 25 microgrammes/kg d'Aggrastat et le groupe contrôle.
Les taux de saignements majeurs (2,4% vs. 1.6%, p=0,44) ou mineurs (4,8% contre 6,2%, p=0,4) selon la classification TIMI n'étaient pas significativement différents entre la dose de 25 microgrammes/kg d'Aggrastat et la dose standard d'abciximab, qui étaient comparées dans l'étude MULTISTRATEGY.
En se basant sur une évaluation des complications hémorragiques rapportées dans une méta-analyse (n=4076 patients SCA), le bolus de 25 microgrammes/kg d'Aggrastat n'augmente pas significativement le nombre de saignements majeurs ou de thrombocytopénies, quand il est comparé au placebo. Les résultats des études individuelles comparant le bolus de 25 microgrammes/kg d'Aggrastat à l'abciximab, ne montrent pas de différence significative des saignements majeurs entre les deux traitements.
Thrombocytopénie
Une chute brutale de la numération plaquettaire ou une thrombopénie est apparue plus fréquemment au cours du traitement par Aggrastat que dans le groupe placebo. Ces diminutions ont été réversibles après l'arrêt d'Aggrastat. Des diminutions aiguës et sévères des plaquettes (numération plaquettaire <20'000/mm3) ont été observées chez des patients sans antécédent de thrombopénie lors de ré-administration des antagonistes des récepteurs GP IIb/IIIa, et pouvaient être associées à des frissons, une légère fièvre ou des complications hémorragiques.
L'analyse des études comparant le bolus de 25 microgrammes/kg par rapport à l'abciximab a montré une réduction significative du nombre de thrombocytopénies avec l'Aggrastat (0,45% vs. 1,7%; OR=0,31; p=0,004).
Réactions allergiques
Des réactions allergiques sévères (par exemple bronchospasme, urticaire) y compris des réactions anaphylactiques sont survenues lors du traitement initial (également le premier jour) et lors de la ré-administration d'Aggrastat. Certains cas ont été associés à une thrombopénie sévère (numération plaquettaire <10'000/mm3).
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch. »
Surdosage
Au cours des études cliniques, des surdosages accidentels du tirofiban ont eu lieu, à savoir jusqu'à cinq fois la dose recommandée pour le bolus initial, ou jusqu'au double de la dose recommandée pour la perfusion de la dose de charge. Des surdosages accidentels ont eu lieu avec des doses 9,8 fois plus élevées que la dose recommandée pour la perfusion d'entretien de 0,15 microgramme/kg/min.
Le symptôme de surdosage le plus fréquemment noté était le saignement; il s'agissait en premier lieu de légers saignements cutanéomuqueux ou au site d'entrée du cathéter cardiaque (voir «Mises en garde et précautions, Précautions en raison du risque d'hémorragie»).
Un surdosage de tirofiban devrait être traité selon l'état clinique du patient par l'arrêt ou une adaptation de la posologie de la perfusion de tirofiban.
Aggrastat peut être extrait de l'organisme par hémodialyse.
Propriétés/Effets
Code ATC
B01AC17
Mécanisme d’action
L'activation, l'adhésion et l'agrégation des plaquettes sont des étapes initiales décisives lors de la formation d'un thrombus artériel recouvrant la plaque athéromateuse lésée. La formation du thrombus est un processus clé de la physiopathologie des syndromes ischémiques coronariens aigus en cas d'angor instable et d'infarctus du myocarde ainsi que lors de complications ischémiques cardiaques après une angioplastie coronarienne.
Tirofiban est un antagoniste non peptidique du récepteur GP IIb/IIIa, le récepteur de surface des plaquettes le plus important pour l'agrégation plaquettaire. Tirofiban empêche la liaison du fibrinogène sur le récepteur GP IIb/IIIa et bloque ainsi l'adhésion et l'agrégation plaquettaire.
Pharmacodynamique
L'administration simultanée d'une perfusion d'Aggrastat (0,15 microgramme/kg/min en 4 heures) et d'acide acétylsalicylique entraîne une inhibition de l'agrégation des plaquettes quasi maximale et en outre un léger allongement du temps de saignement.
Chez les patients souffrant d'angor instable, la perfusion intraveineuse d'Aggrastat (perfusion d'une dose de charge de 0,4 microgramme/kg/min en 30 minutes suivie de 0,1 microgramme/kg/min en 48 heures au maximum avec administration simultanée d'héparine et d'acide acétylsalicylique) provoque une inhibition de près de 90% (médiane) de l'agrégation plaquettaire et multiplie par 2,9 le temps de saignement pendant la perfusion. L'inhibition se manifeste rapidement au cours de la perfusion en 30 minutes de la dose de charge et se maintient durant toute la perfusion. Après arrêt de la perfusion d'Aggrastat, la fonction plaquettaire revient rapidement à sa valeur initiale.
Le tirofiban administré en bolus de 25 microgrammes/kg (suivi par une perfusion d'entretien de 0,15 microgramme/kg/min), en association avec de l'héparine et un traitement antiplaquettaire par voie orale, a entraîné une inhibition moyenne de 92% à 95% de l'agrégation plaquettaire maximale induite par l'ADP, 15 à 60 minutes après le début du traitement et mesurée par agrégométrie par transmittance de la lumière.
Efficacité clinique
Etude PRISM PLUS
L'utilisation d'Aggrastat associé à l'héparine a été comparée à l'utilisation d'héparine seule au cours de l'étude PRISM PLUS (n=1'570) portant sur des patients souffrant d'angor instable/infarctus du myocarde sans onde Q. Tous les patients ont reçu de l'acide acétylsalicylique en même temps, sauf contre-indication. Le traitement avec Aggrastat a été instauré dans les 12 heures après le dernier épisode de douleurs thoraciques. Puis, les patients ont été traités pendant 48 heures, une angiographie et une angioplastie/athérectomie pouvaient ensuite être effectuées (si indiqué), au cours desquelles le traitement avec Aggrastat a été poursuivi. Après une angioplastie/ athérectomie, le traitement avec Aggrastat a été poursuivi pendant 12-24 heures. Au total la perfusion d'Aggrastat dans cette étude a duré 48-108 heures (71,3 heures en moyenne).
Si une angiographie, angioplastie ou athérectomie étaient nécessaires, l'administration d'Aggrastat peut donc être continuée pendant la durée de ces interventions.
L'objectif primaire de l'étude englobait l'ischémie réfractaire, une récidive de l'infarctus du myocarde et le décès 7 jours après le début de l'administration d'Aggrastat. Le risque global était réduit de 32%, le risque d'un infarctus du myocarde de 47% et le risque d'infarctus du myocarde et de décès de 43%. Dans cette étude, le bénéfice d'Aggrastat a pu être démontré de manière équivalente pour les patients des deux sexes et de tout âge. En général le bénéfice clinique précoce persistait encore après 30 jours et 6 mois.
Une sous-étude a montré une diminution significative dans l'étendue du thrombus pouvant être mis en évidence par angiographie chez les patients ayant reçu Aggrastat associé à l'héparine par rapport à ceux ayant reçu l'héparine uniquement. En outre, le flux dans les artères coronaires concernées s'était amélioré de façon significative.
Etude ADVANCE
L'étude ADVANCE a déterminé la sécurité et l'efficacité du bolus d'Aggrastat de 25 microgrammes/kg comparé au placebo chez les patients bénéficiant d'une intervention coronaire percutanée programmée ou urgente, et présentant un risque élevé incluant: présence d'au moins une sténose coronaire ≥70% et d'un diabète, nécessité d'intervention sur plusieurs vaisseaux ou un SCA NST. Tous les patients ont reçu de l'héparine non fractionnée, de l'aspirine et une dose de charge de thiénopyridine suivie par un traitement d'entretien. Un total de 202 patients a été randomisé pour recevoir Aggrastat (bolus de 25 microgrammes/kg par perfusion pendant 3 minutes suivi d'une perfusion IV continue de 0,15 microgramme/kg/minute pendant 24 à 48 heures) ou un placebo administré immédiatement avant l'intervention coronaire percutanée.
Le critère primaire d'efficacité était un critère composite: décès, IDM non fatal, revascularisation urgente du vaisseau cible (uTVR) ou traitement de sauvetage d'une occlusion/menace d'occlusion aiguë per ou post angioplastie (bail-out) par un antagoniste du récepteur GP IIb/IIIa pendant un suivi médian de 180 jours après la procédure. Les critères d'évaluation de la sécurité pour les saignements majeurs et mineurs ont été définis conformément à la classification TIMI.
En intention de traiter, l'incidence cumulative du critère primaire a été de 35% et 20% dans les groupes placebo et Aggrastat, respectivement (rapport des risques [HR] 0,51 [intervalle de confiance (IC) 95%, 0,29 à 0,88]; p=0,01). Comparé au groupe placebo, il y a eu une réduction significative du critère composite: décès, IDM, uTVR dans le groupe Aggrastat (31% vs 20%, HR, 0,57 95% IC, [0,99-0,33]; p=0,048).
Etude EVEREST
L'étude EVEREST randomisée, en ouvert, a comparé chez des patients se présentant avec un SCA NST, la dose de charge de 0,4 microgramme/kg/min administrée de façon précoce en unité de soins intensifs cardiologiques, avec un bolus d'Aggrastat de 25 microgrammes/kg ou une dose d'abciximab de 0,25 milligramme/kg débutée 10 minutes avant l'intervention coronaire percutanée. Tous les patients ont reçu en plus, de l'aspirine et une thiénopyridine. Les 93 patients SCA NST participant ont bénéficié d'une coronarographie et d'une intervention coronaire percutanée dans les 24 à 48 heures suivant leur admission.
Concernant les critères primaires de perfusion tissulaire et de libération de troponine I, les résultats de l'étude EVEREST ont montré des taux significativement plus bas de TMPG (TIMI Myocardial Perfusion Grade) 0/1 après intervention coronaire percutanée (6,2% vs 20% vs 35,5% respectivement; p=0,015) et une amélioration du score de perfusion post-intervention coronaire percutanée mesuré par échographie de contraste myocardique (ECM) (0,88 ± 0,18 vs 0,77 ± 0,32 vs 0,71 ± 0,30 respectivement; p<0,05).
L'incidence de l'élévation de troponine I cardiaque (TnIc) post-procédure a été significativement diminuée chez les patients traités par Aggrastat en amont comparée à ceux ayant reçu un bolus de 25 microgrammes/kg d'Aggrastat ou d'abciximab au moment de l'intervention coronaire percutanée (9,4% vs 30% vs 38,7%, respectivement; p=0,018). Les niveaux de TnIc post-intervention coronaire percutanée ont été également significativement diminués avec la dose d'Aggrastat administré en amont comparé à l'administration d'Aggrastat per intervention coronaire percutanée (3,8 ± 4,1 vs 7,2 ± 12; p=0,015) et d'abciximab per intervention coronaire percutanée (3,8 ± 4,1 vs 9 ± 13,8; p=0.0002).
La comparaison entre les schémas posologiques de 25 microgrammes/kg d'Aggrastat en bolus et d'abciximab dans le cadre de l'intervention coronaire percutanée n'ont pas montré de différences significatives du taux de TMPG 0/1 post-intervention coronaire percutanée (20% vs 35%; p=NS).
Etude ON-TIME 2
L'étude ON-TIME 2 est une étude clinique multi-centrique, prospective, randomisée, contrôlée, évaluant l'effet de l'administration précoce d'un bolus de 25 microgrammes/kg d'Aggrastat chez des patients en phase aiguë d'infarctus du myocarde (IDM ST+) devant bénéficier d'une intervention coronaire percutanée primaire. Tous les patients ont reçu de l'aspirine, une dose de charge de 600 mg de clopidogrel et de l'héparine non fractionnée. L'utilisation d'Aggrastat en traitement de sauvetage d'une occlusion/menace d'occlusion aiguë per ou post angioplastie (bail-out) a été autorisée selon des critères pré-définis. L'étude a été réalisée en deux phases: une phase pilote, en ouvert (n=414) suivie par une phase plus large en double insu (n=984). Une analyse combinée des données des deux phases a été pré-spécifiée pour comparer l'effet d'un bolus de 25 microgrammes/kg à un groupe contrôle, avec comme critère primaire le taux d'événements indésirables cardiaques majeurs (MACE) à 30 jours (décès, infarctus du myocarde récurrent et revascularisation urgente du vaisseau cible).
Dans cette analyse combinée, le taux de MACE à 30 jours a été significativement réduit par l'administration précoce d'Aggrastat comparé au groupe contrôle (5,8% vs. 8,6%; p=0,043). De plus, il y avait une tendance forte vers une diminution significative de la mortalité avec Aggrastat en ce qui concerne la mortalité globale (2,2% dans le bras Aggrastat vs 4,1% dans le groupe contrôle, p=0,051).
Cette réduction de mortalité était principalement due à une réduction de la mortalité cardiaque (2,1% vs 3,6%, p=0,086). Après un an de suivi, la différence de mortalité (critère secondaire) a été maintenue (3,7% vs 5,8%; p=0,078 pour la mortalité globale et 2.5% vs. 4.4% pour la mortalité cardiaque, p=0.061).
Chez les patients qui ont bénéficié d'une intervention coronaire percutanée primaire (86% de la population de l'étude combinée), une réduction significative de la mortalité à la fois à 30 jours (1,0% dans le groupe Aggrastat vs. 3.9% dans le groupe contrôle, p=0,001) et à un an (2,4% pour Aggrastat vs. 5,5% pour le contrôle, p=0,007) a été démontrée.
Etude MULTISTRATEGY
L'étude MULTISTRATEGY est une étude multinationale réalisée en ouvert, utilisant un plan factoriel 2×2, comparant Aggrastat (n=372) à l'abciximab (n=372), administré avec un stent à élution de Sirolimus (SES) ou avec un stent métallique (BMS) chez des patients en phase aiguë d'infarctus du myocarde (IDM ST+). Aggrastat (bolus de 25 microgrammes/kg, suivi par une perfusion à 0,15 microgramme/kg/minute en continu pendant 18 à 24 heures) ou l'abciximab (bolus de 0,25 mg/kg, suivi par une perfusion de 12 heures à 0,125 microgramme/kg/minute) ont été initiés avant l'insertion du désilet en vue de la coronarographie. Tous les patients ont reçu de l'héparine non fractionnée, de l'aspirine et du clopidogrel.
La non infériorité d'Aggrastat par rapport à l'abciximab était testée par le moyen du critère primaire de résolution cumulative du segment ST évalué par la proportion de patients chez lesquels on observait une diminution de plus de 50% de l'élévation du segment ST mesuré dans les 90 minutes après la dernière inflation de ballonnet. En intention de traiter, le pourcentage de patients présentant une diminution d'au moins 50% de l'élévation du segment ST n'était pas significativement différent entre Aggrastat (85,3%) et l'abciximab (83,6%), démontrant la non-infériorité d'Aggrastat par rapport à l'abciximab (RR pour Aggrastat vs abciximab, 1,020; 97,5% CI, 0,958-1,086; p<0,001 pour la non-infériorité).
À 30 jours, le taux d'événements indésirables cardiaques majeurs (MACE) était semblable pour abciximab et Aggrastat (4,3% vs 4,0%, respectivement; p=0,85) et ces résultats se maintenaient à 8 mois (12,4% vs 9,9%, respectivement; p=0,30).
Méta-analyse d'études randomisées utilisant un bolus d'Aggrastat de 25 microgrammes/kg
Les résultats d'une méta-analyse évaluant l'efficacité du bolus de 25 microgrammes/kg d'Aggrastat vs. abciximab (2213 patients avec un SCA, incluant à la fois des patients SCA NST et IDM ST+) n'ont pas retrouvé de différence significative dans le taux de décès ou d'infarctus du myocarde à 30 jours entre les deux produits (OR 0,87 [0,56-1,35], p=0,54). De même, il n'y avait aucune différence significative sur la mortalité à 30 jours entre Aggrastat et abciximab (OR 0,73 [0,36-1,47], p=0,38). De plus, à la fin du suivi, le taux de décès ou d'infarctus du myocarde n'était pas significativement différent entre Aggrastat et abciximab (OR, 0,84 [0,59-1,21] p=0,35).
Etude TARGET
Lors d'une étude utilisant un bolus de 10 microgrammes/kg suivi d'une perfusion d'Aggrastat de 0,15 microgramme/kg/min, Aggrastat n'a pas montré de non-infériorité par rapport à l'abciximab. L'incidence du critère primaire composite (décès, IDM ou uTVR à 30 jours) était significativement plus élevée dans le groupe Aggrastat que dans le groupe abciximab sur les critères cliniques, avec 7,6% vs. 6,0% respectivement (p=0,038), principalement dû à une augmentation significative du nombre d'infarctus du myocarde à 30 jours (respectivement 6,9% vs 5,4%; p= 0,04).
Pharmacocinétique
Absorption
Non pertinent
Distribution
Le tirofiban se lie à 65% aux protéines plasmatiques et la liaison aux protéines est indépendante de la concentration dans une fourchette de 0,01 à 25 microgrammes/ml. La fraction libre du tirofiban dans le plasma humain est de 35%. Le volume de distribution du tirofiban à l'état stationnaire est de 22 litres à 42 litres. Chez les rats et les lapins, le tirofiban traverse la barrière placentaire.
Métabolisme
Le profil du tirofiban marqué au C14 dans l'urine et les fèces laisse supposer que la radioactivité provient avant tout du tirofiban sous forme inchangée. La radioactivité dans le plasma circulant est due surtout au tirofiban sous forme inchangée (jusqu'à 10 heures après l'administration). Ces résultats suggèrent que la métabolisation du tirofiban est limitée.
Elimination
Après administration intraveineuse de tirofiban marqué au C14 à des volontaires sains, 66% de la radioactivité est retrouvée dans l'urine et 23% dans les fèces. La radioactivité totale mesurée est de 91% environ. Aussi bien l'élimination rénale que biliaire contribuent à l'essentiel de l'élimination du tirofiban.
Chez des volontaires sains, la clearance plasmatique se situe entre 213 et 314 ml/min. La clearance rénale représente 39% à 69% de la clearance plasmatique. La demi-vie est de 1,4 à 1,8 heures.
Chez les patients atteints de maladie coronarienne, la clearance plasmatique du tirofiban est de 152 à 267 ml/min. La clearance rénale représente 39% de la clearance plasmatique. La demi-vie se situe entre 1,9 à 2,2 heures.
Chez la rate, le tirofiban passe dans le lait maternel.
Cinétique pour certains groupes de patients
Sexe
Chez les patients atteints de maladie coronarienne, la clearance plasmatique du tirofiban est équivalente pour les hommes et les femmes.
Age
Chez les patients âgés (>65 ans) atteints de maladie coronarienne, la clearance plasmatique du tirofiban est inférieure de 19% à 26% à celle de patients plus jeunes (<65 ans).
Insuffisance hépatique
Chez les patients atteints d'une insuffisance hépatique faible à moyenne, la clearance plasmatique ne diffère pas de manière significative de celle de personnes saines.
Insuffisance rénale
La clearance plasmatique du tirofiban diminue dans une proportion significative (>50%) chez les patients présentant une clearance de la créatinine <30 ml/min, y compris chez les patients nécessitant une hémodialyse (voir «Posologie/Mode d'emploi, Patients avec insuffisance rénale sévère»). Le tirofiban est hémodialysable.
Données précliniques
La LD50 approximative de l'Aggrastat administré sous forme de dose unique intraveineuse à des souris et des rats était supérieure à 5 mg/kg. La dose maximale de 5 mg/kg (22 fois la dose maximale recommandée chez l'homme) était limitée par la solubilité du principe actif et le volume maximal pouvant être administré. Dans le cadre d'études avec une administration intraveineuse ou orale, aucun décès, signe physique ou effet médicamenteux sur le poids corporel n'ont été observés.
Le potentiel toxique du chlorhydrate de tirofiban a été examiné dans le cadre d'une série d'études sur la toxicité chez des rats et des chiens sous perfusion intraveineuse continue durant 5 semaines au maximum. Aucun résultat excluant une administration à des doses thérapeutiques dans un délai pouvant aller jusqu'à 108 heures n'a été trouvé.
Le chlorhydrate de tirofiban a démontré des résultats négatifs lors du test de mutagenèse sur des microbes et lors du test de mutagenèse sur des cellules de mammifères V-79. En outre, aucun signe d'une génotoxicité directe lors du test d'élution alcalin et du test d'aberration chromosomique in vitro n'a été trouvé. Dans le cadre des essais in vitro, le tirofiban a été testé à des concentrations pouvant aller jusqu'à 3 mM (près de 20'000 supérieures à la valeur plasmatique moyenne obtenue chez l'homme aux doses thérapeutiques recommandées). Après l'administration de doses intraveineuses pouvant aller jusqu'à 5 mg/kg (22 fois la dose journalière maximale recommandée chez l'homme), aucune aberration chromosomique n'a été déclenchée dans les cellules de la moelle osseuse de souris du sexe masculin.
Dans le cadre des études avec des rats du sexe masculin et féminin, lors desquelles des doses intraveineuses de chlorhydrate de tirofiban pouvant aller jusqu'à 5 mg/kg/jour ont été administrées, la fertilité et la capacité de reproduction n'ont pas été influencées. Ces doses sont près de 22 fois supérieures aux doses journalières maximales recommandées chez l'homme.
Les études de toxicité chez des rats et des lapins en phase de croissance n'ont montré aucun signe de toxicité chez la mère ou le fœtus. En outre, une étude portant sur la toxicité potentielle lors de la croissance en période de maturation sexuelle de rats dans l'utérus et en période d'allaitement n'a démontré aucun effet médicamenteux sur la mortalité, la croissance, le développement et la maturation sexuelle de la génération F1. Dans le cadre d'études sur la toxicité en période de croissance, les mères ont reçu par voie intraveineuse du chlorhydrate de tirofiban à des doses pouvant aller jusqu'à 5 mg/kg/jour (22 fois la dose maximale journalière recommandée chez l'homme).
Remarques particulières
Incompatibilités
Aggrastat ne doit pas être administré en même temps que le diazépam par le même cathéter intraveineux, car la formation d'un précipité a été observée lors d'expériences de mélanges.
Stabilité
Ce médicament ne doit pas être utilisé au-delà de la date figurant après la mention « EXP » sur l’emballage.
Remarques particulières concernant le stockage
Conserver à température ambiante de 15 à 25 °C et à l'abri de la lumière. Ne pas congeler.
Tenir hors de portée des enfants.
Chaque présentation contient une poche incolore Freeflex® de 250 ml. Cette poche est constituée d’un film plastique de polyoléfine multicouches, non-PVC et sans Latex. La poche est enveloppée dans un suremballage d’alluminium laminé pré-imprimé et est - pour autant que ce suremballage soit intact - stérile en surface et protégée de la lumière.
Remarques concernant la manipulation
L'absence de particules visibles et de colorations dans les médicaments destinés à l'administration intraveineuse devrait toujours être contrôlée, pour autant que la solution et l'emballage le permettent.
Aggrastat est destiné uniquement à l'administration intraveineuse dans des conditions stériles. Aggrastat peut être administré simultanément avec l'héparine par la même voie d'abord.
L'Aggrastat peut être administré avec le sulfate d'atropine, la dobutamine, la dopamine, l'adrénaline, le furosémide, la lidocaïne, le midazolam-HCl, le sulfate de morphine, la nitroglycérine, le chlorure de potassium, le propranolol-HCl et la famotidine par la même voie intraveineuse.
Il est recommandé d'administrer Aggrastat au moyen d'un système de perfusion calibré. La dose de charge devrait appliquée pendant la durée indiquée (30 min pour la perfusion de charge 0,4 microgramme/kg/min et 3 min pour le bolus à 25 microgrammes/kg). Il est aussi essentiel de veiller que les doses et les vitesses de perfusion soient calculées en fonction du poids corporel du patient.
Instructions pour l'emploi de la solution pour perfusion d'Aggrastat
La solution ne doit pas être prélevée directement du récipient à l'aide d'une seringue.
Pour ouvrir: déchirer au niveau de l’encoche le suremballage (contenant la poche de 250 ml de solution pour perfusion), et retirer la poche. Pour rechercher de petites fuites, presser fortement sur la poche intérieure. En présence de fuites, la solution doit être jetée, car la stérilité n'est alors plus garantie. Utiliser la solution uniquement si elle est limpide et si la fermeture est intacte. Aucun médicament supplémentaire ne doit être ajouté avec une seringue et aucun liquide ne doit être prélevé de la poche.
ATTENTION: Il ne faut pas raccorder plusieurs récipients en série, car cela pourrait provoquer des embolies gazeuses en raison de restes d'air qui pourraient passer du premier récipient dans le tuyau avant que la totalité du liquide du prochain récipient ait été perfusée.
Préparation pour l'administration:
|
|
|
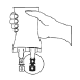
1.Repérez l’orifice de perfusion bleu. |
|
|
|
2.Cassez le bouchon d’inviolabilité bleu sur l’orifice de perfusion Freeflex®. La membrane sous le bouchon est stérile – il n’est pas nécessaire de la désinfecter! |
|
|
|
3.Utilisez un set de perfusion sans prise d’air ou fermez la prise d’air. Fermez la pince à roulette. Engagez le perforateur jusqu’à ce que la collerette en plastique bleue de l’orifice de perfusion soit en contact avec la butée du perforateur. |
|
|
4.Accrochez la poche à la potence à perfusion. Remplissez la chambre de goutte-àgouttes jusqu’au repère, puis le set de perfusion. Raccordez le set de perfusion au dispositif d’accès au patient et réglez le débit. |
Pour l’administration, suivre le tableau d’adaptation posologique (voir “Posologie/Mode d’emploi”).
Numéro d’autorisation
55738 (Swissmedic)
Présentation
Solution pour perfusion dans une poche Freeflex® à 250 ml (A)
Titulaire de l’autorisation
Curatis AG, 4410 Liestal
Mise à jour de l’information
Octobre 2024