Composition
Principes actifs
Complexus toxini botulinici A et haemagglutinini.
Excipients
Albuminum humanum, Lactosum monohydricum.
Indications/Possibilités d’emploi
Traitement symptomatique
·du blépharospasme, du spasme hémifacial et des dystonies focales associées,
·du torticolis spasmodique,
·de la spasticité focale des membres supérieurs chez les adultes,
·de la spasticité focale des membres inférieurs chez les adultes,
·de la spasticité focale des membres supérieurs chez les patients âgés de 2 ans et plus,
·de la spasticité focale des membres inférieurs (voir rubriques «Posologie/Mode d'emploi» et «Efficacité clinique») chez les patients âgés de 2 ans et plus,
·de l'hyperhidrose axillaire.
Dysport est indiqué pour le traitement de l'incontinence urinaire chez les adultes présentant une hyperactivité du détrusor liée à une affection neurologique, due par exemple à une lésion médullaire (traumatique ou non traumatique) ou à une sclérose en plaques, qui effectuent régulièrement un sondage intermittent propre.
Posologie/Mode d’emploi
Dysport ne doit être utilisé que par des médecins ayant l'expérience requise en matière d'indications, de technique d'injection et d'effets indésirables de la toxine botulique.
Les unités de Dysport sont spécifiques au produit en utilisation clinique, elles ne sont pas équivalentes et pas interchangeables avec les unités d'autres préparations à base de toxine botulique.
Afin d'assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
a) Blépharospasme, spasme hémifacial et dystonies focales associées
Posologie
Les doses recommandées s'appliquent aux adultes de tous les groupes d'âge, y compris les patients âgés.
Blépharospasme bilatéral
Lors d'une étude de titration du dosage concernant l'utilisation de Dysport pour traiter le blépharospasme bénin essentiel, une dose de 40 U de Dysport par œil a permis d'obtenir un effet significatif. L'effet se prolongeait davantage avec une dose de 80 U de Dysport par œil.
Après une dose initiale de 40 U de Dysport par œil, il peut être souhaitable, lors de traitements ultérieurs, que le patient reçoive une dose de 60 ou 80 U de Dysport, dans la mesure où un effet prolongé est nécessaire. Une augmentation de la dose peut toutefois augmenter le risque d'effets secondaires locaux, en particulier de ptosis.
La dose maximale de 120 U de Dysport par œil ne doit pas être dépassée.
Blépharospasme unilatéral et/ou spasme hémifacial et dystonies focales associées
Comme pour le blépharospasme bilatéral, l'injection se limitant toutefois à l'œil atteint.
Exécution de l'injection
Administration initiale:
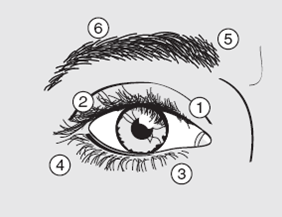
Injecter par voie sous-cutanée 10 U de Dysport dans la partie médiale et 10 U de Dysport dans la partie latérale de la jonction entre les zones préseptales et orbitales du muscle orbiculaire de l'œil supérieur (voir illustration ci-dessous, numéros 1 et 2) ainsi qu'inférieur (numéros 3 et 4).
Afin de réduire le risque de ptose, les injections à proximité du muscle élévateur de la paupière supérieure doivent être évitées. Il faut pour cette raison, en cas d'injection dans la paupière supérieure, détourner l'aiguille du centre.
Administration ultérieure:
Si la dose initiale n'est pas jugée suffisante, il peut être nécessaire d'augmenter la dose par œil lors d'injections ultérieures:
·60 U de Dysport: respectivement 10 U de Dysport médial et 20 U de Dysport latéral
·80 U de Dysport: respectivement 20 U de Dysport médial et 20 U de Dysport latéral
·Au maximum 120 U de Dysport: respectivement 20 U de Dysport médial et 40 U de Dysport latéral
Des injections supplémentaires peuvent être effectuées dans le muscle occipito-frontal au-dessus du sourcil (voir illustration, numéros 5 et 6) si des spasmes gênent la vision.
En cas de spasme hémifacial, un contrôle EMG peut être nécessaire pour identifier les petits groupes musculaires atteints dans la partie inférieure du visage.
Durée du traitement
Une amélioration des symptômes peut être attendue après 2 à 4 jours et l'effet thérapeutique maximal au cours des 2 semaines après l'injection.
Les injections doivent être répétées environ toutes les 12 semaines ou lorsque cela est nécessaire, afin de prévenir une réapparition des symptômes, mais pas plus fréquemment que toutes les 12 semaines.
Si aucun effet thérapeutique n'est constaté après l'administration de la dose maximale, le patient sera considéré en échec thérapeutique et le traitement arrêté.
b) Torticolis spasmodique
Posologie chez l'adulte
Administration initiale:
Au total 500 U de Dysport strictement par voie intramusculaire dans la musculature de la nuque.
Administration ultérieure:
250 à 500 U de Dysport en fonction de la réponse au traitement initial. En cas d'administration réitérée, réduire ou augmenter graduellement, selon l'état clinique, de 100 à 250 U de Dysport par séance, sans toutefois dépasser une dose totale de 500 U de Dysport.
Injecter au maximum 300 U de Dysport dans le muscle sterno-cléido-mastoïdien.
Une augmentation de la dose peut augmenter le risque d'effets indésirables, en particulier des troubles de la déglutition (dysphagie).
Les doses recommandées s'appliquent aux adultes ayant un poids normal, en l'absence de signes d'hypotrophie de la musculature de la nuque. La dose doit être diminuée chez les patients amaigris et chez les patients âgés dont la musculature de la nuque est éventuellement hypotrophiée.
Exécution de l'injection
Les injections strictement intramusculaires sont généralement administrées au niveau des muscles sterno-cléido-mastoïdien, élévateur de la scapula, scalène, splénius de la tête et trapèze.
L'identification des muscles dans lesquels Dysport doit être injecté a lieu sur la base des caractéristiques cliniques (activité musculaire visiblement anormale, indurations palpables, localisation des douleurs musculaires) et conformément au résultat EMG.
Durée du traitement
Une amélioration des symptômes peut être attendue au cours de la première semaine après injection.
Les injections doivent être répétées environ toutes les 16 semaines ou lorsque cela est nécessaire, lors de la réapparition des symptômes, mais pas plus fréquemment que toutes les 12 semaines.
Si aucun effet thérapeutique n'est constaté après l'administration de la dose maximale, le patient sera considéré en échec thérapeutique et le traitement sera arrêté.
c) Spasticité chez l'adulte
Spasticité focale des membres supérieurs
Posologie
La posologie lors du traitement initial et des traitements ultérieurs doit être adaptée individuellement en fonction de la taille, du nombre et de la position des muscles impliqués, de la sévérité de la spasticité, de la présence d'une faiblesse musculaire locale, de la réponse du patient aux traitements antérieurs et/ou des antécédents d'effets indésirables liés à Dysport. Dans le cadre d'études cliniques, les dosages de 500 U, 1000 U et 1500 U ont été répartis entre des muscles sélectionnés lors de certaines séances de traitement. Des doses supérieures à 1000 U voire jusqu'à 1500 U peuvent être administrées si l'on injecte aussi dans la musculature de l'épaule.
Il ne faut habituellement pas administrer plus de 1 ml au même site d'injection.
Au total 1500 U de Dysport par injection intramusculaire dans la musculature du bras. La dose maximale de 1500 U de Dysport ne doit pas être dépassée. On ne dispose que d'expériences limitées dans le cadre des essais cliniques avec la dose maximale de 1500 U. On ne peut par conséquent pas exclure une augmentation de la fréquence des effets indésirables lorsque des patients sont traités par la dose supérieure de 1500 U.
Patients âgés (≥65 ans)
Bien que le nombre de sujets âgés de plus de 65 ans soit faible dans l'étude pivot (N = 49), l'expérience clinique n'a pas montré de lien entre l'efficacité et l'âge. D'une manière générale, les patients âgés doivent faire l'objet d'une surveillance afin d'évaluer la tolérance de Dysport, en raison de la fréquence plus élevée de maladies associées ainsi que d'autres traitements médicamenteux.
Exécution de l'injection
L'injection intramusculaire est recommandée aux dosages et sites d'injection suivants:
|
Muscles dans lesquels l'injection est réalisée |
Dose recommandée de Dysport (U) |
|
Flexor carpi radialis (FCR) |
100-200 |
|
Flexor carpi ulnaris (FCU) |
100-200 |
|
Flexor digitorum profundus (FDP) |
100-200 |
|
Flexor digitorum superficialis (FDS) |
100-200 |
|
Flexor pollicis longus |
100-200 |
|
Adductor pollicis |
25-50 |
|
Brachialis |
200-400 |
|
Brachioradialis |
100-200 |
|
Biceps brachii (BB) |
200-400 |
|
Pronator teres |
100-200 |
|
Triceps brachii (long chef) |
150-300 |
|
Pectoralis major |
150-300 |
|
Subscapularis |
150-300 |
|
Latissimus dorsi |
150-300 |
Lors du traitement de la spasticité focale des membres supérieurs, Dysport est reconstitué dans une solution de chlorure de sodium à 0,9 % afin d'obtenir une solution injectable de 100 U par ml, de 200 U par ml ou de 500 U par ml. Dysport est administré en injection intramusculaire dans les muscles décrits ci-dessus à titre d'exemple.
L'injection dans le muscle biceps brachial doit avoir lieu à deux endroits, à un seul endroit pour tous les autres muscles.
Bien que les sites d'injection proprement dits puissent être repérés par la palpation, le recours à une technique complémentaire d'aide à l'injection, p.ex. l'électromyographie, la stimulation électrique ou l'échographie, est recommandé afin de déterminer les sites d'injection.
Durée du traitement
Le traitement par Dysport doit être répété lorsque l'effet de l'injection précédente s'est atténué, mais en respectant un intervalle minimal de 12 semaines après l'injection précédente. La majorité des patients inclus dans les études cliniques ont de nouveau reçu un traitement après environ 12 à 16 semaines; chez certains patients, l'effet a toutefois été plus prolongé jusqu'à 20 semaines. En fonction du degré et du type de spasticité musculaire observés au moment de la nouvelle injection, il peut s'avérer nécessaire de procéder à un ajustement de la dose de Dysport et de choisir un autre muscle dans lequel réaliser l'injection. Une amélioration clinique de la spasticité peut être attendue une semaine environ après le traitement par Dysport.
Spasticité focale des membres inférieurs
Posologie
Des doses allant jusqu'à 1500 U peuvent être administrées par voie intramusculaire au cours d'une seule séance de traitement. La posologie exacte lors du premier traitement ainsi que des traitements ultérieurs doit être adaptée à chaque patient, en fonction de la taille et du nombre de muscles concernés, de la sévérité de la spasticité, de la présence d'une faiblesse musculaire locale et de la réponse du patient aux traitements antérieurs. Cependant, il ne faut pas dépasser une dose totale de 1500 U.
Il ne faut habituellement pas administrer plus de 1 ml au même site d'injection.
Patients âgés (≥65 ans)
L'expérience clinique n'a pas montré de différence en termes d'efficacité entre les patients âgés et les patients adultes plus jeunes. D'une manière générale, les patients âgés doivent faire l'objet d'une surveillance afin d'évaluer la tolérance de Dysport, en raison de la fréquence plus élevée de maladies associées ainsi que d'autres traitements médicamenteux.
Exécution de l'injection
L'injection intramusculaire est recommandée aux dosages et sites d'injection suivants:
|
Muscle |
Dose recommandée de Dysport (U) |
Nombre de sites d'injection par muscle |
|
Distal | ||
|
Soleus |
300-550 |
2-4 |
|
Gastrocnemius |
|
|
|
chef médial |
100-450 |
1-3 |
|
chef latéral |
100-450 |
1-3 |
|
Tibialis posterior |
100-250 |
1-3 |
|
Flexor digitorum longus |
50-200 |
1-2 |
|
Flexor digitorum brevis |
50-200 |
1-2 |
|
Flexor hallucis longus |
50-200 |
1-2 |
|
Flexor hallucis brevis |
50-100 |
1-2 |
|
Proximal | ||
|
Rectus femoris |
100-400 |
1-3 |
|
Muscles ischio-jambiers |
100-400 |
1-3 |
|
Adductor magnus |
100-300 |
1-3 |
|
Gracilis |
100-200 |
1-3 |
|
Gluteus maximus |
100-400 |
1-2 |
Lors du traitement de la spasticité focale des membres inférieurs chez l'adulte, Dysport est reconstitué dans une solution de chlorure de sodium à 0,9 %, afin d'obtenir une solution injectable de 100 U par ml, de 200 U par ml ou de 500 U par ml. Dysport est administré en injection intramusculaire dans les muscles décrits ci-dessus.
Bien que les sites d'injection proprement dits puissent être repérés par la palpation, le recours à une technique d'injection complémentaire, p.ex. l'électromyographie, la stimulation électrique ou l'échographie, est recommandé afin de déterminer précisément les sites d'injection.
Durée du traitement
Le traitement par Dysport doit être répété toutes les 12 à 16 semaines, le cas échéant de manière plus espacée selon les besoins, en fonction de la réapparition des symptômes cliniques, mais en respectant un intervalle minimal de 12 semaines après l'injection précédente. En fonction du degré et du type de spasticité musculaire observés au moment de la nouvelle injection, il peut s'avérer nécessaire de procéder à un ajustement de la dose de Dysport et de choisir un autre muscle dans lequel réaliser l'injection.
Spasticité focale des membres supérieurs et inférieurs
Lorsqu'un traitement des membres supérieurs et des membres inférieurs est nécessaire au cours de la même séance de traitement, la dose de Dysport à injecter dans chaque membre doit être adaptée à chaque patient sans dépasser la dose totale de 1500 U.
d) Spasticité chez les adolescents et les enfants
Spasticité focale des membres supérieurs chez les patients âgés de 2 ans ou plus
Posologie
La posologie lors du traitement initial et des traitements ultérieurs doit être adaptée individuellement en fonction de la taille, du nombre et de la position des muscles impliqués, de la sévérité de la spasticité, de la présence d'une faiblesse musculaire locale, de la réponse du patient aux traitements antérieurs et/ou des antécédents d'effets indésirables avec les toxines botuliques.
La dose totale maximale de Dysport administrée par séance de traitement ne doit pas dépasser 16 unités/kg ou 640 unités au total pour les injections unilatérales, la valeur la plus faible étant retenue. Pour les injections bilatérales, la dose totale maximale ne doit pas dépasser 21 unités/kg ou 840 unités au total par séance de traitement, la valeur la plus faible étant retenue. La dose totale administrée doit être répartie entre les muscles spastiques concernés des membres supérieurs. Il ne faut pas administrer plus de 0,5 ml de Dysport à un seul site d'injection. En cas de traitement simultané du membre supérieur et du membre inférieur, des instructions posologiques spécifiques doivent être respectées (voir «Traitement simultané d'une spasticité focale du membre supérieur et d'une position dynamique du pied équin due à la spasticité chez les enfants de 2 ans et plus».
Les doses recommandées sont indiquées dans le tableau ci-dessous.
|
Muscle |
Plage de doses recommandées par muscle par membre supérieur (unités/kg de poids corporel) |
Nombre de sites d'injection par muscle |
|
Brachialis |
3 - 6 |
Jusqu'à 2 |
|
Brachioradialis |
1,5 - 3 |
1 |
|
Biceps brachii |
3 - 6 |
Jusqu'à 2 |
|
Pronator teres |
1 - 2 |
1 |
|
Pronator quadratus |
0,5 - 1 |
1 |
|
Flexor carpi radialis |
2 - 4 |
Jusqu'à 2 |
|
Flexor carpi ulnaris |
1,5 - 3 |
1 |
|
Flexor digitorum profundus |
1 - 2 |
1 |
|
Flexor digitorum superficialis |
1,5 - 3 |
Jusqu'à 4 |
|
Flexor pollicis brevis/ opponens pollicis |
0,5 - 1 |
1 |
|
Adductor pollicis |
0,5 - 1 |
1 |
|
Dose totale |
Jusqu'à 16 unités/kg pour un membre supérieur (maximum 21 unités/kg pour des injections bilatérales dans les deux membres supérieurs) | |
Exécution de l'injection
Dans le traitement de la spasticité focale des membres supérieurs chez l'enfant, Dysport est reconstitué dans une solution de chlorure de sodium à 0,9 % afin d'obtenir une solution contenant soit 100 unités par ml, soit 200 unités par ml, soit 500 unités par ml. Dysport est administré par injection intramusculaire comme décrit ci-dessus.
Bien que les sites d'injection proprement dits puissent être déterminés par palpation, il est recommandé d'utiliser une technique d'aide à l'injection, comme l'électromyographie, la stimulation électrique ou les ultrasons, pour déterminer les sites d'injection.
Durée d'utilisation
Le traitement par Dysport doit être répété lorsque l'effet de l'injection précédente a diminué, mais pas avant 16 semaines après l'injection précédente. La majorité des patients dans les études cliniques ont été traités à nouveau après 16-28 semaines, mais certains patients ont eu un effet prolongé de 34 semaines ou plus. En raison du degré et du schéma de spasticité musculaire au moment de la réinjection, des ajustements de la dose de Dysport et des muscles à injecter peuvent être nécessaires.
Spasticité focale du membre inférieur (voir rubriques «Posologie/Mode d'emploi» et «Efficacité clinique») chez les patients âgés de 2 ans et plus
Posologie
La posologie lors du traitement initial et des traitements ultérieurs doit être adaptée individuellement en fonction de la taille, du nombre et de la position des muscles impliqués, de la sévérité de la spasticité, de la présence d'une faiblesse musculaire locale, de la réponse du patient aux traitements antérieurs et/ou des antécédents d'effets indésirables liés à la toxine botulique. Lors du premier traitement, il faut envisager de commencer avec la plus faible dose possible, en se référant au tableau cidessous (voir «Mises en garde et précautions»).
La dose totale maximale de Dysport, administrée au cours d'une séance de traitement, ne doit pas dépasser 15 unités/kg pour des injections unilatérales ou 30 unités/kg pour des injections bilatérales dans les membres inférieurs. La dose maximale par jambe ne doit pas dépasser 500 unités. En outre, la dose totale de Dysport par séance de traitement ne doit pas dépasser 1000 unités ou 30 unités/kg, selon la dose qui est la plus faible. La dose totale administrée doit être répartie entre les différents muscles spastiques des membres inférieurs. Si possible, la dose doit être répartie sur plusieurs sites d'injection dans chaque muscle. La dose de 0,5 ml de Dysport administrée au niveau d'un seul site d'injection ne doit pas être dépassée. Les posologies recommandées figurent dans le tableau suivant. En cas de traitement simultané du membre supérieur et du membre inférieur, des instructions posologiques spécifiques doivent être respectées (voir ci-dessous «Traitement simultané d'une spasticité focale du membre supérieur et d'une position dynamique du pied équin due à la spasticité chez les patients âgés de 2 ans et plus»).
|
Muscle |
Intervalle posologique recommandé par muscle et par jambe (unités/kg de poids corporel) |
Nombre de sites d'injection par muscle |
|
Gastrocnemius |
de 5 à 15 |
jusqu'à 4 |
|
Soleus |
de 4 à 6 |
jusqu'à 2 |
|
Tibialis posterior |
de 3 à 5 |
jusqu'à 2 |
|
Dose totale |
jusqu'à 15 unités/kg/jambe | |
Exécution de l'injection
Lors du traitement de la position dynamique du pied équin suite à la spasticité chez l'enfant, Dysport est reconstitué, pour obtenir une solution contenant soit 100 unités par ml, soit 200 unités par ml, soit 500 unités par ml. Dysport est reconstitué dans une solution de chlorure de sodium à 0,9 % et est injecté par voie intramusculaire comme décrit plus haut.
Bien que les sites d'injection proprement dits puissent être repérés par la palpation, le recours à une technique d'injection complémentaire, p.ex. l'électromyographie, la stimulation électrique ou l'échographie, est recommandé afin de déterminer les sites d'injection.
Durée du traitement
Le traitement par Dysport doit être répété lorsque l'effet de l'injection précédente s'est atténué, mais en respectant un intervalle minimal de 12 semaines après l'injection précédente. La majorité des patients inclus dans les études cliniques ont de nouveau reçu un traitement après environ 16 à 22 semaines; chez certains patients, l'effet a toutefois duré plus longtemps, jusqu'à 28 semaines. En fonction du degré et du type de spasticité musculaire observés au moment de la nouvelle injection, il peut s'avérer nécessaire de procéder à un ajustement de la dose de Dysport et de choisir un autre muscle dans lequel réaliser l'injection.
Traitement simultané d'une spasticité focale du membre supérieur et d'une position dynamique du pied équin due à la spasticité chez les enfants de 2 ans et plus
Si un traitement simultané des membres supérieurs et inférieurs est nécessaire chez les patients âgés de 2 ans et plus, la posologie dépend de l'indication respective, à savoir le traitement de la spasticité focale des membres supérieurs ou de la position dynamique en pointe des membres inférieurs chez les enfants âgés de 2 ans et plus.
La dose totale de Dysport injectée ne doit pas dépasser 30 unités/kg (ou 1000 unités, la valeur la plus faible étant retenue) par séance de traitement.
Le traitement simultané des membres supérieurs et inférieurs doit être répété lorsque l'effet de l'injection précédente a diminué, mais pas plus tôt que 12 à 16 semaines après l'injection précédente. Le moment optimal pour un traitement ultérieur dépend des progrès individuels et de la réponse au traitement. Le degré et le schéma de la spasticité musculaire au moment de l'injection répétée peuvent nécessiter des ajustements de la dose de Dysport et des muscles à injecter.
e) Hyperhidrose axillaire
Posologie
La dose recommandée chez l'adulte est de 100 U de Dysport par aisselle.
Exécution de l'injection
La zone d'injection doit être déterminée au préalable à l'aide du test d'iode-amidon. Les deux aisselles doivent être lavées et désinfectées. Les injections intradermiques sont administrées ensuite à 10 endroits différents, à raison de 10 U de Dysport par injection.
Durée du traitement
L'effet thérapeutique maximal peut être attendu 2 semaines après l'injection. Chez la plupart des patients, la dose recommandée assurera une suppression suffisante de la sécrétion sudorale pendant environ 48 semaines.
Le renouvellement du traitement doit être déterminé sur une base individuelle, en considérant la gêne induite par une sécrétion sudorale trop importante, mais pas plus fréquemment que toutes les 12 semaines. Certains indices signalent que l'intervalle entre les injections tend à se rallonger lorsque le traitement est répété.
f) Incontinence urinaire due à une hyperactivité neurogène du détrusor
Posologie
La dose recommandée est de 600 U. Une dose de 800 U peut être utilisée en cas de réponse insuffisante, p.ex. chez les patients présentant une forme sévère de la maladie.
Dysport doit être administré aux patients qui effectuent régulièrement un sondage intermittent propre.
La dose totale administrée doit être répartie en 30 injections intra-détrusoriennes (dans le muscle détrusor) uniformément distribuées dans tout le muscle détrusor, en évitant le trigone. Dysport est injecté à l'aide d'un cystoscope flexible ou rigide et chaque injection doit se faire à une profondeur d'environ 2 mm avec l'administration de 0,5 ml à chaque site. Pour la dernière injection, environ 0,5 ml de solution de sérum physiologique stérile doit être injecté pour assurer une administration complète de la dose.
Exécution de l'injection
Lors du traitement d'une incontinence urinaire due à une hyperactivité neurogène du détrusor, Dysport est reconstitué dans une solution de chlorure de sodium à 0,9% pour obtenir une solution de 15 ml contenant 600 U ou 800 U.
Dysport est administré comme décrit ci-dessus par injection intra-détrusorienne.
Une antibiothérapie prophylactique doit être instaurée au moins 3 jours avant le traitement par Dysport et poursuivie pendant au moins 3 jours après celui-ci. Les médicaments anticoagulants doivent être arrêtés au moins 3 jours avant l'administration de Dysport et repris uniquement le lendemain des injections. En cas d'indication médicale, les héparines de bas poids moléculaire peuvent être administrées 24 heures avant l'administration de Dysport.
Avant l'injection, une anesthésie locale de l'urètre ou un gel lubrifiant peuvent être utilisés pour faciliter l'insertion du cystoscope. Si nécessaire, une instillation intravésicale d'un anesthésique dilué (avec ou sans sédation) ou une anesthésie générale peuvent également être effectuées. Si une instillation d'anesthésique local est réalisée, la solution anesthésique devra être drainée, puis la vessie rincée avec une solution de chlorure de sodium et drainée à nouveau avant de poursuivre l'injection intra-détrusorienne.
Avant l'injection, un volume suffisant de solution injectable de chlorure de sodium doit être instillé dans la vessie afin d'obtenir une visualisation adéquate pour les injections.
Après l'administration des 30 injections intra-détrusoriennes, la solution injectable de chlorure de sodium utilisée pour la visualisation de la paroi vésicale doit être drainée. Le patient doit rester sous observation pendant au moins 30 minutes après l'injection.
Durée du traitement
Une amélioration clinique est généralement observée dans les 2 semaines suivant le traitement. Le traitement par Dysport doit être répété lorsque l'effet de l'injection précédente a diminué, mais pas plus tôt que 12 semaines après l'injection précédente. Le délai médian jusqu'au renouvellement du traitement chez les patients traités par Dysport était compris entre 39 et 47 semaines. Toutefois, la durée de la réponse peut être plus longue, car plus de 40 % des patients n'avaient pas été retraités à 48 semaines.
Contre-indications
Hypersensibilité démontrée à l'un des constituants.
Infection des voies urinaires au moment du traitement de l'incontinence urinaire due à une hyperactivité neurogène du détrusor.
Mises en garde et précautions
Le dosage recommandé et la fréquence d'administration de Dysport ne doivent pas être dépassés (voir «Posologie/Mode d'emploi»).
Le patient doit savoir qu'il est tenu d'avertir ses autres médecins traitants du traitement avec Dysport.
Des effets indésirables liés à la diffusion de l'effet de la toxine à distance du site d'injection ont été rapportés (voir «Effets indésirables»). Le risque que surviennent de tels effets indésirables pourrait être limité en utilisant la dose minimale efficace et en ne dépassant pas la posologie recommandée.
Une faiblesse musculaire excessive peut survenir même aux doses thérapeutiques. Dans quelques cas, une dysphagie, une pneumonie et/ou une faiblesse marquée, pouvant s'avérer fatales dans de très rares cas, ont été observées. La prudence est recommandée si le muscle cible présente une faiblesse ou une atrophie excessive.
Le risque d'effets indésirables est accru chez:
·les patients souffrant de troubles neurologiques sous-jacents, en particulier des troubles de la déglutition et de la respiration (notamment les patients ayant des antécédents de dysphagie et d'aspiration);
·les patients présentant des symptômes cliniques ou subcliniques de troubles caractérisés de la transmission neuromusculaire, comme par ex. myasthénie gravis.
Les patients atteints de telles affections peuvent présenter une sensibilité accrue à la toxine botulique, ce qui peut entraîner des effets secondaires accrus (affaiblissement excessif de la musculature par ex.). Notamment chez les patients rencontrant des difficultés préexistantes à déglutir et à respirer, il est possible que ces problèmes s'aggravent si la toxine diffuse dans les muscles concernés. Le risque d'aspiration est accru chez ces patients.
Chez les patients atteints de telles maladies sous-jacentes, Dysport ne doit être utilisé que sous le contrôle et la surveillance étroite d'un spécialiste et uniquement si l'on estime que les avantages du traitement l'emportent sur les risques éventuels.
Les patients et leur entourage doivent être avertis de la nécessité d'une prise en charge médicale immédiate en cas de troubles de la déglutition, de l'élocution ou de la respiration.
La prudence est recommandée lors du traitement de patients adultes et notamment de patients âgés atteints d'une spasticité focale des membres inférieurs, car ils pourraient avoir un risque plus élevé de faire des chutes. Au cours des études cliniques contrôlées contre placebo dans lesquelles des patients ont été traités pour une spasticité focale des membres inférieurs, des chutes sont survenues chez respectivement 6,3% et 3,7% des patients dans les groupes sous Dysport et sous placebo.
Des cas de sécheresse oculaire ont été rapportés lors de l'utilisation de Dysport dans le traitement des rides glabellaires, des rides canthales latérales, du blépharospasme et du spasme hémifacial (voir «Effets indésirables»). Une réduction de la production de larmes, une réduction de la fréquence de clignements des yeux et des troubles cornéens peuvent survenir lors de l'utilisation de toxines botuliques, y compris Dysport.
Dans le cadre du traitement de la spasticité chez l'enfant, Dysport ne doit être utilisé qu'à partir de l'âge de 2 ans.
La formation d'anticorps contre la toxine botulique n'a été que rarement observée chez des patients traités avec Dysport. Sur le plan clinique, cela peut se manifester par une réduction marquée de l'effet thérapeutique et/ou la nécessité de procéder à un accroissement constant du dosage. Étant donné que le risque de formation d'anticorps augmente proportionnellement à l'importance du dosage et à la réduction des intervalles de traitement, il faut utiliser le dosage efficace minimum en respectant des intervalles de traitement aussi longs que possible.
Comme pour toute injection intramusculaire, Dysport ne doit être administré à des patients souffrant de problèmes de la coagulation sanguine ainsi que d'infections et/ou d'inflammations aux sites d'injection qu'en cas de nécessité absolue.
En ce qui concerne le traitement d'une hyperactivité neurogène du détrusor, seuls les patients atteints d'une lésion médullaire et d'une sclérose en plaques ont été inclus dans les études.
Une dysréflexie autonome peut survenir dans le cadre du traitement de l'hyperactivité neurogène du détrusor. Une prise en charge médicale immédiate peut être nécessaire.
Un flacon de Dysport ne doit être utilisé que pour un seul patient et durant un seul traitement. Le Dysport non utilisé doit être éliminé, conformément à ce qui figure à «Remarques particulières – Remarques concernant la manipulation». Certaines précautions doivent être prises lors de la préparation et de l'administration du produit, ainsi que lors de l'inactivation et de l'élimination de la solution d'injection non utilisée (voir «Remarques particulières – Remarques concernant la manipulation»).
Dysport contient une faible quantité d'albumine humaine produite à partir d'un pool de plasma humain. Les dons de plasma proviennent exclusivement de centres de transfusion sanguine agréés par les autorités et de donneurs, aussi bien des volontaires bénévoles que des personnes rétribuées. Tous les dons de plasma utilisés pour la production de l'albumine sont séronégatifs pour les antigènes HBs, anti-HCV et anti-VIH et ne présentent pas de valeurs d'ALAT pathologiquement élevées. Le risque de transmission d'infections virales à la suite de l'utilisation de sang humain ou de produits sanguins humains ne peut toutefois être exclu avec une certitude absolue.
Interactions
L'action de la toxine botulique peut être renforcée par des médicaments agissant directement ou indirectement sur la transmission neuromusculaire (entre autres aminoglycosides, relaxants musculaires, bloquants au curare non dépolarisants). Ces médicaments doivent être utilisés avec prudence chez des patients traités avec la toxine botulique. Aucune étude spéciale se rapportant aux interactions avec ces médicaments ou d'autres médicaments n'a été effectuée.
Grossesse, allaitement
Grossesse
Il n'existe aucune étude contrôlée humaine sur l'utilisation de la toxine botulique A pendant la grossesse. Des études expérimentales menées sur des animaux ne laissent pas supposer d'effets nocifs directs ou indirects sur la grossesse, le développement embryonnaire et fœtal, la naissance ou le développement postnatal, à l'exception des hautes doses provoquant une toxicité maternelle (voir «Données précliniques»).
On ignore s'il existe un risque potentiel chez l'être humain. Dysport ne devrait pas être utilisé pendant la grossesse, sauf en cas de nécessité absolue. Si une grossesse survient pendant le traitement, la patiente doit être informée de tout risque potentiel.
Allaitement
On ignore si la toxine botulique A passe dans le lait maternel. Aucune étude expérimentale menées sur les animaux n'a été menée sur le sujet. L'utilisation de la toxine botulique A pendant la période d'allaitement n'est pas recommandée.
Fertilité
Il n'existe aucune donnée clinique évaluant l'effet de Dysport sur la fertilité.
Il n'existe aucune preuve d'effet direct de Dysport sur la fertilité dans les études effectuées sur les animaux (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machines
La toxine botulique A peut provoquer des effets indésirables tels que de la fatigue, un affaiblissement de la musculature, un ptosis et/ou des troubles de la vision. L'aptitude à prendre part à la circulation routière et à utiliser des machines peut de ce fait être entravée.
Effets indésirables
Des effets indésirables peuvent apparaître à la suite d'une injection de Dysport trop profonde ou incorrectement appliquée et peuvent induire une paralysie temporaire des muscles voisins.
Les indications de fréquence sont définies comme suit: très fréquents (≥1/10); fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100); rares (≥1/10 000, <1/1000); très rares (<1/10 000), «fréquence inconnue» (ne peut être estimée sur la base des données disponibles).
Toutes indications
Lors d'études cliniques, un effet indésirable est apparu chez environ 25 % des patients traités avec Dysport.
Une faiblesse musculaire locale a été rapportée dans toutes les indications; ceci correspond au mécanisme d'action de la toxine.
De l'asthénie, une fatigue et des affections de type grippal ont été rapportées après le traitement par la toxique botulique A.
Comme on peut s'y attendre avec tous les traitements injectables, des réactions au site d'injection, incluant ecchymoses et douleurs, ont également été rapportées.
Par ailleurs, les effets indésirables suivants, spécifiques aux indications, ont été rapportés:
a) Blépharospasme, spasme hémifacial et dystonies focales associées
Affections du système nerveux:
Fréquents: parésie faciale
Occasionnels: paralysie du septième nerf crânien
Affections oculaires:
Très fréquents: ptosis (11 %)
Fréquents: diplopie, sécheresse oculaire, augmentation de la sécrétion lacrymale, œdème palpébral
Rares: entropion, ophtalmoplégie
Troubles généraux et anomalies au site d'administration:
Occasionnels: fatigue, asthénie
b) Torticolis spasmodique
Affections du système nerveux:
Fréquents: céphalée, sensation vertigineuse, parésie faciale
Affections oculaires:
Fréquents: vision trouble, baisse de l'acuité visuelle
Affections respiratoires, thoraciques et médiastinales:
Fréquents: dysphonie, dyspnée
Affections gastro-intestinales:
Très fréquents: dysphagie (17 %), sécheresse buccale (16 %)
Occasionnels: nausées
Affections musculosquelettiques et du tissu conjonctif:
Très fréquents: faiblesse musculaire (19 %)
Fréquents: cervicalgie, douleurs musculosquelettiques, myalgie, douleur dans un membre, raideur musculosquelettique
Occasionnels: atrophie musculaire, atteintes de la mâchoire
Troubles généraux et anomalies au site d'administration:
Très fréquents: fatigue (13 %)
Lors de traitements par d'autres préparations à base de toxine botulique, on a rapporté des dysphagies avec risque d'aspiration dans des cas isolés. La dysphagie semble dépendre de la dose utilisée et survient le plus souvent après une injection dans le muscle sterno-cléido-mastoïdien. L'administration d'aliments mous peut être nécessaire jusqu'à la disparition des symptômes. D'autres mesures (par ex. sonde gastrique) peuvent le cas échéant s'avérer nécessaires.
c) Spasticité chez l'adulte
Spasticité focale des membres supérieurs
Affections gastro-intestinales:
Occasionnels: dysphagie*
Affections musculosquelettiques et du tissu conjonctif:
Fréquents: faiblesse musculaire, douleurs musculosquelettiques, douleur dans un membre
Troubles généraux et anomalies au site d'administration:
Fréquents: réactions au niveau du site d'injection (p.ex. douleurs, érythèmes, tuméfaction, etc.), asthénie, fatigue, syndrome grippal
Lésions, intoxications et complications d'interventions:
Fréquents: chute**
* La fréquence de la dysphagie a été déterminée à partir des données groupées des études ouvertes. La dysphagie n'a pas été observée au cours des études en double aveugle pour l'indication «Spasticité des membres supérieurs chez les adultes».
**Incidence des chutes: 2,0 % chez les sujets traités par Dysport, 2,2 % chez les sujets traités par le placebo.
Spasticité focale des membres inférieurs
Affections gastro-intestinales:
Fréquents: dysphagie
Affections musculosquelettiques et du tissu conjonctif:
Fréquents: faiblesse musculaire, myalgie
Lésions, intoxications et complications d'interventions:
Fréquents: chute
Troubles généraux et anomalies au site d'administration:
Fréquents: asthénie, fatigue, syndrome grippal, réaction au site d'injection (douleur, hématome, éruption, prurit)
Lors du traitement simultané des membres supérieurs et inférieurs par une dose totale de Dysport allant jusqu'à 1500 U, aucune information importante relative à la sécurité n'a été enregistrée en plus des effets attendus lors du traitement séparé des muscles des membres supérieurs ou inférieurs.
d) Spasticité chez les adolescents et les enfants
Spasticité focale des membres supérieurs (à partir de 2 ans)
Affections de la peau et du tissu sous-cutané
Fréquent: éruption cutanée
Affections musculosquelettiques et du tissu conjonctif
Fréquent: faiblesse musculaire, douleurs dans les extrémités
Occasionnel: myalgie
Troubles généraux et anomalies au site d'administration
Fréquent: syndrome grippal, asthénie, fatigue, contusion au site d'injection
Occasionnel: eczéma au site d'injection, douleur au site d'injection, gonflement au site d'injection, éruption cutanée au site d'injection
Spasticité focale des membres inférieurs (à partir de 2 ans)
Affections musculosquelettiques et du tissu conjonctif:
Fréquents: myalgie, faiblesse musculaire
Affections du rein et des voies urinaires:
Fréquents: incontinence urinaire
Lésions, intoxications et complications d'interventions:
Fréquents: chute
Troubles généraux et anomalies au site d'administration:
Fréquents: syndrome grippal, réaction au site d'injection (p.ex. douleur, érythème, hématome, etc.), troubles de la démarche, fatigue
Occasionnels: asthénie
Traitement simultané d'une spasticité focale du membre supérieur et d'un pied équin dynamique dû à la spasticité chez les enfants de 2 ans et plus
En cas de traitement simultané des membres supérieurs et inférieurs avec des doses allant jusqu'à 30 unités/kg ou 1 000 unités de dose totale, selon la valeur la plus faible, en cas de traitement simultané des membres supérieurs et inférieurs, il n'y a pas eu de conclusions relatives à la sécurité en plus de celles attendues en cas de traitement séparé des membres supérieurs ou inférieurs.
e) Hyperhidrose axillaire
Affections de la peau et du tissu sous-cutané:
Fréquents: hypersudation compensatoire, prurit
f) Incontinence urinaire due à une hyperactivité neurogène du détrusor
Infections et infestations:
Très fréquents: infection des voies urinaires* (16 %)
Fréquents: bactériurie
Affections du système nerveux:
Occasionnels: hypoesthésie
Affections gastro-intestinales:
Fréquents: constipation
Affections musculosquelettiques et du tissu conjonctif:
Occasionnels: faiblesse musculaire
Affections du rein et des voies urinaires:
Fréquents: hématurie
Affections des organes de reproduction et du sein:
Fréquents: dysérection
Troubles généraux et anomalies au site d'administration:
Occasionnels: fatigue, syndrome grippal
*Dans les études pivots en double aveugle et contrôlées contre placebo, des infections des voies urinaires ont été rapportées chez 15,8 % des patients traités par Dysport et chez 17,4 % des patients sous placebo au cours des 12 premières semaines du traitement.
Effets indésirables après commercialisation
Le profil des effets indésirables, rapportés au titulaire de l'autorisation depuis la mise sur le marché, reflète la pharmacologie du produit et correspond à celui observé lors des études cliniques.
Affections du système immunitaire:
Fréquence inconnue: réactions d'hypersensibilité
Affections du système nerveux:
Fréquence inconnue: hypoesthésie
Affections musculosquelettiques et du tissu conjonctif:
Fréquence inconnue: atrophie musculaire
Dans des cas très rares, des effets indésirables liés à la diffusion de l'effet de la toxine à distance du site d'injection ont été rapportés (faiblesse musculaire excessive, dysphagie, pneumonie par aspiration d'évolution parfois fatale).
Une rougeur cutanée a occasionnellement été rapportée après l'utilisation de Dysport. Des atrophies musculaires d'origine névralgique ont très rarement été rapportées après le traitement par Dysport.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Signes et symptômes
Le surdosage peut provoquer une paralysie neuromusculaire prononcée et à distance du site d'injection. Dans un tel cas, il y a un risque accru que la neurotoxine passe dans la circulation sanguine et provoque des complications similaires à celles d'intoxications à la toxine botulique par voie orale (par ex. dysphagie et dysphonie). Les symptômes du surdosage n'apparaissent en général pas immédiatement après l'injection. En raison de la longue durée d'action de la toxine botulique, le patient doit, en cas de surdosage, être suivi médicalement durant plusieurs semaines pour s'assurer qu'il n'y a pas de symptômes de diffusion de la toxine ou de symptômes de paralysie ou de faiblesse excessive des muscles. De telles mesures sont éventuellement aussi nécessaires après un contact accidentel (voir «Remarques concernant la manipulation») ou une prise orale.
Traitement
Des mesures de soutien générales sont conseillées. Selon les circonstances, une hospitalisation ainsi qu'une assistance respiratoire en cas de paralysie des muscles respiratoires peuvent être nécessaires.
Propriétés/Effets
Code ATC
Classe pharmacothérapeutique: autres myorelaxants à action périphérique, code ATC: M03AX01.
Classe pharmacothérapeutique: antisudoraux, code ATC: D11AA.
Mécanisme d'action
La toxine botulique A bloque sélectivement la transmission aux terminaisons nerveuses cholinergiques par inhibition de la libération d'acétylcholine. La dénervation chimique provoque une paralysie flasque au niveau de la musculature squelettique, une hypohidrose, voire une anhidrose au niveau des glandes sudoripares eccrines et une atonie au niveau des muscles lisses innervés par le parasympathique.
La formation de nouvelles terminaisons nerveuses et de plaques motrices terminales rétablit une conduction normale. Ce processus de régénération débute environ 8 semaines après l'administration de la toxine. Du point de vue anatomique, les nouvelles structures fonctionnelles diffèrent partiellement des structures antérieures.
À la suite de l'injection intra-détrusorienne pour le traitement de l'hyperactivité neurogène du détrusor, la toxine exerce un effet sur les voies efférentes de l'activité du détrusor par l'inhibition de la libération d'acétylcholine. De plus, la toxine peut inhiber les neurotransmetteurs afférents et les voies sensitives.
Les études cliniques n'ont mis en évidence aucun effet toxique chronique après injection répétée de Dysport.
Pharmacodynamique
Non applicable.
Efficacité clinique
Spasticité chez les patients adultes
Dans une étude de titration de la dose, 82 patients atteints de spasticité des membres supérieurs consécutive à un accident vasculaire cérébral ont été traités par placebo, 500, 1000 ou 1500 U de Dysport. Après 4 semaines pour les 3 dosages, on a pu prouver, en s'appuyant sur l'échelle d'Ashworth modifiée (MAS) à 6 degrés, que le critère d'évaluation principal de l'étude, se traduisant par une baisse significative de la spasticité valable pour au moins une articulation du coude, de la main ou des doigts auscultés, était atteint. C'est ainsi que l'on a relevé chez 90,9 % des patients traités par 1000 U de Dysport des régressions de 1 à 4 degrés sur l'échelle MAS (p = 0,001) qui ont duré parfois jusqu'à 16 semaines. Seulement 68,4 % des patients traités par placebo présentaient une régression de 1, voire de 2 degrés au maximum. En ce qui concerne les critères d'évaluation secondaires de l'étude, comme l'amplitude de mouvement actif et passif, l'évaluation subjective de la fonctionnalité et les échelles de douleur, les patients traités par Dysport ont obtenu de meilleurs résultats. Les tests de déglutition réalisés pour contrôler les dysphagies neurogènes n'ont montré aucune anomalie pendant toute la durée de l'étude. Le dosage de 1000 U de Dysport a donné le meilleur rapport bénéfice/risque. Ces résultats ont été confirmés par une étude de suivi contrôlée par placebo, comparable sur le plan de la conception et des méthodes employées, menée auprès de 59 patients traités par une dose de 1000 U de Dysport. L'efficacité du traitement mesurée à l'amplitude des mouvements, aux soins, aux capacités fonctionnelles et aux douleurs ressenties - également lors d'une injection répétée d'au maximum 1000 U de Dysport - a pu être démontrée dans une étude ouverte menée auprès de 51 patients. La sécurité des 3 cycles de traitement qui s'étendaient sur une durée maximale de 1 an, a été jugée positive compte tenu du nombre réduit des effets indésirables et de leur type.
L'efficacité et la sécurité de Dysport pour le traitement de la spasticité des membres supérieurs ont également été évaluées dans le cadre de l'étude «Multicentre, prospective, double blind, randomised, placebo controlled study, assessing the efficacy and safety of Dysport intramuscular injections used for the treatment of upper limb spasticity in adult subjects with spastic hemiparesis due to stroke or traumatic brain injury». Cette étude a inclus 238 patients (159 sous Dysport et 79 sous placebo) souffrant d'une spasticité des membres supérieurs. Dans le cadre de cette étude, la cause de la spasticité était un accident vasculaire cérébral chez 90,3 % des sujets et une lésion cérébrale traumatique chez 9,7 % des sujets. Le faible nombre de patients atteints de spasticité secondaire à une lésion cérébrale traumatique n'a pas permis de réaliser une analyse statistique probante.
Le critère principal d'efficacité était le tonus musculaire du principal groupe musculaire ciblé (primary targeted muscle group, PTMG) à la 4e semaine, celui-ci étant mesuré à l'aide de l'échelle d'Ashworth modifiée (MAS). Le premier critère d'évaluation secondaire était l'appréciation globale du médecin (Physician Global Assessment, PGA) concernant la réponse au traitement. Les principaux résultats, obtenus à la 4e et à la 12e semaine, figurent ci-dessous:
|
|
4e semaine |
12e semaine | ||||
|
Placebo |
Dysport |
Dysport |
Placebo |
Dysport |
Dysport | |
|
Variation de la moyenne des LS du score MAS par rapport à la valeur initiale pour le tonus musculaire du PTMG |
-0,3 |
-1,2** |
-1,4** |
-0,1 |
-0,7** |
-0,8** |
|
LS de la PGA moyenne concernant la réponse au traitement |
0,7 |
1,4* |
1,8** |
0,4 |
0,5 |
1,0* |
|
Variation de la moyenne des LS du score MAS par rapport à la valeur initiale pour le tonus musculaire des fléchisseurs du poignet |
-0,3 |
-1,4** |
-1,6** |
-0,3 |
-0,7* |
-0,9* |
|
Variation de la moyenne des LS du score MAS par rapport à la valeur initiale pour le tonus musculaire des fléchisseurs des doigts |
-0,3 |
-0,9* |
-1,2** |
-0,1 |
-0,4* |
-0,6* |
|
Variation de la moyenne des LS du score MAS par rapport à la valeur initiale pour le tonus musculaire des fléchisseurs du coude |
-0,3 |
-1,0* |
-1,2** |
-0,3 |
-0,7* |
-0,8* |
|
Variation moyenne du score MAS par rapport à la valeur initiale pour le tonus musculaire des extenseurs de l'épaule (1) |
-0,4 |
-0,6 |
-0,7 |
0,0 |
-0,9 |
0,0 |
|
*p < 0,05; ** p < 0,0001 | ||||||
Pour analyser les effets du traitement sur la limitation fonctionnelle, des évaluations ont été réalisées à l'aide du Disability Assessment Scale (DAS). Les scores DAS des répondeurs pour l'objectif du traitement proprement dit (population intention-to-treat, ITT) figurent ci-dessous:
|
Groupe de traitement |
4e semaine |
12e semaine |
|
Dysport |
50,0 |
41,3 |
|
Dysport 1000 U |
62,0 |
55,7 |
|
Placebo |
39,2 |
32,9 |
|
Les domaines inclus dans le DAS comprennent l'hygiène, la position des membres, l'habillage et la douleur. | ||
Aussi bien la dose de 500 U que celle de 1000 U ont entraîné des améliorations statistiquement significatives de l'angle et du degré de spasticité, évalués à l'aide de l'échelle de Tardieu à la 4e semaine dans tous les groupes de muscles (doigts, poignets ou fléchisseurs du coude), par rapport au placebo. Avec la dose de 1000 U, des diminutions significatives du degré de spasticité ont également été observées à la 12e semaine pour tous les groupes de muscles, par rapport au placebo.
L'administration de 1000 U de Dysport a entraîné une amélioration statistiquement significative de l'amplitude des mouvements actifs (active range of motion, AROM) à la 4e semaine, avec des écarts cliniquement significatifs au niveau des muscles du coude (+18,3 degrés), du poignet (+35,2 degrés) et des doigts (+11,8 degrés), tandis qu'aucune amélioration n'a été observée dans le groupe sous placebo. L'administration de 500 U de Dysport a entraîné un bénéfice similaire sur l'amplitude des mouvements actifs des muscles des doigts.
Les améliorations concernant la facilitation de la pose d'une attelle par le sujet ont été statistiquement plus importantes après 4 et 12 semaines dans les groupes traités par 500 U et 1000 U que dans le groupe sous placebo.
Dans le cadre d'une étude d'extension en protocole ouvert réalisée ultérieurement, on a administré un nouveau traitement sur la base du tableau clinique après au minimum 12 semaines. Les doses supérieures à 1000 U voire jusqu'à 1500 U étaient admises lorsqu'on injectait également dans la musculature des épaules. Les patients souffrant d'une spasticité simultanée des membres inférieurs ont pu recevoir des injections de 500 U de Dysport dans les membres inférieurs, en plus des 1000 U dans les membres supérieurs, sans dépasser une dose maximale de 1500 U.
Après des doses répétées, l'efficacité de Dysport s'est maintenue durant jusqu'à 1 an. L'évaluation a été réalisée par le score de MAS (comme mis en évidence par les taux de réponse situés entre 75 % et 80 % dans l'étude ouverte versus 75 % dans l'étude contrôlée par placebo) et l'appréciation globale du médecin (Physician Global Assessment, PGA) en cas d'injection dans la musculature des membres supérieurs. L'efficacité de Dysport s'est aussi maintenue ou s'est renforcée au niveau de la fonction passive (Disability Assessment Scale, DAS), de la spasticité (échelle de Tardieu), de l'AROM et de la facilité de mise en place d'une attelle.
L'efficacité et la sécurité de Dysport dans le traitement de la spasticité des membres inférieurs ont été évaluées dans le cadre d'une étude pivot randomisée, multicentrique, en double aveugle, contrôlée contre placebo, menée chez 385 patients (255 traités par Dysport et 130 traités par un placebo) souffrant de spasticité des membres inférieurs après un accident vasculaire cérébral ou un traumatisme cérébral. Le critère d'évaluation principal était le score obtenu sur l'échelle d'Ashworth modifiée (MAS) pour l'articulation de la cheville.
Un volume total de 7,5 ml de Dysport 1000 U (N = 125), de Dysport 1500 U (N = 128) ou de placebo (N = 128) a été réparti entre les muscles gastrocnémien et soléaire et au moins un autre muscle des membres inférieurs en fonction du tableau clinique.
Une amélioration statistiquement significative du score MAS a été observée à la dose de 1500 U lors de l'évaluation de l'articulation de la cheville avec le genou en extension (impliquant tous les fléchisseurs plantaires). Une amélioration statistiquement significative du score MAS a été observée aux doses de 1000 U et 1500 U lors de l'évaluation de l'articulation de la cheville avec le genou en flexion (impliquant tous les fléchisseurs plantaires à l'exception du muscle gastrocnémien).
Des améliorations de la spasticité de l'articulation de la cheville ont également été démontrées lors de l'utilisation de l'échelle de Tardieu (TS), avec des améliorations significatives du degré de sévérité de la spasticité observées aux doses de 1000 U et de 1500 U. Le traitement par Dysport a également été associé à une amélioration clinique statistiquement significative aux deux doses, mesurée au moyen du score obtenu sur l'échelle d'appréciation globale du médecin (Physician Global Assessment, PGA).
Dans le sous-groupe de patients atteints de spasticité focale des membres inférieurs après un traumatisme crânio-cérébral, aucune efficacité statistiquement significative par rapport au placebo n'a été observée.
À la fin de cette étude, 345 patients ont été inclus dans une étude d'extension en ouvert, au cours de laquelle le renouvellement du traitement par Dysport 1000 U ou 1500 U a été déterminé en fonction des besoins cliniques. Les patients présentant également une spasticité des membres supérieurs ont pu recevoir des injections de 500 U de Dysport dans les membres supérieurs atteints, en plus des 1000 U dans les membres inférieurs, sans dépasser une dose maximale de 1500 U. Les améliorations des paramètres d'efficacité (MAS, PGA, TS), observées après 4 semaines de traitement en double aveugle par Dysport dans les membres inférieurs, ont augmenté de manière continue avec le renouvellement des traitements. Dans l'étude en double aveugle, aucune amélioration de la vitesse de marche n'est survenue après un traitement unique, mais une amélioration a été observée après des traitements répétés.
Spasticité chez les adolescents et les enfants de deux ans et plus
L'efficacité et la sécurité de Dysport dans le traitement de la spasticité des membres supérieurs chez les enfants âgés de deux ans et plus ont été évaluées dans le cadre d'une étude randomisée, multicentrique, en double aveugle et contrôlée. Cette étude a comparé des doses de 8 unités/kg et 16 unités/kg dans le membre supérieur sélectionné à un groupe témoin à faible dose de 2 unités/kg. Au total, 212 patients âgés de deux ans et plus (prétraités ou non par la toxine botulique) présentant une spasticité des membres supérieurs due à une paralysie cérébrale (MAS ≥2 dans le PTMG) ont été randomisés dans l'étude.
Après le traitement initial, il était possible d'effectuer jusqu'à 3 traitements Dysport supplémentaires à des doses planifiées de 8 unités/kg ou 16 unités/kg, l'investigateur pouvant décider d'augmenter ou de diminuer la dose (sans toutefois dépasser 16 unités/kg).
La dose totale de Dysport a été injectée par voie intramusculaire dans les muscles concernés du membre supérieur, qui comprenaient le groupe musculaire cible primaire (PTMG) des fléchisseurs du coude ou du poignet, ainsi que d'autres muscles du membre supérieur en fonction du tableau clinique. Il ne fallait pas administrer plus de 0,5 ml à un seul site d'injection. Cependant, plus d'un site d'injection par muscle était autorisé.
La stimulation électrique et/ou les ultrasons ont été utilisés pour aider à localiser les sites d'injection dans le muscle.
Le critère d'efficacité primaire était le changement moyen de l'échelle d'Ashworth modifiée (MAS) dans le PTMG à la semaine 6 par rapport à l'inclusion. Le principal critère d'évaluation secondaire de l'efficacité, à savoir le jugement global moyen du médecin (Physician Global Assessment (PGA)) à la semaine 6, a également été atteint.
Modification de la MAS entre l'inclusion et la semaine 6 et l'inclusion et la semaine 16 dans le PTMG- premier cycle de traitement (groupe randomisé)
|
|
Dysport 2 U/kg |
Dysport 8 U/kg |
Dysport 16 U/kg |
|
Valeur de PTMG MAS |
|
|
|
|
Semaine 6 |
|
|
|
|
Variation moyenne LS (95 % IC) |
-1,4 (-1,7, -1,2) |
-1,9 (-2,1, -1,6) |
-2,2 (-2,4, -2,0) |
|
Différence avec 2 U/kg (95 % IC) |
|
-0,4 (-0,8, -0,1) |
-0,8 (-1,1, -0,5) |
|
Valeur de p |
|
0,0093 |
<0,0001 |
|
Semaine 16 |
|
|
|
|
Variation moyenne LS (95 % IC) |
-0,9 (-1,2, -0,7) |
-1,3 (-1,5, -1,0) |
-1,5 (-1,7, -1,2) |
|
Différence avec 2 U/kg (95 % IC) |
|
-0,3 (-0,7, 0,0) |
-0,8 (-1,1, -0,5) |
|
Valeur de p |
|
0,0573 |
0,0008 |
|
LS=least square (moindres carrés) | |||
Le critère d'évaluation secondaire a également été atteint. Au cours du premier cycle de traitement, la plupart des patients Dysport ont eu une séance de traitement ultérieure après 28 semaines (62,3 % dans le groupe Dysport 8 unités/kg et 61,4 % dans le groupe 16 unités/kg). Plus de 24 % des patients des deux groupes de traitement n'avaient pas encore eu besoin d'un nouveau traitement à la semaine 34.
Une étude multicentrique, en double aveugle, contrôlée contre placebo (Y-55-52120-141) a été réalisée chez des enfants présentant une déformation dynamique suite à une paralysie cérébrale. Au total, 235 patients (prétraités ou non par la toxine botulique) présentant un degré 2 ou plus sur l'échelle d'Ashworth modifiée (MAS) ont été inclus pour recevoir 10 unités de Dysport/kg/jambe, 15 unités de Dysport/kg/jambe ou un placebo. 41 % des patients ont reçu un traitement bilatéral, soit une dose totale de Dysport de 20 unités/kg ou de 30 unités/kg. Le critère d'efficacité principal était la variation moyenne du score MAS par rapport à l'inclusion à la 4e semaine, mesuré pour les fléchisseurs plantaires de l'articulation tibio-tarsienne. Le principal critère d'efficacité secondaire était le score moyen PGA (Physician Global Assessment, appréciation globale du médecin) mesuré à la 4e semaine. Après le traitement, les patients ont fait l'objet d'un suivi pendant au moins 12 semaines et jusqu'à au maximum 28 semaines. À la fin de cette étude, les patients ont été invités à participer à une étude d'extension en ouvert (Y-55-52120-147).
Variation du score MAS par rapport à l'inclusion à la 4e semaine et l'inclusion à la 12e semaine et le score PGA à la 4e semaine et à la 12e semaine (population en ITT (intention-to-treat))
|
Paramètre |
Placebo |
Dysport | |
|
10 unités/kg/jambe |
15 unités/kg/jambe | ||
|
Variation de la moyenne des LS du score MAS par rapport à la valeur initiale pour les fléchisseurs plantaires de l'articulation tibio-tarsienne |
|
|
|
|
4e semaine |
-0,5 |
-0,9 ** |
-1,0 *** |
|
12e semaine |
-0,5 |
-0,8 * |
-1,0 *** |
|
*p ≤0,05; **p ≤0,003; ***p ≤0,0006 par rapport au placebo; | |||
Hyperhidrose
Dans le cadre d'une étude en double aveugle, un total de 152 patients atteints d'hyperhidrose axillaire a reçu soit 200 U de Dysport, soit un placebo par voie intradermique sous l'une des aisselles. Le critère d'évaluation principal de l'étude était la réduction de la quantité de sueur déterminée par gravimétrie. Deux semaines après injection de Dysport, la valeur initiale de 192 ± 136 mg de sueur par minute avait baissé à 24 ± 27 mg/min. Deux semaines après le premier traitement, 100 U de Dysport ont été injectées sous l'aisselle préalablement traitée par placebo. Après 2 semaines supplémentaires, une production de sueur de 32 ± 39 mg/min (p < 0,001) a été mesurée. Même après 24 semaines, la quantité de sueur était toujours nettement inférieure à la quantité initiale (200 U: 67 ± 66 mg/min; 100 U: 65 ± 64 mg/min). Comme aucun effet secondaire inattendu n'est apparu, le rapport bénéfice-risque des deux dosages a été jugé positif.
Incontinence urinaire due à une hyperactivité neurogène du détrusor
Deux études cliniques pivots, randomisées, en double aveugle, contrôlées contre placebo et multicentriques ont été menées chez des patients souffrant d'incontinence urinaire due à une hyperactivité neurogène du détrusor (seuls des patients atteints d'une lésion médullaire et d'une sclérose en plaques étaient inclus). Tous les patients pratiquaient déjà un sondage pour vider régulièrement leur vessie et étaient insuffisamment contrôlés par des traitements oraux. Les patients étaient naïfs ou non naïfs d'un traitement antérieur par la toxine botulique par voie intra-détrusorienne. Dans les deux études, un total de 485 patients, dont 341 avec une lésion médullaire et 144 avec une sclérose en plaques, ont été randomisés pour recevoir Dysport 600 U (N=162), Dysport 800 U (N=161) ou le placebo (N=162). Le traitement a été administré par cystoscopie en 30 injections intra-détrusoriennes uniformément réparties, en évitant le trigone. Après le traitement initial, les patients pouvaient recevoir d'autres injections de Dysport 600 U ou Dysport 800 U s'ils remplissaient les critères de renouvellement du traitement.
Le critère d'évaluation principal de l'efficacité était la variation du nombre d'épisodes hebdomadaires d'incontinence urinaire entre l'inclusion et la semaine 6. Les critères d'évaluation secondaires comprenaient le pourcentage de patients ne présentant plus d'épisodes d'incontinence urinaire à la semaine 6 (réduction de 100 %), la variation du volume par miction entre l'inclusion et la semaine 6, différents paramètres urodynamiques (cystométrie de remplissage) et la qualité de vie spécifique à l'incontinence, rapportée par les patients (I-QOL – Urinary Incontinence Quality of Life Scale ; comprend les comportements d'évitement et de limitation, l'impact psychosocial et la gêne sociale) et l'évaluation globale du succès du traitement.
Les résultats des études pivots combinées sont présentés dans le tableau ci-dessous:
Critères d'évaluation principaux et secondaires dans les études pivots combinées (population randomisée)
|
|
Placebo |
Dysport 600 U |
Dysport 800 U |
|
Épisodes hebdomadaires d'incontinence urinaire |
|
|
|
|
Semaine 2 |
|
|
|
|
Variation de la moyenne des LS (ET) |
-11,3 (1,4) |
-19,9 (1,4) |
-21,9 (1,4) |
|
Différence par rapport au placebo (IC à 95 %) |
|
-8,6 (-12,2; -4,9) |
-10,6 (-14,3; -7,0) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Semaine 6 |
|
|
|
|
Variation de la moyenne des LS (ET) |
-12,7 (1,4) |
-22,7 (1,3) |
-23,6 (1,3) |
|
Différence par rapport au placebo (IC à 95%) |
|
-10,0 (-13,5, -6,5) |
-10,9 (-14,4; -7,4) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Semaine 12 |
|
|
|
|
Variation de la moyenne des LS (ET) |
-9,2 (1,5) |
-20,4 (1,5) |
-22,8 (1,5) |
|
Différence par rapport au placebo (IC à 95%) |
|
-11,3 (-15,2; -7,3) |
-13,6 (-17,6; -9,7) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Absence d'épisodes d'incontinence urinaire, semaine 6 [a] |
|
|
|
|
Pourcentage de patients |
2,9 % |
36,1 % |
28,8 % |
|
Odds Ratio vs placebo (IC à 95 %) |
|
18,9 (6,9; 51,9) |
15,5 (5,6; 42,9) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Capacité cystomanométrique maximale (ml), semaine 6 [b] |
|
|
|
|
Variation de la moyenne des LS (ET) |
-4,0 (13,9) |
164,6 (13,6) |
175,8 (13,7) |
|
Différence par rapport au placebo (IC à 95%) |
|
168,5 (132,4; 204,7) |
179,8 (143,5; 216,1) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Absence de contractions involontaires du détrusor, semaine 6 [b] |
|
|
|
|
Pourcentage de patients |
6,6 % |
44,0 % |
55,0 % |
|
Odds Ratio vs placebo (IC à 95%) |
|
11,9 (5,3; 26,6) |
18,6 (8,3; 41,7) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Volume lors de la première contraction involontaire du détrusor (ml), semaine 6 [b] |
|
|
|
|
Variation de la moyenne des LS (ET)) |
12,3 (14,7) |
166,4 (14,4) |
191,2 (14,6) |
|
Différence par rapport au placebo |
|
154,1 (116,0; 192,1) |
178,9 (140,4; 217,5) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Pression détrusorienne maximale pendant le stockage (cmH2O), semaine 6 [b] |
|
|
|
|
Variation de la moyenne des LS (ET) |
-4,9 (2,3) |
-33,1 (2,2) |
-35,4 (2,2) |
|
Différence par rapport au placebo |
|
-28,2 (-34,0; -22,3) |
-30,4 (-36,3; -24,5) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
Score I-QOL total [b], semaine 6 |
|
|
|
|
Variation de la moyenne des LS (ET) |
7,1 (1,8) |
22,1 (1,8) |
22,2 (1,7) |
|
Différence par rapport au placebo |
|
15,0 (10,4; 19,6) |
15,1 (10,5; 19,7) |
|
Valeur de p |
|
<0,0001 |
<0,0001 |
|
I-QOL = Incontinence Quality of Life ; LS = least square (moindres carrés); ET = erreur type | |||
Dans les deux groupes sous Dysport, des améliorations significatives par rapport au placebo du volume par miction (variation de la moyenne des LS de 85,1 ml pour Dysport 600 U, de 98,1 ml pour Dysport 800 U contre -5,9 ml pour le placebo à la semaine 6; p<0,0001 pour les deux dosages de Dysport) et du paramètre urodynamique de la compliance détrusorienne (variation de la moyenne des LS de 29,3 ml/cmH2O pour Dysport 600 U, de 28,6 ml/cmH2O pour Dysport 800 U contre 2,8 ml/cmH2O pour le placebo à la semaine 6; respectivement p=0,0039 et p=0,0049) ont également été observées par rapport aux valeurs initiales. En plus de la qualité de vie liée à la santé spécifique à l'incontinence, mesurée par I-QOL, l'évaluation globale du succès du traitement rapportée par le patient, mesurée sur l'échelle d'évaluation à 7 niveaux (de «beaucoup mieux» à «bien pire») a montré une réponse significativement meilleure en cas de traitement par Dysport par rapport au placebo.
Un bénéfice supplémentaire de Dysport 800 U par rapport à 600 U a été mis en évidence chez les patients présentant une incontinence urinaire plus importante à l'inclusion ou une pression détrusorienne maximale plus élevée à l'inclusion.
Pour tous les critères d'évaluation de l'efficacité, les patients ont présenté une réponse similaire au renouvellement du traitement par Dysport; 426, 217 et 76 patients ont reçu respectivement au moins 1, 2 et 3 administrations de Dysport. La diminution moyenne des épisodes hebdomadaires d'incontinence urinaire à la semaine 6 sur l'ensemble des cycles de Dysport était de -21,2 à -22,3 pour Dysport 600 U et de -21,3 à -23,7 pour Dysport 800 U.
Le délai médian de renouvellement du traitement était de 39 à 47 semaines après le traitement initial par Dysport. Cependant, plus de 40 % des patients n'avaient pas été retraités à 48 semaines.
Pharmacocinétique
Absorption
La neurotoxine est largement absorbée à partir du tractus gastro-intestinal et du tissu musculaire.
Distribution
La captation par les terminaisons nerveuses cholinergiques se fait moyennant des récepteurs spécifiques situés dans la membrane plasmatique. La neurotoxine est transportée dans les cellules nerveuses motrices par voie intra-axonale rétrograde. Dans le soma des motoneurones de la moelle épinière, du matériel marqué radioactivement dépourvu d'activité fonctionnelle a été détecté. La neurotoxine ne se retrouve pas dans les fibres nerveuses sensibles et ne traverse pas la barrière hémato-encéphalique.
Après injection thérapeutique, l'effet clinique et les effets indésirables de la neurotoxine se manifestent après un temps de latence de 2 à 7 jours; la durée d'action varie entre 8 semaines et 8 mois. La neurotoxine diffuse du site d'application vers le tissu avoisinant. L'ampleur de la diffusion dépend des données anatomiques (aponévroses et fascia constituent un obstacle mécanique), du volume d'injection et de la dose administrée. Plus le volume d'injection et la dose sont importants, plus les effets indésirables sont marqués et fréquents.
Métabolisme
Aucune étude sur le métabolisme et l'excrétion n'est disponible.
Élimination
Il n'existe aucune étude de métabolisme et d'élimination. On admet que la toxine botulique est dégradée par protéolyse intracellulaire et extracellulaire et que les acides aminés retournent dans le pool d'acides aminés de l'organisme.
Données précliniques
Les effets observés lors d'études non cliniques portant sur la reproduction et la toxicité juvénile et chronique se sont limités aux modifications dans le muscle strié injecté en relation avec le mécanisme d'action de la toxine botulique A.
Toxicité en cas d'administration unique et répétée
Dans les études de toxicité à dose unique, lors desquelles la toxine botulique de type A a été administrée dans le muscle détrusor, la DSENO était de 67 U/kg chez le rat et de 40 U/kg chez le singe. En considérant une dose humaine de 800 U rapportée à un poids corporel de 60 kg (13,3 U/kg), il en découle une marge de sécurité 5 à 3 fois supérieure à la DSENO observée chez le rat et le singe. Chez ces deux espèces, aucune anomalie vésicale liée à la toxine de Clostridium botulinum de type A n'a été constatée avec les doses testées. À des doses supérieures à la DSENO, une perte de poids corporel, une diminution de l'activité et des signes de détresse respiratoire ont été signalés chez les deux espèces. Ces signes sont révélateurs d'une toxicité systémique qui a également été observée dans des études non cliniques menées pour évaluer la sécurité de la toxine de Clostridium botulinum de type A administrée dans les muscles striés.
Une étude de toxicité chronique, réalisée chez le rat avec des doses allant jusqu'à 40 U/kg dans les muscles striés, n'a pas révélé de signes de toxicité systémique.
Génotoxicité / Carcinogénicité
Aucune étude n'a été menée avec Dysport.
Toxicité pour la reproduction
Aucune toxicité embryonnaire/fœtale n'est apparue lors des études portant sur la toxicité pour la reproduction menées sur des rates et des lapines en gestation auxquelles a été administrée quotidiennement par voie i.m. dans les muscles striés de la toxine botulique A à des doses de 79 U/kg et de 42 U/kg. On a observé aux doses supérieures une toxicité maternelle grave chez les deux espèces, associée à une absence de la nidation chez les rates. La toxine botulique A n'a pas eu d'effets tératogènes chez les rates ni chez les lapines; les études pré- et post-natales réalisées avec la génération F1 de rats n'ont pas non plus mis d'effets en évidence. La fertilité des animaux mâles et femelles était réduite en raison d'une baisse des accouplements, un effet secondaire de la paralysie musculaire induite par les doses supérieures.
Une étude de toxicité chez le rat juvénile, dans laquelle la toxine botulique A a été injectée toutes les semaines pendant 10 semaines dans les muscles striés à partir du sevrage au 21e jour après la naissance (doses totales cumulées allant jusqu'à 75,1 U/kg, soit jusqu'à 2,5 fois la dose maximale de 30 U/kg chez l'enfant), ce qui correspond chez l'être humain à une tranche d'âge de 2 ans jusqu'à l'âge adulte jeune, n'a révélé aucun effet indésirable sur la croissance postnatale (y compris sur le squelette) et le développement reproductif et neurologique, ni aucune modification du comportement.
Autres données
L'utilisation de la toxine botulique A chez les lapins n'a pas induit d'irritation oculaire.
Remarques particulières
Incompatibilités
Ce médicament ne peut être mélangé qu'aux médicaments mentionnés sous «Remarques concernant la manipulation». Des études de compatibilité avec d'autres médicaments que ceux mentionnés sous «Remarques concernant la manipulation» n'ont pas été effectuées.
Stabilité
Durée de conservation de la poudre dans son emballage intact: 24 mois.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP:» sur l'étiquette et sur la boîte.
Stabilité après ouverture
Après reconstitution, la stabilité a été démontrée pendant 24 heures à une température comprise entre 2 et 8 °C.
D'un point de vue microbiologique, la solution injectable prête à l'emploi doit être utilisée immédiatement. Si elle n'est pas utilisée immédiatement, l'utilisateur est responsable de la durée et des conditions de conservation qui ne doit pas dépasser 24 heures à une température comprise entre 2 et 8 °C. Ne pas congeler pour une utilisation ultérieure.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C) dans l'emballage original.
Tenir hors de portée des enfants.
Remarques concernant la manipulation
La solution injectable prête à l'emploi Dysport doit être reconstituée immédiatement après la sortie de la poudre du réfrigérateur.
Dysport doit être dissous à l'aide d'une seringue en suivant les indications ci-dessous. On obtient une solution limpide.
Les instructions relatives à la reconstruction sont spécifiques aux flacons de 300 U et aux flacons de 500 U. Ces volumes fournissent des concentrations spécifiques à l'utilisation dans chacune des indications, à l'exception de l'indication incontinence urinaire due à une hyperactivité neurogène du détrusor, pour laquelle il existe des instructions spécifiques (voir ci-dessous).
|
Dose reçue |
Solvant* par flacon de 500 U |
Solvant* par flacon de 300 U |
|
500 U |
1 ml |
0,6 ml |
|
200 U |
2,5 ml |
1,5 ml |
|
100 U |
5 ml |
3 ml |
|
* Solution injectable de chlorure de sodium à 0,9 % sans conservateur | ||
Lors de la préparation d'une dose de 100 U/ml avec 5 ml de solvant, les étapes suivantes doivent être respectées:
1.Reconstituer un flacon de 500 U de Dysport avec 2,5 ml de solution de NaCl à 0,9 % sans conservateur, mélanger délicatement et mettre de côté le flacon.
2.Prélever 2,5 ml de solution de NaCl à 0,9 % sans conservateur dans une seringue de 5 ml.
3.Prendre cette seringue de 5 ml de solution saline de NaCl à 0,9 % sans conservateur et l'utiliser pour aspirer la solution Dysport du flacon reconstitué sans le retourner et mélanger délicatement. La concentration de la solution reconstituée est maintenant de 100 U/ml.
4.La solution reconstituée doit être utilisée immédiatement.
Pour le traitement de la spasticité chez l'enfant, la posologie étant calculée en unités par kg de poids corporel, une dilution supplémentaire peut s'avérer nécessaire pour obtenir le volume d'injection final.
Remarque:
Lorsque plusieurs dosages de Dysport sont utilisés pendant une séance de traitement, il faut veiller à utiliser la quantité appropriée de solvant. La quantité de solution de chlorure de sodium isotonique à ajouter est différente pour Dysport 300 U et Dysport 500 U. Chaque seringue doit être marquée en conséquence.
Instructions de dilution pour l'incontinence urinaire due à une hyperactivité neurogène du détrusor:
Lors de la préparation, il faut veiller à ce que le volume requis de 15 ml de solution injectable reconstituée de Dysport soit réparti de façon égale dans deux seringues de 10 ml, chaque seringue contenant 7,5 ml de Dysport reconstitué à la même concentration.
Après la reconstitution dans la seringue, le médicament doit être utilisé immédiatement et tout produit non utilisé, restant dans les flacons, doit être éliminé. Seuls les flacons de 300 U ou de 500 U de Dysport doivent être utilisés.
Instructions de dilution utilisant des flacons de 500 U
• Pour une dose de 600 U: reconstituer deux flacons de 500 U avec chacun 2,5 ml de solution injectable de chlorure de sodium (à 0,9 %) sans conservateur. Dans la première seringue de 10 ml, prélever 1,5 ml du premier flacon et dans la deuxième seringue de 10 ml, prélever 1,5 ml du deuxième flacon. Terminer la reconstitution en ajoutant 6 ml de solution de chlorure de sodium sans conservateur dans chaque seringue et mélanger doucement.
On obtient ainsi deux seringues de 10 ml contenant chacune 7,5 ml, correspondant à un total de 600 unités de Dysport reconstitué.
• Pour une dose de 800 U: reconstituer deux flacons de 500 U avec chacun 2,5 ml de solution injectable de chlorure de sodium (à 0,9 %) sans conservateur. Dans la première seringue de 10 ml, prélever 2 ml du premier flacon et dans la deuxième seringue de 10 ml, prélever 2 ml du deuxième flacon. Terminer la reconstitution en ajoutant 5,5 ml de solution de chlorure de sodium sans conservateur dans chaque seringue et mélanger doucement.
On obtient ainsi deux seringues de 10 ml contenant chacune 7,5 ml, correspondant à un total de 800 unités de Dysport reconstitué.
Instructions de dilution utilisant des flacons de 300 U
• Pour une dose de 600 U: reconstituer deux flacons de 300 U avec chacun 1,5 ml de solution injectable de chlorure de sodium (à 0,9 %) sans conservateur. Dans la première seringue de 10 ml, prélever la totalité des 1,5 ml du premier flacon et dans la deuxième seringue de 10 ml, prélever la totalité des 1,5 ml du deuxième flacon. Terminer la reconstitution en ajoutant 6,0 ml de solution de chlorure de sodium sans conservateur dans chaque seringue et mélanger doucement.
On obtient ainsi deux seringues de 10 ml contenant chacune 7,5 ml, correspondant à un total de 600 unités de Dysport reconstitué.
• Pour une dose de 800 U: reconstituer trois flacons de 300 U avec chacun 1,5 ml de solution injectable de chlorure de sodium (à 0,9 %) sans conservateur. Dans la première seringue de 10 ml, prélever la totalité des 1,5 ml du premier flacon et 0,5 ml du deuxième flacon. Dans la deuxième seringue de 10 ml, prélever 0,5 ml du deuxième flacon et la totalité des 1,5 ml du troisième flacon. Terminer la reconstitution en ajoutant 5,5 ml de solution de chlorure de sodium sans conservateur dans chaque seringue et mélanger doucement.
On obtient ainsi deux seringues de 10 ml contenant chacune 7,5 ml, correspondant à un total de 800 unités de Dysport reconstitué.
Instructions de dilution utilisant une combinaison de flacons de 500 U et 300 U (uniquement applicable pour une dose de 800 U)
• Pour une dose de 800 U: reconstituer le flacon de 500 U avec 2,5 ml de solution injectable de chlorure de sodium (à 0,9%) sans conservateur et le flacon de 300 U avec 1,5 ml de solution de chlorure de sodium sans conservateur. Dans la première seringue de 10 ml, prélever 2 ml du flacon de 500 U. Dans la deuxième seringue de 10 ml, prélever les 0,5 ml restants du flacon de 500 U et la totalité des 1,5 ml du flacon de 300 U. Terminer la reconstitution en ajoutant 5,5 ml de solution de chlorure de sodium sans conservateur dans chaque seringue et mélanger doucement.
On obtient ainsi deux seringues de 10 ml contenant chacune 7,5 ml, correspondant à un total de 800 unités de Dysport reconstitué.
Élimination
La toxine botulique est très sensible à la chaleur et aux agents chimiques.
En cas d'épandage de poudre de Dysport, éponger avec un chiffon absorbant imbibé d'une solution d'hypochlorite diluée (1 % de chlore libre).
En cas d'épanchement de solution de Dysport, éponger avec un chiffon sec et absorbant.
Les surfaces contaminées doivent être nettoyées avec un chiffon absorbant imbibé d'une solution d'hypochlorite diluée (1 % de chlore libre) et ensuite séchées.
Au cas où un flacon est brisé, ramasser avec précaution les débris de verre; la poudre et/ou le liquide doivent être collectés comme indiqué ci-dessus, en prenant garde d'éviter de se blesser.
En cas de contact du produit avec la peau, la surface contaminée doit être lavée avec une solution d'hypochlorite diluée (1 % de chlore libre), puis soigneusement lavée à l'eau courante.
En cas de contact du produit avec les yeux, l'œil contaminé doit être soigneusement rincé durant 15 minutes avec beaucoup d'eau ou une solution isotonique stérile de chlorure de sodium.
En cas de blessure de l'utilisateur (par coupure ou injection), la surface contaminée doit être rincée d'abord avec une solution d'hypochlorite diluée (1 % de chlore libre), puis soigneusement lavée à l'eau courante. En fonction de la quantité de solution injectée, la personne doit être surveillée et il faut prendre des mesures médicales appropriées.
Recommandations concernant l'élimination d'objets contaminés
Les flacons dont le contenu n'a pas été complètement utilisé ne doivent pas être vidés. Ils doivent être collectés avec les aiguilles d'injection, les seringues d'injection et autres matériaux contaminés (gants, tissus absorbants, débris de verre) dans un récipient spécialement destiné aux objets pointus qui doit être incinéré après usage.
Numéro d’autorisation
55057 (Swissmedic)
Présentation
Flacon (en verre de type 1) muni d'un bouchon en caoutchouc butylique, scellé à l'aide d'une capsule en aluminium et recouvert de plastique.
Dysport 300 U: Emballage original comprenant 1 flacon de 300 U de Dysport [A] ou 2 flacons contenant chacun 300 U de Dysport [A].
Dysport 500 U: Emballage original comprenant 1 flacon de 500 U de Dysport [A] ou 2 flacons contenant chacun 500 U de Dysport [A].
Titulaire de l’autorisation
IPSEN Pharma Schweiz GmbH, Zug
Mise à jour de l’information
Août 2023