Composition
Principes actifs
Drospirenonum, Ethinylestradiolum ut Ethinylestradioli betadexi clathratum.
Excipients pour les comprimés filmés avec principe actif
Lactosum monohydricum 48 mg, Maydis amylum, Magnesii stearas, Hypromellosum, Talcum, Titanii dioxidum (E171), Ferrum oxydatum rubrum (E172) pro compresso obducto.
Excipients pour les comprimés filmés sans principe actif
Cellulosum microcristallinum, Lactosum monohydricum 23 mg, Magnesii stearas, Hypromellosum, Talcum, Titanii dioxidum (E171) pro compresso obducto.
Indications/Possibilités d’emploi
Contraception hormonale.
La décision de prescrire YAZ doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thromboembolie veineuse (TEV), ainsi que du risque de TEV associé à YAZ en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques «Contre-indications» et «Mises en garde et précautions»).
Posologie/Mode d’emploi
Les CHC tels que YAZ ne devraient être prescrits que par des médecins ayant l'expérience de ces traitements et qui sont en mesure, d'une part, de fournir aux patientes toutes les explications requises sur les avantages et inconvénients de toutes les méthodes contraceptives disponibles et, d'autre part, de procéder à un examen général et gynécologique.
La prescription d'un CHC doit en principe se faire conformément aux dernières recommandations de la Société Suisse de Gynécologie et d'Obstétrique (SSGO).
Les comprimés filmés seront pris dans l'ordre indiqué sur l'emballage, si possible au même moment de la journée et de préférence avec un peu de liquide. Pendant 28 jours consécutifs, on prend un comprimé filmé par jour. On commence avec la boîte suivante le jour qui suit la prise du dernier comprimé filmé de la plaquette précédente. Il se produit généralement une hémorragie de privation, qui débute normalement 2–3 jours après le début de la prise du placebo (dernière rangée) et qui peut se poursuivre même si la plaquette suivante est déjà entamée (voir aussi «Conduite à tenir en cas de saignements irréguliers»).
Début de la prise
Femmes n'ayant pas utilisé de contraceptifs hormonaux le mois précédent
Commencer la prise le 1er jour du cycle (= 1er jour des règles). Il est également possible de commencer entre le 2e et le 5e jour du cycle; il est alors recommandé, lors du premier cycle, de recourir durant les 7 premiers jours de la prise du comprimé filmé à des méthodes contraceptives supplémentaires non hormonales (p.ex. le préservatif, à l'exclusion de la méthode d'abstinence périodique selon Ogino-Knaus ou de la méthode des températures).
Remplacement d'un autre contraceptif hormonal combiné (CHC) à YAZ (y compris anneau vaginal et patch transdermique)
Il est préférable de commencer YAZ le lendemain de la prise du dernier comprimé actif du CHC précédent, mais au plus tard le jour suivant l'intervalle habituel sans prise de comprimé ou la phase de placebo.
Dans le cas d'un patch transdermique ou d'un anneau vaginal, on commencera YAZ le jour du retrait du dernier anneau ou du dernier patch, mais au plus tard le jour où la nouvelle application du patch ou de l'anneau vaginal aurait dû avoir lieu.
Remplacement d'une préparation progestative seule (minipilule, injection, implant), ou d'un dispositif intra-utérin diffuseur de progestatif (DIU)
Le passage de la minipilule à YAZ peut se faire n'importe quel jour; le remplacement de l'implant ou d'un DIU diffuseur de progestatif interviendra au plus tôt le jour de leur retrait; s'il s'agit d'une préparation injectable, son remplacement par YAZ aura lieu le jour où était prévue l'injection suivante. Dans tous ces cas, il faudra utiliser en plus, durant les 7 premiers jours de la prise du comprimé filmé, une méthode de contraception non hormonale.
Après un avortement dans le 1er trimestre de la grossesse
La prise de YAZ peut débuter immédiatement. Des mesures contraceptives supplémentaires ne sont pas nécessaires dans ce cas.
Après un avortement au 2e trimestre de grossesse ou un accouchement
La décision quant à la (re)prise d'un CHC tel que YAZ après un avortement au 2e trimestre de grossesse ou un accouchement doit tenir compte du risque accru d'accidents thromboemboliques veineux pendant la période puerpérale (jusqu'à 12 semaines après l' accouchement ou l'avortement; cf. «Mises en garde et précautions»).
Dans tous les cas, après un accouchement ou un avortement au 2e trimestre de grossesse, la prise de YAZ doit débuter au plus tôt entre le 21e et le 28e jour. Si le traitement débute plus tard, il est recommandé d'appliquer des méthodes contraceptives supplémentaires non hormonales durant les 7 premiers jours de la prise. Si des rapports sexuels ont eu lieu entre-temps, il convient d'exclure l'éventualité d'une grossesse ou d'attendre les premières règles avant de débuter le traitement.
Conduite à tenir en cas d'oubli de comprimé filmé
Si la patiente a oublié de prendre son comprimé filmé quotidien à l'heure habituelle et qu'elle s'en rend compte dans les 12 heures, elle devra prendre le comprimé filmé immédiatement. Les comprimés filmés suivants seront à nouveau pris à l'heure habituelle. L'efficacité du contraceptif n'est alors pas altérée.
Si l'heure de prise habituelle est outrepassée de plus de 12 heures, l'efficacité du contraceptif oral pourra être réduite.
Les deux règles de base suivantes sont applicables dans les oublis de prise du médicament:
1.La prise ne doit pas être interrompue pendant plus de 7 jours (un intervalle sans hormones de 4 jours est recommandé).
2.Une prise régulière sur au moins 7 jours est nécessaire pour freiner efficacement l'axe hypothalamo-hypophyso-ovarien.
Selon la semaine de prise, on procédera donc de la manière suivante:
1er au 7e jour
La patiente devra prendre le comprimé filmé oublié sitôt qu'elle se rend compte de l'oubli, même si elle doit, de ce fait, prendre 2 comprimés filmés le même jour. Elle devra continuer à prendre quotidiennement les comprimés filmés suivants à l'heure habituelle. Pendant les 7 jours suivants, il lui faudra recourir en plus à une méthode de contraception non hormonale. S'il y a eu des rapports sexuels dans les 7 jours précédents, il faudra prendre en considération l'éventualité d'une grossesse. Plus le nombre de comprimés filmés oubliés est important et plus ces oublis sont proches de l'intervalle placebo, plus le risque d'une grossesse est grand.
8e au 14e jour
La patiente devra prendre le comprimé filmé oublié sitôt qu'elle se rend compte de l'oubli, même si elle doit, de ce fait, prendre 2 comprimés filmés le même jour. Elle devra continuer à prendre quotidiennement les comprimés filmés suivants à l'heure habituelle. Aucune mesure contraceptive supplémentaire n'est nécessaire, à condition que la prise ait été régulière pendant les 7 jours précédents. Dans le cas contraire ou si plus d'un comprimé filmé a été oublié, il lui faudra utiliser en plus une méthode de contraception non hormonale durant les 7 jours suivants.
15e au 24e jour
Il y a un risque accru de grossesse dû à la proximité de l'intervalle placebo. Pour autant que la prise de YAZ ait été régulière pendant les 7 jours précédents, la femme pourra choisir une des deux possibilités suivantes sans avoir à utiliser de méthode contraceptive supplémentaire. Sinon, elle devra suivre la première des deux possibilités et utiliser une méthode contraceptive supplémentaire non hormonale pendant les 7 jours suivants.
La patiente devra prendre le comprimé filmé oublié sitôt qu'elle se rend compte de son oubli, même si elle doit, de ce fait, prendre 2 comprimés filmés le même jour. Elle devra continuer à prendre quotidiennement tous les comprimés filmés actifs suivants à l'heure habituelle. Les 4 comprimés filmés de placebo de la dernière rangée ne seront pas pris. Elle commencera la prise de la plaquette suivante immédiatement après avoir pris le dernier comprimé filmé actif. Il est improbable qu'une hémorragie de privation se produise avant la fin de la 2e plaquette, mais de petites pertes sanglantes (spotting) ou des métrorragies pourront se produire plus fréquemment.Ou
La patiente cessera de prendre les comprimés filmés de la plaquette en cours. Il faut jeter la plaquette (blister). Après une pause de 4 jours au maximum (le jour de l'oubli du comprimé filmé compris), la patiente commencera la plaquette suivante.
Si l'hémorragie de privation ne se produit pas au cours du prochain intervalle de placebo, il faudra prendre en compte I'éventualité d'une grossesse.
Conduite à tenir en cas de troubles gastro-intestinaux
En cas d'affections gastro-intestinales sévères – quelle que soit leur cause (c.-à-d. aussi en cas de diarrhée d'origine médicamenteuse, etc.) – l'absorption est probablement incomplète et il faut utiliser des méthodes contraceptives supplémentaires.
En cas de vomissements dans les 3 à 4 heures suivant la prise d'un comprimé filmé actif, se conformer aux règles de base mentionnées au paragraphe «Conduite à tenir en cas d'oubli de prise du comprimé filmé». Afin que le schéma habituel de la prise puisse être conservé, la patiente devra prendre le comprimé filmé supplémentaire d'une plaquette de réserve.
Décalage de la menstruation
Report de la menstruation (allongement du cycle)
La patiente prendra les comprimés filmés de la plaquette suivante sans absorber les 4 comprimés filmés de placebo. Elle pourra retarder ainsi ses règles aussi longtemps qu'elle le désire (mais au maximum jusqu'à la fin des comprimés filmés actifs de la deuxième plaquette). Pendant cette période, des petites pertes sanglantes (spotting) ou des métrorragies pourront se produire. La prise régulière de YAZ sera ensuite poursuivie à l'issue de la phase de placebo habituelle.
Avance de la menstruation
La patiente peut avancer le début de ses règles à un autre jour de la semaine en abrégeant, selon son désir, la phase de placebo. Plus cette phase sera longue, moins une hémorragie de privation sera probable et plus les petites pertes sanglantes (spotting) ou les métrorragies pendant la prise de la plaquette suivante seront fréquents (comme lors d'un report des règles).
Conduite à tenir en cas d'irrégularité menstruelles
Comme c'est le cas pour tous les CHC, des saignements irréguliers (spotting ou métrorragies) pourront se produire, surtout pendant les premiers mois d'utilisation. C'est pourquoi un bilan diagnostique visant à rechercher la cause de saignements irréguliers ne se justifie qu'après une période d'adaptation de 3 cycles environ. La prise de YAZ doit être poursuivie. Le cas échéant, on pourra envisager le remplacement par une préparation plus fortement dosée en estrogène.
Si ces irrégularités se poursuivent ou si des saignements irréguliers apparaissent pour la première fois après plusieurs cycles de saignements réguliers, il faudra également prendre en considération des causes non hormonales. Il est recommandé de recourir à des méthodes diagnostiques appropriées en vue d'exclure la possibilité d'une grossesse ou d'une affection maligne. Ces méthodes peuvent inclure un curetage.
L'hémorragie de privation pourra faire défaut au cours de la prise de comprimés filmés placebo (comprimés filmés blancs). Une grossesse est improbable si le CHC a été utilisé selon la posologie prescrite. Si toutefois le CHC n'a pas été utilisé conformément aux prescriptions avant l'absence de la première hémorragie de privation, ou en l'absence de deux hémorragies de privation, il faudra exclure l'éventualité d'une grossesse avant de poursuivre l'utilisation de YAZ.
Instructions posologiques particulières
Enfants et adolescents
L'efficacité et la sécurité de YAZ ont été examinées chez des femmes âgées de 18 ans et plus. Chez les adolescentes (si indiquée), la posologie recommandée de YAZ est la même que chez les adultes.
Patientes âgées
YAZ n'est pas recommandé après la ménopause.
Patientes présentant des troubles de la fonction hépatique
YAZ ne doit pas être utilisée chez les femmes avec une insuffisance hépatique sévère. Voir aussi «Contre-indications».
Patientes présentant des troubles de la fonction rénale
YAZ est contre-indiqué chez les femmes atteintes d'insuffisance rénale sévère ou d'insuffisance rénale aiguë (voir aussi «Contre-indications»). La kaliémie doit être surveillée chez les femmes souffrant d'insuffisance rénale légère à modérée.
Contre-indications
·Présence ou risque de thromboembolie veineuse (TEV)
·thromboembolie veineuse (patiente traitée par des anticoagulants) ou antécédents de TEV (p.ex. thrombose veineuse profonde ou embolie pulmonaire);
·facteurs de risque majeurs de thromboembolie veineuse tels qu'une prédisposition connue, héréditaire ou acquise, telle qu'une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S;
·présence simultanée de multiples facteurs de risque de thromboembolie veineuse, selon la rubrique «Mises en garde et précautions».
·présence ou risque de thromboembolie artérielle (TEA)
·thromboembolie artérielle, antécédents de TEA ou prodromes de TEA (p.ex. angine de poitrine, infarctus du myocarde, accident ischémique transitoire, accident vasculaire cérébral);
·facteurs de risque majeurs de TEA comme
·diabète avec complications vasculaires
·hypertension artérielle sévère
·dyslipoprotéinémie sévère
·antécédents de migraine avec signes neurologiques focaux
·prédisposition héréditaire ou acquise à la TEA, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique)
·présence simultanée de multiples facteurs de risque de TEA, selon la rubrique «Mises en garde et précautions».
·affection hépatique sévère ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques;
·utilisation concomitante avec l'association des principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, glécaprévir/pibrentasvir et sofosbuvir/velpatasvir/voxilaprévir (médicament pour le traitement de l'hépatite C) (voir «Mises en garde et précautions» et «Interactions»);
·tumeur hépatique (bénigne ou maligne) ou antécédent de tumeur hépatique;
·insuffisance rénale sévère ou aiguë;
·existence ou suspicion d'une pathologie maligne dépendante des hormones sexuelles au niveau de l'appareil génital et du sein;
·saignements vaginaux d'origine inconnue;
·grossesse confirmée ou suspicion de grossesse;
·hypersensibilité au principe actif ou à l'un des excipients de YAZ.
Mises en garde et précautions
Le risque de thromboembolie veineuse (TEV) et de thromboembolie artérielle (TEA) est augmenté chez les femmes utilisant un CHC par rapport à celles qui n'en utilisent pas. Les mises en garde et précautions décrites ci-après doivent être prises en considération avant toute prescription (cf. «Risque de thromboembolie veineuse [TEV]» et «Risque de thromboembolie artérielle [TEA]»). Il est en outre important d'informer la patiente des risques d'accidents thromboemboliques veineux et artériels, des facteurs connus de risques vasculaires et en particulier des symptômes de TEV et de TEA ainsi que des mesures à prendre en présence de ces symptômes et de suspicion de thrombose (cf. «Les symptômes d'une TEV [thrombose veineuse profonde et embolie pulmonaire]» et «Les symptômes d'une TEA»).
Avant de prescrire YAZ, les bénéfices associés à son utilisation doivent être évalués par rapport aux maladies/risques détaillés ci-dessous. Le degré de gravité de chaque facteur individuel ainsi que la présence concomitante de plusieurs facteurs de risque doivent être pris en compte et discutés avec la patiente (cf. également «Contre-indications»). La patiente doit en outre être invitée à lire attentivement la notice d'emballage et à suivre les conseils qui y figurent.
Examen médical
Avant le début ou le renouvellement de l'utilisation d'un CHC tel que YAZ, il est nécessaire de procéder à une anamnèse personnelle et familiale minutieuse ainsi qu'à un examen général et gynécologique approfondi en prenant en compte les «Contre-indications» et les «Mises en garde et précautions» afin de dépister les affections nécessitant un traitement ainsi que les états à risque, et de pouvoir exclure l'éventualité d'une grossesse. Ces examens comprennent généralement une mesure de la tension artérielle, un examen des seins, de l'abdomen et des organes pelviens (avec frottis cytologique du col) et les examens de laboratoire appropriés.
Les examens doivent être répétés à intervalle régulier pendant la durée d'utilisation des CHC. Le type et la fréquence d'examen doivent toutefois être déterminés individuellement et se référer aux directives de la Société suisse de gynécologie et d'obstétrique (SSGO). Les contre-indications (p.ex. accident ischémique transitoire) et les facteurs de risque (p.ex. anamnèse familiale de thrombose veineuse ou artérielle; voir «Facteurs de risque de TEV» et «Facteurs de risque de TEA») peuvent apparaître pour la première fois en cours d'utilisation d'un CHC et doivent dès lors être recherchés lors de chaque contrôle.
Motifs imposant l'arrêt immédiat de la prise du médicament
La patiente doit être informée qu'en cas d'apparition de l'une des contre-indications précitées ou de l'une des situations suivantes, il lui faut consulter au plus vite un médecin, qui décidera de la poursuite ou de l'arrêt de l'utilisation du CHC:
·Première apparition ou exacerbation de maux de tête de type migraineux ou survenue plus fréquente de maux de tête d'une intensité inhabituelle;
·troubles visuels, auditifs ou de l'élocution ou autres troubles de la perception d'apparition soudaine;
·dès les premiers signes d'événements thromboemboliques (voir «Symptômes de TEV [thrombose veineuse profonde et embolie pulmonaire]» et «Symptômes de TEA»);
·4 semaines au moins avant une intervention chirurgicale programmée et pendant une immobilisation (p.ex. à la suite d'un accident ou d'une opération);
·augmentation cliniquement pertinente de la tension artérielle (lors de mesures répétées);
·apparition d'ictère, d'hépatite, de prurit généralisé;
·fortes douleurs épigastriques ou hépatomégalie;
·états dépressifs sévères;
·grossesse existante ou présumée.
Risque de thromboembolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes utilisant un CHC par rapport à celles qui n'en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque de TEV le plus faible. Le risque de TEV associé aux autres CHC, tels que YAZ, peut être jusqu'à deux fois plus élevé.
La décision de prendre le médicament doit être prise uniquement après un entretien approfondi avec la patiente, afin de s'assurer qu'elle comprend:
·Le risque de TEV associé à la prise de YAZ.
·Comment ses facteurs de risque personnels préexistants influent sur ce risque?
·Le risque plus élevé de développer une TEV pendant la première année d'utilisation (et en particulier pendant les 3 premiers mois).
·Les données disponibles indiquent que le risque de TEV est accru aussi bien lors de la première utilisation d'un CHC que lors de la réutilisation du même ou d'un autre CHC après une interruption d'au moins 4 semaines ou plus.
·YAZ est un médicament. En cas d'accident ou d'intervention chirurgicale, la patiente doit informer les médecins traitants qu'elle prend YAZ.
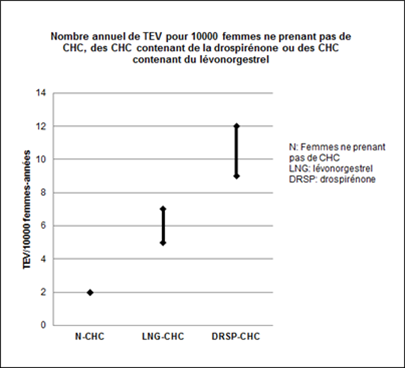
Environ 2 femmes sur 10'000 n'utilisant pas de CHC et qui ne sont pas enceintes développeront une TEV au cours d'une année. Le risque peut toutefois être considérablement plus élevé, selon les facteurs de risque individuels (voir ci-dessous).
À partir des données épidémiologiques, il est possible d'estimer que 9 à 12 femmes sur 10'000 utilisant un CHC contenant de la drospirénone développeront une TEV au cours d'une année. En comparaison, ce nombre est estimé à 5 à 7 par année pour 10'000 femmes utilisant un CHC contenant du lévonorgestrel.
Dans les deux cas, le nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2% des cas.
Très rarement, chez des utilisatrices de CHC, des cas de thrombose veineuse ont été signalés en dehors des membres, p.ex. thromboses des veines sinusales ou thromboses des veines hépatiques, mésentériques, rénales ou rétiniennes.
Facteurs de risque de TEV
Le risque de complications thromboemboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d'autres facteurs de risque sont présents, surtout s'ils sont multiples (voir le tableau ci-dessous). Lors de l'évaluation du rapport bénéfices/risques, il est important de prendre en considération l'augmentation particulière du risque d'accident thromboembolique veineux en présence de plusieurs facteurs de risques concomitants, augmentation qui peut être supérieure à la seule somme des risques pris individuellement. Dans ce cas, le risque global de TEV doit être pris en compte. YAZ est contre-indiqué chez les femmes présentant simultanément de multiples facteurs de risque qui les exposent globalement à un risque élevé de thrombose veineuse.
Tableau: Facteurs de risque de TEV
|
Facteur de risque |
Commentaire |
|
Obésité (indice de masse corporelle supérieur à 30 kg/m²) |
L'augmentation de l'IMC accroît considérablement le risque. |
|
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou la hanche, neurochirurgie ou traumatisme majeur |
Dans ces situations, il est conseillé de suspendre la prise des comprimés filmés (au moins quatre semaines à l'avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d'éviter une grossesse non désirée. |
|
Antécédents familiaux (chaque thromboembolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant la prise de YAZ. |
|
Autres affections médicales associées à un risque accru de TEV |
Lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique), drépanocytose, affection malignes |
|
Âge |
En particulier au-delà de 35 ans |
Remarque: l'immobilisation temporaire, y compris les trajets aériens >4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d'autres facteurs de risque.
Il n'existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l'apparition ou la progression d'une thrombose veineuse.
Le risque accru de thromboembolie pendant la période puerpérale doit être pris en compte. Certaines données indiquent en effet que le risque peut être encore augmenté jusqu'à 12 semaines après l'accouchement.
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
La patiente doit être informée qu'en cas d'apparition d'un ou de plusieurs de ces symptômes, elle doit consulter un médecin en urgence et indiquer au personnel médical qu'elle prend YAZ.
·Les symptômes de thrombose veineuse profonde des membres inférieurs peuvent inclure:
·gonflement unilatéral d'une jambe ou le long d'une veine de la jambe;
·sensation de tension ou douleur à une jambe, même si elle n'est ressentie qu'en position debout ou en marchant;
·sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
·Les symptômes de l'embolie pulmonaire peuvent inclure:
·difficulté respiratoire subite et inexpliquée, respiration rapide ou détresse respiratoire, intolérance à l'effort;
·toux d'apparition soudaine, éventuellement accompagnée d'expectorations sanglantes;
·douleur aiguë et soudaine dans la poitrine pouvant s'amplifier à la respiration profonde;
·obnubilation sévère, vertiges ou sensation d'angoisse;
·tachycardie ou arythmie.
Certains de ces symptômes (p.ex. «essoufflement» ou «toux») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d'événements fréquents ou moins sévères (infections respiratoires, p. ex.).
Risque de thromboembolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l'utilisation de contraceptifs hormonaux et l'augmentation du risque de thromboembolie artérielle (infarctus du myocarde, accident cérébrovasculaire ou accident ischémique transitoire). Avant de décider de prescrire YAZ, la patiente doit être informée de ce risque et, surtout, du fait que des facteurs de risque individuels préexistants sont susceptibles d'aggraver ce risque.
De très rares cas de thromboses dans d'autres vaisseaux sanguins (tels que les artères hépatiques, mésentériques, rénales ou rétiniennes) ont été observés chez les utilisatrices.
Facteurs de risque de TEA
Le risque de complications thromboemboliques artérielles ou d'accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir tableau). Lors de l'évaluation du rapport bénéfices/risques, il est important de prendre en considération l'augmentation particulière du risque d'accident thromboembolique artériel en présence de plusieurs facteurs de risques concomitants, augmentation qui peut être supérieure à la seule somme des risques pris individuellement. Dans ce cas, le risque global de TEA doit être pris en compte. YAZ est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle.
Tableau: Facteurs de risque de TEA
|
Facteur de risque |
Commentaire |
|
Âge |
En particulier au-delà de 35 ans |
|
Tabagisme |
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC comme YAZ. Une méthode de contraception différente doit être fortement conseillée aux femmes de plus de 35 ans qui continuent de fumer. |
|
Hypertension artérielle |
|
|
Diabète |
L'utilisation de CHC est contre-indiquée chez les femmes diabétiques qui présentent déjà des complications vasculaires. |
|
Dyslipoprotéinémie |
|
|
Valvulopathie cardiaque |
|
|
Fibrillation auriculaire |
|
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2) |
L'augmentation de l'IMC accroît considérablement le risque. |
|
Antécédents familiaux (thromboembolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans). |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant la prise de YAZ. |
|
Migraine |
L'accroissement de la fréquence ou de la sévérité des migraines lors de la prise de YAZ peut être le prodrome d'un événement cérébrovasculaire et constituer un motif d'arrêt immédiat de YAZ. |
|
Autres affections médicales associées à un risque accru de TEA |
Hyperhomocystéinémie, Lupus érythémateux disséminé, drépanocytose, affections malignes |
Symptômes de TEA
Les femmes doivent être informées qu'en cas d'apparition d'un ou de plusieurs de ces symptômes, elles doivent consulter un médecin en urgence et indiquer au personnel médical qu'elles prennent YAZ.
·Les symptômes d'un accident cérébrovasculaire peuvent inclure:
·perte soudaine de sensibilité ou de force au niveau du visage, d'un bras ou d'une jambe, touchant notamment une moitié du corps;
·confusion soudaine;
·élocution incompréhensible ou difficulté de compréhension;
·troubles subits de la vision d'un ou des deux yeux;
·troubles subits de la marche;
·vertiges;
·troubles de l'équilibre ou de la coordination;
·céphalées soudaines et sévères, ou de durée inhabituelle, de cause inconnue;
·perte de connaissance ou évanouissement avec ou sans épisode convulsif.
·Les symptômes de l'infarctus du myocarde peuvent inclure:
·douleurs, malaise, sensation de pression, sensation de pesanteur, sensation de serrement ou de tension dans la poitrine, le bras ou derrière le sternum;
·douleurs irradiant dans le dos, la mâchoire, le cou, le bras ou l'estomac;
·sensation de réplétion, troubles gastriques ou effort de vomissement;
·sueurs, nausées, vomissements ou vertiges;
·sensation de grande faiblesse, d'angoisse ou essoufflement;
·tachycardie ou arythmies.
·L'occlusion d'un vaisseau peut engendrer d'autres symptômes:
·douleur soudaine, tuméfaction ou cyanose discrète d'une extrémité;
·abdomen aigu.
Suspicion de prédisposition héréditaire ou acquise aux complications thromboemboliques
En cas de suspicion de prédisposition héréditaire ou acquise aux complications thromboemboliques, un examen de la coagulation sanguine doit être effectué par un spécialiste, qui peut le cas échéant demander une analyse de certains paramètres hémostatiques.
Maladies tumorales
Un risque augmenté de cancer du col de l'utérus a été rapporté lors d'une utilisation au long cours des CHC (>5 ans) dans quelques études épidémiologiques. Néanmoins, ceci est toujours en discussion de façon controversée dans la mesure où ce résultat est influencé par d'autres facteurs, comme une infection par des papillomavirus humains (HPV) (facteur de risque le plus puissant), par la fréquence de la participation au screening du col de l'utérus ou par le comportement sexuel.
Une méta-analyse de 54 études épidémiologiques a montré que le risque relatif (RR) de diagnostiquer un carcinome mammaire chez les femmes utilisant un CHC était faiblement augmenté (RR = 1.24). Ce risque diminue de manière continue après arrêt du CHC et n'est plus décelable après 10 ans. Le cancer du sein étant rare avant l'âge de 40 ans, le nombre supplémentaire de cancers du sein diagnostiqués chez les femmes qui utilisent, ou ont utilisé jusqu'à récemment, un CHC est faible par rapport au risque total de cancer du sein. Ces études ne fournissent aucun indice sur une éventuelle causalité. La hausse observée du risque peut être attribuée soit à un diagnostic plus précoce chez les utilisatrices de CHC, soit aux effets biologiques des CHC, soit à la combinaison de ces deux facteurs. Les cancers du sein avaient tendance à être moins avancés au moment du diagnostic chez les femmes ayant utilisé un CHC que chez celles qui n'avaient jamais utilisé de CHC.
Dans de rares cas, on a observé, suite à l'utilisation d'hormones sexuelles telles que celles contenues dans YAZ, des modifications hépatiques bénignes, plus rarement malignes, dont les complications pourraient être à l'origine d'hémorragies intra-abdominales mettant la vie en danger. Si des douleurs épigastriques intenses, une hépatomégalie ou les signes d'une hémorragie intra-abdominale aiguë apparaissent, il faudra inclure l'éventualité d'un hépatome dans le diagnostic différentiel.
Troubles dépressifs
Les dépressions ou humeurs dépressives sont des effets indésirables potentiels connus survenant lors de l'utilisation d'hormones sexuelles, y compris les contraceptifs hormonaux (voir également rubrique «Effets indésirables»). Ces troubles peuvent apparaître peu de temps après le début du traitement. Une dépression peut avoir une évolution grave et représente un facteur de risque de suicide ou de comportement suicidaire. Les utilisatrices de contraceptifs hormonaux doivent donc être informées des symptômes possibles des troubles dépressifs. Il est vivement conseillé d'aviser les utilisatrices de s'adresser immédiatement à un médecin si elles remarquent des variations d'humeur ou autres symptômes de dépression lors de l'utilisation du contraceptif. Les patientes présentant des antécédents de dépression sévère doivent être attentivement surveillées. Si des états dépressifs sévères réapparaissent lors de l'utilisation de YAZ, la prise du médicament doit être arrêtée.
Autres précautions
Les femmes utilisant un contraceptif hormonal ne doivent pas être traitées simultanément par des préparations à base de millepertuis (Hypericum), car celui-ci peut diminuer l'action contraceptive. Des saignements intermenstruels et des cas isolés de grossesses non désirées ont été rapportés (voir aussi «Interactions»).
La capacité d'élimination du potassium peut être limitée chez les patientes souffrant d'insuffisance rénale. Dans une étude clinique, la prise de drospirénone n'a pas eu d'effet sur la concentration sérique de potassium chez des patientes atteintes d'insuffisance rénale légère à modérée (voir «Propriétés/Effets»). Un risque théorique d'hyperkaliémie peut cependant être présumé chez les patientes souffrant d'insuffisance rénale et les femmes dont la concentration en potassium sérique se trouve dans la partie supérieure de la normale ainsi que celles traitées par des médicaments d'épargne potassique.
Chez les femmes atteintes d'hypertriglycéridémie ou ayant des antécédents familiaux d'hypertriglycéridémie, l'utilisation de CHC peut augmenter le risque de pancréatite.
Bien qu'une légère augmentation de la tension artérielle pendant l'utilisation de CHC ait été assez fréquemment rapportée, des valeurs élevées cliniquement significatives sont rares. L'effet antiminéralocorticoïde de la drospirénone s'oppose à l'augmentation de la pression artérielle favorisée par l'éthinylestradiol qui peut être observée chez des femmes normotensives utilisant d'autres CHC. Si l'utilisation du CHC conduit à une augmentation cliniquement significative de la tension artérielle (confirmée par des mesures répétées), l'utilisation du CHC devra être arrêtée. Dans les cas où l'indication semble justifiée, on pourra envisager la réutilisation d'un CHC, pour autant que la tension artérielle se soit normalisée (sous traitement).
L'utilisation de CHC peut entraîner une diminution de la tolérance au glucose. Les femmes diabétiques et celles ayant une tolérance au glucose réduite doivent donc toutes être attentivement surveillées, particulièrement au cours des premiers mois, lors de l'utilisation d'un CHC. Sauf exception, il n'existe toutefois aucune raison de modifier le traitement antidiabétique.
Des troubles aigus ou chroniques de la fonction hépatique peuvent imposer un arrêt du CHC, jusqu'à ce que les valeurs hépatiques se soient normalisées.
La récidive d'un ictère cholestatique apparu pour la première fois pendant une grossesse ou lors d'une prise antérieure d'hormones stéroïdiennes sexuelles, doit faire arrêter la prise du CHC.
Chez les patientes atteintes d'hépatite C et utilisant un CHC à base d'éthinylestradiol, une augmentation significativement plus fréquente de l'ALT (y compris les cas d'une augmentation de plus du quintuple, dans des cas isolés de plus de 20 fois la limite supérieure de la normale), que chez les patientes uniquement traitées par des principes antiviraux a été observée sous l'utilisation de l'association des principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir (voir «Interactions»). Des augmentations de l'ALT similaires ont également été observées sous les médicaments anti-VHC qui contenaient du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir. Par conséquent, YAZ doit être arrêté avant l'instauration d'un traitement par ces associations de principes actifs. À condition que les paramètres hépatiques soient normaux, la prise de YAZ peut être reprise au plus tôt 2 semaines, mieux encore 4 semaines, après l'arrêt des associations de principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir. Ce faisant, il faut tenir compte du fait que l'efficacité du CHC peut encore être entravée en cas d'intervalle de moins de 4 semaines en raison des propriétés inductrices des enzymes du ritonavir et, par conséquent, une méthode barrière supplémentaire doit être utilisée (voir rubrique «Interactions/Inducteurs enzymatiques»).
Les estrogènes peuvent augmenter la lithogénicité de la vésicule biliaire. Des cas de cholélithiase et d'autres affections de la vésicule biliaire (p.ex. cholécystite) ont été rapportés chez des femmes sous contraceptifs hormonaux.
Chez les femmes atteintes d'un angioœdème héréditaire et/ou acquis, des estrogènes exogènes peuvent induire ou aggraver les symptômes.
Les affections suivantes peuvent survenir ou être aggravées pendant la grossesse ou l'utilisation d'un CHC, même si les données actuellement disponibles ne permettent pas d'imputer une relation de causalité claire avec l'utilisation d'un CHC: ictère et/ou prurit cholestatique; cholélithiase; porphyrie; lupus érythémateux disséminé; syndrome hémolytique et urémique; chorée mineure; herpes gestationis; surdité due à une otosclérose. L'utilisation de CHC a en outre été associée à des cas de maladie de Crohn et de colite ulcéreuse.
Chez les femmes prédisposées, l'utilisation de CHC peut occasionnellement provoquer un chloasma, qui est encore renforcé par une exposition intense aux rayons solaires. Les femmes présentant une tendance au chloasma ne devraient donc pas s'exposer à des rayonnements UV importants.
Il faut informer les patientes que le CHC n'offre aucune protection contre les infections à VIH (SIDA) et autres maladies sexuellement transmissibles.
La prise régulière d'acide folique avant et pendant une grossesse contribue à prévenir les défauts de fermeture du tube neural (Spina bifida, anencéphalie). Hormis une alimentation riche en acide folique, une supplémentation continue de 0.4 mg par jour (p.ex. par une préparation polyvitaminée) est dès lors recommandée pour toutes les femmes à l'arrêt de la contraception hormonale s'il y a souhait ou possibilité de grossesse.
Chaque comprimé filmé rose et chaque comprimé filmé blanc contient du lactose. Les patientes présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne devraient pas prendre ce médicament.
Interactions
Afin de connaître les éventuelles interactions, il est recommandé de consulter également l'information professionnelle des médicaments co-administrés.
Influence d'autres substances sur la pharmacocinétique des contraceptifs hormonaux
Inducteurs enzymatiques
Des interactions peuvent survenir entre contraceptifs hormonaux et médicaments induisant les enzymes microsomales, ce qui peut conduire à une augmentation de la clairance des hormones sexuelles, à une diminution de l'effet contraceptif et à des saignements intermenstruels. Ceci vaut par exemple pour les barbituriques, le bosentan, la carbamazépine, le felbamate, le modafinil, l'oxcarbazépine, la phénytoïne, la primidone, la rifabutine, la rifampicine et le topiramate ainsi que pour les médicaments contenant du millepertuis (Hypericum perforatum).
Une induction enzymatique peut déjà être observée après quelques jours. L'induction enzymatique maximale est généralement atteinte au bout de 2 à 3 semaines et peut persister pendant 4 semaines ou plus après l'arrêt de ces médicaments. Les femmes traitées sur une courte période par un de ces médicaments doivent provisoirement utiliser une méthode de contraception non hormonale en complément au CHC ou choisir une autre méthode contraceptive. Une méthode de contraception mécanique doit être poursuivie pendant toute la prise concomitante des médicaments et encore pendant 28 jours après l'arrêt du traitement. Lorsque la prise concomitante d'un inducteur enzymatique dure au-delà de la fin de l'emballage du CHC, il faut passer immédiatement après la prise du dernier comprimé filmé contenant du principe actif à l'emballage suivant, c'est-à-dire qu'il ne faut pas prendre les 4 comprimés filmés placebo.
En cas de traitement de longue durée avec des médicaments qui entraînent une induction enzymatique hépatique, il convient d'utiliser des méthodes contraceptives non hormonales fiables.
On sait en outre que différents inhibiteurs de la protéase du VIH/VHC et inhibiteurs non nucléosidiques de la transcriptase inverse peuvent entraîner une baisse ou une augmentation des concentrations plasmatiques en estrogènes et progestatifs. Ces modifications peuvent être cliniquement significatives dans certains cas.
Les inhibiteurs des protéases en particulier, tels que le ritonavir ou le nelfinavir (y compris leurs associations) sont connus comme étant des inhibiteurs puissants du CYP3A4, mais en cas de co-administration avec des hormones stéroïdiennes, ils peuvent entraîner une induction enzymatique et provoquer une baisse des concentrations plasmatiques en estrogènes et progestatifs.
Inhibiteurs enzymatiques
Inhibiteurs forts et modérés du CYP3A comme les antifongiques azolés (p.ex. itraconazole, voriconazole, fluconazole), les macrolides (clarithromycine, érythromycine), diltiazem, vérapamil et le jus de pamplemousse peuvent augmenter les taux plasmatiques des estrogènes et/ou des progestatifs et entraîner des effets indésirables plus nombreux.
Dans une étude à doses multiples réalisée avec une association de drospirénone (3 mg/jour) et d'éthinylestradiol (0.02 mg/jour), l'administration concomitante de kétoconazole, un inhibiteur puissant du CYP3A4, a augmenté l'AUC (0-24h) de la drospirénone d'un facteur 2.68 (IC à 90%: 2.44, 2.95) et celle de l'éthinylestradiol d'un facteur 1.40 (IC à 90%: 1.31, 1.49).
Lorsqu'elles étaient administrées en même temps qu'un contraceptif hormonal combiné contenant 0.035 mg d'éthinylestradiol, des doses d'étoricoxibe comprises entre 60 et 120 mg/jour ont entraîné une multiplication des concentrations plasmatiques d'éthinylestradiol par un facteur situé entre 1.4 et 1.6. La pertinence clinique de ces modifications n'est pas connue.
Les inhibiteurs de l'HMG-CoA-réductase atorvastatine et rosuvastatine sont eux aussi susceptibles d'augmenter les concentrations plasmatiques des hormones sexuelles (augmentation d'environ 20 à 30% de l'AUC des composantes œstrogénique et progestative) et, dans certaines circonstances, d'accroître ainsi la survenue des effets indésirables.
Interférence avec le métabolisme entéro-hépatique
En cas de prise simultanée et sur une courte durée (jusqu'à 10 jours) d'antibiotiques qui n'interagissent pas avec le système enzymatique du CYP3A4, aucune interaction pharmacocinétique n'est à prévoir. Il est cependant nécessaire d'avertir la patiente que dans certains cas, la maladie (p.ex. maladie vénérienne) contre laquelle l'antibiotique est utilisé peut nécessiter en complément l'utilisation d'une méthode contraceptive mécanique.
En cas de co-médication de longue durée avec des antibiotiques (p.ex. en cas d'ostéomyélite ou de borréliose), les données d'interaction actuellement disponibles sont insuffisantes. Pour exclure avec certitude toute grossesse, il est dans de tels cas recommandé d'utiliser en complément une méthode contraceptive mécanique pendant la durée de l'antibiothérapie et pendant les 7 jours qui suivent la fin de ce traitement.
En cas d'apparition de diarrhées et/ou de vomissements sous traitement antibiotique, se référer aux indications dans le paragraphe «Comportement lors de troubles gastro-intestinaux» dans la rubrique «Posologie/Mode d'emploi».
Influence des contraceptifs hormonaux sur la pharmacocinétique d'autres médicaments
Les contraceptifs hormonaux peuvent, par différents mécanismes d'interaction, influer également sur la pharmacocinétique de certains autres médicaments: ils peuvent inhiber les enzymes hépatiques microsomaux ou induire la conjugaison hépatique, en particulier la glucuroconjugaison. Les concentrations plasmatiques ou tissulaires d'autres médicaments peuvent par conséquent être soit augmentées (p.ex. la cyclosporine) ou diminuées (p.ex. la lamotrigine, voir ci-dessous). Par ailleurs, l'effet pharmacologique des groupes médicamenteux suivants peut également être influencé: analgésiques, antidépresseurs, antidiabétiques, antimalariques, certaines benzodiazépines, certains béta-bloquants, corticostéroïdes et anticoagulants oraux. Les modifications des taux plasmatiques résultant de ces interactions ne sont pas toujours cliniquement pertinentes.
In vitro, l'éthinylestradiol a révélé une inhibition des CYP1A1, CYP1A2, CYP2C19, CYP3A4/5 et CYP2C8. Dans des études cliniques, l'utilisation d'un contraceptif contenant de l'éthinylestradiol a entraîné une augmentation modérée (p.ex. mélatonine et tizanidine) ou légère (p.ex. théophylline) des concentrations plasmatiques de substrats du CYP1A2, ainsi qu'une augmentation uniquement minime ou absente des concentrations plasmatiques de substrats du CYP3A4 (p.ex. midazolam).
In vitro, la drospirénone a entraîné une inhibition légère à modérée des enzymes CYP1A1, CYP2C9, CYP2C19 et CYP3A4 du cytochrome P450. Sur la base des résultats d'études cliniques d'interactions avec l'oméprazole, la simvastatine et le midazolam utilisés comme substrats marqueurs, une interaction entre 3 mg de drospirénone et le métabolisme d'autres médicaments, lié au cytochrome P450, est cependant improbable.
Lamotrigine
Une étude sur l'interaction avec la lamotrigine, un antiépileptique, et un contraceptif oral combiné (0.03 mg d'éthinylestradiol/0.15 mg de lévonorgestrel) a montré une hausse significative de la clairance de la lamotrigine et une diminution significative des taux plasmatiques de lamotrigine lorsque ces médicaments sont administrés en même temps. Une telle diminution des concentrations plasmatiques peut s'accompagner d'une réduction du contrôle des crises. On ignore cependant dans quelle mesure ces résultats sont transposables à d'autres contraceptifs combinés contenant un autre composant progestatif et/ou une autre dose d'estrogène. Mais on peut partir du principe que ces préparations présentent un profil d'interactions comparable.
Lors du commencement de la prise de YAZ, chez une patiente prenant de la lamotrigine, une adaptation de la dose de lamotrigine peut donc être nécessaire, et les concentrations de lamotrigine devraient être surveillées étroitement au début du traitement. En l'occurrence, il peut y avoir une hausse significative du taux de lamotrigine (selon les cas jusqu'à un niveau toxique) lors de l'arrêt de la prise du contraceptif hormonal (ainsi dans certains cas pendant la période de 4 jours sans utilisation).
Interactions pharmacodynamiques
La kaliémie devra être surveillée lors de la prise simultanée de YAZ et de médicaments qui augmentent les concentrations sériques de potassium (antagoniste des récepteurs de l'angiotensine II, diurétiques d'épargne potassique, antagonistes de l'aldostérone). En revanche, dans des études évaluant l'interaction de la drospirénone (en association avec l'estradiol) avec un inhibiteur de l'ECA ou un AINS (p.ex. indométacine), aucune différence cliniquement pertinente ou statistiquement significative n'a été mise en évidence au niveau des concentrations sériques de potassium.
Interactions au mécanisme inconnu
Dans des études cliniques, une augmentation de l'ALT significativement plus fréquente (y compris les cas d'une augmentation de plus du quintuple, dans des cas isolés de plus de 20 fois la limite supérieure de la normale [LSN]), que chez les patientes uniquement traitées par des principes antiviraux a été observée sous l'utilisation concomitante d'un CHC contenant de l'éthinylestradiol et de l'association des principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir utilisée dans le traitement des infections à VIH. Des augmentations de l'ALT similaires ont également été observées sous les médicaments anti-VHC qui contenaient du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir. Par conséquent, YAZ doit être arrêté avant l'instauration d'un traitement par une telle association antivirale (voir également «Contre-indications» et «Mises en garde et précautions»).
Grossesse, allaitement
Grossesse
La prise de YAZ est contre-indiquée pendant la grossesse. Il faut donc exclure toute grossesse avant le début de la prise. Si une grossesse survient ou est suspectée lors de la prise de YAZ, la prise du médicament doit être arrêtée immédiatement et le médecin consulté.
Des études expérimentales animales suggèrent des risques pour le fœtus (voir aussi «Données précliniques»).
La plupart des études épidémiologiques réalisées jusqu'ici n'ont toutefois montré aucun indice en faveur d'un effet embryotoxique ou tératogène lors de l'utilisation accidentelle de CHC pendant la grossesse.
Allaitement
Le médicament ne doit pas être pris pendant l'allaitement, car il peut réduire la production de lait et modifier sa qualité; d'autre part, de faibles concentrations du principe actif peuvent être mesurées dans le lait. Des méthodes de contraception non hormonales devront si possible être utilisées jusqu'à ce que la mère ait complètement cessé d'allaiter.
Concernant le risque d'événements thromboemboliques chez la mère pendant la période puerpérale, voir la rubrique «Mises en garde et précautions».
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude portant sur l'aptitude à la conduite et à l'utilisation de machines n'a été effectuée.
Effets indésirables
Les effets indésirables les plus graves en rapport avec l'utilisation de CHC sont décrits dans la rubrique «Mises en garde et précautions» (voir la rubrique). Les effets indésirables sérieux incluent en particulier des thromboembolies artérielles et veineuses.
Les effets indésirables les plus fréquemment rapportés sous YAZ sont des nausées, des douleurs mammaires et des irrégularités des règles. Ils sont observés chez ≥3% des utilisatrices.
La sécurité de YAZ a été évaluée dans des études cliniques totalisant n=3565 femmes. Les effets indésirables observés dans le cadre des études cliniques et de la surveillance postcommercialisation sont résumés ci-dessous par systèmes d'organes et par fréquence.
Les fréquences sont définies comme suit: fréquents (≥1/100 à <1/10); occasionnels (≥1/1000 à <1/100); rares (≥1/10 000 à <1/1000); fréquence indéterminée (la fréquence exacte ne peut être estimée essentiellement sur la base des rapports spontanés issus de la surveillance postcommercialisation).
Infections et infestations
Occasionnels: candidose vaginale.
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes)
Rares: néoplasies mammaires.
Affections du système immunitaire
Rares: réactions allergiques.
Troubles du métabolisme et de la nutrition
Occasionnels: modifications du poids.
Rares: modifications de l'appétit, hyperkaliémie, hyponatrémie.
Affections psychiatriques
Fréquents: instabilité émotionnelle, dépression/état dépressif.
Occasionnels: diminution de la libido/perte de la libido, troubles du sommeil.
Affections du système nerveux
Fréquents: céphalées, migraine.
Occasionnels: vertiges.
Affections cardiaques/Affections vasculaires
Rares: thromboembolie veineuse (p.ex. thrombose veineuse profonde, embolie pulmonaire), thromboembolie artérielle (p.ex. accident ischémique transitoire, accident vasculaire cérébral, infarctus du myocarde).
Affections gastro-intestinales
Fréquents: nausées.
Occasionnels: flatulences, douleurs abdominales, dyspepsie, vomissements, diarrhée.
Rares: constipation.
Affections hépatobiliaires
Rares: test anormal de la fonction hépatique.
Affections de la peau et du tissu sous-cutané
Occasionnels: acné, prurit, éruption cutanée.
Rares: sécheresse de la peau, alopécie, chloasma, hypertrichose.
Fréquence indéterminée: érythème polymorphe, érythème noueux.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: douleurs dorsales, crampes musculaires.
Affections des organes de reproduction et du sein
Fréquents: douleurs mammaires, irrégularités des règles (p.ex. métrorragie, ménorragie, hyperénorrhée).
Occasionnels: augmentation du volume du sein, seins fibrokystiques, dysménorrhée, pertes vaginales, sécheresse vaginale, douleurs du bas-ventre.
Rares: dyspareunie, polypes cervicaux, kystes ovariens.
Troubles généraux
Occasionnels: oedèmes, asthénie.
À part cela, les effets indésirables suivants ont été rapportés chez des utilisatrices d'autres CHC (cf. «Mises en garde et précautions»):
Infections urinaires, hypertriglycéridémie, modifications de la tolérance au glucose, nervosité, anxiété, agitation, agressivité, épilepsie, dégradation de l'ouïe en raison d'une otosclérose, hypertension, pancréatite (surtout chez des femmes présentant une hypertriglycéridémie), colite ulcéreuse, maladie de Crohn, troubles de la fonction hépatique, lithiase biliaire, ictère cholestatique, tumeurs du foie, porphyrie, syndrome hémolytique et urémique, hirsutisme, galactorrhée, dysplasie cervicale, aménorrhée, augmentation du volume de myomes utérins, aggravation d'un lupus érythémateux disséminé ou d'une chorée de Sydenham.
Un rapport causal avec l'utilisation de contraceptifs hormonaux n'est pas établi dans tous ces cas.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
On ne dispose pas d'expériences d'un surdosage par YAZ. Selon l'expérience avec des CHC, les symptômes d'un surdosage peuvent être les suivants: nausées, vomissements et saignements vaginaux. Ces derniers peuvent également survenir chez les jeunes filles avant la ménarche suite à la prise accidentelle du médicament.
Il n'existe pas d'antidote spécifique. Un traitement symptomatique est éventuellement requis.
Propriétés/Effets
Code ATC
G03AA12
Mécanisme d'action
YAZ contient une association d'éthinylestradiol et de drospirénone, un progestatif exerçant une action antiandrogène et antiminéralocorticoïde. La drospirénone n'exerce aucun effet de type androgène, estrogène, glucocorticoïde ou antiglucocorticoïde. Elle n'inhibe pas l'augmentation dépendante de l'éthinylestradiol de la SHBG (sex hormone-binding globulin), En tenant compte des propriétés antiminéralocorticoïdes et antiandrogènes, la drospirénone présente donc un profil biochimique et pharmacologique proche de celui de la progestérone naturelle.
Comme pour tous les contraceptifs hormonaux combinés (CHC), l'action contraceptive de YAZ repose sur différents facteurs dont les plus importants sont le blocage de l'ovulation et la modification de la glaire cervicale. En outre, l'endomètre offre des conditions défavorables à une nidation en raison des altérations morphologiques et enzymatiques qu'il subit. Enfin, du fait des modifications hormonales induites par le CHC, les cycles deviennent plus réguliers et les saignements moins abondants.
La drospirénone, qui est dotée d'une activité antiminéralocorticoïde, peut empêcher la rétention sodique liée au traitement par des estrogènes. Le traitement avec la drospirénone n'a toutefois pas montré d'influence cliniquement pertinente sur la concentration sérique du potassium chez les patients avec une fonction rénale réduite.
Dans une étude d'inhibition de l'ovulation sur 3 cycles, dans laquelle YAZ a été comparé à un COC donné pendant 21 jours selon un schéma conventionnel (éthinylestradiol 0.02 mg/drospirénone 3 mg), la prise de YAZ sur 24 jours a conduit à une inhibition plus importante de la maturation folliculaire.
Après oublis volontaires («missed pills») de doses pendant le 3e cycle de traitement, moins de femmes ont présenté une activité ovarienne, ovulations comprises («escape ovulations») avec YAZ qu'avec le schéma de prise de 21 jours (45% versus 70%).
Pharmacodynamique
Voir rubrique «Mécanisme d'action».
Efficacité clinique
Pour YAZ, le Pearl Index (PI) a été de 0.80 avec une limite supérieure de l'intervalle de confiance à 95% de 1.30.
En tenant compte uniquement des erreurs liées à la méthode elle-même (c'est-à-dire lors d'une prise correcte), l'indice de Pearl a été de 0.41 avec une limite supérieure de l'intervalle de confiance à 95% de 0.85.
Pharmacocinétique
Drospirénone
Absorption
Après administration orale, la drospirénone est rapidement et presque complètement absorbée. Des taux sériques maximaux de 38 ng/ml sont atteints dans un délai d'environ 1–2 heures après administration orale d'une dose unique. La biodisponibilité absolue est de 76–85%. La prise concomitante de nourriture à jeun n'influence pas la biodisponibilité, qui est identique à celle observée après la prise de drospirénone à jeun.
Distribution
La drospirénone est liée à 95–97%, et de manière non spécifique, à l'albumine sérique, et non à la SHBG (steroid hormone-binding globulin) ni à la CBG (corticoid binding-globulin). Seuls 3–5% de la concentration totale du produit se retrouvent sous forme de stéroïde libre dans le sérum. Le volume de distribution de la drospirénone est de 3.7–4.2 l/kg.
Conditions à l'état d'équilibre
La pharmacocinétique de la drospirénone n'est pas influencée par les concentrations de SHBG. Prise quotidiennement, la drospirénone a vu ses concentrations sériques multipliées par 2 à 3 et l'état d'équilibre a été atteint dans la deuxième moitié du cycle de traitement.
Métabolisme
La drospirénone est presque complètement métabolisée. Les principaux métabolites plasmatiques sont la forme acide de la drospirénone, formée par l'ouverture du cycle lactone, et le 4,5-dihydro-drospirénone-3-sulfate, formé par réduction puis sulfatation. La drospirénone est aussi soumise à un métabolisme oxydatif catalysé par le CYP3A4.
Aucune interaction n'a été constatée lors de l'administration simultanée de drospirénone et d'éthinylestradiol.
Élimination
Les taux sériques de drospirénone diminuent sur un mode biphasique, avec une demi-vie terminale d'env. 31 heures.
La clairance métabolique est d'env. 1.2–1.4 ml/min/kg. Seules des traces de drospirénone sont éliminées sous forme inchangée. Ses métabolites sont éliminés à raison de 54–58% par les fèces et de 42–46% par l'urine; leur demi-vie d'élimination est de l'ordre de 40 heures.
Cinétique pour certains groupes de patients
Troubles de la fonction rénale
À l'état d'équilibre, les taux sériques de drospirénone chez les femmes avec insuffisance rénale légère (clairance de la créatinine CLcr: 50–80 ml/min) étaient comparables aux valeurs mesurées dans le groupe à fonction rénale normale (CLcr >80 ml/min). Chez des femmes souffrant d'insuffisance rénale modérée (clairance de la créatinine CLcr: 30–50 ml/min), les taux sériques de drospirénone (AUC0–24 h) étaient en moyenne de 37% plus élevés que chez les femmes ayant une fonction rénale normale.
Troubles de la fonction hépatique
Chez les patientes présentant une insuffisance hépatique modérée, l'AUC de la drospirénone est multipliée par deux, la demi-vie terminale est augmentée d'un facteur 1,8 et la clairance réduite de 50%.
Groupes ethniques
L'étude pharmacocinétique de la drospirénone n'a fait apparaître aucune différence entre les femmes japonaises et caucasiennes.
Éthinylestradiol
Absorption
Après administration orale, l'éthinylestradiol est résorbé rapidement et complètement. Des taux sériques maximaux de 54–100 pg/ml sont atteints 1–2 heures après administration d'une dose unique. La biodisponibilité absolue est d'environ 45% (avec des variations de 20–65%) en raison d'un métabolisme présystémique (effet de premier passage) important.
Distribution
L'éthinylestradiol est lié très fortement, mais de manière non spécifique, à l'albumine (env. 98.5%) et induit une augmentation de la concentration sérique de la SHBG. Le volume de distribution est d'environ 2.8–8.6 l/kg.
Conditions à l'état d'équilibre
L'état d'équilibre est atteint dans la deuxième moitié du cycle de traitement, les concentrations sériques d'éthinylestradiol augmentant d'un facteur de 2.0–2.3.
Métabolisme
L'éthinylestradiol subit un métabolisme présystémique aussi bien dans la muqueuse de l'intestin grêle que dans le foie. Dans la muqueuse intestinale grêle, l'éthinylestradiol est conjugué et dans le foie, il est dégradé par un métabolisme de phase I (métabolites principaux: 2-hydroxy-éthinylestradiol et 2-méthoxy-éthinylestradiol) et une conjugaison. La CYP3A4 participe au métabolisme. L'éthinylestradiol et ses métabolites oxydatifs sont essentiellement métabolisés en dérivés glucuronoconjugués et sulfoconjugués.
Élimination
Les taux sériques d'éthinylestradiol diminuent de manière biphasique, avec une demi-vie terminale de 10–20 heures. La clairance totale est d'env. 2.3–7 ml/min/kg. L'éthinylestradiol est entièrement métabolisé et ses métabolites, qui sont éliminés seulement par les urines et la bile dans un rapport de 4:6, ont une demi-vie d'env. 24 heures. Les dérivés conjugués subissent une circulation entéro-hépatique.
Cinétique pour certains groupes de patients
On ne dispose pas de données sur la pharmacocinétique de l'éthinylestradiol chez des femmes atteintes d'insuffisance rénale ou hépatique.
L'étude pharmacocinétique de l'éthinylestradiol n'a fait apparaître aucune différence entre les femmes japonaises et caucasiennes.
Données précliniques
Des études précliniques sur la toxicité après des doses répétées, la génotoxicité et le potentiel carcinogène de contraceptifs oraux combinés n'ont pas démontré clairement de risque particulier pour l'être humain, bien que des études épidémiologiques aient démontré un risque accru de carcinome hépatique, observé surtout chez des patientes VHB- et VHC-négatives, non atteintes de cirrhose, qui utilisaient les contraceptifs combinés de longue date (>6 ans).
Chez l'animal, l'éthinylestradiol a déjà montré, à relativement faible dose, un effet létal pour les embryons qui est considéré comme spécifique à l'espèce; des malformations du tractus urogénital et une féminisation des fœtus mâles ont été observées. La transposition à l'être humain de ces résultats issus d'expérimentations animales est controversée.
Des études de toxicologie reproductive chez le rat, la souris et le lapin n'ont fourni aucun indice d'effet tératogène. Concernant les risques pour l'espèce humaine, voir «Grossesse, Allaitement».
Remarques particulières
Influence sur les méthodes de diagnostic
Les stéroïdes contraceptifs peuvent modifier les résultats de certains examens de laboratoire, tels que les paramètres biochimiques hépatiques et thyroïdiens, de la fonction cortico-surrénalienne et rénale, les taux plasmatiques des protéines de transport (p.ex. de la steroid hormone-binding globulin) et des fractions lipidiques ou lipoprotéiniques, les paramètres du métabolisme des hydrates de carbone et les paramètres de la coagulation sanguine et de la fibrinolyse. Ces modifications se situent en général dans les limites de la normale. La drospirénone peut influencer la concentration plasmatique de rénine et d'aldostérone.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30°C.
Conserver hors de portée des enfants.
Numéro d’autorisation
57946 (Swissmedic).
Présentation
Yaz cpr pell 1× 28. (B)
Yaz cpr pell 3× 28. (B)
Yaz cpr pell 6× 28. (B)
Titulaire de l’autorisation
Bayer (Schweiz) AG, 8045 Zurich.
Mise à jour de l’information
Août 2021.