Composition
Principes actifs
Virus de la rougeole (souche Schwarz) (vivant, atténué), virus des oreillons (souche RIT 4385) (vivant, atténué), virus de la rubéole (souche Wistar RA 27/3) (vivant, atténué), virus de la varicelle (souche OKA) (vivant, atténué).
Excipients
Poudre: Acides aminés (contenant 583 µg de phénylalanine), lactose, mannitol (E 421), sorbitol (E 420) 14 mg.
Solvant: eau pour préparations injectables.
Résidus provenant du procédé de fabrication
Sulfate de néomycine.
Indications/Possibilités d’emploi
Priorix-Tetra est indiqué pour l'immunisation active des personnes à partir de l'âge de 12 mois contre la rougeole, les oreillons, la rubéole et la varicelle.
Priorix-Tetra peut être administré à partir de l'âge de 9 mois dans des circonstances particulières (par ex. conformément aux recommandations nationales en matière de vaccination, dans des situations épidémiques ou lors de voyages dans une région où la prévalence de la rougeole est élevée). Dans ce cas, il faut cependant tenir compte du fait que les nourrissons durant la première année de vie peuvent ne pas répondre suffisamment aux composants du vaccin en raison d'éventuelles interférences avec les anticorps maternels. Chez ces enfants, une seconde dose de Priorix-Tetra devra être administrée 3 mois après la première dose (voir «Propriétés/Effets»).
Priorix-Tetra doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploi
Posologie usuelle
L'immunisation comprend deux doses de Priorix-Tetra. Il est préférable de respecter un intervalle minimal de 6 semaines entre les deux doses. Cet intervalle ne doit toutefois en aucun cas être inférieur à 4 semaines.
Comme alternative, une seule dose de Priorix-Tetra peut être administrée après l'immunisation avec une dose d'un autre vaccin rougeole-oreillons-rubéole ou rougeole-oreillons-rubéole-varicelle. Il faut ici tenir compte du fait qu'une dose de vaccin monovalent contre la varicelle devra être administrée, de préférence 6 à 12 semaines après la vaccination par Priorix-Tetra, aux personnes qui n'ont pas été vaccinés précédemment contre la varicelle, afin de renforcer la protection contre la varicelle (voir «Propriétés/Effets»).
Mode d'administration
Le vaccin est à injecter de préférence par voie sous-cutanée ou par voie intramusculaire dans la région deltoïde de la partie supérieure du bras ou dans la région antérolatérale de la cuisse.
Chez les personnes présentant des troubles hémorragiques (par exemple thrombocytopénie ou troubles de la coagulation), le vaccin doit être administré par voie sous-cutanée.
Pour les instructions concernant la reconstitution du vaccin avant administration, voir «Remarques particulières».
Contre-indications
Comme pour tous les autres vaccins, la vaccination avec Priorix-Tetra doit être reportée à un moment plus tardif en présence d'une affection aiguë s'accompagnant de fièvre élevée. Des infections légères ne constituent en général pas une contre-indication pour la vaccination.
Priorix-Tetra est contre-indiqué en cas d'hypersensibilité connue à l'un des composants du vaccin ou à la néomycine et chez les sujets ayant présenté des signes d'hypersensibilité lors d'une administration antérieure de vaccins contre la rougeole, les oreillons, la rubéole et/ou la varicelle. Un antécédent de dermatite de contact à la néomycine ne constitue pas une contre-indication. En ce qui concerne l'allergie aux protéines de l'œuf de poule, voir «Mises en garde et précautions».
Priorix-Tetra est contre-indiqué chez la femme enceinte. De plus, toute grossesse doit être évitée dans les trois mois qui suivent la vaccination (voir «Grossesse/Allaitement»).
Les sujets ayant une immunodéficience ne doivent pas être vaccinés par Priorix-Tetra. Cela s'applique également aux personnes souffrant de déficits immunitaires congénitaux ou acquis.
Mises en garde et précautions
Priorix-Tetra ne doit en aucun cas être administré par voie intravasculaire ou intradermique.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme pour tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et de possibilités de surveillance, pour le cas où surviendrait une réaction anaphylactique suite à l'administration du vaccin.
L'alcool ou tout autre désinfectant doit être complètement évaporé de la surface de la peau avant d'injecter le vaccin, car ces produits peuvent inactiver les virus atténués contenus dans le vaccin.
La vaccination d'enfants âgés de 9-11 mois peut ne pas donner une réponse immunitaire suffisante aux composants du vaccin en raison de la présence éventuelle d'anticorps maternels. Dans le cas où une situation épidémiologique requiert la vaccination de nourrissons de moins de 12 mois, une seconde dose du vaccin ROR-varicelle devra être administrée 3 mois après la première dose (voir «Propriétés/Effets»).
Convulsions fébriles
Dans les 5 à 12 jours après l'administration de la première dose de Priorix-Tetra, un risque plus élevé de fièvre et de convulsions fébriles a été observé comparé à l'administration concomitante des vaccins rougeole-oreillons-rubéole (ROR) et varicelle (voir «Effets indésirables» et «Propriétés/Effets»).
La vaccination d'enfants ayant des antécédents personnels ou familiaux de convulsions y compris convulsions fébriles doit être considérée avec prudence. Pour ces enfants, une vaccination séparée avec des vaccins ROR et varicelle doit être envisagée comme alternative pour la première dose (voir «Posologie/Mode d'emploi»). Dans tous les cas, les enfants doivent faire l'objet d'une surveillance particulière quant à la fièvre et aux convulsions fébriles pendant la période de risque.
De façon générale, des taux élevés de fièvre sont observés après l'administration de la première dose d'un vaccin contre la rougeole.
Les composants rougeole et oreillons du vaccin sont cultivés dans des cultures cellulaires d'embryons de poulet et peuvent donc contenir des traces de protéines d'œuf. Chez les sujets présentant des réactions anaphylactiques, anaphylactoïdes ou d'autres réactions de type immédiat (p.ex. urticaire généralisée, gonflement au niveau de la bouche et du pharynx, difficultés respiratoires, hypotension ou choc) après l'ingestion de protéines d'œuf de poule, le risque d'une réaction d'hypersensibilité de type immédiat est accru après la vaccination, bien que ces réactions n'aient été observées que très rarement. Les personnes ayant déjà subi une réaction d'hypersensibilité de type immédiat après l'ingestion de protéines d'œuf de poule doivent être vaccinées avec une prudence extrême. Un traitement adéquat doit être à disposition en cas d'apparition d'une réaction anaphylactique.
La prise de salicylés lors d'une varicelle sauvage ayant été mise en rapport avec la survenue d'un syndrome de Reye, il ne faut pas prendre de salicylés dans les 6 semaines suivant la vaccination par Priorix-Tetra.
Transmission
Une transmission des virus de la rougeole, des oreillons ou de la rubéole du sujet vacciné lors de contacts avec des personnes prédisposées n'a pas été décrite jusqu'à présent, bien que l'on sache que les virus de la rubéole sont éliminés avec la sécrétion pharyngienne dans les 7 à 28 jours après la vaccination, avec une excrétion maximale vers le 11ème jour. Il a été montré que dans de très rares cas, une transmission du virus vaccinal de la varicelle OKA de personnes vaccinées, qui développent une réaction cutanée, à des personnes de contact séronégatives peut se produire. Il a également été montré dans des cas isolés qu'une transmission du virus vaccinal de la varicelle OKA par des sujets vaccinés exempts d'éruption cutanée à des personnes de contact séronégatives, est possible. Les personnes vaccinées chez lesquelles une éruption cutanée varicelliforme est apparue doivent éviter tout contact avec les femmes enceintes et les personnes sensibles exposées à un haut risque de varicelle sévère (comme les patients ayant un déficit immunitaire congénital ou acquis) jusqu'à la disparition complète de l'éruption.
Comme pour tout vaccin, il est possible qu'une réponse immunitaire protectrice ne soit pas atteinte chez tous les sujets vaccinés.
Thrombocytopénie
Des cas d'aggravation de thrombocytopénie et des cas de récidives de thrombocytopénie chez des sujets ayant développé une thrombocytopénie après la première dose ont été rapportés après une vaccination par des vaccins vivants contre la rougeole, les oreillons et la rubéole. Dans de telles situations, une nouvelle vaccination par Priorix-Tetra n'est pas recommandée. La deuxième dose vaccinale pour l'immunisation contre la varicelle, si considérée nécessaire, doit être effectuée avec un vaccin monovalent contre la varicelle.
L'emploi de Priorix-Tetra chez des personnes ayant une infection à VIH asymptomatique n'a pas été étudié.
Très peu de rapports sont disponibles en ce qui concerne la varicelle disséminée avec une implication des organes internes après la vaccination avec la souche vaccinale de la varicelle OKA; ceux-ci concernaient en particulier, mais pas exclusivement, des personnes immunodéprimées. Dans des cas isolés, une issue fatale a été rapportée, malgré un traitement à base d'aciclovir.
Encéphalite
Après la mise sur le marché de vaccins contre la rougeole, les oreillons, la rubéole et la varicelle (vivants, atténués), y compris Priorix-Tetra, des cas d'encéphalite ont été rapportés. Des issues fatales ont été observées, notamment chez des personnes immunodéprimées (voir «Contre-indications»). Il faut indiquer aux personnes vaccinées ou aux parents/tuteurs légaux de faire immédiatement appel à une aide médicale si, après la vaccination, des symptômes pouvant évoquer une encéphalite apparaissent, p.ex. une perte de connaissance ou une diminution de la conscience, des crises convulsives ou une ataxie, en particulier en association avec de la fièvre et des céphalées.
Excipients
Le médicament contient 14 mg de sorbitol par dose de vaccin. Le vaccin ne doit pas être administré aux patients avec des problèmes héréditaires rares d'intolérance au fructose.
Ce médicament contient 583 microgrammes de phénylalanine par dose de vaccin. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie.
Interactions
Priorix-Tetra peut être administré simultanément, mais à différents sites d'injection, avec chacun des vaccins monovalents ou combinés suivants, y compris les vaccins hexavalents (DTPa-IPV-Hib-HBV): diphtérie-tétanos-coqueluche acellulaire (DTPa), Haemophilus influenza de type b (Hib), poliomyélite inactivée (IPV), hépatite B (HBV).
Il n'existe aucune donnée concernant l'utilisation concomitante de Priorix-Tetra avec d'autres vaccins.
Si un test tuberculinique doit être fait, il est impératif de le faire avant ou en même temps que la vaccination, car les vaccins vivants combinés contre la rougeole, les oreillons et la rubéole peuvent entraîner une diminution temporaire de la sensibilité tuberculinique de la peau. Cette diminution de la sensibilité cutanée pouvant persister jusqu'à 6 semaines au maximum, le test à la tuberculine ne doit pas être effectué pendant cette période post-vaccinale, afin d'éviter des résultats faussement négatifs.
Chez les personnes ayant reçu des immunoglobulines humaines ou une transfusion sanguine, la vaccination par Priorix-Tetra doit être différée d'au moins 3 mois, étant donné le risque d'échec vaccinal dû aux anticorps acquis de façon passive contre la rougeole, les oreillons, la rubéole et/ou la varicelle.
L'emploi de l'acide acétylsalicylique (AAS) au cours d'une varicelle sauvage a été mis en rapport avec l'apparition d'un syndrome de Reye. C'est pourquoi il ne faut pas utiliser de l'AAS jusqu'à 6 semaines après la vaccination par Priorix-Tetra.
Si Priorix-Tetra ne peut pas être administré en même temps que d'autres vaccins vivants atténués, un intervalle d'au moins un mois doit être respecté entre les vaccinations.
Grossesse, allaitement
Grossesse
La vaccination par Priorix-Tetra est contre-indiquée chez la femme enceinte. De plus, une grossesse doit être évitée dans les 3 mois qui suivent la vaccination.
Des études sur la toxicité de reproduction n'ont pas été effectuées en expérimentation animale.
Allaitement
Il n'existe pas de données suffisantes sur l'emploi de Priorix-Tetra pendant la période d'allaitement.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude relative aux effets de Priorix-Tetra sur l'aptitude à la conduite et l'utilisation de machines n'a été réalisée. Certains des effets indésirables décrits au chapitre «Effets indésirables» peuvent avoir une influence sur l'aptitude à la conduite et l'utilisation de machines. Voir «Effets indésirables».
Effets indésirables
Données d'études cliniques
Le profil de sécurité suivant se base sur les données obtenues avec plus de 6'700 doses qui ont été administrées à des enfants âgés de 9 à 27 mois. Les événements ont été recueillis de manière active dans le cadre d'études cliniques jusqu'à 42 jours après la vaccination.
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquent» (≥1/10), «fréquent» (≥1/100, <1/10), «occasionnel» (≥1/1'000, <1/100), «rare» (≥1/10'000, <1/1'000), «très rare» (<1/10'000).
Infections et infestations
Occasionnels: infections des voies respiratoires supérieures.
Rares: otite moyenne.
Affections hématologiques et du système lymphatique
Occasionnels: lymphadénopathie.
Troubles du métabolisme et de la nutrition
Occasionnels: inappétence.
Affections psychiatriques
Fréquents: irritabilité.
Occasionnels: cris, nervosité, insomnie.
Affections du système nerveux
Rares: convulsions fébriles* (voir aussi sous «Mises en garde et précautions»).
Affections respiratoires, thoraciques et médiastinales
Occasionnels: rhinite.
Rares: toux, bronchite.
Affections gastro-intestinales
Occasionnels: gonflement parotidien, diarrhée, vomissements.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée.
Troubles généraux et anomalies au site d'administration
Très fréquents: douleur au site d'injection (10,1%), rougeur au site d'injection (23,2%), fièvre (rectale ≥ 38°C - ≤ 39,5°C; axillaire/orale ≥ 37,5°C - ≤ 39°C) (35,8%)**.
Fréquents: gonflement au site d'injection, fièvre (rectale > 39,5°C; axillaire/orale >39,0°C)**.
Occasionnels: léthargie, malaise, lassitude.
* Dans le cadre d'une analyse rétrospective d'une banque de données, le risque de survenue de convulsions fébriles après l'administration de la première dose de Priorix-Tetra a été étudié en comparaison avec la vaccination avec un vaccin ROR ou l'administration concomitante des vaccins ROR et varicelle dans des membres différents chez des enfants âgés de 9 à 30 mois.
Dans l'étude, 82'656 enfants ont été vaccinés avec un vaccin ROR-varicelle et 149'259 enfants avec un vaccin ROR. Chez 39'203 enfants, les vaccins ROR et varicelle ont été administrés de façon concomitante.
En fonction de la définition de cas utilisée pour identifier les convulsions fébriles dans la période avec le plus fort risque (dans les 5 à 12 jours après la première dose), l'incidence de convulsions fébriles était de 2,18 (IC à 95%: 1,38; 3,45) ou 6,19 (IC à 95%: 4,71; 8,13) pour 10'000 enfants pour le groupe ROR-varicelle et de 0,49 (IC à 95%: 0,19; 1,25) ou 2,55 (IC à 95%: 1,67; 3,89) pour 10'000 enfants pour les cohortes de contrôle correspondantes.
Ces données indiquent que pour 5'882 ou 2'747 enfants vaccinés avec Priorix-Tetra un cas supplémentaire de convulsion fébrile survient, comparé aux cohortes de contrôle correspondantes qui ont reçu un vaccin ROR ou en même temps un vaccin ROR et un vaccin contre la varicelle (risque supplémentaire de 1,70 (IC à 95%: -1,86; 3,46) et 3,64 (IC à 95%: -6,11; 8,30) respectivement pour 10'000 enfants) (voir «Propriétés/Effets»).
** Des incidences de fièvre plus élevées (environ 1,5 fois) ont été observées après l'administration de la première dose du vaccin combiné ROR-varicelle comparée à l'administration simultanée du vaccin ROR et du vaccin contre la varicelle à des sites d'injection différents.
Aucune étude clinique n'a été réalisée avec Priorix-Tetra chez des personnes âgées de plus de 6 ans. Le profil de sécurité de Priorix-Tetra chez les personnes âgées de plus de 6 ans est déduit des données disponibles sur le vaccin ROR (Priorix) et le vaccin monovalent Oka contre la varicelle (Varilrix) de GlaxoSmithKline. Les fréquences des effets indésirables tels que fièvre, éruption cutanée, douleurs au site d'injection, gonflement au site d'injection et rougeur au site d'injection, rapportées chez les personnes âgées de plus de 6 ans ayant reçu Priorix ou Varilrix étaient comparables à celles observées chez les enfants âgés de moins de 6 ans ayant reçu Priorix-Tetra.
Effets indésirables identifiés après la mise sur le marché
Lors de la surveillance post-commercialisation, les réactions supplémentaires suivantes ont été signalées avec un vaccin rougeole-oreillons-rubéole et varicelle:
Infections et infestations
Rares: méningite, zona, syndrome semblable à la rougeole, syndrome semblable aux oreillons (y compris orchite, épididymite et parotidite).
Affections hématologiques et du système lymphatique
Rares: thrombocytopénie, purpura thrombocytopénique.
Affections du système immunitaire
Rares: réactions allergiques, y compris réactions anaphylactiques et anaphylactoïdes.
Affections du système nerveux
Rares: encéphalite (voir «Mises en garde et précautions»), accident vasculaire cérébral (dans certains cas avec la mise en évidence du virus vaccinal dans le vaisseau atteint), cérébellite, symptômes de type cérébellite (y compris des troubles transitoires de la locomotion et une ataxie transitoire), syndrome de Guillain-Barré, myélite transverse, névrite périphérique.
Affections vasculaires
Rares: vascularite (y compris purpura Schönlein-Henoch et syndrome de Kawasaki).
Affections de la peau et du tissu sous-cutané
Rares: érythème exsudatif multiforme, éruption semblable à la varicelle.
Affections musculo-squelettiques et du tissu conjonctif
Rares: arthralgie, arthrite.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Aucun cas de surdosage n'a été rapporté à ce jour.
Propriétés/Effets
Code ATC
J07BD54
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Efficacité et effectivité
L'efficacité des vaccins Oka contre la varicelle de GlaxoSmithKline (1 dose de Varilrix ou 2 doses de vaccin tétravalent rougeole-oreillons-rubéole-varicelle Priorix-Tetra administrées à un intervalle de 42 jours) a été évaluée dans la grande étude clinique OKA-H-179 (suivi OKAH-182 EXT 179:Y4-Y6-Y8-Y10), contrôlée contre traitement actif et réalisée dans plusieurs pays, en comparaison avec 2 doses de vaccin rougeole-oreillons-rubéole sans composante varicelle données à un intervalle de 42 jours. Différents critères d'efficacité ont été utilisés pour le diagnostic d'une varicelle manifeste. 5803 enfants ont participé à la phase A (vaccination à l'âge de 12-24 mois). 4580 enfants ont été inclus dans la phase B de suivi au long terme. 3298 enfants (56,8%) ont terminé la totalité de l'étude OKAH-182 EXT 179:Y4-Y6-Y8-Y10 d'une durée de 10 ans. Il n'était prévu aucune hypothèse statistique pour la phase B de l'étude, mais seulement des observations descriptives. Le diagnostic primaire reposait sur la déclaration d'une affection de type varicelle par les parents qui, en cas de confirmation prévue par l'investigateur, était suivie d'un examen par PCR. Des contacts téléphoniques avaient lieu tous les 6 mois. L'investigateur a tout d'abord évalué les varicelles supposées au niveau clinique. Les cas de varicelle supposés ont ensuite encore été évalués par un panel d'experts. De plus, une vérification directe de la présence du virus par PCR (Polymerase Chain Reaction) a été réalisée ainsi qu'une vérification de l'anamnèse quant à une exposition possible à la varicelle.
Dans la première analyse (cas confirmés de varicelle), la condition pour évaluer le succès de la vaccination contre la varicelle quelle que soit la sévérité et contre les cas de varicelle modérés à sévères était la mise en évidence définitive du virus par PCR et/ou la confirmation de l'exposition à la varicelle. Dans une deuxième analyse moins stricte (cas cliniques de varicelle), ont été considérés pour l'évaluation du succès de la vaccination tous les cas confirmés de varicelle mais aussi tous les cas de varicelle identifiés par le panel d'experts, indépendamment d'une confirmation par PCR ou d'une exposition dans l'anamnèse.
L'efficacité du vaccin pour prévenir les cas de varicelle confirmée quelle que soit la sévérité de la varicelle ainsi que les cas de varicelle confirmée modérée ou sévère a été démontrée après une période de suivi principale de 2 ans chez 5803 enfants vaccinés (durée médiane de 3,2 ans). Une efficacité durable a été observée durant les périodes de suivi au long terme de 6 ans (durée médiane de 6,4 ans) et de 10 ans (durée médiane de 9,8 ans, 3298 enfants ont participé entièrement à l'étude dans les 3 bras) de la même étude OKAH-182 EXT 179:Y4-Y6-Y8-Y10. Les résultats sont présentés dans le tableau ci-dessous.
|
Groupe |
Période de suivi |
Efficacité contre une varicelle confirmée, quelle que soit la sévérité |
Efficacité contre une varicelle confirmée modérée ou sévère |
|
Priorix-Tetra |
à 2 ans |
94,9% |
99,5% |
|
à 6 ans(1) |
95,0% |
99,0% | |
|
à 10 ans(1) |
95,4% |
99,1% | |
|
Vaccin varicelleux Oka monovalent |
à 2 ans |
65,4% |
90,7% |
|
à 6 ans(1) |
67,0% |
90,3% | |
|
à 10 ans(1) |
67,2% |
89,5% |
N=nombre de sujets inclus dans l'étude et vaccinés. Le suivi sur 10 ans a été réalisé chez 3298 enfants au total inclus dans les 3 bras (Priorix-Tetra, Varilrix, Priorix).
(1) analyse descriptive
Les données d'efficacité contre les cas cliniques de varicelle quelle que soit la sévérité de la varicelle ainsi que les cas cliniques de varicelle modérée ou sévère observés après une première période de suivi de 2 ans et après les périodes de suivi de 6 ans et de 10 ans sont présentées dans le tableau ci-dessous.
|
Groupe |
Période de suivi |
Efficacité contre une varicelle clinique, quelle que soit la sévérité |
Efficacité contre une varicelle clinique modérée ou sévère |
|
Priorix-Tetra |
à 2 ans |
92,5% |
99,3% |
|
à 6 ans(1) |
93,4% |
98,7% | |
|
à 10 ans(1) |
93,6% |
98,5% | |
|
Vaccin varicelleux Oka monovalent |
à 2 ans |
64,6% |
90,2% |
|
à 6 ans(1) |
66,2% |
89,8% | |
|
à 10 ans(1) |
66,3% |
89,0% |
N=nombre de sujets inclus dans chaque groupe. Le suivi sur 10 ans a été réalisé chez 3298 enfants au total inclus dans les 3 bras (Priorix-Tetra, Varilrix, Priorix).
(1) analyse descriptive
Ces données indiquent que l'administration de deux doses de Priorix-Tetra en comparaison à une dose unique aboutit à une meilleure efficacité et à une diminution des cas de varicelle chez les sujets antérieurement vaccinés. L'augmentation significative (26,3 fois) des anticorps contre la varicelle après la deuxième dose indique un effet booster. Des taux d'anticorps plus élevés ont également été observés pour les autres composants du vaccin après l'administration de deux doses; cette augmentation est de 1,5 fois pour les anticorps contre la rougeole jusqu'à 3,3 fois pour les anticorps contre les oreillons (dans le test de neutralisation).
L'efficacité de deux doses de Priorix-Tetra lors d'une épidémie de varicelle dans des crèches en Allemagne était de 91% (IC à 95%: 65;98) contre toute forme de maladie et 94% (IC à 95%: 54;99) contre les formes modérées.
Un certain effet protecteur contre la rougeole ou la varicelle peut être atteint chez les sujets qui reçoivent le vaccin dans les 72 heures suivant leur exposition au virus naturel.
Réponse immunitaire
Les taux de séroconversion (SC) et les GMC/GMT (Geometric Mean antibody Concentrations/Titres) suivants ont été obtenus avec une ou deux doses de Priorix-Tetra, administrées à environ 2'000 enfants antérieurement non vaccinés et âgés de 11 à 23 mois (les doses étaient administrées à 6 semaines d'intervalle):
|
Anticorps |
Après la 1ère dose |
Après la 2ème dose | ||
|
|
SC |
GMC/GMT |
SC |
GMC/GMT |
|
Rougeole |
96,4% |
3'184,5 |
99,1% |
4'828,6 |
|
Oreillons |
|
|
|
|
|
ELISA (231 U/mL) |
91,3% |
976,7 |
98,8% |
1'564,4 |
|
Neutralisation (1:28) |
95,4% |
147,0 |
99,4% |
478,4 |
|
Rubéole |
99,7% |
62,2 |
99,9% |
119,7 |
|
Varicelle |
97,2% |
97,5 |
99,8% |
2'587,8 |
ELISA: Enzyme Linked Immunosorbent Assay
IFA: Immunofluorescence Assay
Les taux de séroconversion et les GMC/GMT observés étaient comparables à ceux obtenus après la vaccination avec un vaccin monovalent contre la varicelle et un vaccin combiné rougeole-oreillons-rubéole.
Il n'existe pas d'études concernant la CMI (cell mediated immunity) après vaccination avec Priorix-Tetra (ROR-varicelle) en comparaison avec la vaccination avec un vaccin rougeole-oreillons-rubéole (Priorix) et une dose unitaire du vaccin contre la varicelle à un intervalle minimal de 4 semaines.
300 enfants sains âgés de 9 à 10 mois au moment de la première dose de vaccin ont été inclus dans une étude clinique en Asie (Singapour). 153 enfants ont reçu deux doses de Priorix-Tetra à un intervalle de trois mois et 147 ont reçu Priorix et Varilrix. Les taux de séroconversion et les GMC/GMT étaient similaires à ceux observés après une vaccination séparée avec le vaccin contre la varicelle et le vaccin rougeole-oreillons-rubéole de GlaxoSmithKline. Les taux de séroconversion après la première dose de Priorix-Tetra étaient comparables pour tous les antigènes, à l'exception de la rougeole, à ceux observés dans d'autres études cliniques chez des enfants âgés de 12 à 24 mois. Le taux de séroconversion pour la rougeole chez des enfants âgés de 9 à 10 mois après une dose de Priorix-Tetra était de 93,3% (IC 95%: 87,6; 96,9). La réponse immunitaire des enfants pendant leur première année de vie peut ne pas être suffisante en raison d'une interférence possible avec les anticorps maternels. Par conséquent, une seconde dose de Priorix-Tetra doit être administrée 3 mois après la première dose.
Aucune étude clinique visant à évaluer l'immunogénicité de Priorix-Tetra chez des personnes âgées de plus de 6 ans n'a été réalisée. L'immunogénicité de Priorix-Tetra chez les personnes âgées de plus de 6 ans est déduite des données disponibles pour Priorix et Varilrix.
Une étude comparative auprès de 328 enfants (âge moyen de 12 mois) auxquels Priorix-Tetra a été administré par voie i.m. ou par voie s.c. a montré que l'immunogénicité et le profil de sécurité sont similaires pour les deux voies d'administration. Des données sur l'injection intramusculaire de Priorix-Tetra chez l'adolescent et l'adulte ne sont pas disponibles.
Persistance de la réponse immunitaire contre la rougeole, les oreillons et la rubéole
Le tableau suivant présente, pour des enfants âgés de 12 à 22 mois qui ont reçu dans une étude clinique deux doses vaccinales de Priorix-Tetra (N = 2'489), les taux de séropositivité pour les anticorps anti-rougeole, anti-oreillons et anti-rubéole observés après des périodes de suivi de 2, 6 et 10 ans en termes d'enfants ayant des concentrations d'anticorps égales ou supérieures au seuil défini:
|
Période de suivi |
Anticorps | ||
|
Rougeole |
Oreillons |
Rubéole | |
|
À 2 ans |
99,1% |
90,5% |
100% |
|
À 6 ans |
99,0% |
90,5% |
99,8% |
|
À 10 ans |
98,5% |
90,0% |
97,7% |
ELISA: Enzyme Linked Immuno Sorbent Assay
Observation suite à la commercialisation (étude de sécurité)
Le risque de convulsions fébriles après la première dose de Priorix-Tetra a été étudié dans le cadre d'une analyse rétrospective d'une banque de données chez des enfants âgés de 9 à 30 mois (voir «Effets indésirables»).
Efficacité clinique
Voir sous «Pharmacodynamique».
Pharmacocinétique
L'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniques
Les études de toxicité chez l'animal après administration répétée n'ont fourni aucun indice de toxicité locale ou systémique du vaccin.
Remarques particulières
Incompatibilités
Priorix-Tetra ne doit pas être mélangé à d'autres vaccins, étant donné l'absence de données sur la compatibilité.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Il est recommandé d'utiliser le vaccin immédiatement après sa dissolution. Cependant, il a été montré que le vaccin reconstitué est stable pendant 8 heures lorsqu'il est conservé entre 2°C et 8°C.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. La chaîne du froid doit être respectée. Ne pas congeler!
Remarques concernant la manipulation
En raison de variations mineures du pH, la couleur du vaccin dissous peut varier de pêche clair à rose fuchsia. Après la reconstitution, des particules transparentes liées au produit peuvent être présentes. Ceci est normal et n'affecte pas l'efficacité du vaccin. Le vaccin reconstitué (dissous) doit être inspecté visuellement avant l'administration. Si le vaccin présente une coloration différente ou contient des particules autres que celles décrites, il ne doit pas être administré.
Instructions pour la reconstitution du vaccin avec le solvant contenu dans la seringue préremplie
Priorix-Tetra est reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon-ampoule contenant la poudre.
Pour fixer l'aiguille à la seringue, suivez les instructions ci-dessous. La seringue fournie avec Priorix-Tetra peut toutefois légèrement différer de la seringue illustrée (c.-à-d. sans filetage). Dans ce cas, l'aiguille ne doit pas être vissée pour être connectée à la seringue.
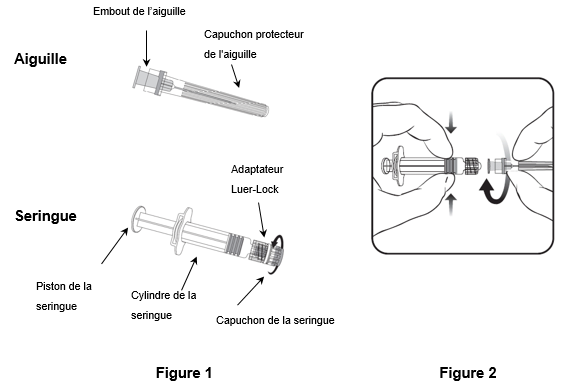
Tenez toujours la seringue par le cylindre. Ne tenez pas la seringue par le piston ou l'adaptateur Luer-Lock (ALL).
1. Tenez la seringue par le cylindre et retirez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre (comme illustré dans la figure 1).
2. Pour fixer l'aiguille à la seringue, introduisez prudemment l'embout de l'aiguille dans l'ALL et tournez l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit solidement fixée (comme illustré dans la figure 2). Veillez pendant cette opération à ce que l'aiguille soit dans l'axe de la seringue (comme illustré dans la figure 2). L'ALL risquerait sinon de se tordre et de ne plus être étanche. Si l'ALL se détache pendant la fixation de l'aiguille, il faut utiliser une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon-ampoule).
3. Retirez le capuchon protecteur de l'aiguille, qui peut parfois résister.
4. Ajoutez le solvant à la poudre. Puis agitez soigneusement le mélange jusqu'à ce que la poudre soit entièrement dissoute dans le solvant.
Le vaccin doit être administré immédiatement après la reconstitution.
5. Prélevez la totalité du contenu du flacon-ampoule dans la seringue.
6. Une nouvelle aiguille doit être utilisée pour l'administration du vaccin. Retirez l'aiguille de la seringue en la dévissant et fixez une aiguille d'injection en répétant l'étape 2.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la règlementation nationale.
Numéro d’autorisation
58158 (Swissmedic)
Présentation
Flacon-ampoule contenant une dose de vaccin lyophilisé et seringue préremplie contenant le solvant (aiguilles séparées) [B].
Titulaire de l’autorisation
GlaxoSmithKline AG, 6340 Baar
Mise à jour de l’information
Octobre 2025