Composition
Principes actifs : Glucose anhydre, chlorure de sodium, (S)-acide lactique, chlorure de calcium dihydraté, bicarbonate de sodium, chlorure de magnésium hexahydraté, chlorure de potassium
Excipients : Eau pour préparations injectables, dioxyde de carbone.
Forme galénique et quantité de principe actif par unité
Solution pour hémofiltration et hémodialyse.
Prismasol se présente dans une poche en polyoléfine à deux compartiments renfermant la solution d’électrolytes dans le petit compartiment A et la solution tampon dans le grand compartiment B.
La solution reconstituée prête à l’emploi est préparée en ouvrant la soudure entre les deux compartiments et en mélangeant les deux solutions.
Avant reconstitution
|
1000 ml de solution d’électrolytes (petit compartiment A) contiennent : |
Prismasol 4 mmol/l Potassium |
|
Chlorure de calcium dihydraté |
5,145 g |
|
Chlorure de magnésium hexahydraté |
2,033 g |
|
Glucose anhydre |
22,00 g |
|
(S)-Acide lactique (sous forme de solution d’acide lactique à 90% m/m) |
5,400 g |
|
1000 ml de solution tampon (grand compartiment B) contiennent : |
|
|
Chlorure de sodium |
6,45 g |
|
Chlorure de potassium |
0,314 g |
|
Bicarbonate de sodium |
3,090 g |
Après reconstitution
1000 ml de solution reconstituée prête à l’emploi contiennent :
|
|
Prismasol 4 mmol/l Potassium |
|
Chlorure de calcium dihydraté |
0.257 g |
|
Chlorure de magnésium hexahydraté |
0.102 g |
|
Glucose anhydre |
1.100 g |
|
(S)-Acide lactique (sous forme de solution d’acide lactique à 90% m/m) |
0.270 g |
|
Chlorure de sodium |
6,128 g |
|
Bicarbonate de sodium |
2.936 g |
|
Chlorure de potassium |
0.298 g |
|
Eau pour préparations injectables |
qs ad 1000ml |
Composition d’électrolyte
|
|
Prismasol 4 mmol/l Potassium | |
|
Calcium (Ca2+) |
1,75 mmol/l |
3,50 mEq/l |
|
Magnésium (Mg2+) |
0,5 mmol/l |
1,0 mEq/l |
|
Sodium (Na+) |
140 mmol/l |
140 mEq/l |
|
Chlorure (Cl-) |
113,5 mmol/l |
113,5 mEq/l |
|
Lactate |
3 mmol/l |
3 mEq/l |
|
Bicarbonate (HCO3-) |
32 mmol/l |
32 mEq/l |
|
Potassium (K+) |
4 mmol/l |
4 mEq/l |
|
Glucose |
6,1 mmol/l |
|
|
Osmolarité théorique |
301 mOsmol/l |
|
Un litre de solution prête à l’emploi se compose de 50 ml de solution d’électrolytes A et de 950 ml de solution tampon B.
pH de la solution prête à l’emploi: 7,0-8,5.
Indications/Possibilités d’emploi
Prismasol est utilisé dans le traitement de l’insuffisance rénale aiguë comme solution de substitution pour l’hémofiltration et l’hémodiafiltration, et comme solution de dialyse pour l’hémodialyse continue et l’hémodiafiltration continue.
Prismasol peut aussi être utilisée pour le traitement des empoisonnements dus à des substances dialysables ou filtrables.
Prismasol est indiqué pour les patients normokaliémiques ou en cas de risque d’hypokaliémie.
Posologie/Mode d’emploi
Posologie habituelle
Le débit d’administration de Prismasol dépend de la concentration sanguine d’électrolytes, de l’équilibre acido-basique, de l’équilibre hydrique et de l’état clinique général du patient.
Le volume de solution de substitution et/ou le volume de dialysat à administrer dépendent de l’intensité (dose) du traitement souhaité.
La dose, le débit de perfusion et le volume cumulatif doivent être définis uniquement par un médecin expérimenté dans les soins intensifs et les traitements d’épuration extra-rénale continue (EERC).
Adultes
Les débits usuels de solution de substitution pour l’hémofiltration et l’hémodiafiltration sont :
|
Adultes : |
500 - 3000 ml/h |
Les débits usuels de solution de dialyse (dialysat) pour l’hémodialyse continue et en hémodiafiltration continue sont :
|
Adultes : |
500 - 2500 ml/h |
Les débits usuels utilisés chez l’adulte sont approximativement de 2000 à 2500 ml/h et correspondent à un volume quotidien de liquide d’approximativement 48 à 60L.
Instructions posologiques particulières
Enfants et adolescents
Les débits usuels de solution de substitution pour l’hémofiltration et l’hémodiafiltration et de solution de dialyse (dialysat) en hémodialyse continue sont les suivantes :
Enfants (nouveau-nés à adolescents jusqu’à l’âge de 18 ans) : 1000 bis 2000 ml/h/1.73 m2
Il pourra être nécessaire d’utiliser des débits jusqu’ à 4000 ml/h/1,73 m2, notamment chez les jeunes enfants (≤ 10 kg). Le débit maximal utilisé (en ml/h) ne doit généralement pas dépasser le débit maximal utilisé chez les adultes.
Mode d’emploi
Voie intraveineuse et pour hémodialyse.
Prismasol, lorsqu'elle est utilisée en tant que solution de substitution, est administrée dans le circuit extracorporel en amont (pré dilution) ou en aval (post dilution) de l'hémofiltre ou de l’hémodiafiltre.
Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés.
Les contre-indications liées à la solution sont :
·Alcalose métabolique.
Contre-indications liées à l’hémofiltration ou l’hémodialyse
·Insuffisance rénale associée à un état d’hypercatabolisme prononcé, si les symptômes urémiques ne peuvent plus être corrigés par hémofiltration.
·Pression artérielle insuffisante au niveau des accès vasculaires.
·Anticoagulation systémique (risque hémorragique élevé).
Mises en garde et précautions
La solution doit seulement être utilisée par ou sous la responsabilité d’un médecin expérimenté dans le traitement de l’insuffisance rénale par hémofiltration, hémodiafiltration ou hémodialyse continue.
Avant et pendant toute la durée du traitement, l’état hémodynamique ainsi que l’équilibre hydrique, électrolytique et acido-basique du patient doivent être surveillés étroitement.
Une surveillance étroite du taux de potassium sérique est nécessaire afin que la concentration en potassium adéquate puisse être évaluée.
Lors de l’utilisation de Prismasol, il faut être attentif à l’apparition éventuelle d’une hyperkaliémie, en particulier si les facteurs de risque d’hypokaliémie ne persistent plus.
Prismasol doit être utilisé avec prudence chez les patients présentant une hyperkaliémie.
La concentration sérique en potassium doit être surveillée avant et pendant l’hémofiltration et/ou l’hémodialyse.
Prismasol contient du potassium.
Si une hyperkaliémie survient après le début du traitement, des sources supplémentaires de potassium influençant les concentrations sanguines devraient être évaluées.
Lorsque la solution est utilisée comme solution de substitution, le débit de perfusion doit être réduit jusqu’à l’obtention de la concentration de potassium souhaitée. Si l'hyperkaliémie persiste, interrompre immédiatement l’administration.
En cas d’apparition d’une hyperkaliémie pendant l’utilisation de Prismasol comme dialysat, l’administration d’un dialysat sans potassium pourra être nécessaire pour accroître l’élimination du potassium.
Chez les patients atteints d’hémorragies cérébrales récentes ou d’autres hémorragies récentes d’organes parenchymateux, il faut veiller avec un soin particulier à éviter une hypervolémie.
Une surveillance régulière du phosphate inorganique doit être effectuée. Il est possible d’ajouter à la solution jusqu’à 1,2 mmol/l de phosphate. En cas d’ajout de phosphate dans la poche, utiliser du phosphate de sodium. En cas d’hypophosphatémie, une supplémentation en phosphate inorganique doit être apportée.
L’état hémodynamique et l’équilibre hydrique du patient doivent être surveillés tout au long de la procédure.
·En cas d’hypervolémie, le débit net d’ultrafiltration prescrit pour l’équipement d’EERC peut être augmenté et/ou le débit d’administration d’autres solutions en tant que solution de substitution et/ou dialysat peut être réduit.
·En cas d’hypovolémie, le débit net d’ultrafiltration prescrit pour l’équipement d’EERC peut être réduit et/ou le débit d’administration d’autres solutions en tant que solution de substitution et/ou dialysat peut être augmenté.
Des solutions contenant du glucose dérivé d’amidon de maïs hydrolysé ne doivent pas être utilisée chez les patients ayant une allergie connue au maïs ou aux produits contenant du maïs.
L’administration doit être immédiatement stoppée en cas d’apparition de signe ou symptômes d’une éventuelle réaction d’hypersensibilité. Les mesures thérapeutiques appropriées doivent être instaurées selon l’état clinique du patient.
Etant donné que Prismasol contient du glucose et du lactate, une hyperglycémie peut survenir, en particulier chez les patients diabétiques. La glycémie doit être régulièrement surveillée. En cas d’hyperglycémie, l’administration d’une solution de substitution / dialysat sans glucose pourra être nécessaire. D’autres mesures correctives pourront être nécessaires pour maintenir la glycémie au niveau souhaité.
Un contrôle étroit de la glycémie est nécessaire, notamment chez les patients diabétiques.
En cas de déséquilibre hydrique (par ex. insuffisance cardiaque, traumatisme crânien), l’état clinique doit être surveillé attentivement et l’équilibre hydrique doit être restauré.
Prismasol contient de l’hydrogénocarbonate (bicarbonate) et du lactate (un précurseur du bicarbonate), qui peuvent influencer l’équilibre acido-basique du patient. Si une alcalose métabolique se développe ou s’aggrave pendant le traitement avec Prismasol, il faut réduire le débit d’administration ou interrompre l’administration.
L’utilisation d’une solution d’hémofiltration ou d’hémodialyse contaminée peut entraîner une septicémie, un état de choc et le décès du patient.
Interactions
Les taux plasmatiques des médicaments filtrables/dialysables peuvent être réduits au cours du traitement à cause de leur rétention par le filtre extracorporel. Des mesures correctives doivent être prises si nécessaire pour garantir les concentrations sanguines souhaitées des médicaments.
Des interactions avec d’autres médicaments liés à un déséquilibre de l’équilibre électrolytique ou acido-basique peuvent être évitées par un dosage approprié de la solution d’hémofiltration et d’hémodialyse ainsi qu’une surveillance étroite.
Cependant, les interactions suivantes peuvent se produire :
·Le risque d’une arythmie cardiaque induite par les digitaliques est augmenté en cas d’hypokaliémie. Le taux de potassium des patients traités par des digitaliques doit donc être surveillé particulièrement attentivement.
·La vitamine D et ses analogues ainsi que les médicaments contenant du calcium (p.ex. chlorure de calcium ou gluconate de calcium, utilisés pour l’homéostasie calcique) peuvent augmenter le risque d’hypercalcémie.
·Un ajout de bicarbonate de sodium p.ex. via les liquides d’EERC ou d’autres liquides ou de solutions tampon peut augmenter le risque d’alcalose métabolique.
·L’apport d’insuline peut renforcer une hypokaliémie.
·Le volume d’autres perfusions, par exemple dans le cadre d’une alimentation parentérale, doit être pris en compte dans le volume d’ultrafiltration et le volume de substitution afin d’éviter une déshydratation ou une hypervolémie.
·Lorsque du citrate est utilisé comme anticoagulant, il est inclus dans le volume total de tampon et peut réduire le taux plasmatique de calcium.
Grossesse/Allaitement
Il n’existe pas de données suffisantes concernant l’emploi de Prismasol pendant la grossesse ou l’allaitement. Prismasol ne doit être administré pendant la grossesse et l’allaitement qu’en cas de nécessité absolue.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Après une dialyse/hémofiltration/hémodiafiltration ambulatoire, on tiendra compte de l’état général du patient et des effets indésirables éventuels du traitement.
Effets indésirables
Des effets indésirables peuvent être dus à la solution ou au traitement lui-même. Les effets indésirables suivants ont été rapportés après la commercialisation :
Troubles du métabolisme et de la nutrition
Inconnu : Rétention liquidienne, déshydratation, déséquilibre électrolytique (p. ex. hypophosphatémie), hyperglycémie, troubles de l’équilibre acido-basique (p.ex. alcalose métabolique).
Affections vasculaires
Inconnu : hypotension*.
Affections gastro-intestinales
Inconnu : nausées*, vomissements*.
Affections musculosquelettiques et du tissu conjonctif
Inconnu : crampes musculaires*.
* Effets indésirables causés par le traitement par dialyse (hémofiltration et hémodialyse)
InvestigationsInconnu : augmentation des niveaux de calcium
Surdosage
Un surdosage n’est pas à craindre si la procédure est conduite correctement et si l’équilibre hydro-électrolytique et acido-basique du patient est surveillé attentivement.
Un surdosage peut avoir des conséquences graves comme une insuffisance cardiaque congestive ainsi que des troubles hydro-électrolytiques et acido-basiques.
En ce qui concerne la gestion de l’hypervolémie ou de l’hypovolémie voir la section Mises en garde et précautions.
En cas de déséquilibres électrolytiques et de déséquilibres acido-basiques (p.ex. alcalose métabolique, hypophosphatémie, hypokaliémie, etc.), interrompre immédiatement l’administration. Il n’existe aucun antidote spécifique au surdosage.
Ce risque peut être limité par une surveillance étroite pendant le traitement (voir Mises en garde et précautions).
Propriétés/Effets
Code ATC : B05ZB
Prismasol est pharmacologiquement inactif. Les ions sodium, calcium, magnésium, potassium et chlorure ainsi que le glucose contenus dans celui-ci sont présents à des concentrations physiologiques typiques du plasma.
La solution est utilisée pour substituer le liquide et les électrolytes éliminés durant l’hémofiltration ou l’hémodiafiltration ou pour servir de milieu d’échange au cours de l’hémodiafiltration continue ou de l’hémodialyse continue.
Le bicarbonate est utilisé en tant que tampon alcalinisant.
Pharmacocinétique
Non pertinent. Les principes actifs sont inactifs sur le plan pharmacologique et sont présents à des concentrations physiologiques typiques du plasma.
Données précliniques
Tous les composants de la solution sont des composants physiologiques du plasma animal et humain. Des effets toxiques ne sont pas à craindre aux doses thérapeutiques.
Remarques particulières
Incompatibilités
Aucune étude de compatibilité n’ayant été effectuée, ce médicament ne doit pas être mélangé à d’autres médicaments, à moins que la procédure et / ou le traitement du patient ne l’impose absolument.
Stabilité
Le médicament ne doit pas être utilisé audelà de la date figurant après la mention «EXP» sur l’emballage.
La stabilité physico-chimique de la solution prête à l’emploi a été démontrée pendant 24 heures à 22°C. Pour des raisons microbiologiques et chimiques, la préparation doit être utilisée immédiatement.
Toute autre condition et/ou tout autre délai de conservation relèvent de la responsabilité de l’utilisateur et le délai ne doit en aucun cas dépasser 24 heures, durée du traitement comprise.
Remarques concernant le stockage
Tenir hors de la vue et de la portée des enfants.
Ne pas conserver au-dessus de 30°C.
Ne pas conserver au-dessous de +4°C.
Remarques concernant la manipulation
Les remarques concernant la manipulation doivent être suivies attentivement.
Une technique aseptique rigoureuse doit être respectée lors de la connexion et de la déconnexion de tous les raccords de tubulures.
Utiliser uniquement avec des moniteurs de surveillance appropriés pour la thérapie d’épuration extra-rénale continue en circuit extracorporel.
La solution d’électrolytes doit être mélangée avec la solution tampon avant utilisation pour obtenir la solution finale prête à l’emploi pour l’hémofiltration, l’hémodiafiltration ou l’hémodialyse continue.
Prismasol peut être réchauffé à 37°C pour améliorer le confort du patient. Le réchauffement de la solution avant son utilisation doit être effectué avant la reconstitution, exclusivement avec une chaleur sèche. Ne pas réchauffer les solutions au bain-marie ou au four à micro-ondes.
Lors de l'utilisation du médicament sur le patient, une procédure aseptique stricte doit être suivie.
La solution doit être inspectée visuellement afin de détecter toute présence de particules ou de décoloration avant l’administration, si la solution et le contenant le permettent.
N’utiliser la solution que si elle est limpide et que le film de protection ainsi que toutes les soudures et fermetures sont intacts. Comprimez fermement la poche pour vérifier l’absence de fuite. Si une fuite est détectée, jeter immédiatement la solution puisque sa stérilité ne peut plus être garantie.
Avant de procéder au mélange, vérifier que les solutions sont limpides et que la poche est intacte. N’utiliser la solution que si elle est limpide.
Le grand compartiment comporte un site d’injection pour l’ajout éventuel d’autres médicaments nécessaires après la reconstitution de la solution.
Il est de la responsabilité du médecin traitant d’évaluer la compatibilité de l’ajout d’un autre médicament à Prismasol.
Il est possible que des additifs soient incompatibles. La notice d’utilisation du médicament ajouté, la littérature correspondante et l’information professionnelle doivent être préalablement consultées. Après l’ajout, la solution ne doit pas être utilisée si elle présente un changement de couleur et/ou un précipité, des complexes insolubles ou des cristaux.
Avant d’ajouter un principe actif ou un médicament, vérifier sa solubilité et sa stabilité dans Prismaol et s’assurer de l’adéquation du pH pour Prismasol (le pH de la solution prête à l’emploi doit être compris entre 7,0 et 8,5).
Bien mélanger la solution après l’ajout d’additifs.
L’introduction et le mélange d’additifs doivent toujours être effectués avant de connecter la poche de solution au circuit extracorporel.
Les médicaments compatibles ne doivent être ajoutés qu’à la solution prête à l’emploi et le mélange ainsi obtenu doit être administré immédiatement.
La solution d’électrolytes (petit compartiment A) est ajoutée à la solution tampon (grand compartiment B) en ouvrant la soudure de séparation, juste avant son administration au patient, de sorte à obtenir la solution reconstituée prête à l’emploi.
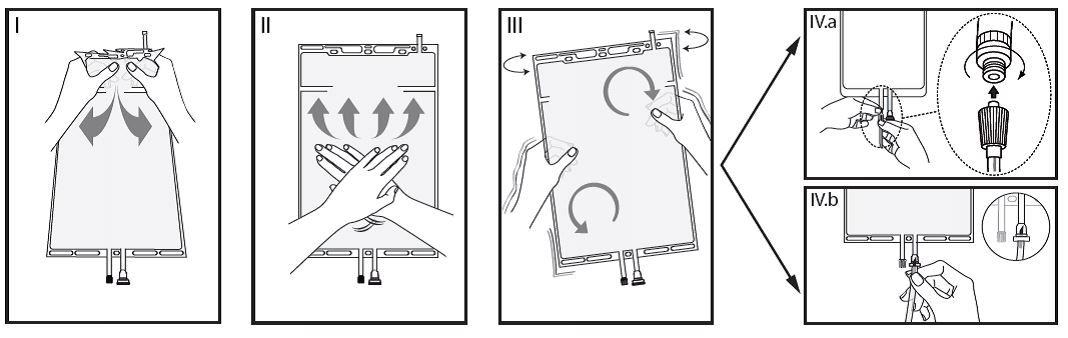
I Retirez l’emballage de protection de la poche immédiatement avant usage et mélangez les solutions dans les deux compartiments. Maintenez le petit compartiment A avec les deux mains et appuyez jusqu’à la formation d’une ouverture dans la soudure séparant les deux compartiments.
II Appuyez avec les deux mains sur le grand compartiment B jusqu’à l’ouverture complète de la soudure entre les deux compartiments.
III Assurez le mélange complet de la solution en secouant doucement la poche. La solution est maintenant prête à l’emploi est peut-être suspendue à l’appareil.
IV La ligne de dialyse ou de substitution peut être connectée à l’un des deux embouts de la poche.
IV.a Si l’embout Luer est utilisé, commencez par retirer le capuchon. Connectez l’embout Luer-Lock mâle de la ligne de dialyse ou de substitution sur l’embout femelle de la poche et serrez. Vérifiez que la connexion est solide et étanche. La connexion est à présent ouverte. Assurez-vous que le liquide peut s’écouler librement. Aussitôt que la ligne de dialyse ou de substitution est déconnectée de l’embout Luer, la connexion se ferme et l’écoulement libre de la solution s’arrête. Cette connexion est dépourvue d’aiguille et mobile.
IV.b Si le site d’injection est utilisé, enlevez tout d’abord le capuchon de protection. Enfoncez ensuite le perforateur dans la membrane en caoutchouc. Assurez-vous que la solution s’écoule librement.
La solution prête à l’emploi doit être utilisée immédiatement. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures suivant le mélange de la solution d’électrolytes dans la solution tampon, durée du traitement incluse.
À usage unique.
Ne pas utiliser si l’emballage est endommagé ou si la solution n’est pas limpide.
Jeter quantités de solution non utilisées.
Numéro d’autorisation
58609 (Swissmedic).
Présentation
Poche en polyoléfine à deux compartiments. La poche de 5000 ml se compose d’un petit compartiment A (250 ml) et d’un grand compartiment B (4750 ml). Les deux compartiments sont séparés par une soudure.
Le grand compartiment (B) comporte un site d’injection (ou perforateur) en polycarbonate qui peut être fermé par un disque en caoutchouc sous le capuchon de protection, et un embout Luer muni d’une valve en caoutchouc de silicone permettant de connecter la poche à une ligne de solution de substitution ou de dialyse adéquate.
La poche est emballée dans une enveloppe transparente en polymère multicouche.
Poche en polyoléfine avec valve : 2 x 5000 ml (B).
Titulaire de l’autorisation
Vantive GmbH, 8152 Opfikon
Mise à jour de l’information
Août 2018