Composition
Principe actif: Nonacogum gamma (Factor IX coagulationis humanus(ADNr))
Excipients: Natrii chloridum,, saccharum, calcii chloridum, mannitolum, histidinum, polysorbatum 80
Solvant: Aqua ad iniectabilia
Forme galénique et quantité de principe actif par unité
Lyophilisat et solvant pour injection intraveineuse.
Dose unique. Flacon avec 250 U.I., 500 U.I., 1000 U.I., 2000 U.I. ou 3000 U.I.
Après reconstitution avec 5 ml aqua ad iniectabilia livré, la concentration du produit diffère pour chaque puissance. Le tableau suivant indique la concentration approximative pour chaque dosage.
|
Dosage |
Concentration approximative du produit |
|
250 U.I./flacon |
50 U.I./ml |
|
500 U.I./flacon |
100 U.I./ml |
|
1000 U.I./flacon |
200 U.I./ml |
|
2000 U.I./flacon |
400 U.I./ml |
|
3000 U.I./flacon |
600 U.I./ml |
L’activité spécifique de RIXUBIS n’est pas inférieure à 200 U.I. facteur IX par mg. L’activité (U.I.) est déterminée à l’aide de l’épreuve de coagulation en une étape de la Pharmacopée
Européenne
Indications/possibilités d’emploi
RIXUBIS est indiqué pour le traitement et la prophylaxie des épisodes hémorragiques chez les patients atteints d’hémophilie B (déficit congénital en facteur IX)
Posologie/mode d’emploi
La thérapie doit être initiée sous surveillance d’un médecin expérimenté dans le traitement de l’hémophilie.
Posologie
·La posologie et la durée du traitement avec RIXUBIS dépendent de la sévérité du déficit en facteur IX, de la localisation et de l'importance de l'hémorragie, de l'état clinique et l’âge du patient ainsi que des paramètres pharmacocinétiques du facteur IX, tels que récupération et demi-vie.
·Pour s'assurer que le taux de facteur IX souhaité est atteint, il est nécessaire de surveiller attentivement le patient par le dosage de l'activité du facteur IX. Si nécessaire, la dose et la fréquence des injections peuvent être adaptées d’autant. L'apparition d'inhibiteurs du facteur IX doit être régulièrement surveillée chez les patients, si les activités plasmatiques de facteur IX ne sont pas atteintes ou si le saignement n'est pas maîtrisé après administration d'une dose adéquate (voir „Mises en garde et précautions“).
·L’activité du facteur IX recombinant (rFIX) exprimée en Unités Internationales est indiquée sur chaque flacon de RIXUBIS.
·La sécurité et l’efficacité de l‘’administration de RIXUBIS en perfusion continue n’a pas été prouvée.
La dose nécessaire pour le traitement de saignements est déterminée à l'aide de la formule suivante:
|
Nombre d’unités UI de facteur IX nécessaire |
= |
Poids corporel (en kg) |
x |
Augmentation souhaitée en facteur IX (% ou UI/dl) |
x |
Inverse de la récupération observée |
Patients de 12 ans et plus
Le calcul de la dose requise de RIXUBIS repose sur la découverte empirique du fait qu‘une Unité Internationale de rFIX par kg de poids corporel augmente le taux circulant en facteur IX de 0,9 UI/dl en moyenne (ET 0.5 – 1.4 UI/dl) chez les patients ≥ 12 ans. En conséquence la valeur moyenne de l‘inverse de la récupération observée demandée dans la formule ci-dessus est 1.1 dl/kg (ET 0.7 – 1.9 dl/kg).
Patients de moins de 12 ans
Le calcul de la dose requise de facteur IX repose sur la découverte empirique du fait qu‘une Unité Internationale de rFIX par kg de poids corporel augmente le taux circulant en facteur IX de 0.7 UI/dl en moyenne (ET 0.31 – 1.0 UI/dl) chez les patients <12 ans. En conséquence la valeur moyenne de l‘inverse de la récupération observée demandée dans la formule ci-dessus est de 1.4 dl/kg.
En raison de la diversité de différences individuelles de récupération, il est recommandé de calculer la dose nécessaire en prenant en compte la récupération individuelle du patient, déterminée à l'aide des activités successives du facteur IX.
Adapter la dose sous considération de la situation clinique du patient et de la pharmacocinétique individuelle, spécialement en termes de la récupération et de la demi-vie.
En cas des épisodes hémorragiques mettant en jeu le pronostic vital et d’interventions majeures, il est particulièrement important de surveiller soigneusement la thérapie.
En cas de survenue des épisodes hémorragiques suivants, l’activité du facteur IX ne doit pas diminuer en dessous des taux indiques (en % de la norme ou en UI/dl) pendant la période mentionnée. Le tableau suivant peut servir de guide pour la posologie en cas d’accidents hémorragiques et en chirurgie:
|
Degré d’hémorragie/Type de chirurgie |
Niveau plasmatique de facteur IX nécessaire (% ou UI/dl) |
Fréquence des injections (heures)/Durée du traitement (jours) |
|
Hémorragie | ||
|
Hémarthrose au stade précoce, hémorragie musculaire ou de la cavité buccale |
20 – 40 |
Répéter l’injection toutes les 24 heures, au moins un jour, jusqu’à l’arrêt de l’épisode hémorragique indiqué par la cessation de la douleur ou jusqu’à la cicatrisation |
|
Hémarthrose plus importante, hémorragie musculaire ou hématome |
30 – 60 |
Répéter l’injection toutes les 24 heures pendant 3 à 4 jours ou plus longtemps, jusqu’à la disparition de la douleur et de la gêne aiguë. |
|
Hémorragies menaçant le pronostic vital |
60 – 100 |
Répéter l’injection toutes les 8 à 24 heures jusqu’à l’arrêt du risque hémorragique, resp. jusqu’à la guérison. |
|
Chirurgie | ||
|
Mineure, y compris extraction dentaire |
30 – 60 |
Injection toutes les 24 heures, au moins 1 jour, jusqu’à la cicatrisation. |
|
Chirurgie majeure |
80 – 100 |
Répéter l’injection toutes les 8 à 24 heures jusqu’à cicatrisation satisfaisante puis continuer le traitement pendant au moins 7 jours afin de conserver une activité en facteur IX de 30% à 60% (UI/dl) |
Il est indispensable d’effectuer une surveillance précise du traitement substitutif, en particulier dans le cas d’interventions chirurgicales majeures ou d‘hémorragies menaçant le pronostic vitale.
Prophylaxie à long terme
RIXUBIS peut être administré dans le cadre d’une prophylaxie à long terme des épisodes hémorragiques chez les patients atteints d’hémophilie B sévère et moyennement sévère. La dose recommandée pour les patients préalablement traités (PTP) de 12 ans et plus est 40 à 60 UI/kg deux fois par semaine, pour les enfants de moins de 12 ans elle se situe entre 40 et 80 UI/kg deux fois par semaine.
Dépendant de l’âge du patient, phénotype de l’hémorragie et activité physique, des intervalles de dosage plus courts ou des doses plus élevées peuvent être nécessaires.
En raison de la diversité de différences individuelles de récupération, il est recommandé de calculer la dose nécessaire en prenant en compte la récupération individuelle du patient, déterminée à l'aide des activités successives du facteur IX.
La dose doit être adaptée en fonction de la situation clinique du patient et la pharmacocinétique individuelle, particulièrement de la récupération et la demi-vie.
Patients non préalablement traités
Il n’existe aucune expérience avec RIXUBIS pour des patients non préalablement traités avec des préparations contenant du facteur IX (Previously Untreated Patients, PUPs).
Patients âgés
Aucun patient âgé de 65 ans et plus a été inclus dans les études cliniques de RIXUBIS. Pour cela il n’est pas connu, si ce groupe de patients réponde différemment au RIXUBIS de patients jeunes. Comme pour tous les autres patients, la posologie pour des patients âgés doit être individualisée.
Mode d’administration
Pour injection intraveineuse seulement après reconstitution.
RIXUBIS est administré à température ambiante, avec une vitesse d’administration déterminée en fonction du niveau de confort du patient et ne pas dépassant une vitesse maximale de 10 ml/min.
Ne pas administrer RIXUBIS comme injection continue.
Utiliser ce produit qu’avec de seringues stériles à usage unique en matière plastique.
Contre-indications
RISUBIS est contre-indiqué chez les patients avec hypersensibilité connue au principe actif, autres composants du produit ou aux protéines de hamster.
Mises en garde et précautions
Réactions d’hypersensibilité
Des cas d’hypersensibilité ont été rapportés avec RIXUBIS. Une anaphylaxie ou des réactions d’hypersensibilité sont possible. Voir sous Effets indésirables. Les patients et/ou leurs soignants doivent être informés des signes précoces de réactions d’hypersensibilité. En cas d’apparition de ces symptômes, les patients doivent immédiatement interrompre le traitement et contacter leur médecin. Le risque le plus important existe pendant la phase initiale d'un premier traitement aux concentrés de facteur IX chez des patients non préalablement traités, en particulier chez les patients avec certaines mutations du gène FIX , lesquelles sont liées à un risque élevé d’apparition d’inhibiteurs du facteur IX et/ou d’une réaction d’hypersensibilité au produits contenant du facteur IX.
Une corrélation entre l’apparition d’un inhibiteur du facteur IX et des réactions allergiques a été rapportée dans la littérature, notamment chez les patients avec un risque élevé d’une mutation du gène du facteur IX. Pour cette raison, les patients développant une réaction allergique doivent être examinés étroitement afin de détecter la présence d'un inhibiteur.
En cas de choc, une thérapie du choc basée sur le standard actuel de la médecine doit être appliquée.
Inhibiteurs – Syndrome néphrotique
Les patients atteints d‘hémophilie B peuvent développer des anticorps neutralisants (inhibiteurs) dirigés contre le facteur IX. L'apparition d’un inhibiteur doit être surveillée régulièrement au niveau clinique et avec des tests biologiques appropriés chez les patients traités par du facteur IX recombinant (rFIX).
Si les activités plasmatiques attendues du facteur IX n'ont pas été atteintes ou si l'hémorragie n'est pas maîtrisée avec la dose attendue, un dosage doit être effectué pour calculer la concentration de l'inhibiteur du facteur IX. Il est recommandé aux patients développant des inhibiteurs du facteur IX de prendre contact avec un centre spécialisé dans l'hémophilie. Comme un traitement par rFIX peut ne pas être efficace chez les patients présentant des titres élevés d'inhibiteurs du facteur IX, un autre traitement doit alors être envisagé. En cas d'exposition répétée au facteur IX, les patients présentant des inhibiteurs du facteur IX ont un risque accru de développer une réaction d'hypersensibilité sévère ou un choc anaphylactique. L’apparition d’un syndrome néphrotique après un essai d‘induction d’une tolérance immune a été rapportée chez les patients atteints d’hémophilie B présentant des inhibiteurs du facteur IX. La sécurité et l’efficacité de l’utilisation de RIXUBIS pour l’induction d’une tolérance immune n’ont pas été établies.
Thromboembolie, CIVD, fibrinolyse
L'utilisation des concentrés de facteur IX est associée à des complications thromboemboliques (p.ex. embolie pulmonaire, thrombose veineuse et artérielle). Ainsi, l'utilisation de produits contenant du facteur IX peut entraîner un risque potentiel chez les patients avec coagulation intravasculaire disséminée (CIVD) ou présentant des signes de fibrinolyse. En raison du risque de complications thrombotiques, une surveillance clinique des premiers signes de thrombose ou de coagulation intravasculaire disséminée et des tests biologiques appropriés doivent être effectués lors de l'administration de ce produit à des patients atteints de maladies hépatiques, en postopératoire, aux nouveau-nés ou à des patients à risque de thrombose ou de CIVD. Dans chacune de ces situations, le bénéfice potentiel du traitement par le facteur IX recombinant doit être évalué par rapport aux risques.
Analyses biologiques de surveillance
·Surveillance de l'activité du facteur IX à l'aide d'un dosage chronométrique en un temps pour s'assurer qu'un taux adapté du facteur IX a été atteint et, si cliniquement démontré, peut être maintenu (voir Posologie/Mode d'administration).
·Contrôle d'un éventuel développement des inhibiteurs si les activités plasmatiques attendues du facteur IX n'ont pas été atteintes ou si l'hémorragie n'a pas pu être maîtrisée avec la dose recommandée de RIXUBIS. Pour vérifier la présence d'inhibiteurs du facteur IX, un titrage en unités Bethesda (UB) doit être effectué en utilisant le dosage correspondant.
Chaque flacon de ce médicament contient 19 mg de sodium. Cela doit être considéré chez les patients sous régime contrôlé de sodium.
Dans l’intérêt des patients, il est recommandé d’enregistrer le nom et le numéro de lot de RIXUBIS pour toute administration.
Interactions
Aucune interaction avec d'autres médicaments n'est connue pour les préparations de facteur IX de coagulation recombinant.
Grossesse, allaitement
Aucune expérimentation de reproduction n'a été conduite chez l'animal avec RIXUBIS.
Il n’est pas connu si l’utilisation de RIXUBIS chez la femme enceinte a des effets toxiques sur la reproduction ou si elle pourrait être néfaste à la santé du fœtus.
Si nécessaire, RIXUBIS peut être utilisé pendant la grossesse.
Il n’est pas connu si cette substance passe dans le lait maternel. Comme de nombreuses substances passent dans le lait maternel, RIXUBIS ne doit être administré qu'avec prudence chez la femme qui allaite. N'administrer que si nécessaire.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune indication n’est connue sur l’influence de RIXUBIS sur l’aptitude à la conduite ou à l’utilisation d’outils/machines.
Effets indésirables
Les effets indésirables suivants ont été constatés au cours du développement clinique de RIXUBIS à partir de 2 études clôturée ainsi que de deux études encore en cours auprès de 99 patients masculins traités présentant une hémophilie de type B, qui ont reçu un total de 14018 injections.
Dans chaque catégorie des organes, les effets indésirables sont présentés par ordre de leurs fréquences. Les fréquences ont été estimées «par perfusion» et sont réparties en utilisant les catégories suivantes: fréquent (< 1/10, ≥1/100), occasionnel (≥1/1000, <1/100); rare (≥1/10000, <1/1000), très rare (<1/10000).
Système immunitaire
Cas isolés: Hypersensibilité (y compris symptômes comme dyspnée, prurit)
Système nerveux
Rare: dysgueesie
Troubles musculosquelettiques
Très rare: extrémités douloureuses
Troubles cutanés
Cas isolés: urticaire, rash
Investigations
Rare: test d’anticorps anti-facteur IX positif
Immunogénicité
Au cours du développement cliniques de RIXUBIS chez 99 patients préalablement traités, aucune formation d’inhibiteurs n’a été montrée. Aucun anticorps avec capacité de liaison totale par rapport au facteur IX n'est apparu avec le traitement, ni aucun anticorps contre la protéine de la lignée cellulaire ovarienne de hamster chinois.
Enfants et adolescents
Nous ne disposons toutefois d’aucune donnée sur les patients non traités précédemment
car seuls des patients déjà traités précédemment ont été inclus dans les études cliniques ; aucune investigation d’immunogénicité n’a donc été menée sur le développement d’inhibiteurs dans cette population à risque.
Effet de classe
Coagulation intravasculaire disséminée, évènements thromboemboliques (p.ex. embolie pulmonaire, thrombose veineuse, thrombose artérielle), anaphylaxie ou réactions allergiques (y compris symptômes comme angiooedème, sensation d'oppression thoracique, hypotension, léthargie, nausées, vomissement, troubles de la sensibilité, anxiété, sibilances, détresse respiratoire).
Surdosage
Aucun symptôme de surdosage n’a été rapporté.
Propriétés/Effets
Code ATC: B02BD04
RIXUBIS contient du facteur IX de coagulation recombinant (nonacog gamma). Le facteur IX est une glycoprotéine à chaîne unique d’une masse moléculaire d’environ 68 000 daltons. Il s’agit d’un facteur de coagulation dépendant de la vitamine K et est synthétisé par le foie. Le facteur IX est activé par le facteur XIa dans la voie de coagulation intrinsèque et par le complexe facteur VII/facteur tissulaire dans la voie extrinsèque. Le facteur IX activé, en association avec le facteur VIII activé, active à son tour le facteur X. Le facteur X activé transforme la prothrombine en thrombine. La thrombine transforme ensuite le fibrinogène en fibrine ce qui mène à une formation d’un caillot.
L’hémophilie B est une anomalie héréditaire de la coagulation sanguine liée au sexe et due à une diminution du taux de facteur IX. Elle entraîne d’abondantes hémorragies dans les articulations, les muscles ou les organes internes, spontanées ou consécutives à un traumatisme accidentel ou chirurgical. Grâce au traitement substitutif, la concentration plasmatique de facteur IX augmente, ce qui corrige temporairement le déficit en facteur et les syndromes hémorragiques.
Efficacité clinique
Patients de 12 ans et plus
L'efficacité clinique de RIXUBIS a été démontrée dans une étude en ouvert multicentrique, non contrôlée et prospective. 73 patients préalablement traités et âgés de 12 à 65 ans ont reçu une administration de RIXUBIS pour la prophylaxie ou pour un traitement d'urgence. Les patients préalablement traités sont définis comme patients traités au moins 150 jours avec une thérapie substitutive avec le facteur IX. Tous les patients souffraient d'une hémophilie de type B sévère (taux de facteur IX < 1 %) ou moyennement sévère (taux de facteur IX ≤ 2 %).
Le taux d'hémorragie annuel sous prophylaxie était de 4,3 pour toutes les hémorragies, 1,7 pour les hémorragies spontanées et 2,9 pour les hémorragies articulaires.
Au total, 249 épisodes hémorragiques ont été traités par RIXUBIS dont 197 hémorragies articulaires et 52 autres hémorragies (tissus mous, muscles, cavités corporelles, hémorragies intracrâniennes et autres).
Sur les 249 épisodes hémorragiques, 163 étaient de gravité modérée, 71 d'un faible degré de gravité et 15 graves. Dans 211/249 des cas (84.7%) les hémorragies ont pu être arrêtés avec 1 à 2 injections de RIXUBIS.
Dans 96.0 % de l'ensemble des épisodes hémorragiques traités, l'efficacité hémostatique pour le contrôle de l'hémorragie a été qualifiée d'excellente ou de bonne.
La sécurité et l'efficacité de RIXUBIS dans une application périopératoire ont été testées dans une étude de phase 3 multicentrique, non contrôlée, en ouvert et prospective sur des patients masculins déjà traités présentant une hémophilie de type B sévère ou modérée.
L'analyse d'efficacité du protocole comprenait 37 opérations auprès de 27 patients (âgés de 17 à 57 ans) qui ont subi de grosses ou petites chirurgies, interventions dentaires ou autres interventions chirurgicales invasives. Vingt interventions étaient importantes, dont 13 opérations orthopédiques et 3 opérations dentaires.
17 interventions dont 10 extractions dentaires ont été qualifiées de petites interventions chirurgicales.
Non seulement en cas des interventions majeures mais encore en cas des interventions mineures, les pertes de sang peropératoires correspondaient aux quantités attendues et spécifié en avance. Dans aucun cas des pertes de sang anormalement excessives n’ont été observées. Aucunes complications thrombotiques pour l'ensemble des participants à l'étude n’ont été observées.
Patients de moins de 12 ans
L’efficacité clinique de RIXUBIS a été évaluée lors d’une étude combinée de phase 2/3, au cours de laquelle 23 PTP de sexe masculin entre 1.8 et 11.8 ans (âge médian 7.10 ans) dont 11 patients < 6 ans ont reçu RIXUBIS pour la prophylaxie et le contrôle des épisodes hémorragiques.
Tous les sujets étaient atteints d’hémophilie B sévère (taux de facteur IX <1 %) ou modérément sévère (taux de facteur IX ≤2 %). Les 23 sujets ont tous reçu un traitement prophylactique avec RIXUBIS pendant un minimum de 3 mois et ont été inclus dans l’évaluation d’efficacité pour la prophylaxie.
Le taux annualisé d’hémorragie médian était de 2.0, pour les hémorragies spontanées de 0.0 et pour les hémorragies articulaires de 0.0.
Neuf sujets (39.1 %) n’ont présenté aucune hémorragie.
Au total, 26 épisodes hémorragiques ont été traités avec RIXUBIS, dont 23 étaient dus à des
lésions, 2 spontanés et un d’origine inconnue. Dix-neuf hémorragies étaient non articulaires (tissus mous, muscles, cavités corporelles, intracrâniennes et autres) et 7 étaient des hémorragies articulaires, dont une dans une articulation cible. Sur les 26 épisodes hémorragiques, 15 étaient mineurs, 9 modérés et 2 majeurs. Le traitement a été adapté en fonction de la sévérité, de la cause et de l’emplacement de l’hémorragie. La majorité (23 ; 88.5 %) a été traitée avec 1 à 2 perfusions. L’efficacité hémostatique à la résolution de l’hémorragie a été considérée comme excellente ou bonne dans 96.2 % de tous les
épisodes hémorragiques traités.
Pharmacocinétique
Les paramètres pharmacocinétiques ont été déterminés dans le cadre de l’étude pivot (patients ≥ 12 ans) et de l’étude pédiatrique (patients < 12 ans) sur la base de mesures de l’activité du facteur IX dans des échantillons de sang prélevés jusqu’à 72 heures après une seule perfusion de 75 UI/ml. L’évaluation pharmacocinétique a été répétée dans une étude pivot chez des patients qui ont reçu RIXUBIS pendant 26±1 semaines (moyenne ± ET) et accumulé au moins 30 jours d’exposition à RIXUBIS.
|
RIXUBIS | |||||
|
Paramètres |
≥ 12 ans, |
≥ 12 ans, |
< 6 ans |
6 - < 12 ans |
< 12 ans |
|
AUC0–Inf (UI·h/dL) |
1207.10 ± 242.26 |
1305.08 ± 299.95 |
723.7 ± 119.0 |
886.0 ± 133.66 |
808.4 ± 149.14 |
|
Récupération progressive à Cmax |
0.87 ± 0.22 |
0.95 ± 0.25 |
Non déterminé |
Non déterminé |
Non déterminé |
|
Récupération progressive à 30 minutes |
NA |
0.87±0.20 |
Voir tableau ci-dessous |
Voir tableau ci-dessous |
Voir tableau ci-dessous |
|
Demi-vie (h) |
26.70 ± 9.55 |
25.36 ± 6.86 |
27.67 ± 2.66 |
23.15 ± 1.58 |
25.31 ± 3.13 |
|
Cmax (UI/dl) |
66.22 ± 15.80 |
72.75 ± 19.73 |
Non déterminé |
Non déterminé |
Non déterminé |
|
Temps de séjour moyen (h) |
30.82 ± 7.26 |
29.88 ± 4.16 |
30.62 ± 3.27 |
25.31 ± 1.83 |
27.85 ± 3.73 |
|
VSS (dL/kg) |
2.02 ± 0.77 |
1.79 ± 0.45 |
3.22±0.52 |
2.21±0.32 |
2.7±0.67 |
|
Clairance (dL/[kg·h]) |
0.0644 ± 0.0133 |
0.0602 ± 0.0146 |
0.1058±0.01650 |
0.0874±0.01213 |
0.0962±0.01689 |
La récupération progressive 30 minutes après la perfusion a été déterminée chez tous les sujets lors de l’évaluation pharmacocinétique initiale (jour d’exposition 1), lors des visites des semaines 5, 13 et 26, et au terme de l’étude ou à son interruption, si elle ne coïncidait pas avec la visite de la semaine 26.
|
Récupération |
Jour d’exposition 1 |
Semaine 5 |
Semaine 13 |
Semaine 26 |
Au terme/ |
|
Patients ≥ 12 ans | |||||
|
N |
73 |
71 |
68 |
55 |
23 |
|
Moyenne ±ET |
0.79±0.20 |
0.83±0.21 |
0.85±0.25 |
0.89±0.12 |
0.87±0.20 |
|
Patients pédiatriques < 6 ans | |||||
|
N |
10 |
11 |
10 |
10 |
10* |
|
Moyenne ±ET |
0.59 ± 0.13 |
0.63 ± 0.10 |
0.68 ± 0.12 |
0.65 ± 0.13 |
0.65 ± 0.13 |
|
Patients pédiatriques 6 - < 12 ans | |||||
|
N |
12 |
12 |
11 |
11 |
11* |
|
Moyenne ±ET |
0.73 ± 0.16 |
0.73 ± 0.13 |
0.73 ± 0.14 |
0.8 ± 0.14 |
0.8 ± 0.14 |
|
Tous patients pédiatriques < 12 ans | |||||
|
N |
22 |
23 |
21 |
21 |
21* |
|
Moyenne ±ET |
0.67 ± 0.16 |
0.68 ± 0.12 |
0.71 ± 0.13 |
0.72 ± 0.15 |
0.72 ± 0.15 |
*Semaine 26 correspond au terme/à l’interruption de l’étude
Données précliniques
RIXUBIS n'a entraîné aucune thrombose pour une dose de 750 UI/kg dans un modèle de lapin en stase (test de Wessler).
RIXUBIS n'a entraîné aucun effet secondaire clinique respiratoire ou cardiovasculaire chez les macaques de Java jusqu'à une dose de 450 UI/kg.
Aucune étude de cancérogénicité, des troubles de fertilité et du développement fœtal n’ont été réalisées.
Au cours d'une étude de toxicité après administration unique et répétée conduite chez des souris, des rats et des singes cynomolgus, les doses jusqu'à 7 500 UI/kg (administration unique) et 750 UI/kg (administration répétée) ont été bien tolérées.
Remarques particulières
Incompatibilités
Ce médicament ne doit pas être mélangé avec d’autres médicaments.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention « EXP » sur l’emballage.
Le produit reconstitué doit être utilisé immédiatement, en aucun cas plus tard que 3 heures après la reconstitution. Eliminer la solution reconstituée non utilisée.
La stabilité chimique et physique pendant l’utilisation a été démontrée pendant 3 heures aux températures ne dépassant pas 30 °C.
Remarques concernant le stockage
·Conservez à une température ne dépassant pas 30 °C
·Ne pas congeler
Remarques concernant la manipulation
Avant l'administration et dans la mesure où le contenant le permet, il est conseillé de rechercher d'éventuelles particules et changements de couleur dans les préparations parentérales.
La solution doit être limpide et incolore. Si ce n’est pas le cas, la solution ne peut pas être utilisée.
Préparation et reconstitution
La procédure décrite ci-dessous constitue seulement une recommandation pour la préparation et reconstitution de RIXUBIS. Lavez-vous toujours les mains avant de réaliser les procédures suivantes et travaillez sur des surfaces propres. Pendant la reconstitution faites attention d’utiliser une méthode de travail aseptique.
1.Si le produit est conservé au réfrigérateur, amenez le flacon avec le concentré de facteur, ainsi que le flacon de verre avec d'eau stérile pour préparations injectables à température ambiante.
2.Enlever les capsules de protection des flacons pour le concentré de facteur sec et le solvant.
3.Nettoyez les bouchons avec une solution bactéricide et laissez-les sécher avant l’utilisation. Disposer les flacons sur une surface plane.
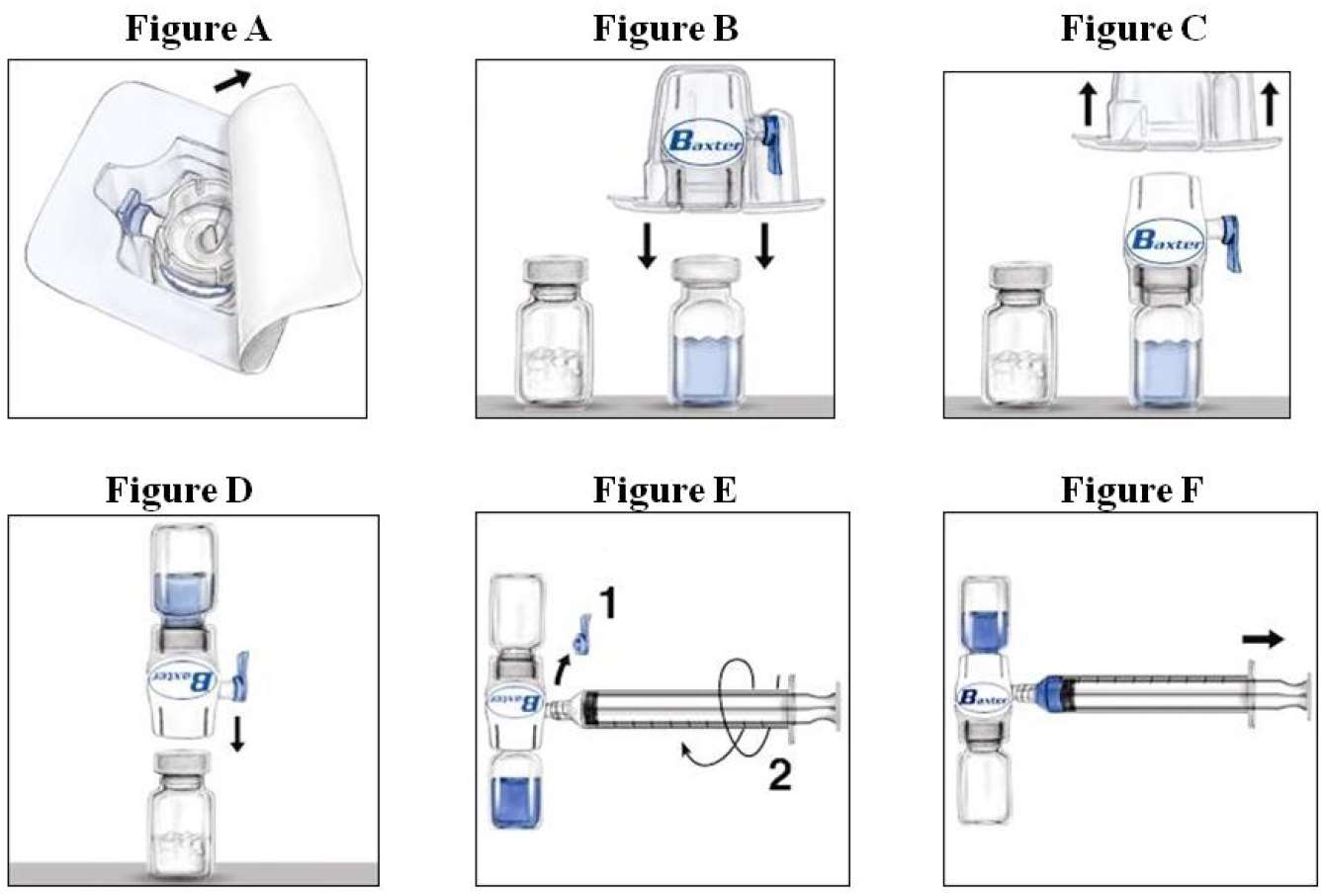
4.Ouvrez l’emballage de BAXJECT II en retirant l’opercule sans toucher l’intérieur (Fig. A). Ne retirez pas le dispositif de l’emballage. Il faut faire attention au fait que BAXJECT II est prévu pour l’utilisation de seulement un flacon unique de RIXUBIS et d'eau stérile pour préparations injectables. Pour cette raison il est nécessaire d’utiliser un deuxième dispositif BAXJECT II pour une autre reconstitution et une autre aspiration de la solution dans la seringue.
5. Tournez l’emballage et insérez complètement le perforateur en plastique dans le bouchon du flacon de solvant (Fig. B).
6.Saisissez l’emballage du dispositif BAXJECT II sur les côtés puis retirez l’emballage du dispositif BAXJECT II (Fig. C). Ne pas retirer le capuchon bleu du dispositif BAXJECT II. Ne touchez pas le perforateur en plastique blanc.
7.Tournez le système sur lui-même de sorte que le flacon de solvant se trouve en haut. Insérez vite le perforateur en plastique blanc dans le bouchon du flacon de RIXUBIS, en le baissant directement (Fig. D). Le vide présent dans le flacon de RIXUBIS aspirera le solvant
8.Agitez doucement jusqu’à ce que RIXUBIS soit dissout complètement. Ne pas congeler après la reconstitution. Après la reconstitution utiliser dans les 3 heures.
Administration
1.Retirer le capuchon de protection bleu du dispositif BAXJECT II. Connectez la seringue au dispositif BAXJECT II (Fig E). Ne remplissez pas la seringue d’air.
2.Retournez le système une fois – le flacon verre contenant la solution de facteur concentré est en position haute. Remplissez la seringue avec la solution de facteur concentré en tirant lentement le piston en arrière (Fig. F).
3.Retirez la seringue, fixez une aiguille appropriée et commencez avec l’injection intraveineuse. Si plus d’un flacon de RIXUBIS doit être injecté à un patient, la même seringue peut être utilisée pour ces flacons.
4.La vitesse maximale d’injection est 10 ml/min.
Numéro d’autorisation
63123 (Swissmedic)
Présentation
Chaque présentation de RIXUBIS contient : 1 flacon contenant le lyophilisat, 1 flacon contenant d’eau stérile pour préparations injectables et un dispositif BAXJECT II.
RIXUBIS 250 (B)
Lyophilisat avec 250 UI de facteur IX de coagulation recombinant (nonacog gamma) et 5 ml d’eau stérile pour préparations injectables.
RIXUBIS 500 (B)
Lyophilisat avec 500 UI de facteur IX de coagulation recombinant (nonacog gamma) et 5 ml d’eau stérile pour préparations injectables.
RIXUBIS 1000 (B)
Lyophilisat avec 1000 UI de facteur IX de coagulation recombinant (nonacog gamma) et 5 ml d’eau stérile pour préparations injectables.
RIXUBIS 2000 (B)
Lyophilisat avec 2000 UI de facteur IX de coagulation recombinant (nonacog gamma) et 5 ml d’eau stérile pour préparations injectables.
RIXUBIS 3000 (B)
Lyophilisat avec 3000 IU de facteur IX de coagulation recombinant (nonacog gamma) et 5 ml d’eau stérile pour préparations injectables
Titulaire de l’autorisation
Takeda Pharma AG, 8152 Opfikon
Mise à jour de l’information
Octobre 2016