Composition
Principes actifs
Urapidilum.
Excipients
1 ampoule Urapidil Stragen i.v. 25 mg contient:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad solutionem pro 5 ml.
*Excipients revêtant un intérêt particulier: 500 mg de propylenglycolum et 2.18 mg de natrium.
1 ampoule Urapidil Stragen i.v. 50 mg contient:
Acidum hydrochloridum concentratum, Natrii dihydrogenophosphas dihydricus*, dinatrii phosphas dihydricus*, Propylenglycolum*, Natrii hydroxidum*, Aqua ad injectabilia q.s. ad solutionem pro 10 ml.
*Excipients revêtant un intérêt particulier: 1000 mg de propylenglycolum et 4.36 mg de natrium.
Indications/Possibilités d’emploi
Hypertension.
Formes urgentes d'hypertension (p.ex. poussées tensionnelles), formes graves et très graves de la maladie hypertensive, hypertension artérielle résistant au traitement. Le traitement d'une ascension tensionnelle paroxystique en cas de phéochromocytome est possible. Hypotension contrôlée chez des hypertendus pendant et/ou après une intervention. Abaissement tensionnel en cas d'ascension paroxystique de la pression artérielle chez un sujet normotendu, pendant et/ou après l'intervention.
Posologie/Mode d’emploi
Adultes
Posologie usuelle
L'Urapidil Stragen i.v. s'administre par voie intraveineuse en injection ou en perfusion, le malade étant en position couchée.
On peut pratiquer une ou plusieurs injections ou une perfusion prolongée par voie intraveineuse. Des injections peuvent être associées à une perfusion prolongée consécutive. On peut progressivement passer du traitement parentéral en aigu à un traitement prolongé par des médicaments d'administration orale.
Urgences au cours de l'hypertension artérielle, formes graves et très graves de l'hypertension et hypertension résistant au traitement
En injection intraveineuse on injecte 10 mg à 50 mg d'Urapidil Stragen i.v. On peut escompter une chute tensionnelle en l'espace de 5 minutes. Suivant l'évolution de la tension, on peut répéter l'injection d'Urapidil Stragen i.v.
Pour une perfusion prolongée par voie intraveineuse, le mieux est de diluer 250 mg d'Urapidil Stragen i.v. (5 ampoules d'Urapidil Stragen i.v. 50 mg ou 10 ampoules d'Urapidil Stragen i.v. 25 mg) dans 500 ml d'un soluté compatible pour perfusion, p.ex. soluté salé physiologique, soluté glucosé à 5 ou à 10% ou solution de lévulose à 5% ou solution de dextran-40 avec chlorure de sodium à 0,9%. La concentration maximale compatible est de 4 mg d'Urapidil Stragen i.v. par ml de soluté pour perfusion. En raison d'incompatibilités physico-chimiques, Urapidil Stragen i.v. ne doit pas être mélangé avec des solutés alcalins à injecter ou à perfuser. Etant donné l'acidité de la solution injectable, une opalescence et une précipitation peuvent apparaître.
Lorsqu'on utilise un perfuseur pour administrer la dose d'entretien, on aspire 20 ml de solution d'Urapidil Stragen i.v. à perfuser, soit 100 mg d'Urapidil Stragen i.v., dans la seringue du perfuseur et l'on dilue jusqu'à 50 ml avec un soluté compatible pour perfusion (voir ci-dessus).
A titre de posologie initiale, on peut appliquer une vitesse de perfusion allant jusqu’à 2 mg/minute. La dose d'entretien, en moyenne 9 mg/h, et la durée de la perfusion, de 48 heures au maximum, doivent être adaptées à l'évolution tensionnelle.
L'importance de la chute tensionnelle est fonction de la dose perfusée au cours des 15 premières minutes. Ensuite, les chiffres tensionnels peuvent être maintenus grâce à des doses nettement plus faibles.
Abaissement tensionnel contrôlé chez des hypertendus pendant et/ou après interventions
Schéma d'administration
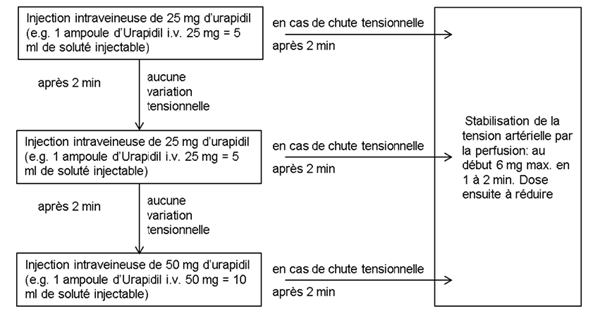
Pour maintenir le niveau tensionel atteint avec l'injection, on recourt à une perfusion continue à la pompe ou au goutte-à-goutte.
Instructions posologiques particulières
Si Urapidil Stragen i.v. n'est pas l'unique hypotenseur à prendre il peut se produire une chute de tension importante accompagnée de bradycardie et/ou d'asystole. Dans ce cas il faut attendre assez longtemps de sorte que l'autre hypotenseur prescrit ait produit son effet. En conséquence il faut choisir une posologie de l'Urapidil Stragen i.v. plus faible et correspondante.
Patients âgés
Chez les malades âgés, les antihypertenseurs doivent être administrés avec les précautions qui conviennent et, initialement, à plus faibles doses, de tels malades s'avérant souvent très sensibles aux antihypertenseurs.
Patients présentant des troubles de la fonction rénale et/ou de la fonction hépatique
Chez les patients présentant des troubles de la fonction rénale et/ou de la fonction hépatique légère à modérée, une réduction posologique moyenne d'Urapidil Stragen i.v. peut s'avérer nécessaire.
Enfants et adolescents
Les indications de ce médicament sont extrêmement rares en pédiatrie. L'application et la sécurité d'emploi de la solution injectable d'Urapidil Stragen i.v. n'ont pas été étudiées à ce jour chez les enfants et les adolescents.
Durée du traitement
Au maximum 48 heures.
Contre-indications
L'Urapidil Stragen i.v. injectable ne doit pas être utilisé en cas de sténose isthmique de l'aorte, de shunts artério-veineux à l'exception d'un shunt par dialyse inefficace du point de vue hémodynamique, et d'hypersensibilité à l'une des substances contenue dans le produit.
Mises en garde et précautions
Si d'autres hypotenseurs ont été prescrits avant l'Urapidil Stragen i.v. il faut prendre des précautions particulières en ce qui concerne la posologie et le temps d'attente (voir sous «Posologie/Mode d'emploi»).
Une chute tensionnelle trop brusque peut provoquer une bradycardie ou un arrêt cardiaque.
Lors de l'administration d'Urapidil Stragen i.v., une prudence particulière s'impose en cas de:
·insuffisance cardiaque due à un dysfonctionnement mécanique (p.ex. sténose de valve aortique ou mitrale), en cas d'embolie pulmonaire ou d'insuffisance de la fonction cardiaque liée à une affection péricardique;
·chez les enfants et les adolescents, car aucune étude n'est disponible;
·chez les patients présentant une insuffisance hépatique;
·chez les patients présentant une insuffisance rénale modérée à sévère;
·chez les patients âgés;
·chez les patients traités simultanément par la cimétidine (cf. rubrique «Interactions»).
Hypersensibilité/urticaire/angio-œdème
On a observé chez des patients traités par urapidil des cas d'urticaire et d'angio-œdème du visage, des lèvres, de la langue, de la glotte et/ou du larynx (voir aussi «Effets indésirables»).
Urapidil Stragen i.v. doit dans ces cas être interrompu immédiatement et le patient doit être attentivement surveillé jusqu'à ce que le gonflement ait disparu. Même les patients dont seule la langue est enflée et qui ne souffrent pas de détresse respiratoire ont besoin, selon les circonstances, d'être mis sous surveillance prolongée, car le traitement par antihistaminiques et corticostéroïdes peut s'avérer insuffisant.
Pour les patients chez qui la langue, la glotte ou le larynx sont touchés, il est possible que les voies respiratoires soient bloquées. Si la langue, le larynx et la glotte sont touchés, il faut immédiatement prendre des mesures thérapeutiques adéquates, par exemple l'injection sous-cutanée d'une solution d'adrénaline 1:1000 (de 0,3 ml à 0,5 ml) et/ou des mesures pour garantir que les voies respiratoires soient ouvertes. Le patient doit faire l'objet d'une surveillance médicale étroite.
Excipients revêtant un intérêt particulier:
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c'est à dire qu'il est essentiellement «sans sodium».
Le propylène glycol contenu dans ce médicament peut avoir les mêmes effets que l'absorption d'alcool et augmenter la probabilité d'effets indésirables. Divers effets indésirables, tels que l'hyperosmolalité, l'acidose lactique, la dysfonction rénale (nécrose tubulaire aiguë), l'insuffisance rénale aiguë, la cardiotoxicité (arythmie, hypotension); les troubles du système nerveux central (dépression, coma, convulsions), la dépression respiratoire, la dyspnée, la dysfonction hépatique, la réaction hémolytique (hémolyse intravasculaire) et l'hémoglobinurie ou le dysfonctionnement organique multisystémique, ont été signalés à des doses élevées ou lors de l'utilisation prolongée du propylène glycol. Par conséquent, des doses supérieures à 500 mg/kg/jour peuvent être administrées chez les enfants de plus de 5 ans, mais elles devront être considérées au cas par cas. Les effets indésirables s'inversent généralement après sevrage du propylène glycol et, dans des cas plus sévères suite à une hémodialyse. Une surveillance médicale est nécessaire. Ne pas utiliser ce médicament chez l'enfant de moins de 5 ans.
N'utilisez ce médicament que sur recommandation de votre médecin. Votre médecin pourra procéder à des examens complémentaires pendant que vous prenez ce médicament.
Interactions
Interactions pharmacocinétiques et pharmacodynamiques
L'urapidil ne modifie ni l'activité, ni la réactivité individuelle de la rénine plasmatique.
Effet d'autres médicaments sur Urapidil Stragen i.v.
Les antagonistes du récepteur alpha, les vasodilatateurs et d'autres médicaments utilisés pour traiter la maladie hypertensive (y compris les diurétiques), des états de déficit volumique (diarrhée, vomissements) ou la consommation d'alcool peuvent renforcer l'effet hypotenseur de l'urapidil. En cas d'administration simultanée de cimétidine, il faut escompter une élévation des pics sériques d'urapidil.
Autres interactions
On n'a pas rapporté d'interactions lors de l'administration simultanée d'anesthésiques, de sédatifs et de produits cardio-vasculaires, d'anticoagulants, d'hypo-uricémiants, d'antidiabétiques ou d'hypolipémiants.
Inhibiteurs enzymatiques
En l'absence d'une expérience clinique suffisante, l'association avec des inhibiteurs de l'ECA n'est pas recommandée.
Grossesse, allaitement
Grossesse
Il n'existe que des données limitées sur l'utilisation chez les femmes enceintes.
L'urapidil n'est pas tératogène chez les animaux, mais des études chez l'animal ont montré une toxicité sur la reproduction à des doses considérées comme bien supérieures à la dose humaine maximale (voir «Données précliniques»). Urapidil n'est pas recommandé pendant la grossesse à moins que le bénéfice attendu ne justifie le risque potentiel pour le foetus. Urapidil n'est pas recommandé pour les femmes en âge de procréer qui n'utilisent pas de contraception efficace.
Allaitement
On ne sait pas si l'urapidil est excrété dans le lait maternel, les mères ne doivent donc pas allaiter pendant qu'elles reçoivent de l'urapidil.
Fertilité
Aucune étude clinique sur les effets sur la fertilité masculine et féminine n'a été réalisée. Des études animales ont montré que l'urapidil affecte la fertilité (voir «Données précliniques»), mais sa pertinence pour l'homme est inconnue.
Effet sur l’aptitude à la conduite et l’utilisation de machines
En raison de réactions individuelles variées, la vigilance peut être affectée au point de compromettre l'aptitude à conduire des véhicules et à utiliser des machines ou à travailler dans des conditions manquant d'appuis stables. Ceci est valable en particulier au début du traitement, lors d'une augmentation posologique et de changement de traitement ainsi qu'en association avec l'alcool.
Urapidil Stragen i.v. a une légère influence sur l'aptitude à la conduite ou l'utilisation de machines.
Effets indésirables
Les effets indésirables susceptibles de survenir après l'administration d'urapidil sont énumérés ci-après. Les fréquences sont définies comme suit: très fréquents: ≥1/10; fréquents: ≥1/100 à <1/10; occasionnels: ≥1/1000 à <1/100; rares ≥1/10 000 à <1/1000; très rares: <1/10 000.
Affections du système nerveux
Fréquents: vertiges*, céphalées*.
Très rares: inquiétude*.
Affections cardiaques
Occasionnels: palpitations*, tachycardie*, bradycardie*, sténocardie*, dyspnée*, arythmies*.
Très rares: états de type collapsus (orthostase).
Affections respiratoires, thoraciques et médiastinales
Rares: nez bouché.
Affections gastro-intestinales
Fréquents: nausée*.
Occasionnels: vomissement*.
Affections de la peau et du tissu sous-cutané
Occasionnels: transpiration*.
Rares: réactions allergiques (démangeaisons, rougeurs, exanthèmes).
Cas isolés: angio-œdème et urticaire.
Affections des organes de reproduction et du sein
Rares: priapisme.
Troubles généraux et anomalies au site d'application
Occasionnels: fatigue*.
*) Ces effets indésirables sont généralement dus à une chute tensionnelle trop brusque induite par l'urapidil. Selon les expériences, ces effets secondaires disparaissent cependant en l'espace de quelques minutes même sous perfusion prolongée; une interruption du traitement n'étant donc pas nécessaire.
A ce jour, une rétention de sodium n'a pas été observée sous traitement par l'urapidil.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Signes et symptômes
·concernant la circulation: vertiges, orthostase et collapsus
·concernant le système nerveux central: fatigue et diminution de la vigilance.
Traitement en cas de surdosage
Un abaissement exagéré de la pression artérielle peut être pallié par une mise en position haute des jambes et par une substitution de volume. Si ces mesures sont insuffisantes, des vasoconstricteurs peuvent être injectés lentement par voie i.v. sous contrôle de la pression artérielle. Dans de rares cas, il est nécessaire d'administrer de l'adrénaline à la dilution et à la dose habituelle (100 à 1000 μg).
Propriétés/Effets
Code ATC
C02CA06
Mécanisme d'action
L'effet hypotenseur de l'urapidil est dû à un abaissement d'origine centrale et périphérique des résistances vasculaires. L'urapidil exerce une action inhibitrice préférentielle sur les récepteurs alpha1-adrénergiques périphériques post-synaptiques, atténue la transmission nerveuse au niveau des terminaisons neuronales sympathiques périphériques et entraîne une diminution du tonus sympathique central.
L'avantage est qu'une interruption, soit volontaire, soit par inadvertance, du traitement par urapidil n'entraîne aucune remontée tensionnelle brutale.
Les poussées tensionnelles dues à l'effort chez l'hypertendu sont atténuées par urapidil.
La fréquence cardiaque est généralement stable.
Le débit cardiaque n'est pas modifié; un débit cardiaque diminué en raison d'une post-charge plus élevée peut augmenter.
L'injection d'urapidil n'est suivie d'aucune ascension tensionnelle initiale.
On note une normalisation de la pression au niveau des capillaires pulmonaires.
Sous urapidil, la régulation normale de la tension artérielle est maintenue. Aussi n'a-t-on pas à redouter de chute tensionnelle conduisant à une hypotension artérielle.
L'urapidil se distingue par sa grande marge de sécurité. Son effet est parfaitement contrôlable.
D'après les constatations faites jusqu'à présent, il n'y a aucune raison d'exclure les malades ayant une insuffisance cardiaque ou une atteinte de la fonction respiratoire.
Pharmacodynamique
Voir «Mécanisme d'action».
Efficacité clinique
Des études cliniques ont prouvé que l'urapidil peut être utilisé comme mono-thérapie pour le traitement à long terme de l'hypertension artérielle. Après application intraveineuse, la réduction des chiffres tensionnels, tant systoliques que diastoliques, est certes rapide mais n'a rien de spectaculaire. Lorsqu'on arrête le traitement par voie intraveineuse, la tension artérielle ne tarde pas à remonter lentement en 2 à 3 heures. C'est là un avantage net en post-opératoire à la suite d'une hypotension contrôlée per-opératoire chez un hypertendu.
Pharmacocinétique
Absorption
En administration intraveineuse, l'urapidil a une demi-vie d'élimination du sérum de 2,5 heures en moyenne. Le volume de distribution est de 0,59 l/kg et la valeur moyenne de la clairance de 0,17 l/h/kg.
Distribution
Voir «Absorption».
Métabolisme
En dehors de la substance mère (10 à 15%), on trouve, dans les urines chez l'homme, le métabolite principal, biologiquement inactif M1 (=6-{3-[4-(2-méthoxy-4-hydroxyphényl)-pipérazine-1-yl]-propylamino}- 1,3-diméthyluracil), qui représente environ 30% de la dose administrée et, en outre, de petites quantités des métabolites M2 et M3.
Élimination
L'élimination de l'urapidil se fait par voie rénale, à raison de 76% environ et, par voie fécale, à raison de 20% environ. La liaison aux protéines plasmatiques de l'urapidil dans le sérum humain est, in vitro, de 94%.
Données précliniques
Pharmacologie de sécurité
Les données précliniques ne montrent aucun risque particulier pour l'homme en raison des études menées sur la pharmacologie de sécurité.
Toxicité à long terme
L'administration intraveineuse répétée aux animaux n'a montré aucune létalité jusqu'à la dose la plus élevée testée (chez le rat 300 mg/kg pendant 7 jours et 40 mg/kg pendant 4 semaines; chez le chien 75 mg/kg sur 7 jours et 50 mg/kg sur 4 semaines). Les résultats tels que la sédation, la diminution de la motricité, la dyspnée, l'augmentation du rythme cardiaque, la baisse de la pression artérielle et l'hypertension musculaire étaient réversibles en quelques heures après l'administration chez le rat et en 24 heures chez le chien.
Des études de toxicité chronique, dans lesquelles des doses allant jusqu'à 266 mg/kg chez le rat et des doses de 64 mg/kg chez le chien ont été administrées par voie orale sur une période de 12 mois, ont montré des signes tels que sédation, allongement du cycle oestrogénique, hypersalivation et tremblements à fortes doses.
Mutagénicité et carcinogénicité
Dans des essais sur des bactéries (test d'AMES, Host Mediated Assay), sur des lymphocytes humains et dans le test de moelle osseuse à la métaphase sur la souris, l'urapidil n'a montré aucune propriété mutagène. Un test de réparation de l'ADN sur des hépatocytes de rats était également négatif. Des études de carcinogénicité menées sur des souris et des rats pendant 18 et 24 mois n'ont fourni aucun indice d'un potentiel carcinogène pour l'être humain. Dans des études spéciales menées sur des rats et des souris, il a été démontré que l'urapidil augmente le taux de prolactine. Chez le rongeur, un taux de prolactine élevé stimule la croissance du tissu mammaire. Compte tenu des connaissances relatives au mécanisme d'action, cet effet est improbable chez l'humain traité par des doses thérapeutiques et n'a pas été démontré dans des études cliniques.
Toxicité sur la reproduction
Urapidil n'était pas tératogène chez des souris, des rats et des lapins. De plus, l'urapidil n'a eu aucun effet sur les rates allaitantes ou sur la progéniture pendant la lactation et plus tard après le sevrage, tel que mesuré par la survie, le comportement, l'apparence, le poids corporel et les signes de maturation. L'urapidil a le potentiel de diminuer la fertilité masculine et féminine et d'induire une mortalité embryo-foetale. Une prolongation du cycle oestral chez les rats et les souris femelles a été observée dans les études de toxicité de reproduction et la toxicité chronique, mais sa pertinence pour l'homme est inconnue.
Remarques particulières
Incompatibilités
Urapidil Stragen i.v. ne doit pas être mélangé avec des solutés alcalins à injecter ou à perfuser. Etant donné l'acidité de la solution injectable, une opalescence et une précipitation peuvent apparaître.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30 °C et tenir hors de portée des enfants.
Stabilité après ouverture
Une fois diluée, la préparation injectable ou pour perfusion ne doit pas être conservée. Sa stabilité chimique et physique «in use» a été démontrée pendant 50 heures à 15-25 °C. Pour des raisons microbiologiques, la préparation prête à l'emploi devrait être utilisée immédiatement après la dilution. Si cela n'est pas possible, le délai d'utilisation et les conditions de stockage relèvent de la responsabilité de l'utilisateur mais, de manière générale, l'entreposage ne devrait pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf si la dilution/reconstitution se déroule dans des conditions aseptiques contrôlées et validées.
De plus amples informations: cf. rubrique «Posologie/Mode d'emploi».
Numéro d’autorisation
66012 (Swissmedic).
Présentation
5 ampoules d'Urapidil Stragen i.v. 25 mg/5 ml, solution injectable: [B]
5 ampoules d'Urapidil Stragen i.v. 50 mg/10 ml, solution injectable: [B]
Titulaire de l’autorisation
Stragen Pharma SA, 1228 Plan-les-Ouates.
Mise à jour de l’information
Octobre 2021.