Composition
Principes actifs
Cénégermine*.
*Une forme recombinante du facteur de croissance nerveuse humain (FCN) produit par Escherichia coli.
Excipients
Tréhalose dihydraté, mannitol, phosphate disodique anhydre, phosphate monosodique dihydraté, hypromellose, macrogol 6000, L-méthionine, eau pour préparations injectables, acide chlorhydrique (pour l’ajustement du pH), hydroxyde de sodium (pour l’ajustement du pH).
1 ml de médicament contient 2.66 mg de phosphate.
Indications/Possibilités d’emploi
Traitement de la kératite neurotrophique modérée (lésions épithéliales persistantes) ou sévère (ulcères cornéens) chez l’adulte.
Le traitement doit être instauré et surveillé par un ophtalmologue.
Posologie/Mode d’emploi
Adultes
La dose recommandée est d’une goutte d’Oxervate dans le cul-de-sac conjonctival de l’œil ou des yeux atteints, six fois par jour, toutes les deux heures en débutant le matin, pendant une période de 12 heures. Le traitement doit être poursuivi pendant huit semaines.
Il convient de traiter les patients atteints d’une infection oculaire avant d’instaurer le traitement par Oxervate (voir «Mises en garde et précautions»).
En cas d’oubli d’une dose, le traitement doit être poursuivi de manière habituelle avec l’administration suivante telle qu’elle a été planifiée. La dose oubliée peut être administrée ultérieurement, dans un délai de douze heures correspondant à la durée de conservation du flacon quotidien. Les patients doivent être informés de ne pas instiller plus d’une goutte dans l’œil ou les yeux atteints au cours de la même administration.
Afin d’assurer la traçabilité des médicaments biotechnologiques, il convient de documenter pour chaque traitement le nom commercial et le numéro de lot.
Instructions posologiques particulières
Patients présentant des troubles de la fonction hépatique et rénale
Le médicament n’a pas été évalué chez les patients atteints d’insuffisance hépatique ou rénale. Toutefois, aucun ajustement de la dose n’est jugé nécessaire chez ces patients.
Patients âgés
Aucun ajustement de la posologie n’est nécessaire chez les patients âgés de 65 ans et plus.
Enfants et adolescents
La sécurité et l’efficacité pour les enfants et les adolescents de moins de 18 ans ne sont pas établies. Aucune donnée n’est disponible.
Mode d‘administration
A usage ophtalmique uniquement.
Précautions d’emploi du médicament
Les patients doivent être informés de la nécessité de se laver les mains avant l’administration.
Oxervate ne doit être utilisé qu’avec le système d’administration prévu à cet effet (adaptateurs et pipettes) tel que décrit dans la rubrique «Remarques particulières» et dans le mode d'emploi à la fin de l'information professionnelle.
Une nouvelle pipette doit être utilisée pour chaque administration.
Traitement combiné
Si plusieurs médicaments ophtalmiques topiques sont utilisés, les différents collyres doivent être administrés en respectant des intervalles d’au moins 15 minutes. Si des pommades, des gels ophtalmiques ou autres collyres visqueux sont utilisés, ceux-ci doivent être administrés 15 minutes après le traitement par Oxervate (voir «Interactions»).
Contre-indications
Hypersensibilité au principe actif ou à l’un des excipients.
Mises en garde et précautions
Risques de kératomalacie ou de perforation imminente de la cornée
Il est important d’évaluer le risque de kératomalacie ou de perforation imminente de la cornée et la nécessité d’une intervention chirurgicale en urgence ou d’une autre intervention avant d’instaurer le traitement par Oxervate, car la cénégermine ne doit pas être utilisée chez les patients qui nécessitent une intervention chirurgicale immédiate.
Réactions oculaires
Oxervate peut provoquer chez les patients des troubles oculaires légers à modérés tels que des douleurs oculaires. Le patient doit être informé qu’il doit contacter son médecin en cas de doutes ou de réactions oculaires sévères.
Utilisation de corticostéroïdes ou de collyres contenant des conservateurs
L’utilisation de médicaments ophtalmiques topiques, connus pour inhiber la cicatrisation de l’épithélium, y compris les corticostéroïdes et les collyres contenant des conservateurs comme le chlorure de benzalkonium, le polyquaternium-1, le bromure de benzododécinium, le cétrimide et d’autres dérivés des ammoniums quaternaires, doit être évitée lors du traitement de la kératite neurotrophique, car ceux-ci peuvent compromettre la cicatrisation de la cornée (voir «Interactions»).
Infections oculaires
Il convient de traiter les infections oculaires avant d’utiliser Oxervate. En cas d’infection oculaire, le traitement par Oxervate doit être interrompu jusqu’à la disparition de celle-ci (voir «Posologie/Mode d’emploi»).
Cancer oculaire
La cénégermine peut théoriquement avoir une influence sur les cancers oculaires puisqu’il s’agit d’un facteur de croissance. La prudence est donc de mise lors de l’utilisation d’Oxervate chez les patients présentant un cancer oculaire. Il est recommandé de surveiller l’apparition de toute progression tumorale chez les patients pendant et après un traitement par ce médicament.
Lentilles de contact
Les patients doivent être avisés de retirer leurs lentilles de contact avant d’utiliser Oxervate et d’attendre 15 minutes après l’instillation de la dose avant de les remettre, car les lentilles de contact (quelles soient à visée thérapeutique ou corrective) peuvent théoriquement compromettre la répartition de cénégermine au niveau de la lésion cornéenne.
Ce médicament contient 2.66 mg de phosphates par 1ml de solution.
Interactions
Lors du traitement par Oxervate, d’autres médicaments ophtalmiques topiques peuvent être utilisés à condition de respecter un délai de 15 minutes entre les applications, à l’exception des substances connues pour inhiber la cicatrisation épithéliale (p.ex. les corticostéroïdes ou les collyres contenant le chlorure de benzalkonium, le polyquaternium-1, le bromure de benzododécinium, le cétrimide et d’autres dérivés des ammoniums quaternaires) (voir «Posologie/Mode d’emploi» et «Mises en garde et précautions»). Oxervate doit être administré en premier lorsque d’autres pommades, gels ophtalmiques ou autres collyres visqueux doivent être utilisés (voir «Posologie/Mode d’emploi» et « Mises en garde et précautions»).
Aucune étude d’interactions avec d’autres médicaments n’a été réalisée. Aucune interaction avec d’autres médicaments n’est attendue, car l’absorption systémique de la cénégermine est faible voire non décelable après l’utilisation de ce médicament.
Grossesse, Allaitement
Grossesse
Il n’existe pas de données suffisantes concernant l’emploi de la cénégermine chez la femme enceinte. Les expérimentations animales réalisées avec la cénégermine n’ont révélé aucune toxicité directe ou indirecte sur la reproduction lors de son administration par voie sous-cutanée (voir «Données précliniques»).
L’exposition systémique à la cénégermine est négligeable voire inexistante.
Par mesure de précaution, l’utilisation d’Oxervate doit être évitée pendant la grossesse.
Allaitement
On ignore si la cénégermine passe dans le lait maternel. Un risque pour l’enfant allaité ne peut être exclu.
Il convient de décider si l’allaitement doit être interrompu ou s’il faut renoncer / interrompre le traitement par Oxervate, en tenant compte du bénéfice de l’allaitement pour l’enfant ainsi que du bénéfice du traitement pour la mère.
Fertilité
Il n'existe pas de données de fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Le traitement peut avoir une légère influence sur l’aptitude à la conduite et l’utilisation de machines, car il peut provoquer passagèrement une vision trouble ou d’autres troubles visuels susceptibles de persister pendant quelques minutes après l’instillation. En cas de vision trouble après l’instillation du produit, le patient doit attendre que sa vision redevienne claire avant de conduire ou d’utiliser des machines.
Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés chez les patients atteints de kératite neutrophique et traités par Oxervate dans le cadre d’études cliniques, sont les douleurs oculaires (11,1%), les inflammations oculaires (8,3%), y compris les inflammations de la chambre antérieure et les hyphémas; l’augmentation de la sécrétion lacrymale (5,6%) associée à des symptômes tels qu’un écoulement oculaire, des douleurs palpébrales (5,6%) et une sensation de corps étranger dans l'œil (5,6%).
En tenant compte de la population globale traitée par ce médicament (c’est à dire la population incluse dans les études cliniques réalisées également dans des indications autres que la kératite neurotrophique), les douleurs oculaires étaient les effets secondaires les plus fréquents, suivis des irritations oculaires et d’une sensation anormale dans l’œil.
Liste des effets indésirables
Les effets indésirables mentionnés ci-dessous ont été observés au cours des études cliniques chez les patients atteints de kératite neurotrophique traités par 20 µg/ml d’Oxervate.
Les effets indésirables sont rangés par classe de système d’organes de la classification MedDRA et par fréquence selon la convention suivante :
« très fréquents » (≥1/10),
« fréquents » (≥1/100 à <1/10),
« occasionnels » (≥1/1000 à <1/100),
« rares » (≥1/10 000 à <1/1000),
« très rares » (<1/10 000).
Infections et infestations
Occasionnels: abcès cornéens
Affections du système nerveux
Fréquents: céphalées
Affections oculaires
Très fréquents: douleurs oculaires
Fréquents: inflammation oculaire, douleur palpébrale, sensation de corps étranger dans l’œil, augmentation de la sécrétion lacrymale, blépharite, hyperémie conjonctivale, photophobie, irritation de l’œil, dépôts cornéens
Occasionnels: néovascularisation cornéenne
Quelques cas rares de calcification cornéenne ont été signalés en association avec l'utilisation de gouttes contenant des phosphates chez certains patients atteints de cornées gravement endommagées.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
Aucun cas de surdosage n'a été rapporté.
Un surdosage topique est peu probable et ne devrait avoir aucun effet toxique. Un surdosage de cénégermine par voie topique peut être traité par un rinçage des yeux à l’eau tiède.
Propriétés/Effets
Code ATC
S01XA24
Mécanisme d’action/Pharmacodynamique
Oxervate contient de la cénégermine, une forme recombinante du facteur de croissance nerveuse humain.
Le facteur de croissance nerveuse est une protéine endogène qui participe à la différenciation et au maintien des neurones et qui agit par l’intermédiaire de récepteurs spécifiques de haute affinité (tel que TrkA) et de récepteurs de faible affinité (tel que p75NTR).
Les récepteurs du facteur de croissance nerveuse sont exprimés au niveau du segment antérieur de l’œil (cornée, conjonctive, iris, corps ciliaire et cristallin), par la glande lacrymale et les tissus intraoculaires du segment postérieur. Le traitement par la cénégermine, administrée sous forme de collyre, vise à permettre la restauration de l’intégrité de la cornée.
Efficacité clinique
L’efficacité et la sécurité d’Oxervate ont été évaluées dans deux études cliniques multicentriques, randomisées, en double aveugle, contrôlées versus le véhicule (NGF0212 et NGF0214) chez les patients atteints de kératite neurotrophique modérée (lésion épithéliale persistante) ou sévère (ulcère cornéen) en échec de traitements non chirurgicaux. Dans les deux études, les patients ont reçu soit Oxervate soit le véhicule 6 fois par jours dans l’œil ou les yeux atteints pendant une période de 8 semaines et ont bénéficié d’un suivi ultérieur.
L’étude NGF0214 a inclus 48 patients (âge moyen de 65 ± 14 ans, fourchette 33-94 ans) qui ont été traités soit par Oxervate à la dose de 20 μg/ml soit par le véhicule (24 patients par bras). L’étude NGF0212 a inclus un total de 174 patients (âge moyen 61 ± 16 ans, fourchette 18-95 ans), qui ont reçu un traitement par Oxervate et le véhicule sans le composant L-méthionine. L’efficacité de deux doses différentes de cénégermine 20 et 10 μg/ml par rapport au véhicule (52 patients par bras) a été comparée de manière indépendante chez 156 patients.
Le tableau suivant donne un aperçu des résultats en termes de cicatrisation cornéenne complète d’une lésion épithéliale persistante ou d’un ulcère cornéen (le critère d’évaluation principal étant le plus grand diamètre de la coloration cornéenne par la fluorescéine <0,5 mm) après 4 et 8 semaines de traitement chez les patients qui ont reçu 20 µg/ml d’Oxervate ou le véhicule dans les deux études.
|
|
Etude NGF0214 |
Etude NGF0212 | |||
|
Résultats après 4 et 8 semaines de traitement |
Semaine 4 |
Semaine 8 |
Semaine 4 |
Semaine 8 | |
|
Taux de cicatrisation cornéenne complète |
Oxervate |
56,5 % |
69,6 % |
58,0 % |
74,0 % |
|
Véhicule |
37,5 % |
29,2 % |
19,6 % |
43,1 % | |
|
|
(Valeur de p) |
(0,191) |
(0,006) |
(0,001) |
(0,002) |
Le pourcentage de patients ayant présenté une cicatrisation cornéenne complète (grade 0 de l’échelle modifiée d’Oxford), la moyenne des moindres carrés de la variation du score de meilleure acuité visuelle de loin corrigée (en nombre de lettres sur l’échelle Early Treatment Diabetic Retinopathy Study) par rapport aux valeurs initiales et l’amélioration de la sensibilité cornéenne mesurée en millimètres par un esthésiomètre de Cochet-Bonnet (différence par rapport à la valeur initiale >0) ont également été mesurés après 8 semaines de traitement dans les deux études et sont résumés dans le tableau ci-dessous.
|
Résultats après 8 semaines de traitement |
Etude NGF0214 |
Etude NGF0212 | |
|
Cicatrisation cornéenne complète |
Oxervate |
22,7 % |
21,4 % |
|
Véhicule |
4,2 % |
10,0 % | |
|
(Valeur de p) |
(0,062) |
(0,157) | |
|
Meilleure acuité visuelle de loin corrigée |
Oxervate |
6,11 |
11,9 |
|
Véhicule |
3,53 |
6,9 | |
|
(Valeur de p) |
(0,143) |
(0,213) | |
|
Sensibilité cornéenne au niveau de la lésion |
Oxervate |
72,2 % |
76,3 % |
|
Véhicule |
60,0 % |
68,4 % | |
|
(Valeur de p) |
(0,458) |
(0,442) | |
Les patients considérés comme ayant eu une cicatrisation complète après 8 semaines de traitement par Oxervate, n’ont pas eu tendance à présenter de récidives au cours de la période de suivi de 12 mois de l’étude NGF0212. Sur les 31 patients qui ont présenté une cicatrisation complète après le traitement initial par 20 μg/ml d‘Oxervate et pour lesquels des données étaient disponibles, plus de 80% présentaient toujours une cicatrisation complète à la fin de la période de suivi de 12 mois.
Pharmacocinétique
Absorption
Après instillation oculaire, la cénégermine est principalement éliminée de l’œil avec les secrétions lacrymales par le canal lacrymo-nasal; une faible proportion est absorbée par la conjonctive, le tissu périorbitaire et dans une moindre mesure par la cornée.
Les études pharmacocinétiques entreprises chez les patients inclus dans les études, n’ont pas mis en évidence d’accumulation de la cénégermine. De manière générale, l’absorption systémique d’Oxervate est négligeable.
Distribution
Après administration du collyre, la cénégermine est surtout distribuée dans le segment antérieur de l’œil. Toutefois, une étude a montré que la cénégermine radiomarquée, administrée à des rats à des posologies nettement supérieures à celles prescrites chez l’homme sous forme de collyre dans le traitement de la kératite eutrophique, atteignait la rétine ainsi que d’autres parties du segment postérieur de l’œil. Lors de l’administration de la dose dans l’œil, la cénégermine n’est pas distribuée dans l’ensemble de l’organisme, car il n’y a pas d’absorption systémique au-delà des concentrations initiales naturelles.
Métabolisme
La cénégermine administrée par voie oculaire est principalement éliminée par sécrétion lacrymale et la quantité résiduelle est essentiellement métabolisée par les protéases tissulaires locales.
Élimination
La cénégermine administrée sous forme de collyre est principalement éliminée par secrétion lacrymale.
Données précliniques
Les données précliniques issues des études conventionnelles de pharmacologie de sécurité (système nerveux central), de toxicité après administration unique ou répétée, de toxicité sur la reproduction, le développement embryonnaire/fœtal ainsi que le développement pré et postnatal, n’ont pas mis en évidence de risque particulier chez l’homme lors de l’administration par voie ophtalmique (collyre), intraveineuse et/ou sous-cutanée.
Remarques particulières
Incompatibilités
Non pertinent.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité après ouverture
Ne pas conserver au-dessus de 25°C et utiliser dans les 12 heures à 25 °C.
Sur le plan microbiologique, la méthode d’ouverture (c’est-à-dire la connexion de l’adaptateur sur le flacon) exclut le risque de contamination microbienne.
Remarques particulières concernant le stockage
Tenir hors de la portée des enfants.
A la pharmacie (flacon non ouvert)
Conserver au congélateur (de -25°C à -15°C).
Chez le patient (flacon non ouvert)
Conserver au réfrigérateur (2-8°C).
Le patient reçoit une boîte en carton hebdomadaire contenant 7 flacons d’Oxervate dans un conditionnement isolant. Dès que le patient regagne son domicile (dans les 5 heures qui suivent l’obtention du médicament à la pharmacie), la boîte en carton hebdomadaire doit être placée au réfrigérateur entre 2 et 8 °C. Le patient doit être informé que la décongélation du médicament obtenu à la pharmacie peut nécessiter 30 minutes.
Chez le patient (flacon ouvert)
Chaque jour, un flacon multidose d’Oxervate doit être retiré du réfrigérateur pour être utilisé dans la journée. Tout flacon ouvert peut être conservé au réfrigérateur ou à une température inférieure à 25 °C, mais doit être utilisé dans les 12 heures.
Une fois ce délai écoulé, le contenu du flacon doit être jeté, quelle que soit la quantité de solution restant dans le flacon.
Remarques concernant la manipulation
Le patient reçoit une boîte en carton hebdomadaire contenant 7 flacons d’Oxervate.
Ce médicament ne doit être utilisé qu‘avec les adaptateurs de flacon prévus à cet effet et les produits à usage unique (pipettes) qui sont également fournis en plus du carton hebdomadaire d’Oxervate.
Un système d’administration contenant 7 adaptateurs (soit 1 par jour), 42 pipettes (soit 6 par jour) et 42 lingettes désinfectantes (soit 6 par jour), ainsi qu’une fiche permettant de noter la dose sont fournis en plus de la boîte en carton hebdomadaire contenant 7 flacons d’Oxervate, ce qui suffit pour administrer le médicament pendant une semaine. Sont également fournis en réserve un adaptateur (1), des pipettes (3) et des lingettes désinfectantes (3).
Le patient reçoit une boîte en carton hebdomadaire contenant 7 flacons multidoses d’Oxervate qui devront être conservés au réfrigérateur jusqu’au jour de leur utilisation.
Il recevra également un adaptateur de flacon, des pipettes et des lingettes désinfectantes.
Chaque matin (toujours à la même heure), un flacon multidose d’Oxervate devra être retiré du réfrigérateur afin de débuter la phase de traitement de douze heures.
Un mode d'emploi détaillé est disponible après la rubrique «Mise à jour de l’information» ainsi que dans la notice d'emballage.
Numéro d’autorisation
67019 (Swissmedic)
Présentation
1 ml de solution d‘Oxervate en flacon multidose stérile, en verre de type 1, sans conservateur, fermé par un bouchon de caoutchouc et une capsule en aluminium dotée d’un opercule amovible en polypropylène, présenté dans un emballage en carton.
Taille du conditionnement: 7 flacons multidose [B]
Système d’administration supplémentaire :7 adaptateurs de flacons, 42 pipettes, 42 lingettes désinfectante et une fiche hebdomadaire de saisie de la dose, ainsi qu’un adaptateur (1), des pipettes (3) et des lingettes désinfectantes (3) supplémentaires en réserve.
Titulaire de l’autorisation
Dompé International SA, 1860 Aigle
Mise à jour de l’information
Janvier 2024
Mode d'emploi
La préparation du flacon multidose qui contient le médicament se fera conformément aux instructions suivantes:
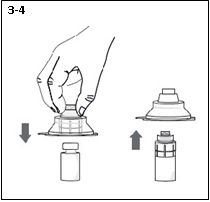
1) Se laver les mains, poser le flacon sur une surface stable et retirer l’opercule de protection en plastique.
2) Décoller le film au verso de l’emballage thermoformé de l’adaptateur.
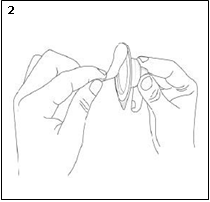
3) Sans retirer l’adaptateur de son emballage thermoformé, le fixer au flacon en le poussant fermement sur le flacon jusqu’à ce qu’il s’enclenche sur le col du flacon et que l’extrémité de l’adaptateur s’enfonce dans le bouchon en caoutchouc du flacon. Une fois que l’adaptateur a été correctement fixé, il ne doit plus être retiré du flacon.
4) Retirer, puis jeter l’emballage thermoformé de l’adaptateur. Ne pas toucher la surface de l’adaptateur.

Pour prélever une dose d’Oxervate et l’administrer, il convient de suivre les étapes suivantes:
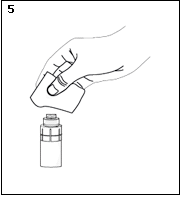
5) Prendre une lingette désinfectante et nettoyer délicatement la surface de la valve du connecteur Luer-Lock de l’adaptateur. Après le nettoyage, laisser sécher la valve pendant environ une minute.
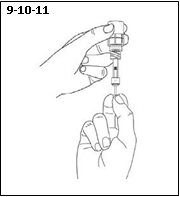
6) Prendre une pipette, la retirer de son emballage protecteur.
7) Fixer la pipette en la vissant (dans le sens des aiguilles d’une montre) sur le connecteur Luer Lock de l’adaptateur.
8) S’assurer que le piston de la pipette a été entièrement poussé vers le bas.
9) Retourner le flacon à l’envers (la pipette y étant fixée) et tirer délicatement le piston de la pipette jusqu’à la butée afin d‘aspirer la solution dans la pipette (s’assurer que le piston a atteint la butée).
10) Examiner la pipette pour s’assurer qu’elle contienne bien la solution. Des bulles d‘air peuvent être à l’origine d’une obstruction et empêcher le remplissage correct de la pipette (surtout au cours du premier prélèvement). Si la pipette est vide, maintenir le flacon à l’envers avec la pipette fixée, pousser le piston à fond et le tirer à nouveau.
11) Lorsque la pipette est correctement remplie, la dévisser du connecteur Luer-Lock de l’adaptateur.

12) Tenir la pipette entre le majeur et le pouce et la diriger vers le bas, incliner la tête en arrière et positionner la pipette au-dessus de l’œil atteint. Tirer la paupière inférieure vers le bas. Pousser doucement le piston jusqu’à ce qu’une goutte tombe dans le cul-de-sac conjonctival.
13) Jeter la pipette et la lingette désinfectante immédiatement après les avoir utilisées.
14) En cas d’erreur, si la goutte tombe en dehors de l’œil, répéter les étapes décrites ci-dessus en utilisation une nouvelle pipette et une nouvelle lingette.
15) Après chaque administration, remettre le flacon au réfrigérateur pour le reste de la journée, l’adaptateur restant fixé (ou conserver le flacon à une température inférieure à 25 °C).

Les instructions d’emploi décrites ci-dessus (étape 5 à 15) doivent être répétées toutes les 2 heures (six fois par jour) en utilisant à chaque fois une nouvelle lingette désinfectante et une nouvelle pipette.
Le flacon usagé doit être jeté à la fin de la journée (même s’il contient encore du liquide), mais au plus tard 12 heures après avoir fixé l’adaptateur au flacon.
Il faut conseiller au patient d’utiliser une alarme afin de garantir l’administration exacte de la dose toutes les 2 heures.
Il faut conseiller au patient d’utiliser la fiche hebdomadaire de saisie de la dose fournie avec le système d’administration du médicament, afin de contrôler l’administration conforme des six doses journalières. Sur cette fiche, il devra indiquer la date de la première utilisation hebdomadaire, l’heure d’ouverture du flacon (c.-à-d. le moment où l’adaptateur a été fixé au flacon) ainsi que l‘heure de chaque instillation oculaire au cours de la semaine.
Chaque semaine, un nouveau stock d’Oxervate sera remis au patient pendant toute la durée du traitement.
Tout médicament non utilisé ou déchet doit être éliminé selon la réglementation en vigueur.