Composition
Principe actif
Étofénamate
Excipients
Couche adhésive: polycondensat de polysilicate alpha-hydro-omégahydroxypoly(diméthylsiloxane) triméthylsilylé (diméthylsiloxane), diméthicone, Macrogol 400, huile d’olive;
couche support: textile en polyester biélastique;
film détachable: film de polyester recouvert de fluoropolymère.
Indications/Possibilités d’emploi
Traitement local symptomatique des affections douloureuses et inflammatoires accompagnées de tuméfactions dues à des traumatismes contondants tels que les claquages, les entorses ou les contusions (écrasements).
Posologie/Mode d’emploi
Posologie habituelle
Adulte
1 emplâtre est collé toutes les 24 heures avec une pression légère sur la zone douloureuse.
N’utilisez toujours qu’un seul emplâtre sur la région lésée.
Durée du traitement
La durée du traitement dépend principalement de la gravité des symptômes. Selon les études cliniques établissant l’efficacité de ce produit, l’utilisation de Lixim Patch doit être limitée à 7 jours. Demander un avis médical si aucune amélioration n’est constatée au bout de 7 jours.
Recommandations posologiques spéciales
Patients âgés
Aucun ajustement posologique n’est nécessaire pour les personnes âgées.
Enfants et adolescents
La sécurité et l’efficacité de Lixim Patch n’ont pas été contrôlées de manière systématique chez les enfants et adolescents. Une utilisation n’est pas recommandée pour cette raison. L'utilisation est contre-indiquée chez les nourrissons et les enfants en bas âge.
Patients avec une insuffisance hépatique ou rénale
Lixim Patch n’a pas été étudié spécifiquement chez des patients souffrant d’insuffisance hépatique ou rénale. Étant donné le type d’utilisation et la disponibilité systémique négligeable du principe actif, la nécessité d’un ajustement posologique n’est pas à craindre dans ces cas.
Mode d’administration
Voir la rubrique «Lixim Patch» à la fin de cette information professionnelle.
Contre-indications
Application sur une peau lésée (p. ex. dermatite exsudative, eczéma, lésion infectée, brûlure ou plaie ouvert).
3e trimestre de la grossesse (voir «Grossesse/Allaitement»)
Allaitement.
Nourrissons et enfants en bas âge.
Hypersensibilité au principe actif étofénamate, à d’autres anti-inflammatoires non stéroïdiens ou à l’un des excipients selon la composition.
Mises en garde et précautions
Pour minimiser les effets indésirables, il est recommandé de réduire la durée d’utilisation au minimum nécessaire.
Lixim Patch doit être appliqué uniquement sur une peau intacte et saine.
L’emplâtre ne doit pas entrer en contact avec les muqueuses ou les yeux.
En cas d’éruption cutanée après l’application d’un emplâtre (voir «Effets indésirables»), le traitement doit être immédiatement interrompu.
Pour les patients souffrant d’asthme, d’une rhinite allergique ou de polypes nasaux, un bronchospasme ou une rhinite peuvent apparaître dans de rares cas.
Chez les patients souffrant d’urticaire chronique, des réactions allergiques sont possibles.
En raison de la quantité non négligeable de principe actif présente après utilisation, une élimination conforme de l’emplâtre est requise. Les emplâtres usagés doivent dans tous les cas être tenus hors de portée des enfants en bas âge et des animaux domestiques. Il est toutefois peu probable qu’un surdosage important se produise en suçant ou en mâchant des emplâtres usagés.
Interactions
L’absorption systémique de l’étofénamate est très faible en cas d’utilisation externe sous forme d’un emplâtre. Le risque d’interaction médicamenteuse avec d’autres principes actifs est de ce fait négligeable.
Grossesse, Allaitement
Grossesse
Après une utilisation topique, la concentration systémique de l’étofénamate est plus faible qu’en cas d’utilisation systémique. L’expérience des traitements avec des anti-inflammatoires non stéroïdiens à absorption systémique permet d’établir les recommandations suivantes:
L’inhibition de la synthèse des prostaglandines peut avoir une incidence négative sur la grossesse et/ou le développement embryofœtal. Selon des données tirées d’études épidémiologiques, l’administration d’inhibiteurs de la synthèse des prostaglandines au début de la grossesse accroît le risque de fausses couches, de malformations cardiaques et de gastroschisis. Le risque absolu de malformations cardiovasculaires après l’utilisation d’un inhibiteur de la synthèse des prostaglandines augmente de < 1% à environ 1,5%. On présume que ce risque est proportionnel à la dose administrée et à la durée du traitement.
Chez les animaux, il est prouvé que l’administration d’un inhibiteur de la synthèse des prostaglandines entraîne une augmentation des pertes préimplantatoires et post-implantatoires ainsi que de la létalité embryofœtale. En outre, une incidence accrue de différentes malformations, notamment cardiovasculaires, a été observée chez des animaux qui avaient reçu un inhibiteur de la synthèse des prostaglandines pendant la phase de l’organogenèse (voir «Données précliniques»).
Premier et deuxième trimestres
Lixim Patch ne doit pas être utilisé pendant les deux premiers trimestres, sauf en cas de nécessité absolue. Si l’étofénamate est donné à une femme qui envisage une grossesse ou qui est au premier ou au deuxième trimestre de sa grossesse, la dose doit être aussi faible et la durée du traitement aussi courte que possible.
Troisième trimestre
Les inhibiteurs de la synthèse des prostaglandines ont été associés à une fermeture prématurée du canal artériel, des complications rénales chez l’enfant, une tendance accrue aux saignements chez la mère et l’enfant, la tocolyse ainsi qu’un risque accru d’œdème chez la mère. L’utilisation de Lixim Patch est pour cette raison contre-indiquée au dernier trimestre de la grossesse.
Allaitement
L’acide flufénamique, un métabolite, passe en faibles quantités dans le lait maternel. Il n’existe aucune étude incluant des mères allaitantes. C’est pourquoi l’utilisation de Lixim Patch pendant l’allaitement est contre-indiquée.
Fertilité
Il n’existe aucune donnée concernant l’impact potentiel sur la fertilité.
Effet sur l’aptitude à la conduite et l’utilisation de machines
Aucune étude correspondante n’a été réalisée. Toutefois, en raison du type d’utilisation et de la faible disponibilité systémique du principe actif, on ne s’attend pas à ce que Lixim Patch ait une influence sur l’aptitude à la conduite ou la capacité à utiliser des machines.
Effets indésirables
Les effets indésirables observés dans la littérature lors de l'utilisation d'étofénamate en application topique sont listés ci-dessous par classe d'organes (MedDRA) et par fréquence.
L’incidence est définie comme suit: «très fréquents» (≥1/10), «fréquents» (<1/10, ≥1/100), «occasionnels» (<1/100, ≥1/1000), «rares» (<1/1000, ≥1/10 000), «très rares» (<1/10 000).
Affections du système immunitaire
Rares: réactions d’hypersensibilité
Affections de la peau et du tissu sous-cutané
Occasionnels: réactions cutanées locales, p. ex. érythème, prurit, sensation de brûlure, gonflements de la peau.
Rares: réactions allergiques locales (dermatite de contact).
Affections respiratoires, thoraciques et médiastinales
Occasionnels: respiration sifflante.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
Surdosage
En raison du mode d’administration et de la faible absorption systémique, un surdosage est peu probable.
Propriétés/Effets
Code ATC
M02AA06
Mécanisme d’action
Le principe actif étofénamate est un anti-inflammatoire non stéroïdien aux propriétés analgésiques, antiphlogistiques et décongestionnantes. En administration topique, il traverse la peau et pénètre dans le tissu sous-jacent.
Pharmacodynamique
L’effet pharmacologique repose sur une inhibition du métabolisme en cascade de l’acide arachidonique, l’étofénamate inhibant aussi bien la cyclooxygénase que la lipoxygénase et ainsi la formation de peroxydes cycliques tout comme celle d’acides gras hydroxyperoxydés.
Efficacité clinique
L’efficacité antalgique de Lixim Patch a été exposée dans quatre études randomisées, en double aveugle, contrôlées contre placebo menées auprès d’un total de n=639 patients, dont 398 avec l’emplâtre actif et 241 avec le placebo. Ont été inclus des patients adultes âgés entre 18 et 60 ans avec une distorsion aiguë bénigne de la cheville ainsi que des claquages, des entorses ou des distorsions dus à des traumatismes contondants. Le critère d’évaluation principal était dans les trois études la modification des douleurs de l’appareil moteur au bout de 72 heures sur une EVA de 100 mm. Les deux premières études incluant un total de n=236 patients portaient sur l’application deux fois par jour d’un emplâtre (c.-à-d. changement d’un emplâtre toutes les 12 heures). Dans la troisième étude incluant 160 patients, Lixim Patch a été appliqué deux fois par jour à la moitié des patients et une fois par jour (c.-à-d. changement d’un emplâtre toutes les 24 heures) à l’autre moitié. La quatrième étude portait exclusivement sur l’application une fois par jour de l’emplâtre chez 180 patients (n=120 avec Lixim Patch).
Dans les trois études, une réduction significative des douleurs de l’appareil moteur par rapport au placebo a pu être établie (différence thérapeutique entre les données regroupées des deux études avec une utilisation deux fois par jour 21,7 mm [IC à 95% 18,20-25,28]; différence thérapeutique dans la troisième étude avec changement d’un emplâtre deux fois par jour 17,2 mm [IC à 95% 11,7-22,8 mm; p<0,0001], avec changement d’un emplâtre une fois par jour 19,1 mm [IC à 95% 14,0-24,2 mm; p<0,0001]). Dans la quatrième étude, la différence thérapeutique était de 25,0 mm [IC à 95% 21,3-28,7; p<0,0001]. Les résultats pour les critères d’évaluation secondaires essentiels étaient en l’occurrence cohérents. Déjà après 12 à 48 heures, Lixim Patch présentait une supériorité significative par rapport au placebo. Le délai moyen de réduction des douleurs de l’appareil moteur ≥ 50% par rapport à la référence était significativement plus court avec le traitement actif par rapport au placebo.
Pharmacocinétique
Absorption
L’étofénamate est bien résorbé après application locale. La biodisponibilité relative s’élève à 20% environ par rapport à l’administration orale.
La biodisponibilité des préparations contenant de l’étofénamate est sujette à de grandes fluctuations inter-individuelles et intra-individuelles qui sont essentiellement dues au site d’application, à l’hydratation cutanée et à d’autres facteurs.
Lorsque l’emplâtre Lixim Patch était appliqué une fois par jour sur la cheville d’adultes sains, les concentrations plasmatiques maximales atteintes le jour 4 étaient de 0,164 ng/ml pour l’étofénamate et de 7,47 ng/ml pour le métabolite actif, l’acide flufénamique. Les concentrations plasmatiques après 7 jours d’application ont été déterminées uniquement lors du changement d’un emplâtre toutes les 12 heures. La Cmax de l’étofénamate était de 0,36 ng/ml, celle de l’acide flufénamique de 14,94 ng/ml.
Distribution
Après application cutanée, les taux d’étofénamate mesurés dans les tissus enflammés sont environ 25 fois supérieurs à ceux mesurés après l’administration orale de la même dose. La substance inchangée reste plus longtemps dans les tissus enflammés que dans le plasma. Après application cutanée, on retrouve principalement de l’étofénamate sous forme inchangée (jusqu’à 94%) dans les tissus; son dérivé hydrolysé, l’acide flufénamique, ainsi que d’autres métabolites n’y sont détectés que dans de faibles proportions.
La liaison de l’étofénamate aux protéines est de 98 – 99%.
Métabolisme
L’étofénamate est métabolisé dans le foie par oxydation et conjugaison principalement en acide flufénamique libre et conjugué, acide 5-hydroxy-flufénamique et 4-hydroxy-flufénamique. L’acide flufénamique présente une activité pharmacologique comparable à celle de la substance mère.
Élimination
Le taux d’élimination rénale de l’étofénamate est de 35%. La majeure partie est éliminée par voie biliaire et fécale sous forme de nombreux métabolites et leurs conjugués.
L’étofénamate est éliminé du plasma sanguin avec une demi-vie d’élimination d’environ 3,3 heures.
L’existence d’une circulation entérohépatique est probable.
Données précliniques
Dans l’essai animal, l’étofénamate appliqué localement n’était généralement pas toxique. En revanche, l’essai animal a montré que l’administration orale de doses élevées d’étofénamate entraînait une ulcération de la muqueuse gastro-intestinale s’accompagnant d’une perte sanguine dans le tractus gastro-intestinal. Il s’agit d’un effet bien connu des AINS. Des effets indésirables ont été observés au niveau des reins.
Chez le rat, la dose correspondant au seuil d’absence d’effets observés (NOAEL) était de 22 mg/kg de poids corporel en cas d’administration orale et de 300 mg/kg de poids corporel en cas d’application dermique.
Mutagénicité et cancérogénicité
Les essais in vitro et in vivo d’induction de mutations géniques et chromosomiques ainsi que les études de cancérogénicité avec administration orale ont eu un résultat négatif.
Toxicité sur la reproduction
L’étofénamate traverse la barrière placentaire. Chez le rat, des doses orales toxiques chez les mères ont entraîné une augmentation de l’incidence des malformations (dilatations rénales et côtes surnuméraires). Le retard de mise-bas et la fermeture prématurée du canal artériel sont des effets bien connus des AINS.
Autres données (toxicité locale, phototoxicité)
La tolérance locale des emplâtres avec 70 mg d’étofénamate a été étudiée chez 6 lapins blancs néo-zélandais pendant 7 jours. Ni les emplâtres médicaux à l’étofénamate ni les emplâtres placebo n’étaient irritants.
L’étofénamate (pur à 99,6%) n’était pas phototoxique dans un essai avec des cellules Balb/c 3T3 NRU cultivées et une lumière ultraviolette.
Remarques particulières
Incompatibilités
Non pertinent.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité après ouverture
Une ouverture répétée de l’emballage n’altère pas la qualité du produit.
Remarques particulières concernant le stockage
Ne pas conserver au-dessus de 30°C.
Bien refermer le sachet après retrait du produit.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Lixim Patch doit être appliqué sur une peau sèche et lisse en le tendant légèrement. La transpiration et une pilosité importante au site d’application peuvent impacter l’adhérence de l’emplâtre. Il est important que l’emplâtre soit fermement appliqué sur la peau sèche.
Les informations détaillées concernant le mode d’administration sont énumérées à la fin de cette information professionnelle.
Après utilisation, l’emplâtre doit être replié avec la face adhésive vers l’intérieur et éliminé conformément aux dispositions locales, dans un endroit sûr, hors de portée des enfants.
Numéro d’autorisation
67494 (Swissmedic)
Présentation
Lixim Patch, sachets de 7 emplâtres et 2x7 emplâtres [D].
Titulaire de l’autorisation
Drossapharm AG, Bâle.
Mise à jour de l’information
Août 2024
Utilisation de Lixim Patch
L’emplâtre ne doit être utilisé que sur une peau sèche et lisse. La transpiration et une pilosité importante au site d’application peuvent impacter l’adhérence de l’emplâtre.
Vidéo d’instructions

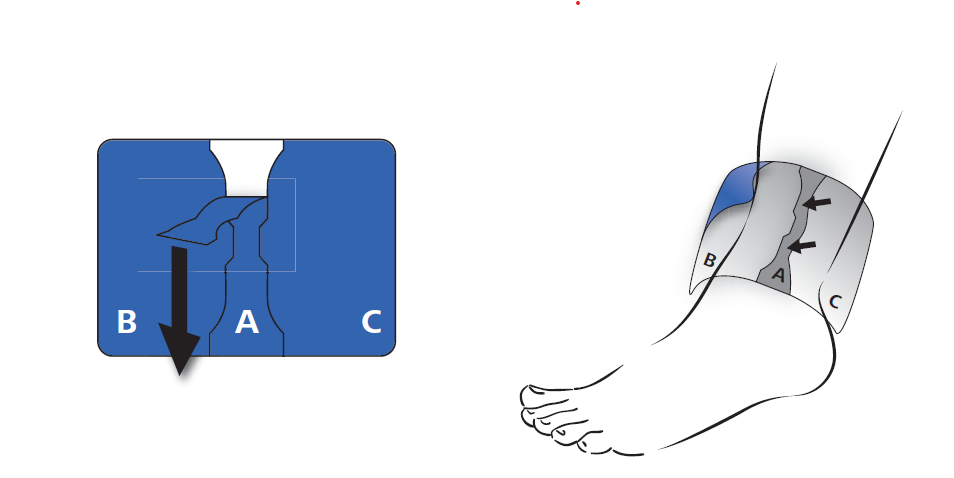
Retirer d’abord la bande protectrice au centre de l’emplâtre (A). Cette partie de l’emplâtre est directement appliquée sur la zone douloureuse.
Ne touchez pas la face adhésive de l’emplâtre avec les doigts.
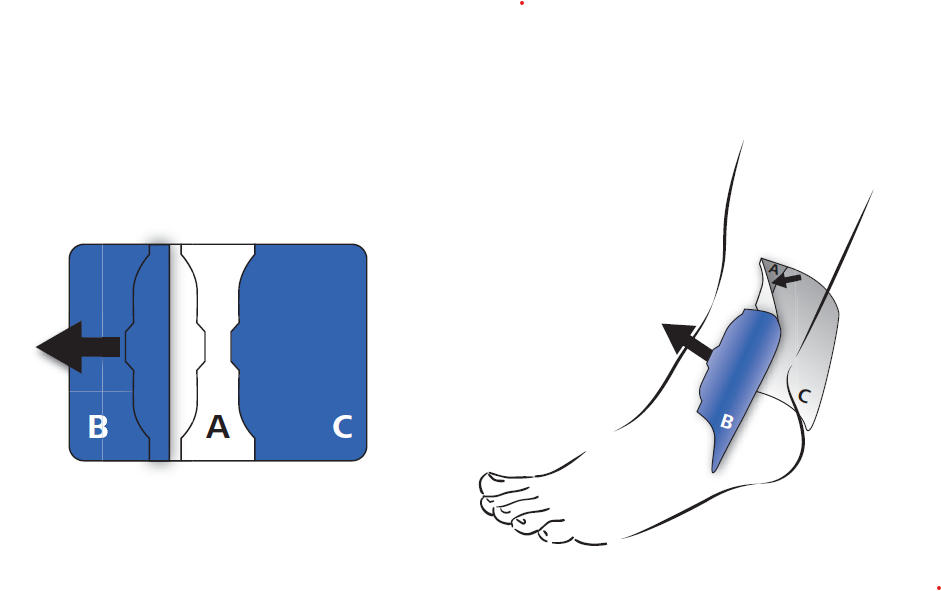
Le film extérieur de protection (B) est retiré du centre vers l’extérieur. La surface adhésive ainsi dévoilée est collée sur la peau en exerçant une légère traction.
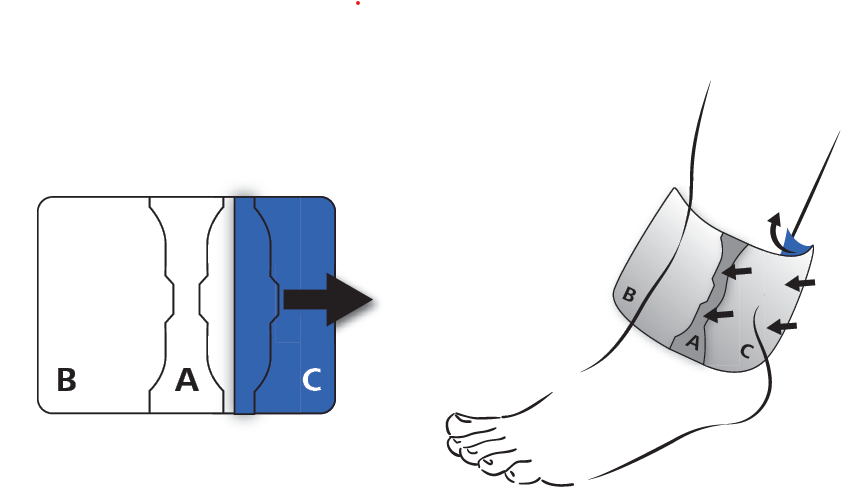
Procéder de la même manière pour retirer l’autre film extérieur de protection (C). La surface adhésive ainsi dévoilée est également collée sur la peau en exerçant une légère traction.
Après l’application, presser l’emplâtre pendant au minimum 30 secondes sur la peau pour obtenir une adhérence optimale.