Eigenschaften/WirkungenATC-Code
L04AB05
Certolizumab pegol ist ein Fab'-Fragment eines rekombinanten, humanisierten Antikörpers. Das Fab'-Fragment wird in Escherichia coli gebildet und dann gereinigt und an Polyethylenglykol (PEG) konjugiert.
Wirkungsmechanismus
Certolizumab pegol besitzt eine hohe Affinität zu humanem TNF-α mit einem KD-Wert von 90 pM. TNF-α ist ein wichtiges proinflammatorisches Zytokin, das bei Entzündungsprozessen eine entscheidende Rolle spielt. Certolizumab pegol besitzt eine selektive neutralisierende Wirkung auf TNF-α (IC90 von 4 ng/ml bei der Hemmung des humanen TNF-α in einem in vitro L929 murinen Fibrosarcoma-Zytotoxizitätsassay), neutralisiert aber Lymphotoxin-α (TNF-β) nicht.
Certolizumab pegol besitzt nachweislich eine Dosis-abhängige neutralisierende Wirkung auf membranassoziiertes und lösliches humanes TNF. Die Inkubation von Monozyten mit Certolizumab pegol führte zu einer Dosis-abhängigen Hemmung von LPS-induziertem TNF-α sowie zur Bildung von IL-1β in humanen Monozyten.
Certolizumab pegol besitzt keine Fc-Region («fragment crystallizable»), wie sie in einem vollständigen Antikörper normalerweise vorhanden ist; es bindet deshalb kein Komplement und verursacht keine antikörperabhängige, zellvermittelte Zytotoxizität. Es führt in vitro nicht zur Apoptose in humanen, peripheren, aus dem Blut gewonnenen Monozyten oder Lymphozyten oder zu einer Degranulation von Neutrophilen.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Morbus Crohn
Die Untersuchung der Wirksamkeit und Sicherheit von Cimzia erfolgte im Rahmen zweier randomisierter, placebokontrollierter Doppelblind-Studien an Patienten im Alter von ≥18 Jahren mit aktivem, mässigem bis schwerem Morbus Crohn, d.h. mit einem Crohn's Disease Activity Index (CDAI) von 220-450 (jeweils einschliesslich). Cimzia wurde in beiden Studien bei einer Dosierung von 400 mg subkutan verabreicht. Dabei war eine stabile Begleitmedikation gegen Morbus Crohn erlaubt.
Studie I
Bei der Studie I (PRECiSE 1) handelte es sich um eine randomisierte, placebokontrollierte Studie an 662 Patienten mit aktivem Morbus Crohn. Cimzia bzw. Placebo wurde in den Wochen 0, 2 und 4, danach alle 4 Wochen bis zur Woche 24 verabreicht. Das klinische Ansprechen (Response) definierte sich als eine Abnahme des CDAI-Werts um mindestens 100 Punkte, eine klinische Remission als absoluter CDAI-Wert von 150 oder weniger. Drei Patienten wurden von der Intent-to-treat- (ITT-) Analyse ausgeschlossen; bei zwei für Cimzia randomisierten Patienten erfolgte keine Dosierung; ein für Placebo randomisierter Patient wurde ausgeschlossen.
Die Ergebnisse in Bezug auf das klinische Ansprechen (Response) sind in Tabelle 1 dargestellt. Der Wirkungseintritt von Cimzia erfolgte in Woche 2. In Woche 6 war die Anzahl der Responder im Vergleich zu Placebo klinisch signifikant; d.h. ein klinisches Ansprechen wurde erzielt. Weiterhin war die Anzahl der Responder sowohl in Woche 6 als auch in Woche 26 klinisch signifikant, was ein anhaltendes Ansprechen zeigte.
Tabelle 1: PRECiSE 1 – Klinisches Ansprechen; gesamte Studienpopulation
|
Zeitpunkt
|
Anzahl (%) der Responder
95% CI
| |
Placebo
(N=328)
|
Cimzia 400 mg
(N=331)
| |
Woche 2
| |
N
|
326
|
328
| |
Responder
|
46 (14.1%)
|
82 (25.0%)§
| |
95%CI
|
10.3%, 17.9%
|
20.3%, 29.7%
| |
Woche 6 (Induktion)
| |
N
|
325
|
327
| |
Responder
|
87 (26.8%)
|
115 (35.2%)*
| |
95%CI
|
22.0%, 31.6%
|
30.0%, 40.3%
| |
Woche 26
| |
N
|
327
|
328
| |
Responder
|
87 (26.6%)
|
122 (37.2%)*
| |
95% CI
|
21.8%, 31.4%
|
32.0%, 42.4%
| |
Wochen 6 & 26 (anhaltendes Ansprechen)
| |
N
|
325
|
325
| |
Responder
|
52 (16.0%)
|
75 (23.1%)*
| |
95% CI
|
12.0%, 20.0%
|
18.5%, 27.7%
|
§ p-Wert nicht berechnet
* p-Wert <0.05 logistischer Regressionstest
Die Anwendung von Immunsuppressiva oder Kortikosteroiden zum Baseline-Zeitpunkt hatte keine Auswirkungen auf das klinische Ansprechen auf Cimzia. Cimzia war wirksam in Bezug auf die Induktion und Aufrechterhaltung des Ansprechens in der Subpopulation der mit Infliximab vorbehandelten Patienten (Woche 6: 24.5% vs. 20.0%; Wochen 6 und 26: 15.5% vs. 10.6% für Cimzia bzw. Placebo).
Cimzia war wirksam in Bezug auf die Induktion und Aufrechterhaltung des Ansprechens in der Subpopulation der nicht mit Infliximab vorbehandelten Patienten (Woche 6: 39.7% vs 29.2%; Wochen 6 und 26: 26.3% vs. 17.9% für Cimzia bzw. Placebo). Die Auswirkungen von Morbus Crohn auf den Patienten wurden im Verlauf der Studie mittels eines krankheitsspezifischen Fragebogens, des sog. Inflammatory Bowel Disease Questionnaire (IBDQ), sowie eines Fragebogens (SF-36) zum allgemeinen Gesundheitszustand bewertet.
Anhand des IBDQ (Gesamtwert ≥16 Punkte gegenüber Baseline) zeigte in den Wochen 6, 16 und 26 in der mit Cimzia 400 mg behandelten Gruppe ein grösserer Anteil der Patienten eine klinisch bedeutsame Verbesserung in Bezug auf das Behandlungsergebnis als in der Placebogruppe.
Die mit 400 mg Cimzia behandelten Patienten wiesen in Woche 6, bzw. in den Wochen 6 und 26, im Vergleich zur Placebogruppe eine signifikante Schmerzlinderung (p ≤0.05) gegenüber Baseline anhand des körperlichen Schmerzwerts im Fragebogen SF-36 auf.
Studie II:
Bei der Studie II (PRECiSE 2) handelte es sich um eine randomisierte Studie zum Behandlungsabbruch, die an 668 Patienten mit aktivem Morbus Crohn durchgeführt wurde. Alle in die Studie aufgenommenen Patienten erhielten Cimzia 400 mg in den Wochen 0, 2 und 4; die Bewertung des klinischen Ansprechens erfolgte in Woche 6. Das klinische Ansprechen (Response) definierte sich als eine Abnahme des CDAI-Werts um mindestens 100 Punkte, eine klinische Remission als absoluter CDAI-Wert von 150 oder weniger. Die Responder wurden zu einer Erhaltungstherapie mit Cimzia 400 mg oder Placebo alle 4 Wochen (beginnend mit Woche 8) bis zur Woche 24 randomisiert.
Patienten, die in Woche 6 kein Ansprechen zeigten (Non-Responder) wurden aus der Studie ausgeschlossen. Drei Patienten wurden von der ITT-Analyse ausgeschlossen.
Insgesamt 668 Patienten mit aktivem Morbus Crohn erhielten Cimzia 400 mg als Induktionstherapie nach dem Open-Label-Prinzip.
Davon sprachen 428 (64.1%) auf die Behandlung an und wurden in Woche 6 für Placebo (212; ITT 210) bzw. Cimzia 400 mg (216; ITT 215) randomisiert; sie erhielten mindestens eine doppelblinde Injektion. Ein Wirkungseintritt zeigte sich in Woche 2.
Von den Respondern in Woche 6 zeigten 45.1% ein klinisches Ansprechen in Woche 2.
Die Ergebnisse in Bezug auf das klinische Ansprechen (Response) bzw. Remission sind in Tabelle 2 dargestellt. In Woche 26 zeigte in der Cimzia-Gruppe ein signifikant höherer Anteil der Woche-6-Responder ein klinisches Ansprechen bzw. eine klinische Remission als in der Gruppe mit 3 Dosierungen Cimzia + Placebo.
Tabelle 2: PRECiSE 2 – Klinisches Ansprechen (Response) und klinische Remission in der Gesamt-Studienpopulation
|
Zeitpunkt
|
Klinisches Ansprechen (Response)
Anzahl (%)
|
Klinische Remission
Anzahl (%)
| |
|
Cimzia
400 mg × 3
+ Placebo*
N=210
|
Cimzia
400 mg
N=215
|
Cimzia 400 mg × 3
+ Placebo*
N=210
|
Cimzia 400 mg
N=215
| |
Woche 26
Anhaltendes Ansprechen
| |
N
|
210
|
215
|
210
|
215
| |
Responder
|
76 (36.2%)
|
135 (62.8%)
|
60 (28.6%)
|
103 (47.9%)
| |
95% CI
|
29.7%, 42.7%
|
56.3%, 69.3%
|
22.5%, 34.7%
|
41.2%, 54.6%
| |
p-Wert
|
|
<0.001
|
|
<0.001
|
* Diese Tabelle bezieht sich ausschliesslich auf den doppelblinden Teil der Studie.
Abbildung 1: PRECiSE 2 – Klinisches Ansprechen im zeitlichen Verlauf; gesamte ITT-Population
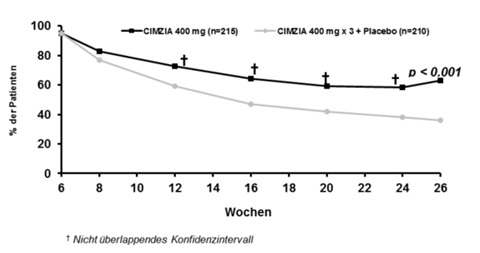
Die Anwendung von Immunsuppressiva oder Kortikosteroiden zum Baseline-Zeitpunkt hatte keine Auswirkungen auf das klinische Ansprechen auf Cimzia. Cimzia war wirksam in Bezug auf die Aufrechterhaltung des Ansprechens bis zur Woche 26 sowohl in der Subpopulation der mit Infliximab vorbehandelten Patienten (44.2% vs 25.5% für Cimzia bzw. Placebo), als auch bei den nicht mit Infliximab vorbehandelten Patienten (68.7% bzw. 39.6%).
Die Auswirkungen von Morbus Crohn auf den Patienten wurden im Verlauf der Studie mittels eines krankheitsspezifischen Fragebogens, des sog. Inflammatory Bowel Disease Questionnaire (IBDQ), sowie eines weiteren Fragebogens (SF-36) zum allgemeinen Gesundheitszustand bewertet.
Anhand des IBDQ (Gesamtwert ≥16 Punkte gegenüber Baseline) zeigte in den Wochen 16 und 26 in der mit Cimzia 400 mg behandelten Gruppe ein grösserer Anteil der Patienten eine klinisch bedeutsame Verbesserung in Bezug auf das Behandlungsergebnis als in der Placebogruppe.
Die mit 400 mg Cimzia behandelten Patienten wiesen in Woche 26 im Vergleich zur Placebogruppe eine signifikante Schmerzlinderung (p ≤0.05) gegenüber Baseline anhand des körperlichen Schmerzwerts im Fragebogen SF-36 auf. Die Ergebnisse in Bezug auf die «körperliche Rollenerfüllung» im Fragebogen waren bei Cimzia besser als bei Placebo; sie waren jedoch nicht statistisch signifikant (p >0.05).
Cimzia wurde für die Behandlung pädiatrischer Patienten mit mässig bis schwer aktivem Morbus Crohn untersucht (Studie C87035 und deren Langzeit-Follow-Up CR0012). Die Wirksamkeit von Cimzia wurde in einer offenen, randomisierten, parallelen Gruppenstudie mit Mehrfachgabe über einen Zeitraum von bis zu 62 Wochen bei 99 Probanden im Alter von 6 bis 17 Jahren nicht nachgewiesen (C87035). Die Studie wurde aufgrund einer hohen Abbruchrate vorzeitig beendet.
Rheumatoide Arthritis
RA-I, RA-II, Studien
Die Wirksamkeit und Sicherheit von Cimzia wurden in zwei randomisierten, placebokontrollierten, doppelblinden klinischen Studien, RA-I (RAPID 1) und RA-II (RAPID 2), bei Patienten ab 18 Jahren mit aktiver rheumatoider Arthritis untersucht. Die Diagnose der Arthritis wurde entsprechend den Kriterien des American College of Rheumatology (ACR) vorgenommen. Jeder Patient hatte mindestens 9 geschwollene und schmerzempfindliche Gelenke und eine aktive RA seit mindestens 6 Monaten vor Studienbeginn. Cimzia wurde in beiden Studien subkutan in Kombination mit MTX p.o. für mindestens 6 Monate verabreicht, wobei MTX in einer stabilen Dosis von mindestens 10 mg pro Woche für zwei Monate gegeben wurde. Es liegen keine Erfahrungen zu Cimzia in Kombination mit anderen DMARDs als MTX vor.
C-EARLY Studie
Die Wirksamkeit und Sicherheit von Cimzia wurden in einer randomisierten, placebokontrollierten, doppelblinden klinischen Studie (C-EARLY) bei erwachsenen Patienten mit mittelschwerer (3.5%) bis schwerer (96.5%) aktiver RA ohne DMARD-Vorbehandlung untersucht. In der Studie C-EARLY waren die Patienten mindestens 18 Jahre alt und hatten je mindestens 4 geschwollene und schmerzempfindliche Gelenke und die Diagnosestellung musste innerhalb eines Jahres erfolgt sein (definiert nach den Klassifizierungskriterien der ACR/European League Against Rheumatism [EULAR] aus dem Jahr 2010). Der DAS28 bei Baseline musste >3.2 sein (mittlere bis hohe Krankheitsaktivität) und CRP war ≥10 mg/l bzw. die ESR ≥28 mm/Std. Bei Studienbeginn lag die Diagnose bei den Patienten im Mittel 2.9 Monate zurück und die Patienten hatten vorgängig keine Behandlung mit DMARDs (einschliesslich MTX) erhalten. 96.5% der Studienpatienten wiesen eine schwere RA auf. Patienten erhielten eine Anfangsdosis (Wochen 0, 2 und 4) von 400 mg oder Placebo und dann eine Erhaltungsdosis von 200 mg Cimzia oder Placebo alle 2 Wochen während 52 Wochen. Sowohl im Cimzia- als auch im Placeboarm wurde mit der Anwendung von MTX in Woche 0 begonnen (10 mg/Woche), bis Woche 8 wurde es auf eine maximal verträgliche Dosis erhöht (es waren mindestens 15 mg/Woche und höchstens 25 mg/Woche zulässig) und diese wurde dann während der Studie beibehalten (die MTX-Dosis nach Woche 8 betrug in der Placebogruppe im Durchschnitt 22.3 mg/Woche und in der Cimzia-Gruppe im Durchschnitt 21.1 mg/Woche).
Im weiteren Verlauf wurde im zweiten Jahr die Erhaltung der Antwort untersucht. Dazu wurden die Patienten mit anhaltender niedriger Krankheitsaktivität (DAS28 [ESR] < 3.2 in Woche 40 und Woche 52) unter Cimzia 200 mg alle 2 Wochen + MTX, in Woche 52, nach Cimzia 200 mg alle 2 Wochen + MTX, Cimzia 200 mg alle 4 Wochen + MTX, oder Placebo + MTX re-randomisiert (im Verhältnis 2:3:2). Die Endpunkte sind in Tabelle 3 zusammengefasst.
Tabelle 3: Beschreibung der klinischen Studien
|
Studien-Nr.
|
Patienten-anzahl
|
Dosisregime
|
Studienziele
| |
RA-I
(52 Wochen)
|
982
|
400 mg (0, 2, 4 Wochen) mit MTX
|
Beurteilung in Bezug auf die Behandlung der Anzeichen und Symptome und Hemmung von Strukturschäden
| |
200 mg oder 400 mg alle 2 Wochen mit MTX
|
Gleichzeitige primäre Endpunkte: ACR 20 nach 24 Wochen und Änderungen gegenüber dem Ausgangswert nach 52 Wochen beim mTSS
| |
RA-II
(24 Wochen)
|
619
|
400 mg (0, 2, 4 Wochen) mit MTX
|
Beurteilung in Bezug auf die Behandlung der Anzeichen und Symptome und Hemmung von Strukturschäden
| |
200 mg oder 400 mg alle 2 Wochen mit MTX
|
Primärer Endpunkt: ACR 20 nach 24 Wochen
| |
C-EARLY
(bis 104 Wochen)
|
879
|
400 mg (0, 2, 4 Wochen) mit MTX
200 mg alle 2 Wochen mit MTX
200 mg alle 4 Wochen mit MTX
(Rerandomisierung nach 52 Wochen)
|
Beurteilung in Bezug auf die Behandlung der Anzeichen und Symptome und Hemmung des Fortschreitens von Strukturschäden bei Patienten ohne DMARD-Vorbehandlung
Primärer Endpunkt in Woche 52:
Anteil der Teilnehmer in anhaltender Remission*
Primärer Endpunkt in Woche 104: Erhaltung der niedrigen Krankheitsaktivität**
|
mTSS: modified Total Sharp Score
* Anhaltende Remission in Woche 52 ist definiert als DAS28 (ESR) <2.6 in Woche 40 und in Woche 52.
** Anhaltende niedrige Krankheitsaktivität in Woche 104 definiert als DAS28 (ESR) <3.2 in Woche 52 und Woche 104 ohne Krankheitsschub (=DAS28 (ESR)-Anstieg >=0.6 und DAS28 (ESR) >3.2)
ACR-Ansprechen
Die Ergebnisse der klinischen Studien RA-I und RA-II sind in Tabelle 4 dargestellt. In beiden klinischen Studien wurde im Vergleich zu Placebo ab Woche 1 bzw. 2 ein statistisch signifikant grösseres ACR-20- und ACR-50-Ansprechen erreicht. Das Ansprechen wurde bis Woche 52 (RA-I) und Woche 24 (RA-II) aufrechterhalten. Von den 783 Patienten, die zu Beginn der RA-I zur Verumbehandlung randomisiert wurden, schlossen 508 Patienten 52 Wochen der placebokontrollierten Behandlung ab und traten in die offene Verlängerungsstudie ein. Von diesen schlossen 427 Patienten 2 Jahre der offenen Nachbeobachtung ab, so dass sich eine Cimzia-Gesamtexposition von insgesamt 148 Wochen ergab. Die beobachtete ACR-20-Ansprechrate zu diesem Zeitpunkt betrug 91%. Die Verminderung (RA-I) des DAS28 (ESR) gegenüber dem Ausgangswert in Woche 52 (RA-I) und Woche 24 (RA-II) war im Vergleich zu Placebo ebenfalls signifikant grösser (p<0.001) und blieb über 2 Jahre in der offenen Verlängerungsstudie zu RA-I erhalten.
Tabelle 4: ACR-Ansprechen in den klinischen Studien RA-I und RA-II
|
|
Studie RA-I
Methotrexat-Kombination
(24 und 52 Wochen)
|
Studie RA-II
Methotrexat-Kombination
(24 Wochen)
| |
Ansprechen
|
Placebo
+ MTX
N=199
|
Cimzia 200 mg
+ MTX alle 2 Wochen
N=393
|
Placebo
+ MTX
N=127
|
Cimzia 200 mg
+ MTX alle 2 Wochen
N=246
| |
ACR 20
| |
Woche 24
|
14%
|
59%**
|
9%
|
57%**
| |
Woche 52
|
13%
|
53%**
|
k. A.
|
k. A.
| |
ACR 50
| |
Woche 24
|
8%
|
37%**
|
3%
|
33%**
| |
Woche 52
|
8%
|
38%**
|
k. A.
|
k. A.
| |
ACR 70
| |
Woche 24
|
3%
|
21%**
|
1%
|
16%*
| |
Woche 52
|
4%
|
21%**
|
k. A.
|
k. A.
| |
Wesentliches klinisches Ansprechena
|
1%
|
13%**
|
|
|
Cimzia vs. Placebo: * p≤0.01, ** p<0.001
a Ein wesentliches klinisches Ansprechen ist definiert als das Erreichen des ACR-70-Ansprechens bei allen Untersuchungen über einen kontinuierlichen Zeitraum von 6 Monaten.
Wald-p-Werte werden für den Vergleich zwischen den Behandlungen unter Anwendung der logistischen Regression mit Faktoren für Behandlung und Region angegeben.
Grundlage des prozentualen Ansprechens ist die Zahl der Teilnehmer, die bis zu jenem Endpunkt und Zeitpunkt, der von N verschieden sein kann, Daten (n) liefern.
Die Studie C-EARLY erreichte ihren primären und ihren wichtigsten sekundären Endpunkt. Die wichtigsten Ergebnisse der Studie sind in Tabelle 5 angegeben.
Tabelle 5: C-EARLY-Studie: Prozentanteil der Patienten in anhaltender Remission und mit anhaltend niedriger Krankheitsaktivität in Woche 52
|
Ansprechen
|
Placebo + MTX
N=213
|
Cimzia 200 mg + MTX
N=655
| |
Anhaltende Remission*
(DAS28 [ESR] <2.6 in Woche 40 und in Woche 52)
|
15.0%
|
28.9%**
| |
Anhaltend niedrige Krankheitsaktivität
(DAS28 [ESR] ≤3.2 in Woche 40 und in Woche 52)
|
28.6%
|
43.8%**
|
* Primärer Endpunkt der Studie C-EARLY (bis Woche 52)
Gesamtgruppe (Full Analysis Set), Non-Responder-Imputation bei fehlenden Werten.
** Cimzia + MTX vs. Placebo + MTX: p<0.001
Der p-Wert wurde ausgehend von einem logistischen Regressionsmodell mit Behandlung, Region und Dauer seit der RA-Diagnose bei Studienbeginn (≤4 Monate vs. >4 Monate) als Faktoren geschätzt.
Bei den Patienten in der mit Cimzia + MTX behandelten Gruppe verminderte sich der DAS28 (ESR) stärker gegenüber Studienbeginn als in der Gruppe, die Placebo + MTX erhielt, was bereits in Woche 2 der Fall war und sich bis Woche 52 fortsetzte (p<0.001 bei jedem Besuch). Die Beurteilung der Remission (DAS28[ESR] <2,6), des niedrigen Krankheitsaktivitätsstatus (DAS28[ESR] ≤3,2), ACR 50 und ACR 70 je Untersuchung zeigten, dass die Behandlung mit Cimzia + MTX zu einem schnelleren und stärkeren Ansprechen führte als die Behandlung mit Placebo + MTX. Diese Ergebnisse hielten während der 52-wöchigen Behandlungsdauer bei DMARD-naiven Studienteilnehmern an.
In Patienten mit niedriger Krankheitsaktivität in Woche 52 wurde bei Fortführung der Cimzia + MTX Kombinationstherapie bis Woche 104 gegenüber den Patienten, bei denen Cimzia abgesetzt wurde, die Antwort nummerisch häufiger erhalten (41/84, 48.8%, gegen 31/79, 39,2%, p=0.112).
Radiologisches Ansprechen
In der Studie RA-I wurde der strukturelle Gelenkschaden im Röntgenbild beurteilt und als Veränderung im mTSS (modified Total Sharp Score) und seinen Komponenten, des Erosion Scores und des Gelenkspaltverschmälerung Scores (JSN von Joint Space Narrowing) nach 52 Wochen im Vergleich zum Ausgangswert beurteilt. Patienten unter Cimzia wiesen in Woche 24 und Woche 52 eine signifikant geringere radiologische Progredienz auf als Patienten, die Placebo erhielten (siehe Tabelle 6). In der Placebogruppe wurde nach 52 Wochen bei 52% der Patienten keine Progredienz im Röntgenbild entdeckt (mTSS ≤0.0) im Vergleich zu 69% in der Behandlungsgruppe mit Cimzia 200 mg.
Tabelle 6: Änderungen über 12 Monate in RA-I
|
|
Placebo + MTX
N=199
Mittelwert (SD)
|
Cimzia 200 mg + MTX
N=393
Mittelwert (SD)
|
Cimzia 200 mg + MTX – Placebo + MTX
mittlerer Unterschied
| |
mTSS
| |
Woche 52
|
2.8 (7.8)
|
0.4 (5.7)
|
-2.4
| |
Erosion Score
| |
Woche 52
|
1.5 (4.3)
|
0.1 (2.5)
|
-1.4
| |
JSN Score
| |
Woche 52
|
1.4 (5.0)
|
0.4 (4.2)
|
-1.0
|
Die p-Werte betrugen <0.001 sowohl für mTSS and den Erosion Score und ≤0.01 für den JSN Score. Eine Kovarianzanalyse (ANCOVA) wurde an die gewichtete Änderung gegenüber der Ausgangslage für jeden Parameter mit Region und Behandlung als Faktoren und Ausgangsrang als eine Kovariate angepasst.
Von den 783 Patienten, die zu Beginn der RA-I zur Verumbehandlung randomisiert wurden, schlossen 508 Patienten 52 Wochen der Placebo-kontrollierten Behandlung ab und traten in die offene Verlängerungsstudie ein. Eine andauernde Hemmung der Progredienz der strukturellen Schädigung wurde in einer Subgruppe von 449 dieser Patienten nachgewiesen, die mindestens 2 Jahre lang mit Cimzia behandelt wurden (RA-I und offene Verlängerungsstudie) und von denen zum 2-Jahres-Zeitpunkt auswertbare Daten vorlagen.
In der Studie C-EARLY hatte Cimzia + MTX in Woche 52 die radiologische Progression im Vergleich zu Placebo + MTX gehemmt (siehe Tabelle 7). In der mit Placebo + MTX behandelten Gruppe wiesen 49.7% der Patienten in Woche 52 keine radiologische Progression auf (Veränderung des mTSS ≤0.5), verglichen mit 70.3% in der mit Cimzia + MTX behandelten Gruppe (p<0.001).
Tabelle 7: Radiologische Veränderung in Woche 52 in der C-EARLY-Studie
|
|
Placebo + MTX
N=163
Mittelwert (SD)
|
Cimzia 200 mg + MTX
N=528
Mittelwert (SD)
|
Cimzia 200 mg + MTX – Placebo + MTX
Differenz*
| |
mTSS
Woche 52
|
1.8 (4.3)
|
0.2 (3.2)**
|
-0.978 (-1.005, -0.500)
| |
Erosion Score
Woche 52
|
1.1 (3.0)
|
0.1 (2.1)**
|
-0.500 (-0.508, -0336)
| |
JSN Score
Woche 52
|
0.7 (2.3)
|
0.1 (1.7)**
|
0.000 (0.000, 0.000)
|
Radiologischer Datensatz mit linearer Extrapolation.
* Hodges-Lehmann-Punktschätzung der Verschiebung und asymptotisches 95%-Konfidenzintervall (Moses)
** Cimzia + MTX vs. Placebo + MTX p<0.001. Der p-Wert wurde geschätzt ausgehend von einem ANCOVA-Modell der Ränge mit Behandlung, Region und Dauer seit der RA-Diagnose bei Studienbeginn (≤4 Monate vs. >4 Monate) als Faktoren und dem Rang bei Studienbeginn als Kovariable.
In Patienten mit niedriger Krankheitsaktivität in Woche 52 wurde bis Woche 104 nur wenige Patienten mit einer Progression der strukturellen Schäden beobachtet (7/72, 10% der Patienten unter Cimzia 200 mg + MTX alle 2 Wochen; 18/113 und 15/75, 20% der Patienten unter Placebo + MTX). Die Daten erlauben keine vergleichenden Rückschlüsse zwischen den Dosisregimes.
Lebensqualität und körperliche Funktionsfähigkeit
In RA-I und RA-II zeigten die Cimzia-Patienten von Woche 1 bis zum Ende der Studien signifikante Verbesserungen im Vergleich zu Placebo (p<0.001) bei der körperlichen Leistung, bewertet anhand des «Health Assessment Questionnaire-Disability Index» (HAQ-DI) Fragebogens, und der Abgeschlagenheit, bewertet anhand der «Fatigue Assessment Scale» (FAS). In beiden klinischen Studien berichteten die Patienten der Cimzia-Gruppe über signifikant grössere Verbesserungen in den SF-36 «Physical and Mental Component Summaries» und allen Domain-Punktwerten. Verbesserungen der körperlichen Leistung und der HRQoL wurden über 2 Jahre in der offenen Verlängerungsstudie von RA-I aufrechterhalten. Mit Cimzia behandelte Patienten zeigten im «Work Productivity Survey» statistisch signifikante Verbesserungen im Vergleich zu Placebo.
In der Studie C-EARLY gaben mit Cimzia + MTX behandelte Patienten in Woche 52 im Vergleich zu den mit Placebo + MTX behandelten Patienten signifikante Verbesserungen der körperlichen Funktion bei Beurteilung mit dem HAQ-DI und der Arthritis-Schmerzen bei Beurteilung mit dem PtAAP («Patient Assessment of Arthritis Pain») an (p<0.001 bzw. p<0.05). In Woche 52 hatten 48.1% der Patienten in der mit Cimzia + MTX behandelten Gruppe die normative körperliche Funktion (HAQ-DI Score ≤0.5) erreicht im Vergleich zu 35.7% in der mit Placebo + MTX behandelten Gruppe (p<0.01).
Axiale Spondyloarthritis (Subpopulationen mit nicht-radiographischer axialer Spondyloarthritis und ankylosierender Spondylitis)
AS001
Die Wirksamkeit und Sicherheit von Cimzia wurden im Rahmen einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AS001) untersucht. Sie umfasste 325 Patienten ≥18 Jahren mit im Erwachsenenalter einsetzender, aktiver axialer Spondyloarthritis seit mindestens drei Monaten, gemäss den Klassifizierungskriterien für axiale Spondyloarthritis der Assessment of Spondyloarthritis International Society (ASAS). Axiale Spondyloarthritis bezeichnet eine Spondyloarthritis mit vorrangig axialer Beteiligung und umfasst die Krankheitssubgruppe ankylosierende Spondylitis sowie die Krankheitssubgruppe mit keinem definitiven Nachweis einer Sakroiliitis in Röntgenleeraufnahmen, bezeichnet als nicht-röntgenologische axiale Spondyloarthritis. Die Studienpopulation mit axialer Spondyloarthritis umfasste sowohl Subpopulationen mit ankylosierender Spondylitis (AS) (auch radiographische axiale Spondyloarthritis genannt) als auch mit nicht-röntgenologischer axialer Spondyloarthritis. Die Patienten zeigten eine aktive Erkrankung, welche definiert wurde durch einen Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) ≥4, Schmerzen der Wirbelsäule ≥4 auf einer numerischen Bewertungsskala (NRS) von 0 bis 10 und erhöhtes CRP oder aktueller Nachweis einer Sakroiliitis mittels Magnetresonanztomographie (MRT). Ausserdem mussten sie gegen mindestens ein NSAID eine Intoleranz oder ein unzureichendes Ansprechen gezeigt haben.
Insgesamt wurden 16% der Patienten zuvor mit einem TNF-Antagonisten behandelt. Die Patienten erhielten eine Initialdosis Cimzia von 400 mg in den Wochen 0, 2 und 4 (für beide Behandlungsarme) oder Placebo gefolgt von entweder 200 mg Cimzia alle zwei Wochen oder 400 mg Cimzia alle vier Wochen oder Placebo. 87.7% der Patienten erhielten begleitend NSAIDs. Der primäre Wirksamkeitsendpunkt war die ASAS20-Ansprechrate in Woche 12. 153 Patienten nahmen an einer Bildgebungssubstudie teil.
CRP ist ein sensitiver Marker für Entzündungen und könnte aus anderen Gründen als nicht-röntgenologische axiale Spondyloarthritis erhöht sein. Bei Patienten mit schwerer aktiver nicht-röntgenologischer axialer Spondyloarthritis ohne einen definitiven Beweis von Sakroiliitis auf Röntgenaufnahmen sollte daher ein erhöhter CRP-Wert mit Nachweis einer Sakroiliitis in den SI-Gelenken mittels MRT unterstützt werden.
ASAS -Ansprechen
In der klinischen Studie AS001 erreichten in Woche 12 58% der Patienten unter 200 mg Cimzia alle zwei Wochen und 64% der Patienten unter 400 mg Cimzia alle vier Wochen ein ASAS20-Ansprechen, im Vergleich zu 38% unter Placebo (p <0.01).
In der Gesampopulation war der Anteil der ASAS20-Responder bei jeder Untersuchung nach Baseline bis Woche 24 klinisch relevant und signifikant höher in der Behandlungsgruppen mit 200 mg Cimzia alle zwei Wochen und 400 mg Cimzia alle vier Wochen als in der Placebogruppe (p≤0.001 bei jeder Untersuchung).
In den Subpopulationen ankylosierende Spondylitis und nicht-röntgenologische axiale Spondyloarthritis wurden ähnliche Ergebnisse erreicht (siehe Tabelle 8).
Die mit Cimzia behandelten Patienten zeigten im Vergleich zu Patienten unter Placebo ausserdem signifikante Verbesserungen bei mehreren Komponenten der Krankheitsaktivität der axialen Spondyloarthritis (Schmerzen [Gesamtschmerzen der Wirbelsäule], Funktionsfähigkeit [BASFI], Entzündung [BASDAI Mittelwert aus Q5/6], nächtliche Schmerzen der Wirbelsäule, Müdigkeit, BASMI).
Tabelle 8: Wirksames Ansprechen in der klinischen Studie AS001: Reduktion der Anzeichen und Symptome bei den Subpopulationen mit ankylosierender Spondylitis und nicht-röntgenologischer axialer Spondyloarthritis (Prozent der Patienten)
|
Parameter
|
Ankylosierende Spondylitis
|
Nicht-röntgenologische axiale
Spondyloarthritits
| |
|
Placebo
N=57
|
Cimzia – alle
Dosisregime(a)
N=121
|
Placebo
N=50
|
Cimzia – alle
Dosisregime(a)
N=97
| |
ASAS20(b, c)
| |
Woche 12
|
37%
|
60%*
|
40%
|
61%*
| |
Woche 24
|
33%
|
69%**
|
24%
|
68%**
| |
ASAS40(c, d)
| |
Woche 12
|
19%
|
45%**
|
16%
|
47%**
| |
Woche 24
|
16%
|
53%**
|
14%
|
51%**
| |
ASAS 5/6(c, d)
| |
Woche 12
|
9%
|
42%**
|
8%
|
44%**
| |
Woche 24
|
5%
|
40%**
|
4%
|
45%**
| |
Partielle Remission(c, d)
| |
Woche 12
|
2%
|
20%**
|
6%
|
29%**
| |
Woche 24
|
7%
|
28%**
|
10%
|
33%**
| |
BASDAI 50(c, d)
| |
Woche 12
|
11%
|
41%**
|
n.v.
|
n.v.
| |
Woche 24
|
16%
|
49%**
|
n.v.
|
n.v.
|
a) Cimzia - alle Dosisregime = Daten für 200 mg Cimzia alle zwei Wochen, nach einer Initialdosis von 400 mg in den Wochen 0, 2 und 4, und 400 mg Cimzia alle vier Wochen, nach einer Initialdosis von 400 mg in den Wochen 0, 2 und 4
(b) Ergebnisse der randomisierten Gruppe
(c) Behandlungsdifferenz: Cimzia 200 – Placebo, Cimzia 400 – Placebo (entspricht 95% KI und p-Wert) werden mittels eines normalen zweiseitigen Wald-Tests bestimmt. Es wird Non-Responder Imputation (NRI) verwendet.
(d) Full Analysis Set
n.v. = nicht verfügbar
* p≤0.05, Cimzia vs Placebo
** p<0.001, Cimzia vs Placebo
Wirbelsäulenbeweglichkeit
Die Wirbelsäulenbeweglichkeit wurde zu Studienbeginn, in Woche 12 und in Woche 24 anhand des BASMI bewertet. Zwischen Patienten unter Cimzia und Patienten unter Placebo konnten bei jeder Untersuchung nach Studienbeginn klinisch bedeutsame und statistisch signifikante Unterschiede gezeigt werden.
Die Differenz zu Placebo der mittleren Veränderung des linearen BASMI-Werts gegenüber Baseline betrug bei Patienten unter Cimzia -0.40 Punkte (p<0.001) bis Woche 12 und -0.44 Punkte (p<0.001) bis Woche 24. Die Differenz zu Placebo war in der Subpopulation nicht-röntgenologische axiale Spondyloarthritis höher (-0.60 und -0.59 Punkte bis Woche 12 bzw. Woche 24) als in der Subpopulation ankylosierende Spondylitis (-0.21 und -0.32 Punkte bis Woche 12 bzw. Woche 24).
Entzündungshemmung in der Magnetresonanztomographie (MRT)
In einer Bildgebungssubstudie wurden in Woche 12 die Entzündungsanzeichen mittels MRT untersucht und dargestellt als Änderung gegenüber Baseline im SPARCC (Spondyloarthritis Research Consortium of Canada)-Score für die sakroiliakalen Gelenke und im ASspiMRI-a Score (Berlin-Modifikation) für die Wirbelsäule. Bei Patienten unter Cimzia (alle Dosisregime), der Gesamtpopulation mit axialer Spondyloarthritis sowie in den Subpopulationen ankylosierende Spondylitis und nicht-röntgenologische axiale Spondyloarthritis konnte eine signifikante Hemmung der Entzündungsanzeichen in den sakroiliakalen Gelenken und der Wirbelsäule beobachtet werden, jedoch nicht bei Patienten unter Placebo.
C-OPTIMISE
Bei erwachsenen Patienten (18-45 Jahre) mit früher aktiver axSpA (Symptomdauer von weniger als 5 Jahren), einem ASDAS-Score ≥2,1 (und ähnlichen Krankheitseinschlusskriterien wie in der AS001-Studie) und mit unzureichendem Ansprechen auf mindestens 2 NSAR oder einer Unverträglichkeit oder Kontraindikation für NSAR wurden die Wirksamkeit und Sicherheit einer Dosisreduktion bzw. eines Behandlungsabbruchs bei Patienten in anhaltender Remission untersucht. Als Patienten waren sowohl die AS- als auch die nr-axSpA-Subpopulation von axSpA eingeschlossen. Sie wurden in eine 48-wöchige open-Label Run-in-Periode (Teil A) aufgenommen, in der alle Patienten drei Initialdosen von je 400 mg Cimzia in den Wochen 0, 2 und 4 erhielten, gefolgt von Cimzia 200 mg alle 2 Wochen von Woche 6 bis Woche 46.
Patienten, die eine anhaltende Remission erreichten (definiert als Patienten mit inaktiver Krankheit [ASDAS < 1,3] über einen Zeitraum von mindestens 12 Wochen) und bis Woche 48 in Remission blieben, wurden in Teil B randomisiert und erhielten 48 Wochen lang entweder Cimzia 200 mg alle 2 Wochen (N=104), Cimzia 200 mg alle 4 Wochen (Dosisreduktion, N=105) oder Placebo (Behandlungsabbruch, N=104).
Die primäre Wirksamkeitsvariable war der Prozentsatz an Patienten, bei denen während Teil B kein Schub auftrat.
Patienten, bei denen in Teil B ein Schub auftrat, d.h. ASDAS ≥2,1 an zwei aufeinanderfolgenden Besuchsterminen oder ASDAS > 3,5 an irgendeinem der Besuchstermine während Teil B, erhielten mindestens 12 Wochen lang alle 2 Wochen eine Escape-Behandlung mit Cimzia 200 mg (mit einer Initialdosis von 400 mg Cimzia in Woche 0, 2 und 4 bei mit Placebo behandelten Patienten).
Klinisches Ansprechen
Der Prozentsatz der Patienten, die in Woche 48 in Teil A eine anhaltende Remission erreichten, betrug bei der gesamten axSpA-Population 43,9 %, mit ähnlichen Anteilen in den Subpopulationen nr-axSpA (45,3 %) und AS (42,8 %).
Unter den Patienten, die in Teil B randomisiert wurden (N=313), trat bei einem statistisch signifikant (p < 0,001, NRI) grösseren Anteil der Patienten kein Schub auf, wenn die Behandlung mit Cimzia 200 mg alle 2 Wochen (83,7 %) bzw. Cimzia 200 mg alle 4 Wochen (79,0 %) im Vergleich zum Behandlungsabbruch (20,2 %) fortgesetzt wurde.
Hinsichtlich der Zeit bis zum Schub war der Unterschied zwischen der Behandlungsabbruch-Gruppe und den beiden jeweiligen Cimzia-Behandlungsgruppen statistisch signifikant (p < 0,001 je Vergleich) und klinisch aussagekräftig. In der Placebogruppe begannen die Schübe etwa 8 Wochen nach dem Abbruch von Cimzia, wobei die meisten Schübe innerhalb von 24 Wochen nach dem Behandlungsabbruch auftraten (Abbildung 2).
Abbildung 2: Kaplan-Meier-Kurve der Zeit bis zum Schub
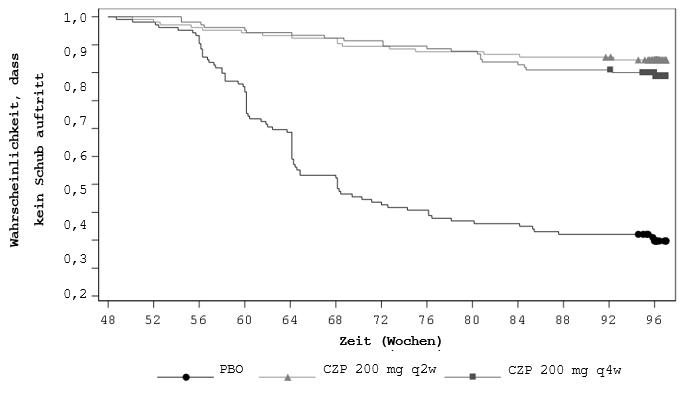
Es wurde die Non-Responder-Imputation (NRI) verwendet. Die Ergebnisse beziehen sich auf das randomisierte Set.
Hinweis: Die Zeit bis zum Schub wurde definiert als die Zeit vom Datum der Randomisierung bis zum Datum des Schubs. Bei Studienteilnehmern, bei denen kein Schub auftrat, wurde die Zeit bis zum Schub am Datum des Besuchstermins in Woche 96 zensiert.
Die Kaplan-Meier-Darstellung wurde auf 97 Wochen verkürzt, als noch < 5 % der Teilnehmer in der Studie verblieben waren.
Erneute Behandlung bei Patienten, bei denen ein Schub auftrat
In Teil B trat bei 70 % (73/104) der mit Placebo behandelten Patienten, 14 % (15/105) der alle 4 Wochen mit Cimzia 200 mg behandelten Patienten und 6,7 % (7/104) der alle 2 Wochen mit Cimzia 200 mg behandelten Patienten ein Schub auf. Anschliessend wurden diese Patienten alle 2 Wochen mit Cimzia 200 mg behandelt.
In der Gruppe mit einem Behandlungsabbruch schlossen 71 der 73 Patienten, bei denen ein Schub auftrat, eine 12-wöchige Escape-Behandlung mit Cimzia ab und verfügten über ASDAS-Daten. Von diesen wiesen 12 Wochen nach Wiederaufnahme der Open-Label-Behandlung 64 (90%) eine geringe oder inaktive ASDAS-Erkrankung auf (d.h. alle ASDAS < 2,1).
Die Anzahl der Patienten in beiden Cimzia-Gruppen die einen Schub aufwiesen, war zu gering, um eine gültige Bewertung der Auswirkungen einer erneuten Behandlung in diesen Fällen vorzunehmen.
Basierend auf den Ergebnissen aus C-OPTIMISE kann bei Patienten in anhaltender Remission nach einem Jahr der Behandlung mit Cimzia eine Dosisreduktion in Betracht gezogen werden (siehe «Dosierung/Anwendung»).
Nicht-radiographische axiale Spondyloarthritis (nr-axSpA)
Die Wirksamkeit und Sicherheit von Cimzia wurden in einer 52-wöchigen multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AS0006) bei 317 Patienten ≥18 Jahre mit axialer Spondyloarthritis, aufgetreten im Erwachsenenalter und mit Rückenschmerzen seit mindestens 12 Monaten untersucht. Die Patienten mussten objektive Anzeichen der Entzündung aufweisen, bestimmt durch Werte für C-reaktives Protein (CRP), die über der oberen Normgrenze liegen, und/oder Nachweis von Sakroiliitis in der Magnetresonanztomographie (MRT), was auf eine entzündliche Erkrankung hindeutet [positiver CRP (> ULN) und/oder positive MRT], aber keine definitive radiographische Evidenz einer strukturellen Schädigung der Iliosakralgelenke. Die Patienten hatten eine aktive Erkrankung, definiert als BASDAI ≥4, und Wirbelsäulenschmerzen ≥4 auf einer NRS von 0 bis 10. Bei den Patienten musste eine Unverträglichkeit gegenüber oder ein unzureichendes Ansprechen auf mindestens zwei NSAID vorliegen. Die Patienten wurden mit Placebo oder einer Initialdosis Cimzia 400 mg in den Wochen 0, 2 und 4 sowie anschliessend mit 200 mg Cimzia alle 2 Wochen behandelt. Einsatz und Dosisanpassung von Standard-Therapien (wie z.B. NSAID, DMARD, Kortikosteroide und Schmerzmittel) waren jederzeit gestattet. Ebenso konnten Patienten jederzeit von der doppelblinden Studienbehandlung auf eine offene Behandlung mit Cimzia oder einem anderen Wirkstoff wechseln. Die primäre Wirksamkeitsvariable war das ASDAS-MI-Ansprechen (Ankylosing Spondylitis Disease Activity Score major improvement) in Woche 52. Das ASDAS-MI-Ansprechen war definiert als eine ASDAS-Reduktion (Verbesserung) ≥2,0 im Verhältnis zur Baseline oder das Erreichen des niedrigsten möglichen Wertes.
In der Cimzia-Gruppe bzw. Placebogruppe wiesen bei Baseline 37 % bzw. 41 % der Patienten eine hohe (ASDAS ≥2,1; ≤3,5) und 62 % bzw. 58 % der Patienten eine sehr hohe Krankheitsaktivität (ASDAS >3,5) auf.
Klinische Ansprechen
Im Vergleich zu den Patienten, die Placebo erhielten, erreichte, in Studie AS0006 in Woche 52, ein statistisch signifikant grösserer Anteil der Patienten, die mit Cimzia behandelt wurden, die ASDAS-MI-Ansprechen. Mit Cimzia behandelte Patienten zeigten im Vergleich zu mit Placebo behandelten Patienten Verbesserungen in mehreren Komponenten der axialen Spondyloarthritis Krankheitsaktivität. Sowohl in Woche 12 als auch in Woche 52 war die ASAS 40-Ansprechen signifikant höher als mit Placebo. Die wichtigsten Ergebnisse sind in Tabelle 9 und 10 dargestellt.
Tabelle 9: ASDAS-MI- und ASAS-40-Ansprechen in AS0006 (Prozent der Patienten)
|
Parameter
|
Placebo
N = 158
|
Cimziaa 200 mg alle 2 Wochen
N = 159
| |
ASDAS-MI
Woche 52
|
7 %
|
47 %*
| |
ASAS 40
Woche 12
Woche 52
|
11 %
16 %
|
48 %*
57 %*
|
a Cimzia, verabreicht alle 2 Wochen, im Anschluss an eine Initialdosis von 400 mg in Woche 0, 2 und 4
* p<0,001
Alle Prozentzahlen stehen für den Anteil von Patienten aus dem vollständigen Analysenset, die ein Ansprechen erreichten.
Tabelle 10: BASDAI und BASFI Ergebnisse in AS0006
|
Parameter
|
Placebo
N = 158
|
Cimzia(a) 200 mg alle 2 Wochen
N = 159
| |
|
Baseline
|
Woche 12
|
Woche 52
|
Baseline
|
Woche 12
|
Woche 52
| |
BASDAI(b)
|
6,79 (1,28)
|
5,71 (2,09)
|
5,47 (2,30)
|
6,88 (1,40)
|
3,93 (2,21)
|
3,26 (2,47)
| |
BASFI(c)
|
5,44 (2,18)
|
4,95 (2,46)
|
4,71 (2,60)
|
5,41 (2,12)
|
3,20 (2,33)
|
2,68 (2,42)
|
(a) Cimzia, verabreicht alle 2 Wochen, im Anschluss an eine Initialdosis von 400 mg in Woche 0, 2 und 4
(b) BASDAI ist der «Bath Ankylosing Spondylitis Disease Activity NRS Index», wobei 0 = keine und 10 = sehr stark bedeutet
(c) BASFI ist der «Bath Ankylosing Spondylitis Functional NRS Index», wobei 0 = einfach und 10 = unmöglich bedeutet
Es wurde ein vollständiges Analysenset mit Fortschreibung des letzten Wertes (last observation carried forward, LOCF) verwendet.
Zeichen der Entzündung wurden durch MRI in Woche 12 ermittelt und als Veränderung zur Baseline in SPARCC Punkten für Iliosakralgelenke dargestellt.
In Woche 12 und Woche 52, wurde bei mit Cimzia behandelten Patienten eine signifikante Hemmung der Entzündung der Iliosakralgelenke festgestellt (-4,3 bzw. -7,4) gegenüber bei mit Placebo behandelten Patienten (0,3 bzw. 2,3), verglichen mit Baseline.
Psoriatische Arthritis
Wirksamkeit und Sicherheit von Cimzia wurden im Rahmen einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten klinischen Studie (PsA001) an 409 Patienten im Alter von ≥18 Jahren mit im Erwachsenenalter erstmals aufgetretener und seit mindestens 6 Monaten gemäss den Klassifizierungskriterien für psoriatische Arthritis (Classification Criteria for Psoriatic Arthritis, CASPAR-Kriterien) aktiver psoriatischer Arthritis beurteilt. Die Patienten wiesen ≥3 geschwollene, schmerzempfindliche Gelenke sowie entweder erhöhte Werte der Akute-Phase-Reaktanten oder Erythrozytensedimentationsrate (ESR) ≥28 mm/Stunde auf. Ausserdem zeigten die Patienten aktive psoriatische Hautläsionen oder wiesen eine dokumentierte Psoriasis-Anamnese auf und hatten mindestens einen erfolglosen DMARD-Behandlungsversuch hinter sich. Die Vorbehandlung mit einem TNF-Antagonisten war zulässig; ungefähr 20% der Patienten wiesen eine vorausgegangene TNF-Antagonisten-Exposition auf. Die Patienten erhielten nach Initialdosen von 400 mg Cimzia in Woche 0, 2 und 4 (in beiden Behandlungsarmen) oder Placebo entweder alle 2 Wochen 200 mg Cimzia bzw. alle 4 Wochen 400 mg Cimzia oder alle 2 Wochen Placebo. Ein Anteil von 72.6% oder 70.2% der Patienten erhielt gleichzeitig NSAIDs oder DMARDs. Die beiden primären Endpunkte bildeten der prozentuale Anteil der Patienten, die bis Woche 12 ein ACR-20-Ansprechen erreichten, sowie die Änderung im modifizierten Sharp-Gesamtscore (modified Total Sharp Score, mTSS) in Woche 24 gegenüber Baseline.
ACR-Ansprechen
Die ACR-20-, ACR-50- bzw. ACR-70-Ansprechraten auf die Behandlung mit Cimzia in der klinischen Studie PsA001 sind in Tabelle 11 aufgeführt. Patienten unter Cimzia wiesen gegenüber Patienten unter Placebo eine statistisch signifikant höhere ACR-20-Ansprechrate in Woche 12 und 24 auf (p<0,001). Ausserdem zeigten Patienten unter Cimzia gegenüber Patienten unter Placebo in Woche 12 und 24 signifikante Verbesserungen in Bezug auf die ACR-50- und ACR-70-Ansprechraten sowie auf die einzelnen ACR-Komponenten (siehe Tabelle 12). Patienten unter Cimzia 200 mg alle 2 Wochen und Patienten unter Cimzia 400 mg alle 4 Wochen sprachen ähnlich auf die Behandlung an.
Patienten mit einer Komedikation von Methotrexat wiesen bei Woche 24 numerisch höhere ACR 20-, ACR 50- und ACR 70-Antwortraten (62%, 35% und 26%) auf als Patienten unter Monotherapie (53%, 32% und 20%).
Tabelle 11: ACR-Ansprechen in der klinischen Studie PsA001 (Prozent Patienten)
|
Ansprechen
|
Placebo
N=136
|
Cimzia(a) 200 mg
Q2W
N=138
|
Cimzia(b) 400 mg
Q4W
N=135
| |
ACR 20
| |
Woche 12
|
24%
|
58%**
|
52%**
| |
Woche 24
|
24%
|
64%**
|
56%**
| |
ACR 50
| |
Woche 12
|
11%
|
36%**
|
33%**
| |
Woche 24
|
13%
|
44%**
|
40%**
| |
ACR 70
| |
Woche 12
|
3%
|
25%**
|
13%*
| |
Woche 24
|
4%
|
28%**
|
24%**
|
(a) Cimzia alle 2 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(b) Cimzia alle 4 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
* p<0.01, Cimzia vs. Placebo
** p<0.001, Cimzia vs. Placebo
Die Ergebnisse basieren auf der randomisierten Population. Behandlungsunterschied: Cimzia 200 mg – Placebo, Cimzia 400 mg – Placebo (mit entsprechendem 95%-KI und p-Wert) werden mit asymptotischen Standardfehlern anhand eines zweiseitigen Standard-Wald-Tests geschätzt, unter Verwendung der NRI-Methode (Non-Responder-Imputation).
Tabelle 12: Komponenten des ACR-Ansprechens in der klinischen Studie PsA001
|
Parameter
|
Placebo
N=136
|
Cimzia(a)
200 mg Q2W
N=138
|
Cimzia(b)
400 mg Q4W
N=135
| |
|
Baseline
|
Woche 12
|
Woche 24
|
Baseline
|
Woche 12
|
Woche 24
|
Baseline
|
Woche 12
|
Woche 24
| |
Anzahl
schmerzempfindlicher Gelenke
(0–68)(c)
|
19,9
|
16,5
|
17,0
|
21,5
|
11,2*
|
8,5*
|
19,6
|
11,2*
|
9,4*
| |
Anzahl
geschwollener Gelenke
(0–66)(c)
|
10,4
|
8,7
|
9,9
|
11,0
|
4,0*
|
3,1*
|
10,5
|
4,7*
|
3,0*
| |
Ärztl. Gesamtbeurteilung(c, d)
|
58,7
|
44,1
|
42,2
|
56,8
|
24,8*
|
19,6*
|
58,2
|
28,7*
|
21,1*
| |
Patienten-Gesamtbeurteilung(c, d)
|
57,0
|
50,2
|
49,0
|
60,2
|
32,6*
|
31,1*
|
60,2
|
39,6*
|
32,5*
| |
Schmerz(c, e)
|
60,0
|
50,2
|
48,8
|
59,7
|
32,8*
|
31,1*
|
61,1
|
38,6*
|
32,7*
| |
Disability-Index (HAQ)(c, f)
|
1,30
|
1,15
|
1,13
|
1,33
|
0,87*
|
0,81*
|
1,29
|
0,90*
|
0,86*
| |
CRP (mg/l)
|
18,56
|
14,75
|
14,66
|
15,36
|
5,67*
|
4,58*
|
13,71
|
6,34*
|
7,37*
|
(a) Cimzia alle 2 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(b) Cimzia alle 4 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(c) LOCF-Ansatz (Last Observation Carried Forward) bei fehlenden Daten, vorzeitigem Studienabbruch oder Placebo-Escape
(d) Patient and Physician Global Assessment of Disease Activity (Globale Beurteilung der Krankheitsaktivität durch den Patienten bzw. den Arzt), VAS-Skala mit 0 = sehr gut und 100 = sehr schlecht
(e) The Patient Assessment of Arthritis Pain, VAS-Skala mit 0 = keine Schmerzen und 100 = sehr starke Schmerzen
(f) HAQ-DI, 4-Punkte-Skala von 0 = keine Behinderung bis 3 = hohe Behinderung
Bei den dargestellten Werten handelt es sich um Durchschnittsangaben.
Die Ergebnisse basieren auf der randomisierten Population (Imputation oder Beobachtung).
* p<0.001, Cimzia vs. Placebo
Der Anteil der ACR-20-Responder war klinisch relevant und lag in den Behandlungsgruppen mit Cimzia 200 mg alle 2 Wochen und Cimzia 400 mg alle 4 Wochen bei allen Studienvisiten nach Behandlungsbeginn bis Woche 24 signifikant höher als in der Placebogruppe (p ≤0.001 bei allen Visiten).
PASI-Ansprechen
Patienten mit einem von psoriatischen Läsionen betroffenen Körperoberflächenanteil von mindestens 3% bei Baseline wurden hinsichtlich der Verbesserung ihrer Hauterscheinungen anhand des Ansprechens nach dem Psoriasis Area and Severity Index (PASI) beurteilt. Wie Tabelle 13 zeigt, betrug der Anteil der Patienten, die in Woche 24 ein PASI-75- und ein PASI-90-Ansprechen erreichten, in beiden Cimzia-Dosierungsgruppen zusammen (200 mg alle 2 Wochen + 400 mg alle 4 Wochen) (n=166) 61% bzw. 42% gegenüber 15% bzw. 6% in der Placebogruppe (n=86) (p<0.001).
Tabelle 13: PASI-Ansprechrate in der klinischen Studie PsA001
|
Ansprech-Rate
|
Placebo
N=86
|
Cimzia(a)
200 mg Q2W
N=90
|
Cimzia(b)
400 mg Q4W
N=76
|
Cimzia (alle Dosierungsregime)(c)
N=166
| |
|
Woche 12
|
Woche 24
|
Woche 12
|
Woche 24
|
Woche 12
|
Woche 24
|
Woche 12
|
Woche 24
| |
PASI 75
|
14%
|
15%
|
47% **
|
62% **
|
47% **
|
61% **
|
47% **
|
61% **
| |
PASI 90
|
5%
|
6%
|
22% **
|
47% **
|
20%*
|
36% **
|
21% **
|
42% **
|
(a) Cimzia alle 2 Wochen, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(b) Cimzia alle 4 Woche, nach Initialdosen von 400 mg in Woche 0, 2 und 4
(c) Cimzia (alle Dosierungsregime) = Daten für Cimzia 200 mg alle 2 Wochen nach Initialdosen von 400 mg in Woche 0, 2 und 4 plus Daten für Cimzia 400 mg alle 4 Wochen nach Initialdosen von 400 mg in Woche 0, 2 und 4
* p-Wert <0.01, Cimzia vs. Placebo
** p-Wert <0.001, Cimzia vs. Placebo
Die Ergebnisse basieren auf der randomisierten Population.
Behandlungsunterschied: Cimzia 200 mg – Placebo, Cimzia 400 mg – Placebo (mit entsprechendem 95%-KI und p-Wert) werden mit asymptotischen Standardfehlern anhand eines zweiseitigen Standard-Wald-Tests geschätzt. Hinweis: Verwendet wird die NRI-Methode (Non-Responder-Imputation).
Patienten, die vor Behandlungsbeginn eine Enthesitis aufwiesen, wurden hinsichtlich der durchschnittlichen Verbesserung des Leeds Enthesitis Index (LEI) beurteilt. Patienten unter Cimzia 200 mg alle 2 Wochen oder 400 mg alle 4 Wochen zeigten eine stärkere Verbesserung der Enthesitis (-1.8; -1.7) als Patienten unter Placebo (-0.9) in Woche 12 (p<0.001 bzw. p<0.01) und Woche 24 (200 mg alle 2 Wochen: -2.0; 400 mg alle 4 Wochen: 1.8; Placebo: -1.1) (p<0.001 bzw. p<0.01).
Die gleichen Dosierungsschemata zeigten auch eine signifikante Reduktion der Daktylitis (mittlere Veränderung vom Ausgangswert -30.40; -45.46) im Vergleich zu Placebo behandelten Patienten (-16.79) in Woche 12.
Radiologisches Ansprechen
In der klinischen Studie PsA001 wurde die Progredienz des strukturellen Gelenkschadens von Baseline bis Woche 24 im Röntgenbild beurteilt und als Veränderung im mTSS und seinen Komponenten, im Erosion Score (ES) und im Gelenkspaltverschmälerung-Score (JSN, von Joint Space Narrowing) angegeben. Der mTSS-Score wurde durch Ergänzung um die distalen Interphalangealgelenke für psoriatische Arthritis modifiziert. Mit einer Post-hoc Imputation zeigte es nun folgende Behandlungswirkung: Die Behandlung mit Cimzia hemmte gegenüber der Placebobehandlung in Woche 24 die radiologische Progredienz in Bezug auf die Änderung des mTSS gegenüber Baseline (der LS-Mittelwert [± Standardfehler, SF] des Scores betrug 0.28 [± 0.07] in der Placebogruppe, gegenüber 0.06 [± 0.06] in der Cimzia-Gesamtgruppe; p=0.007). Ein statistisch signifikanter Unterschied zu Placebo wurde in der CZP 200 mg Q2W Gruppe beobachtet (p=0.004), nicht aber der CZP 400 mg Q4W Gruppe (p=0.072).
Ansprechen hinsichtlich der körperlichen Funktionsfähigkeit und der gesundheitsbezogenen Endpunkte
In der klinischen Studie PsA001 verzeichneten die mit Cimzia behandelten Patienten ab Woche 2 gegenüber den Patienten der Placebogruppe deutliche Verbesserungen in Bezug auf die körperliche Funktionsfähigkeit (ermittelt anhand des «Health Assessment Questionnaire – Disability Index [HAQ-DI]») sowie auf die Schmerzbelastung (ermittelt anhand des «Patient Assessment of Arthritis Pain [PAAP]» (siehe Tabelle 12). Für PAAP war der Unterschied signifikant nach Woche 1. Die Patienten unter Cimzia verzeichneten eine Verbesserung im Hinblick auf Abgeschlagenheit, bewertet anhand der «Fatigue Assessment Scale (FASCA)» von Woche 2 bis Woche 24 im Vergleich zu Placebo
Patienten unter Cimzia verzeichneten im Fragebogen zur psoriatische Arthritis-bezogenen Lebensqualität (PsAQoL) ab Woche 2 sowie bei allen «Scores» der körperlichen und der psychischen Summenskala des SF-36-Fragbogens von Woche 4 bis Woche 24 signifikante Verbesserungen der gesundheitsbezogenen Lebensqualität.
Mit Cimzia behandelte Patienten erfuhren auf Basis des «Work Productivity Survey» gegenüber Patienten unter Placebo von Woche 4 bis Woche 24 Verbesserungen der durch psoriatische Arthritis bedingten Produktivitätseinschränkungen am Arbeitsplatz und zu Hause.
Plaque-Psoriasis
Die Wirksamkeit und Sicherheit von Cimzia wurden in zwei placebokontrollierten Studien (CIMPASI-1 und CIMPASI-2) und einer placebo- und aktiv-kontrollierten Studie (CIMPACT) bei Patienten im Alter ≥18 Jahren mit mittelschwerer bis schwerer chronischer Plaque-Psoriasis über einen Zeitraum von mindestens 6 Monaten untersucht. Die Patienten wiesen einen Psoriasis Area and Severity Index-Score (PASI) ≥12, eine Beteiligung der betroffenen Körperoberfläche (body surface area involvement, BSA) ≥10%, ein Physician Global Assessment (Globale Beurteilung durch den Arzt, PGA) ≥3 auf und waren Kandidaten für eine systemische Therapie und/oder eine Phototherapie und/oder eine Chemophototherapie. Patienten, die bei einer beliebigen früheren biologischen Therapie «primäre» Non-Responder waren (definiert als kein Ansprechen innerhalb der ersten 12 Behandlungswochen), wurden aus den Phase III-Studien (CIMPASI-1, CIMPASI-2 und CIMPACT) ausgeschlossen. In der CIMPACT-Studie wurden die Wirksamkeit und Sicherheit von Cimzia im Vergleich zu Etanercept beurteilt.
In den Studien CIMPASI-1 und CIMPASI-2 waren die co-primären Wirksamkeitsendpunkte der Anteil der Patienten, die in Woche 16 PASI 75 und PGA «klar» oder «fast klar» (mit einer Reduktion von mindestens 2 Punkten seit Baseline) erzielten. In der CIMPACT-Studie war der primäre Wirksamkeitsendpunkt der Anteil der Patienten, die in Woche 12 PASI 75 erzielten. PASI 75 und PGA in Woche 16 waren die wichtigsten sekundären Endpunkte. PASI 90 in Woche 16 war einer der wichtigsten sekundären Endpunkte in allen drei Studien.
In CIMPASI-1 und CIMPASI-2 wurden 234 Patienten bzw. 227 Patienten ausgewertet. In beiden Studien wurden die Patienten randomisiert und erhielten Placebo oder Cimzia 200 mg alle 2 Wochen (nach einer Anfangsdosis von Cimzia 400 mg in den Wochen 0, 2 und 4) oder Cimzia 400 mg alle 2 Wochen. In Woche 16 erhielten in die Behandlung mit Cimzia randomisierte Patienten, die ein PASI 50-Ansprechen erzielten, Cimzia in der gleichen Randomisierungsdosis weiter bis Woche 48. Patienten, die ursprünglich in die Placebobehandlung randomisiert worden waren und in Woche 16 ein PASI 50-Ansprechen, aber kein PASI 75-Ansprechen erzielten, erhielten Cimzia 200 mg alle 2 Wochen (mit einer Anfangsdosis von Cimzia 400 mg in den Wochen 16, 18 und 20). Patienten mit einem unzureichenden Ansprechen in Woche 16 (PASI 50-Non-Responder) waren für die unverblindete Verabreichung von Cimzia 400 mg alle 2 Wochen geeignet für maximal 128 Wochen.
In der CIMPACT-Studie wurden 559 Patienten ausgewertet. Die Patienten wurden randomisiert und erhielten Placebo oder Cimzia 200 mg alle 2 Wochen (nach einer Anfangsdosis von Cimzia 400 mg in den Wochen 0, 2 und 4) oder Cimzia 400 mg alle 2 Wochen bis Woche 16 oder Etanercept 50 mg zweimal wöchentlich bis Woche 12. Patienten, die ursprünglich in die Behandlung mit Cimzia randomisiert worden waren und in Woche 16 ein PASI 75-Ansprechen erzielten, wurden basierend auf ihrem ursprünglichen Dosierungsschema erneut randomisiert. Patienten, die Cimzia 200 mg alle 2 Wochen erhielten, wurden erneut randomisiert und erhielten Cimzia 200 mg alle 2 Wochen, Cimzia 400 mg alle 4 Wochen oder Placebo. Patienten, die Cimzia 400 mg alle 2 Wochen erhielten, wurden erneut randomisiert und erhielten Cimzia 400 mg alle 2 Wochen, Cimzia 200 mg alle 2 Wochen oder Placebo. Die Patienten wurden doppelblind und placebo-kontrolliert bis einschliesslich Woche 48 ausgewertet. Alle Studienteilnehmer, die in Woche 16 kein PASI 75-Ansprechen erzielten, wurden in einen Escape-Arm aufgenommen und erhielten unverblindet Cimzia 400 mg alle 2 Wochen für maximal 128 Wochen.
In allen drei Studien folgte nach einer verblindeten 48-wöchigen Erhaltungsphase eine 96-wöchige offene Behandlungsphase für Patienten, die in Woche 48 ein PASI 50 Ansprechen zeigten. Alle Patienten in verblindeter Behandlung begannen die Open-Label-Periode mit Cimzia 200 mg alle zwei Wochen. Während der Open-Label-Behandlungsphase waren Dosisänderungen zwischen Cimzia 200 mg alle zwei Wochen und Cimzia 400 mg alle zwei Wochen aufgrund des Ausbleibens eines PASI 50-Ansprechens oder nach Ermessen des Prüfarztes erlaubt. Die maximale Dauer der Studien betrug insgesamt 144 Wochen.
Von den 850 in die Behandlung mit Placebo oder Cimzia randomisierten Patienten in diesen placebokontrollierten Studien hatten 29% zuvor noch keine systemische Therapie zur Behandlung der Psoriasis erhalten. 47% hatten bereits zuvor eine Phototherapie oder Chemophototherapie erhalten und 30% hatten bereits zuvor eine biologische Therapie zur Behandlung der Psoriasis erhalten. Von den 850 Patienten hatten 14% mindestens einen TNF-Antagonisten erhalten, 13% hatten ein Anti-IL-17 erhalten und 5 % hatten ein Anti-IL 12/23 erhalten. 18% der Patienten berichteten bei Baseline von einer psoriatischen Arthritis in der Vorgeschichte. Der mittlere PASI-Score bei Baseline betrug 20 und reichte von 12 bis 69. Der Baseline-PGA-Score reichte von mittelschwer (70%) bis schwer (30%). Die mittlere Baseline-BSA betrug 25% und reichte von 10% bis 96%.
Die wichtigsten Ergebnisse der CIMPASI-1- und CIMPASI-2-Studien sind in Tabelle 14 dargestellt.
Tabelle 14: Klinisches Ansprechen in den Studien CIMPASI-1 und CIMPASI-2 in Woche 16 und Woche 48
|
|
Woche 16
|
Woche 48
| |
CIMPASI-1
| |
|
Placebo
N=51
|
Cimzia 200 mg Q2W a)
N=95
|
Cimzia 400 mg Q2W
N=88
|
Cimzia 200 mg Q2W
N=95
|
Cimzia 400 mg Q2W
N=88
| |
PGA klar oder fast klarb)
|
4.2%
|
47.0%*
|
57.9%*
|
52.7%
|
69.5%
| |
PASI 75
|
6.5 %
|
66.5%*
|
75.8%*
|
67.2%
|
87.1%
| |
PASI 90
|
0.4%
|
35.8%*
|
43.6%*
|
42.8%
|
60.2%
| |
CIMPASI-2
| |
|
Placebo
N=49
|
Cimzia 200 mg Q2W a)
N=91
|
Cimzia 400 mg Q2W
N=87
|
Cimzia 200 mg Q2W
N=91
|
Cimzia 400 mg Q2W
N=87
| |
PGA klar oder fast klarb)
|
2.0%
|
66.8%*
|
71.6%*
|
72.6%
|
66.6%
| |
PASI 75
|
11.6%
|
81.4%*
|
82.6%*
|
78.7%
|
81.3%
| |
PASI 90
|
4.5%
|
52.6%*
|
55.4%*
|
59.6%
|
62.0%
|
a) Cimzia 200 mg, verabreicht alle 2 Wochen, im Anschluss an eine Anfangsdosis von 400 mg in Woche 0, 2, 4.
b) PGA-Skala mit 5 Kategorien. Der Behandlungserfolg von «klar» (0) oder «fast klar» (1) umfasste fehlende Anzeichen einer Psoriasis oder normale bis rosa Färbung der Läsionen, fehlende Plaqueverdickung und keine bis minimale fokale Schuppung.
* p<0.0001, Cimzia vs Placebo
Die Ansprechraten und p-Werte für PASI und PGA wurden basierend auf einem logistischen Regressionsmodell geschätzt, in dem eine multiple Imputation fehlender Daten auf der Grundlage des MCMC-Verfahrens erfolgte. Patienten, die in den Escape-Arm übergingen oder die die Studie abbrachen (basierend auf dem Nichterreichen eines PASI 50-Ansprechens), wurden in Woche 48 als Non-Responder behandelt.
Die Ergebnisse stammen aus der randomisierten Gruppe.
Die wichtigsten Ergebnisse der CIMPACT-Studie sind in Tabelle 15 dargestellt.
Tabelle 15: Klinisches Ansprechen in der CIMPACT-Studie in Woche 12 und Woche 16
|
|
Woche 12
|
Woche 16
| |
|
Placebo
N=57
|
Cimzia 200 mg Q2W a)
N=165
|
Cimzia 400 mg Q2W
N=167
|
Placebo
N=57
|
Cimzia 200 mg Q2W
N=165
|
Cimzia 400 mg
Q2W
N=167
| |
PASI 75
|
5%
|
61.3%*
|
66.7%*
|
3.8%
|
68.2%*
|
74.7%*
| |
PASI 90
|
0.2%
|
31.2%*
|
34.0%*
|
0.3%
|
39.8%*
|
49.1%*
| |
PGA klar oder fast klarb)
|
1.9%
|
39.8%**
|
50.3%*
|
3.4%
|
48.3%*
|
58.4%*
|
a) Cimzia 200 mg, verabreicht alle 2 Wochen, im Anschluss an eine Anfangsdosis von 400 mg in Woche 0, 2, 4.
b) PGA-Skala mit 5 Kategorien. Der Behandlungserfolg von «klar» (0) oder «fast klar» (1) umfasste fehlende Anzeichen einer Psoriasis oder normale bis rosa Färbung der Läsionen, fehlende Plaqueverdickung und keine bis minimale fokale Schuppung.
* p<0.0001, Cimzia vs Placebo
** p<0.0001, Cimzia vs Placebo
Die Ansprechraten und p-Werte basierten auf einem logistischen Regressionsmodell. Es erfolgte eine multiple Imputation fehlender Daten auf der Basis des MCMC-Verfahrens.
Die Ergebnisse stammen aus der randomisierten Gruppe.
In der Studie CIMPACT zeigte Cimzia 400 mg alle 2 Wochen nach 12 Wochen eine Überlegenheit bezüglich der PASI 75-Ansprechrate gegenüber Etanercept 50 mg zweimal wöchentlich (66.7% bzw. 53.3%; p < 0.05). Das Dosisschema Cimzia 200 mg alle 2 Wochen zeigte bezüglich der PASI 75-Ansprechrate bei Zugrundelegung einer Äquivalenzgrenze von 10% Nichtunterlegenheit gegenüber Etanercept 50 mg zweimal wöchentlich (61.3%; Differenz zwischen Etanercept und Cimzia 200 mg alle 2 Wochen 8.0% [95%KI –2.9; 18.9]).
In allen drei Studien waren die Ansprechrate mit PASI 75 und der Anteil der Patienten mit einem PGA-Score «klar» oder «fast klar» beginnend in Woche 4 bei Cimzia im Vergleich zu Placebo signifikant grösser.
Beide Cimzia-Dosen zeigten eine Wirksamkeit im Vergleich zu Placebo, und zwar ungeachtet von Alter, Geschlecht, Körpergewicht, BMI, Dauer der Psoriasis-Erkrankung, früherer Behandlung mit systemischen Therapien und früherer Behandlung mit Biologika.
Erhaltung des Ansprechens
In einer integrierten Analyse von CIMPASI-1 und CIMPASI-2 betrug die Aufrechterhaltung des Ansprechens in Woche 48 bei Patienten, die in Woche 16 PASI 75-Responder waren und Cimzia 400 mg alle 2 Wochen (134 von 175 randomisierten Patienten) oder Cimzia 200 mg jede zweite Woche erhielten (132 von 186 randomisierten Patienten), 98.0% bzw. 87.5%. Bei Patienten mit PGA «klar» oder «fast klar» in Woche 16, die Cimzia 400 mg alle 2 Wochen (103 von 175 Patienten) oder Cimzia 200 mg alle 2 Wochen (95 von 186 Patienten) erhielten, betrug die Aufrechterhaltung des Ansprechens in Woche 48 85.9% bzw. 84.3%.
Diese Ansprechraten basierten auf einem logistischen Regressionsmodell, bei dem eine multiple Imputation (MCMC-Verfahren) fehlender Daten über 48 bzw. 144 Wochen erfolgte. Resultate der 96-wöchigen offenen Behandlungsphase bei PASI 75-Respondern an Woche 48 wiesen darauf hin, dass das Ansprechen unter Cimzia 200 mg alle 2 Wochen mehrheitlich erhalten bleibt.
In der CIMPACT-Studie war der Prozentsatz der PASI 75-Responder unter jenen PASI 75-Respondern in Woche 16, die Cimzia 400 mg alle 2 Wochen erhielten und nach erneuter Randomisierung entweder Cimzia 400 mg alle 2 Wochen, Cimzia 200 mg alle 2 Wochen oder Placebo erhielten, in Woche 48 in den Cimzia-Gruppen im Vergleich zu Placebo höher (98.0%, 80.0% bzw. 36.0%). Der Prozentsatz der PASI 75-Responder war unter jenen PASI 75-Respondern in Woche 16, die Cimzia 200 mg alle 2 Wochen erhielten und nach erneuter Randomisierung entweder Cimzia 400 mg alle 4 Wochen, Cimzia 200 mg alle 2 Wochen oder Placebo erhielten, in Woche 48 in den Cimzia-Gruppen im Vergleich zu Placebo ebenfalls höher (88.6%, 79.5% bzw. 45.5%). Für fehlende Daten erfolgte eine Non-Responder-Imputation (NRI). Resultate der anschliessenden 96-wöchigen offenen Behandlungsperiode mit PASI 75-Respondern wiesen darauf hin, dass das Ansprechen unter Cimzia 200 mg alle 2 Wochen mehrheitlich erhalten bleibt.
Lebensqualität / Ergebnisse aus Patientensicht
Im Dermatologie-Lebensqualität-Index-Score (Dermatology Life Quality Index, DLQI) zeigten sich in Woche 16 (CIMPASI-1- und CIMPASI-2-Studien) gegenüber Baseline statistisch signifikante Verbesserungen im Vergleich zu Placebo. Die mittleren Rückgänge (Verbesserungen) im DLQI in Woche 16 gegenüber Baseline reichten von -8.9 bis -11.1 unter Cimzia 200 mg alle 2 Wochen und von -9.6 bis -10.0 unter Cimzia 400 mg alle 2 Wochen vs -2.9 bis -3.3 unter Placebo.
Ausserdem war die Behandlung mit Cimzia in Woche 16 mit einem grösseren Anteil von Patienten, die einen DLQI von 0 oder 1 erzielten, assoziiert (Cimzia 400 mg alle 2 Wochen, 45.5 % bzw. 50.6 %; Cimzia 200 mg alle 2 Wochen, 47.4 % bzw. 46.2 %, versus Placebo, 5.9 % bzw. 8.2 %).
Die mit Cimzia behandelten Patienten berichteten im Vergleich zu Placebo über stärkere Verbesserungen auf der Skala zur Erfassung von Angst und Depression (Hospital Anxiety and Depression Scale, HADS-D).
|


