ZusammensetzungWirkstoffe
Ivermectinum.
Hilfsstoffe
Glycerol (E 422), Isopropylpalmitat, Carbomer Copolymer Typ B, Dimeticon 200, Dinatriumedetat, Citronensäure-Monohydrat, Cetylalkohol (35 mg/g), Stearylalkohol (25 mg/g), Macrogol Cetostearyl Ether, Sorbitanstearat, Methylparahydroxybenzoat (E 218) (2 mg/g), Propylparahydroxybenzoat (E 216) (1 mg/g), Phenoxyethanol , Propylenglykol (E 1520) (20 mg/g), Oleylalkohol, Natriumhydroxid, Gereinigtes Wasser
Indikationen/AnwendungsmöglichkeitenSoolantra wird bei erwachsenen Patienten angewendet zur äusserlichen Behandlung entzündlicher Läsionen bei mittelschwerer bis schwerer papulopustulöser Rosazea (Investigator Global Assessment Grad 3 und 4) (siehe auch „Eigenschaften/Wirkungen“).
Dosierung/AnwendungÜbliche Dosierung
Eine Anwendung mit 1 g Creme (entsprechend 10 mg Ivermectin) täglich, gewöhnlich für bis zu 3 Monate. Soolantra sollte ohne Unterbruch über die gesamte Behandlungsdauer angewendet werden. Im Allgemeinen wird eine Besserung nach 4 Wochen Behandlung erkennbar. Falls nach 3 Monaten keine Besserung eintritt, sollte die Behandlung nicht fortgesetzt werden.
Ein Behandlungszyklus soll nur nach individuellen Nutzen-Risiko-Abwägung wiederholt werden (siehe „Unerwünschte Wirkungen“ und „Pharmakokinetik“).
Spezielle Dosierungsempfehlungen
Patienten mit Leberfunktionsstörungen
Bei Patienten und Patientinnen mit schwerer Leberinsuffizienz ist Vorsicht geboten.
Patienten mit Nierenfunktionsstörungen
Es ist keine Dosisanpassung notwendig.
Ältere Patienten
Für ältere Patienten ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Zur Sicherheit und Wirksamkeit von Soolantra bei Kindern und Jugendlichen liegen keine Daten vor. Soolantra soll daher in dieser Altersgruppe nicht angewendet werden.
Art der Anwendung
Nur zur Anwendung auf der Gesichtshaut.
Auftragen einer jeweils erbsengrossen Menge des Arzneimittels auf jeden der fünf Gesichtsbereiche: Stirn, Kinn, Nase und beide Wangen. Das Arzneimittel sollte anschliessend, unter Aussparung der Augen und Lippen, als eine dünne Schicht über das ganze Gesicht verteilt werden.
Nach dem Auftragen sollen die Hände gewaschen werden.
Kosmetika dürfen erst aufgetragen werden, nachdem das Arzneimittel in die Haut eingezogen ist.
KontraindikationenÜberempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenBei Therapiebeginn kann es infolge einer Reaktion auf die absterbenden Demodex-Milben zu einer vorübergehenden Verschlimmerung der Rosazea kommen, die sich bei fortgesetzter Behandlung in der Regel innerhalb von 1 Woche bessert. Im Falle einer starken Verschlechterung mit schwerer Hautreaktion sollte die Behandlung abgebrochen werden.
Die Anwendung von Soolantra bei Patienten mit Nieren- oder Leberfunktionsstörungen wurde bisher nicht untersucht.
Relevante Interaktionen (siehe auch "Interaktionen")
Ivermectin soll nicht mit starken Inhibitoren des P-Glykoprotein (P-gp) und des CYP3A4 (z.B., Itraconazol, Voriconazol, Posaconazol, Clarithromycin, Cobicistat) angewendet werden, weil dies zu einem erheblichen Anstieg der Ivermectin-Spiegel führen kann.
Wenn Soolantra zusammen mit moderaten Inhibitoren des P-gp und moderaten CYP3A4 Inhibitoren angewendet wird, ist Vorsicht geboten, da die Ivermectin-Exposition signifikant erhöht sein kann.
Ivermectin ist ein starker P-gp-Inhibitor und kann zu einem erheblichen Anstieg der Plasmakonzentrationen von P-gp-Substraten führen. Es soll daher nicht mit Substanzen mit enger therapeutischer Breite angewendet werden, deren Exkretion wesentlich vom P-gp abhängt (z.B. Digoxin, Ciclosporin).
InteraktionenKlinische Studien zu Interaktionen mit Soolantra wurden nicht durchgeführt. Da nach Auftragen von Soolantra auf die Gesichtshaut relevante systemische Ivermectin-Konzentrationen gemessen wurden, können die nachfolgend beschriebenen Interaktionen auch bei topischer Therapie auftreten.
Einfluss anderer Arzneimittel auf die Pharmakokinetik von Ivermectin
Der Haupt-Eliminationsweg von Ivermectin erfolgt über P-Glykoprotein (P-gp). Dabei ist das genaue Ausmass des Anteils vom Pgp am Metabolismus von Ivermectin beim Menschen unbekannt. Im Tierversuch führte der starke P-gp-Inhibitor Itraconazol zu einer annähernden Vervierfachung der Exposition. Beim Menschen führte der P-gp-Inhibitor Levamisol gemäss Literatur zu einer Verdopplung der AUC von Ivermectin; für den moderaten Inhibitor Azithromycin wurde ein Anstieg der Ivermectin-AUC um 31% beschrieben. Klinische Daten zum Einfluss starker P-gp-Inhibitoren (wie z.B. Ketokonazol oder Itraconazol) auf die Pharmakokinetik von Ivermectin liegen nicht vor.
Ivermectin ist ausserdem auch ein Substrat der Transporter MRP1, MRP2 und MRP3.
Die Metabolisierung von Ivermectin über das hepatische Enzym CYP3A4 ist im Vergleich zum Pgp quantitativ weniger bedeutend. Der Einfluss von starken CYP3A4-Inhibitoren (z.B. Voriconazol, Posaconazol, Clarithromycin, Ketokonazol, Itraconazol) auf den Metabolismus von Ivermectin wurde nicht untersucht.
Ivermectin soll nicht zusammen mit starken Inhibitoren des Pgp oder des CYP3A4 (z.B. Itraconazol, Voriconazol, Posaconazol, Clarithromycin, Ritonavir, Cobicistat) angewendet werden, weil dies zu einem erheblichen Anstieg der Ivermectin-Spiegel führen kann (siehe "Warnhinweise / Vorsichtsmassnahmen").
Einfluss von Ivermectin auf die Pharmakokinetik anderer Arzneimittel
In vitro ist Ivermectin kein Inhibitor der CYP450-Isoenzyme 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 3A4, 4A11 oder 2E1 und kein Induktor von CYP1A2, 2B6, 2C9 oder 3A4.
Ivermectin ist in hohen Konzentrationen gemäss Literatur ein moderater P-gp-Induktor. Klinische Daten zu möglichen Interaktionen mit P-gp-Substraten mit enger therapeutischer Breite liegen nicht vor. Durch die ausgeprägte Hemmwirkung von Ivermectin am P-gp können klinisch relevante Interaktionen mit P-gp Substraten bei längerer topischer Anwendung jedoch nicht ausgeschlossen werden. Ivermectin soll daher nicht zusammen mit Substanzen mit enger therapeutischer Breite angewendet werden, deren Exkretion wesentlich vom Pgp abhängt (z.B. Digoxin, Ciclosporin).
Ivermectin hemmt das Breast Cancer Resistance Protein (BCRP), was den Übertritt von Arzneimitteln in die Muttermilch beeinflusst.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt keine hinreichenden Daten zur Anwendung von Ivermectin bei Schwangeren. Studien zur Reproduktionstoxizität bei oraler Gabe haben gezeigt, dass Ivermectin in Ratten und Kaninchen teratogen ist (siehe „Präklinische Daten“). Während der Schwangerschaft darf Soolantra nicht angewendet werden, es sei denn dies ist eindeutig erforderlich.
Stillzeit
Nach oraler Einnahme geht Ivermectin in die Muttermilch über, für die topische Anwendung wurde ein Übergang von Ivermectin in die Muttermilch nicht untersucht. Daten aus Tierversuchen deuten ebenfalls auf einen Übertritt von Ivermectin in die Milch und eine dadurch verursachte neonatale Toxizität hin.. Ein Risiko für den gestillten Säugling kann daher nicht ausgeschlossen werden. Soolantra sollte während der Stillzeit nicht angewendet werden. Ist eine Therapie mit Soolantra notwendig, soll abgestillt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenDie Wirkung von Soolantra auf die Fahrtüchtigkeit und das Bedienen von Maschinen wurde nicht untersucht.
Unerwünschte WirkungenDie in klinischen Studien am häufigsten berichteten unerwünschten Wirkungen waren brennendes Gefühl auf der Haut, Hautirritation, Pruritus und Hauttrockenheit. Die unerwünschten Wirkungen nahmen gewöhnlich mit zunehmender Dauer der Behandlung ab.
Zwischen Studienteilnehmern im Alter von 18 bis 65 Jahren und Patienten über 65 wurden keine relevanten Unterschiede im Sicherheitsprofil festgestellt.
Nach Auftragen auf die Gesichtshaut führte Soolantra sowohl bei gesunden Probanden als auch bei Patienten mit papulopustolöser Rosazea zu relevanten, langanhaltenden systemischen Ivermectin-Spiegeln (siehe „Pharmakokinetik“). Systemische Effekte sind deshalb nicht prinzipiell ausgeschlossen.
Nachfolgend aufgelistet sind die unerwünschten Wirkungen, über die bei der Anwendung von Soolantra in klinischen Studien und/oder während der Marktüberwachung berichtet wurde. Diese sind gemäss den folgenden Kriterien nach Systemorganklassen und Häufigkeit eingeordnet: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10), gelegentlich (≥1/1.000 bis <1/100), selten (≥1/10.000 bis <1/1.000), sehr selten (<1/10.000), nicht bekannt (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Erkrankungen des Blutes und des Lymphsystems
Während der klinischen Studien mit Soolantra wurde über das Auftreten von leichtgradigen Neutropenien <1,5 G/L berichtet. Eine konsistente Häufung leichtgradiger Neutropenien <1,5 G/L in den Ivermectin-Armen konnte nicht festgestellt werden. Im Vergleich zu den Kontrollgruppen verteilten sich die Fälle von leichtgradigen Neutropenien <1,5 G/L folgendermassen:
Tabelle 1 Gepoolte Häufigkeitstabelle der leichtgradigen Neutropenien <1,5 G/L aufgetreten nach der ersten Anwendung
|
|
Azelainsäurea
(N=418)
|
Ivermectin 1%b
(N=2047)
|
Ivermectin <1%c
(N=98)
|
Ivermectin >1%d
(N=48)
|
Metronidazol 0.75%e
(N=532)
|
Vehikel Creme
(N=617)
| |
N(%) der Probanden die eine leichtgradige Neutropenie aufwiesen (<1,5 G/L)
|
9 (2.2%)
|
26 (1.3%)
|
1 (1.0%)
|
0 (0.0%)
|
4 (0.8%)
|
5 (0.8%)
|
Studien mit PPR (papulopustolöse Rosazea) Probanden SPR40027 – SPR40051 – SPR40106 – SPR40064 – SPR40173 – SPR18170 – SPR18171
Berücksichtigt wurden Fälle nach erster Anwendung, d.h. wenn Labor-Datum > Datum erste Anwendung. Blutprobe für Baseline wurde vor der ersten Anwendung gemacht.
a)Azelainsäure entspricht Azelainsäure 15% Gel zweimal täglich
b)CD5024 1% entspricht Ivermectin 1% Creme einmal täglich
c)CD5024 <1% entspricht Ivermectin 0.03% Creme einmal täglich, 0.1% Creme einmal täglich und 0.3% Creme einmal täglich
d)CD5024 >1% entspricht Ivermectin 1% Creme zweimal täglich
e) Metronidazol 0.75% entspricht Metronidazol 0.75% Creme zweimal täglich
Erkrankungen des Immunsystems
Sehr selten: Hypersensitivitätsreaktionen mit systemischen Reaktionen wie peripheren Ödemen
Nicht bekannt: Anschwellen des Gesichtes
Leber- und Gallenerkrankungen
Häufig: Transaminasenerhöhung
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Gefühl des Brennens auf der Haut
Gelegentlich: Hautirritation, Pruritus, Hauttrockenheit, Verschlimmerung der Rosazea
Selten: Erythem, Kontaktdermatitis (allergisch oder irritativ)
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEs wurden keine Fälle einer Überdosierung mit Soolantra berichtet.
Ivermectin ist in hohen systemischen Dosen durch Wirkung an den GABA-Rezeptoren neurotoxisch.
Bei einer hohen Exposition von Menschen gegenüber unbekannten Mengen von veterinären Formulierungen von Ivermectin durch Verzehr, Inhalation, Injektion oder Exposition an Körperoberflächen wurden folgende Nebenwirkungen am häufigsten beobachtet: Ausschlag, Ödeme, Kopfschmerzen, Schwindel, Asthenie, Übelkeit, Erbrechen und Diarrhoe. Weiterhin wurden u. a. folgende Nebenwirkungen gemeldet: Krampfanfälle, Ataxie, Dyspnoe, Bauchschmerzen, Parästhesien, Urtikaria und Kontaktdermatitis.
Die Therapie im Falle einer oralen Aufnahme erfolgt supportiv. Falls indiziert, sollten parenterale Flüssigkeit und Elektrolyte, eine Unterstützung der Atmung (Sauerstoff und bei Bedarf maschinelle Beatmung) sowie Antihypotensiva (falls eine klinisch relevante Hypotonie vorliegt) eingesetzt werden. Die möglichst unverzügliche Induktion einer Emesis und/oder Magenspülung und eine nachfolgende Verabreichung von Purgativa oder andere gängige Entgiftungsmassnahmen können eingesetzt werden, um eine Absorption von Ivermectin zu vermeiden.
Eigenschaften/WirkungenATC-Code
D11AX22
Wirkungsmechanismus
Der Wirkmechanismus von Soolantra beim Menschen bei der Behandlung entzündlicher Läsionen bei Rosazea ist nicht bekannt.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Die Behandlung entzündlicher Läsionen bei Rosazea mit Soolantra, einmal täglich zur Schlafenszeit angewendet, wurde in zwei randomisierten, doppelblinden, Vehikelkontrollierten klinischen Studien mit identischem Design untersucht. Eingeschlossen waren 1371 Patienten im Alter von mindestens 18 Jahren. Diese wurden 12 Wochen lang einmal täglich mit Soolantra oder mit dem Vehikel behandelt.
Insgesamt waren 96 % der Patienten hellhäutig, 67 % Frauen. Mit der 5-Punkte-Skala der Globalen Beurteilung der Untersucher (Investigator Global Assessment, IGA) wurde der Zustand vor Behandlungsbeginn (Baseline) bei 79 % der Patienten als moderat (IGA=3), bei 21 % als schwergradig (IGA=4) eingestuft.
Die co-primären Wirksamkeitsendpunkte beider klinischer Studien waren die Erfolgsrate basierend auf dem IGA-Ergebnis (Prozentzahl der Patienten, deren Zustand nach 12 Wochen als „entzündungsfrei“ oder „beinahe entzündungsfrei“ eingestuft wurde) und der absoluten Änderung der Anzahl entzündlicher Läsionen seit Behandlungsbeginn. Die IGA-Skala stützt sich auf folgende Definitionen:
Tabelle 2: Investigator Global Assessment (IGA)-Skala
|
Grad
|
Wertung
|
Klinische Beschreibung
| |
Entzündungsfrei
|
0
|
Keine entzündlichen Läsionen, kein Erythem
| |
Beinahe entzündungsfrei
|
1
|
Sehr wenige, kleine Papeln/Pusteln, sehr mildes Erythem
| |
Mild
|
2
|
Wenige kleine Papeln/Pusteln, mildes Erythem
| |
Moderat
|
3
|
Mehrere kleine oder grosse Papeln/Pusteln, moderates Erythem
| |
Schwer
|
4
|
Zahlreiche kleine und/oder grosse Papeln/Pusteln, schweres Erythem
|
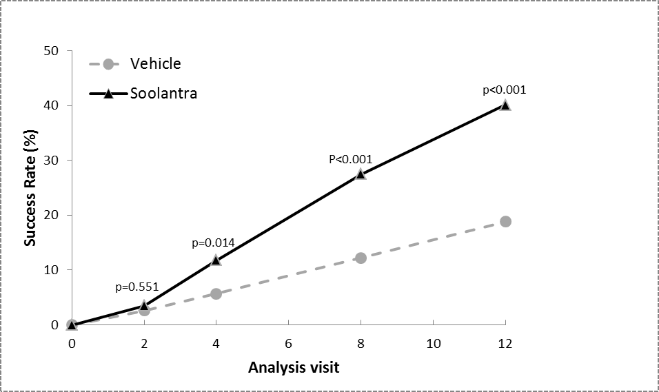
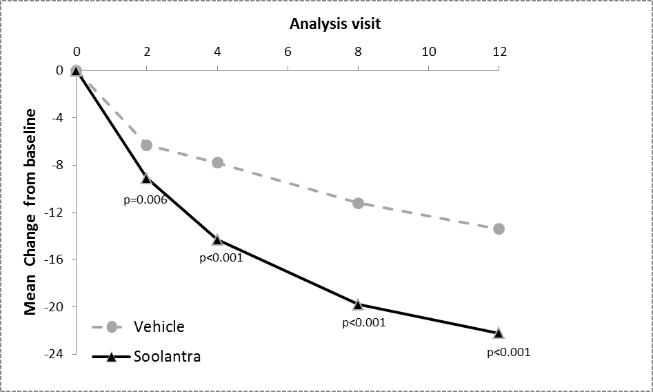
In beiden Studien war Soolantra in beiden Co-Primärendpunkten der Vehikel-Crème statistisch signifikant überlegen (p<0,001, siehe Tabelle 4 sowie Abbildung 1, Abbildung 2, Abbildung 3 und Abbildung 4), wobei die Wirkung bereits nach 4-wöchiger Behandlung einsetzte.
Tabelle 3: Wirksamkeitsbefunde
|
|
Studie 1
|
Studie 2
| |
Soolantra
(N=451)
|
Vehikel
(N=232)
|
Soolantra
(N=459)
|
Vehikel
(N=229)
| |
Investigator Global Assessment
|
|
|
|
| |
Anzahl (%) der gemäss IGA-Skala entzündungsfreien oder beinahe entzündungsfreien Probanden in Woche 12
|
173
(38.4)
|
27
(11.6)
|
184
(40.1)
|
43
(18.8)
| |
Entzündliche Läsionen
|
|
|
|
| |
Durchschnittliche Anzahl entzündlicher Läsionen vor Behandlungsbeginn
|
31.0
|
30.5
|
33.3
|
32.2
| |
Durchschnittliche Anzahl entzündlicher Läsionen in Woche 12
|
10.6
|
18.5
|
11.0
|
18.8
| |
Durchschnittliche absolute Änderung (% Änderung der Anzahl entzündlicher Läsionen gegenüber der Baseline) in Woche 12
|
-20.5
(-64.9)
|
-12.0
(-41.6)
|
-22.2
(-65.7)
|
-13.4
(-43.4)
|
Abbildungen 1 und 2: IGA-Erfolgsraten im Verlauf der Zeit in Wochen
Studie 1

Studie 2
Abbildungen 3 und 4: Mittlere absolute Veränderung der Anzahl entzündlicher Läsionen im Verlauf der Zeit in Wochen
Studie 1

Studie 2
Die IGA wurde auch während einer 40-wöchigen Verlängerung der beiden klinischen Studien ausgewertet: Der Anteil der mit Soolantra behandelten Patienten, die eine IGA-Wertung von 0 oder 1 erhielten, stieg bis Woche 52 weiter an. Die Erfolgswertung (IGA=0 oder 1) in Woche 52 lag für die Studien 1 und 2 jeweils bei 71 % und 76 %.
Wirksamkeit und Sicherheit des Arzneimittels zur Behandlung entzündlicher Läsionen bei Rosazea wurden auch in einer weiteren randomisierten, Prüfarzt-verblindeten, aktiv-kontrollierten klinischen Studie an n=962 Patienten >18 Jahre untersucht. Die Patienten wurden 16 Wochen lang entweder einmal täglich mit Soolantra oder zweimal täglich mit Metronidazol 7,5 mg/g Crème behandelt. In dieser Studie waren 99,7 % der Patienten hellhäutig, 65,2 % Frauen; gemäss der IGA-Wertung wurden vor Behandlungsbeginn 83,3 % der Patienten als moderat (IGA=3) und 16,7 % als schwer (IGA=4) erkrankt eingestuft. Primärer Wirksamkeitsendpunkt dieser Studie war die mittlere Veränderung in % der Anzahl entzündlicher Läsionen.
Nach 16 Behandlungswochen war Soolantra statistisch signifikant wirksamer als die 7,5 mg/g Metronidazol-Creme (p<0.001), mit einer Reduktion der Läsionen um 83,0 % bzw. 73,7 % gegenüber Baseline in der Ivermectin- bzw. Metronidazolgruppe (siehe Abbildung 5). Die Befunde für die Sekundärendpunkte IGA-Wertung und absolute Änderung der Anzahl entzündlicher Läsionen in Woche 16 bestätigten die Überlegenheit von Soolantra (p<0.001).
Abbildung 5: Mittlere prozentuale Veränderung im Verlauf der Zeit in Wochen

In allen klinischen Studien wurden insgesamt etwa 300 Patienten im Alter von über 65 Jahren mit dem Arzneimittel behandelt. Zwischen Patienten >65 Jahren und Patienten im Alter von 18 bis 65 Jahren wurden keine relevanten Unterschiede betreffend Wirksamkeit oder Sicherheit beobachtet.
Das in der Rubrik „Unerwünschte Wirkungen“ beschriebene Sicherheitsprofil blieb in der Verlängerungsstudie über 12 Monate stabil. Dennoch soll eine Behandlung über 3 Monate nur nach Abwägung des individuellen Nutzen-Risiko-Verhältnisses wiederholt werden.
PharmakokinetikAbsorption
Die Pharmakokinetik von Ivermectin wurde an 32 gesunden Probanden untersucht. Die PK-Parameter von Ivermectin 10 mg/Dosis (=1 g Creme) kutan im Gesichtsbereich angewendet stellten sich wie in der Tabelle beschrieben dar (Einzeldosis, 1x täglich über 28 Tage, 2x täglich über 28 Tage):
Tabelle 4
|
|
Cmax
|
Tmax
|
T1/2
|
AUC0-12h
|
AUC0-24h
|
AUCinf
| |
Einzeldosis 10 mg Iver.
|
0,49 ng/ml
|
9 h
|
45,01 h
|
3,82 ng.h/ml
|
8,26 ng.h/ml
|
26,56 ng.h/ml
| |
1x 28 Tage 10 mg Iver.
|
1,08 ng/ml
|
679 h
|
87,44 h
|
11,05 ng.h/ml
|
20,86 ng.h/ml
|
133,14 ng.h/ml
| |
2x 28 Tage 10 mg Iver.
|
1,90 ng/ml
|
678 h
|
96,64 h
|
20,29 ng.h/ml
|
37,86 ng.h/ml
|
233,49 ng.h/ml
|
In einer anderen Studie wurde die Pharmakokinetik von Ivermectin (1x täglich 1g Creme entsprechend 10mg Ivermectin) an insgesamt 17 Patienten mit schwerer Rosazea über 28 Tage untersucht. Bei den 15 Patienten, die die Studie vollständig abgeschlossen hatten, stellten sich die PK-Parameter folgendermassen dar:
Tabelle 5
|
|
Cmin
|
Cmax
|
Tmax
|
T1/2
|
AUC0-24h
|
AUCt
|
AUCinf
| |
Einzeldosis 10 mg Iver.
|
0,37 ng/ml
|
0,69 ng/ml
|
9 h
nur 1-24 h
|
NA
|
9,29 ng.h/ml
|
NA
|
NA
| |
1x 14 Tage 10 mg Iver.
|
1,26 ng/ml
|
2,10 ng/ml
|
10 h
nur 0-24 h
|
NA
|
36,14 ng.h/ml
|
NA
|
NA
| |
1x 28 Tage 10 mg Iver.
|
1,36 ng/ml
|
1,74 ng/ml
|
11 h
nur 0-24 h
|
145 h
|
35,43 ng.h/ml
|
274,62 ng.h/ml
|
311,74 ng.h/ml
| |
1x 28 Tage 10 mg Iver.
|
|
|
322 h over-all
|
|
|
|
|
Bei Steady-State-Bedingungen war die Exposition von Ivermectin im Mittel niedriger (AUC0-24hr: 36 ± 16 ng.hr/mL) als jene, die nach einer oralen Einzeldosis von 6 mg Ivermectin bei gesunden Probanden gemessen wurden (AUC0-24hr: 134 ± 66 ng.hr/mL) (siehe Diagramm). Die relative kutane Bioverfügbarkeit von Ivermectin betrug in dieser vergleichenden Studie für Soolantra 16%.

Abbildung 6: Ivermectin Plasma Konzentrationen (Mittelwert ± SD) für Orale versus topische Applikation (Studien 18120 und 40064)
In den Phase 3-Studien war die Ivermectin-Exposition während der 52-wöchigen Behandlungsdauer, bei sehr hoher interindividueller Variabilität, jener nach zweiwöchiger Behandlung in etwa vergleichbar. Ein kleiner Teil der mit Soolantra Creme behandelten Patienten erreichte eine systemische Exposition, die etwa im Bereich der mittleren Exposition nach oraler Gabe von 6 mg Ivermectin lag.
Distribution
Ivermectin wird zu >99 % an Plasmaproteine gebunden, primär an Serumalbumin. Eine erwähnenswerte Bindung von Ivermectin an Erythrozyten wurde nicht beobachtet.
Metabolismus
Es wurde keine vollständige Massenbilanzstudie beim Menschen mit Ivermectin durchgeführt, und der Metabolismus von Ivermectin beim Menschen nicht vollständig abgeklärt. Aus zahlreichen tierexperimentellen Untersuchungen ist bekannt, dass die Exkretion über P-gp den Haupteliminationsweg von Ivermectin darstellt. Das genaue Ausmass des Anteils vom Pgp am Metabolismus von Ivermectin beim Menschen ist jedoch unbekannt.
Die Metabolisierung von Ivermectin über das CYP3A4 ist im Vergleich zum Pgp quantitativ weniger bedeutend. In einer Studie mit Soolantra konnten ca. 27% der verabreichten Menge Ivermectin als Metaboliten nachgewiesen werden. Zwei dieser Metaboliten konnten identifiziert werden (3’’-O-Demethyl-Ivermectin und 4a-Hydroxy-Ivermectin). Diese erreichten nach 2 Behandlungswochen Steady-State-Bedingungen, ohne dass es anschliessend (während bis zu 12 Wochen) zu einer Akkumulation kam.
Elimination
Bei Patienten, bei denen Soolantra über 28 Tage einmal täglich angewendet wurde, lag die terminale Halbwertszeit im Durchschnitt bei 6 Tagen (Mittel: 145 Stunden, Bereich 92-238 Stunden).
Kinetik spezieller Patientengruppen
Die Pharmakokinetik von Ivermectin wurde bei Patienten mit Nierenoder Leberinsuffizienz nicht untersucht .
Präklinische DatenEffekte in nicht-klinischen Studien wurden nur bei Expositionen beobachtet, die im Vergleich mit der beim Menschen maximalen Exposition als signifikant höher galten, was auf eine wahrscheinlich geringe Relevanz für die klinische Anwendung hindeutet. Bei hohen oralen Dosen in Ratten und Hunden war Neurotoxizität das hauptsächliche Sicherheitsrisiko.
Karzinogenität
Eine zweijährige orale Karzinogenitätsstudie bei Ratten zeigte keine erhöhte Tumorrate bei Dosierungen bis zu 3 mg/kg/Tag. Bei dieser Dosierung entspricht die Plasmaexposition (AUC) bei Tieren mindestens dem 282-Fachen der Exposition bei lokaler Anwendung beim Menschen bei der maximalen humanen Dosierungsempfehlung. Bei der höheren Dosierung von 9 mg/kg/Tag wurde eine erhöhte Inzidenz von haepatozellulären Adenomen in männlichen Tieren mit unbekannter klinischer Relevanz beobachtet. Eine zweijährige Karzinogenitätsstudie mit dermaler Anwendung von Ivermectin 10 mg/g Crème in Mäusen zeigte keine erhöhte Tumorrate. Bei dieser Dosierung entsprach die Exposition (AUC) in Mäusen dem 352-Fachen der Exposition beim Menschen bei der maximalen humanen Dosierungsempfehlung.
Reproduktionstoxizität
Bei Sprague Dawley-Ratten gab es keine Wirkung auf das Paarungsverhalten oder die Fertilität nach einer Behandlung mit Ivermectin bei oralen Dosen von bis zu 9 mg/kg/Tag, ausser einer Verlängerung der precoitalen Periode bei der höchsten Dosis.
Reproduktionstoxizitätsstudien nach oraler Verabreichung von Ivermectin zeigten teratogene Effekte bei Ratten bei 12 mg/kg/Tag (Gaumenspalten) und bei Kaninchen bei 4,5 mg/kg/Tag (Handwurzelflexuren). Bei NOAEL betrug die Exposition (AUC) bei trächtigen Weibchen mindestens das 70-Fache der klinischen Exposition.
Eine prä- und postnatale Entwicklungsstudie an Ratten mit oraler Gabe bis zu 4 mg/kg/Tag zeigte eine erhöhte neonatale Sterblichkeit bei Dosen von ≥2 mg/kg/Tag sowie Entwicklungsverzögerungen bei allen Dosen.
Die neonatale Toxizität nach oraler Gabe bei Ratten wies keinen Zusammenhang mit der intrauterinen Exposition auf, wohl aber mit der postnatalen Exposition über die Muttermilch. Diese führte zu hohen Ivermectin-Konzentrationen in Plasma und Gehirn der Nachkommen.
Genotoxizität
Ivermectin zeigte keine mutagene Wirkung in vitro (Ames- und Maus-Lymphoma-Test) und war in einem in vivo Mikronukleus-Test an Ratten nicht klastogen.
Lokale Toleranz
Ivermectin 1% Creme war reizend für die Haut in Kaninchen unter okklusiven Bedingungen, zeigte aber generell eine gute Hautverträglichkeit nach wiederholter dermaler Applikation an Mäusen, Ratten und Minipigs. Haut- bzw. Photosensibilisierung ist nicht auszuschliessen. Das Phototoxizitätspotenzial kann allerdings als gering beurteilt werden.
Sonstige HinweiseBehältnis: Kunststofftube mit kindersicherem Verschluss.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Nach Anbruch der Tube das Produkt innerhalb von 6 Monaten verwenden.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer65561 (Swissmedic).
PackungenTube zu 30 g. [B]
ZulassungsinhaberinGalderma SA, CH-6300 Zug
Stand der InformationAugust 2020
|






