ZusammensetzungWirkstoffe
Tisagenlecleucel: Autologe T-Zellen, die mit einem lentiviralen Vektor, der einen gegen CD19 gerichteten chimären Antigenrezeptor kodiert, ex vivo gentechnisch modifiziert wurden.
Hilfsstoffe
·Mehrfachelektrolyte zur Injektion, Typ 1, pH 7,4, 31,25 % (v/v) (Natriumchlorid (1,97 mg/ml), Kaliumchlorid (0,13 mg/ml), Magnesiumchlorid (0,10 mg/ml), Natriumacetat (1,27 mg/ml), Natriumgluconat (1,73 mg/ml))
·Dextrose und Natriumchlorid zur Injektion, 31,25 % (v/v) (Dextrose (16,4 mg/ml), Natriumchlorid (1,48 mg/ml), 5'-Hydroxymethylfurfural (0,00048 mg/ml))
·10 % Dextran 40 (LMD) in 5 % Dextrose zur Injektion, 10 % (v/v) (Dextran 40 (11,0 mg/ml), Dextrose (5%) (5,0 mg/ml), 5'-Hydroxymethylfurfural (0,00048 mg/ml))
·25 % Humanalbumin, 20 % (v/v) (Albumin (52,4 mg/ml), Natrium (0,676 mg/ml), Kalium (0,016 mg/ml), N-Acetyltryptophanat (1,08 mg/ml), Caprylat (0,630 mg/ml), Aluminium (0,04 μg/ml))
·Dimethylsulfoxid, 7,5 % (v/v) (DMSO (82,5 mg/ml), Dimethylsulfon (0,03 mg/ml))
Indikationen/AnwendungsmöglichkeitenKymriah ist eine gegen CD19 gerichtete autologe Immunzell-Therapie für folgende Indikationen:
·Die Behandlung von pädiatrischen und jungen erwachsenen Patienten im Alter bis zu 25 Jahren mit akuter lymphatischer B-Zell-Leukämie (B-Zell-ALL), die refraktär ist, nach einer Transplantation rezidiviert ist oder nach zwei Therapielinien oder später rezidiviert ist.
·Die Behandlung erwachsener Patienten mit rezidiviertem oder refraktärem diffus grosszelligem B-Zell-Lymphom (DLBCL) nach zwei oder mehr Linien einer systemischen Therapie.
·Die Behandlung erwachsener Patienten mit rezidiviertem oder refraktärem follikulärem Lymphom (FL) nach drei oder mehr Linien einer systemischen Therapie.
Dosierung/AnwendungKymriah muss an einem von der Zulassungsinhaberin qualifizierten Behandlungszentrum angewendet werden. Die Therapie sollte unter der Leitung und Aufsicht eines Arztes begonnen und durchgeführt werden, der Erfahrung in der Behandlung von hämatologischen Malignomen besitzt und für die Anwendung und das Management von Patienten, die mit Kymriah behandelt werden, einschliesslich der Bewältigung eines möglichen Cytokine Release Syndrome (CRS) geschult ist.
Vor der Infusion müssen mindestens zwei Dosen Tocilizumab zur Anwendung beim Auftreten eines CRS sowie eine Notfallausrüstung pro Patient und geeignete intensiv-medizinische Überwachungsmöglichkeiten verfügbar sein. Das Behandlungszentrum muss schnellen Zugang (innert 8 Stunden) zu weiteren Dosen Tocilizumab haben.
Nur für die autologe Anwendung.
Die Herstellung und Freigabe von Kymriah dauert üblicherweise etwa 3-4 Wochen. Es gibt Gründe, die dazu führen können, dass ein Patient trotz erfolgter Leukapharese nicht mit Kymriah behandelt werden kann (für Details siehe «Eigenschaften/Wirkungen»).
Nur zur intravenösen Anwendung. Keinen leukozytendepletierenden Filter verwenden.
Zur einmaligen Behandlung.
Vorbehandlung (lymphodepletierende Chemotherapie)
Vor Einleitung der Lymphozytendepletion muss die Verfügbarkeit von Kymriah bestätigt sein. Es wird empfohlen, Kymriah bei den Indikationen B-Zell-ALL und DLBCL 2 bis 14 Tage nach Abschluss der lymphodepletierenden Chemotherapie zu infundieren. Bei FL wird empfohlen, Kymriah 2 bis 6 Tage nach Abschluss der lymphodepletierenden Chemotherapie zu infundieren.
Eine lymphodepletierende Chemotherapie kann unterbleiben, wenn der Patient innerhalb einer Woche vor der Infusion eine signifikante Zytopenie aufweist, d.h. die Anzahl der weissen Blutkörperchen (WBC) weniger als 1'000 Zellen/Mikroliter beträgt.
Wenn zwischen dem Abschluss der lymphodepletierenden Chemotherapie und der Kymriah-Infusion mehr als 4 Wochen liegen und die WBC-Zahl > 1'000 Zellen/Mikroliter beträgt, muss der Patient vor der Kymriah-Infusion erneut mit einer lymphodepletierenden Chemotherapie behandelt werden.
B-Zell-ALL: Folgendes Behandlungsschema wird für die lymphodepletierende Chemotherapie empfohlen.
·Fludarabin (30 mg/m2 i.v. täglich 4 Tage lang) und Cyclophosphamid (500 mg/m2 i.v. täglich 2 Tage lang ab der ersten Fludarabin-Verabreichung).
Ist beim Patienten zuvor unter Cyclophosphamid-Behandlung eine hämorrhagische Zystitis vom Grad 4 aufgetreten oder war er bei einer Therapie, die Cyclophosphamid beinhaltete und kurz vor der lymphodepletierenden Chemotherapie verabreicht wurde, chemorefraktär, dann sollte folgendes Behandlungsschema verwendet werden:
·Cytarabin (500 mg/m2 i.v. täglich 2 Tage lang) und Etoposid (150 mg/m2 i.v. täglich 3 Tage lang ab der ersten Cytarabin-Verabreichung).
DLBCL und FL: Folgendes Behandlungsschema wird für die lymphodepletierende Chemotherapie empfohlen.
·Fludarabin (25 mg/m2 i.v. täglich 3 Tage lang) und Cyclophosphamid (250 mg/m2 i.v. täglich 3 Tage lang ab der ersten Fludarabin-Verabreichung).
Ist beim Patienten zuvor bei Cyclophosphamid eine hämorrhagische Zystitis vom Grad 4 aufgetreten oder war er bei einer Therapie, die Cyclophosphamid beinhaltete und vor der lymphodepletierenden Chemotherapie verabreicht wurde, chemorefraktär, dann sollte folgendes Behandlungsschema verwendet werden:
·Bendamustin (90 mg/m2 i.v. täglich 2 Tage lang).
Klinische Beurteilung vor der Infusion
Die Behandlung mit Kymriah sollte bei bestimmten Risikopatienten aufgeschoben werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Überwachung nach der Infusion
Die Patienten sollten die ersten 10 Tage nach der Infusion täglich auf Anzeichen und Symptome eines möglichen CRS, neurologischer Ereignisse und anderer Toxizitäten überwacht werden. Während der ersten 10 Tage nach der Infusion oder bei den ersten Anzeichen/Symptomen eines CRS und/oder von neurologischen Ereignissen sollten Ärzte eine Hospitalisierung in Betracht ziehen.
Im Anschluss an die ersten 10 Tage nach der Infusion sollte der Patient nach Ermessen des Arztes überwacht werden.
Die Patienten sollten angewiesen werden, mindestens 4 Wochen nach der Infusion in der Nähe (in 2 Stunden Reisedistanz) einer qualifizierten klinischen Einrichtung zu bleiben.
Während die meisten Fälle von CRS und Neurotoxizität von Kymriah innerhalb der ersten vier Wochen nach Infusion auftreten, könnten solche Fälle auch später auftreten und eine Behandlung erfordern.
Behandlungsschema
Kymriah ist für die Anwendung als einmalige Behandlung vorgesehen.
Prämedikation:
Zur Minimierung potenzieller akuter Infusionsreaktionen wird empfohlen, Patienten 30 bis 60 Minuten vor der Kymriah-Infusion Acetaminophen/Paracetamol und Diphenhydramin oder ein anderes H1-Antihistaminikum zu geben. Kortikosteroide sollten zu keinem Zeitpunkt angewendet werden, ausser bei einem lebensbedrohlichen Notfall (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Dosierung bei Kindern, Jugendlichen und jungen erwachsenen Patienten mit B-Zell-ALL
·Für Patienten bis 50 kg: 0,2 bis 5 x 106 CAR-positive lebensfähige T-Zellen/kg Körpergewicht.
·Für Patienten über 50 kg: 0,1 bis 2,5 x 108 CAR-positive lebensfähige T-Zellen (unabhängig vom Körpergewicht).
Dosierung bei DLBCL- und FL-Patienten:
·0,6 bis 6 x 108 CAR-positive lebensfähige T-Zellen (unabhängig vom Körpergewicht).
Besondere Patientengruppen
Patienten mit Leber- oder Nierenerkrankungen
Als zellbasierte Therapie erfolgt bei Kymriah keine Ausscheidung über die Niere oder den Leberstoffwechsel. Es wurden keine Studien bei Patienten mit Leber- oder Nierenkrankheiten durchgeführt.
Pädiatrie
Siehe allgemeine Zielpopulation.
B-Zell-ALL: Bei Kindern unter 3 Jahren wurden keine formalen Studien durchgeführt.
DLBCL: Die Sicherheit und Wirksamkeit von Kymriah bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht erwiesen.
FL: Die Sicherheit und Wirksamkeit von Kymriah bei Kindern und Jugendlichen unter 18 Jahren ist bisher nicht erwiesen. Es liegen keine Daten vor.
Ältere Patienten (ab 65 Jahre)
B-Zell-ALL: Die Sicherheit und Wirksamkeit von Kymriah in dieser Patientengruppe wurde bisher nicht nachgewiesen.
DLBCL und FL: Bei älteren Patienten über 65 Jahre ist keine Dosisanpassung erforderlich (siehe «Eigenschaften/Wirkungen»).
Patienten, die seropositiv für Hepatitis-B-Virus (HBV), Hepatitis-C-Virus (HCV) oder Humanes Immundefizienz-Virus (HIV) sind
Es gibt keine Erfahrungen mit der Herstellung von Kymriah für Patienten mit positiver Testung auf HIV, aktive HBV, oder aktive HCV-Infektion. Leukapheresat von diesen Patienten wird nicht für die Herstellung von Kymriah akzeptiert. Führen Sie ein Screening auf HBV, HCV und HIV gemäss den klinischen Leitlinien durch, bevor Sie Zellen für die Herstellung entnehmen.
Aktive Leukämie oder Lymphom des Zentralnervensystems (ZNS)
Es gibt nur begrenzte Erfahrungen mit Kymriah bei Patienten mit aktiver ZNS-Leukämie und aktivem ZNS-Lymphom. Daher wurden in dieser Population Risiko und Nutzen von Kymriah nicht untersucht.
Art der Anwendung
Kymriah darf nur intravenös angewendet werden.
Vorsichtsmassnahmen vor der Handhabung und Verabreichung von Kymriah
Dieses Arzneimittel enthält genetisch veränderte menschliche Blutzellen. Das medizinische Fachpersonal, das mit Kymriah umgeht, sollte daher, wie bei jedem Material, das vom Menschen stammt, angemessene Vorsichtsmassnahmen treffen (Tragen von Handschuhen und Schutzbrille), um eine mögliche Übertragung von infektiösen Krankheiten zu vermeiden (siehe «Sonstige Hinweise»).
Vorbereitung auf die Infusion
Bestätigung der Patientenidentität: Vor der Kymriah-Infusion muss die Identität des Patienten mit den Angaben zum Patienten auf den Kymriah-Infusionsbeuteln abgeglichen werden.
Prüfung und Auftauen der Infusionsbeutel: Der Zeitpunkt des Auftauens von Kymriah muss mit dem Zeitpunkt der Infusion koordiniert werden. Bestätigen Sie im Voraus, wann die Infusion erfolgen soll, und passen Sie die Auftauzeit so an, dass Kymriah für die Infusion zur Verfügung steht, sobald der Empfänger bereit ist. Sobald Kymriah aufgetaut ist und Raumtemperatur (20°C -25°C) erreicht hat, muss es innerhalb von 30 Minuten infundiert werden, um die maximale Zellviabilität des Produkts zu erhalten, eventuelle Unterbrechungen während der Infusion eingeschlossen (siehe «Sonstige Hinweise», Abschnitt «Hinweise für die Handhabung»)).
Verabreichung
Tocilizumab und eine Notfallausrüstung müssen vor der Infusion und während der Erholungsphase zur Verfügung stehen.
Kymriah muss als i.v.-Infusion durch latexfreie i.v.-Schläuche ohne leukozytendepletierenden Filter verabreicht werden. Die Verabreichung erfolgt ungefähr bei 10 bis 20 ml pro Minute durch Schwerkraftfluss und muss entsprechend für kleinere Kinder und kleinere Volumina angepasst werden. Es muss der gesamte Inhalt des Infusionsbeutels infundiert werden. Natriumchloridlösung 9 mg/ml (0,9 %) zur Injektion muss verwendet werden, um den Schlauch für die Infusion vorzubereiten und nach der Infusion zu spülen. Nach der Infusion des vollständigen Volumens von Kymriah sollte der Infusionsbeutel mit 10 bis 30 ml Natriumchloridlösung 9 mg/ml (0,9%) zur Injektion nachgespült (back priming) werden, um sicherzustellen, dass dem Patienten so viele Zellen wie möglich infundiert werden.
In klinischen Studien war die intravenöse Druckinjektion eine alternative Methode zur Verabreichung niedriger Dosen Kymriah (<20 mL).
KontraindikationenKymriah ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber Tisagenlecleucel oder einem der Hilfsstoffe, einschliesslich Dimethylsulfoxid (DMSO) und Dextran 40 (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Die Gegenanzeigen der Chemotherapie zur Lymphozytendepletion sind zu beachten.
Warnhinweise und VorsichtsmassnahmenGründe für eine Verschiebung der Behandlung
Wegen der Risiken bei einer Behandlung mit Kymriah sollte die Infusion aufgeschoben werden, wenn bei einem Patienten eine der folgenden Bedingungen zutrifft:
·Noch andauernde, schwerwiegende Nebenwirkungen (insbesondere pulmonale Nebenwirkungen, kardiale Nebenwirkungen oder Hypotonie) aufgrund vorangegangener Chemotherapien.
·Aktive unkontrollierte Infektion.
·Aktives Graft-versus-Host-Syndrom (GVHD).
·Klinisch signifikante Verschlechterung der Leukämielast oder schnelle Progression des Lymphoms nach Chemotherapie zur Lymphozytendepletion.
Blut-, Organ-, Gewebe- und Zellspende
Patienten, die mit Kymriah behandelt werden, dürfen kein Blut, Organe, Gewebe, Sperma, Oocyten und Zellen spenden.
Patienteninformation
Vor der Infusion muss der Patient genau informiert und darauf hingewiesen werden, seinen Arzt sofort zu informieren, wenn nach der Infusion mit Kymriah Symptome eines Cytokine Release Syndromes (CRS) oder neurologische Symptome auftreten. Der Patient muss ausserdem darüber informiert werden, dass er sich für mindestens 4 Wochen nicht weiter als 2 Stunden von dem Ort entfernen sollte, an dem er seine Kymriah-Behandlung erhalten hat.
Der Patient muss ebenfalls darauf aufmerksam gemacht werden, dass obwohl die meisten CRS und neurologischen Symptome innerhalb der ersten vier Wochen nach Infusion auftreten, solche und andere Nebenwirkungen jederzeit auftreten können, und eine Behandlung erfordern können.
Cytokine Release Syndrome (CRS)
CRS einschliesslich lebensbedrohlicher oder tödlicher Ereignisse wurde bei Patienten nach einer Kymriah-Infusion häufig beobachtet. In nahezu allen Fällen trat das CRS zwischen 1 und 10 Tagen (medianer Beginn nach 3 Tagen) nach der Kymriah-Infusion bei pädiatrischen und jungen erwachsenen B-Zell-ALL-Patienten auf, und zwischen 1 und 9 Tagen (medianer Beginn nach 3 Tagen) nach der Kymriah-Infusion bei erwachsenen DLBCL-Patienten und zwischen 1 und 14 Tagen (medianer Beginn nach 4 Tagen) nach der Kymriah-Infusion bei erwachsenen FL-Patienten. Die mediane Zeit bis zum Abklingen der CRS-Symptomatik betrug bei B-Zell-ALL 8 Tage, bei DLBCL-Patienten 7 Tage und bei FL-Patienten 4 Tage.
Symptome von CRS können hohes Fieber, Hypotonie, Hypoxie, Dyspnoe, Tachypnoe, Tachykardie, Ermüdung, Kopfschmerzen, Rigor, Myalgie, Arthralgie, Übelkeit, Erbrechen, Diarrhö, Diaphorese, Ausschlag und Anorexie einschliessen. Organversagen einschliesslich Herzinsuffizienz, Niereninsuffizienz und Leberschäden mit begleitender erhöhter Aspartat-Aminotransferase (AST), erhöhter Alanin-Aminotransferase (ALT) oder erhöhtem Bilirubin können ebenfalls beobachtet werden. In einigen Fällen können disseminierte intravaskuläre Gerinnung (DIC) mit niedrigem Fibrinogenspiegel, Capillary Leak Syndrome (CLS), Makrophagen-Aktivierungssyndrom (MAS) und Hämophagozytische Lymphohistiozytose im Zusammenhang mit CRS auftreten. Die Patienten sollten genauestens auf Anzeichen oder Symptome dieser Ereignisse, einschliesslich Fieber, überwacht werden.
Risikofaktoren für ein schweres CRS (Zytokinsturm) bei pädiatrischen und jungen erwachsenen Patienten mit B-Zell-ALL sind eine vor der Infusion bestehende hohe Tumorlast, unkontrollierte oder schnell zunehmende Tumorlast nach einer Chemotherapie zur Lymphozytendepletion, aktive Infektion sowie früh nach der Infusion von Kymriah einsetzendes Fieber oder CRS. Eine hohe Tumorlast vor der Kymriah-Infusion wurde als ein Risikofaktor für die Entstehung eines schweren CRS bei erwachsenen DLBCL-Patienten identifiziert.
Bei allen Indikationen sollte eine entsprechende prophylaktische und therapeutische Behandlung von Infektionen vorgenommen und ein vollständiger Rückgang aller bestehenden Infektionen sichergestellt werden. Auch im Rahmen des CRS können Infektionen auftreten und das Risiko für einen tödlichen Verlauf erhöhen. Koagulationsparameter sollten häufig und in Übereinstimmung mit lokalen Standards überwacht und entsprechend behandelt werden, einschliesslich der Behandlung mit Kryopräzipitaten oder Fibrinogenkonzentraten.
Behandlung des mit Kymriah assoziierten CRS
Um das Risiko für CRS-Komplikationen zu verringern oder die CRS-Komplikationen zu behandeln, können Patienten, die mit Kymriah behandelt werden, eine anti-Interleukin-6-basierte Behandlung (z.B. Tocilizumab) erhalten. Diese Behandlung kann bei Bedarf durch Kortikosteroide ergänzt werden. Die Strategien für die Behandlung des CRS können auf der neusten Leitlinie der American Society of Clinical Oncology (ASCO) und/oder entsprechenden lokalen institutionellen/akademischen Leitlinien beruhen.
Vor der Kymriah-Infusion müssen mindestens 2 Dosen Tocilizumab pro Patient am Infusionsort vorhanden sein und für die Verabreichung zur Verfügung stehen. Das Behandlungszentrum sollte schnellen Zugang zu weiteren Dosen Tocilizumab haben. Nach Gabe von Tocilizumab und Kortikosteroiden expandiert Tisagenlecleucel weiter und bleibt nach der Anwendung von Tocilizumab und Kortikosteroiden erhalten.
Patienten mit einer klinisch signifikanten kardialen Dysfunktion sollten nach intensivmedizinischen Standards betreut und Massnahmen wie eine Echokardiographie in Betracht gezogen werden.
Tumornekrosefaktor-Antagonisten (TNF-Antagonisten) werden für die Behandlung von Kymriah-assoziiertem CRS nicht empfohlen.
Neurologische Ereignisse
Neurologische Ereignisse (auch bekannt als Immuneffektorzell-assoziiertes Neurotoxizitätssyndrom (ICANS)), insbesondere Anzeichen und Symptome einer Enzephalopathie, Verwirrtheitszustand oder Deliriums können bei Kymriah häufig auftreten und schwerwiegend oder lebensbedrohlich sein. Andere Manifestationen beinhalteten getrübten Bewusstheitszustand, Krampfanfälle, Aphasie und Sprachstörungen. Die meisten neurologischen Ereignisse traten innerhalb von 8 Wochen nach der Kymriah-Infusion auf und waren vorübergehend. Die mediane Zeit bis zum Auftreten der ersten neurologischen Ereignisse, die zu irgendeinem Zeitpunkt nach der Kymriah-Infusion auftraten, betrug bei der B-Zell-ALL 8 Tage, bei DLBCL 6 Tage und bei FL 9 Tage. Die mediane Zeit bis zum Abklingen betrug bei der B-Zell-ALL 7 Tage, bei DLBCL 13 Tage und bei FL 2 Tage.
Neurologische Ereignisse können während des CRS, nach dessen Abklingen oder ohne CRS erfolgen.
Die Patienten sollten auf neurologische Ereignisse überwacht werden. Um das Risiko neurologischer Nebenwirkungen (einschliesslich ICANS) (siehe oben) zu verringern oder die neurologischen Nebenwirkungen zu behandeln, können Patienten, die mit Kymriah behandelt werden, eine unterstützende Behandlung erhalten, die auf der neuesten Leitlinie der American Society of Clinical Oncology (ASCO) und/oder den entsprechenden lokalen institutionellen/akademischen Leitlinien basiert.
Infektionen und febrile Neutropenie
Patienten mit aktiver, unkontrollierter Infektion dürfen erst dann mit der Kymriah-Behandlung beginnen, wenn die Infektion vollständig zurückgegangen ist. Vor der Kymriah-Infusion muss die Infektionsprophylaxe nach Leitlinien auf Basis der vorangegangenen Immunsuppression erfolgen.
Schwerwiegende Infektionen, einschliesslich lebensbedrohlicher und tödlicher Infektionen, traten bei Patienten nach der Kymriah-Infusion häufig auf. Bei immunsupprimierten Patienten wurden Fälle von lebensbedrohlichen und tödlich verlaufenden opportunistischen Infektionen berichtet, einschliesslich disseminierte Pilzinfektionen und Virus-Reaktivierung (z.B. HHV-6 und progressive multifokale Leukoenzephalopathie (PML)). Bei Patienten mit neurologischen Ereignissen sollte die Möglichkeit solcher Infektionen berücksichtigt werden und entsprechende diagnostischen Massnahmen durchgeführt werden. Die Patienten müssen auf Anzeichen und Symptome einer Infektion überwacht und entsprechend behandelt werden. Gegebenenfalls müssen prophylaktisch Antibiotika verabreicht und Untersuchungen zur Krankheitsüberwachung vor und während der Behandlung mit Kymriah durchgeführt werden. Es ist bekannt, dass Infektionen den Verlauf und das Management von gleichzeitig auftretendem CRS erschweren. Die Möglichkeit von opportunistischen Infektionen des zentralen Nervensystems sollte bei Patienten mit neurologischen Nebenwirkungen in Betracht gezogen werden und entsprechende diagnostische Untersuchungen sollten durchgeführt werden.
Febrile Neutropenie wurde bei Patienten nach der Kymriah-Infusion häufig beobachtet und kann gleichzeitig mit CRS auftreten. Bei einer febrilen Neutropenie muss die Infektion beurteilt und mit Breitbandantibiotika, Flüssigkeitszufuhr und anderen unterstützenden Therapien wie medizinisch indiziert entsprechend behandelt werden.
Bei Patienten, die nach der Kymriah-Infusion eine vollständige Remission erzielen, kann ein niedriger Immunglobulinspiegel das Infektionsrisiko erhöhen. Es muss auf Anzeichen und Symptome von Infektionen geachtet werden und dabei müssen das Alter des Patienten und die Leitlinien berücksichtigt werden.
Länger anhaltende Zytopenien
Patienten können nach der lymphodepletierenden Chemotherapie und der Kymriah-Infusion noch mehrere Wochen lang Zytopenien aufweisen und müssen in diesem Fall nach den Leitlinien behandelt werden. Bei der Mehrheit der Patienten, die am Tag 28 nach der Kymriah-Behandlung Zytopenien hatten, gingen diese bei pädiatrischen ALL- und DLBCL-Patienten innerhalb von drei Monaten nach der Behandlung und bei FL-Patienten innerhalb von 6 Monaten nach der Behandlung auf Grad 2 oder darunter zurück. Eine länger anhaltende Neutropenie wird mit einem erhöhten Infektionsrisiko assoziiert. Myeloische Wachstumsfaktoren, insbesondere Granulozyten-Makrophagen-Kolonie-stimulierende Faktoren (granulocyte macrophage colony stimulating factor, GM-CSF) besitzen das Potenzial, die Symptome eines Zytokinfreisetzungssyndroms zu verschlechtern und werden in den ersten 3 Wochen nach der Kymriah-Infusion und bis zum vollständigen Rückgang des CRS nicht empfohlen.
Sekundäre Malignome
Patienten, die mit Kymriah behandelt werden, können sekundäre Malignome oder ein Rezidiv ihres Krebses entwickeln. T-Zell-Malignome sind nach der Behandlung hämatologischer Malignome mit BCMA- und CD19-gerichteten genetisch modifizierten autologen T-Zell-Immuntherapien, einschliesslich Kymriah, aufgetreten. Reife T-Zell-Malignome, einschliesslich CAR-positiver Tumoren, können bereits Wochen nach der Infusion auftreten und auch tödlich verlaufen. Die Patienten sollten lebenslang auf sekundäre Malignome, einschliesslich solcher, die von T-Zellen ausgehen, überwacht werden. Für den Fall, dass ein sekundäres Malignom auftritt, sollte die Zulassungsinhaberin kontaktiert werden, um Anweisungen zur Entnahme von Patientenproben für eine Untersuchung zu erhalten.
Hypogammaglobulinämie
Hypogammaglobulinämie (IgG) und Agammaglobulinämie (IgG) können bei Patienten nach der Kymriah-Infusion auftreten. Der Immunglobulinspiegel muss nach der Behandlung mit Kymriah überwacht werden. Bei Patienten mit niedrigen Immunglobulinspiegeln müssen je nach Alter des Patienten und Leitlinien Massnahmen wie Infektions- und Antibiotikaprophylaxe sowie Immunglobulinersatz getroffen werden.
Lebendimpfstoffe
Die Sicherheit einer Immunisierung mit lebenden Impfstoffen während oder nach der Kymriah-Behandlung wurde nicht untersucht. Die Impfung mit Lebendimpfstoffen wird für mindestens 6 Wochen vor Beginn der lymphodepletierenden Chemotherapie, während der Kymriah-Behandlung und bis zur Wiederherstellung des Immunsystems nach der Behandlung mit Kymriah nicht empfohlen.
Tumorlysesyndrom
Das Auftreten eines zum Teil schwerwiegenden Tumorlysesyndroms (TLS) wurde gelegentlich beobachtet. Als TLS-Risikominderung müssen Patienten mit erhöhter Harnsäure oder hoher Tumorlast vor der Kymriah-Infusion Allopurinol oder eine alternative Prophylaxe erhalten. Anzeichen und Symptome von TLS müssen überwacht und Ereignisse nach einheitlichen Behandlungsleitlinien behandelt werden.
Begleiterkrankungen
Patienten mit aktiven ZNS-Erkrankungen in der Vorgeschichte oder mit eingeschränkter Funktion von Nieren, Leber, Lunge oder Herz wurden von den Studien ausgeschlossen. Diese Patienten reagieren wahrscheinlich empfindlicher auf die unten beschriebenen Nebenwirkungen und benötigen daher eine besondere Überwachung.
Frühere Stammzelltransplantation
Es wird nicht empfohlen, dass Patienten Kymriah innerhalb von 4 Monaten nach einer allogenen Stammzelltransplantation (SCT) erhalten, da das potenzielle Risiko einer sich verschlimmernden Graft-versus-Host-Disease (GVHD) besteht. Die Leukapherese zur Herstellung von Kymriah sollte frühestens 12 Wochen nach einer allogenen SCT erfolgen.
Virusreaktivierung
Eine Virusreaktivierung, wie z.B. Hepatitis-B-Virus (HBV) Reaktivierung, kann bei Patienten auftreten, die mit Medikamenten behandelt werden, die gegen B-Zellen gerichtet sind und könnten zu fulminanter Hepatitis, Leberversagen oder zum Tod führen.
Vorbehandlung mit einer Anti-CD19-Therapie
Die Erfahrung mit Kymriah ist begrenzt bei Patienten, die zuvor eine gegen CD19 gerichtete Therapie erhalten haben. Kymriah wird nicht empfohlen bei Patienten, die nach einer vorausgegangenen Anti-CD19-Therapie ein Rezidiv mit einer CD19-negativen Leukämie entwickelten.
Interferenz mit serologischen Tests
Wegen geringfügiger Übereinstimmung kurzer genetischer Sequenzen zwischen dem lentiviralen Vektor für die Herstellung von Kymriah und HIV können einige handelsübliche Nukleinsäure-Amplifikations-Tests (NAT) zum Nachweis von HIV ein falsch-positives Ergebnis anzeigen.
Risiko für den Fötus
Tisagenlecleucel hat das Potenzial, eine maternale B-Zell-Lymphozytopenie zu verursachen, die ein Risiko für den Fötus darstellen könnte. Daher wird Kymriah nicht für schwangere Frauen empfohlen und die Planung einer möglichen Schwangerschaft nach der Kymriah-Therapie sollte mit dem behandelnden Arzt besprochen werden (siehe «Schwangerschaft/Stillzeit»). Schwangere Frauen und Frauen im gebärfähigen Alter müssen über das mögliche Risiko für den Fötus aufgeklärt werden.
Gehalt an Natrium und Kalium
Dieses Arzneimittel enthält 24.3 bis 121.5 mg Natrium pro Dosiereinheit, entsprechend 1 bis 6% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g.
Dieses Arzneimittel enthält Kalium, jedoch weniger als 1 mmol (39 mg) Kalium pro Dosiereinheit, d.h. es ist nahezu «kaliumfrei».
Gehalt an Dextran 40 und Dimethylsulfoxid (DSMO)
Dieses Arzneimittel enthält 11 mg Dextran 40 und 82,5 mg Dimethylsulfoxid (DMSO) pro ml. Es wurde über schwerwiegende Überempfindlichkeitsreaktionen, einschliesslich Anaphylaxie, berichtet (siehe «Unerwünschte Wirkungen»). Kymriah kann bei parenteraler Anwendung anaphylaktische Reaktionen auslösen. Alle Patienten müssen während der Infusionsdauer genau beobachtet werden.
InteraktionenEs wurden keine pharmakokinetischen oder pharmakodynamischen Interaktionsstudien mit Tisagenlecleucel durchgeführt. Die gleichzeitige Anwendung von Arzneimitteln, von denen bekannt ist, dass sie die Funktion von T-Zellen hemmen, wurde nicht untersucht. Die Gabe niedrig dosierter Steroide im Rahmen der Behandlung eines CRS beeinflusst nicht die Expansion und Persistenz der CAR-T-Zellen. Die gleichzeitige Anwendung von Arzneimitteln, von denen bekannt ist, dass sie die Funktion von T-Zellen stimulieren, wurde nicht untersucht und die Auswirkungen sind nicht bekannt.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter/Verhütung bei Männern und Frauen
Bei Frauen im gebärfähigen Alter ist vor Behandlungsbeginn mit Kymriah zu klären, ob Sie schwanger sind.
Informationen über die Notwendigkeit einer wirksamen Verhütung bei Patienten, die eine lymphozytendepletierende Chemotherapie erhalten, finden Sie in den Fachinformationen der verwendeten lymphozytendepletierenden Chemotherapeutika.
Die Expositionsdaten reichen nicht aus, um eine Empfehlung zur Dauer der Verhütung nach der Behandlung mit Kymriah abzugeben.
Sexuell aktive, gebärfähige Frauen müssen während der vorbereitenden Chemotherapie und bis 6 Monate nach der Verabreichung von Kymriah eine zuverlässige Verhütungsmethode anwenden (Methoden, die zu einer Schwangerschaftsrate von weniger als 1 % führen). Wenn eine Schwangerschaft geplant oder gewünscht wird, muss dies mit dem behandelnden Arzt besprochen werden.
Schwangerschaft
Es gibt keine verfügbaren Daten über die Verwendung von Kymriah bei schwangeren Frauen. Es wurden keine tierexperimentellen Studien mit Kymriah durchgeführt, um zu untersuchen, ob die Anwendung bei Schwangeren zu einer Schädigung des Fötus führen kann. Es ist nicht bekannt, ob Kymriah das Potenzial hat, auf den Fötus übertragen zu werden. Basierend auf dem Wirkmechanismus könnten die transduzierten Zellen, falls sie die Plazentaschranke überschreiten, fetale Toxizität verursachen, darunter eine B-Zell-Lymphozytopenie. Schwangere Frauen müssen über das mögliche Risiko für den Fötus aufgeklärt werden. Daher wird Kymriah nicht für schwangere Frauen empfohlen. Eine Schwangerschaft nach der Kymriah-Therapie sollte mit dem behandelnden Arzt besprochen werden.
Bei schwangeren Frauen, die Kymriah erhalten haben, kann eine Hypogammaglobulinämie auftreten. Untersuchen Sie den Immunglobulinspiegel bei Neugeborenen von Müttern, die mit Kymriah behandelt wurden.
Stillzeit
Es ist nicht bekannt, ob Kymriah-Zellen in die Muttermilch übergehen. Ein Risiko für das gestillte Neugeborene / den gestillten Säugling kann nicht ausgeschlossen werden. Stillende Frauen sollten über das mögliche Risiko für den gestillten Säugling aufgeklärt werden.
Nach der Verabreichung von Kymriah sollte mit dem behandelnden Arzt besprochen werden, ob das Stillen infrage kommt.
Fertilität
Es liegen keine Daten über die Beeinflussung der Fertilität durch Kymriah vor.
Die Auswirkungen von Kymriah auf die männliche und die weibliche Fertilität wurden in tierexperimentellen Studien nicht untersucht.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenKymriah hat grossen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Da neurologische Ereignisse, einschliesslich Bewusstseinsveränderungen und Krampfanfälle, auftreten können, besteht für Patienten in den 8 Wochen nach der Kymriah-Infusion das Risiko einer Veränderung oder Einschränkung des Bewusstseinszustands oder der Koordination. Den Patienten wird empfohlen, während dieser Anfangszeit nicht am Strassenverkehr teilzunehmen und keine gefährlichen Arbeiten oder Tätigkeiten wie das Bedienen schwerer oder potenziell gefährlicher Maschinen durchzuführen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die Sicherheitsbewertung basierte auf insgesamt 291 Patienten (79 pädiatrische Patienten und junge Erwachsene mit B-Zell-ALL, 115 erwachsene Patienten mit DLBCL und 97 erwachsene Patienten mit FL), die Kymriah in drei zulassungsrelevanten multizentrischen klinischen Studien erhielten.
B-Zell-ALL
Die in diesem Abschnitt beschriebenen Nebenwirkungen traten bei 79 Patienten auf, denen Kymriah in der multizentrischen, zulassungsrelevanten klinischen Studie CCTL019B2202 als Infusion verabreicht wurde.
Die häufigsten nicht-hämatologischen Nebenwirkungen waren Zytokinfreisetzungssyndrom (Cytokine release syndrome, CRS) (77 %), Infektionen (72 %), Hypogammaglobulinämie (53 %), Fieber (42 %) und verminderter Appetit (38 %).
Die häufigsten hämatologischen Nebenwirkungen waren verringerte weisse Blutzellen (100 %), verringertes Hämoglobin (100 %), verringerte Neutrophile (100 %), verringerte Lymphozyten (100 %) und verringerte Thrombozyten (97 %).
Nebenwirkungen vom Grad 3 und 4 wurden bei 89 % der Patienten angegeben. Die häufigste nicht-hämatologische Nebenwirkung vom Grad 3 und 4 war das CRS (48 %).
Die häufigsten hämatologischen Nebenwirkungen vom Grad 3 und 4 waren verringerte weisse Blutzellen (97 %), verringerte Lymphozyten (96 %), verringerte Neutrophile (95 %), verringerte Thrombozyten (77 %) und verringertes Hämoglobin (48 %).
In den ersten 8 Wochen nach der Infusion waren bei mehr Patienten (82 %) Nebenwirkungen vom Grad 3 und 4 zu beobachten als in der Zeit nach der 8. Woche nach der Infusion (51 %).
DLBCL
Die in diesem Abschnitt beschriebenen Nebenwirkungen wurden bei 115 Patienten beschrieben, denen im Rahmen einer globalen multizentrischen Studie Kymriah infundiert wurde, und zwar in der noch andauernden klinischen Zulassungsstudie CCTL019C2201.
Die häufigsten nicht-hämatologischen Nebenwirkungen waren Zytokinfreisetzungssyndrom (57 %), Infektionen (58 %), Fieber (35 %), Diarrhö (31 %), Übelkeit (29 %), Hypotonie (25 %) und Müdigkeit (27 %).
Die häufigsten hämatologischen Nebenwirkungen waren verringerte Lymphozyten (100 %), verringerte weisse Blutzellen (99 %), verringertes Hämoglobin (99 %), verringerte Neutrophile (97 %) und verringerte Thrombozyten (95 %).
Nebenwirkungen vom Grad 3 und 4 wurden bei 88 % der Patienten angegeben. Die häufigsten nicht-hämatologischen Nebenwirkungen vom Grad 3 und 4 waren Infektionen (34 %) und Zytokinfreisetzungssyndrom (23 %).
Die häufigsten (> 25 %) hämatologischen Nebenwirkungen vom Grad 3 und 4 waren verringerte Lymphozyten (95 %), verringerte Neutrophile (82 %), verringerte weisse Blutzellen (78 %), verringertes Hämoglobin (59 %) und verringerte Thrombozyten (56 %).
In den ersten 8 Wochen nach der Infusion waren bei mehr Patienten (82 %) Nebenwirkungen vom Grad 3 und 4 zu beobachten als in der Zeit nach der 8. Woche nach der Infusion (48 %).
FL
Die in diesem Abschnitt beschriebenen Nebenwirkungen wurden bei 97 Patienten beschrieben, die Kymriah im Rahmen einer globalen, multizentrischen internationalen Studie erhielten, d.h. der laufenden klinischen Zulassungsstudie CCTL019E2202.
Die häufigsten nicht-hämatologischen Nebenwirkungen (> 25 %) waren Zytokinfreisetzungssyndrom (50 %), Infektionen (50 %) und Kopfschmerzen (26 %).
Die häufigsten hämatologischen Nebenwirkungen waren verringertes Hämoglobin (94 %), verringerte Lymphozyten (92 %), verringerte weisse Blutzellen (91 %), verringerte Neutrophile (89 %) und verringerte Thrombozyten (89 %).
Nebenwirkungen vom Grad 3 und 4 wurden bei 76 % der Patienten berichtet. Die häufigsten nicht-hämatologischen Nebenwirkungen vom Grad 3 und 4 waren Infektionen (16 %).
Die häufigsten (> 25 %) hämatologischen Nebenwirkungen vom Grad 3 und 4 waren verringerte Lymphozyten (87 %), verringerte weisse Blutzellen (74 %), verringerte Neutrophile (71 %), verringerte Thrombozyten (26 %) und verringertes Hämoglobin (25 %).
Nebenwirkungen vom Grad 3 und 4 wurden häufiger innerhalb der ersten 8 Wochen nach der Infusion (69 %) als in der Zeit nach der 8.Woche (42 %) beobachtet.
Tabellarische Auflistung von Nebenwirkungen aus klinischen Studien
Die in diesem Abschnitt beschriebenen Nebenwirkungen traten bei 79 pädiatrischen und jungen Erwachsenen r/r B-Zell-ALL, 115 erwachsenen r/r DLBCL Patienten bzw. 97 erwachsenen FL Patienten auf, denen im Rahmen der derzeit laufenden weltweiten multizentrischen Studien (CCTL019B2202, CCTL019C2201 bzw. CCTL019E2202) Kymriah infundiert worden war. Die in diesen klinischen Studien beobachteten Nebenwirkungen sind nach Systemorganklassen gemäss MedDRA aufgelistet. Innerhalb jeder Systemorganklasse werden die Nebenwirkungen entsprechend ihrer Häufigkeit aufgelistet, wobei die häufigsten Wirkungen zuerst aufgeführt werden, basierend auf folgender Konvention: sehr häufig (≥1/10), häufig (≥1/100 bis < 1/10), gelegentlich (≥1/1'000 bis < 1/100), selten (≥1/10'000 bis < 1/1'000), sehr selten (< 1/10'000); unbekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und parasitäre Erkrankungen1)
Sehr häufig: Infektionen - Erreger nicht spezifiziert (46 %), Virusinfektion (20 %), bakterielle Infektion (17 %), Pilzinfektion (9 %).
Erkrankungen des Blutes und des Lymphsystems
Sehr häufig: Anämie (36 %), Neutropenie (26 %), Febrile Neutropenie (20 %), Hämorrhagie2) (19 %), Thrombozytopenie (15 %).
Häufig: Leukopenie, Lymphopenie, Panzytopenie, Hämophagozyitische Lymphohistiozytose, Koagulopathie, Fibrinogen im Blut erniedrigt, International normalized Ratio erhöht, Fibrin D-Dimer erhöht, aktivierte partielle Thromboplastinzeit verlängert, Prothrombinzeit verlängert.
Gelegentlich: B-Zell Aplasie.
Erkrankungen des Immunsystems
Sehr häufig: Zytokinfreisetzungssyndrom (60 %), Hypogammaglobulinämie3) (27 %).
Häufig: Infusionsbedingte Reaktionen, Graft-versus-Host-Syndrom4).
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Hypokaliämie (19 %), Verminderter Appetit (18 %), Hypophosphatämie (16 %), Hypomagnesiämie (11 %).
Häufig: Hypokalzämie, Hypoalbuminämie5), Hyperglykämie, Hyponatriämie, Hyperferritinämie6), Hyperurikämie, Hypercalzämie, Hyperkaliämie, Tumorlysesyndrom, Hyperphosphatämie, Hypernatriämie, Hypermagnesiämie.
Psychiatrische Erkrankungen
Häufig: Angst, Schlafstörung7), Delirium8).
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerz9) (27 %), Enzephalopathie10) (16 %).
Häufig: Schwindelgefühl11), periphere Neuropathie12), Tremor13), motorische Funktionsstörung14), Krampfanfall15), Sprechstörungen16), immuneffektorzellenassoziiertes Neurotoxizitätssyndrom, Neuralgie17), Ataxie18).
Gelegentlich: ischämischer Zerebralinfarkt.
Augenerkrankungen
Häufig: Sehverschlechterung19).
Herzerkrankungen
Sehr häufig: Tachykardie20) (13%).
Häufig: Herzinsuffizienz21), Vorhofflimmern, Herzstillstand.
Gelegentlich: ventrikuläre Extrasystolen.
Gefässerkrankungen
Sehr häufig: Hypotonie22) (21 %).
Häufig: Hypertonie, Thrombose23), Capillary Leak Syndrome.
Gelegentlich: Hitzegefühl.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Husten24) (20 %), Dyspnoe25) (16 %), Hypoxie (10 %).
Häufig: Schmerzen im Oropharynx26), Pleuraerguss, Nasenverstopfung, Lungenödem27), Tachypnoe, akutes Atemnotsyndrom.
Gelegentlich: Lungeninfiltration.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Diarrhö (28 %), Übelkeit (24 %), Obstipation (16 %), Erbrechen (15 %), Abdominalschmerz28) (12 %).
Häufig: Stomatitis, aufgetriebener Bauch, Mundtrockenheit, Aszites.
Leber- und Gallenerkrankungen
Sehr häufig: Leberenzyme erhöht29) (14 %).
Häufig: Hyperbilirubinämie.
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: Ausschlag 30) (13 %).
Häufig: Pruritus, nächtliche Schweissausbrüche, Erythem, Hyperhidrose.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Schmerzen des Muskel- und Skelettsystems31) (17 %), Arthralgie (13 %).
Häufig: Myalgie.
Erkrankungen der Nieren und Harnwege
Sehr häufig: Akute Nierenschädigung 32) (14 %).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Fieber (32 %), Ermüdung33) (23 %), Ödeme 34) (20 %), Schmerzen35) (15 %).
Häufig: Schüttelfrost, Asthenie, grippeähnliche Erkrankung, Multiorgandysfunktionssyndrom, Gewicht erniedrigt.
1) Die aufgeführten Infektionen und parasitären Erkrankungen spiegeln Gruppenbezeichnungen einer hohen Ebene wieder.
2) Blutung umfasst die Einträge Analblutung, Blutblase, Blut im Urin nachweisbar, Blutung an der Katheterstelle, Hirnblutung, Bindehautblutung, Kontusion, hämorrhagische Zystitis, disseminierte intravaskuläre Gerinnung, Ulkus duodeni mit Blutung, Epistaxis, Augenkontusion, gastrointestinale Blutungen, Zahnfleischbluten, Hämarthrose, Hämatemesis, Hämatochezie, Hämatom, Hämaturie, Bluthusten, heftige Menstruationsblutung, Dickdarmblutung, Meläna, Blutung des Munds, Schleimhautblutung, Blutblase am Mund, Peritonealhämatom, Petechien, Pharynxblutung, Blutung nach einem Eingriff, Lungenblutung, Purpura, Netzhautblutung, subdurales Hämatom, traumatisches Hämatom, Tumorblutung, Blutung im oberen gastrointestinalen Bereich und vaginale Blutung.
3) Hypogammaglobulinämie umfasst die Einträge Immunglobuline erniedrigt, Immunglobulin A im Blut erniedrigt, Immundefekt, Immunglobulin G im Blut erniedrigt, Immunglobulin M im Blut erniedrigt, Immunmangel allgemein variabel, Hypogammaglobulinämie.
4) Graft-versus-Host-Syndrom (GVHD) umfasst die Einträge GVHD, GVHD im GI-Trakt, GVHD in der Haut.
5) Hypoalbuminämie umfasst die Einträge Albumin im Blut erniedrigt und Hypoalbuminämie.
6) Hyperferritinämie umfasst die Einträge Hyperferritinämie und Ferritin im Serum erhöht.
7) Schlafstörung umfasst die Einträge Schlafstörung, Schlaflosigkeit und Alptraum.
8) Delirium umfasst die Einträge Agitation, Delirium, Halluzination, Halluzination optisch, Reizbarkeit und Unruhe.
9) Kopfschmerz umfasst die Einträge Kopfschmerz und Migräne.
10) Enzephalopathie umfasst die Einträge getrübter Bewusstseinszustand, Gemütszustand verändert, Automatismus, kognitive Störung, Verwirrtheitszustand, Störung der Aufmerksamkeit, Enzephalopathie, posteriores reversibles Enzephalopathiesyndrom, Somnolenz, Lethargie, Erinnerungsvermögen eingeschränkt, metabolische Enzephalopathie und Denken anomal.
11) Schwindelgefühl umfasst die Einträge Schwindelgefühl, Präsynkope und Synkope.
12) Periphere Neuropathie umfasst die Einträge Dysästhesie, Parästhesie, periphere sensorische Neuropathie, periphere Neuropathie, Hyperästhesie und Hypoästhesie.
13) Tremor umfasst die Einträge Dyskinesie und Tremor.
14) Motorische Funktionsstörung umfasst die Einträge Muskelspasmen, Muskelzucken, Myoklonus und Myopathie.
15) Krampfanfall umfasst die Einträge Krampfanfall, generalisierte tonisch-klonische Anfälle und Status epilepticus.
16) Sprechstörungen umfasst die Einträge Sprechstörungen, Dysarthrie und Aphasie.
17) Neuralgie umfasst die Einträge Neuralgie und Ischialgie.
18) Ataxie umfasst die Einträge Ataxie und Dysmetrie.
19) Sehverschlechterung umfasst die Einträge Sehen verschwommen und Sehverschlechterung.
20) Tachykardie umfasst die Einträge Sinustachykardie, Tachykardie supraventrikulär und Tachykardie.
21) Herzinsuffizienz umfasst die Einträge Herzinsuffizienz, Funktionsstörung des linken Ventrikels, Stauungsinsuffizienz und Funktionsstörung des rechten Ventrikels.
22) Hypotonie umfasst die Einträge Hypotonie und Orthostasesyndrom.
23) Thrombose umfasst die Einträge tiefe Venenthrombose, Embolie, Lungenembolie, Thrombose, Thrombose der Vena cava und Venenthrombose.
24) Husten umfasst die Einträge Husten, Husten mit Auswurf und Hustensyndrom der oberen Atemwege.
25) Dyspnoe umfasst die Einträge akute respiratorische Insuffizienz, Dyspnoe, Belastungsdyspnoe, Atemnot und respiratorische Insuffizienz.
26) Schmerzen im Oropharynx umfasst die Einträge Mundschmerzen und Schmerzen im Oropharynx.
27) Lungenödem umfasst die Einträge akutes Lungenödem und Lungenödem.
28) Abdominalschmerz umfasst die Einträge Abdominalschmerz, Schmerzen Oberbauch und abdominale Beschwerden.
29) Leberenzym erhöht umfasst die Einträge Alaninaminotransferase erhöht, Aspartataminotransferase erhöht, alkalische Phosphatase im Blut erhöht, Leberenzym erhöht und Transaminasen erhöht.
30) Ausschlag umfasst die Einträge Dermatitis, Dermatitis akneiform, Kontaktdermatitis, Ausschlag, makulopapulöser Ausschlag, papulöser Ausschlag und Ausschlag mit Juckreiz.
31) Schmerzen des Muskel- und Skelettsystems umfasst die Einträge Rückenschmerzen, Knochenschmerzen, Flankenschmerz, Brustschmerzen die Skelettmuskulatur betreffend, Schmerzen des Muskel- und Skelettsystems, Nackenschmerzen, Thoraxschmerz nicht kardialen Ursprungs.
32) Akute Nierenschädigung umfasst die Einträge akute Nierenschädigung, Anurie, Azotämie, Kreatinin im Blut anomal, Kreatinin im Blut erhöht, Nierenversagen, Nierentubulusdysfunktion und Nierentubulusnekrose.
33) Ermüdung umfasst die Einträge Ermüdung und Unwohlsein.
34) Ödeme umfasst die Einträge Überwässerung, Flüssigkeitsretention, peripheres Ödem, generalisiertes Ödem, lokalisiertes Ödem, Ödem des Gesichts und periphere Schwellung.
35) Schmerzen umfasst die Einträge Schmerzen und Schmerz in einer Extremität.
Beschreibung ausgewählter Nebenwirkungen
Zytokinfreisetzungssyndrom
In der noch laufenden klinischen Studie mit pädiatrischen und jungen erwachsenen Patienten mit B-Zell-ALL (N = 79) wurde über Zytokinfreisetzungssyndrom bei 77 % der Patienten (48 % vom Grad 3 oder 4) berichtet. Innerhalb von 30 Tagen nach der Infusion von Kymriah gab es zwei Todesfälle, wobei ein Patient an progredienter Leukämie im Zusammenhang mit einem möglichen Zytokinfreisetzungssyndrom verstarb und ein Patient eine tödlich verlaufende intrakranielle Blutung erlitt, die im Laufe eines abklingenden Zytokinfreisetzungssyndroms mit abdominellem Kompartmentsyndrom, Koagulopathie und Nierenversagen auftrat.
In der noch andauernden klinischen Studie mit DLBCL-Patienten (N = 115) wurde über Zytokinfreisetzungssyndrom bei 57 % der Patienten (23 % vom Grad 3 oder 4) berichtet.
In der noch andauernden klinischen Studie mit FL-Patienten (N = 97) wurde bei 50 % der Patienten über Zytokinfreisetzungssyndrom berichtet. Es wurden keine Ereignisse vom Grad 3 oder 4 berichtet; ein berichtetes CRS-Ereignis mit Beginn > 1 Jahr nach der Behandlung mit Kymriah hatte einen tödlichen Ausgang.
Ein Zytokinfreisetzungssyndrom wurde in Studien mit pädiatrischen und jungen erwachsenen Patienten mit B-Zell-ALL und DLBCL entsprechend der Penn-Skala wie folgt gewichtet: Grad 1: leichte Reaktionen, die eine unterstützende Behandlung erfordern; Grad 2: mittelschwere Reaktionen, die eine intravenöse Therapie erfordern; Grad 3: schwere Reaktionen, die die Gabe von niedrig dosierten Vasopressoren oder von Sauerstoff erfordern; Grad 4: lebensbedrohliche Reaktionen, die hoch dosierte Vasopressoren oder Intubation erfordern; Grad 5: Tod.
Das Zytokinfreisetzungssyndrom wurde gemäss den Lee-Kriterien in der FL-Studie wie folgt gewichtet: Grad 1: leichte Allgemeinsymptome, die eine symptomatische Behandlung erfordern; Grad 2: Symptome, die eine moderate Invention erfordern, z.B. Sauerstoffsupplementierung mit niedrigem Fluss oder niedrigdosierte Vasopressoren; Grad 3: Symptome, die eine aggressive Invention erfordern, z.B. Sauerstoffsupplementierung mit hohem Fluss und hochdosierte Vasopressoren; Grad 4: lebensbedrohliche Symptome, die eine Intubation erfordern; Grad 5: Tod.
Informationen zur klinischen Behandlung des Zytokinfreisetzungssyndroms siehe «Warnhinweise und Vorsichtsmassnahmen».
Infektionen und febrile Neutropenie
Nach der Infusion von Kymriah traten bei den Patienten mit B-Zell-ALL bei 48 % schwere Infektionen (Grad 3 und 4) auf, die lebensbedrohlich oder tödlich verlaufen können. Die Gesamtinzidenz (alle Grade) betrug 72 % (nicht näher spezifiziert 57 %, viral 38 %, bakteriell 27 % und mykotisch 15 %) (siehe «Warnhinweise und Vorsichtsmassnahmen»). Innerhalb von 8 Wochen nach der Infusion von Kymriah kam es bei 43 % der Patienten zu einer Infektion jeglicher Art.
Bei DLBCL-Patienten traten bei 34 % schwere Infektionen (Grad 3 und 4) auf, die lebensbedrohlich oder tödlich verlaufen können. Die Gesamtinzidenz (alle Grade) betrug 58 % (nicht näher spezifiziert 48 %, bakteriell 15 %, mykotisch 11 % und viral 11 %) (siehe «Warnhinweise und Vorsichtsmassnahmen»). Innerhalb von 8 Wochen kam es bei 37 % der Patienten zu einer Infektion jeglicher Art.
Bei FL-Patienten traten schwere Infektionen (Grad 3 oder 4) bei 16 % der Patienten auf. Die Gesamtinzidenz (alle Schweregrade) betrug 50 % (nicht näher bezeichnete 36 %, virale 17 %, bakterielle 6 % und Pilzinfektionen 2 % ) (siehe «Warnhinweise und Vorsichtsmassnahmen»). Bei 19 % der Patienten trat innerhalb von 8 Wochen eine Infektion irgendeiner Art auf.
Bei 34 % der pädiatrischen und jungen erwachsenen Patienten mit B-Zell-ALL, 17 % der DLBCL-Patienten und 12 % der FL-Patienten wurde eine schwere febrile Neutropenie (Grad 3 oder 4) beobachtet. Informationen zur Behandlung der febrilen Neutropenie vor und nach der Infusion von Kymriah sind unter «Warnhinweise und Vorsichtsmassnahmen» zu finden.
Länger anhaltende Zytopenien
Zytopenien treten unter vorangegangenen Chemotherapien und der Therapie mit Kymriah sehr häufig auf.
Bei allen pädiatrischen und jungen erwachsenen Patienten mit B-Zell-ALL wurden irgendwann nach der Infusion mit Kymriah basierend auf Laborbefunden Zytopenien vom Grad 3 und 4 berichtet, die länger als 28 Tage nach Infusion anhielten, darunter Leukopenie (57 %), Neutropenie (54 %), Lymphopenie (44 %), Thrombozytopenie (42 %) und Anämie (13 %).
Alle der erwachsenen DLBCL-Patienten hatten Zytopenien vom Grad 3 und 4 irgendwann nach der Infusion mit Kymriah. Zytopenien vom Grad 3 und 4 die länger als 28 Tage anhielten, beinhalteten Thrombozytopenie (39 %), Lymphopenie (29 %), Neutropenie (25 %), Leukopenie (21 %) und Anämie (14 %).
99 % der erwachsenen FL-Patienten hatten Zytopenien vom Grad 3 und 4 irgendwann nach der Infusion mit Kymriah. Zytopenien vom Grad 3 und 4, die bis zum 28. Tag nach der Kymriah-Infusion nicht abgeklungen waren, beinhalteten eine Lymphopenie (23 %), Thrombozytopenie (17 %), Neutropenie (16 %), Leukopenie (13 %) und Anämie (vermindertes Hämoglobin) (3 %).
Neurologische Nebenwirkungen
Mehrheitlich traten neurotoxische Ereignisse innerhalb von 8 Wochen nach der Infusion auf und waren von vorübergehender Natur.
Bei pädiatrischen und jungen erwachsenen Patienten mit B-Zell-ALL kam es innerhalb von 8 Wochen nach der Infusion von Kymriah bei 39 % der Patienten zu Manifestationen von Enzephalopathie und/oder Delirium (Grad 3 oder 4 bei 13 %). Bei DLBCL-Patienten kam es innerhalb von 8 Wochen nach der Infusion von Kymriah bei 20 % der Patienten zu Manifestationen von Enzephalopathie und/oder Delirium (Grad 3 oder 4 bei 11 %).
Bei FL-Patienten traten diese bei 9 % der Patienten (1 % mit Grad 3 oder 4) innerhalb von 8 Wochen nach der Kymriah-Infusion auf.
Zum klinischen Management neurologischer Toxizitäten siehe Warnhinweise und Vorsichtsmassnahmen.
Hypogammaglobulinämie
Hypogammaglobulinämie wurde bei 53 % der Patienten mit r/r ALL, bei 17 % der Patienten mit r/r DLBCL und bei 17 % der Patienten mit FL, die mit Kymriah behandelt wurden, gemeldet.
Bei Schwangeren, die Kymriah erhalten haben, kann es zu einer Hypogammaglobulinämie kommen. Bei Neugeborenen von Müttern, die mit Kymriah behandelt worden sind, sollten die Immunglobulinspiegel gemessen werden.
Immunogenität
In klinischen Studien wurde die humorale Immunogenität von Tisagenlecleucel bestimmt, indem das Serum vor und nach der Anwendung auf Antikörper hin untersucht wurde, die gegen den murinen CAR19 gerichtet (antimCAR19) sind. Die Mehrheit der Patienten zeigte vor der Anwendung ein positives Ergebnis hinsichtlich antimCAR19-Antikörper und zwar sowohl bei pädiatrischen und jungen erwachsenen ALL-Patienten (B2202 91,1 %), bei erwachsenen DLBCL-Patienten (C2201; 93,9 %) als auch bei erwachsenen FL-Patienten (E2202; 66,0 %).
Durch die Behandlung induzierte antimCAR19-Antikörper wurden bei 40,5 % der pädiatrischen und jungen erwachsenen ALL-Patienten, bei 8,7% der erwachsenen DLBCL-Patienten und bei 28,7 % der erwachsenen FL-Patienten nachgewiesen. Vorbestehende und durch die Behandlung induzierte antimCAR19-Antikörper hatten weder eine Auswirkung auf das klinische Ansprechen noch einen Einfluss auf die Expansion und Persistenz von Tisagenlecleucel. Es gibt keine Hinweise, dass das Vorhandensein vorbestehender und durch die Behandlung induzierter antimCAR19-Antikörper die Sicherheit oder Wirksamkeit von Kymriah beeinflusst.
Eine T-Zell-Immunantwort wurde bei pädiatrischen und jungen erwachsenen Patienten mit B-Zell-ALL, erwachsenen Patienten mit r/r DLBCL und erwachsenen Patienten mit FL nicht beobachtet.
Pädiatrische Population – Non-Hodgkin-Lymphom
33 pädiatrische Patienten mit rezidiviertem oder refraktärem, B-Zell-Non-Hodgkin-Lymphom (NHL) wurden in einer Phase II-Studie mit Tisagenlecleucel (C2202, BIANCA) behandelt. Die allgemeine Erfahrung bezüglich der Sicherheit bei pädiatrischen und jungen erwachsenen Patienten mit CD19+ r/r reifem B-Zell-NHL stimmte mit dem bekannten Sicherheitsprofil von Tisagenlecleucel überein.
Unerwünschte Arzneimittelwirkungen aus Spontanmeldungen und Literaturberichten (Häufigkeit nicht bekannt)
Die folgenden unerwünschten Wirkungen stammen aus Erfahrungen mit Kymriah nach der Marktzulassung, und zwar aus Spontanmeldungen, aus Literaturberichten, aus erweiterten Zugangsprogrammen und aus klinischen Studien, ausgenommen den weltweiten Zulassungsstudien. Da diese Ereignisse freiwilligen Meldungen aus einer Population unbestimmter Grösse entstammen, ist es nicht immer möglich, ihre Häufigkeit zuverlässig zu schätzen oder einen Kausalzusammenhang mit der Exposition gegenüber von Tisagenlecleucel herzustellen.
Häufigkeit nicht bekannt: anaphylaktische Reaktion/infusionsbedingte Reaktion, Neurotoxizität, sekundäre Malignome, die von T-Zellen ausgehen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungNicht zutreffend.
Eigenschaften/WirkungenATC-Code
L01XL04
Wirkungsmechanismus
Tisagenlecleucel ist eine autologe Immunzell-Krebstherapie, bei der patienteneigene T-Zellen mit einem Transgen, das einen chimären Antigenrezeptor (chimeric antigen receptor, CAR) kodiert, umprogrammiert werden, um CD19-exprimierende Zellen zu erkennen und zu zerstören. Der CAR besteht aus einem murinen Single-Chain-Antikörperfragment, das CD19 erkennt und mit intrazellulären Signaldomänen von 4-1BB (CD137) und CD3-Zeta fusioniert ist. Die CD3-Zeta-Komponente ist entscheidend für die Initiierung der T-Zell-Aktivierung und der Antitumor-Aktivität, während 4-1BB die Expansion und Persistenz von Kymriah verstärkt. Nach der Bindung an CD19-exprimierende Zellen überträgt der CAR ein Signal, um die Expansion der T-Zellen, die Zerstörung der Zielzellen und die Persistenz von Kymriah zu fördern.
Pharmakodynamik
Kardiale Elektrophysiologie
Kymriah ist ein Produkt auf Zellbasis und es wird nicht erwartet, dass es das QT-Intervall verlängert; daher wurde keine formale QT-Studie durchgeführt.
Klinische Wirksamkeit
Akute lymphatische Leukämie (ALL)
Die Sicherheit und Wirksamkeit der Kymriah-Behandlung bei pädiatrischen und jungen erwachsenen Patienten mit rezidivierter und refraktärer (r/r) B-Zell-ALL wurden in drei offenen, einarmigen Studien (total 205 Patienten infundiert) untersucht. Bei allen Patienten wurden Leukaphereseprodukte vor oder während dem Studieneintritt entnommen und kryokonserviert.
CCTL019B2202
Bei der zulassungsrelevanten Studie (B2202) handelt es sich um eine multizentrische, einarmige Phase-II-Studie mit pädiatrischen und jungen erwachsenen Patienten mit r/r B-Zell akuter lymphatischer Leukämie, die chemorefraktär, nach allogener SCT oder nach zwei oder mehr Therapielinien im Knochenmark rezidiviert ist oder für die allogene SCT keine Behandlungsmöglichkeit darstellt.
Patienten mit den folgenden genetischen Syndromen mit angeborenen Störungen der Blutbildung (bone-marrow failure) wurden aus der Studie ausgeschlossen:
Fanconi-Anämie, Kostmann-Syndrom, Shwachman-Syndrom oder andere Blutbildungsstörungen; Patienten mit Down Syndrom wurden in die Studie eingeschlossen. Patienten mit Burkitt's Lymphoma/Leukämie waren nicht zulässig (z.B. Patienten mit differenziertr B-Zell ALL, Leukämie mit B-Zell [sIg positiv und Kappa oder Lambda begrenzter Positivität] ALL, mit FAB L3 Morphologie und/oder einer MYC Translokation).
Von den 97 Patienten, die in die Hauptkohorte aufgenommen wurden, erhielten 79 Kymriah, 18 Patienten (19 %) beendeten die Studie vor der Kymriah-Infusion (7 Patienten verstarben, 8 Patienten konnten aufgrund von Problemen im Zusammenhang mit der Kymriah-Herstellung keine Infusion bekommen, 3 Patienten aufgrund von unerwünschten Ereignissen).
Die infundierten Patienten waren zwischen 3 und 24 Jahre alt mit einem medianen Alter von 11 Jahren und 8 % hatten eine primäre refraktäre Erkrankung. 61 Prozent der Patienten hatten zuvor eine Stammzelltransplantation erhalten. Das mediane Alter aller in der Studie eingeschlossenen Patienten war 11 Jahre mit einer Altersspanne von 3 bis 27 Jahren; 8% hatten eine primär refraktäre Erkrankung. 61 % der eingeschlossenen Patienten erhielten zuvor eine SCT. Die Mehrheit der Patienten (69/79, 87 %) erhielt eine Überbrückungstherapie, während sie auf Kymriah warteten. Insgesamt 76 von 79 mit Kymriah infundierten Patienten erhielten nach der Aufnahme in die Studie und vor der Kymriah-Infusion eine lymphodepletierende Chemotherapie.
77 % der Patienten wurden zur Infusion ins Spital eingewiesen mit einer medianen Entlassung am Tag 21; von diesen verblieben 68 % für mindestens 10 Tage nach Infusion im Spital. Von den 23% der Patienten, welche ursprünglich für die Infusion nicht hospitalisiert wurden, wurden 83 % zu einem späteren Zeitpunkt ins Spital eingewiesen.
Die Wirksamkeit von Kymriah wurde durch den primären Endpunkt der Gesamtremissionsrate (overall remission rate, ORR), welche das beste Gesamtansprechen als komplette Remission (complete remission, CR) oder komplette Remission mit unvollständiger hämatologischer Wiederherstellung (CRi) umfasste, innerhalb von 3 Monaten nach der Infusion durch ein Independent Review Committee untersucht. Die Wirksamkeit wurde weiter ermittelt durch die Dauer der Remission (duration of remission, DOR) und den Anteil der Patienten, die CR oder CRi mit minimaler Resterkrankung (minimal residual disease, MRD) < 0,01 % (beurteilt durch die Durchflusszytometrie (MRD-negativ)) erreicht haben. Die mediane Zeit von der Kymriah-Infusion bis zu LPLV (17. November 2022) betrug 79,4 Monate (Bereich: 59,7 bis 90,3). Die Ergebnisse zur Wirksamkeit aus dieser Studie sind in Tabelle 1 dargestellt.
Die ORR war über alle Untergruppen hinweg konsistent. Acht Patienten, denen eine Kymriah-Infusion verabreicht wurde, erhielten eine Transplantation, während sie sich in Remission befanden.
Tabelle 1 Studie B2202: Ergebnisse zur Wirksamkeit bei pädiatrischen und jungen erwachsenen Patienten mit rezidivierter/refraktärer akuter lymphatischer B-Zell-Leukämie (ALL)
|
Primärer Endpunkt
|
Eingeschlossene Patienten
N = 97
|
Infundierte Patienten
N = 79
| |
Gesamtremissionsrate (ORR)1,2, n (%)
95 %-KI
|
65 (67,0)
(56,7; 76,2)
p < 0,0001
|
65 (82,3)
(72,1; 90,0)
p < 0,0001
| |
CR3, n (%)
|
49 (50,5)
|
49 (62,0)
| |
CRi4, n (%)
|
16 (16,5)
|
16 (20,3)
| |
Wichtigster sekundärer Endpunkt
|
N = 97
|
N = 79
| |
CR oder CRi mit MRD-negativem Knochenmark5,6, n (%)
95 %-KI
|
64 (66,0)
(55,7; 75,3)
p < 0.0001
|
64 (81,0)
(70,6; 89,0)
p < 0,0001
| |
Dauer der Remission (DOR)7
|
N = 66
|
N = 66
| |
% Wahrscheinlichkeit, nach 12 Monaten ereignisfrei zu sein (95 %-KI)
|
67,4 (53,2; 78,1)
|
67,4 (53,2; 78,1)
| |
% Wahrscheinlichkeit, nach 24 Monaten ereignisfrei zu sein (95 %-KI)
|
58,4 (43,7; 70,5)
|
58,4 (43,7; 70,5)
| |
% Wahrscheinlichkeit, nach 36 Monaten ereignisfrei zu sein (95 %-KI)
|
53,9 (39,2; 66,5)
|
53,9 (39,2; 66,5)
| |
% Wahrscheinlichkeit, nach 54 Monaten ereignisfrei zu sein (95 %-KI)
|
49,2 (34,6; 62,3)
|
49,2 (34,6; 62,3)
| |
Median (Monate) (95 %-KI)
|
46,8 (17,8; n.b.9)
|
46,8 (17,8; n.b.)
| |
Weitere sekundäre Endpunkte
|
N = 97
|
N = 79
| |
Ereignisfreies Überleben (EFS)8
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
n.a.11
|
57,2 (44,5; 68,0)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
n.a.11
|
49,6 (36,7; 61,2)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
n.a.11
|
45,8 (33,0; 57,6)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
n.a.11
|
41,8 (29,1; 53,9)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
n.a.11
|
41,8 (29,1; 53,9)
| |
Median (Monate) (95 %-KI)
|
n.a.11
|
23,7 (9,2; n.b.10)
| |
Gesamtüberleben (overall survival, OS)9
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
69,5 (59,2; 77,7)
|
77,1 (66,1; 84,9)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
57,6 (46,9; 66,8)
|
67,8 (56,1; 77,0)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
52,8 (42,1; 62,4)
|
63,5 (51,6; 73,2)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
49,0 (38,4; 58,9)
|
59,0 (46,9; 69,2)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
46,3 (35,7; 56,3)
|
55,7 (43,6; 66,3)
| |
Median (Monate) (95 %-KI)
|
49,9 (19,4; n.b.)
|
Nicht erreicht (45,6; n.b.)
| |
Die Wirksamkeitsendpunkte wurden auf der Grundlage der in die Hauptkohorte aufgenommenen Patienten analysiert.
1 Remissionsstatus muss mindestens 28 Tage erhalten bleiben, ohne klinischen Hinweis auf ein Rezidiv.
2 Nominal einseitiger exakter p-Wert auf Grundlage von H0: ORR ≤20 % vs. Ha: ORR > 20 %
3 CR (komplette Remission) war definiert als: < 5 % Blasten im Knochenmark, zirkulierende Blasten im Blut sollten < 1 % sein, kein Hinweis auf extramedulläre Erkrankung und vollständige Wiederherstellung des peripheren Blutbildes (Thrombozyten > 100.000/µl und absolute Neutrophilenzahl [absolute neutrophil counts, ANC] > 1.000/µl) ohne Bluttransfusion.
4 CRi (komplette Remission mit unvollständiger Wiederherstellung des Blutbildes) war definiert als: < 5 % Blasten im Knochenmark, zirkulierende Blasten im Blut sollten < 1 % sein, kein Hinweis auf extramedulläre Erkrankung und keine vollständige Wiederherstellung des peripheren Blutbildes mit oder ohne Bluttransfusion.
5 MRD(minimale Resterkrankung)negativ war definiert als MRD < 0,01 % (durch Durchflusszytometrie ermittelt).
6 Nominal einseitiger exakter p-Wert auf Grundlage von H0: Rate der MRDnegativen Remission ≤15 % vs. Ha: > 15 %.
7 DOR war definiert als der Zeitraum vom Einsetzen der CR oder CRi bis zum Rezidiv oder Tod aufgrund der zugrundeliegenden Erkrankung, je nachdem, was zuerst eintrat (N = 66). Ein Patient erreichte nach Monat 3 eine Remission.
8 EFS war definiert als die Zeit zwischen der Infusion von Kymriah bis zu dem frühesten Eintreten eines der folgenden Events: Tod jeglicher Ursache für infundierte Patienten nach Erreichen einer Remission, Verlust der Remission oder fehlendes Ansprechen auf die Behandlung.
9 OS war definiert als die Zeit zwischen der Infusion von Kymriah bis zum Tod jeglicher Ursache für infundierte Patienten und als die Zeit zwischen Einschluss in die Studie bis zum Tod jeglicher Ursache für eingeschlossene Patienten. Von den 79 infundierten Patienten in der Hauptkohorte wurden 46 Patienten (58,2 %) für das OS zensiert, von denen 31 Patienten (39,2 %) die Nachbeobachtung der Studie abschlossen und die übrigen 15 Patienten (19,0 %) die Nachbeobachtung der Studie abbrachen. Zu den Abbruchgründen gehörten: Entscheidung des Probanden/Vormunds/Arztes (N = 5), mangelnde Wirksamkeit einschliesslich fehlender Remission oder Rückfall nach Remission (N = 2), neue Therapie für die Studienindikation während der Remission (N = 7) und «Lost to follow-up» (N = 1).
10 Nicht bestimmbar
11 Nicht anwendbar
|
Besondere Patientengruppen
Es wurden keine Unterschiede hinsichtlich Wirksamkeit oder Sicherheit zwischen verschiedenen Altersgruppen beobachtet.
Leukämiepatienten mit aktiver Beteiligung des zentralen Nervensystems (ZNS)
Es gibt nur begrenzte Erfahrungen mit Kymriah bei Patienten mit aktiver ZNS-Leukämie und aktivem ZNS-Lymphom. Daher wurden in dieser Population Risiko und Nutzen von Kymriah nicht untersucht.
Diffuses grosszelliges B-Zell-Lymphom (DLBCL)
Die Sicherheit und Wirksamkeit der Kymriah-Behandlung bei erwachsenen Patienten mit rezidiviertem und refraktärem (r/r) diffus grosszelligem B-Zell-Lymphom (DLBCL) wurden in einer offenen, einarmigen zulassungsrelevanten Studie untersucht. 167 Patienten wurden in die Studie aufgenommen, davon erhielten 115 Patienten die Infusion (99 Patienten in der Hauptkohorte und 16 Patienten in der Kohorte A).
CCTL019C2201
Bei der zulassungsrelevanten Studie (C2201) handelt es sich um eine multizentrische, einarmige Phase-II-Studie mit erwachsenen Patienten mit rezidiviertem oder refraktärem DLBCL, die ≥2 Chemotherapielinien, einschliesslich Rituximab und Anthrazyklin, erhalten haben oder nach einer autologen hämatopoetischen Stammzelltransplantation (autologous haematopoietic stem cell transplantation, HSCT) rezidiviert sind. Patienten mit aktivem ZNS Lymphom (active CNS involvement by malignancy) wurden von der Studie C2201 ausgeschlossen wie auch Patienten mit T-Zell-reichem/Histiozyten-reichem, grosszelligem B-Zell-Lymphom (THRBCL), primär kutanem grosszelligem B-Zell-Lymphom, primär mediastinalem B-Zell-Lymphom (PMBCL), EBV-positivem DLBCL bei älteren Patienten, Richter-Transformation und Burkitt-Lymphom. Von 167 in die Studie aufgenommenen Patienten erhielten 115 eine Infusion mit Kymriah. Ca. 31 % der Patienten brachen die Studie vor der Gabe von Kymriah ab. 13 (8 %) Patienten erhielten aufgrund von Herstellungsfehlern kein Kymriah. Weitere Gründe für den Abbruch vor der Kymriah-Infusion: Tod (n=16; 10 %), Entscheidung des Arztes/Fortschreiten der Grunderkrankung (n=16, 10 %), Entscheidung des Patienten (n=2; 1 %), unerwünschte Ereignisse (n=4; 2 %) und Abweichung vom Prüfplan (n=1, 1 %) während sie auf die Herstellung von Kymriah im Rahmen der klinischen Studie warteten.
Das mediane Alter der infundierten Patienten betrug 56 Jahre (Bereich: 22 bis 76 Jahre), 77 % der Patienten hatten eine Erkrankung im Stadium III/IV bei Studieneintritt, 51 % hatten bereits 3 oder mehr Behandlungslinien für DLBCL erhalten. 49 Prozent der Patienten hatten zuvor eine Stammzelltransplantation erhalten. 55 Prozent der Patienten waren refraktär gegenüber der letzten Behandlungslinie. Das mediane Alter aller in der Studie eingeschlossenen Patienten war 58 Jahre (Altersspanne 22 bis 76 Jahre). 78% der Patienten hatten ein Stadium III/IV bei Studieneintritt der Erkrankung, 53% erhielten zuvor 3 oder mehr Behandlungslinien. 44% der Patienten erhielten zuvor eine SCT. 59% waren refraktär gegenüber der letzten Behandlungslinie.
Bei allen Patienten (n=167, d.h. alle Patienten, die in die Studie aufgenommen wurden) wurde Leukapheresematerial vor oder während Studieneintritt entnommen und kryokonserviert. Die Mehrheit der infundierten Patienten (103 von 115, 90 %) erhielt eine Überbrückungstherapie, während sie auf Kymriah warteten, und 107 von 115 Patienten (93 %) erhielten eine lymphodepletierende Chemotherapie. Kymriah wurde als intravenös infundierte Einzeldosis in einem qualifizierten Kymriah-Behandlungszentrum stationär und ambulant verabreicht. Die zugelassene Dosierspanne in der Studie reichte von 1.0-5.0×108 CAR-positive, lebensfähige T-Zellen.
88 % der Patienten wurden zur Infusion ins Spital eingewiesen mit einer medianen Entlassung am Tag 15; von diesen verblieben 60 % für mindestens 10 Tage nach Infusion im Spital. Von den 12 % der Patienten, welche ursprünglich für die Infusion nicht hospitalisiert wurden, wurden 50 % zu einem späteren Zeitpunkt ins Spital eingewiesen.
Die Wirksamkeit von Kymriah wurde anhand des primären Endpunkts, d.h. der besten Gesamtansprechrate (ORR), die vollständiges Ansprechen (CR) und partielles Ansprechen (PR) gemäss IRC-Bewertung basierend auf der Lugano-Klassifikation (Cheson et al. 2014) umfasst, sowie der sekundären Endpunkte einschliesslich der Dauer des Ansprechens (DOR) bewertet (Tabelle 2). Der primäre Endpunkt wurde bei 99 weltweit behandelten Patienten ermittelt, die Kymriah erhielten, das im Novartis-Werk in den USA hergestellt wurde, und die mindestens drei Monate lang beobachtet bzw. früher nach der Kymriah-Verabreichung die Studie abgebrochen hatten. Die mediane Zeit von der Kymriah-Infusion bis zu LPLV für infundierte Patienten der Hauptkohorte betrug 75,1 Monate (Bereich: 58,1 bis 86.6).
Unter den 99 Patienten, die in die primäre Endpunktanalyse eingeschlossen waren, war die beste ORR 54,5 % (54/99) mit einem 95%-Konfidenzintervall (KI) von (44,2 %, 64,6%). 41 Patienten (41,4 %) erzielten ein CR und 13 (13,1 %) ein PR. Von den 41 Patienten, die ein vollständiges Ansprechen (CR) erreichten, zeigten 16 Patienten zunächst ein Gesamtansprechen in Form eines partiellen Ansprechens (PR), das sich im Laufe der Zeit zu einem CR verbesserte, wobei die meisten Patienten (13/16) innerhalb von 6 Monaten nach der Infusion von Tisagenlecleucel eine Konversion vom PR zum CR erreichten. Die ORR war innerhalb verschiedener demographischer und prognostischen Subgruppen hauptsächlich konsistent, ausser bei den 14 Patienten unter 40 Jahre, bei welchen nur einer ein CR und einer ein PR hatte. Da die Fallzahl der Patienten unter 40 Jahren klein war, kann man nur limitierte Rückschlüsse auf die Wirksamkeit in dieser Patientengruppe ziehen.
Keiner der Patienten, die eine Kymriah-Infusion erhalten hatten, erhielt nach Erreichen des CR oder PR eine Transplantation.
Tabelle 2 Studie C2201: Ergebnisse zur Wirksamkeit bei erwachsenen Patienten mit rezidiviertem oder refraktärem diffus grosszelligen B-Zell-Lymphom (DLBCL) nach zwei oder mehr Linien einer systemischen Therapie
|
|
Eingeschlossene Patienten N=167
|
Infundierte Patienten
N=115
| |
Primärer Endpunkt1
|
N = 147
|
N = 99
| |
Gesamtansprechrate (ORR) (CR+PR)2, n (%)
95 %-KI
|
54 (36,7)
(28,9; 45,1)
|
54 (54,5)
(44,2; 64,6)
| |
CR, n (%)
|
41 (27,9)
|
41 (41,4)
| |
PR, n (%)
|
13 (8,8)
|
13 (13,1)
| |
Ansprechen in Monat 3
|
N = 147
|
N = 99
| |
ORR (%)
|
40 (27,2)
|
40 (40,4)
| |
CR (%)
|
34 (23,1)
|
34 (34,3)
| |
Ansprechen in Monat 6
|
N = 147
|
N = 99
| |
ORR (%)
|
34 (23,1)
|
34 (34,3)
| |
CR (%)
|
31 (21,1)
|
31 (31,3)
| |
Ansprechdauer (DOR)3
|
N = 54
|
N = 54
| |
Median (Monate) (95 %-KI)
|
Nicht erreicht (10,0; n.b.6)
|
Nicht erreicht (10,0; n.b.6)
| |
% Wahrscheinlichkeit, nach 12 Monaten rezidivfrei zu sein (95 %-KI)
|
63,4 (48,2; 75,2)
|
63,4 (48,2; 75,2)
| |
% Wahrscheinlichkeit, nach 24 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% Wahrscheinlichkeit, nach 36 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% Wahrscheinlichkeit, nach 48 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% Wahrscheinlichkeit, nach 54 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
Weitere sekundäre Endpunkte
|
N = 167
|
N = 115
| |
Ereignisfreies Überleben (EFS) 4
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
n.a.7
|
29,2 (21,1, 37,7)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
n.a.7
|
24,6 (17,1; 32,9)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
n.a.7
|
23,7 (16,3; 31,9)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
n.a.7
|
23,7 (16,3; 31,9)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
n.a.7
|
20,3 (13,3; 28,4)
| |
Median (Monate) (95 %-KI)
|
n.a.7
|
2,8 (2,1;3,1)
| |
Gesamtüberleben (OS)5
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
41,0 (32,9; 48,9)
|
48,2 (38,6; 57,1)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
33,3 (25,6; 41,2)
|
40,5 (31,2; 49,5)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
29,4 (22,1; 37,2)
|
36,6 (27,6, 45,6)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
27,9 (20,7; 35,6)
|
34,7 (25,9; 43,7)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
25,5 (18,5; 33,1)
|
31,7 (23,1; 40,6)
| |
Median (Monate) (95 %-KI)
|
8,2 (5,8; 11,7)
|
11,1 (6,6; 23,9)
| |
1
Der primäre Endpunkt wurde für alle Patienten analysiert, deren Kymriah im US-amerikanischen Werk von Novartis hergestellt wurde.
2 ORR ist der Anteil der Patienten, die als bestes Gesamtansprechen (best overall response, BOR) eine CR oder PR auf der Grundlage der Lugano-Klassifikation (Cheson et al. 2014) erreichten. Patienten, die nicht infundiert wurden, wurde ein BOR = unbekannt (d.h. Nicht-Responder) zugeordnet.
3 DOR war definiert als der Zeitraum vom Erreichen des CR oder PR, je nachdem, was zuerst eintrat, bis zum Rezidiv oder Tod aufgrund des DLBCL.
4 EFS war definiert als die Zeit zwischen der Infusion von Kymriah bis zu dem frühesten Eintreten eines der folgenden Events: Tod jeglicher Ursache für infundierte Patienten nach Erreichen eines Ansprechens, Verlust eines Ansprechens oder Fortschreiten der Krankheit oder neue Behandlung der Krankheit mit Ausnahme einer SCT.
5 OS war definiert als der Zeitraum zwischen der Infusion von Kymriah und dem Tod jeglicher Ursache (N = 115) und als der Zeitraum zwischen Einschluss in die Studie und dem Tod jeglicher Ursache für eingeschlossene Patienten (N = 165). Von den 115 infundierten Patienten wurden 39 Patienten (33,9 %) für das OS zensiert, darunter 28 Patienten (24,3 %), die die Nachbeobachtung der Studie abschlossen, und die übrigen 11 Patienten (9,6 %), die die Nachbeobachtung der Studie abbrachen. Zu den Abbruchgründen gehörten: Entscheidung des Patienten/Arztes (N = 5), Fortschreiten der Krankheit (N = 5) und Abbruch der Nachbeobachtung (N = 1).
6 Nicht bestimmbar.
7 Nicht anwendbar
|
Pädiatrie
Bei 34 Patienten mit rezidiviertem oder refraktärem, B-Zell-Non-Hodgkin-Lymphom (NHL) bei Kindern und jungen Erwachsenen wurde eine Phase II-Studie mit Tisagenlecleucel (C2202, BIANCA) durchgeführt. Von den 33 Patienten, die mit Kymriah infundiert wurden, hatten 28 Patienten (24 Patienten im Alter von 3-17 Jahren und 4 Patienten im Alter von 20-22 Jahren) vor der Infusion eine messbare Krankheit gehabt und wurden in das Wirksamkeitsanalysen-Set (efficacy analysis set, EAS) eingeschlossen. Das Wirksamkeitsanalysen-Set umfasste das Burkitt-Lymphom (n=15), das diffuse grosszellige B-Zell-Lymphom (n=8), das primäre mediastinale B-Zell-Lymphom (n=3), das Grauzonen-Lymphom (n=1) und das hochmaligne Lymphom mit MYC- und BCL2-Rearrangements (n=1). Bei diesen Patienten betrug das mediane Alter 14,0 Jahre (Spanne: 3 bis 22 Jahre), 9 (32,1 %) waren weiblich, 19 (67,9 %) waren männlich. Der Median der Anzahl der vorangegangenen Therapielinien lag bei 1 (Spanne: 1-3), bei 17,9 % der Patienten war zuvor eine (1) hämatopoetische Stammzelltransplantation durchgeführt worden. 96.4% der infundierten Patienten hatte in der Wartezeit vor der Behandlung mit Kymriah eine überbrückende Chemotherapie erhalten. Die Patienten erhielten die zugelassene Tisagenlecleucel-Dosis für die Indikation ALL.
Die Ergebnisse des Wirksamkeitsanalysen-Sets (n=28) zeigten eine ORR von 32,1 % (95 % KI: 15,9; 52,4) mit einer CR von 7,1 %. Die Subgruppenanalyse wies auf eine niedrigere ORR bei Patienten mit Burkitt-Lymphom (20 %, 95 % KI: 4,3; 48,1) im Vergleich zu Patienten mit diffusem grosszelligem B-Zell-Lymphom (37,5 %, 95 % KI: 8,5; 75,5) oder anderen Diagnosen welche in der Studie eingeschlossen waren (60,0 %, 95 % KI: 14,7; 94,7) hin. Da die Daten zur Behandlung pädiatrischer Patienten mit r/r B-Zell-Non-Hodgkin-Lymphom auf 33 Patienten beschränkt sind, lassen sich keine endgültigen Schlussfolgerungen zur Wirksamkeit in dieser Patientengruppe ziehen. Die verfügbaren limitierten Daten geben keine Hinweise für einen Nutzen bei der untersuchten Population.
Follikuläres Lymphom (FL)
Die Sicherheit und Wirksamkeit der Kymriah-Behandlung bei erwachsenen Patienten mit rezidiviertem oder refraktärem (r/r) follikulärem Lymphom (FL) wurden in einer einarmigen, multizentrischen Open-Label-Studie der Phase II untersucht.
CCTL019E2202
Bei der Zulassungsstudie E2202 (ELARA-Studie) handelt es sich um eine multizentrische, einarmige offene Phase-II-Studie bei erwachsenen Patienten mit r/r FL. Die Studie bezieht Patienten ein, die auf eine zweite oder spätere systemische Therapie (einschliesslich eines Anti-CD20-Antikörpers und eines Alkylierungsmittels) refraktär waren oder innerhalb von sechs Monaten nach Abschluss einer Anti-CD20-Antikörper-Erhaltungstherapie nach mindestens zwei Therapielinien einen Rückfall erlitten oder nach einer autologen hämatopoetischen Stammzelltransplantation (HSCT) einen Rückfall erlitten. Die eingeschlossenen Patienten erhielten im Median 4 (Spanne 2-13) vorherige Therapielinen. 75.5 % (74) der Patienten erhielten ≥3 vorherige Therapielinen. Von der Studie ausgeschlossen waren Patienten mit aktiven oder schweren Infektionen, transformierten Lymphomen oder anderen aggressiven Lymphomen, früherer allogener HSCT oder Erkrankungen mit aktiver Beteiligung des ZNS.
Von 98 Patienten, die an der Studie teilnahmen und sich einer Leukapherese unterzogen, erhielten 97 Patienten eine Infusion mit Kymriah. Ein Patient erreichte vor der Infusion ein vollständiges Ansprechen, das auf seine vorherige Therapielinie zurückgeführt wurde, und wurde anschliessend aufgrund einer ärztlichen Entscheidung vor der Infusion aus der Studie genommen. Von den 97 Patienten, denen Kymriah infundiert wurde, wiesen 94 Patienten zu Studienbeginn eine messbare Erkrankung auf und wurden in die Wirksamkeitsanalyse (Efficacy Analysis Set [EAS]) aufgenommen. Kymriah wurde an alle eingeschlossenen Patienten verabreicht.
Von den 94 Patienten in der Wirksamkeitspopulation wiesen folgende wichtige klinische Merkmale auf: Das Durchschnittsalter lag bei 57 Jahren (Spanne von 29 bis 73 Jahren), 86 % der Patienten waren bei Studienbeginn im Stadium III-IV erkrankt, 61 % hatten einen hohen FLIPI-Score, 65 % wiesen bei Studienbeginn eine ausgedehnte Erkrankung auf, 79 % waren refraktär gegenüber der letzten Behandlungslinie, 69 % waren doppelt refraktär, 37 % hatten zuvor eine autologe Stammzelltransplantation erhalten und bei 65 % war die Erkrankung innerhalb von 24 Monaten (POD24) nach Beginn der ersten Anti-CD20-Kombinationstherapie fortgeschritten. 44 Patienten (47 %) erhielten eine Überbrückungstherapie zwischen der Leukapherese und der Verabreichung von Kymriah, und alle Patienten erhielten eine lymphdepletierende Chemotherapie. Bei allen Patienten, die eine Infusion erhielten, wurde Kymriah als intravenöse Einzeldosis-Infusion stationär oder ambulant (18 %) verabreicht.
Die Wirksamkeit wurde anhand des primären Endpunkts der vollständigen Ansprechrate (CRR), die durch eine IRC auf der Grundlage der Lugano-Klassifikation (Cheson et al. 2014) bestimmt wurde, sowie anhand der sekundären Endpunkte der Gesamtansprechrate (ORR), der Dauer des Ansprechens (DOR) und des progressionsfreien Überlebens (PFS) gemäss IRC sowie des Gesamtüberlebens (OS) bewertet. Die erste Krankheitsbeurteilung sollte im Monat 3 nach der Infusion durchgeführt werden.
Von den 94 Patienten mit messbarer Erkrankung vor der Infusion, die in die Wirksamkeitsanalyse einbezogen wurden, mit einer medianen Nachbeobachtungszeit von 29 Monaten, wurde bei 64 Patienten (68 %, 95 %-KI: 57,7; 77,3) eine CR beobachtet; 17 (18 %) erreichten eine PR. Die ORR nach IRC-Bewertung betrug 86 % (81 Patienten) (95 %-KI: 77,5; 92,4). Alle Responder erreichten das Ansprechen (CR oder PR) bei der ersten nach der Infusion durchgeführten Krankheitsbeurteilung. Von den 65 Patienten, die ein CR erreichten, hatten 14 Patienten zunächst ein PR. Bei der Mehrheit der Patienten konnte innerhalb von 6 Monaten nach der Infusion eine CR festgestellt werden. Kein Patient, der eine Kymriah-Infusion erhielt, musste transplantiert werden, während er auf die Therapie ansprach (CR oder PR).
Die Wahrscheinlichkeit, dass ein Patient ein dauerhaftes Ansprechen (DOR) von ≥9 Monate hat, betrug 77 % (95 %-KI: 65,4; 84,6), während die Wahrscheinlichkeit, dass ein Patient, der ein CR erreicht hat, ein dauerhaftes Ansprechen von ≥9 Monate hat, 89 % (95 %-KI: 77,6; 94,4) betrug. Die Wahrscheinlichkeit eines progressionsfreien Überlebens (PFS) nach 12 Monaten betrug 67 % (95 %-KI: 56,3: 75,9), während die Wahrscheinlichkeit des Überlebens (OS) nach 12 Monaten 95 % (95 %-KI: 88,1; 98,2) betrug.
Tabelle 3 Studie E2202: Ergebnisse zur Wirksamkeit bei erwachsenen Patienten mit rezidivierter/refraktärer FL
|
|
Wirksamkeitspopulation
N=94
| |
Vollständige Ansprechrate (CRR), n (%)
95 %-KI
|
64 (68,1)
(57,7; 77,3)
| |
Gesamtansprechrate (ORR), n (%)
95 %-KI
|
81 (86,2)
(77,5; 92,4)
| |
Ansprechdauer (DOR), Monate
|
| |
Median (95 %-KI)
% Wahrscheinlichkeit nach 9 Monaten rezidivfrei zu sein, (95 %-KI)
|
Nicht erreicht (15,6, NE*)
76,6 (65,4; 84,6)
| |
DOR bei Patienten, die eine BOR von CR erreichen, Monate
Median (95 % KI)
% Wahrscheinlichkeit nach 9 Monaten rezidivfrei zu sein, (95 %-KI)
|
Nicht erreicht (NE, NE)
88.6 (77,6; 94,4)
| |
Fortschrittsfreies Überleben (PFS), Monate
|
| |
Median (95 %-KI)
PFS nach 12 Monaten % (95 %-KI)
|
Nicht erreicht (18,2; NE)
67.2 (56,3; 75,9)
| |
Gesamtüberleben (OS), Monate
|
| |
Median (95 %-KI)
OS nach 12 Monaten, % (95 %-KI)
|
Nicht erreicht
95.3 (88,1; 98,2)
| |
*NE: Nicht abschätzbar
|
|
Abbildung 1 Kaplan-Meier-Diagramm der Ansprechdauer (DOR) nach IRC-Bewertung (Efficacy Analysis Set [EAS])
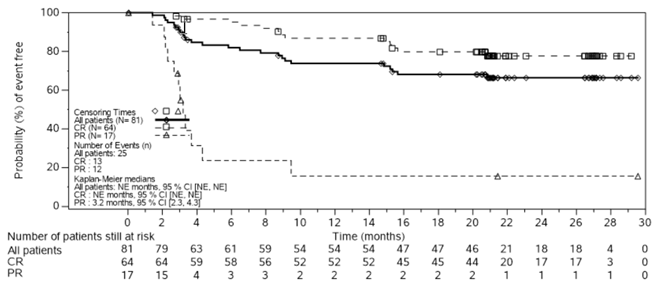
- Die Zeit ist relativ zum Beginn des Ansprechens, 1 Monat = 30,4375 Tage.
Abbildung 2 Kaplan-Meier-Diagramm des progressionsfreien Überlebens (PFS) nach IRC-Bewertung (EAS)
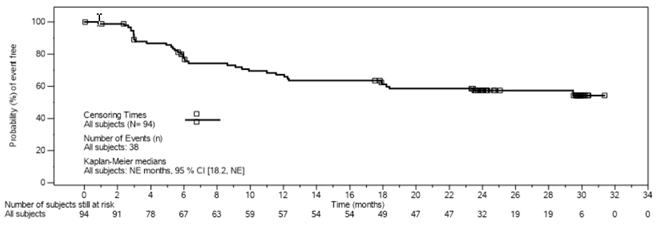
- Der Zeitpunkt ist relativ zur Tisagenlecleucel-Infusion, 1 Monat = 30,4375 Tage.
Experimentelle Indikation (Non-Hodgkin-Lymphom, NHL)
In einer experimentellen Indikation wurde eine Phase-III-Studie CCTL019H2301 (BELINDA) durchgeführt, an der 322 Patienten mit aggressivem NHL teilnahmen, die innerhalb von 365 Tagen nach ihrer letzten Dosis der Erstlinien-Immunchemotherapie refraktär waren oder ein Rezidiv erlitten hatten und für eine Stammzelltransplantation (SCT) in Frage kamen. Die Patienten wurden im Verhältnis 1:1 randomisiert und erhielten entweder eine Behandlung mit Tisagenlecleucel oder die Standardtherapie (SOC), definiert als platinbasierte Immunchemotherapie, gefolgt von einer Hochdosis-Chemotherapie (HDCT) und einer autologen hämatopoetischen Stammzelltransplantation (HSCT), wenn die Patienten auf die Behandlung angesprochen hatten.
Beim primären Endpunkt des ereignisfreien Überlebens (EFS) wurde zwischen Tisagenlecleucel und SOC kein statistisch signifikanter Unterschied beobachtet (stratifizierter Log-Rank-Test p = 0,69, einseitig). Nach einer medianen Nachbeobachtungszeit von 10 Monaten (Bereich: 2,9; 23,2) betrug das mediane EFS (95 %-KI) 3,0 Monate bei Tisagenlecleucel (95 %-KI: 2,9; 4,2) gegenüber 3,0 Monate bei SOC (95 %-KI: 3,0; 3,5). Für das OS wurde kein statistischer Test durchgeführt, da der primäre Endpunkt EFS statistisch nicht signifikant war. Das mediane OS betrug 16,9 Monate (95 %-KI: 11,1, NE) im Tisagenlecleucel-Arm gegenüber 15,3 Monaten (95 %-KI: 12,3, NE) im SOC-Arm. Einundachtzig (50,6 %) Patienten aus dem SOC-Arm wechselten die Behandlung und erhielten eine Infusion mit Tisagenlecleucel.
Im Rahmen der Studie wurden keine neuen Sicherheitssignale für Tisagenlecleucel beobachtet.
PharmakokinetikNach der Verabreichung von Kymriah bei pädiatrischen und jungen erwachsenen B-Zell-ALL-Patienten, r/r DLBCL-Patienten und r/r FL-Patienten zeigte Kymriah typischerweise anfänglich eine schnelle Expansion, gefolgt von einem langsameren bi-exponentiellen Rückgang. Eine hohe interindividuelle Variabilität war bei allen Indikationen mit den In-vivo-Expositionsmetriken (AUC0-28d und Cmax) verbunden.
Zelluläre Kinetik bei pädiatrischen B-Zell-ALL-Patienten
Die Parameter der zellulären Kinetik von Tisagenlecleucel sind in Tabelle 4 zusammengefasst.
Die maximale Expansion (Cmax) war bei CR/CRi-Patienten (n=114, basierend auf der Anzahl der Patienten mit auswertbaren Parametern) etwa 50,2 % höher als bei Non-Respondern (NR) (n=10), gemessen mittels quantitativer Echtzeit-PCR (qPCR). Eine verzögerte und geringere Expansion wurde bei Non-Respondern (N=12) im Vergleich zu Respondern (N=114) beobachtet.
Tabelle 4 Parameter für die zelluläre Kinetik von Tisagenlecleucel bei pädiatrischen und jungen erwachsenen r/r B-Zell-ALL-Patienten (B2202, B2205J)
|
Parameter
|
Zusammenfassende Statistik
|
Responder
N=114
|
Non-Responder
N=12
| |
Cmax (Kopien/μg)
|
Geometrischer Mittelwert (CV%), n
|
32'900 (173,8), 114
|
21'900 (80,7), 10
| |
Tmax (Tag)
|
Medianwert [min;max], n
|
9,85 [5,70; 54,8], 114
|
20,1 [12,6;62,7], 10
| |
AUC0–28d (Kopien/μg*Tag)
|
Geometrischer Mittelwert (CV%), n
|
286'000 (194,9), 114
|
232'000 (104,5), 8
| |
T½ (Tag)
|
Geometrischer Mittelwert (CV%), n
|
40,0 (436,8), 72
|
3,78 (222,0), 4
| |
Tlast (Tag)
|
Median [min; max], n
|
190 [17,8; 1'860], 114
|
28,8 [13,9; 888], 11
|
Zelluläre Kinetik bei DLBCL-Patienten
Eine Zusammenfassung der Parameter der zellulären Kinetik von Tisagenlecleucel bei DLBCL-Patienten finden Sie in Tabelle 5 unten.
Tabelle 5 Parameter für die zelluläre Kinetik von Tisagenlecleucel bei r/r DLBCL-Patienten.
|
Parameter
|
Zusammenfassende Statistik
|
Responder
(CR und PR)
N=44
|
Non-Responder
(SD/PD/Unbekannt)
N=71
| |
Cmax (Kopien/μg)
|
Geometrischer Mittelwert (CV%), n
|
6'070 (256.8), 44
|
5'000 (391.7), 67
| |
Tmax (Tag)
|
Medianwert [min;max], n
|
9.02 [5.78; 27.7], 44
|
8.84 [0.994; 26.7], 67
| |
AUC0–28d (Kopien/μg*Tag)
|
Geometrischer Mittelwert (CV%), n
|
63'000 (177.7), 43
|
52'300 (321.4), 62
| |
T½ (Tag)
|
Geometrischer Mittelwert (CV%), n
|
151 (487.5), 31
|
11.6 (196.2), 49
| |
Tlast (Tag)
|
Median [min; max], n
|
930 [17.1; 1 830], 44
|
41.9 [0.994; 1'480], 67
|
Zelluläre Kinetik bei FL-Patienten
Eine Zusammenfassung der zellulären kinetischen Parameter von Tisagenlecleucel bei FL-Patienten nach BOR findet sich in Tabelle 6 unten.
Der geometrische Mittelwert der AUC0-84d bei Respondern (CR und PR) war ähnlich wie bei Non-Respondern (SD und PD) basierend auf der klinischen BOR. Allerdings war der geometrische Mittelwert der AUC0-28d bei Respondern im Vergleich zu Non-Respondern um 186 % höher, während der geometrische Mittelwert der Cmax bei Respondern im Vergleich zu Non-Respondern um 109 % höher war. In Anbetracht der hohen interindividuellen Variabilität, der geringen Anzahl von Non-Respondern und der Überlappung der Expansionsbereiche zwischen Respondern und Non-Respondern sollten die Expositionsunterschiede jedoch mit Vorsicht interpretiert werden.
Tabelle 6 Parameter für die zelluläre Kinetik von Tisagenlecleucel bei Patienten mit rezidivierter/refraktärer FL
|
Parameter
|
Zusammenfassende Statistik
|
Ansprechende Patienten
(CR und PR)
N=81
|
Nicht-ansprechende Patienten
(SD/PD)
N=12
| |
Cmax (Kopien/ μg)
|
Geometrischer Mittelwert (CV%), n
|
6280 (331), 67
|
3000 (1190), 8
| |
Tmax (Tag)
|
Medianwert [min;max], n
|
9,92 [2,62, 28,0], 67
|
13,0 [7,73,16,0], 8
| |
AUC0-28d (Kopien/μg*Tag)
|
Geometrischer Mittelwert (CV%), n
|
57500 (261), 66
|
20100 (18100), 7
| |
T½ (Tag)
|
Geometrischer Mittelwert (CV%), n
|
43,8 (287), 43
|
24,4 (180), 6
| |
Tlast (Tag)
|
Median [min;max], n
|
191 [19,9, 558], 73
|
107 [18,7, 366], 10
|
Begleitende Therapie mit Tocilizumab und Kortikosteroiden
Bei Patienten, die mit Tocilizumab oder Kortikosteroiden zur Behandlung von CRS behandelt wurden, expandiert das Tisagenlecleucel-Transgen weiter und persistiert nach Verabreichung von Tocilizumab und Steroiden.
Absorption
Nicht zutreffend. Kymriah ist eine T-Zell-Immuntherapie und wird über eine intravenöse Infusion verabreicht.
Distribution
Bei pädiatrischen und jungen erwachsenen B-Zell-ALL-Patienten ist Kymriah nachweislich bis zu 5 Jahre bzw. 6 Monate lang im Blut und im Knochenmark vorhanden. Die Verteilung von Kymriah vom Blut ins Knochenmark betrug 51 % der Menge, die am 28. Tag im Blut vorhanden war, während sie in den Monaten 3 und 6 jeweils 67 % betrug. Darüber hinaus ist Kymriah auch für pädiatrische und junge erwachsene B-Zell-ALL-Patienten (Studie B2101J) bis zu einem Jahr lang im Liquor aktiv.
Bei DLBCL-Patienten (Studie C2201) wurde Kymriah bei Patienten mit vollständigem Ansprechen bis zu fünf Jahren im peripheren Blut und bis zu Monat 9 im Knochenmark nachgewiesen. Die Blut-Knochenmark-Verteilung von Kymriah betrug im Knochenmark fast 70 % der Menge, die an Tag 28 im Blut vorhanden war, und 50% bei Responder- und Non-Responder-Patienten in Monat 3.
Bei FL-Patienten (Studie E2202) wurde Kymriah bei Patienten mit vollständigem Ansprechen bis zu 18 Monate lang im peripheren Blut und bis zu Monat 3 im Knochenmark nachgewiesen. Die Blut-zu-Knochenmark-Verteilung im Knochenmark betrug 54 % in Monat 3 bei Respondern und Non-Respondern.
Metabolismus
Nicht zutreffend, Kymriah ist eine Immunzell-Therapie.
Elimination
Das Eliminationsprofil von Kymriah beinhaltet einen bi-exponentiellen Rückgang im peripheren Blut und Knochenmark.
Linearität/Nicht Linearität
Dosis und zelluläre kinetische Parameter sind unabhängig voneinander, sodass es keinen offensichtlichen Zusammenhang von AUC0–28d und Cmax mit der Dosis gibt.
Ältere Patienten (65 Jahre oder älter)
Die Streudiagramme, in denen die Parameter der zellulären Kinetik gegen das Alter (22 bis 76 Jahre in DLBCL-Patienten und 29 bis 73 Jahre in FL-Patienten) aufgetragen wurden, zeigten keinen relevanten Zusammenhang zwischen den Parametern der zellulären Kinetik (AUC0-28d und Cmax) und dem Alter.
Geschlecht
Das Geschlecht ist kein signifikantes Merkmal, das die Tisagenlecleucel-Expansion bei B-Zell-ALL-, DLBCL- und FL-Patienten beeinflusst.
Ethnische Gruppen
Die Mehrheit der mit Kymriah behandelten Patienten sind Kaukasier, daher gibt es nur begrenzte Belege dafür, dass die Ethnizität Auswirkungen auf die Expansion von Kymriah bei pädiatrischen und jungen erwachsenen ALL-, DLBCL- und FL-Patienten hat. In der Studie B2202 waren 73,4 % der Patienten Kaukasier, 12,7 % asiatischer Abstammung und 13,9 % Patienten anderer ethnischer Herkunft.
In Studie C2201 waren 85 % der Patienten Kaukasier, 9 % asiatischer Abstammung, 4 % schwarz bzw. afroamerikanischer Abstammung und 3 Patienten (3 %) unbekannter ethnischer Zugehörigkeit.
In der Studie E2202 waren 76 % der Patienten Kaukasier, 13 % asiatischer Abstammung, 1 % schwarz bzw. afroamerikanischer Abstammung und 10 % Patienten unbekannter ethnischer Zugehörigkeit.
Körpergewicht
Bei ALL-, DLBCL- und FL-Patienten in den Gewichtsbereichen (ALL: 14,4 bis 137 kg; DLBCL: 38,3 bis 186,7 kg; FL: 44.3 bis 127.7 kg) zeigten die Streudiagramme von qPCR-Zellkinetik-Parametern gegenüber Gewicht keine offensichtliche Beziehung zwischen zellkinetischen Parametern und Gewicht.
Niereninsuffizienz
Kymriah ist ein zellbasiertes Produkt, und basierend auf dem Wirkmechanismus ist nicht zu erwarten, dass die Niereninsuffizienz die Expansion von Tisagenlecleucel und die Zellkinetik beeinflusst; daher wurden keine formalen Studien zur Niereninsuffizienz durchgeführt.
Vorherige Transplantation
Eine vorherige Transplantation hatte keinen Einfluss auf die Expansion bzw. Persistenz von Tisagenlecleucel bei pädiatrischen und jungen Erwachsenen Patienten mit B-Zell-ALL, erwachsenen DLBCL-Patienten und FL-Patienten.
Leberinsuffizienz
Kymriah ist ein zellbasiertes Produkt und basierend auf dem Wirkmechanismus ist nicht zu erwarten, dass eine Leberinsuffizienz die Expansion von Tisagenlecleucel und die Zellkinetik beeinflusst; daher wurden keine formalen Studien zur Leberinsuffizienz durchgeführt.
Präklinische DatenDie nichtklinische Sicherheitsbewertung von Kymriah befasste sich mit den Sicherheitsbedenken hinsichtlich des potenziellen unkontrollierten Zellwachstums von transduzierten T-Zellen in vitro und in vivo sowie mit dosisbedingter Toxizität, Biodistribution und Persistenz. Auf der Grundlage dieser Studien wurden keine derartigen Risiken festgestellt.
Mangels validierter nicht-klinischer In-vivo-Modelle konnten das Cytokine Release Syndrome (CRS) und Tumorlysesyndrom (TLS) in Tierversuchen nicht untersucht werden.
Sicherheitspharmakologie und Toxizität bei wiederholter Verabreichung
Studien zur Sicherheitspharmakologie wurden nicht durchgeführt, da die Gewebeverteilung des Targets begrenzt ist (d. h., CD19 wird ausschliesslich auf B-Zellen in Blut und lymphatischen Geweben exprimiert), und weil aufgrund des pharmakologischen Prinzips (d. h., die zielgruppenspezifische T-Zell-vermittelte Zytotoxizität) solche Sicherheitsstudien nicht gerechtfertigt sind.
Es wurden keine Studien zur Toxizität bei wiederholter Verabreichung durchgeführt.
Karzinogenität und Mutagenität
Genotoxizitätstests und Kanzerogenitätsstudien an Nagetieren sind nicht geeignet, um das Risiko einer Insertionsmutagenese für gentechnisch veränderte Zelltherapieprodukte abzuschätzen. Adäquate alternative Tiermodelle wurden nicht etabliert.
In-vitro-Expansionsstudien mit CAR-positiven T-Zellen (Kymriah) von gesunden Spendern und Patienten (Kymriah) zeigten keine Hinweise auf eine Transformation oder Immortalisierung von T-Zellen. In-vivo-Studien mit immungeschwächten Mäusen zeigten bis zu 7 Monate lang keine Anzeichen für abnormales Zellwachstum oder Anzeichen einer klonalen Zellausdehnung, was den längsten aussagekräftigen Beobachtungszeitraum für immunsupprimierte Mausmodelle darstellt. Eine genomische Insertionsstellenanalyse des lentiviralen Vektors wurde mit Kymriah-Produkten von 14 Einzelspendern (12 Patienten und 2 gesunde Teilnehmer) durchgeführt. Es gab keine Belege für eine bevorzugte Integration in der Nähe von besorgniserregenden Genen oder präferenziellem Wachstum von Zellen, die besorgniserregende Integrationsstellen beherbergen.
Reproduktionstoxizität
Es wurden keine nicht-klinischen Studien zur reproduktiven Sicherheit durchgeführt, da kein adäquates Tiermodell zur Verfügung steht.
Tierexperimentelle Studien mit Jungtieren
Studien zur Toxizität bei Jungtieren wurden nicht durchgeführt.
Sonstige HinweiseInkompatibilitäten
Da keine Verträglichkeitsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Hinweise für die Handhabung (Überprüfung und Auftauen des/der Infusionsbeutel(s))
Der Infusionsbeutel sollte während des Auftauens in einen zweiten, sterilen Beutel gelegt werden, um die Ports vor einer Kontamination zu schützen und um ein Auslaufen für den unwahrscheinlichen Fall zu verhindern, dass der Infusionsbeutel undicht ist. Kymriah sollte unter Verwendung eines Wasserbads oder einer trockenen Auftaumethode bei 37 °C aufgetaut werden, bis im Infusionsbeutel kein Eis mehr zu sehen ist. Nach Beendigung des Auftauvorgangs sollte der Beutel sofort aus der Auftauvorrichtung entnommen und bei Raumtemperatur (20 °C bis 25 °C) bis zur Infusion aufbewahrt werden (nicht länger als 30 Minuten einschliesslich Infusion, siehe «Dosierung/Anwendung», Abschnitt «Art der Anwendung»). Wenn mehr als 1 Infusionsbeutel für die Behandlungsdosis erhalten wurde (die Anzahl der Beutel, die eine Dosis ergeben, ist im Chargenzertifikat [batch certificate] angegeben), sollte der nächste Beutel erst aufgetaut werden, nachdem der Inhalt des vorherigen Beutels infundiert wurde.
Kymriah darf nicht bearbeitet werden. Kymriah darf z.B. vor der Infusion nicht gewaschen (zentrifugiert und in einem neuen Medium suspendiert) werden.
Der/die Infusionsbeutel muss/müssen vor dem Auftauen auf Beschädigungen oder Risse untersucht werden. Wenn der Infusionsbeutel eine Beschädigung aufweist oder undicht ist, darf der Inhalt nicht infundiert werden, sondern muss in Übereinstimmung mit den national geltenden Bestimmungen zur biologischen Sicherheit entsorgt werden (siehe «Dosierung/Anwendung»).
Besondere Vorsichtsmassnahmen beim Transport und bei der Entsorgung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
Die lokalen Biosicherheitsrichtlinien für die Handhabung und Entsorgung von Produkten, die gentechnisch veränderte Organismen enthalten, sind zu beachten.
Kymriah muss innerhalb des Labors bzw. Spitals in geschlossenen, bruch- und auslaufsicheren Behältern transportiert werden.
Feste und flüssige Abfälle: Alle Materialien, die mit Kymriah in Berührung gekommen sind, müssen als potenziell infektiöser Abfall gemäss den örtlichen Verfahren im Spital behandelt und entsorgt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Kymriah muss in einem temperaturüberwachten System bei ≤ -120°C gelagert und transportiert werden, z.B. in einem Gefäss zur Tieftemperaturlagerung (Dewar) in der Dampfphase von Flüssigstickstoff.
Das Verfallsdatum ist auf dem Produktetikett angegeben. Erst auftauen, wenn das Produkt anzuwenden ist.
Kymriah ausser Reichweite von Kindern aufbewahren.
Bedingungen für die Aufbewahrung des Arzneimittels nach dem Auftauen, siehe «Hinweise für die Handhabung».
Zulassungsnummer66778 (Swissmedic)
Packungen1 oder mehrere Infusionsbeutel für eine Gesamtdosis von 1,2 x 106– 6,0 x 108 CAR-positive lebensfähige T-Zellen. [A]
ZulassungsinhaberinNovartis Pharma Schweiz AG, Risch; Domizil: 6343 Rotkreuz
Stand der InformationNovember 2024
|


