Eigenschaften/WirkungenATC-Code
L01XL04
Wirkungsmechanismus
Tisagenlecleucel ist eine autologe Immunzell-Krebstherapie, bei der patienteneigene T-Zellen mit einem Transgen, das einen chimären Antigenrezeptor (chimeric antigen receptor, CAR) kodiert, umprogrammiert werden, um CD19-exprimierende Zellen zu erkennen und zu zerstören. Der CAR besteht aus einem murinen Single-Chain-Antikörperfragment, das CD19 erkennt und mit intrazellulären Signaldomänen von 4-1BB (CD137) und CD3-Zeta fusioniert ist. Die CD3-Zeta-Komponente ist entscheidend für die Initiierung der T-Zell-Aktivierung und der Antitumor-Aktivität, während 4-1BB die Expansion und Persistenz von Kymriah verstärkt. Nach der Bindung an CD19-exprimierende Zellen überträgt der CAR ein Signal, um die Expansion der T-Zellen, die Zerstörung der Zielzellen und die Persistenz von Kymriah zu fördern.
Pharmakodynamik
Kardiale Elektrophysiologie
Kymriah ist ein Produkt auf Zellbasis und es wird nicht erwartet, dass es das QT-Intervall verlängert; daher wurde keine formale QT-Studie durchgeführt.
Klinische Wirksamkeit
Akute lymphatische Leukämie (ALL)
Die Sicherheit und Wirksamkeit der Kymriah-Behandlung bei pädiatrischen und jungen erwachsenen Patienten mit rezidivierter und refraktärer (r/r) B-Zell-ALL wurden in drei offenen, einarmigen Studien (total 205 Patienten infundiert) untersucht. Bei allen Patienten wurden Leukaphereseprodukte vor oder während dem Studieneintritt entnommen und kryokonserviert.
CCTL019B2202
Bei der zulassungsrelevanten Studie (B2202) handelt es sich um eine multizentrische, einarmige Phase-II-Studie mit pädiatrischen und jungen erwachsenen Patienten mit r/r B-Zell akuter lymphatischer Leukämie, die chemorefraktär, nach allogener SCT oder nach zwei oder mehr Therapielinien im Knochenmark rezidiviert ist oder für die allogene SCT keine Behandlungsmöglichkeit darstellt.
Patienten mit den folgenden genetischen Syndromen mit angeborenen Störungen der Blutbildung (bone-marrow failure) wurden aus der Studie ausgeschlossen:
Fanconi-Anämie, Kostmann-Syndrom, Shwachman-Syndrom oder andere Blutbildungsstörungen; Patienten mit Down Syndrom wurden in die Studie eingeschlossen. Patienten mit Burkitt's Lymphoma/Leukämie waren nicht zulässig (z.B. Patienten mit differenziertr B-Zell ALL, Leukämie mit B-Zell [sIg positiv und Kappa oder Lambda begrenzter Positivität] ALL, mit FAB L3 Morphologie und/oder einer MYC Translokation).
Von den 97 Patienten, die in die Hauptkohorte aufgenommen wurden, erhielten 79 Kymriah, 18 Patienten (19 %) beendeten die Studie vor der Kymriah-Infusion (7 Patienten verstarben, 8 Patienten konnten aufgrund von Problemen im Zusammenhang mit der Kymriah-Herstellung keine Infusion bekommen, 3 Patienten aufgrund von unerwünschten Ereignissen).
Die infundierten Patienten waren zwischen 3 und 24 Jahre alt mit einem medianen Alter von 11 Jahren und 8 % hatten eine primäre refraktäre Erkrankung. 61 Prozent der Patienten hatten zuvor eine Stammzelltransplantation erhalten. Das mediane Alter aller in der Studie eingeschlossenen Patienten war 11 Jahre mit einer Altersspanne von 3 bis 27 Jahren; 8% hatten eine primär refraktäre Erkrankung. 61 % der eingeschlossenen Patienten erhielten zuvor eine SCT. Die Mehrheit der Patienten (69/79, 87 %) erhielt eine Überbrückungstherapie, während sie auf Kymriah warteten. Insgesamt 76 von 79 mit Kymriah infundierten Patienten erhielten nach der Aufnahme in die Studie und vor der Kymriah-Infusion eine lymphodepletierende Chemotherapie.
77 % der Patienten wurden zur Infusion ins Spital eingewiesen mit einer medianen Entlassung am Tag 21; von diesen verblieben 68 % für mindestens 10 Tage nach Infusion im Spital. Von den 23% der Patienten, welche ursprünglich für die Infusion nicht hospitalisiert wurden, wurden 83 % zu einem späteren Zeitpunkt ins Spital eingewiesen.
Die Wirksamkeit von Kymriah wurde durch den primären Endpunkt der Gesamtremissionsrate (overall remission rate, ORR), welche das beste Gesamtansprechen als komplette Remission (complete remission, CR) oder komplette Remission mit unvollständiger hämatologischer Wiederherstellung (CRi) umfasste, innerhalb von 3 Monaten nach der Infusion durch ein Independent Review Committee untersucht. Die Wirksamkeit wurde weiter ermittelt durch die Dauer der Remission (duration of remission, DOR) und den Anteil der Patienten, die CR oder CRi mit minimaler Resterkrankung (minimal residual disease, MRD) < 0,01 % (beurteilt durch die Durchflusszytometrie (MRD-negativ)) erreicht haben. Die mediane Zeit von der Kymriah-Infusion bis zu LPLV (17. November 2022) betrug 79,4 Monate (Bereich: 59,7 bis 90,3). Die Ergebnisse zur Wirksamkeit aus dieser Studie sind in Tabelle 1 dargestellt.
Die ORR war über alle Untergruppen hinweg konsistent. Acht Patienten, denen eine Kymriah-Infusion verabreicht wurde, erhielten eine Transplantation, während sie sich in Remission befanden.
Tabelle 1 Studie B2202: Ergebnisse zur Wirksamkeit bei pädiatrischen und jungen erwachsenen Patienten mit rezidivierter/refraktärer akuter lymphatischer B-Zell-Leukämie (ALL)
|
Primärer Endpunkt
|
Eingeschlossene Patienten
N = 97
|
Infundierte Patienten
N = 79
| |
Gesamtremissionsrate (ORR)1,2, n (%)
95 %-KI
|
65 (67,0)
(56,7; 76,2)
p < 0,0001
|
65 (82,3)
(72,1; 90,0)
p < 0,0001
| |
CR3, n (%)
|
49 (50,5)
|
49 (62,0)
| |
CRi4, n (%)
|
16 (16,5)
|
16 (20,3)
| |
Wichtigster sekundärer Endpunkt
|
N = 97
|
N = 79
| |
CR oder CRi mit MRD-negativem Knochenmark5,6, n (%)
95 %-KI
|
64 (66,0)
(55,7; 75,3)
p < 0.0001
|
64 (81,0)
(70,6; 89,0)
p < 0,0001
| |
Dauer der Remission (DOR)7
|
N = 66
|
N = 66
| |
% Wahrscheinlichkeit, nach 12 Monaten ereignisfrei zu sein (95 %-KI)
|
67,4 (53,2; 78,1)
|
67,4 (53,2; 78,1)
| |
% Wahrscheinlichkeit, nach 24 Monaten ereignisfrei zu sein (95 %-KI)
|
58,4 (43,7; 70,5)
|
58,4 (43,7; 70,5)
| |
% Wahrscheinlichkeit, nach 36 Monaten ereignisfrei zu sein (95 %-KI)
|
53,9 (39,2; 66,5)
|
53,9 (39,2; 66,5)
| |
% Wahrscheinlichkeit, nach 54 Monaten ereignisfrei zu sein (95 %-KI)
|
49,2 (34,6; 62,3)
|
49,2 (34,6; 62,3)
| |
Median (Monate) (95 %-KI)
|
46,8 (17,8; n.b.9)
|
46,8 (17,8; n.b.)
| |
Weitere sekundäre Endpunkte
|
N = 97
|
N = 79
| |
Ereignisfreies Überleben (EFS)8
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
n.a.11
|
57,2 (44,5; 68,0)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
n.a.11
|
49,6 (36,7; 61,2)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
n.a.11
|
45,8 (33,0; 57,6)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
n.a.11
|
41,8 (29,1; 53,9)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
n.a.11
|
41,8 (29,1; 53,9)
| |
Median (Monate) (95 %-KI)
|
n.a.11
|
23,7 (9,2; n.b.10)
| |
Gesamtüberleben (overall survival, OS)9
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
69,5 (59,2; 77,7)
|
77,1 (66,1; 84,9)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
57,6 (46,9; 66,8)
|
67,8 (56,1; 77,0)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
52,8 (42,1; 62,4)
|
63,5 (51,6; 73,2)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
49,0 (38,4; 58,9)
|
59,0 (46,9; 69,2)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
46,3 (35,7; 56,3)
|
55,7 (43,6; 66,3)
| |
Median (Monate) (95 %-KI)
|
49,9 (19,4; n.b.)
|
Nicht erreicht (45,6; n.b.)
| |
Die Wirksamkeitsendpunkte wurden auf der Grundlage der in die Hauptkohorte aufgenommenen Patienten analysiert.
1 Remissionsstatus muss mindestens 28 Tage erhalten bleiben, ohne klinischen Hinweis auf ein Rezidiv.
2 Nominal einseitiger exakter p-Wert auf Grundlage von H0: ORR ≤20 % vs. Ha: ORR > 20 %
3 CR (komplette Remission) war definiert als: < 5 % Blasten im Knochenmark, zirkulierende Blasten im Blut sollten < 1 % sein, kein Hinweis auf extramedulläre Erkrankung und vollständige Wiederherstellung des peripheren Blutbildes (Thrombozyten > 100.000/µl und absolute Neutrophilenzahl [absolute neutrophil counts, ANC] > 1.000/µl) ohne Bluttransfusion.
4 CRi (komplette Remission mit unvollständiger Wiederherstellung des Blutbildes) war definiert als: < 5 % Blasten im Knochenmark, zirkulierende Blasten im Blut sollten < 1 % sein, kein Hinweis auf extramedulläre Erkrankung und keine vollständige Wiederherstellung des peripheren Blutbildes mit oder ohne Bluttransfusion.
5 MRD(minimale Resterkrankung)negativ war definiert als MRD < 0,01 % (durch Durchflusszytometrie ermittelt).
6 Nominal einseitiger exakter p-Wert auf Grundlage von H0: Rate der MRDnegativen Remission ≤15 % vs. Ha: > 15 %.
7 DOR war definiert als der Zeitraum vom Einsetzen der CR oder CRi bis zum Rezidiv oder Tod aufgrund der zugrundeliegenden Erkrankung, je nachdem, was zuerst eintrat (N = 66). Ein Patient erreichte nach Monat 3 eine Remission.
8 EFS war definiert als die Zeit zwischen der Infusion von Kymriah bis zu dem frühesten Eintreten eines der folgenden Events: Tod jeglicher Ursache für infundierte Patienten nach Erreichen einer Remission, Verlust der Remission oder fehlendes Ansprechen auf die Behandlung.
9 OS war definiert als die Zeit zwischen der Infusion von Kymriah bis zum Tod jeglicher Ursache für infundierte Patienten und als die Zeit zwischen Einschluss in die Studie bis zum Tod jeglicher Ursache für eingeschlossene Patienten. Von den 79 infundierten Patienten in der Hauptkohorte wurden 46 Patienten (58,2 %) für das OS zensiert, von denen 31 Patienten (39,2 %) die Nachbeobachtung der Studie abschlossen und die übrigen 15 Patienten (19,0 %) die Nachbeobachtung der Studie abbrachen. Zu den Abbruchgründen gehörten: Entscheidung des Probanden/Vormunds/Arztes (N = 5), mangelnde Wirksamkeit einschliesslich fehlender Remission oder Rückfall nach Remission (N = 2), neue Therapie für die Studienindikation während der Remission (N = 7) und «Lost to follow-up» (N = 1).
10 Nicht bestimmbar
11 Nicht anwendbar
|
Besondere Patientengruppen
Es wurden keine Unterschiede hinsichtlich Wirksamkeit oder Sicherheit zwischen verschiedenen Altersgruppen beobachtet.
Leukämiepatienten mit aktiver Beteiligung des zentralen Nervensystems (ZNS)
Es gibt nur begrenzte Erfahrungen mit Kymriah bei Patienten mit aktiver ZNS-Leukämie und aktivem ZNS-Lymphom. Daher wurden in dieser Population Risiko und Nutzen von Kymriah nicht untersucht.
Diffuses grosszelliges B-Zell-Lymphom (DLBCL)
Die Sicherheit und Wirksamkeit der Kymriah-Behandlung bei erwachsenen Patienten mit rezidiviertem und refraktärem (r/r) diffus grosszelligem B-Zell-Lymphom (DLBCL) wurden in einer offenen, einarmigen zulassungsrelevanten Studie untersucht. 167 Patienten wurden in die Studie aufgenommen, davon erhielten 115 Patienten die Infusion (99 Patienten in der Hauptkohorte und 16 Patienten in der Kohorte A).
CCTL019C2201
Bei der zulassungsrelevanten Studie (C2201) handelt es sich um eine multizentrische, einarmige Phase-II-Studie mit erwachsenen Patienten mit rezidiviertem oder refraktärem DLBCL, die ≥2 Chemotherapielinien, einschliesslich Rituximab und Anthrazyklin, erhalten haben oder nach einer autologen hämatopoetischen Stammzelltransplantation (autologous haematopoietic stem cell transplantation, HSCT) rezidiviert sind. Patienten mit aktivem ZNS Lymphom (active CNS involvement by malignancy) wurden von der Studie C2201 ausgeschlossen wie auch Patienten mit T-Zell-reichem/Histiozyten-reichem, grosszelligem B-Zell-Lymphom (THRBCL), primär kutanem grosszelligem B-Zell-Lymphom, primär mediastinalem B-Zell-Lymphom (PMBCL), EBV-positivem DLBCL bei älteren Patienten, Richter-Transformation und Burkitt-Lymphom. Von 167 in die Studie aufgenommenen Patienten erhielten 115 eine Infusion mit Kymriah. Ca. 31 % der Patienten brachen die Studie vor der Gabe von Kymriah ab. 13 (8 %) Patienten erhielten aufgrund von Herstellungsfehlern kein Kymriah. Weitere Gründe für den Abbruch vor der Kymriah-Infusion: Tod (n=16; 10 %), Entscheidung des Arztes/Fortschreiten der Grunderkrankung (n=16, 10 %), Entscheidung des Patienten (n=2; 1 %), unerwünschte Ereignisse (n=4; 2 %) und Abweichung vom Prüfplan (n=1, 1 %) während sie auf die Herstellung von Kymriah im Rahmen der klinischen Studie warteten.
Das mediane Alter der infundierten Patienten betrug 56 Jahre (Bereich: 22 bis 76 Jahre), 77 % der Patienten hatten eine Erkrankung im Stadium III/IV bei Studieneintritt, 51 % hatten bereits 3 oder mehr Behandlungslinien für DLBCL erhalten. 49 Prozent der Patienten hatten zuvor eine Stammzelltransplantation erhalten. 55 Prozent der Patienten waren refraktär gegenüber der letzten Behandlungslinie. Das mediane Alter aller in der Studie eingeschlossenen Patienten war 58 Jahre (Altersspanne 22 bis 76 Jahre). 78% der Patienten hatten ein Stadium III/IV bei Studieneintritt der Erkrankung, 53% erhielten zuvor 3 oder mehr Behandlungslinien. 44% der Patienten erhielten zuvor eine SCT. 59% waren refraktär gegenüber der letzten Behandlungslinie.
Bei allen Patienten (n=167, d.h. alle Patienten, die in die Studie aufgenommen wurden) wurde Leukapheresematerial vor oder während Studieneintritt entnommen und kryokonserviert. Die Mehrheit der infundierten Patienten (103 von 115, 90 %) erhielt eine Überbrückungstherapie, während sie auf Kymriah warteten, und 107 von 115 Patienten (93 %) erhielten eine lymphodepletierende Chemotherapie. Kymriah wurde als intravenös infundierte Einzeldosis in einem qualifizierten Kymriah-Behandlungszentrum stationär und ambulant verabreicht. Die zugelassene Dosierspanne in der Studie reichte von 1.0-5.0×108 CAR-positive, lebensfähige T-Zellen.
88 % der Patienten wurden zur Infusion ins Spital eingewiesen mit einer medianen Entlassung am Tag 15; von diesen verblieben 60 % für mindestens 10 Tage nach Infusion im Spital. Von den 12 % der Patienten, welche ursprünglich für die Infusion nicht hospitalisiert wurden, wurden 50 % zu einem späteren Zeitpunkt ins Spital eingewiesen.
Die Wirksamkeit von Kymriah wurde anhand des primären Endpunkts, d.h. der besten Gesamtansprechrate (ORR), die vollständiges Ansprechen (CR) und partielles Ansprechen (PR) gemäss IRC-Bewertung basierend auf der Lugano-Klassifikation (Cheson et al. 2014) umfasst, sowie der sekundären Endpunkte einschliesslich der Dauer des Ansprechens (DOR) bewertet (Tabelle 2). Der primäre Endpunkt wurde bei 99 weltweit behandelten Patienten ermittelt, die Kymriah erhielten, das im Novartis-Werk in den USA hergestellt wurde, und die mindestens drei Monate lang beobachtet bzw. früher nach der Kymriah-Verabreichung die Studie abgebrochen hatten. Die mediane Zeit von der Kymriah-Infusion bis zu LPLV für infundierte Patienten der Hauptkohorte betrug 75,1 Monate (Bereich: 58,1 bis 86.6).
Unter den 99 Patienten, die in die primäre Endpunktanalyse eingeschlossen waren, war die beste ORR 54,5 % (54/99) mit einem 95%-Konfidenzintervall (KI) von (44,2 %, 64,6%). 41 Patienten (41,4 %) erzielten ein CR und 13 (13,1 %) ein PR. Von den 41 Patienten, die ein vollständiges Ansprechen (CR) erreichten, zeigten 16 Patienten zunächst ein Gesamtansprechen in Form eines partiellen Ansprechens (PR), das sich im Laufe der Zeit zu einem CR verbesserte, wobei die meisten Patienten (13/16) innerhalb von 6 Monaten nach der Infusion von Tisagenlecleucel eine Konversion vom PR zum CR erreichten. Die ORR war innerhalb verschiedener demographischer und prognostischen Subgruppen hauptsächlich konsistent, ausser bei den 14 Patienten unter 40 Jahre, bei welchen nur einer ein CR und einer ein PR hatte. Da die Fallzahl der Patienten unter 40 Jahren klein war, kann man nur limitierte Rückschlüsse auf die Wirksamkeit in dieser Patientengruppe ziehen.
Keiner der Patienten, die eine Kymriah-Infusion erhalten hatten, erhielt nach Erreichen des CR oder PR eine Transplantation.
Tabelle 2 Studie C2201: Ergebnisse zur Wirksamkeit bei erwachsenen Patienten mit rezidiviertem oder refraktärem diffus grosszelligen B-Zell-Lymphom (DLBCL) nach zwei oder mehr Linien einer systemischen Therapie
|
|
Eingeschlossene Patienten N=167
|
Infundierte Patienten
N=115
| |
Primärer Endpunkt1
|
N = 147
|
N = 99
| |
Gesamtansprechrate (ORR) (CR+PR)2, n (%)
95 %-KI
|
54 (36,7)
(28,9; 45,1)
|
54 (54,5)
(44,2; 64,6)
| |
CR, n (%)
|
41 (27,9)
|
41 (41,4)
| |
PR, n (%)
|
13 (8,8)
|
13 (13,1)
| |
Ansprechen in Monat 3
|
N = 147
|
N = 99
| |
ORR (%)
|
40 (27,2)
|
40 (40,4)
| |
CR (%)
|
34 (23,1)
|
34 (34,3)
| |
Ansprechen in Monat 6
|
N = 147
|
N = 99
| |
ORR (%)
|
34 (23,1)
|
34 (34,3)
| |
CR (%)
|
31 (21,1)
|
31 (31,3)
| |
Ansprechdauer (DOR)3
|
N = 54
|
N = 54
| |
Median (Monate) (95 %-KI)
|
Nicht erreicht (10,0; n.b.6)
|
Nicht erreicht (10,0; n.b.6)
| |
% Wahrscheinlichkeit, nach 12 Monaten rezidivfrei zu sein (95 %-KI)
|
63,4 (48,2; 75,2)
|
63,4 (48,2; 75,2)
| |
% Wahrscheinlichkeit, nach 24 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% Wahrscheinlichkeit, nach 36 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% Wahrscheinlichkeit, nach 48 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
% Wahrscheinlichkeit, nach 54 Monaten rezidivfrei zu sein (95 % KI)
|
60,8 (45,5; 73,1)
|
60,8 (45,5; 73,1)
| |
Weitere sekundäre Endpunkte
|
N = 167
|
N = 115
| |
Ereignisfreies Überleben (EFS) 4
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
n.a.7
|
29,2 (21,1, 37,7)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
n.a.7
|
24,6 (17,1; 32,9)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
n.a.7
|
23,7 (16,3; 31,9)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
n.a.7
|
23,7 (16,3; 31,9)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
n.a.7
|
20,3 (13,3; 28,4)
| |
Median (Monate) (95 %-KI)
|
n.a.7
|
2,8 (2,1;3,1)
| |
Gesamtüberleben (OS)5
|
|
| |
% Überlebenswahrscheinlichkeit nach 12 Monaten (95 %-KI)
|
41,0 (32,9; 48,9)
|
48,2 (38,6; 57,1)
| |
% Überlebenswahrscheinlichkeit nach 24 Monaten (95 %-KI)
|
33,3 (25,6; 41,2)
|
40,5 (31,2; 49,5)
| |
% Überlebenswahrscheinlichkeit nach 36 Monaten (95 %-KI)
|
29,4 (22,1; 37,2)
|
36,6 (27,6, 45,6)
| |
% Überlebenswahrscheinlichkeit nach 48 Monaten (95 %-KI)
|
27,9 (20,7; 35,6)
|
34,7 (25,9; 43,7)
| |
% Überlebenswahrscheinlichkeit nach 60 Monaten (95 %-KI)
|
25,5 (18,5; 33,1)
|
31,7 (23,1; 40,6)
| |
Median (Monate) (95 %-KI)
|
8,2 (5,8; 11,7)
|
11,1 (6,6; 23,9)
| |
1
Der primäre Endpunkt wurde für alle Patienten analysiert, deren Kymriah im US-amerikanischen Werk von Novartis hergestellt wurde.
2 ORR ist der Anteil der Patienten, die als bestes Gesamtansprechen (best overall response, BOR) eine CR oder PR auf der Grundlage der Lugano-Klassifikation (Cheson et al. 2014) erreichten. Patienten, die nicht infundiert wurden, wurde ein BOR = unbekannt (d.h. Nicht-Responder) zugeordnet.
3 DOR war definiert als der Zeitraum vom Erreichen des CR oder PR, je nachdem, was zuerst eintrat, bis zum Rezidiv oder Tod aufgrund des DLBCL.
4 EFS war definiert als die Zeit zwischen der Infusion von Kymriah bis zu dem frühesten Eintreten eines der folgenden Events: Tod jeglicher Ursache für infundierte Patienten nach Erreichen eines Ansprechens, Verlust eines Ansprechens oder Fortschreiten der Krankheit oder neue Behandlung der Krankheit mit Ausnahme einer SCT.
5 OS war definiert als der Zeitraum zwischen der Infusion von Kymriah und dem Tod jeglicher Ursache (N = 115) und als der Zeitraum zwischen Einschluss in die Studie und dem Tod jeglicher Ursache für eingeschlossene Patienten (N = 165). Von den 115 infundierten Patienten wurden 39 Patienten (33,9 %) für das OS zensiert, darunter 28 Patienten (24,3 %), die die Nachbeobachtung der Studie abschlossen, und die übrigen 11 Patienten (9,6 %), die die Nachbeobachtung der Studie abbrachen. Zu den Abbruchgründen gehörten: Entscheidung des Patienten/Arztes (N = 5), Fortschreiten der Krankheit (N = 5) und Abbruch der Nachbeobachtung (N = 1).
6 Nicht bestimmbar.
7 Nicht anwendbar
|
Pädiatrie
Bei 34 Patienten mit rezidiviertem oder refraktärem, B-Zell-Non-Hodgkin-Lymphom (NHL) bei Kindern und jungen Erwachsenen wurde eine Phase II-Studie mit Tisagenlecleucel (C2202, BIANCA) durchgeführt. Von den 33 Patienten, die mit Kymriah infundiert wurden, hatten 28 Patienten (24 Patienten im Alter von 3-17 Jahren und 4 Patienten im Alter von 20-22 Jahren) vor der Infusion eine messbare Krankheit gehabt und wurden in das Wirksamkeitsanalysen-Set (efficacy analysis set, EAS) eingeschlossen. Das Wirksamkeitsanalysen-Set umfasste das Burkitt-Lymphom (n=15), das diffuse grosszellige B-Zell-Lymphom (n=8), das primäre mediastinale B-Zell-Lymphom (n=3), das Grauzonen-Lymphom (n=1) und das hochmaligne Lymphom mit MYC- und BCL2-Rearrangements (n=1). Bei diesen Patienten betrug das mediane Alter 14,0 Jahre (Spanne: 3 bis 22 Jahre), 9 (32,1 %) waren weiblich, 19 (67,9 %) waren männlich. Der Median der Anzahl der vorangegangenen Therapielinien lag bei 1 (Spanne: 1-3), bei 17,9 % der Patienten war zuvor eine (1) hämatopoetische Stammzelltransplantation durchgeführt worden. 96.4% der infundierten Patienten hatte in der Wartezeit vor der Behandlung mit Kymriah eine überbrückende Chemotherapie erhalten. Die Patienten erhielten die zugelassene Tisagenlecleucel-Dosis für die Indikation ALL.
Die Ergebnisse des Wirksamkeitsanalysen-Sets (n=28) zeigten eine ORR von 32,1 % (95 % KI: 15,9; 52,4) mit einer CR von 7,1 %. Die Subgruppenanalyse wies auf eine niedrigere ORR bei Patienten mit Burkitt-Lymphom (20 %, 95 % KI: 4,3; 48,1) im Vergleich zu Patienten mit diffusem grosszelligem B-Zell-Lymphom (37,5 %, 95 % KI: 8,5; 75,5) oder anderen Diagnosen welche in der Studie eingeschlossen waren (60,0 %, 95 % KI: 14,7; 94,7) hin. Da die Daten zur Behandlung pädiatrischer Patienten mit r/r B-Zell-Non-Hodgkin-Lymphom auf 33 Patienten beschränkt sind, lassen sich keine endgültigen Schlussfolgerungen zur Wirksamkeit in dieser Patientengruppe ziehen. Die verfügbaren limitierten Daten geben keine Hinweise für einen Nutzen bei der untersuchten Population.
Follikuläres Lymphom (FL)
Die Sicherheit und Wirksamkeit der Kymriah-Behandlung bei erwachsenen Patienten mit rezidiviertem oder refraktärem (r/r) follikulärem Lymphom (FL) wurden in einer einarmigen, multizentrischen Open-Label-Studie der Phase II untersucht.
CCTL019E2202
Bei der Zulassungsstudie E2202 (ELARA-Studie) handelt es sich um eine multizentrische, einarmige offene Phase-II-Studie bei erwachsenen Patienten mit r/r FL. Die Studie bezieht Patienten ein, die auf eine zweite oder spätere systemische Therapie (einschliesslich eines Anti-CD20-Antikörpers und eines Alkylierungsmittels) refraktär waren oder innerhalb von sechs Monaten nach Abschluss einer Anti-CD20-Antikörper-Erhaltungstherapie nach mindestens zwei Therapielinien einen Rückfall erlitten oder nach einer autologen hämatopoetischen Stammzelltransplantation (HSCT) einen Rückfall erlitten. Die eingeschlossenen Patienten erhielten im Median 4 (Spanne 2-13) vorherige Therapielinen. 75.5 % (74) der Patienten erhielten ≥3 vorherige Therapielinen. Von der Studie ausgeschlossen waren Patienten mit aktiven oder schweren Infektionen, transformierten Lymphomen oder anderen aggressiven Lymphomen, früherer allogener HSCT oder Erkrankungen mit aktiver Beteiligung des ZNS.
Von 98 Patienten, die an der Studie teilnahmen und sich einer Leukapherese unterzogen, erhielten 97 Patienten eine Infusion mit Kymriah. Ein Patient erreichte vor der Infusion ein vollständiges Ansprechen, das auf seine vorherige Therapielinie zurückgeführt wurde, und wurde anschliessend aufgrund einer ärztlichen Entscheidung vor der Infusion aus der Studie genommen. Von den 97 Patienten, denen Kymriah infundiert wurde, wiesen 94 Patienten zu Studienbeginn eine messbare Erkrankung auf und wurden in die Wirksamkeitsanalyse (Efficacy Analysis Set [EAS]) aufgenommen. Kymriah wurde an alle eingeschlossenen Patienten verabreicht.
Von den 94 Patienten in der Wirksamkeitspopulation wiesen folgende wichtige klinische Merkmale auf: Das Durchschnittsalter lag bei 57 Jahren (Spanne von 29 bis 73 Jahren), 86 % der Patienten waren bei Studienbeginn im Stadium III-IV erkrankt, 61 % hatten einen hohen FLIPI-Score, 65 % wiesen bei Studienbeginn eine ausgedehnte Erkrankung auf, 79 % waren refraktär gegenüber der letzten Behandlungslinie, 69 % waren doppelt refraktär, 37 % hatten zuvor eine autologe Stammzelltransplantation erhalten und bei 65 % war die Erkrankung innerhalb von 24 Monaten (POD24) nach Beginn der ersten Anti-CD20-Kombinationstherapie fortgeschritten. 44 Patienten (47 %) erhielten eine Überbrückungstherapie zwischen der Leukapherese und der Verabreichung von Kymriah, und alle Patienten erhielten eine lymphdepletierende Chemotherapie. Bei allen Patienten, die eine Infusion erhielten, wurde Kymriah als intravenöse Einzeldosis-Infusion stationär oder ambulant (18 %) verabreicht.
Die Wirksamkeit wurde anhand des primären Endpunkts der vollständigen Ansprechrate (CRR), die durch eine IRC auf der Grundlage der Lugano-Klassifikation (Cheson et al. 2014) bestimmt wurde, sowie anhand der sekundären Endpunkte der Gesamtansprechrate (ORR), der Dauer des Ansprechens (DOR) und des progressionsfreien Überlebens (PFS) gemäss IRC sowie des Gesamtüberlebens (OS) bewertet. Die erste Krankheitsbeurteilung sollte im Monat 3 nach der Infusion durchgeführt werden.
Von den 94 Patienten mit messbarer Erkrankung vor der Infusion, die in die Wirksamkeitsanalyse einbezogen wurden, mit einer medianen Nachbeobachtungszeit von 29 Monaten, wurde bei 64 Patienten (68 %, 95 %-KI: 57,7; 77,3) eine CR beobachtet; 17 (18 %) erreichten eine PR. Die ORR nach IRC-Bewertung betrug 86 % (81 Patienten) (95 %-KI: 77,5; 92,4). Alle Responder erreichten das Ansprechen (CR oder PR) bei der ersten nach der Infusion durchgeführten Krankheitsbeurteilung. Von den 65 Patienten, die ein CR erreichten, hatten 14 Patienten zunächst ein PR. Bei der Mehrheit der Patienten konnte innerhalb von 6 Monaten nach der Infusion eine CR festgestellt werden. Kein Patient, der eine Kymriah-Infusion erhielt, musste transplantiert werden, während er auf die Therapie ansprach (CR oder PR).
Die Wahrscheinlichkeit, dass ein Patient ein dauerhaftes Ansprechen (DOR) von ≥9 Monate hat, betrug 77 % (95 %-KI: 65,4; 84,6), während die Wahrscheinlichkeit, dass ein Patient, der ein CR erreicht hat, ein dauerhaftes Ansprechen von ≥9 Monate hat, 89 % (95 %-KI: 77,6; 94,4) betrug. Die Wahrscheinlichkeit eines progressionsfreien Überlebens (PFS) nach 12 Monaten betrug 67 % (95 %-KI: 56,3: 75,9), während die Wahrscheinlichkeit des Überlebens (OS) nach 12 Monaten 95 % (95 %-KI: 88,1; 98,2) betrug.
Tabelle 3 Studie E2202: Ergebnisse zur Wirksamkeit bei erwachsenen Patienten mit rezidivierter/refraktärer FL
|
|
Wirksamkeitspopulation
N=94
| |
Vollständige Ansprechrate (CRR), n (%)
95 %-KI
|
64 (68,1)
(57,7; 77,3)
| |
Gesamtansprechrate (ORR), n (%)
95 %-KI
|
81 (86,2)
(77,5; 92,4)
| |
Ansprechdauer (DOR), Monate
|
| |
Median (95 %-KI)
% Wahrscheinlichkeit nach 9 Monaten rezidivfrei zu sein, (95 %-KI)
|
Nicht erreicht (15,6, NE*)
76,6 (65,4; 84,6)
| |
DOR bei Patienten, die eine BOR von CR erreichen, Monate
Median (95 % KI)
% Wahrscheinlichkeit nach 9 Monaten rezidivfrei zu sein, (95 %-KI)
|
Nicht erreicht (NE, NE)
88.6 (77,6; 94,4)
| |
Fortschrittsfreies Überleben (PFS), Monate
|
| |
Median (95 %-KI)
PFS nach 12 Monaten % (95 %-KI)
|
Nicht erreicht (18,2; NE)
67.2 (56,3; 75,9)
| |
Gesamtüberleben (OS), Monate
|
| |
Median (95 %-KI)
OS nach 12 Monaten, % (95 %-KI)
|
Nicht erreicht
95.3 (88,1; 98,2)
| |
*NE: Nicht abschätzbar
|
|
Abbildung 1 Kaplan-Meier-Diagramm der Ansprechdauer (DOR) nach IRC-Bewertung (Efficacy Analysis Set [EAS])
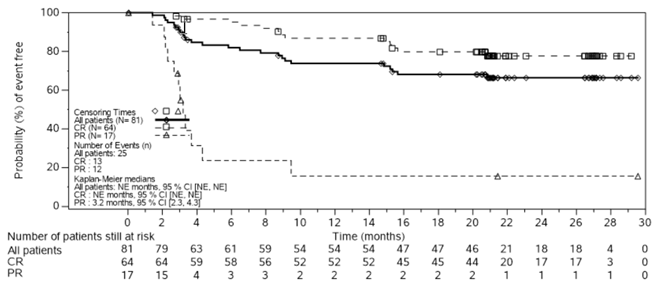
- Die Zeit ist relativ zum Beginn des Ansprechens, 1 Monat = 30,4375 Tage.
Abbildung 2 Kaplan-Meier-Diagramm des progressionsfreien Überlebens (PFS) nach IRC-Bewertung (EAS)
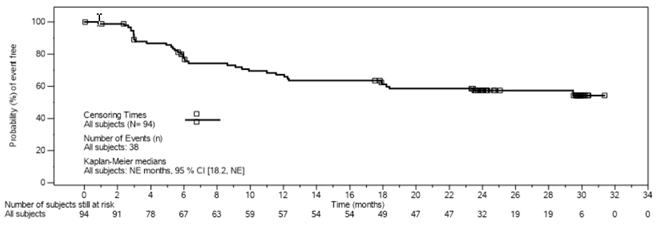
- Der Zeitpunkt ist relativ zur Tisagenlecleucel-Infusion, 1 Monat = 30,4375 Tage.
Experimentelle Indikation (Non-Hodgkin-Lymphom, NHL)
In einer experimentellen Indikation wurde eine Phase-III-Studie CCTL019H2301 (BELINDA) durchgeführt, an der 322 Patienten mit aggressivem NHL teilnahmen, die innerhalb von 365 Tagen nach ihrer letzten Dosis der Erstlinien-Immunchemotherapie refraktär waren oder ein Rezidiv erlitten hatten und für eine Stammzelltransplantation (SCT) in Frage kamen. Die Patienten wurden im Verhältnis 1:1 randomisiert und erhielten entweder eine Behandlung mit Tisagenlecleucel oder die Standardtherapie (SOC), definiert als platinbasierte Immunchemotherapie, gefolgt von einer Hochdosis-Chemotherapie (HDCT) und einer autologen hämatopoetischen Stammzelltransplantation (HSCT), wenn die Patienten auf die Behandlung angesprochen hatten.
Beim primären Endpunkt des ereignisfreien Überlebens (EFS) wurde zwischen Tisagenlecleucel und SOC kein statistisch signifikanter Unterschied beobachtet (stratifizierter Log-Rank-Test p = 0,69, einseitig). Nach einer medianen Nachbeobachtungszeit von 10 Monaten (Bereich: 2,9; 23,2) betrug das mediane EFS (95 %-KI) 3,0 Monate bei Tisagenlecleucel (95 %-KI: 2,9; 4,2) gegenüber 3,0 Monate bei SOC (95 %-KI: 3,0; 3,5). Für das OS wurde kein statistischer Test durchgeführt, da der primäre Endpunkt EFS statistisch nicht signifikant war. Das mediane OS betrug 16,9 Monate (95 %-KI: 11,1, NE) im Tisagenlecleucel-Arm gegenüber 15,3 Monaten (95 %-KI: 12,3, NE) im SOC-Arm. Einundachtzig (50,6 %) Patienten aus dem SOC-Arm wechselten die Behandlung und erhielten eine Infusion mit Tisagenlecleucel.
Im Rahmen der Studie wurden keine neuen Sicherheitssignale für Tisagenlecleucel beobachtet.
|


