Eigenschaften/WirkungenATC-Code
D11AH05
Wirkungsmechanismus
Dupilumab ist ein rekombinanter, humaner, monoklonaler IgG4-Antikörper, der die Signalwege von Interleukin 4 (IL-4) und Interleukin 13 (IL-13) hemmt. Dupilumab hemmt den IL-4-Signalweg über den Typ-I-Rezeptor (IL-4Rα/γc) und die Signalwege von IL-4 und IL-13 über den Typ-II-Rezeptor (IL-4Rα/IL-13Rα).
IL-4 und IL-13 sind Zytokine im Zusammenhang mit entzündlichen Erkrankungen vom Typ-2 wie atopische Dermatitis und Asthma. Durch Hemmung des IL-4-/IL-13-Signalwegs mit Dupilumab kommt es zu einer Verringerung mehrerer Mediatoren der Typ-2-Inflammation.
Pharmakodynamik
In klinischen Studien zu atopischer Dermatitis war die Behandlung mit Dupilumab mit einer Senkung der Konzentration von Biomarkern der Immunität Typ 2 wie thymusaktivitätsregulierten Chemokinen (TARC/CCL17), dem Gesamt-IgE im Serum sowie dem allergenspezifischen IgE im Serum gegenüber den Ausgangswerten assoziiert. Unter der Behandlung mit Dupilumab wurde bei Erwachsenen und Jugendlichen mit atopischer Dermatitis eine Abnahme der Laktatdehydrogenase (LDH) beobachtet.
Während der Behandlung kommt es durch die Präsenz von Dupilumab zu einem Anstieg des IgG4-Spiegels. Die Auswirkungen einer Langzeittherapie mit einem monoklonalen IgG4-Antikörper wurden noch nicht ausreichend untersucht.
In klinischen Studien zu Asthma kam es unter der Behandlung mit Dupilumab im Vergleich zu Placebo zu einer deutlichen Verringerung der FeNO-Werte und der Konzentrationen an Eotaxin-3, Gesamt-IgE, allergenspezifischem IgE, TARC und Periostin im Blutkreislauf. Diese Verringerungen von Biomarkern der Typ-2-Inflammation waren für die Behandlungsschemata mit 200 mg Q2W und 300 mg Q2W vergleichbar. Diese Marker waren nach 2-wöchiger Behandlung nahezu nicht nachweisbar, mit Ausnahme von IgE, das einen langsameren Rückgang zeigte. Diese Wirkungen hielten über die gesamte Behandlungsdauer an.
Klinische Wirksamkeit
1) Klinische Wirksamkeit und Sicherheit bei atopischer Dermatitis bei Erwachsenen
Die Wirksamkeit und Sicherheit von Dupilumab als Monotherapie und mit einer begleitenden Behandlung mit topischen Kortikosteroiden wurden in drei randomisierten, placebokontrollierten, doppelblinden Zulassungsstudien (SOLO 1, SOLO 2 und CHRONOS) untersucht. Eingeschlossen waren 2119 Patienten ab 18 Jahren mit einer mittelschweren bis schweren atopischen Dermatitis (AD), definiert durch einen Investigator's Global Assessment-Score ≥3 (IGA), einen EASI-Score (Eczema Area and Severity Index) ≥16 und eine betroffene Körperoberfläche von 10 % oder mehr. Die für diese drei Studien geeigneten und darin eingeschlossenen Patienten hatten vorher nur unzureichend auf eine topische Behandlung angesprochen.
In den drei Studien erhielten die Patienten 1) eine Anfangsdosis von 600 mg Dupilumab (zwei Injektionen zu je 300 mg) an Tag 1, gefolgt von 300 mg einmal alle zwei Wochen (Q2W); 2) eine Anfangsdosis von 600 mg Dupilumab an Tag 1, gefolgt von 300 mg einmal wöchentlich (QW; dieses Dosierungsschema ist in der Schweiz nicht zugelassen) oder 3) ein entsprechendes Placebo. Dupilumab wurde in allen Studien als subkutane (s. c.) Injektion verabreicht. Um als unerträglich empfundene Symptome der atopischen Dermatitis zu lindern, konnten die Patienten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten (u.a. topische Steroide mit höherer Wirksamkeit oder systemische Immunsuppressiva). Patienten, die eine Rescue-Therapie erhielten, wurden als Non-Responder eingestuft.
In die Studie SOLO 1 wurden 671 Patienten eingeschlossen (224 in die Placebo-Gruppe, 224 in die Gruppe mit Dupilumab 300 mg Q2W und 223 in die Gruppe mit Dupilumab 300 mg QW). Der Behandlungszeitraum betrug 16 Wochen.
In die Studie SOLO 2 wurden 708 Patienten eingeschlossen (236 in die Placebo-Gruppe, 233 in die Gruppe mit Dupilumab 300 mg Q2W und 239 in die Gruppe mit Dupilumab 300 mg QW; (dieses Dosierungsschema ist in der Schweiz nicht zugelassen)). Der Behandlungszeitraum betrug 16 Wochen.
In die Studie CHRONOS wurden 740 Patienten eingeschlossen (315 in die Gruppe Placebo + TCS, 106 in die Gruppe mit Dupilumab 300 mg Q2W + TCS und 319 in die Gruppe mit Dupilumab 300 mg QW + TCS (dieses Dosierungsschema ist in der Schweiz nicht zugelassen)). Der Behandlungszeitraum betrug 52 Wochen. Die Patienten erhielten ab Baseline Dupilumab oder ein Placebo sowie eine begleitende Therapie mit TCS gemäss standardisiertem Behandlungsschema. Die Patienten konnten auch topische Calcineurin-Inhibitoren (TCI) erhalten.
Primäre Endpunkte:
Die co-primären Endpunkte aller drei Zulassungsstudien waren der Anteil der Patienten, bei denen sich der Wert auf einer IGA-Skala (von 0 bis 4) von der Baseline bis Woche 16 um ≥2 Punkte auf dann 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») verbesserte sowie der Anteil der Patienten, deren EASI-Score sich von der Baseline bis Woche 16 um mindestens 75 % (EASI-75) verbesserte. Die weiteren untersuchten Resultate umfassten den Anteil der Patienten mit einer EASI-Verbesserung von mindestens 50 % (EASI-50) bzw. 90 % (EASI-90), einer Verringerung des Juckreizes gemessen an der numerischen Bewertungsskala für Pruritus (Peak Pruritus Numerical Rating Scale [NRS]) und einer prozentualen Veränderung des SCORAD (SCORing Atopic Dermatitis) von der Baseline bis Woche 16. Zusätzliche sekundäre Endpunkte umfassten die mittlere Veränderung des POEM (Patient-Oriented Eczema Measure), des DLQI (Dermatology Life Quality Index) sowie des HADS-Werts (Hospital Anxiety and Depression Scale) von der Baseline bis Woche 16. In der CHRONOS-Studie wurde die Wirksamkeit auch in Woche 52 bewertet.
Patientencharakteristika bei der Baseline:
In allen Behandlungsgruppen der Monotherapie-Studien (SOLO 1 und SOLO 2) lag das mittlere Alter bei 38,3 Jahren und das mittlere Gewicht bei 76,9 kg. 42,1 % der Studienteilnehmer waren Frauen, 68,1 % Weisse, 21,8 % Asiaten und 6,8 % Schwarze. In diesen Studien hatten 51,6 % der Patienten einen Baseline-IGA-Score von 3 (mittelschwere AD), 48,3 % einen Baseline-IGA-Score von 4 (schwere AD) und 32,4 % der Patienten wurden in der Vergangenheit mit systemischen Immunsuppressiva behandelt. Bei Behandlungsbeginn betrug der mittlere EASI-Score 33,0, der wöchentliche Durchschnittswert gemäss Pruritus NRS 7,4, der mittlere SCORAD 67,8, der mittlere POEM 20,5, der mittlere DLQI 15,0 und der mittlere HADS-Gesamtwert 13,3.
In allen Behandlungsgruppen der Studie mit begleitender TCS-Therapie (CHRONOS) lag das mittlere Alter bei 37,1 Jahren und das mittlere Gewicht bei 74,5 kg. 39,7 % der Studienteilnehmer waren Frauen, 66,2 % Weisse, 27,2 % Asiaten und 4,6 % Schwarze. In dieser Studie hatten 53,1 % der Patienten einen Baseline-IGA-Score von 3, 46,9 % einen Baseline-IGA-Score von 4 und 33,6 % der Patienten wurden in der Vergangenheit mit systemischen Immunsuppressiva behandelt. Bei Behandlungsbeginn betrug der mittlere EASI-Score 32,5, der wöchentliche Durchschnittswert gemäss Pruritus NRS 7,3, der mittlere SCORAD 66,4, der mittlere POEM 20,1, der mittlere DLQI 14,5 und der mittlere HADS-Gesamtwert 12,7.
Klinische Wirksamkeit: 16-wöchige Monotherapie-Studien (SOLO 1 und SOLO 2)
Im Vergleich zu Placebo erreichte in den Studien SOLO 1 und SOLO 2 von der Baseline bis Woche 16 ein signifikant höherer Anteil an Patienten, denen randomisiert Dupilumab zugewiesen worden war, einen IGA-Score von 0 oder 1, den EASI-75 und/oder eine Verbesserung um > 4 Punkte gemäss Pruritus NRS (siehe Tabelle 1).
Im Vergleich zu Placebo erreichte ein signifikant höherer Anteil an Patienten, die randomisiert Dupilumab erhielten, eine schnelle Verbesserung gemäss Pruritus NRS (definiert als Verbesserung um ≥4 Punkte bereits in Woche 2; p < 0,01); im Laufe des Behandlungszeitraums stieg der Patientenanteil mit einem Ansprechen gemäss Pruritus NRS weiterhin an. Die Verbesserung gemäss Pruritus NRS trat parallel zu einer Verbesserung der objektiven Anzeichen der atopischen Dermatitis auf.
Abbildung 1 und Abbildung 2 stellen die mittlere prozentuale Veränderung der EASI- bzw. Pruritus NRS-Scores von der Baseline bis Woche 16 dar.
Tabelle 1: Wirksamkeitsergebnisse der Dupilumab-Monotherapie in Woche 16
|
|
SOLO 1 (FSA) a
|
SOLO 2 (FSA) a
| |
|
Placebo
|
Dupilumab
300 mg Q2W
|
Placebo
|
Dupilumab
300 mg Q2W
| |
Randomisierte Patienten
|
224
|
224
|
236
|
233
| |
IGA 0 oder 1b,
% der Responderc
|
10,3 %
|
37,9 %e
|
8,5 %
|
36,1 %e
| |
EASI-50,
% der Responderc
|
24,6 %
|
68,8 %e
|
22,0 %
|
65,2 %e
| |
EASI-75,
% der Responderc
|
14,7 %
|
51,3 %e
|
11,9 %
|
44,2 %e
| |
EASI-90,
% der Responderc
|
7,6 %
|
35,7 %e
|
7,2 %
|
30,0 %e
| |
Anzahl Patienten mit Pruritus NRS-Wert bei Baseline ≥4
|
212
|
213
|
221
|
225
| |
Pruritus gemäss NRS (Verbesserung ≥4 Punkte)
% der Responderc,d
|
12,3 %
|
40,8 %e
|
9,5 %
|
36,0 %e
|
LS = Least Squares [Methode der kleinsten Quadrate]; SE = Standard Error [Standardfehler]
a Die Full-Sample-Analyse (FSA) umfasst alle randomisierten Patienten.
b Als Responder angesehen wurden Patienten mit einem IGA-Score von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Verbesserung um ≥2 Punkte auf einer von 0 bis 4 reichenden IGA-Skala.
c Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
d In Woche 2 war der Anteil der Patienten, bei denen eine Verbesserung gemäss Pruritus NRS um ≥4 Punkte festzustellen war, in den Dupilumab-Gruppen signifikant höher als in der Placebo-Gruppe (p < 0,01).
e p < 0,0001
Abbildung 1: Mittlere prozentuale Veränderung des EASI-Score gegenüber der Baseline in den Studien SOLO 1a und SOLO 2a (FSA)b
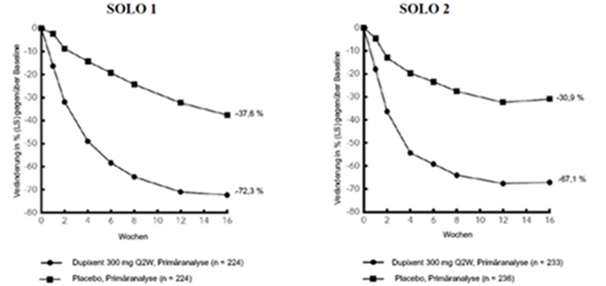
Abbildung 2: Mittlere prozentuale Veränderung gemäss Pruritus NRS gegenüber der Baseline in den Studien SOLO 1a und SOLO 2a (FSA)b
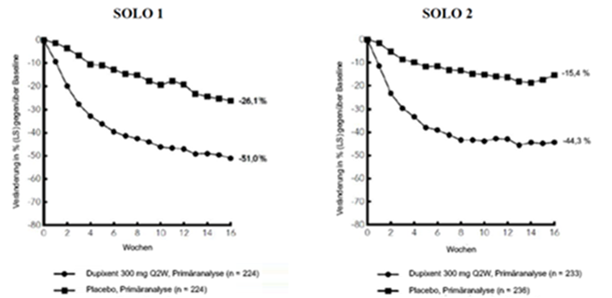
LS = Least Squares
a In den primären Analysen der Wirksamkeitsendpunkte wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die Full-Sample-Analyse (FSA) umfasst alle randomisierten Patienten.
In den Studien SOLO 1 und SOLO 2 stimmten die Wirksamkeit der Behandlung in den Untergruppen (Gewicht, Alter, Geschlecht, ethnische Herkunft sowie Hintergrundbehandlung einschliesslich Immunsuppressiva) mit den Ergebnissen der gesamten Studienpopulation überein.
Klinische Wirksamkeit: 52-wöchige Studie mit begleitender Therapie mit TCS (CHRONOS)
Im Vergleich zu Placebo + TCS erreichte in der Studie CHRONOS von der Baseline bis Woche 16 und 52 ein signifikant höherer Anteil an Patienten, denen randomisiert Dupilumab 300 mg Q2W + TCS zugewiesen worden war, einen IGA-Score von 0 oder 1, den EASI-75 und/oder eine Verbesserung um > 4 Punkte gemäss Pruritus NRS (siehe Tabelle 2).
Im Vergleich zu Placebo + TCS erreichte ein signifikant höherer Anteil an Patienten, die randomisiert Dupilumab + TCS erhielten, eine schnelle Verbesserung gemäss Pruritus NRS (definiert als Verbesserung um > 4 Punkte bereits in Woche 2; p < 0,05); im Laufe des Behandlungszeitraums stieg der Patientenanteil mit einem Ansprechen gemäss Pruritus NRS weiterhin an. Die Verbesserung gemäss Pruritus NRS trat im Zusammenhang mit einer Verbesserung der objektiven Anzeichen der atopischen Dermatitis auf.
Abbildung 3 und Abbildung 4 stellen die mittlere prozentuale Veränderung der EASI- bzw. NRS-Scores in der CHRONOS-Studie von der Baseline bis Woche 52 dar.
Tabelle 2: Wirksamkeitsergebnisse von Dupilumab mit begleitenden TCSa in Woche 16 und Woche 52 in der CHRONOS-Studie
|
|
Woche 16 (FSA)b
|
Woche 52 (FSA Woche 52)b
| |
|
Placebo
+
TCS
|
Dupilumab
300 mg
Q2W + TCS
|
Placebo
+
TCS
|
Dupilumab
300 mg
Q2W + TCS
| |
Randomisierte Patienten
|
315
|
106
|
264
|
89
| |
IGA 0 oder 1c,
% der Responderd
|
12,4 %
|
38,7 %f
|
12,5 %
|
36,0 %f
| |
EASI-50,
% der Responderd
|
37,5 %
|
80,2 %f
|
29,9 %
|
78,7 %f
| |
EASI-75,
% der Responderd
|
23,2 %
|
68,9 %f
|
21,6 %
|
65,2 %f
| |
EASI-90,
% der Responderd
|
11,1 %
|
39,6 %f
|
15,5 %
|
50,6 %f
| |
Anzahl Patienten mit Pruritus NRS-Wert bei Baseline ≥4
|
299
|
102
|
249
|
86
| |
Pruritus NRS-Wert
(Verbesserung ≥4 Punkte)
% der Responderd,e
|
19,7 %
|
58,8 %f
|
12,9 %
|
51,2 %f
|
LS = Least Squares [Methode der kleinsten Quadrate]; SE = Standard Error [Standardfehler]
a Alle Patienten erhielten eine Hintergrundbehandlung mit TCS. Die Patienten konnten topische Calcineurin-Inhibitoren anwenden.
b Die Full-Sample-Analyse (FSA) umfasst alle randomisierten Patienten. Die FSA in Woche 52 umfasst alle Patienten, die mindestens ein Jahr vor dem Enddatum der Primäranalyse randomisiert wurden.
c Als Responder angesehen wurden Patienten mit einem IGA-Score von 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Verbesserung um ≥2 Punkte auf einer von 0 bis 4 reichenden IGA-Skala.
d Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
e In Woche 2 war der Anteil der Patienten, bei denen eine Verbesserung gemäss Pruritus NRS um ≥4 Punkte festzustellen war, unter Dupilumab signifikant höher als unter Placebo (p < 0,05).
f p < 0,0001
g p = 0,0015
h p = 0,0003
i p = 0,0005
Abbildung 3: Mittlere Veränderung (in %) des EASI-Score gegenüber der Baseline in der CHRONOS-Studiea (FSA in Woche 52)b
CHRONOS
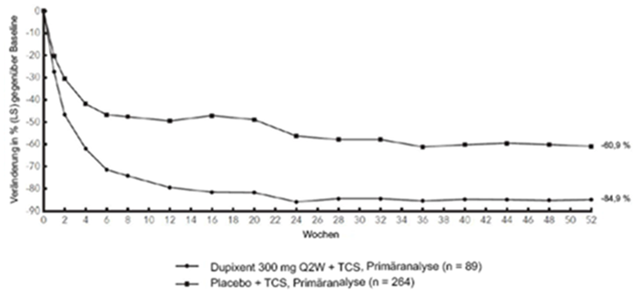
Abbildung 4: Mittlere Veränderung gemäss Pruritus NRS gegenüber der Baseline in der CHRONOS-Studiea (FSA in Woche 52)b
CHRONOS
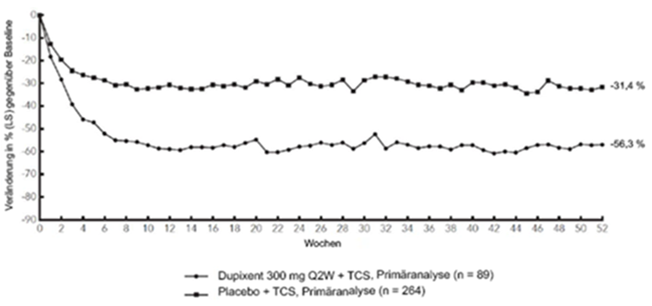
LS = Least Squares [Methode der kleinsten Quadrate]
a In den primären Analysen der Wirksamkeitsendpunkte wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die FSA in Woche 52 umfasst alle Patienten, die mindestens ein Jahr vor dem Enddatum der Primäranalyse randomisiert wurden.
In der CHRONOS-Studie stimmte die Wirksamkeit der Behandlung in den Untergruppen (Gewicht, Alter, Geschlecht, ethnische Herkunft sowie Hintergrundbehandlung einschliesslich Immunsuppressiva) mit den Ergebnissen der gesamten Studienpopulation überein.
Klinische Wirksamkeit: Patienten, die unter einer Ciclosporin-Behandlung unzureichend eingestellt waren, eine Unverträglichkeit gegenüber Ciclosporin aufwiesen oder für die diese Behandlung medizinisch nicht indiziert war (CAFE-Studie)
Im Rahmen der CAFE-Studie wurde die Wirksamkeit von Dupilumab mit begleitender TCS-Therapie gegenüber Placebo innerhalb eines 16-wöchigen Behandlungszeitraums bewertet. Bei den Studienteilnehmern handelte es sich um erwachsene Patienten mit schwerer atopischer Dermatitis, die unter einem oralen Ciclosporin unzureichend eingestellt waren, dieses nicht vertrugen oder für die diese Behandlung derzeit kontraindiziert oder medizinisch nicht angezeigt ist.
Insgesamt wurden 325 Patienten eingeschlossen, von denen 210 bereits in der Vergangenheit mit Ciclosporin behandelt wurden, während 115 Patienten noch nie Ciclosporin erhalten hatten oder eine Ciclosporin-Behandlung bei ihnen medizinisch nicht angezeigt war. Das mittlere Alter lag bei 38,4 Jahren, 38,8 % der Patienten waren Frauen. Bei Behandlungsbeginn betrug der mittlere EASI-Score 33,1, die durchschnittliche betroffene Körperoberfläche 55,7, der wöchentliche Durchschnittswert gemäss Pruritus NRS 6,4, der mittlere SCORAD 67,2 und der mittlere DLQI 13,8.
Primärer Endpunkt war der Anteil der Patienten mit einem EASI-75 in Woche 16.
In Tabelle 3 sind sowohl die primären als auch die sekundären Endpunkte der 16-wöchigen CAFE-Studie zusammengefasst.
Tabelle 3: Ergebnisse der primären und sekundären Endpunkte der CAFE-Studie
|
|
Placebo + TCS
|
Dupilumab
300 mg Q2W + TCS
| |
Randomisierte Patienten
|
108
|
107
| |
EASI-75, Responder (in %)
|
29,6 %
|
62,6 %
| |
EASI, mittlere prozentuale Veränderung (LS) gegenüber den Ausgangswerten (+/– SE)
|
-46,6
(2,76)
|
-79,8
(2,59)
| |
Wert gemäss Pruritus NRS, mittlere prozentuale Veränderung (LS) gegenüber den Ausgangswerten (+/– SE)
|
-25,4 % (3,39)
|
-53,9 % (3,14)
| |
SCORAD, mittlere prozentuale Veränderung (LS) gegenüber den Ausgangswerten (+/– SE)
|
-29,5 % (2,55)
|
-62,4 % (2,48)
| |
DLQI, mittlere Veränderung (LS) gegenüber den Ausgangswerten (SE)
|
-4,5
(0,49)
|
-9,5
(0,46)
|
In der Patientenuntergruppe der 52-wöchigen CHRONOS-Studie, die der Studienpopulation der CAFE-Studie ähnelte, erreichten bis Woche 16 69,6 % der mit Dupilumab 300 mg Q2W behandelten Patienten ein EASI-75-Ansprechen, während es bei den mit Placebo behandelten Patienten 18,0 % waren. Bis Woche 52 erreichten 52,4 % der mit Dupilumab 300 mg Q2W behandelten Patienten ein EASI-75-Ansprechen gegenüber 18,6 % in der Placebo-Gruppe. In dieser Untergruppe lag die mittlere prozentuale Veränderung des Pruritus NRS-Werts von der Baseline bis Woche 16 bei – 51,4 % unter Dupilumab 300 mg Q2W und bei – 30,2 % unter Placebo, beziehungsweise bis Woche 52 bei – 54,8 % in der Gruppe mit Dupilumab 300 mg Q2W und bei – 30,9 % in der Placebo-Gruppe.
Aufrechterhaltung und Dauer des Ansprechens (Studie SOLO CONTINUE)
Um Aufrechterhaltung und Dauer des Ansprechens zu untersuchen, wurden die Studienteilnehmer, die in den Studien SOLO 1 und SOLO 2 16 Wochen lang mit Dupilumab behandelt wurden und einen IGA-Wert von 0 oder 1 oder ein EASI-75-Ansprechen erreichten, im Rahmen der Studie SOLO CONTINUE erneut randomisiert. Diese Studie umfasste eine zusätzliche 36-wöchige Behandlung mit Dupilumab oder Placebo, sodass sich die Gesamtdauer der Studienbehandlung auf 52 Wochen belief. Die Beurteilung der Endpunkte erfolgte in Woche 51 oder 52.
Die co-primären Endpunkte waren der Unterschied zwischen der Baseline (Woche 0) und Woche 36 gemessen an der prozentualen Veränderung des EASI-Score gegenüber der Baseline der Studien SOLO 1 und SOLO 2 sowie der prozentuale Anteil an Patienten mit einem EASI-75-Ansprechen in Woche 36 bei Patienten, die bereits bei Behandlungsbeginn ein EASI-75-Ansprechen hatten.
Bei Patienten, die dasselbe Behandlungsschema beibehielten, mit dem sie in den Studien SOLO 1 und SOLO 2 behandelt worden waren (300 mg Q2W oder 300 mg QW; letzteres Dosierungsschema ist in der Schweiz nicht zugelassen), konnte ein optimaler Erhaltungseffekt des klinischen Ansprechens nachgewiesen werden, wohingegen sich die Wirksamkeit bei anderen Dosierungsschemata dosisabhängig verringerte.
Sowohl die primären als auch die sekundären Endpunkte der 52-wöchigen Studie SOLO CONTINUE sind in Tabelle 4 zusammengefasst.
Tabelle 4: Ergebnisse der primären und sekundären Endpunkte der Studie SOLO CONTINUE
|
|
Placebo
|
Dupilumab 300 mg
| |
|
N = 83
|
Q8W
N = 84
|
Q2W/QW
N = 169
| |
Co-primäre Endpunkte
| |
Mittlerer Unterschied (LS) (+/– SE) zwischen der Baseline und Woche 36 in prozentualer EASI-Veränderung gegenüber der Baseline der Vorläufer-Studien
|
21,7
(3,13)
|
6,8***
(2,43)
|
0,1***
(1,74)
| |
Prozentualer Anteil an Patienten mit EASI-75-Ansprechen in Woche 36 bei Patienten mit EASI-75-Ansprechen bei der Baseline (n [%])
|
24/79
(30,4 %)
|
45/82*
(54,9 %)
|
116/162***
(71,6 %)
| |
Wichtige sekundäre Endpunkte:
| |
Prozentualer Anteil an Patienten, deren IGA-Wert in Woche 36 um nicht mehr als 1 Punkt vom Baseline-Wert abwich, unter den Patienten mit IGA 0 oder 1 bei der Baseline (n [%])
|
18/63
(28,6)
|
32/64†
(50,0)
|
89/126***
(70,6)
| |
Prozentualer Anteil an Patienten mit einem IGA-Wert von 0 oder 1 in Woche 36 unter den Patienten mit IGA von 0 oder 1 bei der Baseline (n [%])
|
9/63
(14,3)
|
21/64†
(32,8)
|
68/126***
(54,0)
| |
Prozentualer Anteil an Patienten, deren maximaler Pruritus NRS-Wert von der Baseline bis Woche 35 um ≥3 Punkte anstieg, unter den Patienten mit einem maximalen Baseline-Pruritus
NRS-Wert ≤7 (n [%])
|
56/80
(70,0)
|
45/81
(55,6)
|
57/168***
(33,9)
|
† p < 0,05; *p < 0,01; **p < 0,001; ***p ≤0,0001
In der Studie SOLO CONTINUE wurde bei verlängerten Dosierungsintervallen eine Tendenz zu einer behandlungsbedingten stärkeren Produktion von Antikörpern gegen den Wirkstoff (Anti-Drug Antibodies, ADA) beobachtet.
Behandlungsbedingte ADA-Reaktionen: QW: 1,2 %; Q2W: 4,3 %; Q4W: 6,0 %; Q8W: 11,7 %. ADA-Reaktionen, die länger als 12 Wochen andauerten: QW: 0,0 %; Q2W: 1,4 %; Q4W: 0,0 %; Q8W: 2,6 %.
Lebensqualität/von Patienten berichtete Ergebnisse (Patient Reported Outcomes, PRO)
In den Studien SOLO 1 und SOLO 2 wurde mit Dupilumab im Vergleich zu Placebo gemäss der POEM-, der DLQI- und der HADS-Gesamtbewertung eine signifikante Verbesserung der Symptome der AD, der gesundheitsbezogenen Lebensqualität sowie der Angst- und Depressionssymptome erzielt.
In der CHRONOS-Studie wurde mit Dupilumab im Vergleich zu Placebo gemäss der POEM- und der DLQI-Gesamtbewertung nach 16 Wochen eine signifikante Verbesserung der Symptome der AD und der gesundheitsbezogenen Lebensqualität erzielt.
In den Studien SOLO 1 und SOLO 2 waren die mittleren Veränderungen (± SE) der Least Squares der POEM-, der DLQI- und der HADS-Gesamtbewertung von der Baseline bis Woche 16 bei Patienten, die Dupilumab erhielten, signifikant höher als bei Placebo-Patienten (p < 0,0001 für alle Vergleiche ausser HADS in der Studie SOLO 2, p < 0,001), siehe Tabelle 5.
In der Studie CHRONOS waren die mittleren Veränderungen (± SE) der Least Squares der POEM- und der DLQI-Gesamtbewertung von der Baseline bis Woche 16 bei Patienten, die Dupilumab erhielten, signifikant höher als bei Placebo-Patienten (p < 0,0001 für alle Vergleiche), siehe Tabelle 5.
Tabelle 5: Zusätzliche Ergebnisse der sekundären Endpunkte der Dupilumab-Behandlung mit oder ohne TCS in Woche 16
|
|
Monotherapie in Woche 16
|
Begleitende Therapie mit TCS in Woche 16
| |
|
SOLO 1
|
SOLO 2
|
CHRONOS
| |
|
Placebo
|
Dupilumab
300 mg Q2W
|
Placebo
|
Dupilumab
300 mg Q2W
|
Placebo
|
Dupilumab
300 mg Q2W
| |
Randomisierte Patienten
|
224
|
224
|
236
|
233
|
315
|
106
| |
POEM, mittlere Veränderung (LS) gegenüber der Baseline (SE)
|
-5,1
(0,67)
|
-11,6a
(0,49)
|
-3,3
(0,55)
|
-10,2a
(0,49)
|
-5,3
(0,41)
|
-12,7a
(0,64)
| |
DLQI, mittlere Veränderung (LS) gegenüber der Baseline (SE)
|
-5,3
(0,50)
|
-9,3a
(0,40)
|
-3,6
(0,50)
|
-9,3a
(0,38)
|
-5,8
(0,34)
|
-10,0a
(0,50)
|
LS = Least Squares [Methode der kleinsten Quadrate]; SE = Standard Error [Standardfehler]
a p < 0,0001
2) Klinische Wirksamkeit und Sicherheit bei Jugendlichen mit atopischer Dermatitis:
Die Wirksamkeit und Sicherheit einer Monotherapie mit Dupilumab bei Jugendlichen wurden in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AD-1526) bei 251 jugendlichen Patienten von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis (AD) beurteilt. Diese wurde definiert als ein Wert ≥3 gemäss IGA (Investigator's Global Assessment) bei der Gesamtbeurteilung der AD-Läsionen auf einer Schweregrad-Skala von 0 bis 4, ein Wert ≥16 gemäss EASI (Eczema Area and Severity Index) auf einer Skala von 0 bis 72 und eine betroffene Körperoberfläche (Body Surface Area, BSA) ≥10 %. Patienten, die für die Studie geeignet waren und in diese eingeschlossen wurden, hatten zuvor nur unzureichend auf eine topische Medikation angesprochen.
Die Patienten erhielten:
1.eine Anfangsdosis von 400 mg Dupilumab (zwei Injektionen zu je 200 mg) an Tag 1, gefolgt von 200 mg einmal alle zwei Wochen (Q2W) bei einem Ausgangsgewicht von < 60 kg oder eine Anfangsdosis von 600 mg Dupilumab (zwei Injektionen zu je 300 mg) an Tag 1, gefolgt von 300 mg Q2W, bei einem Ausgangsgewicht von ≥60 kg;
2.eine Anfangsdosis von 600 mg Dupilumab (zwei Injektionen zu je 300 mg) an Tag 1, gefolgt von 300 mg alle 4 Wochen (Q4W), unabhängig vom Ausgangsgewicht oder
3.ein entsprechendes Placebo.
Dupilumab wurde als subkutane (s. c.) Injektion verabreicht. Um als unerträglich empfundene Symptome der atopischen Dermatitis zu lindern, konnten die Patienten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten. Patienten, die eine Rescue-Therapie erhielten, wurden als Non-Responder eingestuft.
In dieser Studie betrug das mittlere Alter 14,5 Jahre, das mediane Körpergewicht 59,4 kg, 41,0 % der Patienten waren weiblich, 62,5 % Weisse, 15,1 % Asiaten und 12,0 % Schwarze. Zu Studienbeginn hatten 46,2 % der Patienten einen Baseline-IGA-Wert von 3 (mittelschwere AD), 53,8 % einen Baseline-IGA-Wert von 4 (schwere AD), die mittlere BSA-Beteiligung betrug 56,5 %, und 42,4 % der Patienten hatten in der Vergangenheit systemische Immunsuppressiva erhalten. Bei der Aufnahme in die Studie betrug der mittlere EASI-Wert 35,5, der wöchentliche Durchschnittswert gemäss Pruritus NRS (Numeral Rating Scale) 7,6, der mittlere SCORAD (SCORing Atopic Dermatitis)-Wert 70,3, der mittlere POEM (Patient Oriented Eczema Measure)-Wert 21,0 und der mittlere CDLQI (Children Dermatology Life Quality Index)-Wert 13,6. Insgesamt lag bei 92,0 % der Patienten mindestens eine allergische Begleiterkrankung vor; 65,6 % hatten allergische Rhinitis, 53,6 % Asthma und 60,8 % Nahrungsmittelallergien.
Co-primäre Endpunkte waren der Anteil der Patienten mit IGA 0 oder 1 mit einer Verbesserung um mindestens 2 Punkte und der Anteil der Patienten mit EASI-75 (EASI-Verbesserung um mindestens 75 %) zwischen Baseline und Woche 16. Die weiteren beurteilten Endpunkte umfassten den Anteil der Patienten mit EASI-50 bzw. EASI-90 (EASI-Verbesserung von mindestens 50 % bzw. 90 % gegenüber Baseline), die Verringerung des Juckreizes gemäss Peak Pruritus NRS und die prozentuale Veränderung auf der SCORAD-Skala zwischen Baseline und Woche 16. Zusätzliche sekundäre Endpunkte beinhalteten die mittlere Veränderung des POEM- und CDLQI-Scores zwischen Baseline und Woche 16.
Klinische Wirksamkeit
Die Wirksamkeitsergebnisse aus Woche 16 der Studie für atopische Dermatitis bei Jugendlichen sind in der Tabelle unten angegeben.
Tabelle 6: Wirksamkeitsergebnisse der Dupilumab-Therapie aus Woche 16 der Studie für atopische Dermatitis bei Jugendlichen (FAS)
|
|
AD-1526 (FAS)a
| |
|
Placebo
|
Dupilumab 200 mg (< 60 kg) und 300 mg (≥60 kg) Q2W
| |
Randomisierte Patienten
|
85a
|
82a
| |
IGA 0 oder 1b, % Responderc
|
2,4 %
|
24,4 %
| |
EASI-50, % Responderc
|
12,9 %
|
61,0 %
| |
EASI-75, % Responderc
|
8,2 %
|
41,5 %
| |
EASI-90, % Responderc
|
2,4 %
|
23,2 %
| |
EASI, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-23,6 %
(5,49)
|
-65,9 %
(3,99)
| |
SCORAD, mittlere LS-Veränderung in % gegenüber Baseline
(+/- SE)
|
-17,6 %
(3,76)
|
-51,6 %
(3,23)
| |
Pruritus NRS, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-19,0 %
(4,09)
|
-47,9 %
(3,43)
| |
Pruritus NRS (> 4 Punkte Verbesserung), % Responderc
|
4,8 %
|
36,6 %
| |
BSA, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-11,7 %
(2,72)
|
-30,1 %
(2,34)
| |
CDLQI, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-5,1
(0,62)
|
-8,5
(0,50)
| |
CDLQI (≥6 Punkte Verbesserung), % Responder
|
19,7 %
|
60,6 %
| |
POEM, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-3,8
(0,96)
|
-10,1
(0,76)
| |
POEM (≥ 6 Punkte Verbesserung), % Responder
|
9,5 %
|
63,4 %
|
a Die FAS- (Full Analysis Set [Gesamtanalyse-Datensatz]) Population umfasst alle randomisierten Patienten.
b Responder wurde definiert als ein Patient mit IGA 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei») mit einer Verbesserung um ≥2 Punkte auf einer von 0 bis 4 reichenden IGA-Skala.
c Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft (58,8 % im Placebo-Arm und 20,7 % im Dupilumab-Arm).
Alle p-Werte < 0,0001.
Ein grösserer Anteil der in die Placebo-Gruppe randomisierten Patienten benötigte eine Rescue-Therapie (topische Kortikosteroide, systemische Kortikosteroide oder systemische nichtsteroidale Immunsuppressiva) im Vergleich zur Dupilumab-Gruppe (58,8 % bzw. 20,7 %).
Im Vergleich zu Placebo erreichte ein signifikant höherer Anteil der in die Dupilumab-Gruppe randomisierten Patienten eine schnelle Verbesserung gemäss Pruritus NRS (definiert als Verbesserung um > 4 Punkte bereits in Woche 4; nominaler p-Wert < 0,001); im Laufe des Behandlungszeitraums stieg der Patientenanteil mit einem Ansprechen gemäss Pruritus NRS weiterhin an (siehe Abbildung unten). Die Verbesserung gemäss Pruritus NRS trat im Zusammenhang mit einer Verbesserung der objektiven Anzeichen der atopischen Dermatitis auf.
Anteil der Jugendlichen mit einer Verbesserung um ≥4 Punkte gemäss Pruritus NRS in der AD-1526-Studie (FAS)b
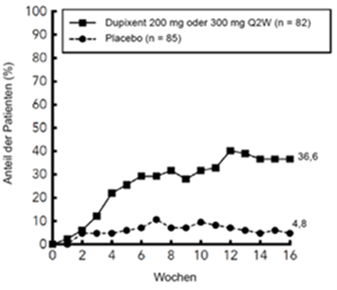
a In den Primäranalysen der Wirksamkeitsendpunkte wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die FAS- (Full Analysis Set [Gesamtanalyse-Datensatz]) Population umfasst alle randomisierten Patienten.
Im Vergleich zu Placebo wurde in der Dupilumab-Gruppe in Woche 16 eine signifikante Verbesserung der von Patienten angegebenen Symptome verzeichnet. Dies galt auch für die Auswirkungen der AD auf die Schlafqualität und die gesundheitsbezogene Lebensqualität gemäss den POEM-, SCORAD- und CDLQI-Werten.
Die langfristige Wirksamkeit von Dupilumab bei Jugendlichen mit mittelschwerer bis schwerer AD, die an den vorherigen klinischen Studien mit Dupilumab teilgenommen hatten, wurde in einer unverblindeten Verlängerungsstudie (AD-1434) untersucht. Wirksamkeitsdaten aus dieser Studie weisen darauf hin, dass der in Woche 16 erzielte klinische Nutzen bis einschliesslich Woche 52 anhielt.
3) Klinische Wirksamkeit und Sicherheit bei Kindern (6 bis 11 Jahre) mit atopischer Dermatitis
Die Wirksamkeit und Sicherheit der Anwendung von Dupilumab in Kombination mit TCS bei pädiatrischen Patienten wurden in einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie (AD-1652) mit 367 Patienten im Alter von 6 bis 11 Jahren untersucht. Atopische Dermatitis wurde dabei definiert als ein Wert von 4 gemäss IGA (Skala von 0 bis 4), ein Wert ≥21 gemäss EASI (Skala von 0 bis 72) und eine betroffene Körperoberfläche (Body Surface Area, BSA) von ≥15 %. Patienten, die für die Studie geeignet waren und in diese eingeschlossen wurden, hatten zuvor nur unzureichend auf eine topische Medikation angesprochen. Die Rekrutierung erfolgte stratifiziert nach Ausgangsgewicht (< 30 kg; ≥30 kg).
Patienten in der Gruppe Dupilumab Q4W + TCS erhielten unabhängig vom Gewicht eine Anfangsdosis von 600 mg an Tag 1, gefolgt von 300 mg Q4W von Woche 4 bis Woche 12. Patienten in der Gruppe Dupilumab Q2W + TCS mit einem Ausgangsgewicht von < 30 kg erhielten eine Anfangsdosis von 200 mg an Tag 1, gefolgt von 100 mg Q2W von Woche 2 bis Woche 14; Patienten mit einem Ausgangsgewicht von ≥30 kg erhielten eine Anfangsdosis von 400 mg an Tag 1, gefolgt von 200 mg Q2W von Woche 2 bis Woche 14. Die Patienten konnten nach Ermessen des Prüfarztes eine Rescue-Therapie erhalten. Patienten, die eine Rescue-Therapie erhielten, wurden als Non-Responder eingestuft.
In der Studie AD-1652 betrug das mittlere Alter 8,5 Jahre, das mediane Körpergewicht 29,8 kg, 50 % der Patienten waren weiblich, 69,2 % Weisse, 16,7 % Schwarze und 7,6 % Asiaten. Zu Beginn betrug die mittlere BSA-Beteiligung 57,6 %, und 16,9 % hatten in der Vergangenheit bereits systemische nichtsteroidale Immunsuppressiva erhalten. Zu Beginn betrug der mittlere EASI-Score 37,9, der wöchentliche Durchschnittswert des täglich stärksten Juckreizes lag bei 7,8 auf einer Skala von 0 bis 10, der mittlere SCORAD bei der Baseline betrug 73,6, der mittlere POEM 20,9 und der mittlere CDLQI 15,1. Insgesamt lag bei 91,7 % der Patienten mindestens eine allergische Begleiterkrankung vor; 64,4 % hatten Nahrungsmittelallergien, 62,7 % andere Allergien, 60,2 % allergische Rhinitis und 46,7 % Asthma.
Primärer Endpunkt war der Anteil der Patienten mit IGA 0 («erscheinungsfrei») oder 1 («fast erscheinungsfrei») in Woche 16. Die weiteren untersuchten Resultate umfassten den Anteil der Patienten mit EASI-75 bzw. EASI-90 (EASI-Verbesserung von mindestens 75 % bzw. 90 % gegenüber Baseline), die prozentuale Veränderung des EASI-Scores zwischen Baseline und Woche 16 sowie die Verringerung des Juckreizes gemäss Pruritus NRS (Verbesserung um ≥4 Punkte). Zusätzliche sekundäre Endpunkte beinhalteten die mittlere Veränderung des POEM- und CDLQI-Scores zwischen Baseline und Woche 16.
Tabelle 7 zeigt die nach Ausgangsgewicht stratifizierten Ergebnisse für die zugelassenen Dosierungsschemata.
Tabelle 7: Wirksamkeitsergebnisse von DUPIXENT mit begleitenden TCS in der Studie AD-1652 in Woche 16 (FAS)a
|
|
DUPIXENT
300 mg Q4Wd
+ TCS
(N = 61)
|
Placebo
+ TCS
(N = 61)
|
DUPIXENT
200 mg Q2We
+ TCS
(N = 59)
|
Placebo
+ TCS
(N = 62)
| |
< 30 kg
|
< 30 kg
|
≥30 kg
|
≥30 kg
| |
IGA 0 oder 1 b, % Responderc
|
29,5 %
|
13,1 %
|
39,0 %
|
9,7 %
| |
EASI-50, % Responderc
|
95,1 %
|
42,6 %
|
86,4 %
|
43,5 %
| |
EASI-75, % Responderc
|
75,4 %
|
27,9 %
|
74,6 %
|
25,8 %
| |
EASI-90, % Responderc
|
45,9 %
|
6,6 %
|
35,6 %
|
8,1 %
| |
EASI, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-84,3 %
(3,08)
|
-49,1 %
(3,30)
|
-80,4 %
(3,61)
|
-48,3 %
(3,63)
| |
SCORAD, mittlere LS-Veränderung in % gegenüber Baseline
(+/- SE)
|
-65,3 %
(2,87)
|
-28,9 %
(3,05)
|
-62,7 %
(3,14)
|
-30,7 %
(3,28)
| |
Pruritus NRS, mittlere LS-Veränderung in % gegenüber Baseline (+/- SE)
|
-55,1 %
(3,94)
|
-27,0 %
(4,24)
|
-58,2 %
(4,01)
|
-25,0 %
(3,95)
| |
Pruritus NRS (≥4 Punkte Verbesserung), % Responderc
|
54,1 %
|
11,7 %
|
61,4 %
|
12,9 %
| |
CDLQI, mittlere LS-Veränderung gegenüber Baseline (+/- SE)
|
-11,5
(0,69)
|
-7,2
(0,76)
|
-9,8
(0,63)
|
-5,6
(0,66)
| |
CDLQI (≥6 Punkte Verbesserung), % Responder
|
81,8 %
|
48,3 %
|
80,8 %
|
35,8 %
| |
POEM, mittlere LS-Veränderung gegenüber Baseline (+/- SE)
|
-14,0
(0,95)
|
-5,9
(1,04)
|
-13,6
(0,90)
|
-4,7
(0,91)
|
a Die FAS- (Full Analysis Set [Gesamtanalyse-Datensatz]) Population umfasst alle randomisierten Patienten.
b Responder wurde definiert als ein Patient mit IGA 0 oder 1 («erscheinungsfrei» oder «fast erscheinungsfrei»).
c Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, wurden als Non-Responder eingestuft.
d An Tag 1 erhielten die Patienten 600 mg Dupilumab.
e An Tag 1 erhielten die Patienten 200 mg (Ausgangsgewicht < 30 kg) oder 400 mg (Ausgangsgewicht ≥30 kg) DUPIXENT.
Im Vergleich zu Placebo + TCS erreichte ein grösserer Anteil an Patienten, die randomisiert Dupilumab + TCS erhielten, eine Verbesserung gemäss Pruritus NRS (definiert als Verbesserung ≥4 Punkte in Woche 16). Siehe Abbildung 5.
Abbildung 5: Anteil der pädiatrischen Patienten mit einer Verbesserung um ≥4 Punkte auf der Pruritus NRS in Woche 16 der Studie AD-1652a (FAS)b
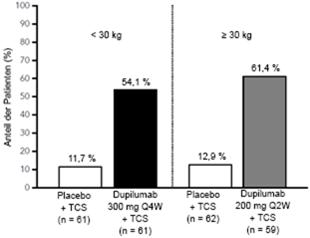
a In den Primäranalysen der Wirksamkeitsparameter wurden Patienten, die eine Rescue-Therapie erhielten oder bei denen Daten fehlten, als Non-Responder eingestuft.
b Die FAS- (Full Analysis Set [Gesamtanalyse-Datensatz]) Population umfasst alle randomisierten Patienten.
Im Vergleich zu Placebo wurde in der Dupilumab-Gruppe in Woche 16 eine signifikante Verbesserung der von Patienten angegebenen Symptome verzeichnet. Dies galt auch für die Auswirkungen der AD auf die Schlafqualität und die gesundheitsbezogene Lebensqualität gemäss den POEM-, SCORAD- und CDLQI-Werten.
Die langfristige Wirksamkeit von Dupilumab + TCS bei pädiatrischen Patienten mit atopischer Dermatitis, die an den vorherigen klinischen Studien mit Dupilumab + TCS teilgenommen hatten, wurde in einer unverblindeten Verlängerungsstudie (AD-1434) untersucht. In dieser Studie zeigten die in Woche 52 verfügbaren nicht kontrollierten Daten zu 45 Patienten, dass der Anteil der Patienten mit klinisch bedeutsamen IGA- oder EASI-Verbesserungen im Laufe der Zeit stabil blieb.
4) Klinische Wirksamkeit und Sicherheit bei Erwachsenen und Jugendlichen mit Asthma:
Das Entwicklungsprogramm zu Asthma beinhaltete drei randomisierte, doppelblinde, placebokontrollierte, multizentrische Parallelgruppenstudien (DRI12544, QUEST und VENTURE) mit 24- bis 52-wöchiger Behandlungsdauer, in die insgesamt 2'888 Patienten (ab 12 Jahren) eingeschlossen wurden.
Die Patienten wurden unabhängig von ihren Eosinophilwerten im Blut bzw. ihrer FeNO- oder IgE-Konzentration aufgenommen.
In den Studien DRI12544 und QUEST umfassten die präspezifizierten Subgruppenanalysen Eosinophil-(EOS-)Werte im Blut von ≥150 und ≥300 Zellen/μl.
Bei DRI12544 handelte es sich um eine 24-wöchige Dosisfindungsstudie, in die 776 Patienten (ab 18 Jahren) eingeschlossen wurden. Dupilumab wurde bei erwachsenen Patienten mit mittelschwerem bis schwerem Asthma, die ein mittel- bis hochdosiertes inhalatives Kortikosteroid und ein langwirksames Beta-2-Sympathomimetikum anwendeten, im Vergleich zu Placebo beurteilt. Der primäre Endpunkt war die Veränderung des FEV1 (l) zwischen dem Ausgangswert und Woche 12 bei Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/mcl. Die schweren Asthma-Exazerbationsereignisse während des 24-wöchigen placebokontrollierten Behandlungszeitraums wurden ebenfalls für einen einjährigen Zeitraum bestimmt. Die Auswertung der Ergebnisse erfolgte für die Gesamtpopulation (ohne Einschränkung des Mindestausgangswerts für Eosinophile) und Subgruppen, die auf dem Eosinophilen-Ausgangswert im Blut beruhten.
Bei QUEST handelte es sich um eine 52-wöchige konfirmatorische Studie, in die 1'902 Patienten (ab 12 Jahren) eingeschlossen wurden. Dupilumab im Vergleich zu Placebo wurde bei 107 jugendlichen und 1'795 erwachsenen Patienten mit persistierendem Asthma, die ein mittel- bis hochdosiertes inhalatives Kortikosteroid (ICS) und ein zweites Arzneimittel als Basistherapie anwendeten, beurteilt. Patienten, die ein drittes Arzneimittel als Basistherapie benötigten, durften an dieser Studie teilnehmen. Nach der Randomisierung erhielten die Patienten entweder 200 mg (n = 631) oder 300 mg (n = 633) Dupilumab alle zwei Wochen (oder das entweder 200 mg (n = 317) oder 300 mg (n = 321) entsprechende Placebo alle zwei Wochen) nach einer Anfangsdosis von 400 mg bzw. 600 mg bzw. Placebo. Die primären Endpunkte waren die Jahresrate schwerer Exazerbationsereignisse während des 52-wöchigen placebokontrollierten Zeitraums und die Veränderung des FEV1 vor Anwendung eines Bronchodilatators zwischen der Baseline und Woche 12 in der Gesamtpopulation (ohne Einschränkung des Mindestausgangswerts für Eosinophile).
Die sekundären Endpunkte umfassten die Jahresrate schwerer Exazerbationsereignisse und FEV1 in den Subgruppen, die auf dem Eosinophilen-Ausgangswert im Blut beruhten.
Bei VENTURE handelte es sich um eine 24-wöchige Studie zur Reduktion von oralen Kortikosteroiden (OCS) bei 210 Asthmapatienten ohne Einschränkung der Biomarker-Ausgangswerte für die Typ-2-Inflammation, die täglich orale Kortikosteroide zusätzlich zur regelmässigen Anwendung hochdosierter inhalativer Kortikosteroide plus ein weiteres Arzneimittel als Basistherapie benötigten. Nach Optimierung der OCS-Dosis während des Screeningzeitraums erhielten die Patienten 300 mg Dupilumab (n = 103) oder Placebo (n = 107) einmal alle zwei Wochen über 24 Wochen, nach einer Anfangsdosis von 600 mg oder Placebo. Während der Studie erhielten die Patienten weiter ihre bestehende Asthmamedikation, die OCS-Dosis wurde jedoch während der OCS-Reduktionsphase (Woche 4–20) alle 4 Wochen verringert, solange die Asthmakontrolle aufrechterhalten werden konnte. Der primäre Endpunkt war die prozentuale Verringerung der oralen Kortikosteroiddosis, beurteilt in der Gesamtpopulation, beruhend auf einem Vergleich der oralen Kortikosteroiddosis in den Wochen 20 bis 24, bei der die Asthmakontrolle aufrechterhalten wurde, mit der zuvor (bei Studienbeginn) optimierten Dosis oraler Kortikosteroide in der Gesamtpopulation (ohne Einschränkung des Mindestausgangswerts für Eosinophile). Weitere sekundäre Endpunkte umfassten die Jahresrate schwerer Exazerbationsereignisse im Behandlungszeitraum und den Prozentsatz der Responder beim ACQ-5- und AQLQ-Score (S).
Die demografischen Angaben und Baseline-Charakteristika bzgl. Asthma sind für diese 3 Studien in nachfolgender Tabelle 8 dargestellt.
Tabelle 8: Demografische Angaben und Baseline-Charakteristika in den Asthma-Studien
|
Parameter
|
DRI12544
(n = 776)
|
QUEST
(n = 1'902)
|
VENTURE
(n = 210)
| |
Mittleres Alter in Jahren (SD)
|
48,6 (13,0)
|
47,9 (15,3)
|
51,3 (12,6)
| |
% weiblich
|
63,1
|
62,9
|
60,5
| |
% weiss
|
78,2
|
82,9
|
93,8
| |
Dauer des Asthmas (Jahre), Mittelwert ± SD
|
22,03 (15,42)
|
20,94 (15,36)
|
19,95 (13,90)
| |
Nie geraucht, (%)
|
77,4
|
80,7
|
80,5
| |
Mittlere Anzahl der Exazerbationen im vorherigen Jahr ± SD
|
2,17 (2,14)
|
2,09 (2,15)
|
2,09 (2,16)
| |
Anwendung hochdosierter ICS (%)a
|
49,5
|
51,5
|
88,6
| |
FEV1 (l) vor Verabreichung bei der Baseline ± SD
|
1,84 (0,54)
|
1,78 (0,60)
|
1,58 (0,57)
| |
Mittlere prozentuelle Abweichung des FEV1 bei der Baseline (%) (± SD)
|
60,77 (10,72)
|
58,43 (13,52)
|
52,18 (15,18)
| |
% Reversibilität (± SD)
|
26,85 (15,43)
|
26,29 (21,73)
|
19,47 (23,25)
| |
Mittlerer ACQ-5-Score (± SD)
|
2,74 (0,81)
|
2,76 (0,77)
|
2,50 (1,16)
| |
Mittlerer AQLQ-Score (± SD)
|
4,02 (1,09)
|
4,29 (1,05)
|
4,35 (1,17)
| |
Atopische Krankheiten in der Anamnese% insgesamt
(AD %, NP %, AR %)
|
72,9
(8,0, 10,6, 61,7)
|
77,7
(10,3, 12,7, 68,6)
|
72,4
(7,6, 21,0, 55,7)
| |
Mittelwert FeNO in ppb (± SD)
|
39,10 (35,09)
|
34,97 (32,85)
|
37,61 (31,38)
| |
% Patienten mit FeNO ppb
| |
≥25
≥50
|
49,9
21,6
|
49,6
20,5
|
54,3
25,2
| |
Mittelwert Gesamt-IgE, I.E./ml (± SD)
|
435,05 (753,88)
|
432,40 (746,66)
|
430,58 (775,96)
| |
Mittlere Eosinophilenzahl bei der Baseline (± SD) in Zellen/µl
|
350 (430)
|
360 (370)
|
350 (310)
| |
% Patienten mit EOS
| |
≥150 Zellen/µl
|
77,8
|
71,4
|
71,4
| |
≥300 Zellen/µl
|
41,9
|
43,7
|
42,4
|
ICS = inhalatives Kortikosteroid; FEV1 = Einsekundenkapazität; ACQ-5 = Fragebogen zur Asthmakontrolle (Asthma Control Questionnaire-5); AQLQ = Fragebogen zur Lebensqualität bei Asthma (Asthma Quality of Life Questionnaire); AD = atopische Dermatitis; NP = Nasenpolypen; AR = allergische Rhinitis; FeNO = fraktioniertes exhaliertes Stickstoffmonoxid; EOS= Eosinophilenzahl im Blut
a Die Population, die in Studien zur Therapie von Asthma mit Dupilumab behandelt wurde, umfasste Patienten mit mittleren und hochdosierten ICS. Die mittlere ICS-Dosis war definiert als gleichwertig zu 500 μg Fluticason oder Äquivalent pro Tag.
Exazerbationen
Die Studien DRI12544 und QUEST untersuchten die Häufigkeit schwerer Asthmaexazerbationen, definiert als eine Verschlechterung des Asthmas, die die Anwendung systemischer Kortikosteroide über mindestens 3 Tage, eine Hospitalisierung oder einen Besuch der Notfallstation aufgrund eines Asthmas, das systemische Kortikosteroide erfordert, notwendig macht.
In der Primäranalysenpopulation (Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/mcl in der Studie DRI12544 und der Gesamtpopulation in der Studie QUEST) kam es bei den Teilnehmern, die DUPIXENT 200 mg oder 300 mg Q2W erhielten, zu einem signifikativen Rückgang der Rate schwerer Asthmaexazerbationen im Vergleich zu Placebo. In der Gesamtpopulation der Studie QUEST lag die Rate schwerer Exazerbationen bei 0,46 für DUPIXENT 200 mg Q2W bzw. 0,52 für DUPIXENT 300 mg Q2W, unter Placebo bei 0,87 bzw. 0,97.
Die Rate schwerer Exazerbationen im Vergleich zu Placebo lag bei 0,52 (95 %-KI: 0,41, 0,66) und 0,54 (95 %-KI: 0,43, 0,68) für DUPIXENT 200 mg Q2W bzw. 300 mg Q2W. Die Ergebnisse für die Patienten mit einem Eosinophilen-Ausgangswert im Blut ≥150 Zellen/mcl und ≥300 Zellen/mcl in den Studien DRI12544 und QUEST sind in Tabelle 7 dargestellt.
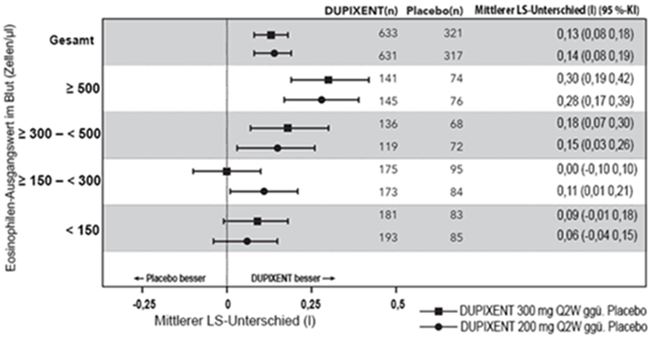
Die Responder-Quote nach Eosinophilen-Ausgangswert für die Studie QUEST ist in Abbildung 6 angegeben. Die präspezifizierten Subgruppenanalysen der Studien DRI12544 und QUEST belegten stärkere Verringerungen von schweren Exazerbationen bei Teilnehmern mit höheren Eosinophilen-Ausgangswerten im Blut. In der Studie QUEST war die Reduzierung von Exazerbationen in der Subgruppe mit einem Eosinophilen-Ausgangswert im Blut ≥150 Zellen/mcl signifikant. Bei Patienten mit Eosinophilen-Werten im Blut < 150 Zellen/mcl war die Rate schwerer Exazerbationen unter DUPIXENT und Placebo vergleichbar.
In der Studie QUEST lag die Rate schwerer Exazerbationen, die zu Hospitalisierungen und/oder Besuchen der Notfallstation führten, im Vergleich zu Placebo bei 0,53 (95 %-KI: 0,28, 1,03) und 0,74 (95 %-KI: 0,32, 1,70) unter DUPIXENT 200 mg bzw. 300 mg Q2W.
Tabelle 9: Rate schwerer Exazerbationen in DRI12544 und QUEST
|
Behandlung
|
EOS-Wert im Blut
| |
|
≥150 Zellen/mcl
|
≥300 Zellen/mcl
| |
Exazerbationen pro Jahr
|
% Reduktion
|
Exazerbationen pro Jahr
|
%
Reduktion
| |
N
|
Rate
(95 %-KI)
|
Raten-verhältnis (95 %-KI)
|
N
|
Rate
(95 %-KI)
|
Raten-verhältnis (95 %-KI)
| |
Schwere Exazerbationen gesamt
| |
DRI12544 Studie
| |
Dupilumab 200 mg Q2W
|
120
|
0,29
(0,16, 0,53)
|
0,28a
(0,14, 0,55)
|
72 %
|
65
|
0,30
(0,13, 0,68)
|
0,29c
(0,11, 0,76)
|
71 %
| |
Dupilumab 300 mg
Q2W
|
129
|
0,28
(0,16, 0,50)
|
0,27b
(0,14, 0,52)
|
73 %
|
64
|
0,20
(0,08, 0,52)
|
0,19d
(0,07, 0,56)
|
81 %
| |
Placebo
|
127
|
1,05
(0,69, 1,60)
|
|
|
68
|
1,04
(0,57, 1,90)
|
|
| |
QUEST Studie
| |
Dupilumab 200 mg
Q2W
|
437
|
0,45
(0,37, 0,54)
|
0,44e
(0,34,0,58)
|
56 %
|
264
|
0,37
(0,29, 0,48)
|
0,34e
(0,24,0,48)
|
66 %
| |
Placebo
|
232
|
1,01
(0,81, 1,25)
|
|
|
148
|
1,08
(0,85, 1,38)
|
|
| |
Dupilumab 300 mg
Q2W
|
452
|
0,43
(0,36, 0,53)
|
0,40 e
(0,31,0,53)
|
60 %
|
277
|
0,40
(0,32, 0,51)
|
0,33e
(0,23,0,45)
|
67 %
| |
Placebo
|
237
|
1,08
(0,88, 1,33)
|
|
|
142
|
1,24
(0,97, 1,57)
|
|
|
Abbildung 6: Risiko in Bezug auf die jährliche Rate schwerer Exazerbationen anhand der Eosinophilen-Ausgangswerte im Blut (Zellen/mcl) in QUEST

In der Studie QUEST verging bei Patienten unter DUPIXENT mehr Zeit bis zur ersten Exazerbation als bei Patienten unter Placebo (Abbildung 6).
Abbildung 7: Kaplan-Meier-Kurve der Zeit bis zur ersten schweren Exazerbation bei Patienten mit Eosinophilen-Ausgangswerten im Blut ≥300 Zellen/mcl (QUEST)a
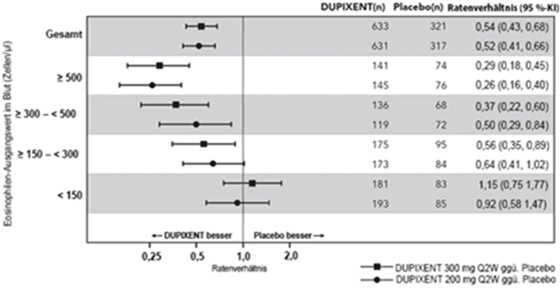
a Zum Zeitpunkt des Schliessens der Datenbank hatten noch nicht alle Patienten Woche 52 beendet.
Lungenfunktion
Klinisch signifikante Zunahmen des FEV1 vor Anwendung eines Bronchodilatators wurden in Woche 12 der Studien DRI12544 und QUEST in den Primäranalysenpopulationen (Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/mcl in der Studie DRI12544 und der Gesamtpopulation in der Studie QUEST) beobachtet. In der Gesamtpopulation der Studie QUEST lag die mittlere Veränderung des FEV1 (l) gegenüber dem Ausgangswert bei 0,32 l (21%) und 0,34 l (23 %) für DUPIXENT 200 mg Q2W bzw. 300 mg Q2W im Vergleich zur durchschnittlichen Veränderung unter Placebo von 0,18 l (12 %) bzw. 0,21 l (14 %).
Der mittlere Behandlungsunterschied gegenüber Placebo betrug 0,14 l (95 %-KI: 0,08, 0,19) bzw. 0,13 l (95 %-KI: 0,08, 0,18) für DUPIXENT 200 mg Q2W bzw. 300 mg Q2W. Die Ergebnisse bei den Patienten mit einem Eosinophilen-Ausgangswert im Blut ≥150 Zellen/mcl und ≥300 Zellen/mcl in den Studien DRI12544 und QUEST sind in Tabelle 10 aufgeführt. Die Verbesserungen des FEV1. je nach Eosinophilen-Ausgangswert für die Studie QUEST sind in Abbildung 8 dargestellt. Die Subgruppenanalyse der Studien DRI12544 und QUEST ergab eine grössere Verbesserung bei den Teilnehmern mit einem höheren Eosinophilen-Ausgangswert.
Tabelle 10: Mittlere Veränderung des FEV1 vor Anwendung eines Bronchodilatators gegenüber der Baseline in Woche 12 in DRI12544 und QUEST.
|
Behandlung
|
EOS-Ausgangswert im Blut
| |
|
≥150 Zellen/mcl
|
≥300 Zellen/mcl
| |
n
|
Mittlere LS-Veränderung
gegenüber der
Baseline
l (%)
|
Mittlerer LS-Unterschied
vs.
Placebo (95 %-
KI)
|
n
|
Mittlere LS-Veränderung
gegenüber der
Baseline
l (%)
|
Mittlerer LS-Unterschied
vs.
Placebo
(95 %-KI)
| |
Studie DRI12544
| |
Dupilumab200 mg Q2W
|
120
|
0,32 (18,25)
|
0,23a
(0,13, 0,33)
|
65
|
0,43 (25,9)
|
0,26c
(0,11, 0,40)
| |
Dupilumab300 mg Q2W
|
129
|
0,26 (17,1)
|
0,18b
(0,08, 0,27)
|
64
|
0,39 (25,8)
|
0,21d
(0,06, 0,36)
| |
Placebo
|
127
|
0,09 (4,36)
|
|
68
|
0,18 (10,2)
|
| |
Studie QUEST
| |
Dupilumab200 mg Q2W
|
437
|
0,36 (23,6)
|
0,17e
(0,11, 0,23)
|
264
|
0,43 (29,0)
|
0,21e
(0,13, 0,29)
| |
Placebo
|
232
|
0,18 (12,4)
|
|
148
|
0,21 (15,6)
|
| |
Dupilumab300 mg Q2W
|
452
|
0,37 (25,3)
|
0,15e
(0,09, 0,21)
|
277
|
0,47 (32,5)
|
0,24e
(0,16, 0,32)
| |
Placebo
|
237
|
0,22 (14,2)
|
|
142
|
0,22 (14,4)
|
|
a p-Wert < 0,0001, b p-Wert = 0,0004, c p-Wert = 0,0008, d p-Wert = 0,0063, e p-Wert < 0,0001
Abbildung 8: Mittlerer LS-Unterschied im Vergleich zu Placebo bzgl. FEV1 vor Anwendung eines Bronchodilatators gegenüber der Baseline in Woche 12 der QUEST-Studie anhand des Eosinophilen-Ausgangswerts im Blut (Zellen/mcl) in QUEST.
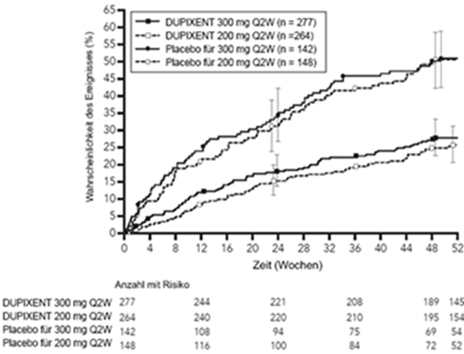
Die mittlere Veränderung des FEV1 im Zeitverlauf in der QUEST-Studie ist in Abbildung 9 dargestellt.
Abbildung 9: Mittlere Veränderung des FEV1 (l) vor Anwendung eines Bronchodilatators gegenüber der Baseline im Zeitverlauf bei Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/mcl (QUEST).
Weitere sekundäre Endpunkte:
Ergebnisse zur Lebensqualität / Patienten-berichtete Endpunkte bei Asthma
Endpunkte bezüglich ACQ-5 und AQLQ (S) wurden in der QUEST-Studie nach 52 Wochen analysiert. Die Responderrate war definiert als eine Verbesserung des Wertes um mindestens 0,5 Punkte (Skalenbereich 0-6 für ACQ-5 und 1-7 für AQLQ (S)).
·Die ACQ-5-Responderrate für Dupilumab 200 mg und 300 mg Q2W in der Gesamtpopulation betrug 69 % gegenüber 62 % unter Placebo (Odds Ratio 1,37; 95 %-KI: 1,01, 1,86) bzw. 69 % gegenüber 63 % unter Placebo (Odds Ratio 1,28; 95 %-KI: 0,94, 1,73). Die AQLQ(S)-Responderrate belief sich auf 62 % gegenüber 54 % unter Placebo (Odds Ratio 1,61; 95 %-KI: 1,17, 2,21) bzw. 62 % gegenüber 57 % unter Placebo (Odds Ratio 1,33; 95 %-KI: 0,98, 1,81).
·Die ACQ-5-Responderrate für Dupilumab 200 mg und 300 mg Q2W bei Patienten mit einem Eosinophilen-Ausgangswert ≥300 Zellen/ml betrug 75 % gegenüber 67 % unter Placebo (Odds Ratio: 1,46; 95 %-KI: 0,90, 2,35) bzw. 71% gegenüber 64 % unter Placebo (Odds Ratio: 1,39; 95 %-KI: 0,88, 2,19). Die AQLQ(S)-Responderrate belief sich auf 71 % gegenüber 55 % unter Placebo (Odds Ratio: 2,02; 95 %-KI: 1,24, 3,32) bzw. 65 % gegenüber 55 % unter Placebo (Odds Ratio: 1,79; 95 %-KI: 1,13, 2,85).
Studie zur Reduktion oraler Kortikosteroide (VENTURE)
In der VENTURE-Studie wurde die Wirkung von Dupilumab in Bezug auf die Reduktion der Anwendung oraler Kortikosteroide für die Erhaltungstherapie untersucht. Bei der Baseline lag die im Mittel angewendete Dosis oraler Kortikosteroide bei 12 mg in der Placebo-Gruppe und 11 mg in der Gruppe, die Dupilumab erhielt. Primärer Endpunkt war die Reduktionsrate der Enddosis oraler Kortikosteroide gegenüber der Baseline in Woche 24, bei der die Asthma-Kontrolle aufrechterhalten wurde.
Patienten, die mit Dupilumab behandelt wurden, erzielten im Vergleich zu Patienten unter Placebo eine stärkere Reduktion der täglichen Dosis oraler Kortikosteroide unter Aufrechterhaltung der Asthma-Kontrolle. Die durchschnittliche Reduktionsrate der täglichen OCS-Dosis gegenüber Baseline lag bei Patienten, die Dupilumab erhielten, bei 70 % (median 100 %) (95 %-KI: 60 %, 80 %) im Vergleich zu 42 % (median 50 %) bei Patienten unter Placebo (95 %-KI: 33 %, 51 %). Bei 82 % (80 %) der Patienten unter Dupilumab vs. 57 % (53 %) der Patienten unter Placebo wurden Reduktionen der OCS-Dosis von mindestens 50 % beobachtet. Der Anteil der Patienten mit einer durchschnittlichen Enddosis unter 5 mg in Woche 24 lag für Dupilumab bei 72 % und für Placebo bei 37 % (Odds Ratio 4,48; 95 %-KI: 2,39, 8,39). Insgesamt 54 (52 %) Patienten, die Dupilumab erhielten, im Vergleich zu 31 (29 %) Patienten in der Placebo-Gruppe erzielten eine Reduktion ihrer OCS-Dosis von 100 %.
In dieser 24-wöchigen Studie traten bei Patienten, die mit Dupilumab behandelt wurden, weniger Asthmaexazerbationen (definiert als vorübergehende Erhöhung der Dosis oraler Kortikosteroide über mindestens 3 Tage) auf als bei Patienten, die Placebo erhielten (annualisierte Rate 0,65 und 1,60 für die Dupilumab- bzw. Placebo-Gruppe; Odds Ratio 0,41 [95 %-KI 0,26, 0,63]), und die Verbesserung des FEV1 vor Anwendung eines Bronchodilatators zwischen der Baseline und Woche 24 war bei Patienten, die Dupilumab erhielten, grösser als unter Placebo (mittlere LS-Veränderung für Dupilumab versus Placebo von 0,22 l [95 %-KI: 0,09 bis 0,34 l]). Die Auswirkungen auf die Lungenfunktion, die Anwendung oraler Steroide und die Verringerung von Exazerbationen fielen, unabhängig von den Eosinophilen-Ausgangswerten im Blut, ähnlich aus. Die Fragebögen ACQ-5 und AQLQ(S) wurden in der VENTURE-Studie ebenfalls beurteilt und ergaben ähnliche Verbesserungen, wie sie in der QUEST-Studie festgestellt wurden.
Langzeit-Verlängerungsstudie (TRAVERSE)
Die Langzeitsicherheit von Dupilumab wurde in der offenen Verlängerungsstudie (TRAVERSE) bei 2193 Erwachsenen und 89 Jugendlichen mit mittelschwerem bis schwerem Asthma untersucht; darunter 185 Erwachsene mit oral steroidpflichtigem Asthma, die an früheren klinischen Studien mit Dupilumab (DRI12544, QUEST und VENTURE) teilgenommen hatten (siehe Abschnitt «Unerwünschte Wirkungen»). Die als sekundäres Beurteilungskriterium gemessene Wirksamkeit war mit den in den Zulassungsstudien beobachteten Ergebnissen vergleichbar und hielt bis zu 96 Wochen an. Bei Erwachsenen mit oral steroidpflichtigem Asthma wurde trotz Dosisreduktion bzw. Absetzen des oralen Kortikosteroids eine anhaltendende Verringerung der Exazerbationen sowie eine Verbesserung der Lungenfunktion während bis zu 96 Wochen beobachtet.
Weitere Informationen
Pädiatrische Population
Atopische Dermatitis:
Die Sicherheit und Wirksamkeit von Dupilumab bei pädiatrischen Patienten ab 6 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis wurden nachgewiesen.
Unterstützende Daten zur Anwendung von Dupilumab bei dieser Altersgruppe liefern die Studie AD-1526, in die 251 Jugendliche von 12 bis 17 Jahren mit mittelschwerer bis schwerer atopischer Dermatitis eingeschlossen wurden, und die Studie AD-1652, an der 367 Kinder von 6 bis 11 Jahren mit schwerer atopischer Dermatitis teilnahmen. Die Sicherheit und Wirksamkeit bei pädiatrischen und erwachsenen Patienten waren insgesamt konsistent.
Gestützt wird die Anwendung von Dupilumab auch von der Studie AD-1434, einer unverblindeten Verlängerungsstudie, in die Patienten eingeschlossen wurden, die zuvor die Studien AD-1526 oder AD-1652 abgeschlossen hatten. Die Studie AD-1434 schloss 136 Jugendliche aus der Studie AD-1526 und 110 Kinder aus der Studie AD-1652 mit mittelschwerer atopischer Dermatitis bei Einschluss in die Verlängerungsstudie ein. Die Studie AD-1434 umfasste 64 Jugendliche aus der Studie AD-1526 und 72 Kinder aus der Studie AD-1652 mit schwerer atopischer Dermatitis bei Einschluss in die Verlängerungsstudie. In der Studie AD-1434 wurden keine neuen Sicherheitserkenntnisse gefunden (siehe Abschnitt «Unerwünschte Wirkungen»).
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten unter 6 Jahren mit atopischer Dermatitis ist nicht erwiesen.
Asthma:
Insgesamt 107 Jugendliche im Alter von 12 bis 17 Jahren mit mittelschwerem bis schwerem Asthma wurden in die QUEST-Studie eingeschlossen und erhielten alle zwei Wochen entweder 200 mg (n = 21) oder 300 mg (n = 18) Dupilumab (oder entweder 200 mg [n = 34] oder 300 mg [n = 34] entsprechendes Placebo). Eine Wirksamkeit hinsichtlich schwerer Asthmaexazerbationen und der Lungenfunktion wurde sowohl bei Jugendlichen als auch bei Erwachsenen beobachtet. Für beide Dosierungen (200 mg und 300 mg alle 2 Wochen) wurden signifikante Verbesserungen des FEV1 (mittlere LS-Veränderung gegenüber der Baseline in Woche 12) beobachtet (0,36 l bzw. 0,27 l). Für die Dosis von 200 mg alle 2 Wochen war die Reduktion der Rate von schweren Exazerbationen bei den Patienten mit der Reduktion bei Erwachsenen vergleichbar. Die Sicherheit und Wirksamkeit bei Kindern und Jugendlichen (< 12 Jahren) mit schwerem Asthma sind nicht erwiesen. Im Allgemeinen war das Nebenwirkungsprofil bei Jugendlichen mit dem von Erwachsenen vergleichbar.
5) Klinische Wirksamkeit bei chronischer Rhinosinusitis mit Nasenpolypen (CRSwNP)
Das Entwicklungsprogramm zur chronischen Rhinosinusitis mit Nasenpolypen (CRSwNP) beinhaltete zwei randomisierte, doppelblinde, multizentrische, placebokontrollierte Parallelgruppenstudien (SINUS-24 und SINUS-52) mit 724 Patienten ab 18 Jahren, eingestellt auf intranasale Kortikosteroide (INCS) als Hintergrundbehandlung. Diese Studien schlossen Patienten ein, die trotz vorherigem operativem Eingriff an den Nasennebenhöhlen oder Behandlung mit systemischen Kortikosteroiden in den vergangenen 2 Jahren unter einer schweren CRSwNP litten bzw. die für eine Therapie mit systemischen Kortikosteroiden in den vergangenen 2 Jahren nicht in Frage kamen. Es lag im Ermessen des Prüfarztes, Notfallmedikation mit systemischen Kortikosteroiden oder einen operativen Eingriff während der Studien zu veranlassen.
In der SINUS-24-Studie wurden insgesamt 276 Patienten randomisiert und erhielten für 24 Wochen entweder 300 mg Dupilumab (n = 143) oder Placebo (n = 133) alle zwei Wochen. In der SINUS-52-Studie wurden 448 Patienten randomisiert und erhielten entweder für 52 Wochen 300 mg Dupilumab (n = 150) alle zwei Wochen oder bis Woche 24 300 mg Dupilumab (n = 145) alle zwei Wochen, gefolgt von 300 mg Dupilumab alle 4 Wochen bis Woche 52, oder Placebo (n = 153). Alle Patienten zeigten eine Verschattung der Nasennebenhöhlen im Lund-MacKay-Gesamt-CT-Score (LMK), und 73 % bis 90 % der Patienten wiesen eine Verschattung aller Nasennebenhöhlen auf. Patienten wurden stratifiziert anhand ihrer vorherigen operativen Eingriffe und ihres komorbiden Asthmas/Analgetika-Intoleranz-Syndroms (nonsteroidal anti-inflammatory drug exacerbated respiratory disease, NSAID-ERD).
Die koprimären Wirksamkeitsendpunkte waren die Veränderung des bilateralen endoskopischen Nasenpolypenscores (NPS), bewertet von zentral verblindeten Prüfern, zwischen dem Ausgangswert und dem Wert in Woche 24 sowie die Veränderung des über 28 Tage gemittelten Scores der nasalen Kongestion/Obstruktion (NC), ermittelt durch Patienten anhand von Tagebüchern, zwischen dem Ausgangswert und dem Wert in Woche 24. Bei dem NPS wurden Polypen auf jeder Seite der Nase auf einer kategorialen Skala beurteilt (0 = keine Polypen; 1 = kleine Polypen im mittleren Nasengang, die nicht weiter als bis zur unteren Grenze der mittleren Nasenmuschel reichen; 2 = Polypen, die weiter als bis zur unteren Grenze der mittleren Nasenmuschel reichen; 3 = grosse Polypen, die bis zur unteren Grenze der unteren Nasenmuschel reichen oder Polypen medial der mittleren Nasenmuschel; 4 = grosse Polypen, die die untere Nasenhöhle komplett blockieren). Der Gesamtscore war die Summe der rechten und linken Scores. Die nasale Kongestion wurde von den Teilnehmern täglich anhand einer kategorialen Schweregrad-Skala von 0 bis 3 beurteilt (0 = keine Symptome; 1 = leichte Symptome; 2 = mittelschwere Symptome; 3 = schwere Symptome).
In beiden Studien umfassten die sekundären Hauptendpunkte in Woche 24 Veränderungen gegenüber dem Ausgangwert bei: Lund-MacKay-Gesamt-CT-Score (LMK), Gesamtsymptom-Score (total symptom score, TSS), Riechtest UPSIT (University of Pennsylvania smell identification test), täglicher Verlust des Geruchssinns und dem aus 22 Fragen bestehenden Sino-Nasal-Outcome-Test (22-item Sino-Nasal Outcome Test, SNOT-22). Anhand der gepoolten Daten der zwei Studien wurde die Verringerung des Anteils der Patienten beurteilt, die im Notfall systemische Kortikosteroide anwendeten und/oder sich einem operativen Eingriff an den Nasennebenhöhlen unterzogen, sowie die Verbesserung des FEV1 in der Asthma-Subgruppe. Zu den weiteren sekundären Endpunkten gehörte der aus 6 Fragen bestehende Fragebogen zur Asthmakontrolle (Asthma Control Questionnaire, ACQ-6) in der Subgruppe mit komorbidem Asthma.
Die demografischen Angaben und Baseline-Charakteristika für diese 2 Studien sind in der nachfolgenden Tabelle 11 dargestellt.
Tabelle 11: Demografische Angaben und Baseline-Charakteristika in den CRSwNP-Studien:
|
Parameter
|
SINUS-24
(n = 276)
|
SINUS-52
(n = 448)
| |
Mittleres Alter in Jahren (SD)
|
50,49 (13,39)
|
51,95 (12,45)
| |
% Männlich
|
57,2
|
62,3
| |
Mittlere Dauer der CRSwNP (Jahre) (SD)
|
11,11 (9,16)
|
10,94 (9,63)
| |
Patienten mit ≥1 vorherigen operativen Eingriff (%)
|
71,7
|
58,3
| |
Patienten mit Anwendung systemischer Kortikosteroide in den vergangenen 2 Jahren (%)
|
64,9
|
80,1
| |
Mittlerer bilateraler endoskopischer NPSa (SD), Bereich: 0–8
|
5,75 (1,28)
|
6,10 (1,21)
| |
Mittlerer nasaler Kongestion (NC)-Scorea (SD), Bereich: 0–3
|
2,35 (0,57)
|
2,43 (0,59)
| |
Mittlerer Lund-MacKay-Gesamt-CT-Scorea (SD), Bereich: 0–24
|
19,03 (4,44)
|
17,96 (3,76)
| |
Mittlerer Riechtest UPSIT-Scorea (SD), Bereich: 0–40
|
14,56 (2,71)
|
13,61 (8,02)
| |
Mittlerer Verlust des Geruchssinn-Scorea, (SD), Bereich: 0–3
|
2,71 (0,54)
|
2,75 (0,52)
| |
Mittlerer SNOT-22-Gesamtscorea (SD), Bereich: 0–110
|
49,40 (20,20)
|
51,86 (20,90)
| |
Mittelwert Rhinosinusitis-Schweregrad-Skalaa (VAS) (SD), 0–10 cm
|
7,68 (2,05)
|
8,00 (2,08)
| |
Mittlere Eosinophilenzahl im Blut (Zellen/µl) (SD)
|
437 (333)
|
431 (353)
| |
Mittleres Gesamt-IgE I.E./ml (SD)
|
211,97 (275,73)
|
239,84
(341,53)
| |
Atopische Krankheiten in der Anamnese (mit Typ-2- Inflammation)
% Insgesamt
|
75,4 %
|
82,4 %
| |
Asthma (%)
|
58,3
|
59,6
| |
Mittlere FEV1 (l) (SD)
|
2,69
(0,96)
|
2,57
(0,83)
| |
Mittlerer Prozentsatz der vorhergesagten FEV1 (%) (SD)
|
85,30
(20,23)
|
83,39
(17,72)
| |
Mittlerer ACQ-6-Scorea (SD)
|
1,62
(1,14)
|
1,58
(1,09)
| |
NSAID-ERD (%)
|
30,4
|
26,8
|
a Höhere Scores weisen auf eine stärkere Ausprägung der Erkrankung hin, ausser bei UPSIT, bei dem höhere Scores auf eine geringere Ausprägung der Erkrankung hinweisen; SD = Standardabweichung; NPS = Nasenpolypenscore; UPSIT = Riechtest (University of Pennsylvania smell identification test); SNOT-22 = Sino-Nasal-Outcome-Test mit 22 Fragen (22-item Sino-Nasal Outcome Test); VAS = visuelle Analogskala (visual analogue scale); FEV1 = Einsekundenkapazität; ACQ-6 = Fragebogen zur Asthmakontrolle (Asthma Control Questionnaire-6); NSAID-ERD = Aspirin/Analgetika-Intoleranz-Syndrom (nonsteroidal anti-inflammatory drug exacerbated respiratory disease).
Klinisches Ansprechen (SINUS-24 und SINUS-52)
Die Ergebnisse der primären und sekundären Endpunkte der CRSwNP-Studien sind in der nachfolgenden Tabelle 12 dargestellt.
Tabelle 12: Ergebnisse der primären und sekundären Endpunkte in den CRSwNP-Studien
|
|
SINUS-24
|
SINUS-52
| |
|
Placebo
(n = 133)
|
Dupilumab
300 mg
Q2W
(n = 143)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
|
Placebo
(n = 153)
|
Dupilumab
300 mg
Q2W
(n = 295)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
| |
Primäre Endpunkte in Woche 24
| |
Scores
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
| |
NPS
|
5,86
|
0,17
|
5,64
|
-1,89
|
-2,06
(-2,43; -1,69)
|
5,96
|
0,10
|
6,18
|
-1,71
|
-1,80
(-2,10; -1,51)
| |
NC
|
2,45
|
-0,45
|
2,26
|
-1,34
|
-0,89
(-1,07; -0,71)
|
2,38
|
-0,38
|
2,46
|
-1,25
|
-0,87
(-1,03; -0,71)
| |
Sekundäre Hauptendpunkte in Woche 24
| |
Scores
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
Mittlere Baseline
|
Mittlere
LS-Veränderung
|
| |
LMK-Score
|
19,55
|
-0,74
|
18,55
|
-8,18
|
-7,44
(-8,35; -6,53)
|
17,65
|
-0,09
|
18,12
|
-5,21
|
-5,13
(-5,80; -4,46)
| |
Gesamtsymptom-Score (TSS)
|
7,28
|
-1,17
|
6,82
|
-3,77
|
-2,61
(-3,04; -2,17)
|
7,08
|
-1,00
|
7,30
|
-3,45
|
-2,44
(-2,87; -2,02)
| |
UPSIT
|
14,44
|
0,70
|
14,68
|
11,26
|
10,56
(8,79; 12,34)
|
13,78
|
-0,81
|
13,53
|
9,71
|
10,52
(8,98; 12,07)
| |
Verlust des Geruchssinns
|
2,73
|
-0,29
|
2,70
|
-1,41
|
-1,12
(-1,31; -0,93)
|
2,72
|
-0,23
|
2,77
|
-1,21
|
-0,98
(-1,15; -0,81)
| |
SNOT-22
|
50,87
|
-9,31
|
48,0
|
-30,43
|
-21,12
(-25,17; -17,06)
|
53,48
|
-10,40
|
51,02
|
-27,77
|
-17,36
(-20,87; -13,85)
| |
VAS
|
7,96
|
-1,34
|
7,42
|
-4,54
|
-3,20
(-3,79; -2,60)
|
7,98
|
-1,39
|
8,01
|
-4,32
|
-2,93
(-3,45, -2,40)
|
Eine Verringerung des Scores bedeutet eine Verbesserung, ausser bei UPSIT, bei dem ein Anstieg eine Verbesserung bedeutet.
Der Gesamtsymptom-Score (TSS) ist ein zusammengesetzter Schweregrad-Score, bestehend aus der Summe der täglichen Symptome von NC, Verlust des Geruchssinns und anteriorer/posteriorer Rhinorrhö.
NC = nasale Kongestion; NPS = Nasenpolypenscore; LMK = Lund-MacKay-Gesamt-CT-Score; UPSIT = Riechtest (University of Pennsylvania smell identification test); SNOT-22 = Sino-Nasal-Outcome-Test mit 22 Fragen (22-item Sino-Nasal Outcome Test); TSS = Gesamtsymptom-Score (total symptom score); VAS = visuelle Analogskala für Rhinosinusitis (visual analogue scale) (alle p-Werte < 0,0001, nominal für VAS)
Die Ergebnisse der SINUS-52-Studie in Woche 52 sind in der nachfolgenden Tabelle 13 dargestellt.
Tabelle 13: Ergebnisse zur Wirksamkeit in Woche 52 der SINUS-52-Studie
|
|
Placebo
(n = 153)
|
Dupilumab
300 mg Q2W
(n = 150)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
|
Dupilumab
300 mg Q2W–Q4W
(n = 145)
|
Mittlerer LS-Unterschied vs. Placebo (95 %-KI)
| |
Mittlere Baseline
|
Mittlere LS-Veränderung
|
Mittlere Baseline
|
Mittlere LS-Veränderung
|
Mittlere Baseline
|
Mittlere LS-Veränderung
| |
NPS
|
5,96
|
0,15
|
6,07
|
-2,24
|
-2,40
(-2,77; -2,02)
|
6,29
|
-2,06
|
-2,21
(-2,59; -1,83)
| |
NC
|
2,38
|
-0,37
|
2,48
|
-1,35
|
-0,98
(-1,17; -0,79)
|
2,44
|
-1,48
|
-1,10
(-1,29; -0,91)
| |
LMK-Score
|
17,65
|
0,11
|
18,42
|
-6,83
|
-6,94
(-7,87; -6,01)
|
17,81
|
-5,60
|
-5,71
(-6,64; -4,77)
| |
Gesamtsymptom-Score (TSS)
|
7,08
|
-0,94
|
7,31
|
-3,79
|
-2,85
(-3,35; -2,35)
|
7,28
|
-4,16
|
-3,22
(-3,73; -2,72)
| |
UPSIT
|
13,78
|
-0,77
|
13,46
|
9,53
|
10,30
(8,50; 12,10)
|
13,60
|
9,99
|
10,76
(8,95; 12,57)
| |
Verlust des Geruchssinns
|
2,72
|
-0,19
|
2,81
|
-1,29
|
-1,10
(-1,31, -0,89)
|
2,73
|
-1,49
|
-1,30
(-1,51; -1,09)
| |
SNOT-22
|
53,48
|
-8,88
|
50,16
|
-29,84
|
-20,96
(-25,03; -16,89)
|
51,89
|
-30,52
|
-21,65
(-25,71; -17,58)
| |
VAS
|
7,98
|
-0,93
|
8,24
|
-4,74
|
-3,81
(-4,46; -3,17)
|
7,78
|
-4,39
|
-3,46
(-4,10, -2,81)
|
Eine Verringerung des Scores bedeutet eine Verbesserung, ausser bei UPSIT, bei dem ein Anstieg eine Verbesserung bedeutet.
Der Gesamtsymptom-Score (TSS) ist ein zusammengesetzter Schweregrad-Score, bestehend aus der Summe der täglichen Symptome von NC, Verlust des Geruchssinns und anteriorer/posteriorer Rhinorrhö.
NC = nasale Kongestion; NPS = Nasenpolypenscore; LMK = Lund-MacKay-Gesamt-CT-Score; UPSIT = Riechtest (University of Pennsylvania smell identification test); SNOT-22 = Sino-Nasal-Outcome-Test mit 22 Fragen (22-item Sino-Nasal Outcome Test); TSS = Gesamtsymptom-Score (total symptom score); VAS = visuelle Analogskala für Rhinosinusitis (visual analogue scale). (alle p-Werte < 0,0001)
Eine statistisch signifikante und klinisch bedeutsame Wirksamkeit wurde in der SINUS-24-Studie hinsichtlich der Verbesserung bei dem bilateralen endoskopischen NPS-Score in Woche 24 beobachtet. Im Zeitraum nach der Behandlung, als Patienten kein Dupilumab erhielten, nahm der Behandlungseffekt mit der Zeit ab (siehe Abbildung 10a). Ähnliche Verbesserungen bei dem bilateralen endoskopischen NPS-Score wurden ebenfalls in der SINUS-52-Studie sowohl in Woche 24 als auch in Woche 52 mit einer progressiven Verbesserung im Laufe der Zeit gesehen (siehe Abbildung 10b).
Abbildung 10. Mittlere LS-Veränderung gegenüber Baseline bei dem bilateralen Nasenpolypenscore (NPS) in SINUS-24 und SINUS-52 (ITT-Population)
|
Abbildung 10a. SINUS-24
|
Abbildung 10b. SINUS-52
| |
|
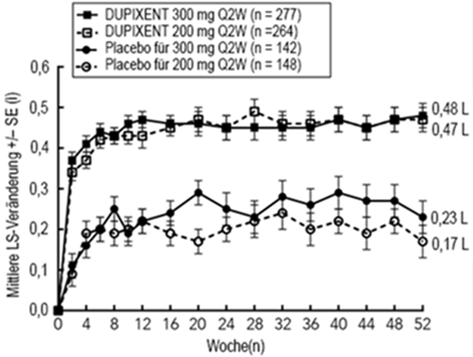
|
|
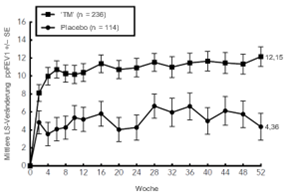
|
In beiden Studien wurden bereits schon bei der ersten Beurteilung in Woche 4 signifikante Verbesserungen bei der NC und bei dem Schweregrad des täglichen Verlusts des Geruchssinns beobachtet. Der mittlere LS-Unterschied bei der NC in Woche 4 lag in der Dupilumab-Gruppe im Vergleich zur Placebo-Gruppe bei -0,41 (95 %-KI: -0,52; -0,30) in SINUS-24 und -0,37 (95 %-KI: -0,46; -0,27) in SINUS-52. Der mittlere LS-Unterschied bei dem Verlust des Geruchssinns in Woche 4 lag in der Dupilumab-Gruppe im Vergleich zur Placebo-Gruppe bei -0,34 (95 %-KI: -0,44; -0,25) in SINUS-24 und -0,31 (95 %-KI: -0,41; -0,22) in SINUS-52.
Eine Verringerung im Anteil der Patienten mit Anosmie wurde in den SINUS-24- und SINUS-52-Studien beobachtet. Zu Beginn litten 74 % bis 79 % der Patienten an Anosmie, was sich in Woche 24 auf 24 % in der SINUS-24-Studie und 30 % in der SINUS-52-Studie verringerte, während es unter Placebo keine Veränderung gab. Eine Verbesserung im nasalen maximalen inspiratorischen Atemstrom (nasal peak inspiratory flow, NPIF) wurde in SINUS-24 und SINUS-52 in Woche 24 beobachtet. Der mittlere LS-Unterschied in der Dupilumab-Gruppe betrug 40,4 l/min (95 %-KI: 30,4; 50,4), während er in der Placebo-Gruppe 36,6 l/min (95 %-KI: 28,0; 45,3) betrug.
Bei den Patienten mit einem Rhinosinusitis-VAS-Score > 7 zu Studienbeginn erreichte in Woche 24 ein grösserer Anteil der Patienten in der Dupilumab-Gruppe einen VAS-Score ≤7 als in der Placebo-Gruppe (83,3 % versus 39,4 % in SINUS-24 und 75,0 % versus 39,3 % in SINUS-52).
In der präspezifizierten, für Multiplizität adjustierten gepoolten Analyse der zwei Studien führte die Behandlung mit Dupilumab im Vergleich mit Placebo zu einer signifikanten Verringerung bei der Anwendung von systemischen Kortikosteroiden und der Notwendigkeit eines operativen Eingriffs an den Nasennebenhöhlen (HR von 0,24; 95 %-KI: 0,17; 0,35) (siehe Abbildung 10). Der Anteil der Patienten, die systemische Kortikosteroide benötigten, wurde um 74 % verringert (HR von 0,26; 95 %-KI: 0,18; 0,38). Die Gesamtzahl der jährlichen Anwendungen systemischer Kortikosteroide wurde um 75 % verringert (RR von 0,25; 95 %-KI: 0,17; 0,37). Die mittlere individuelle jährlich verschriebene Gesamtdosis von systemischen Kortikosteroiden (in mg) während des Behandlungszeitraums war 71 % geringer in der gepoolten Dupilumab-Gruppe als in der gepoolten Placebo-Gruppe (60,5 [531,3] mg versus 209,5 [497,2] mg). Der Anteil der Patienten, die einen operativen Eingriff benötigten, verringerte sich um 83 % (HR von 0,17; 95 %-KI: 0,07; 0,46).
Abbildung 11. Kaplan-Meier-Kurve der Zeit bis zur ersten Anwendung systemischer Kortikosteroide und/oder eines operativen Eingriffs an den Nasennebenhöhlen während des Behandlungszeitraums (ITT-Population) [SINUS-24 und SINUS-52 gepoolt]
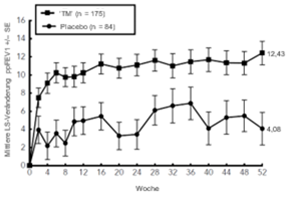
Die Auswirkungen von Dupilumab auf die primären Endpunkte NPS und nasale Kongestion sowie den sekundären Hauptendpunkt Lund-MacKay-Gesamt-CT-Score (LMK) waren vergleichbar bei Patienten mit und ohne vorherigen operativen Eingriff.
Bei Patienten mit komorbidem Asthma wurden in Woche 24, unabhängig vom Eosinophilen-Ausgangswert im Blut, signifikante Verbesserungen bei dem FEV1 und ACQ-6 beobachtet. Die gepoolte mittlere LS-Veränderung bei dem FEV1 im Vergleich zum Ausgangswert lag in Woche 24 für Dupilumab 300 mg alle 2 Wochen (Q2W) bei 0,14 l, während sie bei Placebo bei -0,07 l lag, was einem Unterschied von 0,21 l entspricht (95 %-KI: 0,13; 0,29). Darüber hinaus wurden im Vergleich zu den Ausgangswerten Verbesserungen bei dem FEV1 ab der ersten Beurteilung nach Studienbeginn in Woche 8 in SINUS-24 und in Woche 4 in SINUS-52 beobachtet. Verbesserungen im ACQ-6 bei Patienten mit komorbidem Asthma wurden in beiden Studien beobachtet. Ein Ansprechen war definiert als eine Verbesserung des Scores um 0,5 oder mehr. Der mittlere LS-Unterschied in Woche 24 betrug in der Dupilumab-Gruppe im Vergleich zu Placebo -0,76 (95 %-KI: -1,00 bis -0,51) in SINUS-24 und -0,94 (95 %-KI: -1,19; -0,69) in SINUS-52.
Die Responderrate bei ACQ-6 betrug in Woche 24 bei Dupilumab 300 mg alle 2 Wochen (Q2W) in der SINUS-24-Studie 56 %, bei Placebo 28 % (Odds Ratio 3,17; 95 %-KI: 1,65; 6,09). Die Ansprechrate bei ACQ-6 betrug in Woche 52 bei Dupilumab 300 mg alle 2 Wochen (Q2W) in der SINUS-52-Studie 46 %, bei Placebo 14 % (Odds Ratio 7,02; 95 %-KI: 3,10; 15,90).
Bei Patienten mit NSAID-ERD stimmten die Auswirkungen von Dupilumab auf die primären Endpunkte NPS und NC sowie den sekundären Hauptendpunkt Lund-MacKay-Gesamt-CT-Score (LMK) mit denen überein, die in der CRSwNP-Gesamtpopulation beobachtet wurden.
|













