Eigenschaften/WirkungenATC-Code
R07AX32
Wirkungsmechanismus
Elexacaftor und Tezacaftor sind CFTR-Korrektoren, die sich an verschiedene Stellen des CFTR-Proteins binden und eine additive Wirkung bei der Erleichterung der zellulären Verarbeitung und dem Transport von CFTR haben und somit die Menge an CFTR-Protein, das an die Zelloberfläche transportiert wird, im Vergleich zu einem der beiden Moleküle allein erhöhen. Ivacaftor erhöht die Öffnungswahrscheinlichkeit (Gating) des CFTR-Kanals an der Zelloberfläche.
Die kombinierte Wirkung von Elexacaftor, Tezacaftor und Ivacaftor besteht in einer Erhöhung der Menge und Verbesserung der Funktionsfähigkeit des CFTR-Proteins an der Zelloberfläche, was zu einer Zunahme der CFTR-Aktivität führt, wie Messungen des CFTR-vermittelten Chloridtransports zeigten. Die klinischen Resultate stimmten überein mit den Ergebnissen von In-vitro-Untersuchungen und zeigen, dass eine einzige F508del-Mutation ausreicht, um ein signifikantes klinisches Ansprechen zu erzielen (siehe «Klinische Wirksamkeit»).
CFTR-Chloridtransport-Assay in Fischer-Rat-Thyroid (FRT)-Zellen, die mutiertes CFTR exprimieren
In elektrophysiologischen Studien in der Ussing Kammer wurde das Ansprechen des Chloridtransports von mutiertem CFTR-Protein auf Elexacaftor/Tezacaftor/Ivacaftor untersucht. Dazu wurde ein Panel von FRT-Zelllinien verwendet, die mit einzelnen CFTR-Mutationen transfiziert waren. Elexacaftor/Tezacaftor/Ivacaftor erhöhten den Chloridtransport in FRT-Zellen, die ausgewählte CFTR-Mutationen exprimierten.
Als Schwellenwert für das Ansprechen des In-vitro-CFTR-Chloridtransports wurde eine Nettozunahme von mindestens 10 % des Normalwerts gegenüber Baseline festgelegt, da dies prädiktiv für einen klinischen Nutzen ist oder einen angemessenen klinischen Nutzen erwarten lässt. Bei einzelnen Mutationen korreliert die Grössenordnung der Nettoveränderung gegenüber Baseline des CFTR-vermittelten Chloridtransports in vitro nicht mit dem Ausmass des klinischen Ansprechens.
Tabelle 7 zeigt die ansprechenden CFTR-Mutationen in FRT-Zellen auf der Grundlage des klinischen Ansprechens und/oder von In-vitro-Daten oder Extrapolation, die darauf hinweisen, dass Elexacaftor/Tezacaftor/Ivacaftor den Chloridtransport um mindestens 10 % des Normalwerts gegenüber Baseline erhöhen. Das Vorkommen der in Tabelle 7 aufgeführten CFTR-Mutationen sollte weder anstelle einer Diagnose von zystischer Fibrose noch als alleiniger Faktor für Verschreibungszwecke verwendet werden.
|
Tabelle 7: Liste der CFTR-Genmutationen, die auf Elexacaftor/Tezacaftor/Ivacaftor ansprechen
| |
Mutationen, die basierend auf klinischen Daten auf Trikafta ansprechen
| |
2789+5G→A
|
D1152H
|
L997F
|
P5L
|
R1066H
|
| |
3272-26A→G
|
F508del
|
L1077P
|
R117C
|
S945L
|
| |
3849+10kbC→T
|
G85E
|
M1101K
|
R347H
|
T338I
|
| |
A455E
|
L206W
|
N1303K
|
R347P
|
V232D
|
| |
Mutationen, die basierend auf In-vitro-Daten auf Trikafta ansprechen
| |
3141del9
|
E588V
|
G970D
|
L165S
|
R117G
|
S589N
| |
546insCTA
|
E822K
|
G1061R
|
L320V
|
R117H
|
S737F
| |
A46D
|
F191V
|
G1069R
|
L346P
|
R117L
|
S912L
| |
A120T
|
F311del
|
G1244E
|
L453S
|
R117P
|
S977F
| |
A234D
|
F311L
|
G1249R
|
L967S
|
R170H
|
S1159F
| |
A349V
|
F508C
|
G1349D
|
L1324P
|
R258G
|
S1159P
| |
A554E
|
F508C;S1251N †
|
H139R
|
L1335P
|
R334L
|
S1251N
| |
A1006E
|
F575Y
|
H199Y
|
L1480P
|
R334Q
|
S1255P
| |
A1067T
|
F1016S
|
H939R
|
M152V
|
R347L
|
T1036N
| |
D110E
|
F1052V
|
H1054D
|
M265R
|
R352Q
|
T1053I
| |
D110H
|
F1074L
|
H1085P
|
M952I
|
R352W
|
V201M
| |
D192G
|
F1099L
|
H1085R
|
M952T
|
R553Q
|
V456A
| |
D443Y
|
G27R
|
H1375P
|
P67L
|
R668C
|
V456F
| |
D443Y;G576A; R668C †
|
G126D
|
I148T
|
P205S
|
R751L
|
V562I
| |
D579G
|
G178E
|
I175V
|
P574H
|
R792G
|
V754M
| |
D614G
|
G178R
|
I336K
|
Q98R
|
R933G
|
V1153E
| |
D836Y
|
G194R
|
I502T
|
Q237E
|
R1070Q
|
V1240G
| |
D924N
|
G194V
|
I601F
|
Q237H
|
R1070W
|
V1293G
| |
D979V
|
G314E
|
I618T
|
Q359R
|
R1162L
|
W361R
| |
D1270N
|
G463V
|
I807M
|
Q1291R
|
R1283M
|
W1098C
| |
E56K
|
G480C
|
I980K
|
R31L
|
R1283S
|
W1282R
| |
E60K
|
G551D
|
I1027T
|
R74Q
|
S13F
|
Y109N
| |
E92K
|
G551S
|
I1139V
|
R74W
|
S341P
|
Y161D
| |
E116K
|
G576A
|
I1269N
|
R74W; D1270N †
|
S364P
|
Y161S
| |
E193K
|
G576A;R668C †
|
I1366N
|
R74W;V201M †
|
S492F
|
Y563N
| |
E403D
|
G622D
|
K1060T
|
R74W;V201M; D1270N †
|
S549N
|
Y1014C
| |
E474K
|
G628R
|
L15P
|
R75Q
|
S549R
|
Y1032C
| |
Mutationen, die basierend auf Extrapolation von Studie 445-124 auf Trikafta ansprechen
| |
711+3A→G
|
E831X
|
|
|
|
| |
†
Komplexe/zusammengesetzte Mutationen, bei denen ein einzelnes Allel des CFTR-Gens mehrere Mutationen aufweist. Sie existieren unabhängig von Mutationen auf dem anderen Allel.
|
Pharmakodynamik
Pharmakodynamische Wirkungen
Wirkungen auf die Schweisschloridkonzentration
In Studie 445-102 (Patienten mit einer F508del-Mutation in einem Allel und einer Mutation im zweiten Allel, die entweder zum Fehlen von CFTR-Protein oder zu einem CFTR-Protein führt, das nicht auf Ivacaftor und Tezacaftor/Ivacaftor anspricht [Minimalfunktionsmutation]) wurde eine Abnahme der Schweisschloridkonzentration gegenüber Baseline in Woche 4 beobachtet, die während des gesamten 24-wöchigen Behandlungszeitraums anhielt. Der Behandlungsunterschied von Trikafta im Vergleich zu Placebo in Bezug auf die mittlere absolute Veränderung der Schweisschloridkonzentration von Baseline bis einschliesslich Woche 24 betrug -41,8 mmol/l (95 % KI: -44,4; -39,3; p<0,0001).
In Studie 445-103 (Patienten, die homozygot für die F508del-Mutation sind) betrug der Behandlungsunterschied von Trikafta im Vergleich zum Tezacaftor/Ivacaftor und Ivacaftor-Behandlungsschema (Tezacaftor/Ivacaftor) in Bezug auf die mittlere absolute Veränderung der Schweisschloridkonzentration gegenüber Baseline in Woche 4 -45,1 mmol/l (95 % KI: -50,1; -40,1; p<0,0001).
In Studie 445-104 (Patienten, die heterozygot für die F508del-Mutation sind und eine Gating- oder Restfunktionsmutation im zweiten Allel aufweisen) betrug die mittlere absolute Veränderung der Schweisschloridkonzentration von Baseline bis einschliesslich Woche 8 im Anschluss an eine 4-wöchige Ivacaftor- oder Tezacaftor/Ivacaftor-Einlaufphase in der Trikafta-Gruppe -22,3 mmol/l (95 % KI: -24,5; -20,2; p<0,0001). Der Behandlungsunterschied von Trikafta im Vergleich zur Kontrollgruppe (Ivacaftor oder Tezacaftor/Ivacaftor) betrug -23,1 mmol/l (95 % KI: -26,1; -20,1; p<0,0001).
In Studie 445-106 Teil B (Patienten im Alter von 6 Jahren bis unter 12 Jahren, die homozygot für die F508del-Mutation oder heterozygot für die F508del-Mutation und eine Minimalfunktionsmutation sind) betrug die mittlere absolute Veränderung der Schweisschloridkonzentration von Baseline bis einschliesslich Woche 24 -60,9 mmol/l (95 % KI: -63,7; -58,2). Die Messwerte für die Schweisschloridkonzentration wurden an den geplanten Messtagen bei folgender Anzahl Patienten erhoben: Baseline n=62, Tag 15 n=56, Woche 4 n=56, Woche 12 n=50, Woche 24 n=28.
In Studie 445-111 (Patienten im Alter von 2 Jahren bis unter 6 Jahren, die homozygot für die F508del-Mutation oder heterozygot für die F508del-Mutation und eine Minimalfunktionsmutation sind) betrug die mittlere absolute Veränderung der Schweisschloridkonzentration von Baseline bis einschliesslich Woche 24 -57,9 mmol/l (95 % KI: -61,3; -54,6).
In Studie 445-124 (Patienten ab 6 Jahren mit einer auf Elexacaftor/Tezacaftor/Ivacaftor ansprechenden Nicht-F508del-Mutation, durch die sie sich qualifizierten [siehe Tabelle 8]) betrug die mittlere absolute Veränderung der Schweisschloridkonzentration von Baseline bis einschliesslich Woche 24 im Vergleich zu Placebo -28,3 mmol/l (95 %-KI: -32,1, -24,5 mmol/l; p<0,0001).
Kardiovaskuläre Wirkungen
Wirkung auf das QT-Intervall
Nach Dosen vom bis zu 2-Fachen der maximalen empfohlenen Dosis Elexacaftor und dem 3-Fachen der empfohlenen Höchstdosis von Tezacaftor und Ivacaftor war keine klinisch relevante Verlängerung des QT/QTc-Intervalls bei gesunden Probanden festzustellen.
Herzfrequenz
In Studie 445-102 wurden bei mit Trikafta behandelten Patienten mittlere Abnahmen der Herzfrequenz von 3,7 bis 5,8 Schlägen pro Minute (bpm) gegenüber dem Ausgangswert (76 bpm) beobachtet.
Klinische Wirksamkeit
Die Wirksamkeit von Trikafta bei Patienten mit CF wurde in vier doppelblinden, kontrollierten Phase-3-Studien (Studie 445-102, Studie 445-103, 445-104 und 445-124) statistisch nachgewiesen. In diese Studien wurden jeweils CF-Patienten mit mindestens einer F508del-Mutation oder einer der in Tabelle 8 aufgeführten Mutationen, die auf Trikafta ansprechen, aufgenommen. Vier offene, unkontrollierte Phase 3-Studien (Studie 445-105, Studie 445-106 Teil B, Studie 445-111 und Studie 445-107) unterstützen die Wirksamkeit zusätzlich. Trikafta wurde als Kombinationstherapie mit Elexacaftor, Tezacaftor und Ivacaftor entwickelt. Der Nutzen von Elexacaftor allein und von Tezacaftor allein im Vergleich zur Kombinationstherapie wurde in klinischen Studien nicht untersucht und diese Wirkstoffe allein sind nicht als Arzneimittel verfügbar.
Studie 445-102 war eine randomisierte, doppelblinde, placebokontrollierte klinische Studie von 24 Wochen Dauer an Patienten mit einer F508del-Mutation in einem Allel und einer Minimalfunktions (MF)-Mutation im zweiten Allel, die entweder zum Fehlen von CFTR-Protein oder zu einem CFTR-Protein führt, das nicht auf Ivacaftor und Tezacaftor/Ivacaftor anspricht. Insgesamt 403 Patienten ab 12 Jahren (mittleres Alter 26,2 Jahre) wurden randomisiert einer Behandlung mit Trikafta oder Placebo zugewiesen. Die Patienten hatten beim Screening ein ppFEV1 zwischen 40 und 90 %. Der mittlere ppFEV1-Ausgangswert betrug 61,4 % (Bereich: 32,3 %, 97,1 %).
Studie 445-103 war eine 4-wöchige, randomisierte, doppelblinde, aktiv kontrollierte klinische Studie an Patienten, die für die F508del-Mutation homozygot sind. Insgesamt 107 Patienten ab 12 Jahren (mittleres Alter 28,4 Jahre) erhielten während einer 4-wöchigen offenen Einlaufphase ein Behandlungsschema mit Tezacaftor/Ivacaftor und Ivacaftor (Tezacaftor/Ivacaftor) und wurden anschliessend randomisiert einer Behandlung mit Trikafta oder Tezacaftor/Ivacaftor über einen 4wöchigen doppelblinden Behandlungszeitraum zugewiesen. Die Patienten hatten beim Screening ein ppFEV1 zwischen 40 und 90 %. Der mittlere ppFEV1-Ausgangswert nach der Einlaufphase mit Tezacaftor/Ivacaftor betrug 60,9 % (Bereich: 35,0 %; 89,0 %).
Studie 445-104 war eine 8-wöchige, randomisierte, doppelblinde, aktiv kontrollierte klinische Studie an Patienten, die heterozygot für die F508del (F)-Mutation waren und eine Gating (G)- oder Restfunktions (RF)-Mutation im zweiten Allel aufwiesen. Patienten ab 12 Jahren mit einem ppFEV1-Wert zwischen 40 % und 90 % beim Screening erhielten entweder Ivacaftor (Patienten mit F/G-Mutation) oder Tezacaftor/Ivacaftor (Patienten mit F/RF-Mutation) im Rahmen einer 4-wöchigen unverblindeten Einlaufphase. Patienten mit dem F/R117H-Genotyp erhielten Ivacaftor während der Einlaufphase. Anschliessend wurden die Patienten randomisiert der Trikafta-Gruppe zugewiesen oder blieben bei der CFTR-Modulator-Therapie, die sie in der Einlaufphase erhalten hatten. Das mittlere Alter bei Baseline, nach der Einlaufphase, betrug 37,7 Jahre, und der mittlere ppFEV1-Ausgangswert betrug 67,6 % (Bereich: 29,7 %; 113,5 %).
Studie 445-106 war eine zweiteilige 24-wöchige offene, unkontrollierte Studie an 66 Patienten im Alter von 6 Jahren bis unter 12 Jahren (mittleres Alter bei Baseline 9,3 Jahre), die homozygot für die F508del-Mutation oder heterozygot für die F508del-Mutation und eine Minimalfunktionsmutation waren. Teil A evaluierte die Pharmakokinetik und die vorläufigen Ergebnisse zur Sicherheit, Teil B untersuchte die Sicherheit, Verträglichkeit, Wirksamkeit und Pharmakokinetik. Patienten mit einem Körpergewicht <30 kg bei Baseline (36 Patienten, 54,5 %) erhielten zwei Tabletten Elexacaftor 50 mg/Tezacaftor 25 mg/Ivacaftor 37,5 mg am Morgen und eine Tablette Ivacaftor 75 mg am Abend. Patienten mit einem Körpergewicht ≥30 kg bei Baseline (30 Patienten, 45,5 %) erhielten zwei Tabletten Elexacaftor 100 mg/Tezacaftor 50 mg/Ivacaftor 75 mg am Morgen und eine Tablette Ivacaftor 150 mg am Abend. Beim Screening hatten die Patienten einen ppFEV1-Wert von ≥40 % [mittlerer ppFEV1-Wert bei Baseline 88,8 % (Bereich: 39,0 %, 127,1 %)] und wogen ≥15 kg (verlangtes Einschlusskriterium).
Studie 445-111 war eine 24-wöchige, unverblindete Studie an Patienten im Alter von 2 bis unter 6 Jahren (mittleres Alter bei Baseline 4,1 Jahre). Patienten, die mindestens eine F508del-Mutation oder eine Mutation hatten, die bekanntlich auf Elexacaftor/Tezacaftor/Ivacaftor anspricht, waren für die Studie qualifiziert. Insgesamt 75 Patienten, die homozygot für die F508del-Mutation oder heterozygot für die F508del-Mutation und eine Minimalfunktionsmutation waren, wurden aufgenommen und nach Gewicht behandelt. Patienten mit einem Körpergewicht von 10 kg bis < 14 kg bei Baseline erhielten 1 × täglich morgens Elexacaftor 80 mg /Tezacaftor 40 mg / Ivacaftor 60 mg und 1 × täglich abends Ivacaftor 59,5 mg. Patienten mit einem Körpergewicht von ≥14 kg bei Baseline erhielten 1 × täglich morgens Elexacaftor 100 mg / Tezacaftor 50 mg / Ivacaftor 75 mg und 1 × täglich abends Ivacaftor 75 mg.
Studie 445-124 war eine 24-wöchige, randomisierte, placebokontrollierte, doppelblinde Parallelgruppen-Studie bei Patienten ab 6 Jahren. Patienten mit mindestens einer qualifizierenden Nicht-F508del-Mutation, die auf Elexacaftor/Tezacaftor/Ivacaftor anspricht (siehe Tabelle 8), und ohne Ausschlussmutation (eine andere auf Elexacaftor/Tezacaftor/Ivacaftor ansprechende Mutation) qualifizierten sich für die Studienteilnahme.
Insgesamt wurden 307 Patienten in die Studie aufgenommen und erhielten eine ihrem Alter und Körpergewicht angepasste Dosierung. Patienten im Alter von ≥6 bis < 12 Jahren mit einem Körpergewicht < 30 kg zu Studienbeginn erhielten eine Behandlung mit Elexacaftor 100 mg tgl./Tezacaftor 50 mg tgl./Ivacaftor 75 mg alle 12 Std. Patienten im Alter von ≥6 bis < 12 Jahren mit einem Körpergewicht ≥30 kg zu Studienbeginn erhielten eine Behandlung mit Elexacaftor 200 mg tgl./Tezacaftor 100 mg tgl./Ivacaftor 150 mg alle 12 Std. Patienten im Alter von ≥12 Jahren zu Studienbeginn erhielten Elexacaftor 200 mg tgl./Tezacaftor 100 mg tgl./Ivacaftor 150 mg alle 12 Std. Die Patienten hatten bei der Voruntersuchung einen ppFEV1-Wert ≥40 % und ≤100 % und waren 6 Jahre oder älter. Der mittlere ppFEV1-Wert bei Baseline betrug 67,7 % (Bereich: 34,0 %, 108,7 %)].
|
Tabelle 8: Geeignete auf Elexacaftor/Tezacaftor/Ivacaftor ansprechende CFTR-Mutationen
| |
2789+5G>A
|
D1152H
|
L997F
|
R117C
|
T338I
| |
3272-26A>G
|
G85E
|
M1101K
|
R347H
|
V232D
| |
3849+10kbC>T
|
L1077P
|
P5L
|
R347P
|
| |
A455E
|
L206W
|
R1066H
|
S945L
|
|
Die Patienten in Studie 445-102, 445-103, 445-104, 445-106, 445-111 und 445-124 setzten ihre CF-Therapien (z.B. Bronchodilatatoren, inhalative Antibiotika, Dornase-alfa und hypertone Kochsalzlösung) fort, setzten aber alle vorherigen CFTR-Modulator-Therapien ab, mit Ausnahme der Studienmedikamente. Die Patienten hatten eine bestätigte CF-Diagnose und erfüllten die Eignungskriterien für die Studie.
Von den Studien 445-102, 445-103, 445-104, 445-106, 445-111 und 445-124 waren Patienten, die Lungeninfektionen mit Erregern aufwiesen, die mit einer rascheren Abnahme der Lungenfunktion assoziiert sind, wie u.a. Burkholderia cenocepacia, Burkholderia dolosa oder Mycobacterium abscessus, oder die beim Screening einen abnormalen Leberfunktionstest (ALT, AST, ALP oder GGT ≥3 × ULN oder Gesamtbilirubin ≥2 × ULN) aufwiesen, ausgeschlossen. Von der Studie 445-111 waren Patienten, die ALT- oder AST-Werte ≥2 × ULN aufwiesen, ebenfalls ausgeschlossen.
Patienten aus den Studien 445-102 und 445-103 waren für die Übernahme in eine 192-wöchige unverblindete Verlängerungsstudie (Studie 445-105) qualifiziert. Die Patienten in den Studien 445-104, 445-106 Teil B, 445-111 und 445-124 waren für die Übernahme in unverblindete Verlängerungsstudien qualifiziert.
Studie 445-102
In Studie 445-102 war der primäre Endpunkt die mittlere absolute Veränderung des ppFEV1 von Baseline bis einschliesslich Woche 24. Die Behandlung mit Trikafta führte zu einer statistisch signifikanten Verbesserung des ppFEV1 von 14,3 Prozentpunkten im Vergleich zu Placebo (95 % KI: 12,7; 15,8; p<0,0001) (siehe Tabelle 9). Die durchschnittliche Verbesserung des ppFEV1 setzte schnell ein (Tag 15) und hielt über den gesamten 24wöchigen Behandlungszeitraum an (siehe Abbildung 1). Verbesserungen beim ppFEV1 wurden unabhängig von Alter, Baseline-ppFEV1, Geschlecht und geographischer Region beobachtet. Insgesamt hatten 18 Patienten, die mit Trikafta behandelt wurden, ein ppFEV1 < 40 bei Baseline. Die Sicherheit und Wirksamkeit in dieser Subgruppe war vergleichbar mit den Ergebnissen in der Gesamtstudienpopulation. Eine Zusammenfassung der primären und wichtigsten sekundären Ergebnisse ist Tabelle 9 zu entnehmen.
|
Tabelle 9: Primäre und wichtigste sekundäre Wirksamkeitsanalysen, vollständiges Analyseset (Studie 445-102)
| |
Analyse
|
Statistik
|
Placebo N=203
|
Trikafta N=200
| |
Primäre Wirksamkeitsanalyse
| |
Absolute Veränderung des ppFEV1 von Baseline bis einschliesslich Woche 24 (Prozentpunkte)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
14,3 (12,7; 15,8)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-0,4 (0,5)
|
13,9 (0,6)
| |
Wichtigste sekundäre Wirksamkeitsanalysen
| |
Absolute Veränderung des ppFEV1 gegenüber Baseline in Woche 4 (Prozentpunkte)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
13,7 (12,0; 15,3)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-0,2 (0,6)
|
13,5 (0,6)
| |
Anzahl der pulmonalen Exazerbationen von Baseline bis einschliesslich Woche 24‡
|
Anzahl der Ereignisse (Ereignisrate pro Jahr††)
|
113 (0,98)
|
41 (0,37)
| |
Rate Ratio (95 % KI)
|
N.a.
|
0;37 (0,25; 0,55)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Absolute Veränderung der Schweisschloridkonzentra-tion von Baseline bis einschliesslich Woche 24 (mmol/l)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
-41,8 (-44,4; -39,3)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-0,4 (0,9)
|
-42,2 (0,9)
| |
Absolute Veränderung des Scores der respiratorischen Domäne des CFQ-R von Baseline bis einschliesslich Woche 24 (Punkte)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
20,2 (17,5; 23,0)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-2,7 (1,0)
|
17,5 (1,0)
| |
Absolute Veränderung des BMI gegenüber Baseline in Woche 24 (kg/m²)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
1,04 (0,85; 1,23)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
0,09 (0,07)
|
1,13 (0,07)
| |
Absolute Veränderung der Schweisschloridkonzentra-tion gegenüber Baseline in Woche 4 (mmol/l)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
-41,2 (-44,0; -38,5)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
0,1 (1,0)
|
-41,2 (1,0)
| |
Absolute Veränderung des Scores der respiratorischen Domäne des CFQ-R gegenüber Baseline in Woche 4 (Punkte)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
20,1 (16,9; 23,2)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-1,9 (1,1)
|
18,1 (1,1)
| |
ppFEV1: forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; KI: Konfidenzintervall; SE: Standardfehler; N.a.: nicht anwendbar; CFQ-R: Cystic Fibrosis Questionnaire-Revised, überarbeiteter Fragebogen zu zystischer Fibrose; BMI: Body Mass Index (Körpermassenindex).
‡ Eine pulmonale Exazerbation war definiert als eine Veränderung der antibiotischen Therapie (i.v., inhalativ oder oral) aufgrund von mindestens 4 von 12 im Voraus festgelegten sinopulmonalen Zeichen/Symptomen.
†† Geschätzte Ereignisrate pro Jahr, berechnet anhand von 48 Wochen pro Jahr.
|
Abbildung 1: Absolute Veränderung des ppFEV1 gegenüber dem Ausgangswert bei jedem Untersuchungszeitpunkt in Studie 445-102
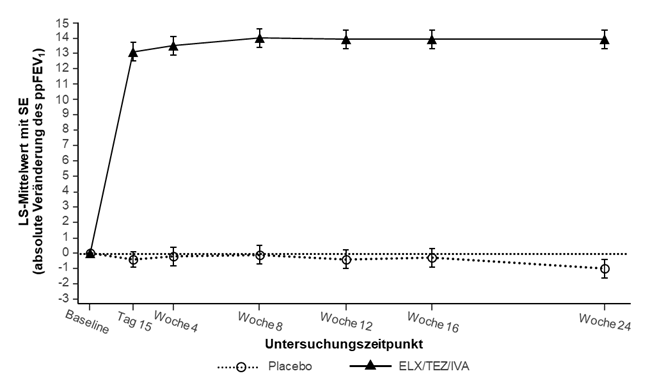
SE: Standardfehler; ELX/TEZ/IVA: Elexacaftor/Tezacaftor/Ivacaftor
Studie 445-103
In Studie 445-103 war der primäre Endpunkt die mittlere absolute Veränderung des ppFEV1 gegenüber Baseline in Woche 4 des doppelblinden Behandlungszeitraums. Die Behandlung mit Trikafta führte zu einer statistisch signifikanten Verbesserung des ppFEV1 von 10,0 Prozentpunkten im Vergleich zum Behandlungsschema mit Tezacaftor/Ivacaftor und Ivacaftor (Tezacaftor/Ivacaftor) (95 % KI: 7,4; 12,6; p<0,0001) (siehe Tabelle 10). Verbesserungen beim ppFEV1 wurden unabhängig von Alter, Geschlecht, Baseline-ppFEV1 und geographischer Region beobachtet. Eine Zusammenfassung der primären und wichtigsten sekundären Ergebnisse ist Tabelle 10 zu entnehmen.
|
Tabelle 10: Primäre und wichtigste sekundäre Wirksamkeitsanalysen, vollständiges Analyseset (Studie 445-103)
| |
Analyse*
|
Statistik
|
Tezacaftor/ Ivacaftor#
N=52
|
Trikafta N=55
| |
Primäre Wirksamkeitsanalyse
| |
Absolute Veränderung des ppFEV1 gegenüber Baseline in Woche 4 (Prozentpunkte)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
10,0 (7,4; 12,6)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
0,4 (0,9)
|
10,4 (0,9)
| |
Wichtigste sekundäre Wirksamkeitsanalysen
| |
Absolute Veränderung der Schweisschloridkonzentration gegenüber Baseline in Woche 4 (mmol/l)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
-45,1 (-50,1; -40,1)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
1,7 (1,8)
|
-43,4 (1,7)
| |
Absolute Veränderung des Scores der respiratorischen Domäne des CFQ-R gegenüber Baseline in Woche 4 (Punkte)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
17,4 (11,8; 23,0)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-1,4 (2,0)
|
16,0 (2,0)
| |
ppFEV1: forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; KI: Konfidenzintervall; SE: Standardfehler; N.a.: nicht anwendbar; CFQ-R: Cystic Fibrosis Questionnaire-Revised, überarbeiteter Fragebogen zu zystischer Fibrose.
* Die Baseline für den primären und die wichtigsten sekundären Endpunkte ist definiert als das Ende der 4-wöchigen Einlaufphase mit Tezacaftor/Ivacaftor und Ivacaftor.
# Behandlungsschema von Tezacaftor/Ivacaftor und Ivacaftor.
|
Abbildung 2: Absolute Veränderung des ppFEV1 gegenüber dem Ausgangswert bei jedem Untersuchungszeitpunkt in Studie 445-103
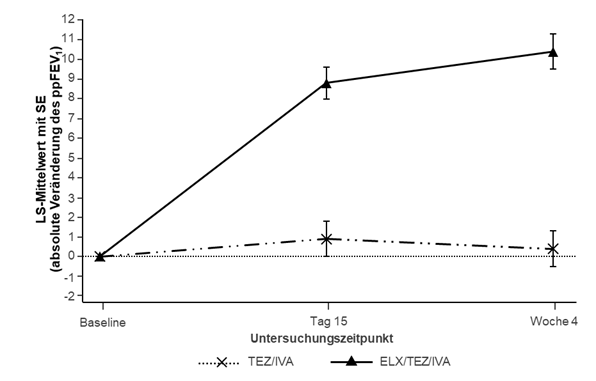
SE: Standardfehler; TEZ/IVA: Tezacaftor/Ivacaftor; ELX/TEZ/IVA: Elexacaftor/Tezacaftor/Ivacaftor
Studie 445-105
Die Studie 445-105 war eine unverblindete Verlängerungsstudie von 192 Wochen Dauer zur Bewertung der Sicherheit und Wirksamkeit einer Langzeitbehandlung mit Trikafta an Patienten, die aus den Studien 445-102 (N=399) und 445-103 (N=107) übernommen wurden. In dieser unverblindeten Verlängerungsstudie haben alle Patienten Trikafta über die gesamte Dauer der Studie erhalten. In Studie 445-105 zeigten Patienten aus den Kontrollarmen der Hauptstudien Verbesserungen der Wirksamkeitsendpunkte, die mit denen von Patienten übereinstimmten, die Trikafta in den Hauptstudien erhielten. Die Patienten aus dem Kontrollarm sowie die Patienten, die in den Hauptstudien Trikafta erhielten, zeigten eine anhaltende Verbesserung des ppFEV1 (siehe Abbildung 3 und Abbildung 4) und anderer Wirksamkeitsendpunkte (siehe Tabelle 11). Der BMI und BMI-z-Score nach 96 Wochen kumulativer Behandlung (Woche 96 in Studie 445-105) waren ähnlich, wie bei Patienten mit den in Studie 445-102 untersuchten Genotypen.
Abbildung 3: Absolute Veränderung des ppFEV1 gegenüber dem Ausgangswert bei jedem Untersuchungszeitpunkt in Studie 445-102 und in Studie 445-105 bei Patienten, die aus Studie 445-102 übernommen wurden

ppFEV1 = forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; LS-Mittelwert = Mittelwert nach der Methode der kleinsten Quadrate; SE = Standardfehler; OL = unverblindet
Abbildung 4: Absolute Veränderung des ppFEV1 gegenüber dem Ausgangswert bei jedem Untersuchungszeitpunkt in Studie 445-103 und in Studie 445-105 bei Patienten, die aus Studie 445-103 übernommen wurden

ppFEV1 = forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; LS-Mittelwert = Mittelwert nach der Methode der kleinsten Quadrate; SE = Standardfehler; OL = unverblindet
|
Tabelle 11: Studie 445-105 sekundäre unverblindete Wirksamkeitsanalyse, vollständiges Analyseset (F/MF und F/F Patienten)
| |
Analyse
|
Statistik
|
Studie 445-105 Woche 192
| |
PBO in
445-102
N = 203
|
ELX/TEZ/IVA in 445-102
N = 196
|
TEZ/IVA in 445-103
N = 52
|
ELX/TEZ/IVA in 445-103
N = 55
| |
Absolute Veränderung des ppFEV1 gegenüber dem Ausgangswert* (Prozentpunkte)
|
n
|
136
|
133
|
32
|
36
| |
LS-Mittelwert
|
15,3
|
13,8
|
10,9
|
10,7
| |
95 %-KI
|
(13,7; 16,8)
|
(12,3; 15,4)
|
(8,2; 13,6)
|
(8,1; 13,3)
| |
Absolute Veränderung der Schweisschlorid-konzentration gegenüber dem Ausgangswert* (mmol/l)
|
n
|
133
|
128
|
31
|
38
| |
LS-Mittelwert
|
-47,0
|
-45,3
|
-48,2
|
-48,2
| |
95 %-KI
|
(-50,1; -43,9)
|
(-48,5; -42,2)
|
(-55,8; -40,7)
|
(-55,1; -41,3)
| |
Anzahl PEx während des kumulativen TC-Wirksamkeits-zeitraums†
|
Anzahl der Ereignisse
|
385
|
71
| |
Geschätzte Ereignisrate pro Jahr (95 %-KI)
|
0,21 (0,17; 0,25)
|
0,18 (0,12; 0,25)
| |
ppFEV1 = forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; SwCl = Schweisschloridkonzentration; PEx = pulmonale Exazerbation; LS-Mittelwert = Mittelwert nach der Methode der kleinsten Quadrate; KI = Konfidenzintervall; PBO = Placebo; TC = Dreifachkombination
* Ausgangswert = Ausgangswert der Hauptstudie
† Bei Patienten, die auf die ELX/TEZ/IVA-Gruppe randomisiert wurden, umfasst der kumulative TC-Wirksamkeitszeitraum Daten aus den Hauptstudien bis 192 Behandlungswochen in Studie 445-105 (N=255, einschliesslich 4 Patienten, die nicht in 445-105 übernommen wurden). Bei Patienten, die auf die Placebo- oder TEZ/IVA-Gruppe randomisiert wurden, umfasst der kumulative TC-Wirksamkeitszeitraum nur Daten für einen Behandlungszeitraum von 192 Wochen in Studie 445-105 (N=255).
|
Studie 445-104
Im Anschluss an eine 4wöchige Einlaufphase mit Ivacaftor oder Tezacaftor/Ivacaftor zeigte der primäre Endpunkt der mittleren absoluten Veränderung des ppFEV1-Werts innerhalb der Behandlungsgruppe von Baseline bis einschliesslich Woche 8 bei der Trikafta-Gruppe eine statistisch signifikante Verbesserung um 3,7 Prozentpunkte (95 % KI: 2,8; 4,6; p<0,0001) (siehe Tabelle 12). Die mittlere Verbesserung des ppFEV1 wurde bei der ersten Untersuchung an Tag 15 festgestellt. Die Gesamtverbesserungen des ppFEV1 waren unabhängig von Alter, Geschlecht, ppFEV1-Ausgangswert, geographischer Region und Genotyp-Gruppe (F/G oder F/RF) zu beobachten.
Eine Zusammenfassung der primären und sekundären Ergebnisse für die gesamte Studienpopulation ist Tabelle 12 zu entnehmen.
|
Tabelle 12: Primäre und sekundäre Wirksamkeitsanalysen, vollständiges Analyseset (Studie 445-104)
| |
Analyse*
|
Statistik
|
Kontrollgruppe#
N=126
|
Trikafta
N=132
| |
Primäre Analyse
| |
Absolute Veränderung des ppFEV1 gegenüber dem Ausgangswert bis einschliesslich Woche 8 (Prozentpunkte)
|
Veränderung innerhalb der Gruppe (95 % KI)
|
0,2 (-0,7; 1,1)
|
3,7 (2,8; 4,6)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Wichtigste und sonstige sekundäre Analysen
| |
Absolute Veränderung der Schweisschloridkonzentration gegenüber dem Ausgangswert bis einschliesslich Woche 8 (mmol/l)
|
Veränderung innerhalb der Gruppe (95 % KI)
|
0,7 (-1,4; 2,8)
|
-22,3 (-24,5; -20,2)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Absolute Veränderung des ppFEV1 gegenüber dem Ausgangswert bis einschliesslich Woche 8 im Vergleich zur Kontrollgruppe (Prozentpunkte)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
3,5 (2,2; 4,7)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Absolute Veränderung der Schweisschloridkonzentration gegenüber dem Ausgangswert bis einschliesslich Woche 8 im Vergleich zur Kontrollgruppe (mmol/l)
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
-23,1 (-26,1; -20,1)
| |
p-Wert
|
N.a.
|
p<0,0001
| |
Absolute Veränderung des Scores der respiratorischen Domäne des CFQ-R gegenüber dem Ausgangswert bis einschliesslich Woche 8 (Punkte)±
|
Veränderung innerhalb der Gruppe (95 % KI)
|
1,6 (-0,8; 4,1)
|
10,3 (8,0; 12,7)
| |
Absolute Veränderung des Scores der respiratorischen Domäne des CFQ-R gegenüber dem Ausgangswert bis einschliesslich Woche 8 im Vergleich zur Kontrollgruppe (Punkte)±
|
Behandlungsunterschied (95 % KI)
|
N.a.
|
8,7 (5,3; 12,1)
| |
ppFEV1: forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; KI: Konfidenzintervall; N.a.: nicht anwendbar; CFQ-R: Cystic Fibrosis Questionnaire-Revised, überarbeiteter Fragebogen zu zystischer Fibrose.
* Die Baseline für die primären und sekundären Endpunkte ist definiert als das Ende der 4wöchigen Einlaufphase mit Ivacaftor oder Tezacaftor/Ivacaftor.
# Ivacaftor-Gruppe oder Tezacaftor/Ivacaftor-Gruppe.
± Die CFQ-R-Ergebnisse wurden nicht nach dem hierarchischen Verfahren für multiples Testen auf Multiplizität kontrolliert.
|
Studie 445-106 Teil B
In Studie 445-106 Teil B wurde der primäre Endpunkt Sicherheit und Verträglichkeit über 24 Wochen bewertet. Sekundäre Endpunkte waren die Bewertung der Wirksamkeit und Pharmakokinetik einschliesslich der absoluten Veränderung des ppFEV1-Werts (1. sekundärer Endpunkt) und der Schweisschloridkonzentration (2. sekundärer Endpunkt, siehe «Pharmakodynamik») gegenüber Baseline in Woche 24 und die Anzahl der pulmonalen Exazerbationen von Baseline bis einschliesslich Woche 24. Aufgrund der Durchführung der Studie 445-106 Teil B während der COVID-19 Pandemie konnten nicht alle Messungen wie ursprünglich geplant durchgeführt werden. Die Messungen der sekundären Endpunkte waren in unterschiedlichem Ausmass von nicht durchgeführten Messungen betroffen. Tabelle 13 zeigt die wichtigsten sekundären Wirksamkeitsergebnisse in der Gesamtanalyse über 24 Wochen.
Die Messwerte für die ppFEV1-Werte wurden an den geplanten Messtagen bei folgender Anzahl Patienten erhoben: Baseline n=62, Tag 15 n=51, Woche 4 n=52, Woche 8 n=51, Woche 12 n=43, Woche 16 n=29, Woche 24 n=15.
Die Messwerte für die Schweisschloridkonzentration wurden an den geplanten Messtagen bei folgender Anzahl Patienten erhoben: Baseline n=62, Tag 15 n=56, Woche 4 n=56, Woche 12 n=50, Woche 24 n=28.
|
Tabelle 13: Sekundäre Wirksamkeitsanalysen, vollständiges Analyseset über 24 Wochen (Studie 445-106, Teil B)
| |
Analyse
|
Veränderung innerhalb der Gruppe (95 % KI) für Trikafta
N=66
| |
Absolute Veränderung des ppFEV1-Werts von Baseline bis einschliesslich Woche 24 (Prozentpunkte)
|
10,2 (7,9; 12,6)
| |
Absolute Veränderung der Schweisschloridkonzentration von Baseline bis einschliesslich Woche 24 (mmol/l)
|
-60,9 (-63,7; -58,2)
| |
Anzahl der pulmonalen Exazerbationen bis einschliesslich Woche 24‡
|
4 (0,12) ††
| |
KI: Konfidenzintervall; ppFEV1: forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts.
‡ Eine pulmonale Exazerbation war definiert als eine Veränderung der antibiotischen Therapie (i.v., inhalativ oder oral) aufgrund von mindestens 4 von 12 im Voraus festgelegten sinopulmonalen Zeichen/Symptomen.
†† Anzahl von Ereignissen und geschätzte Ereignisrate pro Jahr, berechnet anhand von 48 Wochen pro Jahr.
|
Studie 445-107
Eine 192-wöchige, zweiteilige (Teil A und Teil B), offene Verlängerungsstudie zur Untersuchung der Sicherheit und Wirksamkeit einer Langzeitbehandlung mit Trikafta wurde bei Patienten durchgeführt, welche die Studie 445-106 abgeschlossen hatten. Die Analyse von Teil A (96 Wochen) wurde bei 64 pädiatrischen Patienten im Alter von 6 Jahren und älter durchgeführt und zeigte anhaltende Verbesserungen des ppFEV1-Werts und der Schweisschloridkonzentration, die mit den in der Studie 445-106 beobachteten Ergebnissen übereinstimmen. Anschliessend wurden 48 (75,0 %) Probanden in Teil B der Studie bis zur Woche 192 übernommen. 39 (60,9 %) Probanden schlossen Teil B ab und bestätigten die weiter anhaltende Wirksamkeit. Die sekundären Wirksamkeitsendpunkte der Interims- und der finalen Analyse sind in Tabelle 14 zusammengefasst.
|
Tabelle 14: Sekundäre Wirksamkeitsanalyse, vollständiges Analyseset (N=64) (Studie 445-107)
| |
Analyse
|
Statistik
|
Absolute Veränderung gegenüber Baseline* in Woche 96
|
Absolute Veränderung gegenüber Baseline* in Woche 192
| |
ppFEV1 (Prozentpunkte)
|
n
|
45
|
27
| |
LS-Mittelwert
|
11,2
|
9,6
| |
95 %-KI
|
(8,3; 14,2)
|
(5,4; 13,7)
| |
Schweisschloridkonzentration (mmol/l)
|
n
|
56
|
35
| |
LS-Mittelwert
|
-62,3
|
-57,9
| |
95 %-KI
|
(-65,9; -58,8)
|
(-63,3; -52,5)
| |
PEx während des kumulativen TC-Wirksamkeitszeitraums†
|
Anzahl der Ereignisse
|
7
|
11
| |
Beobachtete Ereignisrate pro Jahr
|
0,04
|
0,045
| |
ppFEV1 = forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; PEx = pulmonale Exazerbation; LS-Mittelwert = Mittelwert nach der Methode der kleinsten Quadrate; KI = Konfidenzintervall; TC = Dreifachkombination
* Ausgangswert = Ausgangswert der Hauptstudie
† Der kumulative TC-Wirksamkeitszeitraum umfasst die Daten der 66 Patienten, die in die Hauptstudie (Studie 445-106 Teil B) aufgenommen wurden und mindestens eine Behandlungsdosis erhielten und/oder während der Studie 445-107 mindestens eine Dosis erhielten.
|
Studie 445-111
Das pharmakokinetische Profil, die Sicherheit und Wirksamkeit von Trikafta bei CF-Patienten im Alter von 2 bis unter 6 Jahren werden durch Nachweise aus Studien mit Trikafta an Patienten im Alter ab 12 Jahren (Studien 445-102, 445-103 und 445-104) unterstützt. Zusätzliche Daten stammen aus einer 24-wöchigen, offenen Phase-3-Studie mit 75 Patienten im Alter von 2 bis unter 6 Jahren (Studie 445-111).
In Studie 445-111 wurde der primäre Endpunkt Sicherheit und Verträglichkeit über 24 Wochen bewertet. Sekundäre Endpunkte waren die Bewertung der Pharmakokinetik und die Wirksamkeitsendpunkte der absoluten Veränderung der Schweisschloridkonzentration (siehe «Pharmakodynamik») und des LCI2.5 von der Baseline bis einschliesslich Woche 24. Tabelle 15 enthält eine Zusammenfassung der sekundären Wirksamkeitsergebnisse.
|
Tabelle 15: Sekundäre Wirksamkeitsanalysen, vollständiges Analyseset (Studie 445-111)
| |
Analyse
|
Statistik
|
Veränderung innerhalb der Gruppe (95 % KI) für Trikafta
| |
Absolute Veränderung der Schweisschloridkonzentration von Baseline bis einschliesslich Woche 24 (mmol/l)
|
N*
LS-Mittelwert (95 % KI)
|
75
-57,9 (-61,3; -54,6)
| |
Absolute Veränderung des LCI2.5 von Baseline bis einschliesslich Woche 24
|
N
LS-Mittelwert (95 % KI)
|
63‡
-0,83 (-1,01; -0,66)
| |
Anzahl der pulmonalen Exazerbationen bis einschliesslich Woche 24**
|
N
Anzahl der Ereignisse (geschätzte Ereignisrate pro Jahr)
|
75
12 (0,32) ††
| |
KI: Konfidenzintervall; LCI: Lung Clearance Index.
* N ist die Anzahl der Patienten im entsprechenden vollständigen Analyseset
‡ Der LCI wurde nur bei Patienten bewertet, die beim Screening 3 Jahre oder älter waren
** Altersspezifische Definitionen von PEx werden für Patienten von 2 bis einschliesslich 5 Jahren und ab 6 Jahren verwendet.
†† Anzahl der Ereignisse und geschätzte Ereignisrate pro Jahr auf der Grundlage von 48 Wochen pro Jahr.
|
Studie 445-124
Die Wirksamkeit und Sicherheit von Trikafta wurde bei Patienten ab 6 Jahren mit CF ohne F508del-Mutation untersucht (Studie 445-124).
In Studie 445-124 war der primäre Endpunkt für die Wirksamkeit das ppFEV1. Sekundäre Endpunkte waren die absolute Veränderung der Schweisschloridkonzentration, der Score der respiratorischen Domäne des CFQ-R, Wachstumsparameter (BMI, Körpergewicht) und die Anzahl von PEx. Tabelle 16 enthält eine Zusammenfassung der primären und sekundären Wirksamkeitsendpunkte.
|
Tabelle 16: Primäre und sekundäre Wirksamkeitsanalysen, vollständiges Analyseset (Studie 445-124)
| |
Analyse
|
Statistik
|
Placebo
N = 102
|
ELX/TEZ/IVA
N = 205
| |
Primäre Analyse
| |
Absolute Veränderung des ppFEV1 gegenüber Baseline bis einschliesslich Woche 24 (Prozentpunkte)
|
Behandlungsunterschied (95 %-KI)
|
NA
|
9,2 (7,2; 11,3)
| |
p-Wert
|
NA
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-0,4 (0,8)
|
8,9 (0,6)
| |
Sekundäre Analyse
| |
Absolute Veränderung der Schweisschloridkonzentration gegenüber Baseline bis einschliesslich Woche 24 (mmol/l)
|
Behandlungsunterschied (95 %-KI)
|
NA
|
-28,3 (-32,1, -24,5)
| |
p-Wert
|
NA
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
0,5 (1,6)
|
-27,8 (1,1)
| |
Absolute Veränderung des Scores der respiratorischen Domäne des CFQ-R von Baseline bis einschliesslich Woche 24 (Punkte)
|
Behandlungsunterschied (95 %-KI)
|
NA
|
19,5 (15,5; 23,5)
| |
p-Wert
|
NA
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
-2,0 (1,6)
|
17,5 (1,2)
| |
Absolute Veränderung des BMI gegenüber Baseline in Woche 24 (kg/m2)
|
Behandlungsunterschied (95 %-KI)
|
NA
|
0,47 (0,24; 0,69)
| |
p-Wert
|
NA
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
0,35 (0,09)
|
0,81 (0,07)
| |
Absolute Veränderung des Körpergewichts gegenüber Baseline in Woche 24 (kg)
|
Behandlungsunterschied (95 %-KI)
|
NA
|
1,3 (0,6; 1,9)
| |
p-Wert
|
NA
|
p<0,0001
| |
Veränderung innerhalb der Gruppe (SE)
|
1,2 (0,3)
|
2,4 (0,2)
| |
Anzahl der PEx bis einschliesslich Woche 24
|
Rate Ratio (95 %-KI)
|
NA
|
0,28 (0,15; 0,51)
| |
p-Wert
|
NA
|
p<0,0001
| |
Anzahl der Ereignisse
|
40
|
21
| |
Geschätzte Rate pro Jahr
|
0,63
|
0,17
| |
BMI: Body Mass Index (Körpermassenindex); CFQ-R RD: Cystic Fibrosis Questionnaire-Revised Respiratory Domain (überarbeiteter Fragebogen zu zystischer Fibrose, respiratorische Domäne); ELX: Elexacaftor; IVA: Ivacaftor; N: Grösse der Gesamtstichprobe; p: Wahrscheinlichkeit; PEx: pulmonale Exazerbation; ppFEV1: forciertes exspiratorisches Volumen in 1 Sekunde in Prozent des Sollwerts; SE: Standardfehler; TEZ: Tezacaftor.
|
Studie CFD-016
Die Wirksamkeit von Trikafta bei CF-Patienten im Alter ab 6 Jahren wurde auch in einer retrospektiven Studie zur Bewertung der klinischen Ergebnisse anhand von Real World Data bei CF-Patienten ohne F508del-Mutation untersucht. Dazu wurden Daten des Patientenregisters der US Cystic Fibrosis Foundation herangezogen. Der primäre Wirksamkeitsendpunkt in Studie CFD-016 war das ppFEV1. Die mittlere Veränderung des ppFEV1 gegenüber dem Ausgangswert betrug 4,53 Prozentpunkte (n = 422; 95 %-KI: 3,50; 5,56).
|




