Eigenschaften/WirkungenPharmakotherapeutische Gruppe: Ophthalmika, Glaukommittel und Miotika
ATC-Code
S01EE51
Wirkungsmechanismus
Roclanda enthält zwei Wirkstoffe: Latanoprost und Netarsudil. Diese beiden Bestandteile senken den Augeninnendruck, indem der Abfluss von Kammerwasser erhöht wird. Sowohl Latanoprost als auch Netarsudil senken den Augeninnendruck durch Steigerung des Kammerwasserabflusses, jedoch sind ihre Wirkmechanismen unterschiedlich.
Studien an Tieren und Menschen deuten darauf hin, dass der Hauptwirkmechanismus von Netarsudil, einem Rho-Kinase-Hemmer, ein erhöhter trabekulärer Abfluss ist. Diese Studien legen ausserdem nahe, dass Netarsudil den Augeninnendruck senkt, indem der episklerale Venendruck reduziert wird.
Studien an Tieren und Menschen zeigten, dass der Hauptwirkmechanismus von Latanoprost, einem Prostaglandin-F2α-Analogon, ein gesteigerter uveoskleraler Abfluss ist, auch wenn beim Menschen eine gewisse Steigerung Abflusses (Abnahme des Abflusswiderstands) beschrieben wurde.
Pharmakodynamik
Siehe «Wirkungsmechanismus».
Klinische Wirksamkeit
Roclanda wurde in 3 randomisierten, doppelblinden, multizentrischen klinischen Studien der Phase 3 an 1,686 Patienten mit Offenwinkelglaukom und okulärer Hypertension untersucht. In Studie 301 und 302 wurden Studienteilnehmer mit einem Augeninnendruck < 36 mmHg aufgenommen, und die Wirkung von einmal täglich gegebenem Latanoprost + Netarsudil auf die Senkung des Augeninnendrucks wurde mit der Einzelanwendung von einmal täglich Netarsudil 0,02 % und einmal täglich Latanoprost 0,005 % verglichen. Die Behandlungsdauer von Studie 301 betrug 12 Monate und die von Studie 302 3 Monate. Das mediane Alter der Studienteilnehmer betrug 66 Jahre (Spanne: 18 bis 99 Jahre). In Studie 303 wurde die Wirkung von Latanoprost + Netarsudil im Vergleich zu Ganfort® (Bimatoprost 0,03 %/Timolol 0,5 %) auf die Senkung der okulären Hypertension beurteilt. Die Behandlungsdauer betrug 6 Monate.
Studien 301 und 302 waren so aufgebaut, dass die Überlegenheit von Latanoprost + Netarsudil bei einmal täglicher Gabe jeweils abends gegenüber den Einzelbestandteilen Netarsudil 0,02 % einmal täglich und Latanoprost 0,005 % einmal täglich gezeigt werden konnte. Der Hauptindikator für das Wirksamkeitsergebnis war der Kleinste-Quadrate (LS)-Mittelwert des Augeninnendrucks zu jedem von 9 Zeitpunkten, gemessen jeweils um 08:00 Uhr, 10:00 Uhr und 16:00 Uhr an Tag 15, Tag 43 und Tag 90. Die durchschnittliche Wirkung von Latanoprost + Netarsudil in Bezug auf die Senkung des Augeninnendrucks war über 3 Monate hinweg um 1 bis 3 mmHg grösser als bei einer Monotherapie mit Netarsudil 0,02 % oder Latanoprost 0,005 % (Abbildung 1 und 2). In Studie 301 wurden die Reduzierungen des Augeninnendrucks aufrechterhalten und zeigten die statistische Überlegenheit von Latanoprost + Netarsudil über den Behandlungszeitraum von 12 Monaten. In allen Fällen waren die Unterschiede beim LS-Mittelwert des Augeninnendrucks bis einschliesslich Monat 3 klinisch relevant und statistisch signifikant (p < 0,0001). Ungefähr 30 % der in die Phase-3-Studien einbezogenen Patienten hatten einen Ausgangs-IOP-Wert von ≥27 mmHg (132 in der Behandlungsgruppe mit Latanoprost + Netarsudil, 136 in der Latanoprost-Gruppe und 143 in der Netarsudil-Gruppe). Bei diesen Patienten zeigten Latanoprost + Netarsudil zu allen Messzeitpunkten eine statistisch signifikant überlegene Wirksamkeit in Bezug auf die Senkung des IOP gegenüber den Einzelkomponenten. In beiden Studien senkte das Kombinationspräparat den IOP um weitere 1,7 mmHg bis 3,7 mmHg im Vergleich zu Latanoprost allein, und um weitere 3,4 mmHg bis 5,9 mmHg im Vergleich zu Netarsudil allein.
Abbildung 1: Studie 301: mittlerer IOP (mmHg) nach Behandlungsgruppe und Behandlungsunterschied beim mittleren IOP
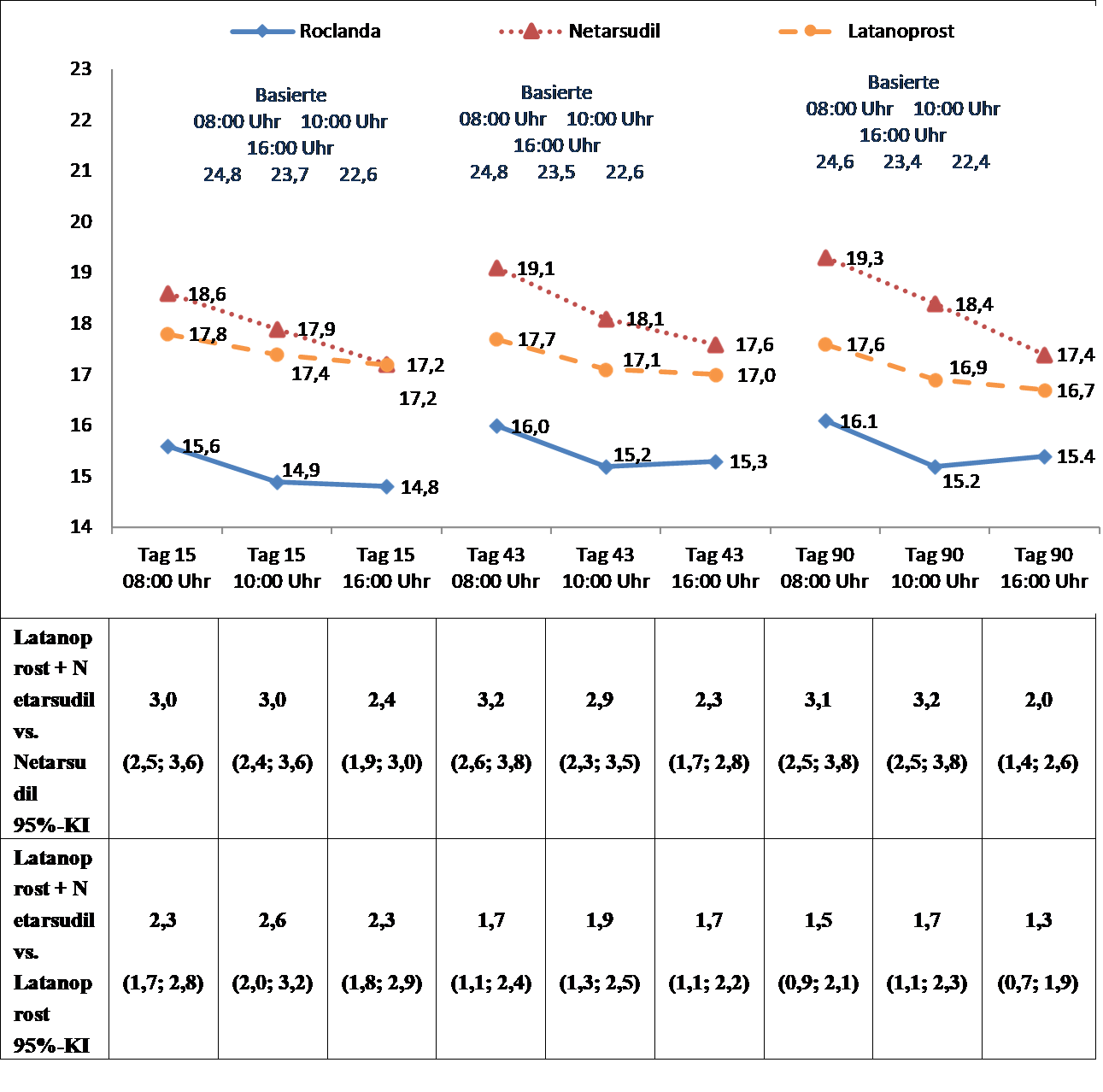
Der LS-Mittelwert des IOP bei jedem Zeitpunkt nach Baseline wurde mithilfe einer um den Baseline-IOP bereinigten Kovarianzanalyse abgeleitet und basierte auf beobachteten Daten für alle randomisierten Studienteilnehmer (238 in der Latanoprost + Netarsudil-Gruppe, 244 in der Netarsudil-Gruppe, 236 in der Latanoprost-Gruppe).
Abbildung 2: Studie 302: mittlerer IOP (mmHg) nach Behandlungsgruppe und Behandlungsunterschied beim mittleren IOP

Der LS-Mittelwert des IOP bei jedem Zeitpunkt nach Baseline wurde mithilfe einer um den Baseline-IOP bereinigten Kovarianzanalyse abgeleitet und basierte auf beobachteten Daten für alle randomisierten Studienteilnehmer (245 in der Latanoprost + Netarsudil-Gruppe, 255 in der Netarsudil-Gruppe, 250 in der Latanoprost-Gruppe).
Etwa 67 % der in die Behandlungsgruppen mit Latanoprost + Netarsudil aufgenommenen Patienten der Phase-3-Studien waren Kaukasier und 30 % Dunkelhäutige oder Afroamerikaner. Über die Hälfte waren ≥ 65 Jahre alt. Mit Ausnahme der Inzidenz von Vortexkeratopathie (Siehe «Unerwünschte Wirlungen») wurde zwischen den ethnischen Abstammungen oder Altersgruppen kein Unterschied bezüglich des Sicherheitsprofils beobachtet.
Die Abschlussraten in den Studien 301 und 302 waren in der Behandlungsgruppe mit Latanoprost + Netarsudil niedriger als in der Latanoprost-Gruppe. Die Abbruchraten aufgrund von Nebenwirkungen lagen in Monat 3 bei 8,7 % in der gepoolten Behandlungsgruppe mit Latanoprost + Netarsudil gegenüber 7,6 % in der gepoolten Netarsudil-Gruppe und 1,0 % in der gepoolten Latanoprost-Gruppe. In Studie 301 lagen die Abbruchraten aufgrund von Nebenwirkungen in Monat 12 bei 19,7 % in der Behandlungsgruppe mit Latanoprost + Netarsudil gegenüber 21,7 % in der Netarsudil-Gruppe und 1,7 % in der Latanoprost-Gruppe. Die Mehrheit der Abbrüche war auf okuläre Nebenwirkungen zurückzuführen. Die am häufigsten gemeldete Nebenwirkung im Zusammenhang mit Studienabbrüchen in der Behandlungsgruppe mit Latanoprost + Netarsudil war Bindehauthyperämie (7,6 % in Monat 12). Die meisten okulären Nebenwirkungen, die im Zusammenhang mit Latanoprost + Netarsudil berichtet wurden, waren leicht ausgeprägt.
Studie 303 war eine prospektive, doppelblinde, randomisierte, multizentrische, aktiv kontrollierte, 6monatige Studie im Parallelgruppendesign, in der die Sicherheit und Wirkung von Latanoprost + Netarsudil in Bezug auf die Senkung des Augeninnendrucks im Vergleich zu Bimatoprost + Timolol bei 430 Teilnehmern mit erhöhtem Augeninnendruck beurteilt wurden. Die Teilnehmer wurden randomisiert einem geplanten Behandlungsschema mit fester Dosis von einmal täglich (QD) jeden Abend als ein Tropfen in jedes Auge verabreichtem Latanoprost + Netarsudil (218 Teilnehmer) oder von QD jeden Abend als ein Tropfen in jedes Auge verabreichtem Vergleichspräparat Bimatoprost + Timolol (212 Teilnehmer) zugewiesen. Das Behandlungsschema wurde nach einer Auswaschphase 180 Tage lang verabreicht.
Das primäre Wirksamkeitsergebnis war der Vergleich von Latanoprost + Netarsudil und Bimatoprost + Timolol bezüglich des mittleren IOP zu bestimmten Zeitpunkten in Woche 2, Woche 6 und in Monat 3. Die primäre Analyse wurde mit der ITT-Population und unter Verwendung der MCMC (Markov Chain Monte Carlo)-Methode zur Imputation durchgeführt. In dieser Analyse zeigte sich eine klinische Nicht-Unterlegenheit der „Latanoprost + Netarsudil“-Lösung für die Augen im Vergleich zu Bimatoprost + Timolol; die Verabreichung erfolgte in der ITT-Population QD und der obere Grenzwert der 95 %-KI lag im Bereich des Unterschieds (Latanoprost + Netarsudil – Bimatoprost + Timolol), wobei der Unterschied von Woche 2 bis Monat 3 an allen 9 Zeitpunkten bei ≤ 1,5 mmHg und an den meisten Zeitpunkten (6 von 9) bei ≤ 1,0 mmHg lag, was die Kriterien eines Erfolgs erfüllt. Die Schwelle für eine klinische Nicht-Unterlegenheit von Latanoprost + Netarsudil QD im Vergleich zu Bimatoprost + Timolol QD (Unterschied zwischen den Gruppen von ≤ 1,5 mmHg) wurde in Woche 2 bis Monat 3 unter Verwendung der MCMC-Methode in der PP-Population an 8 der 9 Zeitpunkte (08:00 Uhr, 10:00 Uhr und 16:00 Uhr) nachgewiesen. Insgesamt wurde die klinische Nicht-Unterlegenheit jedoch nicht erreicht, da der obere Grenzwert des 95 %-KI zum Zeitpunkt 08:00 Uhr in Woche 6 bei 1,55 lag. Im Allgemeinen kam es in der „Latanoprost + Netarsudil“-Gruppe und der „Bimatoprost + Timolol“-Gruppe zu einer vergleichbaren mittleren Senkung des IOP im Laufe des Tages von ungefähr 9,5 mmHg.
Die Gesamtrate der Studienbehandlungsabbrüche aufgrund eines behandlungsbedingten unerwünschten Ereignisses (UE) lag bei 11,2 %. Mehr Teilnehmer in der Behandlungsgruppe, die Latanoprost + Netarsudil QD erhielten, brachen die Behandlung aufgrund eines behandlungsbedingten UE ab (20,2 %) als Teilnehmer in der Gruppe, die Bimatoprost + Timolol QD erhielten (1,9 %), und der Grossteil der behandlungsbedingten UE, die zu einem Behandlungsabbruch führten, betrafen die Augen. In keiner Behandlungsgruppe wurden schwerwiegende behandlungsbedingte unerwünschte Ereignisse berichtet und das Sicherheitsprofil stimmt weiterhin mit dem bekannten Profil von Latanoprost + Netarsudil und/oder Latanoprost oder Netarsudil allein überein.,
Die Wirksamkeit und Sicherheit von Latanoprost + Netarsudil bei Patienten mit beeinträchtigtem Hornhautepithel oder gleichzeitig bestehenden Augenerkrankungen, z. B. Pseudoexfoliation oder Pigmentdispersionssyndrom, sind nicht erwiesen.
|


