ZusammensetzungWirkstoffe
Polysaccharida streptococci pneumoniae (serotype 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F, 33F) conjugatum cum proteinum corynebacteriae diphteriae CRM197.
Adjuvans
Aluminii phosphas.
Hilfsstoffe
Natrii chloridum (corresp. 1.73 mg Natrium), acidum succinicum, polysorbatum 80, aqua ad iniectabilia.
Indikationen/AnwendungsmöglichkeitenAktive Immunisierung zur Prävention von invasiven Erkrankungen, Pneumonie und akuter Otitis media, die durch Streptococcus pneumoniae verursacht werden, bei Säuglingen und Kindern im Alter von 6 Wochen bis 5 Jahren.
Aktive Immunisierung zur Prävention von invasiven Erkrankungen und Pneumonie, die durch Streptococcus pneumoniae verursacht werden, bei Personen ab einem Alter von 65 Jahren.
Prevenar 20 schützt nicht gegen Erkrankungen verursacht durch S. pneumoniae-Serotypen, welche nicht im Impfstoff enthalten sind.
Für Informationen zum Schutz vor bestimmten Pneumokokken-Serotypen, siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen».
Die Anwendung von Prevenar 20 sollte auf Basis von offiziellen Empfehlungen erfolgen.
Dosierung/AnwendungÜbliche Dosierung
Säuglinge und Kinder im Alter von 6 Wochen bis 5 Jahren
Es wird empfohlen, bei Säuglingen, die bei der ersten Impfung Prevenar 20 erhalten, die Impfserie mit Prevenar 20 zu Ende zu führen.
Säuglinge im Alter von 6 Wochen bis 6 Monaten
Das empfohlene Impfschema besteht aus 4 Dosen von je 0.5 ml (Grundimmunisierung mit 3 Dosen, gefolgt von einer Booster-Dosis):
Die Grundimmunisierung für Säuglinge besteht aus 3 Dosen, wobei die erste Dosis normalerweise ab einem Alter von 2 Monaten, die zweite Dosis im Alter von vier Monaten und die dritte Dosis im Alter von sechs Monaten verabreicht wird.
Die erste Dosis kann auch bereits im Alter von 6 Wochen verabreicht werden, wobei der Abstand zwischen den Dosen mindestens 4 Wochen betragen muss.
Die vierte (Booster)-Dosis wird im Alter von 11-15 Monaten empfohlen (siehe «Eigenschaften/Wirkungen»).
Es liegen keine bzw. nur begrenzte Daten zu Prevenar 20 bei Frühgeborenen, älteren ungeimpften oder nicht vollständig geimpften Säuglingen und Kindern vor (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Die folgenden Dosierungsempfehlungen beruhen in erster Linie auf den Erfahrungen mit Prevenar 13.
Frühgeborene Säuglinge (<37 Schwangerschaftswochen)
Das empfohlene Impfschema für Prevenar 20 besteht aus 4 Dosen von je 0.5 ml. Die Grundimmunisierung für Säuglinge besteht aus 3 Dosen, wobei die erste Dosis normalerweise ab einem Alter von 2 Monaten gegeben wird und der Abstand zwischen den Dosen mindestens 4 Wochen beträgt. Die erste Dosis kann auch bereits im Alter von 6 Wochen verabreicht werden. Die vierte (Booster)-Dosis wird im Alter von 11-15 Monaten empfohlen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Nachhol-Impfschemata für ungeimpfte Säuglinge und Kinder im Alter von 7 Monaten bis zu 5 Jahren
|
Ungeimpfte Säuglinge im Alter von 7 bis <12 Monaten
|
3 Dosen
|
Zwei Dosen von je 0.5 ml im Abstand von mindestens 4 Wochen.
Eine dritte Dosis wird im zweiten Lebensjahr empfohlen.
| |
Ungeimpfte Kinder von 12 bis <24 Monaten
|
2 Dosen
|
Zwei Dosen von je 0.5 ml im Abstand von mindestens 8 Wochen.
| |
Ungeimpfte Kinder von 2 bis <5 Jahren
|
1 Dosis
|
Eine Einzeldosis von 0.5 ml.
|
Nachhol-Impfschemata für Kinder im Alter von 12 Monaten bis <5 Jahren, die zuvor vollständig mit Prevenar 13 geimpft wurden
Impfung mit einer Einzeldosis (0.5 ml) auf individueller Basis gemäss den offiziellen Empfehlungen, um eine Immunantwort auf die zusätzlichen Serotypen hervorzurufen.
Wenn Prevenar 13 verabreicht wurde, sollte Prevenar 20 frühestens 8 Wochen danach gegeben werden (siehe «Eigenschaften/Wirkungen»).
Personen ab einem Alter von 65 Jahren
Prevenar 20 wird bei Personen ab einem Alter von 65 Jahren als Einzeldosis verabreicht.
Die Notwendigkeit einer Wiederholungsimpfung mit einer nachfolgenden Dosis von Prevenar 20 wurde nicht untersucht.
Daten zur sequenziellen Impfung mit anderen Pneumokokken-Impfstoffen oder einer Auffrischungsimpfung liegen für Prevenar 20 nicht vor. Basierend auf den klinischen Erfahrungen mit Prevenar 13 (einem Pneumokokken-Konjugatimpfstoff, der aus 13 Polysaccharidkonjugaten besteht, die auch in Prevenar 20 enthalten sind) sollte Prevenar 20 zuerst verabreicht werden, wenn die Anwendung eines 23valenten Pneumokokken-Polysaccharidimpfstoffs (PPSV23) in Betracht gezogen wird (siehe «Eigenschaften/Wirkungen»).
Rückverfolgbarkeit
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Spezielle Dosierungsanweisungen
Es liegen keine Daten zu Prevenar 20 bei besonderen Personengruppen vor.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Prevenar 20 bei Säuglingen, die jünger sind als 6 Wochen, ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Nur zur intramuskulären Anwendung.
Die Dosis (0.5 ml) Prevenar 20 sollte intramuskulär verabreicht werden. Die zu bevorzugenden Stellen sind die anterolaterale Seite des Oberschenkels (Musculus vastus lateralis) bei Säuglingen oder der Deltamuskel des Oberarms bei Kindern und Erwachsenen. Bei der Verabreichung von Prevenar 20 ist darauf zu achten ist, dass eine Injektion in oder in die Nähe von Nerven und Blutgefässen vermieden wird.
Hinweise zur Handhabung des Impfstoffs vor der Anwendung, siehe «Sonstige Hinweise», «Hinweise für die Handhabung».
KontraindikationenÜberempfindlichkeit gegen die Wirkstoffe, einen der in Abschnitt «Zusammensetzung» genannten sonstigen Bestandteile oder gegen Diphtherie-Toxoid.
Warnhinweise und VorsichtsmassnahmenPrevenar 20 darf nicht intravaskulär verabreicht werden.
Überempfindlichkeit
Wie bei allen injizierbaren Impfstoffen muss für den seltenen Fall einer anaphylaktischen Reaktion nach Verabreichung des Impfstoffs eine geeignete medizinische Versorgung und Überwachung gewährleistet sein.
Gleichzeitig bestehende Erkrankung
Bei Personen, die an einer schweren akuten fiebrigen Erkrankung leiden, sollte die Impfung auf einen späteren Zeitpunkt verschoben werden. Bei einer leichten Infektion, z.B. einer Erkältung, sollte die Impfung jedoch nicht verschoben werden.
Thrombozytopenie und Koagulationsstörungen
Der Impfstoff muss bei Personen mit Thrombozytopenie oder Blutgerinnungsstörungen mit Vorsicht verabreicht werden, da nach intramuskulärer Verabreichung Blutungen auftreten können.
Das Risiko von Blutungen bei Patienten mit Gerinnungsstörungen muss vor der intramuskulären Verabreichung jedes Impfstoffs sorgfältig geprüft werden, und eine subkutane Verabreichung sollte in Betracht gezogen werden, wenn der potenzielle Nutzen die Risiken deutlich überwiegt.
Schutz vor Pneumokokken-Erkrankungen
Prevenar 20 schützt ausschliesslich gegen Streptococcus-pneumoniae-Serotypen, die in dem Impfstoff enthalten sind, siehe «Klinische Wirksamkeit». Es bietet keinen Schutz gegen andere Mikroorganismen, die invasive Erkrankungen, Pneumonie oder Otitis Media verursachen. Wie bei allen Impfstoffen gilt, dass Prevenar 20 nicht alle Personen, die diesen Impfstoff erhalten, vor einer Pneumokokken-Erkrankung schützen kann.
Immungeschwächte Personen
Es sind keine Daten zur Sicherheit und Immunogenität von Prevenar 20 bei Personen aus immungeschwächten Gruppen verfügbar. Über eine Impfung sollte individuell entschieden werden.
Basierend auf den Erfahrungen mit Pneumokokken-Impfstoffen können einige Personen mit veränderter Immunkompetenz eine verminderte Immunantwort auf Prevenar 20 aufweisen.
Personen mit eingeschränkter Immunantwort, sei es aufgrund einer immunsuppressiven Therapie, eines genetischen Defekts, einer HIV-Infektion oder anderer Ursachen, können auf die aktive Immunisierung mit einer verringerten Antikörperantwort reagieren. Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Pädiatrische Population
Das mögliche Risiko von Apnoen und die Notwendigkeit einer 48-72 Stunden dauernden respiratorischen Überwachung sollte erwogen werden, wenn die Grundimmunisierung an extrem Frühgeborene (geboren in oder vor der 28. Schwangerschaftswoche) und insbesondere an solche mit anamnestisch unreifem Atemsystem verabreicht wird. Da der Nutzen der Impfung in dieser Gruppe von Säuglingen hoch ist, sollte die Impfung nicht vorenthalten oder verschoben werden.
Hilfsstoffe von besonderem Interesse
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Impfdosis (0.5 ml Injektionssuspension), d.h. es ist nahezu «natriumfrei».
InteraktionenVerschiedene injizierbare Impfstoffe sollten immer an unterschiedlichen Injektionsstellen verabreicht werden.
Prevenar 20 darf nicht mit anderen Impfstoffen/Arzneimitteln in derselben Spritze gemischt werden.
Pädiatrische Population
In klinischen Studien mit Säuglingen und Kleinkindern im Alter von 6 Wochen bis <15 Monaten wurde die gleichzeitige Gabe von Prevenar 20 mit den folgenden Impfstoffantigenen, entweder als monovalenter Impfstoff oder als Kombinationsimpfstoff, untersucht: Diphtherie, Tetanus, azelluläre Pertussis, Haemophilus influenzae Typ b, inaktivierte Poliomyelitis, Hepatitis B, Masern, Mumps, Röteln (MMR) und Varizellen. In klinischen Studien war die gleichzeitige Gabe von Rotavirus-Impfstoffen und Prevenar 20 erlaubt; Sicherheitsbedenken wurden nicht beobachtet.
Erwachsene ≥65 Jahre
In einer Studie mit Erwachsenen im Alter von 65 Jahren und älter wurde die gleichzeitige Gabe von Prevenar 20 mit einem saisonalen Influenzaimpfstoff (QIV; Oberflächenantigen, inaktiviert, adjuvantiert) untersucht. Bei Personen mit Grunderkrankungen, die mit einem hohen Risiko für die Entwicklung einer lebensbedrohlichen Pneumokokkenerkrankung verbunden sind, kann eine getrennte Verabreichung von QIV und Prevenar 20 (z.B. im Abstand von etwa 4 Wochen) in Betracht gezogen werden. In einer doppelblinden, randomisierten Studie (B7471004) bei Erwachsenen ab einem Alter von 65 Jahren war die Immunantwort formal nicht unterlegen, jedoch wurden bei gleichzeitiger Verabreichung mit einem saisonalen Influenzaimpfstoff (QIV; Oberflächenantigen, inaktiviert, adjuvantiert) numerisch niedrigere Titer für alle in Prevenar 20 enthaltenen Pneumokokken-Serotypen beobachtet als bei alleiniger Verabreichung von Prevenar 20. Die klinische Relevanz dieses Ergebnisses ist nicht bekannt.
In einer Studie mit Erwachsenen im Alter von 65 Jahren und älter wurde die gleichzeitige Gabe von Prevenar 20 mit einem COVID-19-mRNA-Impfstoff (Nukleosid-modifiziert) untersucht. Dabei war die Immunantwort zwischen Teilnehmern, die Prevenar 20 und Kochsalz-Placebo gegenüber Teilnehmern, die Prevenar 20 und den COVID-19-mRNA-Impfstoff (Nukleosid-modifiziert) erhielten, vergleichbar.
Es liegen keine Daten zur gleichzeitigen Verabreichung von Prevenar 20 mit anderen Impfstoffen vor.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen keine Daten zur Anwendung von Prevenar 20 bei Schwangeren vor.
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität.
Die Verabreichung von Prevenar 20 in der Schwangerschaft sollte nur in Betracht gezogen werden, wenn der potenzielle Nutzen die möglichen Risiken für Mutter und Fötus überwiegt.
Stillzeit
Es ist nicht bekannt, ob Prevenar 20 in die Muttermilch übergeht.
Fertilität
Es liegen keine Daten über die Auswirkungen von Prevenar 20 auf die Fertilität beim Menschen vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die weibliche Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenPrevenar 20 hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Jedoch können einige der in Kapitel «Unerwünschte Wirkungen» erwähnten Wirkungen die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen vorübergehend beeinträchtigen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Pädiatrische Population
Die Sicherheit von Prevenar 20 wurde bei 5987 Teilnehmern im Alter von 6 Wochen bis <18 Jahren in vier randomisierten, doppelblinden, Wirkstoff-kontrollierten klinischen Studien und einer einarmigen klinischen Studie untersucht (eine Phase-2 und vier Phase-3-Studien). 3664 Teilnehmer erhielten mindestens 1 Dosis Prevenar 20 und 2323 Teilnehmer erhielten Prevenar 13 (Kontrollimpfstoff).
Säuglinge und Kinder im Alter von 6 Wochen bis <15 Monaten
Klinische Studien wurden an gesunden Säuglingen und Kindern im Alter von 6 Wochen bis <15 Monaten unter Anwendung eines Impfschemas mit 3 Dosen (Phase-3-Studie B7471012 [Studie 1012]) oder mit 4 Dosen (Phase-3-Studien B7471011 and B7471013 [Studien 1011 and 1013] und der Phase-2-Studie B7471003 [Studie 1003]) durchgeführt. In diesen 4 Säuglingsstudien erhielten 5156 Teilnehmer mindestens 1 Impfstoffdosis: 2833 erhielten Prevenar 20 und 2323 erhielten Prevenar 13. Insgesamt erhielten etwa 90% der Teilnehmer in jeder Gruppe alle Dosen bis zur studienspezifischen Booster-Dosis. In allen Studien wurden lokale Reaktionen und systemische Ereignisse nach jeder Dosis erfasst. Ebenso wurden in allen Studien unerwünschte Ereignisse ab der 1. Dosis bis 1 Monat nach der letzten Impfung der Grundimmunisierung und ab der Booster-Impfung bis 1 Monat nach der Impfung erfasst. Schwerwiegende unerwünschte Ereignisse wurden bis 1 Monat nach der letzten Dosis in Studie 1012 und bis 6 Monate nach der letzten Dosis in den Studien 1011, 1013 und 1003 ausgewertet.
Die Raten schwerwiegender lokaler Reaktionen und systemischer Ereignisse waren niedrig, und die meisten Reaktionen klangen innerhalb von 1 bis 3 Tagen ab. Die prozentualen Anteile der Teilnehmer mit lokalen Reaktionen und systemischen Ereignissen nach Gabe von Prevenar 20 waren im Allgemeinen ähnlich wie nach Prevenar 13. Basierend auf den Säuglings-Daten, waren die am häufigsten berichteten lokalen Reaktionen und systemischen Ereignisse nach einer beliebigen Dosis Prevenar 20 Reizbarkeit, Benommenheit und Schmerzen an der Injektionsstelle. In diesen Studien wurde Prevenar 20 zusammen mit bestimmten Standard-Impfungen für Kinder gegeben oder die gemeinsame Verabreichung war erlaubt (siehe «Interaktionen»).
Studie 1012 war eine pivotale, randomisierte, doppelblinde, Wirkstoff-kontrollierte Phase-3-Studie, in der 601 gesunde 2 Monate alte Säuglinge (≥42 bis ≤112 Tage), die nach >36 Schwangerschaftswochen geboren wurden, Prevenar 20 nach einem Impfschema mit 3 Dosen erhielten. Die am häufigsten (>10%) berichteten Nebenwirkungen nach einer beliebigen Dosis Prevenar 20 waren Reizbarkeit (71.0% bis 71.9%), Benommenheit/vermehrtes Schlafen (50.9% bis 61.2%), Schmerzen an der Injektionsstelle (22.8% bis 42.4%), verminderter Appetit (24.7% bis 39.3%), Rötung an der Injektionsstelle (25.3% bis 36.9%), Schwellung an der Injektionsstelle (21.4% bis 29.8%) und Fieber ≥38.0°C (8.9% bis 24.3%). Die meisten Nebenwirkungen traten innerhalb von 1 bis 2 Tagen nach der Impfung auf und waren leicht bis mässig stark ausgeprägt und von kurzer Dauer (1 bis 2 Tage).
Die Studien 1011, 1013 und 1003 waren doppelblinde, randomisierte, Wirkstoff-kontrollierte Studien, an denen 2232 gesunde Säuglinge teilnahmen, die mit Prevenar 20 nach einem Impfschema mit 4 Dosen geimpft wurden. Die am häufigsten (>10%) berichteten Nebenwirkungen nach einer beliebigen Dosis Prevenar 20 bei Säuglingen waren Reizbarkeit (58.5% bis 70.6%), Benommenheit/vermehrtes Schlafen (37.7% bis 66.2%), Schmerzen an der Injektionsstelle (32.8% bis 45.5%), verminderter Appetit (23.0% bis 26.4%), Rötung an der Injektionsstelle (22.6% bis 24.5%) und Schwellung an der Injektionsstelle (15.1% bis 17.6%). Die meisten Nebenwirkungen nach der Impfung waren leicht oder mässig stark ausgeprägt und klangen innerhalb von 1 bis 3 Tagen ab. Schwerwiegende Reaktionen wurden selten berichtet.
In Studie 1013 waren lokale Reaktionen und systemische Ereignisse in der Untergruppe der Frühgeborenen (111 Säuglinge, die im Gestationsalter von 34 bis <37 Wochen geboren wurden) ähnlich häufig oder seltener als bei den reifgeborenen Säuglingen der Studie. In der Untergruppe der Frühgeborenen betrug die Häufigkeit aller berichteten lokalen Reaktionen in der Prevenar 20-Gruppe 31.7% bis 55.3%. Die Häufigkeit aller berichteten systemischen Ereignisse betrug 65.0% bis 85.5% in der Prevenar 20-Gruppe.
Kinder im Alter von 15 Monaten bis <5 Jahren
In der Phase-3-Studie B7471014 (Studie 1014) erhielten insgesamt 831 Teilnehmer im Alter von 15 Monaten bis <18 Jahren eine Einzeldosis Prevenar 20 in vier Altersgruppen (davon waren 209 Teilnehmer im Alter von 15 bis <24 Monaten, 216 Teilnehmer im Alter von 2 bis <5 Jahren). Die Teilnehmer unter 5 Jahren hatten zuvor mindestens 3 Dosen Prevenar 13 erhalten.
Die am häufigsten (>10 %) berichteten Nebenwirkungen nach einer beliebigen Dosis Prevenar 20 bei Teilnehmern unter 2 Jahren waren Reizbarkeit (61.8%), Schmerzen an der Injektionsstelle (52.5%), Benommenheit/vermehrtes Schlafen (41.7%), Rötung an der Injektionsstelle (37.7%), verminderter Appetit (25.0%), Schwellung an der Injektionsstelle (22.1%) und Fieber ≥38.0°C (11.8%). Bei Teilnehmern von 2 Jahren bis <5 Jahren waren die am häufigsten berichteten Nebenwirkungen Schmerzen an der Injektionsstelle (66.0%), Rötung an der Injektionsstelle (39.1%), Ermüdung (37.2%), Muskelschmerzen (26.5%) und Schwellung an der Injektionsstelle (23.3%).
Erwachsene >65 Jahre
Die Sicherheit von Prevenar 20 wurde in sechs klinischen Studien (zwei Phase-1-, eine Phase-2- und drei Phase-3-Haupt-Studien) an 4552 Teilnehmern ab einem Alter von 18 Jahren sowie an 2496 Teilnehmern in den Kontrollgruppen untersucht. Die Phase 2-Studie umfasste 443 Teilnehmer im Alter von 60 bis 64 Jahren, davon erhielten 221 Prevenar 20 und 222 gehörten der Kontrollgruppe an. Zwei der Phase-3-Haupt-Studien umfassten 4315 Teilnehmer im Alter von 50 Jahren und älter, davon 2465 in der Prevenar 20-Gruppe und 1850 in den Kontrollgruppen.
In den Phase-3-Haupt-Studien erhielten 2465 Teilnehmer im Alter von 50 Jahren und älter Prevenar 20. Dazu gehörten 334 Teilnehmer im Alter von 50 bis 59 Jahren und 2131 Teilnehmer ab einem Alter von 60 Jahren (1138 waren 65 Jahre oder älter). Von den Teilnehmern im Alter von 50 Jahren und älter, die in den Phase-3-Haupt-Studien Prevenar 20 erhielten, waren 1841 noch nie mit einem Pneumokokken-Impfstoff geimpft worden, 253 hatten zuvor PPSV23 erhalten (≥1 bis ≤5 Jahre vor der Aufnahme in die Studie), 246 hatten zuvor nur Prevenar 13 erhalten (≥6 Monate vor der Aufnahme in die Studie), und 125 hatten zuvor Prevenar 13, gefolgt von PPSV23 erhalten (die PPSV23-Dosis ≥1 Jahr vor der Aufnahme in die Studie).
Die Teilnehmer der Phase-3-Studie B7471007 (pivotale Studie 1007) wurden nach der Impfung 1 Monat lang auf unerwünschte Ereignisse und bis zu 6 Monate lang auf schwerwiegende unerwünschte Ereignisse untersucht. An der Studie nahmen 445 Teilnehmer im Alter von 50 bis 59 Jahren, 1985 Teilnehmer im Alter von 60 bis 64 Jahren, 624 Teilnehmer im Alter von 65 bis 69 Jahren, 319 Teilnehmer im Alter von 70 bis 79 Jahren und 69 Teilnehmer im Alter von ≥80 Jahren teil.
Bei Teilnehmern im Alter von 50 bis 59 Jahren in Studie 1007 waren die am häufigsten gemeldeten Nebenwirkungen Schmerzen an der Injektionsstelle (72.5%), Muskelschmerzen (49.8%), Ermüdung (39.3%), Kopfschmerzen (32.3%) und Gelenkschmerzen (15.4%). Bei Teilnehmern ab einem Alter von 60 Jahren in Studie 1007 waren die am häufigsten gemeldeten Nebenwirkungen Schmerzen an der Injektionsstelle (55.4%), Muskelschmerzen (39.1%), Ermüdung (30.2%), Kopfschmerzen (21.5%) und Gelenkschmerzen (12.6%). Diese waren in der Regel leicht oder mässig ausgeprägt und klangen innerhalb weniger Tage nach der Impfung ab.
Sicherheitsdaten aus einer gepoolten Analyse von Erwachsenen ≥65 Jahre, die sowohl Pneumokokken-naive Teilnehmer (Studie 1007) als auch Teilnehmer mit vorheriger Pneumokokken-Impfung (Studie 1006) einschloss, umfassten 1885 Teilnehmer; von diesen erhielten 1138 Prevenar 20 und 747 den Kontroll-Impfstoff. Das Sicherheitsprofil von Prevenar 20 bei Erwachsenen ab 65 Jahren mit oder ohne vorherige Pneumokokken-Impfung war im Allgemeinen mit dem des Kontroll-Impfstoffs vergleichbar. Die unerwünschten Wirkungen für die MedDRA-Systemorganklasse (SOC) Herzerkrankungen 1 Monat nach Impfung waren bei Teilnehmern ab 65 Jahren ähnlich bei Prevenar 20 (9 Ereignisse bei 1138 Teilnehmern (0.8%)) und PPSV23 (1 Ereignis bei 127 Teilnehmern (0.8%)), aber höher als bei Prevenar 13 (1 Ereignis bei 620 Teilnehmern (0.2%)). 6 Monate nach der Impfung wurden bei 0.5% der Teilnehmer, die Prevenar 20 erhielten, Ereignisse in der SOC Herzerkrankungen gemeldet (6 Ereignisse bei 1138 Teilnehmern).
In der Phase-3-Studie B7471006 (Studie 1006) wurde Prevenar 20 bei Teilnehmern ab einem Alter von 65 Jahren mit unterschiedlichem vorhergehenden Pneumokokken-Impfstatus untersucht (zuvor PPSV23, zuvor Prevenar 13 oder zuvor Prevenar 13, gefolgt von PPSV23). Die bei den Teilnehmern am häufigsten gemeldeten Nebenwirkungen in dieser Studie waren in der Häufigkeit ähnlich zu denen, die für Teilnehmer im Alter von ≥60 Jahren in Studie 1007 berichtet wurden, mit einer leicht erhöhten Häufigkeit von Schmerzen an der Injektionsstelle (61.2%) bei Teilnehmern, die zuvor Prevenar 13 erhalten hatten, und Gelenkschmerzen (16.8%) bei Teilnehmern, die zuvor Prevenar 13, gefolgt von PPSV23 erhalten hatten.
Liste der unerwünschten Wirkungen
Nachfolgend findet sich eine Auflistung der Nebenwirkungen aus der Säuglings-Phase-2-Studie, den klinischen Phase-3-Studien an Kindern (6 Wochen bis <5 Jahren) und Erwachsenen und den Erfahrungen nach der Markteinführung.
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen mit abnehmender Häufigkeit und Schwere aufgeführt. Die Häufigkeiten sind wie folgt definiert: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000) und «nicht bekannt» (Häufigkeit kann aus den verfügbaren Daten nicht abgeschätzt werden).
Unerwünschte Wirkungen in klinischen Studien
Prevenar 20
Da Prevenar 20 dieselben 13 Serotyp-spezifischen Kapselpolysaccharid-Konjugate und dieselben sonstigen Impfstoffbestandteile enthält wie Prevenar 13, wurden die bei Prevenar 13 festgestellten Nebenwirkungen für Prevenar 20 übernommen. Unten aufgelistet sind die in der Säuglings-Phase-2-Studie und in Phase-3-Studien an Kindern (6 Wochen bis <5 Jahren) und Erwachsenen mit Prevenar 20 gemeldeten Nebenwirkungen, basierend auf der höchsten Häufigkeit unerwünschter Reaktionen, Lokalreaktionen oder systemischer Ereignisse nach der Impfung in einer Prevenar 20-Gruppe in einer Studie oder im gesamten Datensatz. Die Daten aus klinischen Studien an Säuglingen ergeben sich aus der gleichzeitigen Gabe von Prevenar 20 mit anderen Standard-Impfungen für Kinder. Im Falle von Nebenwirkungen, die in klinischen Studien mit Prevenar 13 berichtet wurden, aber nicht mit Prevenar 20, ist die Häufigkeit nicht bekannt. Das Sicherheitsprofil von Prevenar 20 war in klinischen Studien ähnlich wie das von Prevenar 13.
Pädiatrische Population
Säuglinge und Kinder im Alter von 6 Wochen bis <5 Jahren
Erkrankungen des Immunsystems
Nicht bekannt: Überempfindlichkeitsreaktionen, einschliesslich Gesichtsödem, Dyspnoe, Bronchospasmusa.
Stoffwechsel- und Ernährungsstörungen
Sehr häufig: Verminderter Appetit (39.3%).
Psychiatrische Erkrankungen
Sehr häufig: Reizbarkeit (71.9%).
Nicht bekannt: Weinena.
Erkrankungen des Nervensystems
Sehr häufig: Benommenheit/vermehrtes Schlafen (66.2%).
Gelegentlich: Krampfanfälle (einschliesslich Fieberkrämpfe).
Nicht bekannt: Hypotonisch-hyporesponsive Episode, unruhiger Schlaf/verminderter Schlafa.
Erkrankungen des Gastrointestinaltrakts
Häufig: Diarrhoe, Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Häufig: Ausschlag.
Gelegentlich: Urtikaria oder Urtikaria-ähnlicher Ausschlag.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Fieber (Pyrexie) (24.3%), Schmerzen/Empfindlichkeit an der Injektionsstelle (66.0%), Erythem an der Injektionsstelle (39.1%), Induration/Schwellung an der Injektionsstelle (29.8%), Erythem an der Injektionsstelle >2.0 cm-7.0 cm (nach der Booster-Dosis und bei älteren [2 bis 5 Jahre alten] Kindern) (15.3%), Induration/Schwellung an der Injektionsstelle (>2.0–7.0 cm) (nach der Booster-Dosis und bei älteren [2 bis 5 Jahre alten] Kindern) (11.9%).
Häufig: Fieber >38.9°C, Induration/Schwellung an der Injektionsstelle >2.0–7.0 cm (nach Grundimmunisierung bei Säuglingen), Erythem an der Injektionsstelle >2.0 cm-7.0 cm (nach Grundimmunisierung bei Säuglingen), Schmerzen/Empfindlichkeit an der Injektionsstelle mit eingeschränkter Beweglichkeit der Gliedmassen.
Gelegentlich: Erythem an der Injektionsstelle (>7.0 cm), Induration/Schwellung an der Injektionsstelle (>7.0 cm).
Selten: Überempfindlichkeit an der Injektionsstelleb.
a Nebenwirkungen, die in klinischen Studien mit Prevenar 13, aber nicht in klinischen Studien mit Prevenar 20 berichtet wurden, sind mit der Häufigkeit «nicht bekannt» aufgeführt.
b Nebenwirkung, die bei Prevenar 13 nicht berichtet wurde, obwohl Urtikaria an der Injektionsstelle, Pruritus an der Injektionsstelle und Dermatitis an der Injektionsstelle während der Überwachung von Prevenar 13 nach der Markteinführung gemeldet wurden.
Erwachsene
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen, einschliesslich Gesichtsödem, Dyspnoe, Bronchospasmus.
Stoffwechsel- und Ernährungsstörungen
Nicht bekannt: Verminderter Appetitc.
Erkrankungen des Nervensystems
Sehr häufig: Kopfschmerzen (36.7%).
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Diarrhoec, Übelkeit, Erbrechenc.
Erkrankungen der Haut und des Unterhautgewebes
Gelegentlich: Ausschlagc, Angioödem.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Sehr häufig: Muskelschmerz (62.9%), Gelenkschmerz (16.8%).
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Sehr häufig: Schmerzen/ Druckempfindlichkeit an der Impfstelle (79.2%), Ermüdung (46.7%).
Häufig: Induration/Schwellung an der Impfstellec, Erythem an der Impfstellec, Fieber (Pyrexie).
Gelegentlich: Pruritus an der Impfstelle, Lymphadenopathie, Urtikaria an der Impfstelle, Schüttelfrostc.
Nicht bekannt: Eingeschränkte Beweglichkeit des Armsc.
c In klinischen Studien zu Prevenar 13 mit der Häufigkeit «sehr häufig» (≥1/10) gemeldete Nebenwirkung. Verminderter Appetit und eingeschränkte Beweglichkeit des Arms wurden in den Phase-3-Studien zu Prevenar 20 bei Erwachsenen nicht gemeldet. Die Häufigkeit ist somit nicht bekannt.
Zusätzliche Informationen für besondere Personengruppen
Es wurden keine klinischen Studien mit Prevenar 20 bei Frühgeborenen durchgeführt. Daten zur Sicherheit von Prevenar 13 bei Frühgeborenen liegen vor.
Zum Risiko von Apnoen bei extrem Frühgeborenen (vor oder in der 28. Schwangerschaftswoche) siehe «Warnhinweise und Vorsichtsmassnahmen».
In einer Studie, die ungefähr 100 frühgeborene Säuglinge mit ungefähr 100 termingerecht geborenen Säuglingen verglich, war bei einer Grundimmunisierung mit 3 Dosen Prevenar 13 nach der 1. und 2. Dosis verminderter Appetit und nach der 2. Dosis Reizbarkeit/mangelhafte Schlafqualität signifikant häufiger bei frühgeborenen Säuglingen (siehe Kapitel «Eigenschaften/Wirkungen»).
Sicherheit bei gleichzeitiger Impfstoffverabreichung
Erwachsene
Bei Verabreichung von Prevenar 20 an Erwachsene ab einem Alter von 65 Jahren zusammen mit der 3. (Booster-)Dosis eines COVID-19-mRNA-Impfstoffs (Nukleosid-modifiziert) war das Verträglichkeitsprofil grundsätzlich ähnlich wie bei alleiniger Verabreichung des COVID-19-mRNA-Impfstoffs (Nukleosid-modifiziert). Im Vergleich zur alleinigen Verabreichung von Prevenar 20 gab es wenige Unterschiede im Sicherheitsprofil. In der Phase-3-Studie B7471026 (Studie 1026) wurde bei gleichzeitiger Verabreichung als «sehr häufig» über Fieber (13.0%) und Schüttelfrost (26.5%) berichtet. In der Gruppe mit gleichzeitiger Verabreichung wurde zudem ein Fall von Schwindelgefühl (0.5%) berichtet.
Prevenar 13
Erwachsene ≥65 Jahre in der klinischen Wirksamkeitsstudie CAPiTA
In der CAPiTA Studie wurden 42'240 Personen ≥65 Jahre geimpft mit Prevenar 13 mit 42'256 Personen ≥65 Jahre unter Placebo verglichen.
Von den 84'496 Teilnehmenden waren 58'072 (68.7%) ≥65 bis <75 Jahre alt, 23'481 (27.8%) waren ≥75 und <85 Jahre alt und 2'943 (3.5%) waren ≥85 Jahre alt. In die gesamte Sicherheitspopulation waren mehr Männer (55.9%) als Frauen aufgenommen worden. Erwachsene mit abwehrschwächenden Erkrankungen oder die eine immunsuppressive Therapie erhielten sowie Erwachsene, die in einem Langzeitpflegeheim untergebracht waren oder die semiprofessionelle Pflege benötigten, waren ausgeschlossen. Erwachsene mit vorbestehenden Krankheiten sowie Personen mit Rauchen in der Vorgeschichte waren zur Teilnahme berechtigt. In der Sicherheitspopulation hatten 42.3% der Probanden vorbestehende Erkrankungen einschliesslich Herzerkrankung (25.4%), Lungenerkrankung oder Asthma (15.1%) und Diabetes mellitus vom Typ 1 und Typ 2 (12.5%). Zu Studienbeginn wurde Rauchen bei 12.3% der Probanden berichtet.
Bei einer Untergruppe von 2011 Probanden (1006 mit Prevenar 13 geimpfte Personen und 1005 Personen, die Placebo erhielten) wurden erfragte Nebenwirkungen über einen Zeitraum von 7 Tagen nach der Impfung durch Aufzeichnung der lokalen und systemischen Ereignisse in elektronischen Tagebüchern erfasst; unaufgefordert gemeldete Nebenwirkungen wurden über einen Zeitraum von 28 Tagen nach der Impfung gesammelt, und schwerwiegende Nebenwirkungen wurden über einen Zeitraum von 6 Monaten nach der Impfung gesammelt. Für die übrigen 41'231 Probanden mit Prevenar 13-Impfung und 41'250 Personen mit Placebo-Impfung wurden schwerwiegende Nebenwirkungen über einen Zeitraum von 28 Tagen nach der Impfung gesammelt.
In der CAPiTA Studie (Probanden 65 Jahre und älter) wurden innerhalb eines Monats nach Impfung schwerwiegende Nebenwirkungen bei 327 von 42'237 (0.8%) der Personen berichtet, die Prevenar 13 erhielten (352 Ereignisse) und bei 314 von 42'225 (0.7%) der Personen, die Placebo erhielten (337 Ereignisse). In der Untergruppe der Probanden, bei denen schwerwiegende Nebenwirkungen über 6 Monate beobachtet wurden, berichteten 70 von 1006 (7%) der mit Prevenar 13 geimpften Personen (90 Ereignisse) und 60 von 1005 (6%) der mit Placebo geimpften Personen (69 Ereignisse) schwerwiegende Nebenwirkungen.
In der Nachbeobachtungsphase (im Durchschnitt 4 Jahre) wurden bei Kumulierung der Fälle 3006 Todesfälle (7.1%) in der Prevenar 13-Gruppe und 3005 Todesfälle (7.1%) in der Placebo-Gruppe beobachtet. Innerhalb von 28 Tagen nach der Impfung traten 10 Todesfälle (<0.1%) in der Prevenar 13-Gruppe und 10 Todesfälle (<0.1%) in der Placebo-Gruppe auf. Im Zeitraum von 29 Tagen – 6 Monaten nach der Impfung traten 161 Todesfälle (0.4%) in der Prevenar 13-Gruppe und 144 Todesfälle (0.3%) in der Placebo-Gruppe auf.
Diese Daten liefern keinen Anhaltspunkt für einen Kausalzusammenhang zwischen den Todesfällen und der Impfung mit Prevenar 13.
Unerwünschte Wirkungen aus der Postmarketingphase
Unten aufgeführt sind die Nebenwirkungen aus Spontanmeldungen während der Anwendung von Prevenar 13 bei Kindern und Erwachsenen nach dem Inverkehrbringen, die auch bei Prevenar 20 auftreten könnten. Die Erfahrungen mit der Sicherheit von Prevenar 13 nach der Markteinführung sind auch für Prevenar 20 relevant, da Prevenar 20 dieselben Bestandteile (Polysaccharidkonjugate und sonstige Bestandteile) wie Prevenar 13 enthält. Diese Ereignisse wurden freiwillig in einer Population ungewisser Grösse gemeldet. Deshalb ist keine zuverlässige Einschätzung ihrer Häufigkeit möglich, und es kann nicht für alle Ereignisse ein kausaler Zusammenhang mit der Impfstoffexposition hergestellt werden.
Erkrankungen des Blutes und des Lymphsystems
Nicht bekannt: Lymphadenopathie lokalisiert im Bereich der Injektionsstelle.
Erkrankungen des Immunsystems
Nicht bekannt: Anaphylaktische/anaphylaktoide Reaktion, einschliesslich Schock.
Erkrankungen der Haut und des Unterhautgewebes
Nicht bekannt: Angioödem, Erythema multiforme.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Nicht bekannt: Dermatitis an der Injektionsstelle, Urtikaria an der Injektionsstelle, Pruritus an der Injektionsstelle.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEine Überdosierung von Prevenar 20 ist aufgrund seiner Darreichungsform als Fertigspritze unwahrscheinlich.
Eigenschaften/WirkungenATC-Code
J07AL02
Wirkungsmechanismus
Prevenar 20 enthält 20 Pneumokokken-Kapselpolysaccharide, die alle an CRM197-Trägerprotein konjugiert sind, das die Immunantwort auf das Polysaccharid von einer T-Zell-unabhängigen zu einer T-Zell-abhängigen Antwort modifiziert. Die T-Zell-abhängige Antwort führt zu einer verstärkten Antikörperantwort (IgG) und induziert funktionale Antikörper (OPA, die mit Opsonisierung, Phagozytose und Abtötung von Pneumokokken in Verbindung stehen) zum Schutz vor Pneumokokkenerkrankungen. Ausserdem wird die Bildung von B-Gedächtniszellen induziert, wodurch eine «anamnestische» (Booster-) Antwort bei erneuter Exposition gegenüber dem Bakterium ermöglicht wird.
Der Serotypen-spezifische Spiegel der zirkulierenden Antikörper oder OPA-Titer, der mit einem Schutz vor Pneumokokken-Erkrankungen korreliert, ist nicht eindeutig definiert.
Pharmakodynamik
Keine Angaben.
Klinische Wirksamkeit
Es wurden keine Studien zur Wirksamkeit mit Prevenar 20 durchgeführt.
Für Prevenar (PCV7) liegen Wirksamkeitsdaten bei Säuglingen/Kleinkindern in Bezug auf invasive Pneumokokkenerkrankungen, Pneumonie und Otitis media aus den Northern California Kaiser Permanente (NCKP) und Finnish Otitis Media (FinOM) Studien vor.
Prevenar 13 wurde aufgrund einer nicht unterlegenen Immunogenität gegenüber PCV7 zugelassen. Die Zulassung von Prevenar 20 für die pädiatrische Population basiert auf dem Vergleich der Gesamtheit der Immunantworten von Kindern nach Erhalt von Prevenar 20 mit der Immunantwort nach Erhalt von Prevenar 13.
Die Schutzwirkung von Prevenar 20 bei Erwachsenen über 65 Jahren beruht auf der Wirksamkeit, die in der Studie zur Immunisierung von Erwachsenen gegen ambulant erworbene Pneumonien/Community-Acquired Pneumonia Immunization Trial in Adults, CAPiTA mit 13-valentem Pneumokokken-Polysaccharid-Konjugatimpfstoff nachgewiesen wurde (siehe «Vergleich der Immunantworten auf Prevenar 20 mit Prevenar 13»). Für die Serotypen 8, 10A, 11A, 12F, 15B, 22F und 33F wurde die Indikation für Erwachsene ≥65 Jahre basierend auf Immunantworten, die mit einem Opsonophagozytose (OPA)-Assay gemessen wurden, genehmigt.
Daten zur Immunogenität
Klinische Studien zu Prevenar 20 in der pädiatrischen Population
Die Immunogenität wurde anhand der Serotyp-spezifischen IgG-Ansprechraten (Anteil der Teilnehmer, die den Serotyp-spezifischen IgG-Spiegel von ≥0.35 μg/ml oder einen äquivalenten Assay-spezifischen Wert erreichten) und der IgG-GMC-Werte jeweils 1 Monat nach der Grundimmunisierung und nach der Boosterdosis beurteilt. Die OPA-GMT-Werte wurden ebenfalls 1 Monat nach der Grundimmunisierung und nach der Boosterdosis gemessen. Die vordefinierte Konzentration entsprechend 0.35 μg/ml im ELISA der WHO (bzw. äquivalenter Assay-spezifischer Grenzwert) gilt nur auf Populationsebene und kann nicht für die Vorhersage eines individuellen oder Serotyp-spezifischen Schutzes gegen IPD verwendet werden. Für Pneumonie und akute Otitis media (AOM) existiert kein Korrelat für einen Schutz.
Pneumokokken-Immunantworten nach 3 und 4 Dosen eines Impfschemas mit 4 Dosen bei Säuglingen
In Studie 1011, die in den Vereinigten Staaten und in Puerto Rico durchgeführt wurde, wurden 1991 gesunde Säuglinge, die zum Zeitpunkt der Einwilligung 2 Monate alt waren (≥42 bis ≤98 Tage) und die nach >36 Schwangerschaftswochen geboren wurden, eingeschlossen. Die Teilnehmer wurden im Verhältnis 1:1 randomisiert und erhielten entweder Prevenar 20 oder Prevenar 13 im Alter von etwa 2, 4, 6 und 12 bis 15 Monaten. Es wurden gleichzeitig pädiatrische Standard-Impfungen verabreicht (siehe «Interaktionen»).
Die Nichtunterlegenheit der Anteile der Teilnehmer mit vordefinierten Serotyp-spezifischen IgG-Konzentrationen einen Monat nach der dritten Dosis der Grundimmunisierung wurde für 8 der 13 gemeinsamen Serotypen erreicht und wurde für 5 Serotypen (Serotypen 1, 3, 4, 9V und 23F) basierend auf einem Nichtunterlegenheitskriterium von 10% verfehlt. Sechs der 7 zusätzlichen Serotypen erfüllten das Kriterium der Nichtunterlegenheit; Serotyp 12F verfehlte das Kriterium der statistischen Nichtunterlegenheit (Tabelle 1).
Tabelle 1: Prozentsatz der geimpften Teilnehmer, die einen Monat nach Dosis 3 (im Alter von 2, 4, 6 Monaten) vordefinierte, Serotyp-spezifische Pneumokokken-IgG-Konzentrationen erreichten, Studie 1011a
|
|
Prevenar 20
Nb=831-833
|
Prevenar 13
Nb=801-802
|
Prevenar 20 minus Prevenar 13
| |
|
% (95% KIc)
|
% (95% KIc)
|
Prozentuale Differenzd (95% KId,e)
| |
Serotypen
| |
1
|
79.8 (76.9, 82.5)
|
88.4 (86.0, 90.5)
|
-8.6 (-12.1, -5.1)
| |
3
|
52.1 (48.6, 55.5)
|
67.6 (64.2, 70.8)
|
-15.5 (-20.1, -10.8)
| |
4
|
79.7 (76.8, 82.4)
|
88.2 (85.7, 90.3)
|
-8.4 (-12.0, -4.9)
| |
5
|
82.5 (79.7, 85.0)
|
86.8 (84.2, 89.1)
|
-4.3 (-7.8, -0.8)
| |
6A
|
93.5 (91.6, 95.1)
|
95.9 (94.3, 97.2)
|
-2.4 (-4.6, -0.2)
| |
6B
|
88.3 (85.9, 90.4)
|
92.4 (90.3, 94.1)
|
-4.1 (-7.0, -1.2)
| |
7F
|
96.6 (95.2, 97.8)
|
97.6 (96.3, 98.6)
|
-1.0 (-2.7, 0.7)
| |
9V
|
81.9 (79.1, 84.4)
|
89.8 (87.5, 91.8)
|
-7.9 (-11.3, -4.6)
| |
14
|
93.4 (91.5, 95.0)
|
94.1 (92.3, 95.7)
|
-0.8 (-3.1, 1.6)
| |
18C
|
92.6 (90.6, 94.2)
|
93.1 (91.2, 94.8)
|
-0.6 (-3.1, 1.9)
| |
19A
|
97.1 (95.7, 98.1)
|
98.1 (96.9, 98.9)
|
-1.0 (-2.6, 0.5)
| |
19F
|
96.9 (95.5, 98.0)
|
96.6 (95.1, 97.8)
|
0.2 (-1.5, 2.0)
| |
23F
|
77.9 (74.9, 80.7)
|
85.5 (82.9, 87.9)
|
-7.6 (-11.4, -3.9)
| |
Zusätzliche Serotypenf
| |
8
|
96.8 (95.3, 97.9)
|
f, g
|
11.2 (8.6, 14.0)
| |
10A
|
82.2 (79.5, 84.8)
|
f, g
|
-3.3 (-6.9, 0.3)
| |
11A
|
92.7 (90.7, 94.4)
|
f, g
|
7.1 (4.2, 10.2)
| |
12F
|
48.0 (44.6, 51.5)
|
f, g
|
-37.5 (-41.6, -33.3)
| |
15B
|
98.2 (97.0, 99.0)
|
f, g
|
12.7 (10.2, 15.4)
| |
22F
|
98.3 (97.2, 99.1)
|
f, g
|
12.8 (10.3, 15.5)
| |
33F
|
86.7 (84.2, 88.9)
|
f, g
|
1.1 (-2.2, 4.5)
|
Abkürzungen: KI=Konfidenzintervall; IgG=Immunoglobulin G.
Hinweis: Die vordefinierte IgG-Konzentration betrug ≥0.35 µg/ml für alle Serotypen mit Ausnahme der Serotypen 5, 6B, 12F und 19A, für die die Konzentration ≥0.23 µg/ml, ≥0.10 µg/ml, ≥0.69 µg/ml bzw. ≥0.12 µg/ml betrug.
a NCT04382326.
b N=Anzahl der Teilnehmer mit validen Untersuchungsresultaten. Diese Werte sind die Nenner für die entsprechenden Prozentberechnungen.
c Exaktes 2-seitiges KI, basierend auf der Clopper-Pearson-Methode.
d Nichtunterlegenheit für einen Serotypen wurde bestätigt, wenn die Untergrenze des 2-seitigen KIs der prozentualen Differenz (Prevenar 20 minus Prevenar 13)>10% (10% Nichtunterlegenheits-Kriterium) für diesen Serotypen betrug.
e 2-seitiges KI basierend auf der Methode von Miettinen und Nurminen für die Differenz der Anteile, ausgedrückt in Prozent.
f Für die 7 zusätzlichen Serotypen wurde der Prozentsatz der Teilnehmer mit der vordefinierten IgG-Konzentration für Serotyp 23F (Prevenar 13-Serotyp mit dem niedrigsten Prozentsatz, ausser Serotyp 3) in der Prevenar 13-Gruppe für die Berechnung der prozentualen Differenz verwendet.
g Für die 7 zusätzlichen Serotypen betrug der prozentuale Anteil der Teilnehmer mit vordefinierten IgG-Konzentrationen für die Serotypen 8, 10A, 11A, 12F, 15B, 22F und 33F in der Prevenar 13-Gruppe 1.6%, 1.2%, 1.5%, 0.1%, 2.6%, 0.9% bzw. 1.1%.
Einen Monat nach der vierten (Booster)-Dosis waren die IgG-GMCs für Prevenar 20, basierend auf einem 2-fachen Nichtunterlegenheitskriterium (Untergrenze des zweiseitigen KIs<0.5), für alle 13 gemeinsamen Serotypen Prevenar 13 nicht unterlegen. Die IgG-GMCs für alle 7 zusätzlichen Serotypen waren dem niedrigsten IgG-GMC der Prevenar 13 Serotypen (ausser Serotyp 3) auf Grundlage eines 2-fachen Nichtunterlegenheitskriteriums nicht unterlegen (Tabelle 2). Dies galt auch für die IgG-GMCs für Prevenar 20 einen Monat nach der dritten Dosis der Grundimmunisierung (Tabelle 3).
Tabelle 2: Serotyp-spezifische Pneumokokken-IgG-GMCs (µg/ml) und GMC-Verhältnisse einen Monat nach Dosis 4 bei Teilnehmern, die im Alter von 2, 4, 6 und 12 bis 15 Monaten geimpft wurden, Studie 1011a
|
|
Prevenar 20
Nb=753-755
|
Prevenar 13
Nb=744-745
|
Prevenar 20/Prevenar 13
| |
|
GMCc (95% KIc)
|
GMCc (95% KIc)
|
GMC Verhältnisd (95% KId,e)
| |
Serotypen
| |
1
|
1.47 (1.37, 1.57)
|
2.12 (1.97, 2.27)
|
0.69 (0.63, 0.76)
| |
3
|
0.56 (0.53, 0.60)
|
0.85 (0.80, 0.90)
|
0.66 (0.61, 0.73)
| |
4
|
3.77 (3.52, 4.04)
|
4.84 (4.50, 5.22)
|
0.78 (0.70, 0.86)
| |
5
|
1.87 (1.74, 2.00)
|
2.51 (2.33, 2.70)
|
0.74 (0.67, 0.82)
| |
6A
|
9.01 (8.45, 9.61)
|
11.69 (10.91, 12.53)
|
0.77 (0.70, 0.85)
| |
6B
|
4.01 (3.70, 4.35)
|
5.74 (5.27, 6.24)
|
0.70 (0.62, 0.79)
| |
7F
|
3.91 (3.70, 4.14)
|
5.18 (4.88, 5.49)
|
0.76 (0.70, 0.82)
| |
9V
|
3.44 (3.23, 3.67)
|
4.30 (4.02, 4.59)
|
0.80 (0.73, 0.88)
| |
14
|
5.68 (5.27, 6.12)
|
6.34 (5.88, 6.83)
|
0.90 (0.81, 1.00)
| |
18C
|
3.46 (3.24, 3.70)
|
4.69 (4.34, 5.05)
|
0.74 (0.67, 0.82)
| |
19A
|
3.53 (3.30, 3.77)
|
4.13 (3.84, 4.45)
|
0.85 (0.77, 0.94)
| |
19F
|
5.01 (4.68, 5.36)
|
5.79 (5.36, 6.25)
|
0.86 (0.78, 0.96)
| |
23F
|
3.95 (3.63, 4.31)
|
6.18 (5.66, 6.75)
|
0.64 (0.57, 0.72)
| |
Zusätzliche Serotypenf
| |
8
|
3.97 (3.73, 4.22)
|
f, g
|
1.87 (1.71, 2.06)
| |
10A
|
6.22 (5.75, 6.72)
|
f, g
|
2.94 (2.64, 3.26)
| |
11A
|
3.53 (3.31, 3.78)
|
f, g
|
1.67 (1.51, 1.84)
| |
12F
|
1.85 (1.73, 1.99)
|
f, g
|
0.88 (0.79, 0.97)
| |
15B
|
12.59 (11.78, 13.45)
|
f, g
|
5.95 (5.39, 6.55)
| |
22F
|
10.60 (9.92, 11.33)
|
f, g
|
5.01 (4.54, 5.52)
| |
33F
|
9.31 (8.71, 9.96)
|
f, g
|
4.40 (3.99, 4.85)
|
Abkürzungen: KI=Konfidenzintervall; GMC=geometrische mittlere Konzentration (geometric mean concentration); IgG=Immunoglobulin G; LLOQ=untere Bestimmungsgrenze (lower limit of quantitation).
Hinweis: Untersuchungsergebnisse unterhalb der LLOQ wurden für die Analyse auf 0.5 × LLOQ gesetzt.
a NCT04382326.
b N=Anzahl der Teilnehmer mit validen IgG-Konzentrationen.
c GMCs und die 2-seitigen KIs wurden durch Potenzieren der Mittelwerte der Logarithmen der Konzentrationen und der entsprechenden KIs (basierend auf der Student-t-Verteilung) berechnet.
d Nichtunterlegenheit für einen Serotypen wurde bestätigt, wenn die Untergrenze des 2-seitigen KIs des IgG-GMC-Verhältnisses (Prevenar 20/Prevenar 13)>0.5 (2-fach Nichtunterlegenheits-Kriterium) für diesen Serotypen betrug.
e Zweiseitige KIs wurden durch das Potenzieren der mittleren Differenzen der Logarithmen der IgG Konzentrationen (Prevenar 20 Minus Prevenar 13) und entsprechenden KIs (basierend auf der Student-t-Verteilung) berechnet.
f Für die 7 zusätzlichen Serotypen wurde die IgG-GMC für Serotyp 1 (Prevenar 13-Serotyp mit der niedrigsten IgG-GMC, ausser Serotyp 3) in der Prevenar 13-Gruppe in die Berechnung des GMC-Verhältnisses einbezogen.
g Für die 7 zusätzlichen Serotypen betrugen die IgG-GMCs für die Serotypen 8, 10A, 11A, 12F, 15B, 22F und 33F in der Prevenar 13-Gruppe 0.03 µg/ml, 0.01 µg/ml, 0.02 µg/ml, 0.01 µg/ml, 0.02 µg/ml, 0.00 µg/ml beziehungsweise 0.01 µg/ml.
Tabelle 3: Serotyp-spezifische Pneumokokken-IgG-GMCs (µg/ml) und GMC-Verhältnisse einen Monat nach Dosis 3 bei Teilnehmern, die im Alter von 2, 4, 6 und 12 bis 15 Monaten geimpft wurden, Studie 1011a
|
Pneumokokken Serotyp
|
Prevenar 20
Nb=831-833
|
Prevenar 13
Nb=801-802
|
Prevenar 20/Prevenar 13
| |
|
GMCc (95% KIc)
|
GMCc (95% KIc)
|
GMC Verhältnisd (95% KId,e)
| |
Serotyp
| |
1
|
0.74 (0.70, 0.79)
|
1.14 (1.06, 1.22)
|
0.65 (0.59, 0.72)
| |
3
|
0.36 (0.33, 0.38)
|
0.51 (0.48, 0.55)
|
0.70 (0.64, 0.76)
| |
4
|
0.75 (0.70, 0.81)
|
1.08 (1.00, 1.17)
|
0.70 (0.63, 0.78)
| |
5
|
0.66 (0.61, 0.71)
|
0.96 (0.88, 1.04)
|
0.69 (0.61, 0.77)
| |
6A
|
1.95 (1.81, 2.10)
|
2.69 (2.48, 2.92)
|
0.72 (0.65, 0.81)
| |
6B
|
0.61 (0.55, 0.68)
|
1.02 (0.91, 1.14)
|
0.60 (0.51, 0.70)
| |
7F
|
1.71 (1.62, 1.81)
|
2.29 (2.16, 2.43)
|
0.75 (0.69, 0.81)
| |
9V
|
0.87 (0.81, 0.93)
|
1.21 (1.12, 1.30)
|
0.72 (0.65, 0.80)
| |
14
|
2.16 (2.01, 2.33)
|
2.72 (2.51, 2.95)
|
0.79 (0.71, 0.89)
| |
18C
|
1.31 (1.23, 1.39)
|
1.71 (1.59, 1.84)
|
0.77 (0.70, 0.84)
| |
19A
|
0.72 (0.67, 0.76)
|
0.91 (0.85, 0.97)
|
0.79 (0.72, 0.86)
| |
19F
|
1.59 (1.50, 1.67)
|
2.00 (1.88, 2.12)
|
0.79 (0.73, 0.86)
| |
23F
|
0.82 (0.75, 0.90)
|
1.25 (1.14, 1.37)
|
0.66 (0.58, 0.75)
| |
Zusätzliche Serotypenf
| |
8
|
1.80 (1.70, 1.91)
|
f, g
|
1.98 (1.81, 2.16)
| |
10A
|
1.21 (1.09, 1.33)
|
f, g
|
1.32 (1.18, 1.49)
| |
11A
|
1.39 (1.30, 1.48)
|
f, g
|
1.52 (1.39, 1.67)
| |
12F
|
0.55 (0.50, 0.60)
|
f, g
|
0.60 (0.54, 0.67)
| |
15B
|
4.40 (4.11, 4.71)
|
f, g
|
4.82 (4.39, 5.30)
| |
22F
|
3.71 (3.45, 3.99)
|
f, g
|
4.06 (3.68, 4.48)
| |
33F
|
1.49 (1.36, 1.64)
|
f, g
|
1.64 (1.46, 1.83)
|
Abkürzungen: KI=Konfidenzintervall; GMC=geometrische mittlere Konzentration (geometric mean concentration); IgG=Immunoglobulin G; LLOQ=untere Bestimmungsgrenze (lower limit of quantitation).
Hinweis: Untersuchungsergebnisse unterhalb der LLOQ wurden für die Analyse auf 0.5 × LLOQ gesetzt.
a NCT04382326.
b N=Anzahl der Teilnehmer mit validen IgG-Konzentrationen.
c GMCs und die 2-seitigen KIs wurden durch Potenzieren der Mittelwerte der Logarithmen der Konzentrationen und der entsprechenden KIs (basierend auf der Student-t-Verteilung) berechnet.
d Nichtunterlegenheit für einen Serotypen wurde bestätigt, wenn die Untergrenze des 2-seitigen KIs des IgG-GMC-Verhältnisses (Prevenar 20/Prevenar 13)>0.5 (2-fach Nichtunterlegenheits-Kriterium) für diesen Serotypen betrug.
e 2-seitige KIs wurden durch das Potenzieren der mittleren Differenzen der Logarithmen der IgG Konzentrationen (Prevenar 20 minus Prevenar 13) und entsprechenden KIs (basierend auf der Student-t-Verteilung) berechnet.
f Für die 7 zusätzlichen Serotypen wurde die IgG-GMC für Serotyp 19A (Prevenar 13-Serotyp mit der niedrigsten IgG-GMC, ausser Serotyp 3) in der Prevenar 13-Gruppe in die Berechnung des GMC-Verhältnisses einbezogen.
g Für die 7 zusätzlichen Serotypen betrugen die IgG-GMCs für die Serotypen 8, 10A, 11A, 12F, 15B, 22F und 33F in der Prevenar 13-Gruppe 0.02 µg/ml, 0.01 µg/ml, 0.02 µg/ml, 0.01 µg/ml, 0.03 µg/ml, 0.01 µg/ml bzw. 0.02 µg/ml.
Die OPA-GMTs für die 13 gemeinsamen Serotypen einen Monat nach der dritten Dosis der Grundimmunisierung und einen Monat nach der Booster-Dosis wurden bei einer Subgruppe der Teilnehmer deskriptiv ausgewertet.
Einen Monat nach der dritten Dosis der Grundimmunisierung lagen die OPA-GMTs für die 13 gemeinsamen Serotypen in der Prevenar 20-Gruppe zwischen 26 (Serotyp 1) und 1222 (Serotyp 7F) und die OPA-GMTs in der Prevenar 13-Gruppe zwischen 34 (Serotyp 1) und 1149 (Serotyp 7F). Einen Monat nach der Booster-Dosis, lagen die OPA-GMTs für die 13 gemeinsamen Serotypen in der Prevenar 20-Gruppe etwas niedriger als die OPA-GMTs in der Prevenar 13-Gruppe, nämlich zwischen 36 (Serotyp 1) und 2609 (Serotyp 9V) bzw. zwischen 66 (Serotyp 1) und 3210 (Serotyp 9V).
Die beobachteten OPA-GMTs waren für die 7 zusätzlichen Serotypen zu beiden Zeitpunkten in der Prevenar 20-Gruppe wesentlich höher als in der Prevenar 13-Gruppe.
Pneumokokken-Immunantworten nach 2 und 3 Dosen eines Impfschemas mit 3 Dosen bei Säuglingen
In Studie 1012 wurde die Immunogenität von Prevenar 20 bei 1204 Säuglingen aus Europa und Australien untersucht. Dabei wurde eine Serie von 2 Dosen (Grundimmunisierung) und 1 Booster-Dosis an Säuglinge im Alter von 2 Monaten (≥42 bis ≤112 Tage) verabreicht, die nach >36 Schwangerschaftswochen geboren wurden. Die Teilnehmer wurden im Verhältnis 1:1 randomisiert und erhielten entweder Prevenar 20 oder Prevenar 13, wobei die erste Dosis im Alter von 42 bis 112 Tagen verabreicht wurde, eine zweite Dosis etwa 2 Monate später und die dritte (Booster)-Dosis im Alter von etwa 11 bis 12 Monaten. Bei diesen Besuchen erhielten die Teilnehmer gleichzeitig andere Impfstoffe.
Die durch Prevenar 20 ausgelösten Immunantworten wurden anhand von IgG-GMCs, dem Prozentsatz der Teilnehmer mit vordefinierten IgG-Konzentrationen und den geometrischen Mittelwerten der OPA-Titer (GMTs) für alle 20 im Impfstoff enthaltenen Serotypen beurteilt.
Einen Monat nach der zweiten Dosis der Grundimmunisierung mit Prevenar 20 waren die beobachteten IgG-GMCs für 9 der 13 gemeinsamen Serotypen denen der Prevenar 13-Gruppe nicht unterlegen, und 4 der 13 gemeinsamen Serotypen (6A, 6B, 9V und 23F) erfüllten das 2-fache statistische Kriterium für die Nichtunterlegenheit nicht.
Der prozentuale Anteil der Teilnehmer mit vordefinierten Serotyp-spezifischen IgG-Konzentrationen einen Monat nach der zweiten Dosis der Grundimmunisierung mit Prevenar 20 war für 4 der 13 gemeinsamen Serotypen denen der Prevenar 13-Gruppe, basierend auf einem Differenz-Nichtunterlegenheitskriterium von 10%, nicht unterlegen und 9 der 13 gemeinsamen Serotypen (1, 3, 4, 5, 6A, 6B, 9V, 18C und 23F) erfüllten die Nichtunterlegenheit nicht.
Für die 7 zusätzlichen Serotypen war der Anteil der Teilnehmer mit vordefinierten Serotyp-spezifischen IgG-Konzentrationen einen Monat nach der zweiten Dosis der Grundimmunisierung mit Prevenar 20 bei 5 der 7 zusätzlichen Serotypen dem Serotyp mit dem niedrigsten Anteil unter den 13 Serotypen (Serotyp 6B) in der Prevenar 13-Gruppe nicht unterlegen; die Serotypen 10A und 12F erfüllten das statistische Nichtunterlegenheits-Kriterium nicht. Die klinische Relevanz dieser Resultate ist nicht bekannt.
Darüber hinaus waren die IgG-GMCs für die 7 zusätzlichen Serotypen nach zwei Dosen der Grundimmunisierung höher als die IgG-GMCs für die entsprechenden Serotypen in der Prevenar 13-Gruppe.
Einen Monat nach der dritten (Booster)-Dosis waren die beobachteten IgG-GMCs von Prevenar 20 für 12 der 13 gemeinsamen Serotypen, mit Ausnahme von Serotyp 6B, denen der Prevenar 13-Gruppe nicht unterlegen, und alle 7 zusätzlichen Serotypen waren der niedrigsten IgG-GMC in der Prevenar 13-Gruppe nicht unterlegen. Des Weiteren waren die IgG-GMCs nach der dritten (Booster)-Dosis für die 7 zusätzlichen Serotypen höher als die IgG-GMCs der entsprechenden Serotypen in der Prevenar 13-Gruppe.
Das funktionale Ansprechen, gemessen mittels OPA-GMT, betrug für die 13 gemeinsamen Serotypen einen Monat nach der zweiten Dosis der Grundimmunisierung in der Prevenar 20-Gruppe zwischen 14 (Serotyp 1) und 858 (Serotyp 7F) und in der Prevenar 13-Gruppe zwischen 23 (Serotyp 1) und 895 (Serotyp 7F). Die gemessenen OPA-GMT-Werte für die 13 gemeinsamen Serotypen einen Monat nach der Booster-Dosis lagen zwischen 54 (Serotyp 1) und 3254 (Serotyp 9V) in der Prevenar 20-Gruppe und zwischen 82 (Serotyp 5) und 4544 (Serotyp 9V) in der Prevenar 13-Gruppe. Die beobachteten OPA-GMTs für die 7 zusätzlichen Serotypen waren einen Monat nach der zweiten Dosis der Grundimmunisierung und nach der Booster-Dosis in der Prevenar 20-Gruppe höher als in der Prevenar 13-Gruppe.
Verstärkte IgG- und OPA-Antikörperantworten wurden nach der 2. und 3. Dosis von Prevenar 20 für alle 20 Serotypen beobachtet, einschließlich derer, die das Nichtunterlegenheits-Kriterium verfehlt hatten, was auf eine Aktivierung des immunologischen Gedächtnisses hinweist.
Kinder im Alter von 12 Monaten bis <5 Jahren, die zuvor mit Prevenar 13 geimpft wurden
Kinder im Alter von 12 Monaten bis <24 Monaten
In einer multizentrischen, randomisierten, teilweise doppelblinden Phase-3-Studie (Studie B7471027) wurde die Immunogenität bei 356 Kindern im Alter von 12 Monaten bis <24 Monaten untersucht, die bereits 2 Dosen Prevenar 13 im Säuglingsalter erhalten hatten. Die Teilnehmer erhielten eine einzelne Booster-Dosis oder 2 Booster-Dosen Prevenar 20 oder eine Booster-Dosis Prevenar 13. In der Gruppe, die 2 Dosen Prevenar 20 erhielt, wurde die zweite Dosis etwa 2 Monate nach Dosis 1 verabreicht.
Nach 1 oder 2 Dosen Prevenar 20 wurden IgG-Immunantworten auf alle 7 zusätzlichen Serotypen beobachtet, wobei die IgG-Antworten auf die 7 zusätzlichen Serotypen nach 2 Dosen Prevenar 20 numerisch höher waren als nach einer Einzeldosis. Einen Monat nach einer Einzeldosis Prevenar 20 lag die Rate der Teilnehmer mit einer vordefinierten Serotyp-spezifischen IgG-Konzentration (≥0.35 µg/ml) für die 7 zusätzlichen Serotypen zwischen 54.6% (Serotyp 12F) und 98.1% (Serotyp 8). Einen Monat nach der zweiten Dosis Prevenar 20 lag die Rate der Teilnehmer mit einer vordefinierten Serotyp-spezifischen IgG-Konzentration bei ≥91.2% (Serotyp 12F).
Für die Prevenar 20 IgG-Immunantworten auf die 13 gemeinsamen Serotypen waren die beobachteten IgG-GMCs für die meisten der 13 gemeinsamen Serotypen nach 1 Dosis Prevenar 20 numerisch höher als nach 2 Dosen Prevenar 20.
Die 1 Monat nach der letzten Impfung für die 13 gemeinsamen Serotypen beobachteten IgG-GMC-Werte waren nach 1 oder 2 Dosen Prevenar 20 niedriger als nach 1 Dosis Prevenar 13.
Kinder im Alter von 15 Monaten bis <5 Jahren
In einer multizentrischen, einarmigen Studie (Studie 1014) wurden die Teilnehmer nach Altersgruppen in die Studie aufgenommen (etwa 200 Teilnehmer pro Gruppe) und erhielten eine Einzeldosis Prevenar 20 wie unten beschrieben.
In den Altersgruppen von 15 bis <24 Monaten und 2 Jahren bis <5 Jahren waren die Teilnehmer zuvor mit 3 oder 4 Dosen Prevenar 13 geimpft worden.
Bei Teilnehmern im Alter von 15 Monaten bis <24 Monaten wurde bei allen 20 Impfstoff-Serotypen ein Anstieg der IgG-GMCs von vor der Impfung bis 1 Monat nach der Impfung mit Prevenar 20 beobachtet. Die beobachteten IgG-GMFRs (geometric mean fold rise) der 7 zusätzlichen Serotypen reichten von 27.9 bis 1847.7. Bei Kindern im Alter von 15 Monaten bis <24 Monaten hatten 83.2% bis 100.0% vordefinierte IgG-Konzentrationen (≥0.35 µg/ml) auf 6 der 7 zusätzlichen Serotypen, Serotyp 12F betrug 40.0%.
Bei Teilnehmern im Alter von 24 Monaten bis <5 Jahren wurde bei allen 20 Impfstoff-Serotypen ein Anstieg der IgG-Konzentrationen von vor der Impfung bis 1 Monat nach der Impfung mit Prevenar 20 beobachtet. Die beobachteten IgG-GMFRs der 7 zusätzlichen Serotypen reichten von 36.6 bis 796.2.
Frühgeborene Säuglinge
Die Sicherheit und Verträglichkeit von Prevenar 20 wurden in Studie 1013 untersucht, die 111 Spät-Frühgeborene (>34 bis <37 Schwangerschaftswochen) aus der gesamten Studienpopulation einschloss. Die Teilnehmer wurden randomisiert und erhielten in einem Impfschema mit 4 Dosen entweder Prevenar 20 (N=77) oder Prevenar 13 (N=34). Es wurden keine speziellen Studien zur Beschreibung der Immunogenität von Prevenar 20 bei Frühgeborenen durchgeführt. Basierend auf den Erfahrungen mit Prevenar und Prevenar 13 werden bei Frühgeborenen Immunantworten hervorgerufen, diese können jedoch niedriger sein können als bei termingerecht geborenen Säuglingen.
Klinische Studien zu Prevenar 20 bei Erwachsenen
Drei klinische Haupt-Studien der Phase 3, B7471006, B7471007 und B7471008 (Studie 1006, Studie 1007 und Studie 1008), wurden in den Vereinigten Staaten und Schweden durchgeführt, um die Immunogenität von Prevenar 20 in verschiedenen Altersgruppen von Erwachsenen und bei Teilnehmern zu untersuchen, die entweder nicht gegen Pneumokokken oder zuvor mit Prevenar 13, PPSV23 oder beidem geimpft worden waren.
An jeder Studie nahmen gesunde Teilnehmer oder immunkompetente Teilnehmer mit stabilen Grunderkrankungen teil, darunter chronische kardiovaskuläre Erkrankung, chronische Lungenerkrankungen, Nierenerkrankungen, Diabetes mellitus, chronische Lebererkrankung sowie medizinische Risikofaktoren und Verhaltensweisen (z.B. Rauchen), die bekanntermassen das Risiko einer schwerwiegenden Pneumokokken-Pneumonie und IPD erhöhen. In der pivotalen Studie (Studie 1007) wurden diese Risikofaktoren bei 34% der Teilnehmer im Alter ab 60 Jahren festgestellt. Eine stabile Grunderkrankung wurde definiert als Erkrankung ohne Notwendigkeit einer erheblichen Therapieänderung in den vorhergehenden 6 Wochen (d.h. kein Wechsel in eine neue Therapiekategorie aufgrund einer Krankheitsverschlechterung) und ohne Krankenhausaufenthalt wegen einer Krankheitsverschlechterung innerhalb von 12 Wochen vor dem Erhalt des Studienimpfstoffs.
In allen Studien wurden die durch Prevenar 20 und die Kontroll-Pneumokokken-Impfstoffe ausgelösten Immunantworten mit einem Opsonophagozytose-Assay (opsonophagocytic activity assay, OPA) gemessen. Mit dem OPA-Assay werden die funktionalen Antikörper gegen S. pneumoniae gemessen.
Vergleich der Immunantworten auf Prevenar 20 mit Prevenar 13 und PPSV23
In einer randomisierten, Wirkstoff-kontrollierten, doppelblinden klinischen Nichtunterlegenheits-Studie (pivotale Studie 1007) zu Prevenar 20 wurden Teilnehmer ab einem Alter von 18 Jahren, die bisher noch nicht mit einem Pneumokokken-Impfstoff geimpft worden waren, basierend auf ihrem Alter bei der Aufnahme in 1 von 3 Kohorten aufgenommen (18 bis 49, 50 bis 59 und ≥60 Jahre) und auf Prevenar 20 oder eine Kontrollgruppe randomisiert. Teilnehmer ab einem Alter von 60 Jahren wurden im Verhältnis 1:1 randomisiert und erhielten Prevenar 20 (n=1507), gefolgt von Kochsalz-Placebo einen Monat danach, oder Prevenar 13 (n=1490), gefolgt von PPSV23 einen Monat danach.
Die geometrischen Mittelwerte der Serotyp-spezifischen OPA-Titer (GMT) wurden vor der ersten Impfung und 1 Monat nach jeder Impfung gemessen. Die Nichtunterlegenheit der Immunantwort (OPA-GMTs 1 Monat nach der Impfung) unter Prevenar 20 gegenüber einem Kontrollimpfstoff für einen Serotyp wurde festgestellt, wenn die untere Grenze des zweiseitigen 95%-Konfidenzintervalls (KI) für das GMT-Verhältnis (Prevenar 20/Prevenar 13; Prevenar 20/PPSV23) für den jeweiligen Serotyp über 0.5 lag.
Einen Monat nach der Impfung waren die bei Teilnehmern ab einem Alter von 60 Jahren durch Prevenar 20 ausgelösten Immunantworten auf alle 13 gemeinsamen Serotypen gegenüber den durch Prevenar 13 ausgelösten Immunantworten für dieselben Serotypen nicht unterlegen. Im Allgemeinen wurden mit Prevenar 20 im Vergleich zu Prevenar 13 bei den gemeinsamen Serotypen numerisch niedrigere geometrische Mitteltiter beobachtet (Tabelle 4). Die klinische Relevanz dieser Ergebnisse ist jedoch unbekannt.
Einen Monat nach der Impfung waren die durch Prevenar 20 ausgelösten Immunantworten auf 6 der 7 zusätzlichen Serotypen gegenüber den durch PPSV23 ausgelösten Immunantworten auf dieselben Serotypen nicht unterlegen. Die Immunantwort auf Serotyp 8 verfehlte das vorgegebene statistische Kriterium für die Nichtunterlegenheit. (Die untere Grenze des zweiseitigen 95%-KI für das GMT-Verhältnis beträgt 0.49 anstatt >0.50, Tabelle 4). Die klinische Relevanz dieser Beobachtung ist unbekannt. Unterstützende Analysen für andere Endpunkte in Bezug auf den Serotyp 8 in der Prevenar 20-Gruppe fielen günstig aus. Dazu gehören ein Anstieg des Serokonversionsfaktors (GMFR) von vor der Impfung bis einen Monat nach der Impfung um 22.1, ein Anstieg der OPA-Titer von vor der Impfung bis einen Monat nach der Impfung um das ≥4-Fache bei 77.8% der Teilnehmer und ein Erreichen von OPA-Titern ≥LLOQ einen Monat nach der Impfung bei 92.9% der Teilnehmer.
Tabelle 4: OPA-GMTs 1 Monat nach der Impfung bei Teilnehmern ab einem Alter von 60 Jahren nach Gabe von Prevenar 20 im Vergleich zu Prevenar 13 für die 13 gemeinsamen Serotypen und im Vergleich zu PPSV23 für die 7 zusätzlichen Serotypen (Studie 1007)a,b,c,d
|
|
Prevenar 20
(n=1157–1430)
|
Prevenar 13
(n=1390–1419)
|
PPSV23
(n=1201–1319)
|
Impfstoffvergleich
| |
|
GMTe
|
GMTe
|
GMTe
|
GMT-Verhältnise
|
95%-KIe
| |
Serotyp
|
| |
1
|
123
|
154
|
|
0.80
|
0.71; 0.90
| |
3
|
41
|
48
|
|
0.85
|
0.78; 0.93
| |
4
|
509
|
627
|
|
0.81
|
0.71; 0.93
| |
5
|
92
|
110
|
|
0.83
|
0.74; 0.94
| |
6A
|
889
|
1165
|
|
0.76
|
0.66; 0.88
| |
6B
|
1115
|
1341
|
|
0.83
|
0.73; 0.95
| |
7F
|
969
|
1129
|
|
0.86
|
0.77; 0.96
| |
9V
|
1456
|
1568
|
|
0.93
|
0.82; 1.05
| |
14
|
747
|
747
|
|
1.00
|
0.89; 1.13
| |
18C
|
1253
|
1482
|
|
0.85
|
0.74; 0.97
| |
19A
|
518
|
645
|
|
0.80
|
0.71; 0.90
| |
19F
|
266
|
333
|
|
0.80
|
0.70; 0.91
| |
23F
|
277
|
335
|
|
0.83
|
0.70; 0.97
| |
Zusätzliche Serotypen
|
| |
8
|
466
|
|
848
|
0.55
|
0.49; 0.62
| |
10A
|
2008
|
|
1080
|
1.86
|
1.63; 2.12
| |
11A
|
4427
|
|
2535
|
1.75
|
1.52; 2.01
| |
12F
|
2539
|
|
1717
|
1.48
|
1.27; 1.72
| |
15B
|
2398
|
|
769
|
3.12
|
2.62; 3.71
| |
22F
|
3666
|
|
1846
|
1.99
|
1.70; 2.32
| |
33F
|
5126
|
|
3721
|
1.38
|
1.21; 1.57
|
Abkürzungen: KI=Konfidenzintervall, GMT=geometrischer Mittelwert der Titer (geometric mean titre), LLOQ=untere Bestimmungsgrenze (lower limit of quantitation), n=Anzahl der Teilnehmer, OPA=Opsonophagozytose-Assay (opsonophagocytic activity), PPSV23=Pneumokokken-Polysaccharidimpfstoff, 23-valent (pneumococcal polysaccharide vaccine, 23-valent).
a Studie 1007 wurde in den Vereinigten Staaten und in Schweden durchgeführt.
b Die Nichtunterlegenheit für einen Serotypen wurde bestätigt, wenn die Untergrenze des zweiseitigen 95%-KI für das GMT-Verhältnis (Verhältnis Prevenar 20/Vergleichsimpfstoff) über 0.5 lag (2-fach-Kriterium für die Nichtunterlegenheit).
c Untersuchungsergebnisse unterhalb der LLOQ wurden für die Analyse auf 0.5 × LLOQ gesetzt.
d Auswertbare Population für die Immunogenität.
e GMTs und GMT-Verhältnisse mit den jeweiligen zweiseitigen KI basierten auf einer Analyse der log-transformierten OPA-Titer unter Verwendung eines Regressionsmodells mit Impfstoffgruppe, Geschlecht, Raucherstatus, Alter bei der Impfung in Jahren und log-transformierten OPA-Titern bei Studienbeginn.
Eine Post-hoc-Analyse der Studie 1007 bei Studienteilnehmern ab 65 Jahren wurde durchgeführt, um die Serotyp-spezifischen OPA-Titer 1 Monat nach Prevenar 20 im Vergleich zu Prevenar 13 für die 13 gemeinsamen Serotypen und zu PPSV23 für die 7 zusätzlichen Serotypen dieser Gruppe zu bewerten. Die OPA-GMR für jeden Serotyp wurde unter Verwendung desselben linearen Regressionsmodells zusammengefasst, wie es bei der Analyse der primären Immunogenitätsziele in der Studienpopulation ab 60 Jahren der Fall war. Bei Anwendung einer 2-fachen Nichtunterlegenheitsspanne (untere Grenzen der 2-seitigen 95%-KI für die modellbasierten OPA-GMRs >0.5) auf die Ergebnisse wie in der Primäranalyse, hätten alle 20 Serotypen die statistische Nichtunterlegenheit von Prevenar 20 gegenüber Prevenar 13 (oder PPSV23) bei Probanden ≥65 Jahren erreicht.
Immunogenität von Prevenar 20 bei Erwachsenen, die zuvor mit einem Pneumokokken-Impfstoff geimpft wurden
In einer randomisierten, offenen klinischen Phase-3-Studie (Studie 1006) wurde die Immunantwort auf Prevenar 20 bei Teilnehmern ab 65 Jahren beschrieben, die zuvor mit PPSV23, Prevenar 13 oder Prevenar 13 gefolgt von PPSV23 geimpft wurden. An Prüfzentren in den Vereinigten Staaten wurden Studienteilnehmer, die zuvor mit Prevenar 13 (nur Prevenar 13 oder gefolgt von PPSV23) geimpft worden waren, aufgenommen, während in Prüfzentren in Schweden Teilnehmer aufgenommen wurden, die zuvor nur mit PPSV23 geimpft worden waren (35.5% in dieser Kategorie).
Bei Teilnehmern ab einem Alter von 65 Jahren mit vorhergehender Impfung mit einem Pneumokokken-Impfstoff löste Prevenar 20 Immunantworten auf alle 20 Impfstoff-Serotypen aus (Tabelle 5). Bei Teilnehmern, die zuvor mit PPSV23 geimpft worden waren, fielen die Immunantworten in beiden Gruppen niedriger aus.
Tabelle 5: OPA-GMTs für Pneumokokken vor und 1 Monat nach der Impfung mit Prevenar 20 bei Teilnehmern ab einen Alter von 65 Jahren mit vorhergehender Impfung mit einem Pneumokokken-Impfstoff (Studie 1006)a,b,c,d
|
|
Vorhergehende Impfung nur mit PPSV23
|
Vorhergehende Impfung nur mit Prevenar 13
|
Vorhergehende Impfung mit Prevenar 13 und PPSV23
| |
Vor der Impfung
(n=208–247)
|
Nach der Impfung
(n=216–246)
|
Vor der Impfung
(n=210-243)
|
Nach der Impfung
(n=201–243)
|
Vor der Impfung
(n=106–121)
|
Nach der Impfung
(n=102-121)
| |
GMT
(95%-KI)e
|
GMT
(95%-KI)e
|
GMT
(95%-KI)e
|
GMT
(95%-KI)e
|
GMT
(95%-KI)e
|
GMT
(95%-KI)e
| |
Serotyp
| |
1
|
24
(20; 28)
|
51
(42; 62)
|
34
(28; 41)
|
115
(96; 138)
|
42
(32; 56)
|
82
(61; 110)
| |
3
|
13
(11; 15)
|
31
(27; 36)
|
15
(13; 18)
|
54
(47; 63)
|
20
(17; 25)
|
39
(32; 48)
| |
4
|
29
(23; 35)
|
150
(118; 190)
|
67
(53; 84)
|
335
(274; 410)
|
73
(53; 101)
|
194
(143; 262)
| |
5
|
27
(24; 31)
|
63
(53; 75)
|
38
(32; 44)
|
87
(73; 104)
|
47
(37; 59)
|
83
(65; 108)
| |
6A
|
57
(46; 70)
|
749
(577; 972)
|
125
(99; 158)
|
1081
(880; 1327)
|
161
(116; 224)
|
1085
(797; 1478)
| |
6B
|
107
(86; 133)
|
727
(574; 922)
|
174
(138; 219)
|
1159
(951; 1414)
|
259
(191; 352)
|
1033
(755; 1415)
| |
7F
|
156
(132; 184)
|
378
(316; 452)
|
210
(175; 251)
|
555
(467; 661)
|
206
(164; 258)
|
346
(277; 432)
| |
9V
|
203
(171; 241)
|
550
(454; 667)
|
339
(282; 408)
|
1085
(893; 1318)
|
352
(270; 459)
|
723
(558; 938)
| |
14
|
212
(166; 270)
|
391
(315; 486)
|
282
(224; 356)
|
665
(554; 798)
|
336
(238; 473)
|
581
(434; 777)
| |
18C
|
173
(137; 218)
|
552
(445; 684)
|
219
(177; 272)
|
846
(693; 1033)
|
278
(209; 369)
|
621
(470; 821)
| |
19A
|
82
(66; 100)
|
239
(197; 288)
|
124
(100; 153)
|
365
(303; 440)
|
182
(141; 235)
|
341
(264; 439)
| |
19F
|
61
(52; 71)
|
159
(131; 192)
|
89
(74; 107)
|
242
(199; 294)
|
120
(94; 154)
|
218
(168; 282)
| |
23F
|
23
(18; 28)
|
152
(115; 199)
|
48
(37; 62)
|
450
(358; 566)
|
66
(46; 94)
|
293
(204; 420)
| |
Zusätzliche Serotypen
| |
8
|
55
(45; 67)
|
212
(172; 261)
|
28
(24; 33)
|
603
(483; 753)
|
139
(99; 195)
|
294
(220; 392)
| |
10A
|
212
(166; 269)
|
1012
(807; 1270)
|
141
(113; 177)
|
2005
(1586; 2536)
|
400
(281; 568)
|
1580
(1176; 2124)
| |
11A
|
510
(396; 656)
|
1473
(1192; 1820)
|
269
(211; 343)
|
1908
(1541; 2362)
|
550
(386; 785)
|
1567
(1141; 2151)
| |
12F
|
147
(112; 193)
|
1054
(822; 1353)
|
53
(43; 65)
|
1763
(1372; 2267)
|
368
(236; 573)
|
1401
(1002; 1960)
| |
15B
|
140
(104; 189)
|
647
(491; 853)
|
74
(56; 98)
|
1480
(1093; 2003)
|
190
(124; 291)
|
1067
(721; 1578)
| |
22F
|
167
(122; 230)
|
1773
(1355; 2320)
|
60
(45; 82)
|
4157
(3244; 5326)
|
286
(180; 456)
|
2718
(1978; 3733)
| |
33F
|
1129
(936; 1362)
|
2026
(1684; 2437)
|
606
(507; 723)
|
3175
(2579; 3908)
|
1353
(1037; 1765)
|
2183
(1639; 2908)
|
Abkürzungen: KI=Konfidenzintervall, GMT=geometrischer Mittelwert der Titer (geometric mean titre), LLOQ=untere Bestimmungsgrenze (lower limit of quantitation), n=Anzahl der Teilnehmer, OPA=Opsonophagozytose-Assay (opsonophagocytic activity), PPSV23=Pneumokokken-Polysaccharidimpfstoff, 23-valent (pneumococcal polysaccharide vaccine, 23-valent).
a Studie 1006 wurde in den Vereinigten Staaten und in Schweden durchgeführt.
b Untersuchungsergebnisse unterhalb der LLOQ wurden für die Analyse auf 0.5 × LLOQ gesetzt.
c Auswertbare Population für die Immunogenität.
d Unverblindete Impfung mit Prevenar 20.
e Zweiseitiges KI basierend auf der Student-t-Verteilung.
PharmakokinetikEine Bewertung der pharmakokinetischen Eigenschaften ist für Impfstoffe nicht erforderlich.
Absorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenBasierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe und zur Reproduktions- und Entwicklungstoxizität liessen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieser Impfstoff nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8 °C) lagern. Fertigspritzen waagrecht im Kühlschrank lagern, um die Resuspensionszeit zu minimieren.
Nicht einfrieren. Impfstoff, der gefroren war, ist zu verwerfen.
Aus mikrobiologischer Sicht sollte der Impfstoff nach der Entnahme aus dem Kühlschrank sofort verwendet werden.
Stabilitätsdaten zeigen, dass der Impfstoff bei einer Lagerung bei Temperaturen zwischen 8 °C und 25 °C 96 h und bei einer Lagerung bei Temperaturen zwischen 0 °C und 2 °C 72 h haltbar ist. Am Ende dieser Zeiträume sollte Prevenar 20 verwendet oder entsorgt werden. Diese Angaben dienen der Orientierung des medizinischen Fachpersonals lediglich im Fall eines vorübergehenden Überschreitens der Lagerungstemperatur.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Während der Lagerung können in der Fertigspritze mit der Suspension ein weisses Sediment und ein klarer Überstand beobachtet werden. Fertigspritzen waagrecht im Kühlschrank lagern, um die Resuspensionszeit zu minimieren.
Vorbereitung der Injektion
|
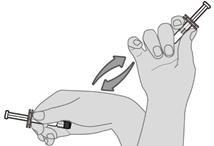
Schritt 1. Resuspension des Impfstoffs
Fertigspritze horizontal zwischen Daumen und Zeigefinger halten und kräftig schütteln, bis der Inhalt der Spritze eine homogene weisse Suspension ist. Den Impfstoff nicht verwenden, wenn er sich nicht resuspendieren lässt.
|
|
| |
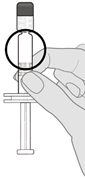
Schritt 2. Sichtprüfung
Den Impfstoff vor der Verabreichung einer Sichtprüfung auf grosse Partikel und Verfärbungen unterziehen. Nicht verwenden, wenn grosse Partikel oder Verfärbungen festgestellt werden. Wenn der Impfstoff keine homogene weisse Suspension ist, Schritte 1 und 2 wiederholen.
|
|
| |
Schritt 3. Schutzkappe entfernen
Schutzkappe des Luer-Lock-Adapters durch langsames Drehen der Kappe gegen den Uhrzeigersinn entfernen. Luer-Lock-Adapter dabei festhalten.
Hinweis: Achten Sie darauf, dass der herausstehende Kolben beim Entfernen der Schutzkappe nicht heruntergedrückt wird.
|
|
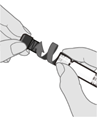
| |
Schritt 4. Sterile Nadel aufsetzen
Setzen Sie eine für die intramuskuläre Injektion geeignete Nadel auf die Fertigspritze auf, indem Sie den Luer-Lock-Adapter festhalten und die Nadel im Uhrzeigersinn drehen.
|
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den lokalen Anforderungen zu beseitigen.
Zulassungsnummer69222 (Swissmedic).
Packungen1 Fertigspritze zu 0.5 ml und 1 Nadel. [B]
10 Fertigspritzen zu 0.5 ml und 10 Nadel. [B]
ZulassungsinhaberinPfizer AG, Zürich.
Stand der InformationFebruar 2025
LLD V007
|



