Eigenschaften/WirkungenATC-Code
L01FF05
Wirkungsmechanismus
Tecentriq s.c. enthält Atezolizumab und rekombinante humane Hyaluronidase (rHuPH20).
Durch die Bindung von PD-L1 an PD-1- und B7.1-Rezeptoren auf T-Zellen wird die zytotoxische T-Zell-Aktivität über eine Hemmung der Proliferation und Zytokinproduktion der T-Zellen supprimiert. PD-L1 kann auf Tumorzellen (TC) und Tumor-infiltrierenden Immunzellen (IC) exprimiert werden und zur Hemmung der antitumoralen Immunantwort in der Mikroumgebung beitragen.
Atezolizumab ist ein humanisierter monoklonaler Immunglobulin G1 (IgG1)-Antikörper mit modifiziertem Fc-Teil, der direkt an PD-L1 bindet und die Interaktionen mit den PD-1- und B7.1-Rezeptoren blockiert. Dies führt zu einer Aufhebung der über den PD-L1/PD-1-Signalweg vermittelten Hemmung der Immunantwort einschliesslich Reaktivierung der antitumoralen Immunantwort. Atezolizumab lässt die PD-L2/PD-1-Interaktion intakt. In syngenen murinen Tumormodellen führte die Blockade der PD-L1-Aktivität zu vermindertem Tumorwachstum.
Die duale Hemmung der PD-1/PD-L1- und MAPK- sowie der BRAF- und MEK-Signalwege unterdrückt in Mauskrebsmodellen das Tumorwachstum und verbessert die Tumorimmunogenität durch eine im Vergleich zur alleinigen zielgerichteten Therapie erhöhte Antigenpräsentation und T-Zell-Infiltration und -Aktivierung.
Rekombinante humane Hyaluronidase (rHuPH20) baut lokal und transient Hyaluronan (HA), ein Glykosaminoglykan, das von Natur aus überall im Körper vorkommt, in der extrazellulären Matrix des subkutanen Raums ab, indem es die Bindung zwischen den beiden Zuckern (N-Acetylglucosamin und Glucuronsäure), aus denen HA besteht, spaltet.
Klinische Wirksamkeit
Intravenöse Darreichungsform
Für detaillierte Angaben zu klinischen Studien, die mit Tecentriq i.v. durchgeführt wurden, bitte die Fachinformation von Tecentriq i.v konsultieren.
Nicht-kleinzelliges Lungenkarzinom
Chemotherapie-vorbehandeltes NSCLC
IMscin001
Es wurde eine offene, multizentrische, internationale, randomisierte Studie der Phase Ib/III, BP40657 (IMscin001), durchgeführt, um die Pharmakokinetik, Wirksamkeit und Sicherheit von Tecentriq s.c. im Vergleich zu Tecentriq i.v. bei Patienten mit lokal fortgeschrittenem oder metastasiertem NSCLC zu bewerten, die noch keine Immuntherapie gegen Krebs (CIT) erhalten hatten und bei Patienten, bei denen es nach einer vorgängigen platinbasierten Therapie zu einer Progression oder zu einem Rezidiv kam. Die Studie IMscin001 war dazu ausgelegt, die Nichtunterlegenheit des Serumtalspiegels (CTal) und des per Modell vorausberechneten AUC-Werts von Tag 0 bis 21 im Atezolizumab-Zyklus 1 (vor der Dosisgabe in Zyklus 2) von Atezolizumab s.c. im Vergleich zu Atezolizumab i.v. aufzuzeigen (Ko-primärer Endpunkt). Zu den deskriptiven sekundären Endpunkten gehörten progressionsfreies Überleben (PFS), die objektive Ansprechrate (ORR) und das Gesamtüberleben (OS).
In Teil 2 (Phase III) wurden insgesamt 371 Patienten aufgenommen und randomisiert, um entweder 1875 mg Tecentriq s.c. q3w oder 1200 mg Tecentriq i.v. q3w zu erhalten. Eine Dosisreduktion war nicht zulässig.
Patienten mit anamnestisch bekannter Autoimmunerkrankung, aktiven oder kortikosteroid-abhängigen Hirnmetastasen, Anwendung einer attenuierten Lebendvakzine in den 4 Wochen vor der Randomisierung, sowie Anwendung von systemischen immunstimulierenden Wirkstoffen in den 4 Wochen oder von systemischen immunsuppressiven Arzneimitteln in den 2 Wochen vor der Randomisierung, wurden von der Teilnahme an der Studie ausgeschlossen.
Das mediane Alter der Intention-to-treat-Population betrug 64 Jahre (Bereich: 27 bis 85 Jahre), und 69 % der Patienten waren männlich. Die meisten Patienten waren Weisse (67 %). Ungefähr zwei Drittel der Patienten (65 %) hatten eine nicht-plattenepitheliale Erkrankung, 5 % hatten eine bekannte EGFR-Mutation, 2 % hatten bekannte ALK-Translokationen, 40 % waren PD-L1-positiv (TC ≥1 % und/oder IC ≥1 %), bei 16 % lagen zur Baseline nichtaktive ZNS-Metastasen vor, 26 % hatten einen ECOG PS von 0 und 74 % einen ECOG PS von 1, und die meisten Patienten waren aktuell oder vorgängig Raucher (70 %).
Die Nichtunterlegenheit der Exposition gegenüber Atezolizumab in Tecentriq s.c. im Vergleich zu Atezolizumab i.v. wurde aufgezeigt (siehe «Pharmakokinetik»). Die Ergebnisse einer post-hoc aktualisierten Wirksamkeitsanalyse mit einer medianen Überlebensdauer von 9,5 Monaten sind in Tabelle 5 zusammengefasst.
Tabelle 5: Zusammenfassung der aktualisierten Wirksamkeitsanalysen (IMscin001)
|
Wirksamkeitsendpunkt
|
Tecentriq s.c.
|
Tecentriq i.v.
| |
Vom Prüfarzt beurteilte, bestätigte ORR (RECIST v1.1)*
|
n=245
|
n=124
| |
Anzahl Responder (%)
|
27 (11,0%)
|
13 (10,5%)
| |
Vom Prüfarzt beurteiltes PFS (RECIST v1.1)*
|
n=247
|
n=124
| |
Anzahl Ereignisse (%)
|
219 (88,7%)
|
107 (86,3%)
| |
Median (Monate)
|
2,8
|
2,9
| |
OS*
|
n=247
|
n=124
| |
Anzahl Ereignisse (%)
|
144 (58,3%)
|
79 (63,7)
| |
Median (Monate)
|
10,7
|
10,1
|
ORR = objektive Ansprechrate; OS = Gesamtüberleben; PFS = progressionsfreies Überleben; RECIST = Beurteilungskriterien des Ansprechens solider Tumoren Version 1.1
* Deskriptive Analysen
Wirksamkeit von Atezolizumab bei Vorliegen von Anti-Drug-Antikörpern
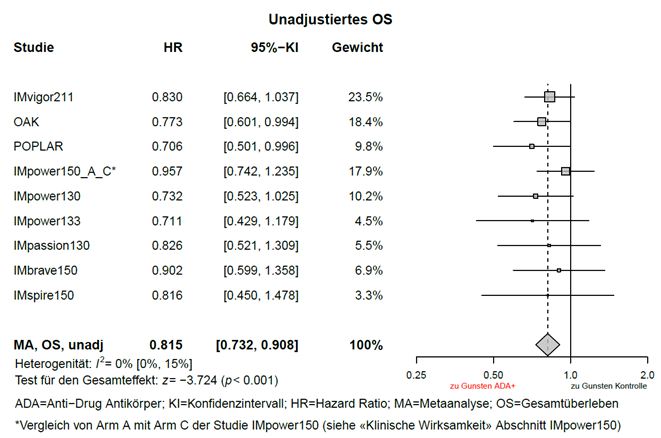
Explorative, nicht-adjustierte Metaanalysen zur Wirksamkeit (ohne Anpassungen von Ungleichgewichten der Baseline Charakteristika) wurden mit Tecentriq i.v. durchgeführt. Gemäss den Metaanalysen betrug der Schätzwert der HR für das Gesamtüberleben (OS) zwischen der ADA-positiven Subgruppe und dem Kontrollarm 0,815 (95-%-KI: 0,732; 0,908), sowie der Schätzwert der HR für das OS zwischen der ADA-negativen Subgruppe und dem Kontrollarm 0,672 (95-%-KI: 0,617; 0,732), siehe Graphiken 1 und 2.
Graphik 1: Meta-Analyse OS (unadjustiert) ADA – Positive Patienten im Vergleich zur Kontrolle
Graphik 2: Meta-Analyse OS (unadjustiert) ADA – Negative Patienten im Vergleich zur Kontrolle
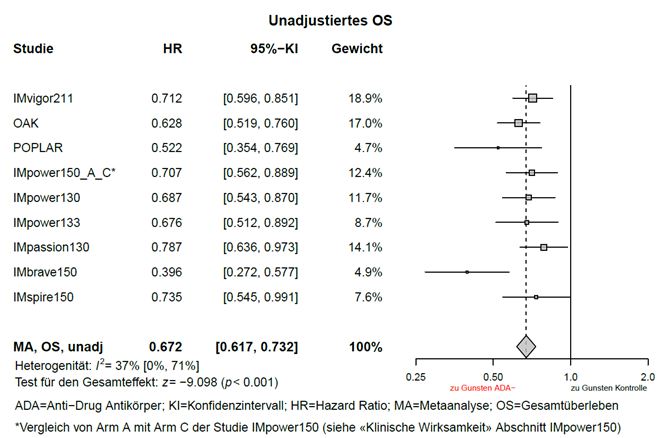
In der Studie IMscin001 war die Inzidenz behandlungsbedingter Anti-Atezolizumab-Antikörper bei Patienten, die mit Tecentriq s.c. bzw. i.v. behandelt wurden 19,5 % [43/221] bzw. 13,9 % [15/108]). Die Inzidenz behandlungsbedingter Anti-rHuPH20-Antikörper bei mit Tecentriq s.c. behandelten Patienten betrug 5,4 % (12/224).
Das mediane OS betrug bei mit Tecentriq s.c. behandelten Patienten, die ADA-negativ waren (n=178), 12,6 Monate (95% KI:10,6, 16,5) und bei Patienten, die zu einem beliebigen Zeitpunkt ADA-positiv waren (n=43), 6,9 Monate (95% KI: 5,0, nicht abschätzbar).
|


