Zusammensetzung
Wirkstoffe
Antithrombin III aus Humanplasma
Hilfsstoffe
Glycin, Natriumchlorid, Natriumcitrat, Natriumhydroxid (entspricht ≤1,95 mmol oder 44,8 mg Natrium pro Durchstechflasche mit 500 I.E. und ≤3,89 mmol oder 89,5 mg Natrium pro Durchstechflasche mit 1000 I.E.) und Salzsäure.
Lösungsmittel: Wasser für Injektionszwecke
Indikationen/Anwendungsmöglichkeiten
Substitutionstherapie bei Patienten mit angeborenem Antithrombin-III-Mangel:
·zur Thromboseprophylaxe in Situationen, in denen die Verabreichung von oralen Antikoagulantien bzw. von Heparin kontraindiziert ist, insbesondere perioperativ und peripartal.
·zur Thrombosetherapie bei ausgedehnten Thrombosen zusammen mit Heparin sowie bei einer Verbrauchskoagulopathie.
Dosierung/Anwendung
Die rekonstituierte Lösung von Antithrombin III wird langsam intravenös injiziert oder infundiert.
Bei angeborenem Mangel sollte die Dosierung bei jedem Patienten individuell erfolgen. Dabei sollten die Familiengeschichte bezüglich thromboembolischer Ereignisse, die aktuellen klinischen Risikofaktoren und die Laborbeurteilung berücksichtigt werden.
Übliche Dosierung
Die Menge der verabreichten Antithrombin-Einheiten wird in Internationalen Einheiten (I.E.) angegeben, die vom aktuellen WHO-Standard für Antithrombin-Produkte abgeleitet sind. Die Antithrombin-Aktivität im Plasma wird entweder als Prozentsatz (relativ zu normalem menschlichen Plasma) oder in Internationalen Einheiten (relativ zum Internationalen Standard für Antithrombin im Plasma) angegeben.
Eine internationale Einheit (I.E.) Antithrombin-Aktivität entspricht dem Antithrombin-Gehalt in 1 ml normalem Humanplasma. Die Berechnung der notwendigen Dosierung basiert auf dem empirischen Befund, dass 1 I.E. Antithrombin/kg Körpergewicht die Antithrombin-Aktivität im Plasma um ca. 1,5 % erhöht.
Die Initialdosis wird nach folgender Formel berechnet:
Erforderliche Einheiten = Körpergewicht [kg] x (100 - aktuelle Antithrombin-Aktivität [%]) x 2/3.
Der initiale Zielwert der Antithrombin-Aktivität hängt von der klinischen Situation ab. Zur Substitution von Antithrombin sollte die Dosierung so gewählt werden, dass der gewünschte Antithrombin-Spiegel erreicht und aufrecht erhalten wird. Dies sollte anhand von Labormessungen der Antithrombin-Aktivität überwacht werden. Diese Antithrombin Bestimmungen sollten mindestens zweimal täglich bis zur Stabilisierung des Patienten durchgeführt werden, anschliessend einmal täglich und insbesondere unmittelbar vor der nächsten Gabe.
Für eine Dosisanpassung sollten sowohl Laborwerte mit möglichen Hinweisen auf erhöhten Antithrombin-Verbrauch, als auch klinische Parameter berücksichtigt werden. Die Antithrombin-Aktivität sollte während der Therapie mindestens 80% der Norm betragen, ausser die klinische Situation spricht für einen anderen effektiven Spiegel.
Die übliche Anfangsdosis bei angeborenem Mangel liegt bei 30-50 I.E./kg.
Im weiteren Verlauf sollte die Dosierung sowie die Häufigkeit und die Dauer der Behandlung den biologischen Daten und der klinischen Situation angepasst werden.
Um die Rückverfolgbarkeit von biologischen Arzneimitteln sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Kinder und Jugendliche
40 - 60 I.E. Antithrombin/kg Körpergewicht/Tag abhängig vom Gerinnungsstatus.
Abhängig vom klinischen Bild können im Einzelfall höhere Dosen notwendig sein. Die Antithrombin-Akitvität muss dann häufiger kontrolliert werden und soll nicht mehr als 120% betragen.
Art der Anwendung
Die Lösung wird langsam intravenös injiziert oder infundiert (max. 4 ml/Min). Hinweise zum Auflösen finden sich im Kapitel «Sonstige Hinweise» im Abschnitt «Hinweise für die Handhabung».
Kontraindikationen
Überempfindlichkeit gegen die aktive Substanz oder einen der Hilfstoffe.
Warnhinweise und Vorsichtsmassnahmen
Aufgrund von Erfahrungen aus klinischen Prüfungen kann die Anwendung von Antithrombin zur Behandlung von IRDS (Infant Respiratory Distress Syndrome) bei Frühgeborenen nicht empfohlen werden.
Die Behandlung von Patienten mit hereditärem Antithrombin-Mangel sowie von deren Nachkommen sollte individuell entsprechend dem Ansprechen des Patienten und unter Hinzuziehung eines Gerinnungsspezialisten durchgeführt werden.
Die Substitutionstherapie wird mit einem Funktionstest überwacht. Bei Patienten mit akutem Verbrauch kann die Halbwertszeit von Antithrombin bis auf wenige Stunden verkürzt sein. Bei diesen Patienten ist eine Bestimmung der Antithrombin-Aktivität mehrmals täglich erforderlich. Dazu eignet sich am besten die Bestimmung mittels chromogenem Substrat.
Aufgrund des intravenösen Applikationsweges des Glykoproteins sind allergische Überempfindlichkeitsreaktionen möglich. Die Patienten müssen während der Infusion engmaschig überwacht und sorgfältig auf allfällige Symptome beobachtet werden. Patienten sollen über Frühzeichen von Überempfindlichkeitsreaktionen informiert werden, wie Hautausschlag, generalisierte Nesselsucht, Engegefühl in der Brust, Stridor, Hypotonie und Anaphylaxie. Falls diese Symptome nach der Anwendung auftreten, sollen die Patienten sofort ihren Arzt kontaktieren. Die aktuellen medizinischen Richtlinien zur Schockbehandlung sind zu beachten.
Es wird empfohlen, Patienten mit hereditärem Antithrombin-Mangel über die Erblichkeit dieser Krankheit und über das Thromboserisiko während einer Schwangerschaft zu informieren.
Sonstiger Bestandteil mit bekannter Wirkung:
Kybernin P 500 enthält ≤1,95 mmol (44,8 mg) Natrium pro Durchstechflasche, was 2,2 % der von der WHO empfohlenen täglichen Aufnahme von 2 g entspricht.
Kybernin P 1000 enthält ≤3,89 mmol (89,5 mg) Natrium pro Durchstechflasche, was 4,5 % der von der WHO empfohlenen täglichen Aufnahme von 2 g entspricht.
Virale Sicherheit
Wenn medizinische Produkte aus humanem Blut oder Plasma angewendet werden, können Infektionskrankheiten bedingt durch die Übertragung infektiöser Agentien nicht vollständig ausgeschlossen werden. Dies gilt auch für Pathogene bisher unbekannter Natur. Standardmassnahmen zur Verhinderung von Infektionen durch den Einsatz von aus Blut oder Blutplasma hergestellten Arzneimitteln schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker (HBsAg und Antikörper gegen HIV und HCV) sowie effektive und mit Modellviren validierte Schritte zur Inaktivierung/Eliminierung von Viren im Herstellverfahren ein. Die getroffenen Massnahmen werden als wirksam angesehen für umhüllte Viren wie z.B. das humane Immundefizienz Virus (HIV), das Hepatitis B Virus (HBV) und das Hepatitis C Virus (HCV) sowie für die nicht umhüllten Viren Hepatitis A Virus (HAV) und Parvovirus B19. Bei Patienten mit angeborenem Mangel, die regelmässig Antithrombin-Konzentrate aus menschlichem Plasma erhalten, sollte eine Impfung gegen Hepatitis A und B in Erwägung gezogen werden.
Klinische und biologische Überwachung bei der Anwendung von Antithrombin zusammen mit Heparin
Um die Dosierung von Heparin anzupassen und um eine exzessive Hypokoagualität zu vermeiden, sollten Kontrollen des Ausmasses der Antikoagulation (APPT, und wo angemessen anti-FXa Aktivität) regelmässig, in kurzen Intervallen und besonders in den ersten Minuten und Stunden nach Beginn der Anwendung von Antithrombin III erfolgen.
Da bei Langzeitbehandlung mit nicht fraktioniertem Heparin das Risiko der Abnahme der Antithrombin-III-Spiegel besteht, sollte unter diesen Bedingungen eine tägliche Messung der Antithrombin-III-Spiegel erfolgen, und die individuelle Dosis ggf. angepasst werden.
Interaktionen
Heparin: Antithrombin-Ersatz während der Anwendung von Heparin in therapeutischer Dosierung erhöht das Blutungsrisiko. Die gerinnungshemmende Wirkung von Antithrombin wird durch gleichzeitige Verabreichung von Heparin wesentlich verstärkt. Dies kann bedingt durch einen beschleunigten Antithrombin Umsatz zu einer beträchtlichen Verkürzung der Halbwertszeit von Antithrombin führen.Daher muss die gleichzeitige Gabe von Heparin und Antithrombin bei Patienten mit einem erhöhten Blutungsrisiko klinisch und biologisch überwacht werden.
Schwangerschaft, Stillzeit
Die Erfahrungen zur Sicherheit von Antithrombin-Produkten während der Schwangerschaft sind begrenzt.
Klinische Prüfungen mit Kybernin P in der Schwangerschaft oder Stillzeit wurden bislang nicht durchgeführt. Untersuchungen am Tier sind ungeeignet für die Beurteilung der Auswirkungen auf die Reproduktionsfähigkeit, die Entwicklung des Embryos oder Foetus, den Schwangerschaftsverlauf und die prä-/postnatale Entwicklung. Bisher liegen keine negativen Erfahrungen hinsichtlich Behandlung während der Schwangerschaft und Stillzeit vor. Kybernin P soll daher bei schwangeren oder stillenden antithrombin-defizienten Frauen nur bei zwingender Indikation unter Berücksichtigung des erhöhten Thromboserisikos angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Kybernin hat keinen bekannten Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Überempfindlichkeit oder allergische Reaktionen (einschliesslich Angioödem, Brennen und Stechen an der Infusionsstelle, Schüttelfrost, Hautrötung, generalisierte Nesselsucht, Kopfschmerzen, quaddelartiger Hautausschlag, Hypotonie, Lethargie, Brechreiz, Ruhelosigkeit, Tachykardie, Engegefühl in der Brust, Kribbeln, Erbrechen und pfeifendes Atemgeräusch) wurden selten beobachtet. Diese können sich in einzelnen Fällen zu schwerer Anaphylaxie einschliesslich Schock entwickeln. Selten wurde Fieber beobachtet.
Die folgenden unerwünschten Arzneimittelwirkungen (UAW) basieren auf den Anwendungserfahrungen nach der Markteinführung. Sofern Daten vorliegen, sind die Häufigkeiten gemäß folgender Standardkonvention beurteilt:
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
«sehr häufig» (≥1/10)
«häufig» (≥1/100, <1/10),
«gelegentlich» (≥1/1000, <1/100)
«selten» (≥1/10'000, <1/1000)
«sehr selten» (<1/10'000)
Erkrankungen des Immunsystems:
Selten: Überempfindlichkeit/anaphylaktische Reaktionen (inklusive schwerer Anaphylaxie und Schock)
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Selten: Fieber
Informationen zur Virensicherheit siehe auch Kapitel «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Symptome bei Überdosierung wurden bisher nicht beobachtet.
Eigenschaften/Wirkungen
ATC-Code
B01A B02
Kybernin P wird aus gepooltem, humanem Plasma gesunder Spender gewonnen. Information über die Testung von Plasma und Plasmapools sind unter Kapitel «Warnhinweise und Vorsichtsmassnahmen» beschrieben. Der Herstellungsprozess von Kybernin P beinhaltet verschiedene Schritte, die zur Eliminierung/Inaktivierung von Viren beitragen. Die Hitzebehandlung des Präparates in wässriger Lösung bei 60°C über 10 Stunden wurde zur Virusinaktivierung eingeführt.
Wirkungsmechanismus/Pharmakodynamik
Antithrombin, ein Glykoprotein mit einem Molekulargewicht von 58 kD und 432 Aminosäuren, gehört in die Gruppe der Serpine (Serin Protease Inhibitor). Es ist einer der wichtigsten physiologischen Hemmer der Blutgerinnung. Die am stärksten gehemmten Faktoren sind Thrombin und Faktor Xa, aber auch die Faktoren der Kontaktaktivierung, des intrinsischen Systems und der Faktor VIIa/Tissue Faktor Komplex. Die Antithrombin-Aktivität wird durch Heparin stark erhöht und der gerinnungshemmende Effekt von Heparin hängt von der Anwesenheit von Antithrombin ab.
Antithrombin enthält zwei funktionell wichtige Domänen.
Die eine enthält das reaktive Zentrum und stellt die Spaltungsstelle für Proteinasen wie Thrombin, eine Vorbedingung zur Bildung eines stabilen Proteinase-Inhibitor Komplexes, dar. Die zweite ist eine Glykosaminoglykan-bindende Domäne und ist für die Interaktion mit Heparin und ähnlichen Substanzen, die die Hemmung von Thrombin beschleunigen, verantwortlich.
Die Komplexe aus Antithrombin und Gerinnungsfaktoren werden durch das retikuloendotheliale System abgebaut.Die normale AntithrombinAktivität beträgt bei Erwachsenen 80-120%, der Spiegel bei Neugeborenen beträgt etwa 40 – 60%.
Klinische Wirksamkeit
Keine Angaben
Pharmakokinetik
Absorption
Kybernin P ist nach intravenöser Applikation sofort in der Dosierung entsprechenden Plasmakonzentration verfügbar und bindet Thrombin, Faktor Xa und andere aktivierte Gerinnungsfaktoren.
Die in-vivo Recovery lag bei 5 gesunden Probanden im Mittel bei 65% (gemessen bei tmax = 1.15 Stunden).
Distribution
Kybernin P verhält sich bei Verteilung und Abbau im Organismus wie der körpereigene Inhibitor AT III.
Metabolismus
Keine Angaben
Elimination
Die biologische Halbwertszeit von Antithrombin beträgt 2,5 Tage, kann aber bei akutem Verbrauch bis auf wenige Stunden verkürzt sein. Bei diesen Patienten ist eine mehrmalige Bestimmung der Antithrombin-Aktivität pro Tag erforderlich. Für diesen Zweck ist die Analyse mit der chromogenen Substratmethode geeignet. Auch bei gleichzeitiger Heparin-Therapie verkürzt sich diese Halbwertszeit (siehe Kap. «Interaktionen»).
Präklinische Daten
Humanes Antithrombin ist ein normaler Bestandteil des menschlichen Plasmas. Die Toxizitätsprüfungen mit Einzeldosen sind von geringer Aussagekraft und erlauben keine Einschätzung der toxischen oder letalen Dosis.
Untersuchungen an Labortieren haben keine akute Toxizität gezeigt.
Toxizitätsuntersuchungen mit wiederholten Dosen sind im Tierversuch wegen der Antikörperbildung gegen heterologes Protein bei den Versuchstieren nicht durchführbar.
Die bisherigen klinischen Erfahrungen geben keinerlei Hinweise auf embryofetale Toxizität. Es wurden weder onkogene noch mutagene Wirkungen beobachtet.
Sonstige Hinweise
Inkompatibilitäten
Hydroxyaethylstärke (HES) kann nicht als Verdünnungsmittel (für Infusionszwecke) empfohlen werden, da ein Aktivitätsverlust an Antithrombin zu beobachten ist.
Kybernin P sollte in der Spritze / dem Infusionsbesteck nicht mit anderen Arzneimitteln gemischt werden. Dopamin, Dobutamin und Furosemid sollten nicht gleichzeitig über denselben venösen Zugang appliziert werden.
Für Hinweise zur Verdünnung und für die Verdünnung geeignete Arzneimittel siehe. «Hinweise für die Handhabung».
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden. Kybernin P darf nach Ablauf des auf Packung und Behältnis angegebenen Verfalldatums nicht mehr angewendet werden.
Haltbarkeit nach Anbruch
Nach Öffnen des Behältnisses ist dessen Inhalt sofort zu verwenden.
Besondere Lagerungshinweise
Kybernin P nicht über 25°C lagern. Vor Licht schützen. Nicht einfrieren! Arzneimittel für Kinder unzugänglich aufbewahren.
Nach Rekonstitution ist die physiko-chemische Stabilität für 8 Stunden bei Raumtemperatur (max. +25 °C) belegt. Aus mikrobiologischer Sicht und da Kybernin P keine Konservierungsmittel enthält, sollte das gelöste Produkt sofort verbraucht werden. Falls es nicht sofort angewendet wird, soll eine Aufbewahrung 8 Stunden bei +25 °C nicht überschreiten.
Hinweise für die Handhabung
Das Kybernin-Pulver wird mit 10 bzw. 20 ml Wasser für Injektionszwecke unter aseptischen Bedingungen vollständig gelöst. Es entsteht eine klare bis leicht opaleszente Lösung. Zur Verabreichung als Infusion eignet sich als Verdünnungsmittel insbesondere 5%ige Human-Albumin-Lösung. Bei Verdünnungen bis 1:5 können folgende Infusionslösungen verwendet werden: Ringer-Lactat-Lösung, physiologische Kochsalzlösung, 5%ige Glukose-Lösung oder Polygeline.
Das rekonstituierte Produkt sollte vor der Anwendung visuell auf Partikel und Verfärbungen geprüft werden. Die Lösung sollte klar oder leicht opaleszent sein. Lösungen, die trübe sind oder einen Niederschlag aufweisen, nicht verwenden.
Zubereitung
Für die korrekte Handhabung des Transofix®-Transfersets gehen Sie wie folgt vor:
|
|
|
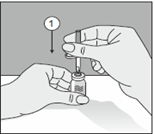
1. Nach Entfernung einer der beiden Schutzkappen den ungeschützten Einstichdorn senkrecht durch den Gummistopfen der Durchstechflasche stechen. |
|
|
|
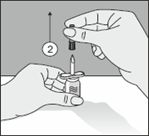
2. Die Schutzkappe vom zweiten Einstichdorn abnehmen. |
|
|
|
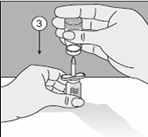
3. Die Durchstechflasche mit dem Kybernin-Pulver kopfüber auf diesen Einstichdorn drücken. |
|
|
|
4. Die Durchstechflasche um 180° drehen. |
|
|
|
5. Die Durchstechflasche mit dem Kybernin-Pulver auf eine ebene Fläche stellen. Das Lösungsmittel fliesst jetzt in die Durchstechflasche mit dem Kybernin-Pulver. |
|
|
|
6. Die Transofix®-Transfervorrichtung zusammen mit der Lösungsmittel-Durchstechflasche aus der Durchstechflasche mit dem Produkt entfernen. Das Kybernin-Pulver löst sich auf. Das rekonstituierte Kybernin kann in eine Spritze aufgezogen und verabreicht werden. |
Nicht verwendetes Arzneimittel und Abfallmaterial muss vorschriftsgemäss entsorgt werden.
Zulassungsnummer
46928 (Swissmedic)
Packungen
Kybernin P 500 [B]
1 Durchstechflasche mit Pulver zu 500 I.E
1 Durchstechflasche mit 10 ml Wasser für Injektionszwecke (Lösungsmittel)
1 Überleitungsgerät
Kybernin P 1000 [B]
1 Durchstechflasche mit Pulver zu 1000 I.E.
1 Durchstechflasche mit 20 ml Wasser für Injektionszwecke (Lösungsmittel)
1 Überleitungsgerät
Zulassungsinhaberin
CSL Behring AG, Bern
Stand der Information
Februar 2025