ZusammensetzungWirkstoffe
Toxinum botulinicum A.
Hilfsstoffe
Albuminum humanum, Saccharum.
Indikationen/AnwendungsmöglichkeitenBocouture wird angewendet zur vorübergehenden Verbesserung des Aussehens bei mittelstarken bis starken
·vertikalen Falten zwischen den Augenbrauen beim Stirnrunzeln (Glabellafalten) und/oder
·seitlichen Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse)
bei Erwachsenen im Alter unter 65 Jahren, wenn das Ausmass dieser Falten eine erhebliche psychologische Belastung für den Patienten darstellt.
Dosierung/AnwendungAllgemeine Hinweise
Bocouture darf nur von Ärzten mit entsprechender Fachkenntnis in der Behandlung mit Botulinumtoxin Typ A angewendet werden.
Die nachfolgend empfohlenen Dosierungen sind aufgrund der unterschiedlichen LD50-Testmethoden spezifisch für Bocouture und nicht auf andere Botulinumtoxin Typ A-Präparate übertragbar.
Rekonstituiertes Bocouture ist zur intramuskulären Injektion bestimmt. Zu Hinweisen zur Rekonstitution und Verdünnung der Durchstechflaschen, siehe «Sonstige Hinweise, Hinweise für die Handhabung».
Rekonstituiertes Bocouture wird unter Verwendung einer dünnen sterilen Nadel (z.B. 30-33 G/0,20-0,30 mm Durchmesser/13 mm Länge) injiziert.
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Übliche Dosierung
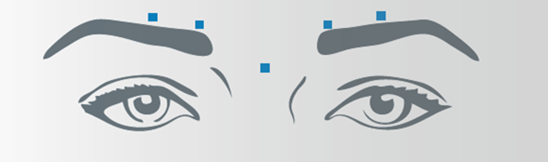
Vertikale Falten zwischen den Augenbrauen (Glabellafalten)
Nach der Rekonstitution von Bocouture wird das empfohlene Injektionsvolumen von 0,1 ml (4 Einheiten) in jede der 5 Injektionsstellen verabreicht: zwei Injektionen in jeden M. corrugator und eine Injektion in den M. procerus. Dies entspricht einer Standarddosis von 20 Einheiten. Aufgrund der individuellen Erfordernisse der Patienten kann die Dosis durch den Arzt auf bis zu 30 Einheiten erhöht werden.
Eine Verbesserung der vertikalen Falten zwischen den Augenbrauen (Glabellafalten) tritt im Allgemeinen innerhalb von 2 bis 3 Tagen ein, wobei die maximale Wirkung an Tag 30 beobachtet wurde. Die Wirkung hält bis zu 4 Monate nach der Injektion an.
Vor und während der Injektion sollte mit Daumen und Zeigefinger fest unter den Augenhöhlenrand gedrückt werden, um eine Diffusion der Lösung in diesem Gebiet zu verhindern. Die Nadel sollte während der Injektion superior und medial ausgerichtet bleiben. Um das Risiko einer Blepharoptosis zu reduzieren, müssen Injektionen in der Nähe des M. levator palpebrae superioris und in den kraniellen Anteil des M. orbicularis oculi vermieden werden. Injektionen in den M. corrugator sollten im medialen Anteil des Muskels sowie im zentralen Anteil des Muskelbauches mindestens 1 cm über dem knöchernen Rand der Augenhöhle erfolgen.
Seitliche Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse)
Nach der Rekonstitution von Bocouture wird das empfohlene Injektionsvolumen von 0,1 ml (4 Einheiten) beidseitig in jeweils 3 Injektionsstellen verabreicht. Eine Injektion wird dabei ca. 1 cm lateral des knöchernen Augenhöhlenrandes platziert. Die anderen zwei Injektionen werden ca. 1 cm oberhalb und unterhalb der ersten Injektionsstelle verabreicht.

Die empfohlene Standarddosis beträgt 12 Einheiten pro Seite und Behandlung (Gesamtdosis: 24 Einheiten).
Eine Verbesserung der seitlichen Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse) - tritt im Allgemeinen innerhalb der ersten 6 Tage ein, wobei die maximale Wirkung an Tag 30 beobachtet wurde. Die Wirkung hält bis zu 4 Monate nach der Injektion an.
Für die Behandlung von seitlichen Kanthalfalten, sichtbar bei maximalem Lächeln, die über zwei Injektionszyklen im Abstand von 4 Monaten hinausgeht, liegen derzeit keine Wirksamkeits- und Sicherheitsdaten vor.
Die Injektion sollte intramuskulär in den M. orbicularis oculi erfolgen, direkt unter der Dermis, um eine Diffusion von Bocouture zu vermeiden. Injektionen in der Nähe des M. zygomaticus major sollten unterlassen werden, um eine Ptosis der Lippe zu vermeiden.
Alle Indikationen
Die Behandlungsintervalle sollten nicht kürzer als 3 Monate sein.
Sollte nach durchgeführter Erstapplikation auch nach einem Monat kein therapeutischer Effekt eingetreten sein, sollten folgende Massnahmen durchgeführt werden:
·Analyse der Gründe für das Therapieversagen, z.B. unzureichende Dosierung, schlechte Injektionstechnik, mögliche Bildung Neurotoxin-neutralisierender Antikörper
·Überprüfung der Behandlung mit Botulinum Neurotoxin Typ A als angemessene Therapieform
·Sofern im Rahmen der Initialbehandlung keine unerwünschten Wirkungen aufgetreten sind, kann eine Wiederholungsbehandlung unter folgenden Voraussetzungen vorgenommen werden:
1.Dosisanpassung unter Berücksichtigung der Analyse des vorausgegangenen Therapieversagens,
2.Einhaltung des Mindestintervalls zwischen der Initial- und der Wiederholungsbehandlung.
Bei Therapieversagen sind alternative Behandlungsmethoden in Betracht zu ziehen.
Spezielle Dosierungsanweisungen
Ältere Patienten
Es liegen nur begrenzte klinische Daten aus Phase-III-Studien mit Bocouture bei Patienten vor, die über 65 Jahre alt sind. Die Anwendung von Bocouture bei Patienten über 65 Jahren kann daher, bis weitere Daten vorliegen, nicht empfohlen werden.
Kinder und Jugendliche
Bocouture wurde nicht in pädiatrischen Studien untersucht und kann daher, bis weitere Daten vorliegen, nicht für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren empfohlen werden.
Kontraindikationen·Überempfindlichkeit gegenüber dem Wirkstoff Botulinum Neurotoxin Typ A (150 kD) oder einem der Inhaltsstoffe.
·Generalisierte Störungen der Muskelaktivität (z.B. Myasthenia gravis, Lambert-Eaton-Syndrom).
·Infektion oder Entzündung an der vorgesehenen Injektionsstelle.
Warnhinweise und VorsichtsmassnahmenAllgemein
Bevor der Arzt Bocouture verabreicht, muss er sich mit der Anatomie des Patienten sowie irgendwelcher aufgrund chirurgischer Eingriffe entstandenen anatomischen Veränderungen vertraut machen.
Wenn vorgeschlagene Injektionsstellen mit einem Stift markiert werden, darf das Produkt nicht durch die markierten Stellen injiziert werden, da sonst ein permanenter Tätowierungseffekt auftreten könnte.
Es ist sicherzustellen, dass Bocouture nicht in ein Blutgefäss injiziert wird.
Bocouture sollte nur mit Vorsicht angewendet werden:
·beim Vorhandensein von Gerinnungsstörungen aller Arten
·bei Patienten, die mit Antikoagulantien oder anderen Wirkstoffen mit antikoagulierender Wirkung behandelt werden
·bei Patienten mit amyotropher Lateralsklerose
·bei Patienten mit anderen Erkrankungen, die zu peripheren neuromuskulären Dysfunktionen führen
·bei ausgeprägter Schwäche oder Atrophie des zu injizierenden Muskels.
Lokale und entfernte Ausbreitung der Toxinwirkung
Unerwünschte Wirkungen können insbesondere auch durch falsch platzierte Injektionen von Botulinum Neurotoxin Typ A hervorgerufen werden, die vorübergehend auch benachbarte Muskelgruppen lähmen.
Es wurden Nebenwirkungen berichtet, die möglicherweise mit der Ausbreitung des Botulinumtoxins Typ A an vom Applikationsort entfernte Stellen in Zusammenhang stehen (siehe «Unerwünschte Wirkungen»).
Bereits bestehende neuromuskuläre Erkrankungen
Bei mit therapeutischen Dosen behandelten Patienten kann eine übermässige Muskelschwäche auftreten. Bei Patienten mit neurologischen Grunderkrankungen wie Schluckstörungen besteht ein erhöhtes Risiko für diese Nebenwirkungen. Das Arzneimittel sollte bei diesen Patienten nur unter Aufsicht eines Spezialisten angewendet werden und die Anwendung darf nur dann erfolgen, wenn der Nutzen der Behandlung das Risiko überwiegt.
Patienten bzw. Betreuungspersonen sind darauf hinzuweisen, dass der ärztliche Notdienst sofort zu verständigen ist, wenn Schluck-, Sprech- oder Atemstörungen auftreten.
Die Injektion von Bocouture wird bei Patienten mit einer Vorgeschichte von Dysphagie und Aspiration nicht empfohlen.
Überempfindlichkeitsreaktionen
Überempfindlichkeitsreaktionen wurden nach der Gabe von Botulinum Neurotoxin Typ A berichtet. Bei schwerwiegenden Überempfindlichkeitsreaktionen (z.B. Anaphylaxie) und/oder Überempfindlichkeitsreaktionen vom Soforttyp, sollte eine angemessene medizinische Therapie erfolgen.
Antikörperbildung
Zu häufige Injektionen mit Botulinum Neurotoxin Typ A können das Risiko einer Bildung von Antikörpern erhöhen, so dass es auch bei der Behandlung von anderen Indikationen zu einem Therapieversagen kommen kann.
InteraktionenEs wurden keine Interaktionsstudien durchgeführt.
Theoretisch kann die Wirkung von Botulinum Neurotoxin Typ A durch Aminoglykosidantibiotika oder andere Arzneimittel, die auf die neuromuskuläre Reizleitung wirken, z.B. Muskelrelaxantien des Tubocurarin-Typs, potenziert werden. Die gleichzeitige Anwendung von Bocouture mit diesen Substanzen erfordert deshalb besondere Vorsicht.
Periphere Muskelrelaxantien sollten mit Vorsicht eingesetzt werden, gegebenenfalls sollte die Initialdosis des Relaxans verringert oder eine mittellangwirksame Substanz, wie Vercuronium oder Atracurium, anstelle von einer langwirksamen Substanz eingesetzt werden.
4-Aminochinoline können die Wirkung von Bocouture abschwächen.
Schwangerschaft, StillzeitSchwangerschaft
Es gibt keine hinreichenden Daten zur Anwendung bei Schwangeren.
In tierexperimentellen Studien fand sich eine Reproduktionstoxizität (nähere Angaben unter dem Kapitel «Präklinische Daten»).
Das potentielle Risiko für den Menschen ist nicht bekannt.
Bocouture darf daher während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich und der potentielle Nutzen rechtfertigt das Risiko.
Stillzeit
Es ist nicht bekannt, ob Botulinum Neurotoxin Typ A in die Muttermilch übergeht. Daher sollte Bocouture in der Stillzeit nicht angewendet werden.
Fertilität
Daten aus klinischen Studien mit Botulinum Neurotoxin Typ A liegen nicht vor. In tierexperimentellen Studien wurden keine nachteiligen Wirkungen auf die männliche oder weibliche Fertilität festgestellt (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine entsprechenden Studien durchgeführt. Patienten sollten darauf hingewiesen werden, dass bei Symptomen wie Müdigkeit, Schwindel, Sehstörungen, Blepharoptosis, Verlust der Muskelkraft oder Muskelschwäche die Verkehrstüchtigkeit und die Fähigkeit zur Durchführung von potentiell gefährlichen Tätigkeiten eingeschränkt sein könnten und solche Tätigkeiten daher vermieden werden sollten.
Unerwünschte WirkungenAllgemein
Gewöhnlich treten Nebenwirkungen innerhalb der ersten Woche nach der Injektion auf und sind vorübergehend. Nebenwirkungen können mit dem Wirkstoff, dem Injektionsverfahren oder mit beidem zusammenhängen.
Wie bei jeder Injektion können im Zusammenhang mit der Injektion lokale Schmerzen, Entzündungen, Parästhesien, Hypoästhesien, Druckempfindlichkeit, Schwellungen/Ödeme, Erytheme, Juckreiz, lokale Infektionen, Hämatome, Blutungen und/oder Blutergüsse auftreten.
Durch den Injektionsprozess verursachter Schmerz und/oder Angst vor der Injektion können zu vasovagalen Reaktionen führen wie z.B. vorübergehende symptomatische Hypotonie, Übelkeit, Tinnitus und Synkopen.
Lokale Muskelschwäche stellt eine erwartete pharmakologische Wirkung von Botulinumtoxin Typ A dar.
Nach der Behandlung von neurologischen Erkrankungen mit Botulinumtoxin wurden in sehr seltenen Fällen unerwünschte Wirkungen im Zusammenhang mit der Ausbreitung des Toxins an vom Injektionsort entfernten Stellen berichtet, bei denen die Symptome der Wirkung von Botulinumtoxin Typ A gleichen (übermässige Muskelschwäche, Dysphagie, Aspirationspneumonie mit bisweilen tödlichem Ausgang). Derartige Nebenwirkungen sind auch bei der Anwendung von Bocouture nicht gänzlich auszuschliessen.
Selten wurden unter der Anwendung von Botulinumtoxin-Präparaten schwerwiegende Überempfindlichkeitsreaktionen und/oder Überempfindlichkeitsreaktionen vom Soforttyp berichtet, einschliesslich Anaphylaxie, Serumkrankheit, Dyspnoe, Weichteilödem und Urtikaria. Einige dieser Reaktionen wurden nach alleiniger Anwendung von herkömmlichen Präparaten mit dem Botulinum Neurotoxin Typ A-Komplex oder in Kombination mit anderen Wirkstoffen berichtet, die dafür bekannt sind, ähnliche Reaktionen auszulösen.
Unerwünschte Wirkungen nach Markteinführung
Die folgenden Nebenwirkungen wurden mit unbekannter Häufigkeit bei der Verwendung von Bocouture seit Markteintritt unabhängig von der Indikation berichtet:
|
Systemorganklasse
|
Nebenwirkung
| |
Erkrankungen des Immunsystems
|
Überempfindlichkeitsreaktionen wie Schwellungen, Ödeme (auch entfernt von der Injektionsstelle), Erytheme, Pruritus, Hautausschlag (lokal oder generalisiert) und Atemnot
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Muskelatrophie
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Grippeähnliche Symptome
|
Unerwünschte Wirkungen aus klinischen Studien
Die Häufigkeiten sind folgendermassen definiert: sehr häufig (≥1/10); häufig (≥1/100, <1/10); gelegentlich (≥1/1000, <1/100); selten (≥1/10'000, <1/1000); sehr selten (<1/10'000), Einzelfälle basierend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht angegeben werden.
Vertikale Falten zwischen den Augenbrauen (Glabellafalten)
|
Systemorganklasse
|
Nebenwirkung
|
Häufigkeit
| |
Infektionen und parasitäre Erkrankungen
|
Nasopharyngitis
|
Selten
| |
Erkrankungen des Nervensystems
|
Kopfschmerzen
|
Häufig
| |
Augenerkrankungen
|
Lidödem, Verschwommensehen, Blepharoptosis
|
Gelegentlich
| |
Gefäßerkrankungen
|
Bluterguss
|
Gelegentlich
| |
Erkrankungen der Haut und des Unterhautzellgewebes
|
Pruritus, Ptosis der Augenbraue
|
Gelegentlich
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Mephisto-Zeichen (seitliche Erhöhung der Augenbrauen)
|
Häufig
| |
Gesichtsasymmetrie (Augenbrauenasymmetrie) Muskelkrämpfe (oberhalb der Augenbraue)
|
Gelegentlich
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Bluterguss an der Injektionsstelle, Schmerzen an der Injektionsstelle, Grippeähnliche Erkrankung, Druckschmerz, Müdigkeit, Schweregefühl von Augenlid/Augenbraue
|
Gelegentlich
|
Seitliche Kanthalfalten (Krähenfüsse) sichtbar bei maximalem Lächeln
|
Systemorganklasse
|
Nebenwirkung
|
Häufigkeit
| |
Augenerkrankungen
|
Lidödem, trockenes Auge
|
Häufig
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Bluterguss an der Injektionsstelle
|
Häufig
|
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungErhöhte Dosen von Botulinum Neurotoxin Typ A können entfernt von der Injektionsstelle ausgeprägte neuromuskuläre Lähmungen erzeugen. Mögliche Symptome einer Überdosierung sind allgemeine Muskelschwäche, Ptosis, Diplopie, Atem-, und Sprechstörungen, Paralyse der Atemmuskulatur oder Schluckstörungen. In deren Folge kann es auch zu einer Aspirationspneumonie kommen.
Die Symptome treten üblicherweise nicht unmittelbar nach der Injektion auf.
Im Falle einer Überdosierung muss der Patient daher mehrere Tage (bis zu mehreren Wochen) lang medizinisch auf Symptome wie übermässige Muskelschwäche und Muskellähmung überwacht werden. Symptomatische Behandlungen können notwendig sein, ggf. einschliesslich Hospitalisierung. Wenn es zur Paralyse der Atemmuskulatur kommt, können Intubation und assistierte Beatmung erforderlich sein.
Eigenschaften/WirkungenATC-Code
M03AX01
Wirkungsmechanismus
Botulinum Neurotoxin Typ A blockiert die cholinerge Signalübertragung an den neuromuskulären Verbindungen, indem es die Freisetzung von Acetylcholin hemmt. Die Nervenendigungen der neuromuskulären Verbindungen reagieren nicht länger auf Nervenimpulse, und die Sekretion des Neurotransmitters an den motorischen Endplatten wird verhindert (chemische Denervation). Die vollständige Wiederherstellung der Endplattenfunktion/Impulsübertragung nach einer Injektion erfolgt normalerweise innerhalb von 3-4 Monaten durch neugebildete Nervenendigungen und deren Wiederverbindung mit den motorischen Endplatten.
Das Botulinum Neurotoxin Typ A blockiert durch Spaltung von SNAP-25 («synaptosomal-associated protein of 25 kDa») die periphere Acetylcholin-Freisetzung an den präsynaptischen Nervenendigungen. SNAP-25 ist ein Protein, das wesentlich für die erfolgreiche Bindung und Freisetzung von Acetylcholin aus den Vesikeln ist, die sich in den Nervenendigungen befinden.
Nach der Injektion erfolgt initial eine hoch-affine Bindung des Toxins an spezifische zelluläre Oberflächenrezeptoren. Durch einen Rezeptor-vermittelten Endozytose Prozess wird das Toxin durch die Plasmamembran transportiert und anschliessend die leichte Kette des Toxins im Cytosol freigesetzt. Diese spaltet SNAP-25 und hemmt damit die Acetylcholin-Freisetzung aus den Neurotransmittervesikeln.
Pharmakodynamik
Siehe Rubrik «Wirkungsmechanismus».
Klinische Wirksamkeit
Vertikale Falten zwischen den Augenbrauen (Glabellafalten)
Zwei identische randomisierte, doppelblinde, multizentrische, Placebo-kontrollierte Phase-III-Studien wurden durchgeführt, um Bocouture für den Einsatz in der temporären Verbesserung der mittelschweren bis schweren Glabellafalten zu bewerten. Die Studien umfassten insgesamt 547 Patienten, von denen 193 Patienten >50 Jahre alt waren. 55 Probanden waren männlich. Es wurde der Behandlungserfolg als 2-Punkt-Verbesserung bei maximalem Stirnrunzeln an Tag 30 auf einer 4-Punkte-Skala (Facial Wrinkle Scale, FWS, 0 = keine, 1 = leicht, 2 = mässig, 3 = schwer) im Vergleich zum Ausgangswert definiert sowohl für den Prüfarzt als auch für den Patienten (zusammengesetzter Endpunkt). An Tag 30 war die Ansprechrate unter 20 Einheiten Bocouture hier im Vergleich zu Placebo statistisch signifikant höher. Die Erfolgsrate betrug 54.1% in der Bocouture Gruppe, wohingegen kein Patient in der Placebo Gruppe eine Verbesserung zeigte. Sekundäre Endpunkte stützen die Ergebnisse des primären Endpunkts.
In einer dritten Studie wurden 169 Patienten (≥18 Jahre) mit Bocouture in der Placebo-kontrollierten Phase der zulassungsrelevanten, doppelblinden Phase-III-Studie und 236 Patienten in der nicht-kontrollierten Phase dieser Studie behandelt. Die Studie zeigte im Vergleich zu Placebo eine statistisch signifikante und klinisch relevante Wirksamkeit von 20 Einheiten Bocouture. Dies wurde durch die Anzahl der Patienten belegt, die bei maximalem Stirnrunzeln am Tag 30 bei Beurteilung entsprechend der Skala für Gesichtsfalten durch den Prüfarzt bzw. durch den Patienten auf die Behandlung ansprachen. Die Ansprechrate unter 20 Einheiten Bocouture war hier im Vergleich zu Placebo signifikant höher.
Subgruppenanalysen zeigten im Vergleich zu jüngeren Patienten eine geringere Wirksamkeit bei Patienten, die 50 Jahre oder älter waren. Dabei waren 113 Patienten 50 Jahre oder jünger und 56 Patienten über 50 Jahre alt. Die Wirksamkeit bei Männern war geringer im Vergleich zu Frauen. Dabei waren 33 Patienten Männer und 136 Patienten Frauen.
In einer Open-Label-Studie zur Beurteilung der langfristigen Sicherheit von Bocouture wurden Patienten, die zuvor an Placebo-kontrollierten Studien zur Behandlung der Glabellafalten teilgenommen hatten, bis zu 8 Mal wiederholt behandelt. Eine Gesamtzahl von 694, 322, 309, 291, 261, 191 und 48 Probanden wurden in den Behandlungszyklen 2, 3, 4, 5, 6, 7 bzw. 8 behandelt. Es war kein Anstieg der Häufigkeit von unerwünschten Ereignissen nach wiederholter Gabe zu sehen. Keine neuen unerwarteten Ereignisse traten auf und das Sicherheitsprofil stimmte mit dem, welches in anderen Studien beobachtet wurde, überein.
Nichtunterlegenheit der Wirksamkeit von Bocouture zu einem Vergleichsprodukt, welches den Botulinumtoxin Typ A Komplex (Onabotulinumtoxin A 900kD) enthält, wurde in zwei prospektiven, multizentrischen, randomisierten, doppelblinden Vergleichsstudien (n=631) nach Einmalgabe (20 bzw. 24 Einheiten) gezeigt. Die Studienergebnisse weisen auch darauf hin, dass Bocouture und das Vergleichspräparat ein vergleichbares Wirksamkeits- und Sicherheitsprofil bei Patienten mit mittelstarken bis starken Glabellafalten haben, wenn sie in einem Umrechnungsverhältnis von 1:1 angewendet werden.
Seitliche Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse)
In einer klinischen Phase-III-Studie wurden 111 Patienten mit mittelstarken bis starken seitlichen Kanthalfalten sichtbar bei maximalem Lächeln (Krähenfüsse), mit 12 Einheiten Bocouture oder Placebo pro Seite (rechter/linker Augenbereich) während eines Injektionszyklus behandelt. Dabei wurde ein 3-Punkt und 4-Punkt Injektionsschema verglichen. Der Behandlungserfolg wurde als Verbesserung um mindestens 1 Punkt auf einer 4-Punkte Skala definiert. Bei maximalem Lächeln wurde die Bewertung für beide Augenbereiche durch ein unabhängiges Expertenkomitee anhand von standardisierten Digitalfotos vorgenommen und mit der Ausgangssituation verglichen. Das 3-Punkte sowie das 4-Punkte Injektionsschema zeigten beide Überlegenheit im Vergleich zur Placebobehandlung. Unter Anwendung des 3-Punkte Injektionsschemas war die Erfolgsrate 69,9% in der Bocouture Gruppe versus 21,4% in der Placebogruppe, während es unter Verwendung des 4-Punkte Injektionsverfahrens 68,7% versus 14,3% waren. Eine Verschlechterung wurde bei keinem der mit Bocouture behandelten Patienten beobachtet. Bestätigt wurde dies durch die hohe Anzahl an Patienten, die an Tag 30 ein erfolgreiches Ergebnis basierend auf einer Bewertung durch den Experten und den Patienten selbst auf der 4-Punkte Skala aufwiesen. Patienten, die 12 Einheiten Bocouture pro Augenbereich erhielten, zeigten im Vergleich zur Placebobehandlung einen signifikant höheren Anteil mit erfolgreichem Ergebnis.
Bei der kombinierten Behandlung von Glabellafalten und seitlichen Kanthalfalten mit Bocouture waren Wirksamkeit und Sicherheit ähnlich zur separaten Behandlung dieser Regionen.
PharmakokinetikAbsorption
Klassische Kinetik- und Verteilungsstudien können mit Botulinum Neurotoxin Typ A nicht durchgeführt werden, da der Wirkstoff in äusserst geringen Dosen (Picogramm pro Injektion) appliziert wird und schnell und irreversibel an die cholinergen Nervenendigungen bindet.
Natives Botulinumtoxin vom Serotyp A stellt einen hochmolekularen Komplex dar (Botulinumtoxin Komplex Typ A), der zusätzlich zu dem Neurotoxin (150 kD) auch andere nicht-toxische Proteine wie Hämagglutinine und Non-Hämagglutinine enthält. Im Gegensatz zu Botulinumtoxin Typ A-Komplex enthält Bocouture das reine Neurotoxin und ist frei von Komplexproteinen.
Für Botulinum Neurotoxin Typ A wurde gezeigt, dass es nach intramuskulärer Injektion einem retrograden axonalen Transport unterliegt. Eine retrograde transsynaptische Passage des aktiven Botulinum Neurotoxins Typ A in das zentrale Nervensystem wurde bei therapeutisch relevanten Dosen dagegen nicht gefunden.
Rezeptor-gebundenes Botulinum Neurotoxin Typ A wird durch Endozytose in die Nervenendigung aufgenommen, bevor es sein Ziel (SNAP-25) erreicht. Es wird schliesslich intrazellulär abgebaut. Frei zirkulierende Botulinum Neurotoxin Typ A-Moleküle, die nicht an präsynaptische Rezeptoren auf den cholinergen Nervenendigungen gebunden haben, werden durch Phagozytose oder Pinocytose aufgenommen und wie andere frei zirkulierende Proteine abgebaut.
Distribution
Siehe Rubrik «Absorption»
Metabolismus
Siehe Rubrik «Absorption»
Elimination
Siehe Rubrik «Absorption»
Präklinische DatenSicherheitspharmakologie
Präklinische, sicherheitspharmakologische Studien zur Untersuchung der Einflüsse von Bocouture auf das kardiovaskuläre und intestinale System zeigten kein erhöhtes Risiko für den Menschen.
Mutagenität und Karzinogenität
Es wurden keine Studien zum genotoxischen oder kanzerogenen Potential von Bocouture durchgeführt.
Reproduktionstoxizität
Reproduktionstoxikologische Studien mit Bocouture zeigten weder eine Beeinträchtigung der männlichen oder weiblichen Fertilität in Kaninchen, noch eine direkte Beeinflussung der embryofötalen oder der prä- und postnatalen Entwicklung in Ratten und/oder Kaninchen. Allerdings führte die Gabe von Bocouture in unterschiedlichen Intervallen (täglich oder weniger häufig) in Embryotoxizitätsstudien in Dosen, welche eine maternale Körpergewichtsreduktion verursachten, zu einer erhöhten Abortrate bei Kaninchen und zu einem geringfügig verringerten fötalen Körpergewicht bei Ratten.
Weitere Daten (Lokale Toxizität, Phototoxizität, Immunotoxizität)
Die Befunde in Studien zur systemischen Toxizität von Bocouture nach wiederholter Gabe waren überwiegend eine Folge der pharmakodynamischen Eigenschaften, d.h. Erschlaffung, Lähmung und Atrophie des injizierten Muskels.
Es wurden keine Hinweise auf lokale Unverträglichkeit beobachtet.
Sonstige HinweiseInkompatibilitäten
Das Arzneimittel darf nur mit den unter Hinweise für die Handhabung aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die rekonstituierte Injektionslösung ist nicht konserviert. Chemische und physikalische in-use Stabilität wurde für 24 Stunden bei 2-8 °C gezeigt. Aus mikrobiologischen Gründen sollte die gebrauchsfertige Zubereitung unmittelbar nach Verdünnung/Rekonstitution verwendet werden. Falls dies nicht möglich ist, liegen Aufbrauchsfristen und Lagerbedingungen in der Verantwortung des Anwenders und sollten normalerweise nicht länger als 24 Std. bei 2-8 °C betragen, ausser wenn die Verdünnung/Rekonstitution unter kontrollierten und validierten aseptischen Bedingungen erfolgte.
Besondere Lagerungshinweise
Das Arzneimittel bei Raumtemperatur (15-25 °C) oder im Kühlschrank (2-8 °C) lagern.
In der Originalverpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Bocouture wird vor dem Gebrauch mit steriler, physiologischer Kochsalzlösung rekonstituiert. Die Rekonstitution und die Verdünnung sollten unter Einhaltung der Standardbedingungen erfolgen, insbesondere im Hinblick auf die aseptische Handhabung.
Das Rekonstituieren des Flascheninhalts und das Aufziehen der Spritze sollten über plastikbeschichteten Papiertüchern erfolgen, um eventuelle Spritzer aufzufangen.
Die folgende Tabelle gibt die Verdünnung für Bocouture 50 Einheiten und 100 Einheiten an:
|
Erhaltene Dosis
(in Einheiten pro 0,1 ml)
|
Zugegebene Menge Lösungsmittel
(Natriumchlorid 9 mg/ml (0,9%) Injektionslösung)
| |
Durchstechflasche mit 50 Einheiten
|
Durchstechflasche mit 100 Einheiten
| |
4 Einheiten
|
1,25 ml
|
2,5 ml
|
Eine entsprechende Menge 0.9%ige (9mg/ml) Natriumchlorid-Lösung (siehe Verdünnungstabelle) wird mit einer Spritze aufgezogen. Es wird empfohlen eine 20-27 G Kurzschliffkanüle für die Rekonstitution zu verwenden. Der freigelegte Teil des Gummistopfens der Durchstechflasche wird vor dem Einstechen der Nadel mit Alkohol (70%) gereinigt. Nach senkrechtem Einstechen der Nadel durch den Gummistopfen der Durchstechflasche sollte die Rekonstitution vorsichtig erfolgen, um eine Blasenbildung zu vermeiden. Die Durchstechflasche ist zu verwerfen, wenn in der Flasche kein Unterdruck vorhanden ist, der das Lösungsmittel aus der Spritze ansaugt.
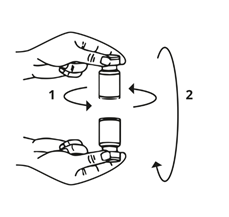
Die Spritze wird von der Flasche entfernt und Bocouture mit dem Lösungsmittel vermischt, indem die Flasche vorsichtig im Kreis gedreht wird und gekippt wird (von rechts nach links und über Kopf) – nicht kräftig schütteln. Falls nötig, sollte die Kanüle, mit welcher die Rekonstitution durchgeführt wurde, in der Flasche verbleiben.
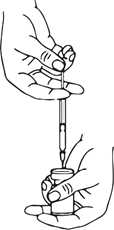
Die benötigte Menge an Lösung sollte mit einer neuen sterilen Injektionsspritze aufgezogen werden.
Die rekonstituierte Bocouture-Lösung ist klar, farblos und frei von Partikeln.
Bocouture darf nicht verwendet werden, wenn die rekonstituierte Lösung, die entsprechend der oben genannten Anweisungen hergestellt wurde, eine Trübung zeigt oder Ausflockungen oder Partikel enthält.
Injektionslösung, die länger als 24 Stunden aufbewahrt wurde, sollte verworfen werden.
VORGEHENSWEISE ZUR SICHEREN ENTSORGUNG DER DURCHSTECHFLASCHEN, SPRITZEN UND VERWENDETEN MATERIALIEN
Unbenutzte Durchstechflaschen oder Restlösung in Durchstechflaschen und/oder Spritzen sollten autoklaviert werden. Alternativ kann das restliche Bocouture durch Zusatz einer der folgenden Lösungsmittel inaktiviert werden: 70%iges Ethanol, 50%iges Isopropanol, verdünnte Natriumhydroxid-Lösung (0,1 N NaOH) oder verdünnte Natriumhypochlorit-Lösung (mindestens 0,1%ige NaOCl).
Verwendete Durchstechflaschen, Spritzen und Materialien sollten nicht entleert, sondern in geeigneten Behältern und entsprechend den lokalen Vorschriften entsorgt werden.
1.Jegliches verschüttetes Arzneimittel muss aufgewischt werden: entweder - im Fall des Pulvers - mit einem saugfähigen Material, das mit einem der oben genannten Lösungsmittel getränkt wurde oder - im Fall der rekonstituierten Lösung - mit einem trockenen saugfähigen Material.
2.Kontaminierte Oberflächen müssen mit einem saugfähigen Material gereinigt werden, das mit einer der oben genannten Lösung getränkt wurde. Anschliessend trocknen lassen.
3.Wenn eine Durchstechflasche zerbricht, wie oben beschrieben vorgehen, Glassplitter vorsichtig aufsammeln und das Arzneimittel aufwischen, dabei Schnittverletzungen der Haut vermeiden.
4.Wenn das Arzneimittel in Kontakt mit der Haut gelangt, den betroffenen Bezirk mit reichlich Wasser abspülen.
5.Wenn das Arzneimittel in Kontakt mit einer Wunde, Schnittverletzung oder nicht-intakter Haut gelangt, gründlich mit reichlich Wasser spülen und die entsprechenden medizinischen Massnahmen entsprechend der injizierten Dosis ergreifen.
6.Wenn das Arzneimittel in Kontakt mit den Augen gelangt, gründlich mit reichlich Wasser oder einer Augenspüllösung ausspülen.
Zulassungsnummer63222 (Swissmedic)
PackungenBocouture Lyophilisat:
Packungen zu 1 Durchstechflasche à 50 Einheiten [A]
Packungen zu 1 Durchstechflasche à 100 Einheiten [A]
ZulassungsinhaberinMerz Aesthetics (Schweiz) AG, 4123 Allschwil
Stand der InformationJuni 2020
|





