ZusammensetzungWirkstoffe
Empagliflozin.
Hilfsstoffe
Jardiance 10 mg:
·Tablettenkern: Lactose-Monohydrat 162,5 mg, mikrokristalline Cellulose, Hydroxypropylcellulose, Croscarmellose-Natrium (entspricht 0,01 mg Natrium), hochdisperses Siliciumdioxid, Magnesiumstearat
·Tablettenüberzug: Hypromellose 2910, Titandioxid (E171), Talkum, Macrogol 400, Eisenoxid gelb (E172)
Jardiance 25 mg:
·Tablettenkern: Lactose-Monohydrat 113 mg, mikrokristalline Cellulose, Hydroxypropylcellulose, Croscarmellose-Natrium (entspricht 0,008 mg Natrium), hochdisperses Siliciumdioxid, Magnesiumstearat
·Tablettenüberzug: Hypromellose 2910, Titandioxid (E171), Talkum, Macrogol 400, Eisenoxid gelb (E172)
Indikationen/AnwendungsmöglichkeitenJardiance ist zur Behandlung des Typ 2 Diabetes mellitus bei Erwachsenen sowie Kindern und Jugendlichen ab einem Alter von 10 Jahren indiziert, zusätzlich zu diätetischen Massnahmen und körperlicher Aktivität, wenn durch diese Massnahmen alleine keine ausreichende Kontrolle des Blutzuckers erreicht werden kann:
·Als Monotherapie bei Patienten, bei denen Metformin aufgrund von Kontraindikationen oder Unverträglichkeiten nicht eingesetzt werden kann.
·Als Add-on Kombinationstherapie mit anderen blutzuckersenkenden Arzneimitteln.
Für Studienergebnisse zu den Kombinationsbehandlungen siehe Abschnitt «Klinische Wirksamkeit».
Jardiance ist indiziert zur Prävention kardiovaskulärer Ereignisse bei erwachsenen Patienten mit Typ 2 Diabetes mellitus und bereits manifester kardiovaskulärer Erkrankung (siehe Abschnitt «Klinische Wirksamkeit»).
Jardiance ist indiziert zur Behandlung der chronischen symptomatischen linksventrikulären Herzinsuffizienz in Kombination mit anderen medikamentösen Therapien der Herzinsuffizienz bei erwachsenen Patienten (siehe Abschnitt «Klinische Wirksamkeit»).
Jardiance ist indiziert zur Senkung des Risikos der Progression einer chronischen Nierenerkrankung bei adulten Patienten mit chronischer Nierenerkrankung (siehe Abschnitte «Dosierung/Anwendung» und «Klinische Wirksamkeit»).
Dosierung/AnwendungEmpfohlene Dosierungen von Jardiance bei Erwachsenen sowie bei Kindern und Jugendlichen ab 10 Jahren:
|
Population
|
Indikation
|
Empfohlene Dosierung
| |
Erwachsene
|
Herzinsuffizienz
|
·Die empfohlene Dosis beträgt 10 mg einmal täglich
| |
Chronische Nierenerkrankung
| |
Typ 2 Diabetes mellitus
|
·Die empfohlene Dosis beträgt 10 mg einmal täglich.
·Bei Patienten, die Empagliflozin 10 mg einmal täglich vertragen und eine bessere Blutzuckerkontrolle benötigen, kann die Dosis auf 25 mg einmal täglich erhöht werden*
| |
Kinder und Jugendliche ab 10 Jahren
|
Typ 2 Diabetes mellitus
|
·Die empfohlene Dosis beträgt 10 mg einmal täglich.
·Bei Patienten, die Empagliflozin 10 mg einmal täglich vertragen und eine bessere Blutzuckerkontrolle benötigen, kann die Dosis auf 25 mg einmal täglich erhöht werden
|
* Für die Anwendung bei Patienten mit eingeschränkter Nierenfunktion siehe Abschnitt «Patienten mit Nierenfunktionsstörungen».
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Siehe «Warnhinweise und Vorsichtsmassnahmen».
Patienten mit Nierenfunktionsstörungen
Die Behandlung einer Herzinsuffizienz oder einer chronischen Nierenerkrankung erfolgt unabhängig von der Nierenfunktion mit einer Dosis von Empagliflozin 10 mg.
Da in keiner dieser Indikationen Daten für Patienten mit einer eGFR <20 ml/min/1.73 m2 vorliegen, wird die Einleitung einer Behandlung mit Jardiance bei diesen Patienten generell nicht empfohlen.
Bei Patienten mit Typ-2-Diabetes mellitus ist die blutzuckersenkende Wirkung von Empagliflozin bei Patienten mit einer eGFR < 45 ml/min/1,73 m2 vermindert und bleibt bei Patienten mit einer eGFR < 30 ml/min/1,73 m2 wahrscheinlich aus. Daher sollte ab einer eGFR < 45 ml/min/1,73 m2, sofern erforderlich, eine zusätzliche blutzuckersenkende Behandlung in Betracht gezogen werden.
Ältere Patienten
Eine Dosisanpassung bei älteren Patienten ist nicht erforderlich.
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit von Empagliflozin wurde bei Kindern und Jugendlichen ausschliesslich für die Behandlung eines Typ 2 Diabetes mellitus und nur für die Altersgruppe von 10 - 17 Jahren gezeigt. Jardiance ist nicht zur Behandlung von Kindern unter 10 Jahren zugelassen. Für diese Altersgruppe sowie für Kinder und Jugendliche mit einer eGFR < 60 ml/min/1,73 m² liegen keine Daten vor.
Kombinationstherapie
Kombinationstherapie mit Sulfonylharnstoff und/oder Insulin
Siehe «Warnhinweise und Vorsichtsmassnahmen», «Interaktionen» und «Unerwünschte Wirkungen».
Verspätete Dosisgabe
Wenn die Einnahme einer Dosis versäumt wurde, sollte sie nachgeholt werden, sobald der Patient sich daran erinnert. Es sollte keine doppelte Dosis am selben Tag eingenommen werden.
Art der Anwendung
Jardiance kann mit oder ohne Nahrung eingenommen werden.
Vorübergehende Unterbrechung bei Operationen
Jardiance sollte wenn möglich mindestens 3 Tage vor grösseren Operationen oder Eingriffen, die mit längerem Fasten verbunden sind, abgesetzt werden. Die Einnahme von Jardiance kann wieder aufgenommen werden, wenn der Patient klinisch stabil ist und orale Nahrung zu sich nimmt (siehe «Warnhinweise und Vorsichtsmassnahmen»).
KontraindikationenÜberempfindlichkeit gegen Empagliflozin oder einen der sonstigen Bestandteile.
Jardiance 10 mg Tabletten bzw. Jardiance 25 mg Tabletten enthalten 162,5 mg bzw. 113 mg Laktose pro Tablette.
Im Falle seltener hereditärer Störungen, die mit einem Inhaltsstoff (Laktose) nicht kompatibel sind, ist die Anwendung des Arzneimittels kontraindiziert.
Warnhinweise und VorsichtsmassnahmenJardiance sollte nicht bei Patienten mit Typ-1-Diabetes eingesetzt werden.
Ketoazidose
Fälle von Ketoazidose, einer schwerwiegenden, lebensbedrohlichen Stoffwechselstörung, die eine sofortige Hospitalisierung erfordert, wurden bei mit Empagliflozin behandelten Patienten mit Diabetes mellitus berichtet, darunter auch tödlich verlaufende Fälle. Bei einigen der berichteten Fälle stellte sich die Krankheit atypisch mit nur mässig erhöhten Blutzuckerwerten unter 14 mmol/l (250 mg/dl) dar. Obwohl das Auftreten einer Ketoazidose bei Patienten ohne Diabetes mellitus weniger wahrscheinlich ist, wurden auch Fälle bei diesen Patienten berichtet.
Das Risiko einer Ketoazidose muss im Falle von unspezifischen Symptomen wie Übelkeit, Erbrechen, Appetitlosigkeit, Bauchschmerzen, übermässigem Durst, Atemschwierigkeiten, Verwirrtheit, ungewöhnlicher Erschöpfung oder Müdigkeit bei mit Empagliflozin-behandelten Patienten mit Diabetes in Betracht gezogen werden.
Wenn diese Symptome auftreten, sollte bei diesen Patienten unabhängig vom Blutzuckerspiegel umgehend ein Test auf Ketonkörper durchgeführt werden. Bei Verdacht auf Ketoazidose sollte Jardiance abgesetzt, der Zustand des Patienten beurteilt und eine sofortige Behandlung eingeleitet werden. Die diabetische Ketoazidose kann bei einigen Patienten nach Absetzen von Jardiance länger andauern, d.h. sie kann länger andauern als aufgrund der Plasmahalbwertszeit von Empagliflozin zu erwarten ist. Es wurde eine prolongierte Glukosurie zusammen mit einer anhaltenden DKA beobachtet. Die Urin-Glukoseausscheidung hält bis zu 3 Tage nach dem Absetzen von Jardiance an; es gibt jedoch Post-Marketing-Berichte über DKA und Glukosurie, die länger als 6 Tage und teilweise bis zu 2 Wochen nach dem Absetzen von SGLT2-Hemmern andauern. Ein höheres Risiko einer Ketoazidose während der Einnahme von Jardiance könnte für Patienten bestehen, die sich sehr kohlenhydratarm ernähren (da die Kombination die Produktion von Ketonkörpern weiter erhöhen könnte), für Patienten mit einer akuten Erkrankung, bei Pankreaserkrankungen, die auf einen Insulinmangel hinweisen (z.B. Typ-1-Diabetes, Pankreatitis oder Pankreasoperation in der Anamnese), bei Reduzierung der Insulindosis (einschliesslich Versagen der Insulinpumpe), bei Alkoholmissbrauch, bei starker Dehydratation und für stark dehydrierte Patienten und für Patienten, die bereits in der Vergangenheit eine Ketoazidose hatten. Jardiance sollte bei diesen Patienten mit Vorsicht angewendet werden. Vorsicht ist geboten bei der Reduzierung der Insulindosis [siehe «Dosierung/Anwendung»]. In klinischen Situationen, die bekanntermassen für eine Ketoazidose prädisponieren (z.B. längeres Fasten aufgrund einer akuten Erkrankung, Eingriffen oder Operation) ist eine Überwachung auf Ketoazidose angezeigt und die Behandlung mit Jardiance sollte vorübergehend abgesetzt werden. In diesen Situationen ist ferner eine Überwachung der Ketonkörperkonzentration in Betracht zu ziehen, auch wenn die Behandlung mit Jardiance unterbrochen wurde. Die Behandlung mit Jardiance kann fortgesetzt werden, wenn der Patient klinisch stabil ist und orale Nahrung zu sich nimmt (siehe «Dosierung/Anwendung»).
Nekrotisierende Fasziitis des Perineums (Fournier-Gangrän)
Bei weiblichen und männlichen Patienten, die mit SGLT2-Hemmern – darunter auch Empagliflozin - behandelt wurden, wurden Fälle von nekrotisierender Fasziitis des Perineums, auch als «Fournier-Gangrän» bezeichnet, berichtet. Dabei handelt es sich um eine seltene, aber schwerwiegende und lebensbedrohliche nekrotisierende Infektion. Zu den schwerwiegenden Folgen zählten Krankenhausaufenthalte, mehrfache Operationen und Tod.
Patienten, die mit Jardiance behandelt werden und sich mit Schmerzen oder Druckempfindlichkeit, Erythemen, Schwellungen im Genital- oder Perinealbereich, Fieber oder Unwohlsein melden, sind auf nekrotisierende Fasziitis hin zu untersuchen. Wenn Verdacht auf nekrotisierende Fasziitis besteht, ist Jardiance abzusetzen und umgehend eine Behandlung (u.a. mit Breitspektrumantibiotika und ggf. chirurgischer Wundausschneidung) einzuleiten.
Anwendung bei Patienten mit eingeschränkter Nierenfunktion
Da keine ausreichenden Daten vorliegen, wird die Einleitung einer Behandlung mit Empagliflozin bei Patienten mit einer eGFR <20 ml/min/1.73 m2 nicht empfohlen.
Die blutzuckersenkende Wirksamkeit von Empagliflozin ist von der Nierenfunktion abhängig und bleibt bei Patienten mit einer eGFR < 30 ml/min/1,73 m2 wahrscheinlich aus (siehe «Dosierung/Anwendung»).
Während der Anwendung von Jardiance sollte die Nierenfunktion regelmässig überprüft werden.
Volumenmangel
Empagliflozin führt auf Grund der osmotischen Diurese zu einer leichten Absenkung des Blutdrucks (systolisch mehr als diastolisch) und kann potentiell eine orthostatische Hypotonie auslösen, was zu unerwünschten Wirkungen wie Schwindel, Synkopen oder Stürzen führen kann. Besondere Vorsicht ist geboten bei Patienten mit bekannter orthostatischer Hypotonie, Patienten unter antihypertensiver Therapie, älteren Patienten sowie Patienten mit bekannter kardiovaskulärer und/oder cerebrovaskulärer Erkrankung.
Erfahrungsgemäss kommt es zu einem Anstieg des Hämatokrits von rund 2%.
Bei Erkrankungen, die zu Flüssigkeitsverlust führen können (z.B. Magen-Darm-Erkrankungen), wird bei Patienten, welche Empagliflozin erhalten, eine sorgfältige Überwachung des Volumenstatus und der Elektrolyte empfohlen. Eine vorübergehende Unterbrechung der Behandlung mit Empagliflozin sollte erwogen werden, bis der Flüssigkeitsverlust korrigiert ist.
Komplizierte Harnwegsinfektionen
In den gepoolten placebo-kontrollierten doppelblinden Studien bei Patienten mit Typ 2 Diabetes mellitus über 18 bis 24 Wochen war die Häufigkeit von Harnwegsinfektionen, welche als unerwünschte Ereignisse gemeldet wurden, unter Empagliflozin 25 mg und Placebo vergleichbar (jeweils 7,6%) und unter Empagliflozin 10 mg höher (9,3%). Wie auch unter Placebo wurde unter Empagliflozin bei Patienten mit anamnestisch bekannten chronischen oder rezidivierenden Harnwegsinfektionen häufiger über Harnwegsinfektionen berichtet. Die Meldungen zum Schweregrad der Harnwegsinfektionen stimmten mit den jeweiligen Meldungen für Placebo (leicht, mittelschwer und schwer) überein. Bei weiblichen Patienten traten Harnwegsinfektionen häufiger unter Empagliflozin als unter Placebo auf. Bei männlichen Patienten wurde dies nicht beobachtet.
Fälle von komplizierten Harnwegsinfektionen, einschliesslich Pyelonephritis und Urosepsis, wurden bei Patienten, die mit Empagliflozin behandelt wurden, berichtet (siehe «Unerwünschte Wirkungen»). Bei Patienten mit komplizierten Harnwegsinfektionen ist eine vorübergehende Unterbrechung der Behandlung mit Empagliflozin zu erwägen.
Amputationen der unteren Gliedmassen
Eine erhöhte Anzahl von Amputationen der unteren Gliedmassen (in erster Linie von Zehen) sind in klinischen Langzeitstudien mit einem anderen SGLT-2-Inhibitor beobachtet worden. Ob es sich hierbei um einen Klasseneffekt handelt, ist nicht bekannt. Wie bei allen Diabetes-Patienten üblich, ist es wichtig, die Patienten hinsichtlich der regelmässigen präventiven Fusspflege zu beraten.
Patienten mit Leberinsuffizienz
Es liegen nur sehr begrenzte Erfahrungen vor zur Verabreichung von Empagliflozin bei Patienten mit schwerer Leberfunktionsstörung oder mit deutlicher (mehr als dreifacher) Erhöhung der Transaminasen. Die Anwendung von Empagliflozin bei diesen Patienten wird nicht empfohlen.
Kombinationstherapie mit Sulfonylharnstoff und/oder Insulin
Wenn Jardiance in Kombination mit einem Sulfonylharnstoff oder Insulin angewendet wird, sollte erwogen werden, die Sulfonylharnstoff- oder Insulindosis zu reduzieren, um das Hypoglykämierisiko zu senken.
Ältere Patienten
Im Rahmen klinischer Studien hatten 992 Patienten ab 75 Jahren Jardiance erhalten. Bei Patienten ab 75 Jahren besteht möglicherweise ein erhöhtes Risiko für Volumenmangel. Daher sollte die Verschreibung von Jardiance in dieser Patientengruppe mit Vorsicht erfolgen (siehe «Unerwünschte Wirkungen»).
Zerebrovaskuläre Ereignisse
In der Studie EMPA-REG OUTCOME war Jardiance (kombinierte Behandlungsgruppen mit Empagliflozin 10 mg und 25 mg) im Vergleich zur Placebo-Gruppe mit einem nicht signifikanten Trend für ein höheres Risiko tödlicher/nicht tödlicher Schlaganfälle assoziiert: HR 1,18 (95%-KI 0,89; 1,56) (siehe „Klinische Wirksamkeit“). Ein kausaler Zusammenhang zwischen Jardiance und Schlaganfall ist nicht erwiesen; allerdings ist bei Patienten mit hohem Risiko für zerebrovaskuläre Ereignisse Vorsicht geboten.
Lactose
Patienten mit der seltenen hereditären Galactose-Intoleranz, völligem Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten dieses Arzneimittel nicht einnehmen.
Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Filmtablette, d.h. es ist nahezu «natriumfrei».
InteraktionenPharmakokinetische Interaktionen
Wirkungen anderer Arzneimittel auf Empagliflozin
In-vitro-Daten lassen darauf schliessen, dass die primäre Metabolisierung von Empagliflozin beim Menschen über eine Glucuronidierung durch die Uridin-5'-Diphospho-Glucuronosyltransferasen UGT1A3, UGT1A8, UGT1A9 und UGT2B7 erfolgt. Empagliflozin ist ein Substrat der Aufnahme-Transporter OAT3, OATP1B1 und OATP1B3 beim Menschen, jedoch nicht von OAT1 und OCT2. Empagliflozin ist ein Substrat für P-Glykoprotein (P-gp) und das Brustkrebsresistenzprotein (BCRP).
Die gleichzeitige Anwendung von Empagliflozin mit Probenecid, einem Inhibitor von UGT-Enzymen und OAT3, führte zu einem Anstieg der maximalen Plasmakonzentrationen (Cmax) von Empagliflozin um 26% und zu einer Zunahme der Fläche unter der Konzentrations-Zeit-Kurve (AUC) um 54%.
Diese Veränderungen wurden als klinisch nicht relevant eingestuft.
Die Wirkung einer Induktion von UGT auf Empagliflozin wurde nicht untersucht. Eine Begleitmedikation mit bekannten Induktoren von UGT-Enzymen sollte vermieden werden, da das potenzielle Risiko einer verminderten Wirksamkeit besteht.
Eine Interaktionsstudie mit Gemfibrozil, einem in-vitro-lnhibitor von OAT3- und OATP1B1/1B3-Transportern, zeigte, dass sich die Cmax von Empagliflozin nach gleichzeitiger Anwendung um 15 % und die AUC um 59% erhöhte. Diese Veränderungen wurden als klinisch nicht relevant eingestuft.
Die Hemmung von OATP1B1/1B3-Transportern durch gleichzeitige Anwendung von Rifampicin führte zu einem Anstieg der Cmax von Empagliflozin um 75% und zu einem Anstieg der AUC von Empagliflozin um 35 %.
Diese Veränderungen wurden als klinisch nicht relevant eingestuft.
Die Exposition gegenüber Empagliflozin war mit oder ohne eine gleichzeitige Anwendung von Verapamil, einem P-gp-lnhibitor, ähnlich; dies zeigt, dass die Hemmung von P-gp keinen klinisch relevanten Effekt auf Empagliflozin hat.
Bei gesunden Probanden durchgeführte Interaktionsstudien lassen darauf schliessen, dass die Pharmakokinetik von Empagliflozin nicht durch die gleichzeitige Anwendung von Metformin, Glimepirid (Einzeldosis), Verapamil, Ramipril, Simvastatin, Torasemid und Hydrochlorothiazid beeinflusst wird.
Wirkungen von Empagliflozin auf andere Arzneimittel
Empagliflozin bewirkt keine Hemmung, Inaktivierung oder Induktion von CYP450-Isoenzymen. UGT1A1, UGT1A3, UGT1A8, UGT1A9 oder UGT2B7 werden durch Empagliflozin nicht gehemmt. In therapeutischen Dosen ist das Potenzial von Empagliflozin, die wichtigsten CYP450- und UGT-Isoenzyme reversibel zu hemmen oder zu inaktivieren, gering. Arzneimittelinteraktionen zwischen den wichtigsten CYP450- und UGT-Isoenzyme und Empagliflozin sowie gleichzeitig verabreichter Substrate dieser Enzyme werden daher als unwahrscheinlich angesehen.
ln therapeutischen Dosen bewirkt Empagliflozin keine Hemmung von P-gp. Basierend auf in-vitro-Studien gilt es als unwahrscheinlich, dass Empagliflozin Wechselwirkungen mit anderen P-gp-Substraten hervorruft. Die gleichzeitige Anwendung von Digoxin, einem P-gp-Substrat, mit Empagliflozin führte zu einer Erhöhung der AUC von Digoxin um 6% und zu einer Erhöhung der Cmax um 15 %. Patienten unter Digoxin sollten entsprechend beobachtet werden.
Empagliflozin hemmt in klinisch relevanten Plasmakonzentrationen in vitro keinen der Aufnahme-Transporter beim Menschen wie OAT3, OATP1B1 und OATP1B3. Daher werden Arzneimittelwechselwirkungen mit Substraten dieser Aufnahme-Transporter als unwahrscheinlich angesehen.
Bei gesunden Probanden durchgeführte Interaktionsstudien lassen darauf schliessen, dass Empagliflozin keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Metformin, Glimepirid, Simvastatin, Warfarin, Ramipril, Hydrochlorothiazid, Torasemid und oralen Kontrazeptiva hat.
Für Acenocoumarol und Phenprocoumon stehen keine Daten zur Verfügung.
SGLT2-Inhibitoren einschliesslich Empagliflozin können die renale Lithiumausscheidung erhöhen und den Lithiumspiegel im Blut senken. Die Serumkonzentration von Lithium sollte nach Beginn der Behandlung mit Empagliflozin und bei Dosisänderungen häufiger kontrolliert werden. Zur Überwachung der Serumkonzentration von Lithium ist der Patient an den Arzt, der das Lithium verschrieben hat, zu verweisen.
Pharmakodynamische Interaktionen
Diuretika
Empagliflozin kann die diuretische Wirkung von Thiazid- und Schleifendiuretika verstärken und das Risiko für Dehydratation und Blutdruckabfall erhöhen.
Insulin und lnsulin-Sekretagoga
Insulin und lnsulin-Sekretagoga, wie z.B. Sulfonylharnstoffe, können das Risiko einer Hypoglykämie erhöhen. Bei Anwendung in Kombination mit Empagliflozin muss daher unter Umständen die Dosierung des Insulins oder lnsulin-Sekretagogums reduziert werden, um das Risiko einer Hypoglykämie zu senken.
Interferenz mit 1,5-Anhydroglucitol(1,5-AG)-Assay
Die Überwachung der Glykämie mittels 1,5-AG-Assay ist nicht empfohlen, da bei Patienten, die SGLT2-Hemmer einnehmen, 1,5-AG-Messungen zur Bewertung der glykämischen Kontrolle unzuverlässig sind. Alternative Methoden zur Überwachung der Glykämie sollen benutzt werden.
Kinder und Jugendliche
Interaktionsstudien wurden ausschliesslich an Erwachsenen durchgeführt.
Schwangerschaft, StillzeitSchwangerschaft
Es liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Jardiance bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf eine Reproduktionstoxizität (siehe «Präklinische Daten»). Aufgrund potentieller Auswirkungen auf die Entwicklung des Föten, ist die Anwendung von Jardiance während der Schwangerschaft zu vermeiden, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Es gibt keine Informationen darüber, ob Empagliflozin in die Muttermilch übergeht. Die zur Verfügung stehenden Daten aus tierexperimentellen Studien zeigten, dass Empagliflozin in die Milch übergeht. Tierstudien haben unerwünschte Wirkungen auf die postnatale Entwicklung (siehe «Präklinische Daten») gezeigt. Ein Risiko für das Neugeborene / Kind kann nicht ausgeschlossen werden. Das Stillen soll während der Behandlung mit Jardiance unterbrochen werden.
Fertilität
Es wurden keine Studien mit Jardiance zu den Auswirkungen auf die Fertilität beim Menschen durchgeführt. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien über die Wirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Patienten sollten jedoch auf das Risiko einer Hypoglykämie hingewiesen werden, wenn Jardiance als zusätzliche Therapie zu Insulin und/oder einem Sulfonylharnstoff verabreicht wird. Zudem sollten sie auf das erhöhte Risiko unerwünschter Wirkungen in Zusammenhang mit reduziertem intravaskulärem Volumen, wie z.B. Schwindel (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen») aufmerksam gemacht werden.
Unerwünschte WirkungenTyp 2 Diabetes mellitus
In klinischen Studien zur Beurteilung der Sicherheit von Empagliflozin wurden insgesamt 15582 Patienten mit Typ 2-Diabetes behandelt, wobei 10004 Patienten Empagliflozin entweder allein oder in Kombination mit Metformin, einem Sulfonylharnstoff, Thiazolidindion, DPP4-Inhibitoren oder Insulin erhielten.
In diesen Studien war die Abbruchrate aufgrund von Nebenwirkungen für alle Behandlungsgruppen vergleichbar: Placebo (5,6%), Jardiance 10 mg (5,0%) und Jardiance 25 mg (4,9%).
An placebokontrollierten, doppelblinden Studien mit 18- bis 24wöchiger Behandlungsdauer nahmen 3534 Patienten teil, von denen 1183 Placebo, 1185 Jardiance 10 mg und 1166 Jardiance 25 mg erhielten.
Die häufigste Nebenwirkung war Hypoglykämie, abhängig von der angewendeten Basistherapie in den jeweiligen Studien (siehe Beschreibung spezieller Nebenwirkungen).
Herzinsuffizienz
In den EMPEROR-Studien waren Herzinsuffizienz-Patienten mit entweder reduzierter Auswurffraktion (n = 3726) oder erhaltener Auswurffraktion (n = 5985) eingeschlossen, die mit 10 mg Empagliflozin oder Placebo behandelt wurden. Etwa die Hälfte der Studienteilnehmer waren Patienten mit Typ 2 Diabetes mellitus.
Die häufigste unerwünschte Arzneimittelwirkung bestand in einer Volumendepletion (Empagliflozin 10 mg: 11,4 %; Placebo: 9,7 %).
Chronische Nierenerkrankung
In die EMPA-KIDNEY-Studie waren Patienten mit chronischer Nierenerkrankung (N = 6609) eingeschlossen, die mit 10 mg Empagliflozin oder Placebo behandelt wurden. Etwa 44 % der Patienten hatten Diabetes mellitus Typ 2.
In der EMPA-KIDNEY-Studie wurden keine neuen unerwünschten Arzneimittelwirkungen festgestellt.
Das Gesamtsicherheitsprofil von Jardiance war bei allen untersuchten Indikationen im Allgemeinen einheitlich.
Folgende Nebenwirkungen wurden bei Patienten, die in placebokontrollierten, doppelblinden Studien mit Empagliflozin behandelt wurden, berichtet:
Definition der verwendeten Häufigkeiten:
«sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1000, <1/100), «selten» (≥1/10'000, <1/1000), «sehr selten» (<1/10'000), «Häufigkeit nicht bekannt» (basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Infektionen und Infestationen
Häufig: Vaginaler Soor, Vulvovaginitis, Balanitis und andere Infektionen des Genitaltraktsb, Harnwegsinfektionenb (einschliesslich Pyelonephritis und Urosepsis)d.
Selten: Nekrotisierende Fasziitis des Perineums (Fournier-Gangrän)d.
Stoffwechsel und Ernährungsstörungen
Sehr häufig: Hypoglykämie (bei Kombination mit einem Sulfonylharnstoff oder Insulin)a.
Gelegentlich: Ketoazidosed.
Erkrankungen des Gastrointestinaltrakts
Häufig: Obstipation.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Pruritus, allergische Hautreaktionen (z.B. Hautausschlag, Urtikaria)d.
Gelegentlich: Angioödemd.
Funktionsstörungen der Gefässe
Sehr häufig: Volumenmangela.
Funktionsstörungen der Nieren und Harnwege
Häufig: Vermehrtes Wasserlassena.
Gelegentlich: Dysurie.
Sehr selten: Tubulointerstitielle Nephritis.
Allgemeine Störungen und Reaktionen an der Applikationsstelle
Häufig: Durst.
Untersuchungen
Häufig: Erhöhte Serumlipidec, erhöhter Hämatokritc.
Gelegentlich: Verringerte glomeruläre Filtrationsratea, erhöhter Kreatininspiegel im Bluta.
anähere Angaben siehe Unterabschnitte weiter unten.
bsiehe Rubrik «Warnhinweise und Vorsichtsmassnahmen».
cnähere Angaben siehe «Klinische Wirksamkeit».
daus den Erfahrungen seit der Marktzulassung.
Beschreibung ausgewählter Nebenwirkungen
Die nachstehend angegebenen Häufigkeiten für unerwünschte Wirkungen werden ungeachtet des Kausalzusammenhangs angegeben.
Hypoglykämie
Die Häufigkeit der Hypoglykämie war von der Basistherapie in der jeweiligen Studie abhängig.
Die Anzahl von Patienten mit leichter Hypoglykämie in den Gruppen mit Empagliflozin bzw. Placebo als Monotherapie, als Zusatztherapie zu Metformin, als Zusatztherapie zu Pioglitazon +/- Metformin und als Zusatztherapie zu Linagliptin +/- Metformin war vergleichbar. Eine erhöhte Häufigkeit wurde beobachtet, wenn die Gabe als Zusatztherapie zu Metformin plus Sulfonylharnstoff (Empagliflozin 10 mg: 16,1%, Empagliflozin 25 mg: 11,5%, Placebo: 8,4%) erfolgte. Als Zusatztherapie zu Insulin +/- Metformin und +/-Sulfonylharnstoff (Empagliflozin 10 mg: 19,5%, Empagliflozin 25 mg: 28,4%, Placebo: 20,6% während der ersten 18 Wochen der Behandlung, als die Insulindosis nicht angepasst werden konnte; Empagliflozin 10 mg und 25 mg: 36,1%, Placebo 35,3% während der 78wöchigen Studie) fand sich für Empagliflozin kein erhöhtes Hypoglykämierisiko versus Placebo.
In den EMPEROR Herzinsuffizienz-Studien wurde bei Gabe zusätzlich zu Sulfonylharnstoff oder Insulin eine ähnliche Häufigkeit von Hypoglykämien beobachtet (Empagliflozin 10 mg: 6,5%, Placebo: 6,7%).
Schwere Hypoglykämie (behandlungsbedürftige Hypoglykämie)
Die Anzahl schwerer hypoglykämischer Episoden im Vergleich zu Placebo war unter Empagliflozin nicht erhöht.
In den EMPEROR Herzinsuffizienz-Studien wurden bei Patienten mit Diabetes mellitus schwerere Hypoglykämien mit ähnlicher Häufigkeit beobachtet, wenn die Gabe als Zusatztherapie zu Sulfonylharnstoff oder Insulin erfolgte (Empagliflozin 10 mg: 2,2%, Placebo: 1,9%).
Vaginaler Soor, Vulvovaginitis, Balanitis und andere Infektionen des Genitaltrakts
In Studien bei Patienten mit Typ 2 Diabetes mellitus traten Vaginaler Soor, Vulvovaginitis, Balanitis und andere Genitalinfektionen häufiger unter Empagliflozin 10 mg (4,1%) und Empagliflozin 25 mg (3,7%) auf als unter Placebo (0,9%); Patientinnen unter Empagliflozin waren im Vergleich zur Placebo-Gruppe häufiger betroffen, bei männlichen Patienten war der Unterschied in der Häufigkeit weniger ausgeprägt. Die Infektionen des Genitaltrakts waren von leichter bis mittelschwerer Intensität.
Fälle von Phimose/erworbener Phimose wurden in Verbindung mit Genitalinfektionen gemeldet.
Vermehrtes Wasserlassen
Wie angesichts des Wirkmechanismus zu erwarten, wurde vermehrtes Wasserlassen (umfasst die bevorzugten Bezeichnungen (PT): Pollakisurie, Polyurie, Nykturie) häufiger bei Patienten unter Jardiance 10 mg (3,5%) und unter Jardiance 25 mg (3,3%) als unter Placebo (1,4%) beobachtet. Diese Nebenwirkung war zumeist leicht bis mittelschwer ausgeprägt. Die Häufigkeit von Meldungen über Nykturie war für Placebo und Jardiance vergleichbar (<1%).
In den EMPEROR Herzinsuffizienz-Studien wurde vermehrtes Wasserlassen bei Patienten, die mit Empagliflozin behandelt wurden, und bei Patienten, die mit Placebo behandelt wurden, ähnlich häufig beobachtet (Empagliflozin 10 mg: 0,9%, Placebo: 0,5%).
Volumenmangel
Insgesamt trat Volumenmangel (einschliesslich der vorab definierten Erfassungsbegriffe (ambulant gemessene) Abnahme des Blutdrucks, Abnahme des systolischen Blutdrucks, Dehydratation, Hypotonie [Blutdruckabfall], Hypovolämie, orthostatische Hypotonie und Synkope) vergleichbar häufig auf wie unter Placebo (Jardiance 10 mg 0,6%, Jardiance 25 mg 0,4% und Placebo 0,3%). Die Wirkung von Empagliflozin auf die Ausscheidung von Zucker im Urin ist mit osmotischer Diurese assoziiert, wodurch der Hydratationsstatus von Patienten ab 75 Jahren beeinträchtigt werden könnte. Bei Patienten ab 75 Jahren war die Häufigkeit von Volumenmangel-Ereignissen unter Jardiance 10 mg (2,3%) oder Jardiance 25 mg (4,3%) und Placebo (2,1%) vergleichbar.
Erhöhter Blutkreatininspiegel und verringerte glomeruläre Filtrationsrate
Die Gesamthäufigkeit der Patienten mit erhöhtem Blutkreatininspiegel und verringerter glomerulärer Filtrationsrate war bei Empagliflozin und Placebo vergleichbar (Blutkreatinin erhöht: Empagliflozin 10 mg 0,6 %, Empagliflozin 25 mg 0,1 %, Placebo 0,5 %; glomeruläre Filtrationsrate verringert: Empagliflozin 10 mg 0,1 %, Empagliflozin 25 mg 0 %, Placebo 0,3 %).
In placebokontrollierten, doppelblinden Studien über einen Zeitraum von bis zu 76 Wochen wurden vorübergehende anfängliche Kreatininerhöhungen (durchschnittliche Veränderung von Baseline bis Woche 12: Empagliflozin 10 mg 0,02 mg/dl, Empagliflozin 25 mg 0,01 mg/dl) sowie vorübergehende anfängliche Senkungen der geschätzten glomerulären Filtrationsrate (durchschnittliche Veränderung von Baseline bis Woche 12: Empagliflozin 10 mg -1,34 ml/min/1,73 m2, Empagliflozin 25 mg -1,37 ml/min/1,73 m2) beobachtet. Diese Veränderungen waren im Allgemeinen unter Dauergabe oder nach Absetzen der Medikation reversibel.
Veränderung der Laborparameter
- Hämatokrit
Die Veränderungen des Hämatokrits gegenüber dem Ausgangswert betrugen -0,8 bis -0,1% für Placebo und 2,1 bis 2,5% für Empagliflozin 10 mg.
- Lipide
Die Veränderung der Lipidparameter gegenüber dem Ausgangswert betrugen für Empagliflozin 10 mg im Vergleich zu Placebo 0,01 bis 0,14 mmol/l (Gesamtcholesterin), 0,03 bis 0,08 mmol/l (HDL-Cholesterin), 0,01 bis 0,12 mmol/l (LDL-Cholesterin) und -0,23 bis -0,05 (Triglyzeride).
Kinder und Jugendliche
Im Rahmen der DINAMO-Studie erhielten 157 Kinder ab 10 Jahren mit Typ-2-Diabetes eine Behandlung, davon 52 Patienten Empagliflozin, 52 Patienten Linagliptin und 53 Patienten Placebo (siehe Abschnitt zu klinischen Studien).
Während der placebokontrollierten Phase war die häufigste unerwünschte Arzneimittelwirkung Hypoglykämie (Empagliflozin 10 mg und 25 mg, gepoolt: 23.1 %, Placebo: 9,4 %).
Keines dieser Ereignisse war schwerwiegend oder bedurfte Unterstützung.
Insgesamt war das Sicherheitsprofil bei Kindern vergleichbar mit dem Sicherheitsprofil bei erwachsenen T2DM-Patienten.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Im Rahmen kontrollierter klinischer Studien an gesunden Probanden wurden Einzeldosen von bis zu 800 mg Empagliflozin verabreicht.
Behandlung
Bei einer Überdosierung sind geeignete unterstützende Massnahmen entsprechend des klinischen Zustands des Patienten einzuleiten. Zur Entfernung von Empagliflozin durch Hämodialyse liegen keine Daten vor.
Eigenschaften/WirkungenATC-Code
A10BK03
Wirkungsmechanismus / Pharmakodynamik
Empagliflozin ist ein reversibler, stark wirksamer und selektiver kompetitiver SGLT2-Inhibitor mit einer IC50 von 1,3 nM. Es zeigt eine 5000-fache höhere Selektivität für SGLT2 gegenüber dem für die Glukose-Resorption im Darm verantwortlichen humanen SGLT1 (IC50: 6278 nM).
Weiter konnte keine hemmende Wirkung auf Glukosetransporter GLUTs gezeigt werden, welche für die Glukoseversorgung in verschiedenen Geweben verantwortlich sind.
SGLT-2 wird vorwiegend in der Niere exprimiert. Es ist als wichtigster Transporter für die Rückresorption der Glukose aus dem glomerulären Filtrat in den Blutkreislauf verantwortlich.
Empagliflozin reduziert insulinunabhängig die renale Glukose-Rückresorption. Die durch diesen Mechanismus über den Urin ausgeschiedene Menge an Glukose ist abhängig von der Blutzuckerkonzentration sowie der glomerulären Filtrationsrate.
Die erhöhte renale Glukoseausscheidung führt zu einer osmotischen Diurese und über diesen diuretischen Effekt zu einer Senkung des Blutdrucks (im Mittel rund 4-5 mmHg systolisch und 1-2 mmHg diastolisch) und zu einem Anstieg des Hämatokrits (rund 2-3%). Zudem wirkt Empagliflozin urikosurisch und reduziert so den Plasma-Harnsäurespiegel (rund 50µmol/L). Durch die renale Glukoseausscheidung ist das Risiko für urogenitale Infektionen insbesondere bei Frauen und älteren Menschen erhöht.
Die renale Glukose-Ausscheidung nach 10mg Empagliflozin beträgt ca. 64g pro Tag (entspricht rund 256 kcal). Nach Einnahme von 25 mg Empagliflozin beträgt die renale Glukose-Ausscheidung ca. 78g pro Tag (entspricht rund 312 kcal).
Bei T2DM-Patienten steigt die renale Ausscheidung von Zucker im Urin nach der ersten Dosis Empagliflozin an und bleibt über das gesamte 24stündige Dosierungsintervall auf ungefähr dem gleichen Niveau.
Die erhöhte Ausscheidung von Zucker im Urin führte bei T2DM-Patienten zu einer Reduktion der Plasmaglukosespiegel.
Die blutzuckersenkende Wirkung von Empagliflozin ist unabhängig von der Betazellfunktion und dem Insulinweg.
Empagliflozin reduziert zudem die Natrium-Rückresorption und verstärkt den Natriumtransport zum distalen Tubulus. Dies kann Auswirkungen auf verschiedene physiologische Funktionen haben, unter anderem: Erhöhung des tubuloglomerulären Feedbacks und Reduktion des intraglomerulären Drucks, Senkung der Vor- und Nachlast des Herzens, Herabregulierung der Sympathikusaktivität und Reduktion der Belastung der linksventrikulären Wand, was durch niedrigere NT-proBNP-Werte mit möglicherweise positiven Auswirkungen auf das kardiale Remodeling, den Fülldruck und die diastolische Funktion sowie den Erhalt der Nierenstruktur und -funktion nachgewiesen wird.
Klinische Wirksamkeit
Typ 2 Diabetes mellitus
Insgesamt 11250 Patienten mit Typ-2-Diabetes wurden in 10 doppelblinden, placebo- und aktivkontrollierten klinischen Studien behandelt, 3021 dieser Patienten erhielten Empagliflozin 10 mg. In vier Studien betrug die Behandlungsdauer 24 Wochen; in Verlängerungen dieser und anderer Studien waren die Patienten bis zu 102 Wochen lang mit Empagliflozin behandelt.
Die Behandlung mit Empagliflozin als Monotherapie und in Kombination mit Metformin, einem Sulfonylharnstoff, DPP-4-Inhibitoren und Insulin führte zu einer klinisch relevanten Verbesserung des HbA1c, Nüchtern-Plasmaglukose (NPG), Körpergewicht sowie systolischem und diastolischem Blutdruck.
Monotherapie
Die Wirksamkeit und Sicherheit von Empagliflozin als Monotherapie wurde bei nicht vorbehandelten Patienten in einer 24-wöchigen doppelblinden, placebo- und aktivkontrollierten Studie untersucht. Die Behandlung mit Empagliflozin führte im Vergleich zu Placebo zu einer statistisch signifikanten (p < 0,0001) Reduktion des HbA1c (Tabelle 1) sowie zu einer klinisch relevanten Abnahme der NPG.
In einer präspezifizierten Analyse von Patienten (N = 201) mit einem HbA1c-Ausgangswert ≥8,5 % führte die Behandlung zu einer Reduktion des HbA1c-Werts gegenüber dem Ausgangswert von -1,44 % für Empagliflozin 10 mg, -1,43 % für Empagliflozin 25 mg, -1,04 % für Sitagliptin und zu einer Zunahme um 0,01 % für Placebo.
In der doppelblinden, placebokontrollierten Verlängerungsperiode dieser Studie blieben die Reduktionen des HbA1c, Körpergewicht und Blutdruck bis Woche 76 bestehen.
Tabelle 1: Ergebnisse einer 24wöchigen (LOCF) placebokontrollierten Studie mit Jardiance als Monotherapie
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
|
Sitagliptin
100 mg
| |
N
|
228
|
224
|
224
|
223
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
7,91
|
7,87
|
7.86
|
7,85
| |
Veränderung gegenüber Baseline1
|
0,08
|
-0,66
|
-0.78
|
-0,66
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,74*
(-0,90, -0,57)
|
-0.85*
(-1.01, -0.69)
|
-0,73
(-0,88, -0,59)3
| |
N
|
208
|
204
|
202
|
200
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Wert zu Baseline ≥7%)4
|
12,0
|
35,3
|
43.6
|
37,5
| |
N
|
228
|
224
|
224
|
223
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
78,23
|
78,35
|
77.80
|
79,31
| |
Veränderung gegenüber Baseline1
|
-0,33
|
-2,26
|
-2.48
|
0,18
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,93*
(-2,48, -1,38)
|
-2.15*
(-2.70,-1.60)
|
0,52
(-0,04, 1,00)3
| |
N
|
228
|
224
|
224
|
223
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
130,4
|
133,0
|
129.9
|
132,5
| |
Veränderung gegenüber Baseline1
|
-0,3
|
-2,9
|
-3.7
|
0,5
| |
Unterschied zu Placebo1
(95 % KI)
|
|
-2,6* (-5,2, -0,0)
|
-3.4* (-6.0, -0.9)
|
0,8 (-1,4, 3,1)3
|
1 für Ausgangswert adjustierter Mittelwert
2 Last Observation Carried Forward (LOCF), Werte nach antihypertensiver Notfallbehandlung zensiert
3 95% KI
4 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Kombinationstherapie
Empagliflozin als Add-on-Therapie zu Metformin und Sulfonylharnstoff
Empagliflozin führte als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff im Vergleich zu Placebo zu einer statistisch signifikanten (p < 0,0001) Abnahme des HbA1c-Werts und des Körpergewichts (Tabelle 2). Zudem führte es im Vergleich zu Placebo zu einer klinischen bedeutsamen Abnahme der NPG sowie des systolischen und diastolischen Blutdrucks.
In der doppelblinden. placebokontrollierten Verlängerungsperiode dieser Studien blieben die Reduktionen von HbA1c, Körpergewicht und Blutdruck bis Woche 52 bestehen.
Tabelle 2: Ergebnisse einer 24wöchigen (LOCF) placebokontrollierten Studie mit Jardiance als Zusatz zu Metformin bzw. zu Metformin und einem Sulfonylharnstoff (Full Analysis Set)
|
Jardiance als Zusatz zu Metformin
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
207
|
217
|
213
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
7,90
|
7,94
|
7,86
| |
Veränderung gegenüber Baseline1
|
-0,13
|
-0,70
|
-0,77
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,57*
(-0,72, -0,42)
|
-0,64*
(-0,79, -0,48)
| |
N
|
184
|
199
|
191
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
12,5
|
37,7
|
38,7
| |
N
|
207
|
217
|
213
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
79,73
|
81,59
|
82,21
| |
Veränderung gegenüber Baseline1
|
-0,45
|
-2,08
|
-2,46
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,63*
(-2,17, -1,08)
|
-2,01*
(-2,56, -1,46)
| |
N
|
207
|
217
|
213
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
128,6
|
129,6
|
130,0
| |
Veränderung gegenüber Baseline1
|
-0,4
|
-4,5
|
-5,2
| |
Unterschied zu Placebo1
(95% KI)
|
|
-4,1* (-6,2, -2,1)
|
-4.8* (-6.9, -2.7)
|
|
Jardiance als Zusatz zu Metformin und einem Sulfonylharnstoff
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
225
|
225
|
216
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
8,15
|
8,07
|
8,10
| |
Veränderung gegenüber Baseline1
|
-0,17
|
-0,82
|
-0,77
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,64*
(-0,79, -0,49)
|
-0,59*
(-0,74, -0,44)
| |
N
|
216
|
209
|
202
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
9,3
|
26,3
|
32,2
| |
N
|
224
|
225
|
215
| |
NPG (mg/dl) [mmol/l]
| |
Baseline (Mittelwert)
|
151,7 [8,42]
|
151,0 [8,38]
|
156,5 [8,68]
| |
Veränderung gegenüber Baseline1
|
5,5 [0,31]
|
-23,3 [-1,29]
|
-23,3 [-1,29]
| |
Unterschied zu Placebo1
(95% KI)
|
|
-28,8
(-34,3, -23,4)
[-1,60
(-1,90, -1,30)]
|
-28,8
(-34,3, -23,3)
[-1,60
(-1,90, -1,29)]
| |
N
|
225
|
225
|
216
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
76,23
|
77,08
|
77,50
| |
Veränderung gegenüber Baseline1
|
-0,39
|
-2,16
|
-2,39
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,76*
(-2,25, -1,28)
|
-1,99*
(-2,48, -1,50)
| |
N
|
225
|
225
|
216
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
128,8
|
128,7
|
129,3
| |
Veränderung gegenüber Baseline1
|
-1,4
|
-4,1
|
-3,5
| |
Unterschied zu Placebo1
(95% KI)
|
|
-2,7
(-4,6, -0,8)
|
-2,1
(-4,0, -0,2)
|
1 für Ausgangswert adjustierter Mittelwert
2 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Empagliflozin im Vergleich zu Placebo bei Patienten mit unzureichender Blutzuckerkontrolle unter Metformin und Linagliptin
Bei Patienten mit einer unzureichenden Blutzuckerkontrolle unter Metformin und Linagliptin führte eine 24-wöchige Behandlung mit 10 mg Empagliflozin zu statistisch signifikanten Verbesserungen des HbA1c-Werts, der NPG sowie des Körpergewichts im Vergleich zu Placebo (Hintergrundtherapie Linagliptin 5 mg und Metformin). (Tabelle 3).
Tabelle 3 Wirksamkeitsparameter zum Vergleich zwischen Empagliflozin und Placebo als Zusatztherapie bei Patienten mit unzureichender Blutzuckerkontrolle unter Metformin und Linagliptin 5 mg
|
|
Metformin + Linagliptin 5 mg
| |
|
Empagliflozin
10 mg1
|
Placebo2
| |
HbA1c (%) – 24 Wochen3
| |
N
|
109
|
106
| |
Baseline (Mittelwert)
|
7,97
|
7,96
| |
Veränderung gegenüber Baseline
(adjustierter Mittelwert)
|
-0,65
|
0,14
| |
Unterschied zu Placebo adjustierter Mittelwert
(95% KI)2
|
-0,79
(-1,02, -0,55)
p<0,0001
|
| |
NPG (mg/dL) – 24 Wochen3
| |
N
|
109
|
106
| |
Baseline (Mittelwert)
|
167,9
|
162,9
| |
Veränderung gegenüber Baseline
(adjustierter Mittelwert)
|
-26,3
|
6,1
| |
Unterschied zu Placebo adjustierter Mittelwert (95% KI)
|
-32,4 (-41,7, -23,0)
p<0,0001
|
| |
Körpergewicht – 24 Wochen3
| |
N
|
109
|
106
| |
Baseline (Mittelwert) in kg
|
88,4
|
82,3
| |
Veränderung gegenüber Baseline (adjustierter Mittelwert)
|
-3,1
|
-0,3
| |
Unterschied zu Placebo (adjustierter Mittelwert) (95% KI)1
|
-2,8 (-3,5, -2,1)
p<0,0001
|
|
1 Patienten, die in die Gruppe mit Empagliflozin 10 mg randomisiert wurden, erhielten Empagliflozin 10 mg/Linagliptin 5 mg mit Metformin als Hintergrundtherapie
2 Patienten, die in die Placebogruppe randomisiert wurden, erhielten Placebo plus Linagliptin 5 mg mit Metformin als Hintergrundtherapie
3 Das für das Full Analysis Set (OC) angewendete MMRM-Modell umfasst HbA1c-Ausgangswert, eGFR-Ausgangswert (MDRD-Formel), geographische Region, Untersuchungstermin, Therapie und zeitabhängigen Behandlungseffekt (treatment-by-visit-interaction). Für die NPG ist auch der NPG-Ausgangswert enthalten. Für das Gewicht ist auch der Gewichtsausgangswert enthalten.
Add-on-Therapie zu Insulin
Empagliflozin als Add-on-Therapie zu Basalinsulin
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu Basalinsulin mit oder ohne Metformin und/oder einem Sulfonylharnstoff wurde in einer doppelblinden, placebokontrollierten Studie mit einer Dauer von 78 Wochen untersucht. In den ersten 18 Wochen wurde die Insulindosis stabil gehalten, in den folgenden 60 Wochen konnte die Dosis angepasst werden, um einen NPG-Wert < 110 mg/dl zu erreichen.
Bis zur Woche 18 führte Empagliflozin zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 4).
Nach 78 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme von NPG, des Körpergewichts und des Blutdrucks.
Tabelle 4: Ergebnisse einer placebokontrollierten Studie mit Jardiance als Zusatz zu Basalinsulin mit oder ohne Metformin oder einem Sulfonylharnstoff (Full Analysis Set – Completer) nach 18 bzw. 78 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
125
|
132
|
117
| |
HbA1c (%) in Woche 18
| |
Baseline (Mittelwert)
|
8,10
|
8,26
|
8,34
| |
Veränderung gegenüber Baseline1
|
-0,01
|
-0,57
|
-0,71
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,56* (-0,78, -0,33)
|
-0,70* (-0,93, -0,47)
| |
N
|
112
|
127
|
110
| |
HbA1c (%) in Woche 78
| |
Baseline (Mittelwert)
|
8,09
|
8,27
|
8,29
| |
Veränderung gegenüber Baseline1
|
-0,02
|
-0,48
|
-0,64
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,46* (-0,73, -0,19)
|
-0,62* (-0,90, -0,34)
| |
N
|
112
|
127
|
110
| |
Dosis Basalinsulin (IE/Tag) in Woche 78
| |
Baseline (Mittelwert)
|
47,84
|
45,13
|
48,43
| |
Veränderung gegenüber Baseline1
|
5,45
|
-1,21
|
-0,47
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-6,66** (-11,56, -1,77)
|
-5,92** (-11,00, -0,85)
|
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p <0,025
Empagliflozin als Add-on-Therapie zu multiplen täglichen Insulininjektionen
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu mehrmals täglich verabreichtem Insulin mit oder ohne begleitende Metformin-Therapie wurde in einer doppelblinden, placebokontrollierten Studie mit einer Dauer von 52 Wochen untersucht.
In den ersten 18 Wochen und den letzten 12 Wochen wurde die Insulindosis stabil gehalten, zwischen Woche 19 und 40 jedoch angepasst, um präprandiale Glukosewerte < 100 mg/dl (5,5 mmol/l) und postprandiale Glukosewerte < 140 mg/dl (7,8 mmol/l) zu erreichen.
Bis zur Woche 18 führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 5).
Nach 52 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme der NPG und des Körpergewichts.
Tabelle 5: Ergebnisse zur Wirksamkeit in den Wochen 18 und 52 einer placebokontrollierten Studie zu Empagliflozin als Add-on-Therapie zu mehreren täglichen Dosen Insulin mit oder ohne Metformin
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
188
|
186
|
189
| |
HbA1c (%) in Woche 18
| |
Baseline (Mittel)
|
8,33
|
8,39
|
8,29
| |
Veränderung gegenüber Baseline1
|
-0,50
|
-0,94
|
-1,02
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,44* (-0,61, -0,27)
|
-0,52* (-0,69, -0,35)
| |
N
|
115
|
119
|
118
| |
HbA1c (%) in Woche 522
| |
Baseline (Mittel)
|
8,25
|
8,40
|
8,37
| |
Veränderung gegenüber Baseline1
|
-0,81
|
-1,18
|
-1,27
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,38*** (-0,62, -0,13)
|
-0,46* (-0,70, -0,22)
| |
N
|
113
|
118
|
118
| |
Patienten (%), die HbA1c <7% mit Baseline HbA1c ≥7% in Woche 52 erreichen
|
26,5
|
39,8
|
45,8
| |
N
|
115
|
118
|
117
| |
Insulindosis (IU/Tag) in Woche 522
| |
Baseline (Mittel)
|
89,94
|
88,57
|
90,38
| |
Veränderung gegenüber Baseline1
|
10,16
|
1,33
|
-1,06
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-8,83# (-15,69, -1,97)
|
-11,22**(-18,09, -4,36)
| |
N
|
115
|
119
|
118
| |
Körpergewicht (kg) in Woche 522
| |
Baseline (Mittel)
|
96,34
|
96,47
|
95,37
| |
Veränderung gegenüber Baseline1
|
0,44
|
-1,95
|
-2,04
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-2,39* (-3,54, -1,24)
|
-2,48* (-3,63, -1,33)
|
1 für Ausgangswert adjustierter Mittelwert
2 Woche 19-40: Treat-to-Target-Regime für Insulindosisanpassung, um vordefinierte Blutzucker-Zielwerte (präprandial <100 mg/dl (5,5 mmol/l), postprandial <140 mg/dl (7,8 mmol/l) zu erreichen
* p-Wert <0,0001
** p-Wert = 0,0003
*** p-Wert = 0,0005
# p-Wert = 0,0040
Spezifische Populationen
Patienten mit Nierenfunktionsstörung, 52-Wochen-Daten aus einer placebokontrollierten Studie
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu einer antidiabetischen Behandlung bei Patienten mit Nierenfunktionsstörung wurde in einer doppelblinden placebokontrollierten Studie über eine Dauer von 52 Wochen untersucht. Die Behandlung mit Empagliflozin führte in Woche 24 im Vergleich zu Placebo zu einer statistisch signifikanten Reduktion des HbA1c (Tabelle 6) und zu einer klinisch relevanten Verbesserung der NPG. Die Verbesserung von HbA1c, Körpergewicht und Blutdruck blieb bis zu 52 Wochen lang bestehen.
Tabelle 6: Ergebnisse einer placebokontrollierten Studie mit Jardiance an Patienten mit Typ 2-Diabetes und Nierenfunktionsstörung (Full Analysis Set) nach 24 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin 10 mg
|
Empagliflozin
25 mg
|
Placebo
|
Empagliflozin
25 mg
| |
|
eGFR ≥60 bis
< 90 ml/min/1,73 m²
|
eGFR ≥30 bis
< 60 ml/min/1,73 m²
| |
N
|
95
|
98
|
97
|
187
|
187
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
8,09
|
8,02
|
7,96
|
8,04
|
8,03
| |
Veränderung gegenüber Baseline1
|
0,06
|
-0,46
|
-0,63
|
0.05
|
-0.37
| |
Unterschied zu Placebo1 (95% KI)
|
|
-0,52*
(-0,72; -0,32)
|
-0,68*
(-0,88; -0,49)
|
|
-0.42*
(-0.56, -0.28)
| |
N
|
89
|
94
|
91
|
178
|
175
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
6,7
|
17,0
|
24,2
|
7.9
|
12.0
| |
N
|
95
|
98
|
97
|
187
|
187
| |
Körpergewicht (kg)2
| |
Baseline (Mittelwert)
|
86,00
|
92,05
|
88,06
|
82.49
|
83.22
| |
Veränderung gegenüber Baseline1
|
-0,33
|
-1,76
|
-2,33
|
-0.08
|
-0.98
| |
Unterschied zu Placebo1 (95% KI)
|
|
-1,43
(-2,09; -0,77)
|
-2,00
(-2,66; -1,34)
|
|
-0.91 (-1.41,
-0.41)
| |
N
|
95
|
98
|
97
|
187
|
187
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
134,69
|
137,37
|
133,68
|
136.38
|
136.64
| |
Veränderung gegenüber Baseline1
|
0,65
|
-2,92
|
-4,47
|
0.40
|
-3.88
| |
Unterschied zu Placebo1 (95% KI)
|
|
-3,57
(-6,86; -0,29)
|
-5,12
(-8,41; -1,82)
|
|
-4.28 (-6.88,
-1.68)
|
1 für Ausgangswert adjustierter Mittelwert
2 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Kardiovaskuläre Ergebnisse in Patienten mit manifester kardiovaskulärer Erkrankung
Die EMPA-REG OUTCOME Studie verglich das Risiko kardiovaskulärer Ereignisse in Patienten mit Typ 2 Diabetes mellitus und kardiovaskulärer Vorerkrankung unter Empagliflozin-Behandlung versus Placebo. In diese Studie wurden insgesamt 7020 Patienten mit koronarer Herzkrankheit (Ein- oder Mehrgefässerkrankung), Zustand nach Myokardinfarkt (MI), Zustand nach Schlaganfall und/oder peripherer arterieller Verschlusskrankheit eingeschlossen und für bis zu 4,5 Jahre (mediane Behandlungsdauer 2,6 Jahre und mediane Beobachtungsdauer 3,1 Jahre) zusätzlich zur vorbestehenden Therapie entweder mit Empagliflozin 10 mg (n=2.345), Empagliflozin 25 mg (n=2.342) oder Placebo (n=2.333) behandelt.
Die Population war zu 72,4 % kaukasisch, zu 21,6 % asiatisch und zu 5,1 % schwarz. Das Durchschnittsalter betrug 63 Jahre (9,3 % der Patienten waren ≥75 Jahre), 71,5 % der Patienten waren männlich. Zu Studienbeginn erhielten etwa 81 % der Patienten einen Hemmer des Renin-Angiotensin-Systems, 65 % Betablocker, 43 % Diuretika, 89 % Antikoagulantien und 81 % eine lipidsenkende Medikation. Etwa 74 % der Patienten nahmen bei Studienbeginn Metformin ein, 48 % wendeten Insulin an und 43 % erhielten einen Sulfonylharnstoff. Die EMPA-REG OUTCOME Studie war mit Ausnahme der ersten 12 Wochen nicht für die Messung der glykämischen Wirksamkeit konzipiert, sondern als Glukose-Gleichgewichtsstudie zur Bewertung des kardiovaskulären Endergebnisses ausgelegt. In den ersten 12 Wochen musste die glukosesenkende Basistherapie unverändert bleiben. Nach dieser Anfangsperiode konnte die blutzuckersenkende Behandlung gemäss den aktuellen Therapierichtlinien angepasst werden. Weitere Begleitmedikationen (z.B. für Hypertonie und Dyslipidämie) konnten während der gesamten Studie hinzugefügt oder verändert werden, um die beste Standardbehandlung zu erzielen.
Primärer Endpunkt (bestimmt für beide Empagliflozin-Arme zusammen) war die Zeit bis zum ersten Ereignis des kombinierten Endpunkts aus kardiovaskulären Todesfällen, nicht-tödlichen MI und nicht-tödlichen Schlaganfällen (3-point MACE [Major Adverse Cardiovascular Events]). Alle Endpunktereignisse und Todesfälle wurden von einem unabhängigen, externen, verblindeten Expertengremium (CEC) beurteilt. Gemäss Beurteilungsvorschrift wurden kardiovaskuläre Todesfälle als tödlicher MI, tödlicher Schlaganfall, Tod aufgrund von Herzinsuffizienz (durch Progression oder kardiogenen Schock), plötzlicher Tod oder andere tödliche kardiovaskuläre Ereignisse kategorisiert.
Reduktion des Risikos für kardiovaskuläre Todesfälle und Gesamtmortalität
Empagliflozin war Placebo hinsichtlich des primären Endpunkts überlegen (d.h. bewirkte eine Senkung des Risikos kardiovaskulärer Ereignisse). Die signifikante Reduktion des primären Endpunkts beruhte grossteils auf der deutlichen Senkung der Inzidenz kardiovaskulärer Todesfälle (Tabelle 7 und Abbildung 1) und war nicht vollständig durch Unterschiede in der glykämischen Kontrolle der Behandlungsgruppen zu erklären. Ein präventiver Effekt wurde für alle Kategorien kardiovaskulärer Todesfälle beobachtet. Gleichzeitig wurde das Risiko nicht-tödlicher Myokardinfarkte nicht statistisch signifikant gesenkt. Empagliflozin hatte keinen präventiven Effekt für Schlaganfälle, eine numerische, jedoch nicht signifikante Reduktion wurde bei tödlichen Schlaganfällen (HR 0,72 (95%-KI 0,33-1,55) beobachtet. Für nicht tödliche Schlaganfälle wurde eine numerische, jedoch nicht signifikante Erhöhung beobachtet (HR 1,24 (95%-KI 0,92-1,67) (siehe «Warnhinweise und Vorsichtsmassnahmen»). Resultierend hauptsächlich aus der Reduktion kardiovaskulärer Todesfälle (Empagliflozin bewirkte keine statistisch signifikante Reduktion der nicht-kardiovaskulären Mortalität) verbesserte sich unter Empagliflozin-Behandlung auch die Gesamtmortalität.
Tabelle 7: Behandlungseffekt in Bezug auf den zusammengesetzten primären Endpunkt, seine Komponenten und die Mortalität (Behandelte Population*)
|
|
Placebo
|
Empagliflozin
(10 and 25 mg, gepoolt)
| |
N
|
2333
|
4687
| |
Zeit bis zum ersten Eintreten eines kardiovaskulären Todesfalls, nicht-tödlichen MI oder nicht-tödlichen Schlaganfalls
|
282 (12,1)
|
490 (10,5)
| |
Hazard Ratio vs. Placebo (95,02%-KI)**
|
|
0,86 (0,74; 0,99)
| |
p−Wert für Überlegenheit
|
|
0,0382
| |
Kardiovaskuläre Todesfälle N (%)
|
137 (5,9)
|
172 (3,7)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,62 (0,49; 0,77)
| |
p-Wert
|
|
<0,0001
| |
Nicht-tödliche MI N (%)
|
121 (5,2)
|
213 (4,5)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,87 (0,70; 1,09)
| |
p−Wert
|
|
0,2189
| |
Nicht-tödliche Schlaganfälle N (%)
|
60 (2,6)
|
150 (3,2)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
1,24 (0,92; 1,67)
| |
p−Wert
|
|
0,1638
| |
Gesamtmortalität N (%)
|
194 (8,3)
|
269 (5,7)
| |
Hazard Ratio vs . Placebo (95%-KI)
|
|
0,68 (0,57; 0,82)
| |
p-Wert
|
|
<0,0001
| |
Nicht-kardiovaskuläre Mortalität N (%)
|
57 (2,4)
|
97 (2,1)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,84 (0,60; 1,16)
|
* d.h. Patienten, die mindestens eine Dosis der Studienmedikation erhalten hatten
** Da Daten der Studie in einer Interim-Analyse berücksichtigt wurden, gilt ein zweiseitiges 95,02-%-Konfidenzintervall, das einem p-Wert von kleiner 0,0498 für Signifikanz entspricht.
Abbildung 1 Zeit bis zum erstmaligen Auftreten eines Ereignisses des zusammengesetzten primären Endpunkts (kardiovaskulärer Tod/nicht-tödlicher MI/nicht-tödlicher Schlaganfall)
In einer randomisierten, placebokontrollierten, wirkstoffkontrollierten Crossover-Studie an 30 gesunden Probanden wurde unter 25 mg bzw. 200 mg Empagliflozin kein Anstieg der QTc beobachtet.
Nüchtern-Plasma-Glukose
In vier placebokontrollierten Studien führte die Behandlung mit Empagliflozin als Monotherapie oder Add-on-Therapie zu Metformin oder Metformin plus einem Sulfonylharnstoff zu mittleren Änderungen der NPG gegenüber dem Ausgangswert von -20,5 mg/dl [-1,14 mmol/l] für Empagliflozin 10 mg und von -23,2 mg/dl [-1,29 mmol/l] für Empagliflozin 25 mg im Vergleich zu Placebo (7,4 mg/dl [0,41 mmol/l]). Diese Wirkung wurde nach 24 Wochen beobachtet und hielt für 76 Wochen an.
Postprandialer 2-Stunden-Glukosewert
Die Behandlung mit Empagliflozin als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff führte nach 24 Wochen zu einer klinisch relevanten Abnahme des postprandialen 2-Stunden-Glukosewertes (Mahlzeittoleranztest) (Add-on-Therapie zu Metformin: Placebo +5,9 mg/dl [+0,33 mmol/l], Empagliflozin 10 mg: -46,0 mg/dl [-2,56 mmol/l], Empagliflozin 25 mg: -44,6 mg/dl [-2,5 mmol/l]. Add-on-Therapie zu Metformin und einem Sulfonylharnstoff: Placebo -2,3 mg/dl [-0,13 mmol/l], Empagliflozin 10 mg: -35,7 mg/dl [1,98 mmol/l], Empagliflozin 25 mg: -36,6 mg/dl [2 mmol/l].
Körpergewicht
In einer präspezifizierten gepoolten Analyse von vier placebokontrollierten Studien führte die Behandlung mit Empagliflozin nach 24 Wochen zu einer Abnahme des Körpergewichts (-0,24 kg für Placebo, -2,04 kg für Empagliflozin 10 mg, -2,26 kg für Empagliflozin 25 mg), die bis Woche 52 bestehen blieb (-0,16 kg für Placebo, -1,96 kg für Empagliflozin 10 mg und -2,25 kg für Empagliflozin 25 mg).
Blutdruck
Die Wirksamkeit und Sicherheit von Empagliflozin wurde in einer 12-wöchigen doppelblinden, placebokontrollierten Studie bei Patienten mit Typ-2-Diabetes und Bluthochdruck untersucht, die mit verschiedenen Antidiabetika und bis zu 2 Antihypertensiva behandelt wurden. Die Behandlung mit Empagliflozin einmal täglich führte zu einer statistisch signifikanten Verbesserung des HbA1c und des mit einem 24-Stunden-Monitoring gemessenen mittleren systolischen und diastolischen Blutdrucks (Tabelle 8). Die Behandlung mit Empagliflozin senkte den SBD und DBD im Sitzen.
Tabelle 8: Ergebnisse einer placebokontrollierten Studie mit Jardiance an Patienten mit Typ 2-Diabetes und unkontrolliertem Blutdruck (Full Analysis Set) nach 12 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
271
|
276
|
276
| |
HbA1c (%) in Woche 12
| |
Baseline (Mittelwert)
|
7,90
|
7,87
|
7,92
| |
Veränderung gegenüber Baseline1
|
0,03
|
-0,59
|
-0,62
| |
Unterschied zu Placebo1
(95% KI)
|
|
-0,62* (-0,72, -0,52)
|
-0,65* (-0,75, -0,55)
| |
24-Stunden-SBD in Woche 12
| |
Baseline (Mittelwert)
|
131,72
|
131,34
|
131,18
| |
Veränderung gegenüber Baseline1
|
0,48
|
-2,95
|
-3,68
| |
Unterschied zu Placebo1
(95% KI)
|
|
-3,44* (-4,78, -2,09)
|
-4,16* (-5,50, -2,83)
| |
24-Stunden-DBD in Woche 12
| |
Baseline (Mittelwert)
|
75,16
|
75,13
|
74,64
| |
Veränderung gegenüber Baseline1
|
0,32
|
-1,04
|
-1,40
| |
Unterschied zu Placebo1
(95% KI)
|
|
-1,36** (-2,15, -0,56)
|
-1,72* (-2,51, -0,93)
|
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p < 0,001
In einer präspezifizierten gepoolten Analyse von vier placebokontrollierten Studien führte die Behandlung mit Empagliflozin in Woche 24 zu einer Senkung des systolischen Blutdrucks (Empagliflozin 10 mg: -3,9 mmHg, Empagliflozin 25 mg: -4,3 mmHg) im Vergleich zu Placebo (-0,5 mmHg) und zu einer Senkung des diastolischen Blutdrucks (Empagliflozin 10 mg: -1,8 mmHg, Empagliflozin 25 mg: -2,0 mmHg) im Vergleich zu Placebo (-0,5 mmHg); diese Verbesserungen blieben bis Woche 52 bestehen.
Laboratorparameter
Erhöhter Hämatokrit
In einer Sicherheitsanalyse (alle gepoolten Daten von Patienten mit Diabetes, n=13402) betrugen die mittleren Veränderungen des Hämatokrits gegenüber dem Ausgangswert 3,4% für Empagliflozin 10 mg und 3,6% für Empagliflozin 25 mg im Vergleich zu -0,1% für Placebo. In der EMPA-REG-Outcome-Studie sanken die Hämatokritwerte nach einer Nachbeobachtungsphase von 30 Tagen nach Absetzen der Medikation auf die Ausgangswerte.
Erhöhte Serumlipide
In einer Sicherheitsanalyse (alle gepoolten Daten von Patienten mit Diabetes, n=13402) betrug der mittlere prozentuelle Anstieg gegenüber dem Ausgangswert für Empagliflozin 10 mg bzw. 25 mg im Vergleich zu Placebo bei Gesamtcholesterin 4,9% bzw. 5,7% versus 3,5%; bei HDL-Cholesterin 3,3% bzw. 3,6% versus 0,4%; bei LDL-Cholesterin 9,5% bzw. 10,0% versus 7,5%; bei Triglyzeriden 9,2% bzw. 9,9% versus 10,5%.
Herzinsuffizienz
Empagliflozin bei Patienten mit Herzinsuffizienz und reduzierter Ejektionsfraktion
Es wurde eine randomisierte, doppelblinde, placebokontrollierte Studie (EMPEROR-Reduced) an 3730 Patienten mit chronischer Herzinsuffizienz (New York Heart Association [NYHA] II–IV) und reduzierter Ejektionsfraktion (LVEF ≤40%) zur Beurteilung der Wirksamkeit und Sicherheit von Empagliflozin 10 mg einmal täglich als Add-on zur Herzinsuffizienz-Standardtherapie durchgeführt.
Patienten mit einer eGFR<20 ml/min/1.73m2, extrem fettleibige Personen (BMI ≥45 kg/m2) und Patienten mit LVAD-Implantaten [linksventrikuläre Unterstützungssysteme] wurden von der Studie ausgeschlossen.
Primärer Endpunkt war die Zeit bis zum ersten Ereignis des kombinierten Endpunkts (kardiovaskulärer Tod und Hospitalisierung wegen Herzinsuffizienz). Konfirmatorische Sekundärendpunkte waren das Auftreten von Hospitalisierungen wegen Herzinsuffizienz [HHF] (erstmalig und wiederholt) sowie die Rate der eGFR-Abnahme im Zeitverlauf.
Die Baseline-Therapie bestand aus ACE-Inhibitoren/Angiotensin-Rezeptor-Blockern/Angiotensin-Rezeptor-Neprilysin-Inhibitor (88,3 %), Betablockern (94,7 %), Mineralokortikoid-Rezeptor-Antagonisten (71,3 %), Diuretika (95,0 %), implantierbarem Kardioverter-Defibrillator (ICD) (31,4 %) und kardialer Resynchronisationstherapie (CRT) (11,8 %).
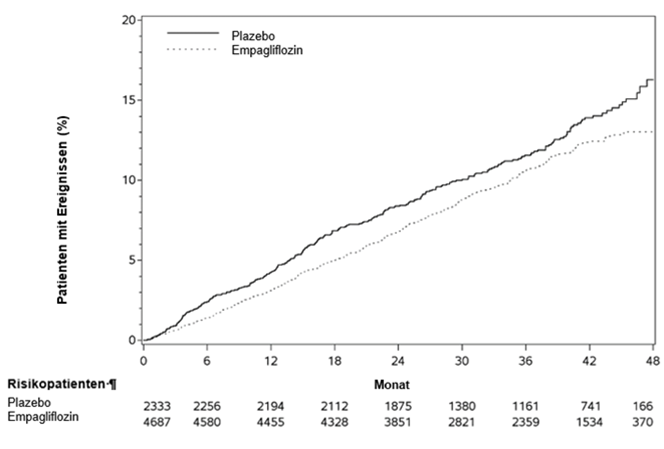
Randomisiert wurden 1863 Patienten mit Empagliflozin 10 mg und 1867 Patienten mit Placebo behandelt und über einen medianen Zeitraum von 15,7 Monaten beobachtet. Das Durchschnittsalter der Studienpopulation (76,1 % männlich) betrug 66,8 Jahre (Bereich: 25–94 Jahre; 26,8 % ≥75 Jahre). Die Mehrheit waren Weisse (70,5%), 18,0 % Asiaten und 6,9 % Schwarze/Afroamerikaner. Der Grossteil der Studienteilnehmer entfiel auf die NYHA-Klasse II (75,1 %; 24,4 % in Klasse III und 0,5 % in Klasse IV). Zu Studienbeginn betrugen die mittlere LVEF 27,5 %, die mittlere eGFR 62,0 ml/min/1,73 m2 und das mediane Verhältnis von Albumin zu Kreatinin im Urin (urinary albumin to creatinine ratio, UACR) 22 mg/g. Etwa die Hälfte der Patienten (51,7 %) hatte eine eGFR von ≥60 ml/min/1,73 m2. Bei 24,1 % der Patienten lag die eGFR zwischen 45 - < 60 ml/min/1,73 m2, bei 18,6 % zwischen 30 - < 45 ml/min/1,73 m2, und bei 5,3 % zwischen 20 - < 30 ml/min/1,73 m2.
Die Behandlung mit Empagliflozin war der Placebo-Behandlung überlegen: Empagliflozin senkte das Risiko des zusammengesetzten primären Endpunkts und die Gesamtanzahl an HHF (erstmalige und wiederholte) signifikant (siehe Tabelle 9).
Tabelle 9: Behandlungseffekt in Bezug auf den zusammengesetzten primären Endpunkt, seine Komponenten und die beiden wichtigsten sekundären Endpunkte in den vorgegebenen Bestätigungstests
|
|
Placebo
|
Empagliflozin 10 mg
| |
N
|
1867
|
1863
| |
Zeit bis zum ersten Eintreten eines kardiovaskulären (KV) Todesfalls oder einer HHF, N (%)
|
462 (24,7)
|
361 (19,4)
| |
Hazard Ratio vs. Placebo (95,04 %-KI)**
|
|
0,75 (0,65, 0,86)
| |
p-Wert für Überlegenheit
|
|
< 0,0001
| |
Kardiovaskulärer (KV) Tod, N (%)*
|
202 (10,8)
|
187 (10,0)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,92 (0,75, 1,12)
| |
p-Wert
|
|
0,4113
| |
HHF (erstmaliges Eintreten), N (%)*
|
342 (18,3)
|
246 (13,2)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,69 (0,59, 0,81)
| |
p-Wert
|
|
< 0,0001
| |
HHF (erstmalig und wiederholt), N der Ereignisse
|
553
|
388
| |
Hazard Ratio vs. Placebo (95,04 %-KI)**
|
|
0,70 (0,58, 0,85)
| |
p-Wert
|
|
0,0003
| |
eGFR (CKD EPI)cr-Veränderungsrate, Rate der Abnahme (ml/min/1,73 m2/Jahr)
|
-2,28
|
-0,55
| |
Behandlungsunterschied vs. Placebo (99,9 %-KI)***
|
|
1,73 (0,67, 2,80)
| |
p-Wert
|
|
p < 0,0001
|
KV = kardiovaskulär, HHF = Hospitalisierung aufgrund von Herzinsuffizienz, eGFR = geschätzte glomeruläre Filtrationsrate, CKD EPI = Chronic Kidney Disease Epidemiology Collaboration Equation
* Nicht auf Fehler erster Art hin überprüft
** Aufgrund einer Interim-Analyse wurde ein zweiseitiges 95,04%-Konfidenzintervall angewendet, das einem p-Wert von kleiner 0,0496 für Signifikanz entspricht. KV-Tod- und HHF-Ereignisse wurden von einem unabhängigen Gremium zur Beurteilung klinischer Ereignisse anerkannt und basierend auf der randomisierten Gruppe analysiert.
*** Wie im statistischen Testverfahren vorgegeben, wurde ein zweiseitiges 99,9 %-Konfidenzintervall angewendet, das einem p-Wert von kleiner 0,001 für Signifikanz entspricht; die Rate der Veränderung der eGFR wurde basierend auf der behandelten Gruppe analysiert.
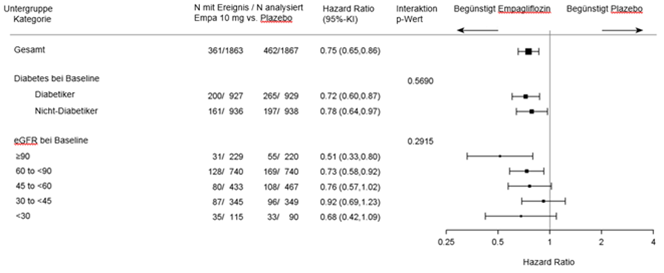
Die Subgruppenanalyse ergab keine signifikanten Unterschiede des Behandlungseffekts für den primären Endpunkt (HR konsistent <1) in Abhängigkeit von den vordefinierten Parametern, wie z.B. vom glykämischer Status (Vorliegen eines Typ-2-Diabetes oder nicht) und Grad der Einschränkung der Nierenfunktion (einschliesslich schwerwiegender Einschränkung eGFR < 30 ml/min/1.73m2 [siehe Ausschlusskriterien]).
Nierenbezogenes Ergebnis
Die Behandlung mit Empagliflozin verlangsamte die Progression der Einschränkung der Nierenfunktion (Abnahme der eGFR über den Behandlungszeitraum; siehe Tabelle 9).
Empagliflozin bei Patienten mit Herzinsuffizienz und erhaltener Auswurffraktion
Eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Studie (EMPEROR-Preserved) untersuchte die Wirksamkeit und Sicherheit von Empagliflozin 10 mg einmal täglich als Ergänzung zur Standardtherapie an Patienten mit symptomatischer chronischer Herzinsuffizienz (NYHA-Funktionsklasse II-IV) und einer Auswurffraktion (LVEF) >40 %. Extrem fettleibige Personen (BMI ≥45 kg/m2) und Patienten mit LVAD-Implantaten [linksventrikuläre Unterstützungssysteme] wurden von der Studie ausgeschlossen.
Primärer (zusammengesetzter) Endpunkt war die Zeit bis zum ersten Auftreten eines der folgenden Ereignisse: kardiovaskulärer (KV) Tod oder Hospitalisierung wegen Herzinsuffizienz (HHF). Hauptsekundärendpunkte waren HHF generell (erste und erneute) und die Steilheit des Abfalls der eGFR(CKD-EPI)cr während der Studie (Veränderung gegenüber Baseline). Der Grossteil der Studienteilnehmer wurde bereits mit einem ACE-Hemmer/Angiotensinrezeptorblocker/Angiotensinrezeptor-Neprilysin-Inhibitor (80,7 %), Betablocker (86,3 %), Mineralokortikoidrezeptor-Antagonisten (37,5 %) und Diuretika (86,2 %) behandelt.
Insgesamt wurden 5988 Patienten (55,3% männlich; 75,9% «Weisse», 13,8 % «Asiaten» und 4,3 % «Schwarze/Afrikaner») mit einem Altersdurchschnitt von 71,9 Jahren (43,0 % ≥75 Jahre) randomisiert mit Empagliflozin 10 mg (N=2997) bzw. Placebo (N=2991) behandelt und über einen Zeitraum von median 26,2 Monaten beobachtet.
Zu Studienbeginn wies je ca. ein Drittel der Patienten eine LVEF von <50 % (33,1 %), 50 bis <60 % (34,4 %) bzw. ≥60 % (32,5 %) auf. Die überwiegende Mehrheit der Patienten (81,5 %) war in NHYHA Klasse II (18,1 % bzw. 0,3 % in NYHA Klasse III bzw. IV). Die mittlere eGFR und der mediane Albumin-Kreatinin-Quotient im Urin (UACR) lagen bei 60,6 ml/min/1,73 m2 und 21 mg/g. Etwa die Hälfte der Patienten (50,1 %) wies eine eGFR von ≥60 ml/min/1,73 m2, 26,1 % eine eGFR von 45 bis <60 ml/min/1,73 m2, 18,6% eine eGFR von 30 bis <45 ml/min/1,73 m2 und 4,9 % eine eGFR von 20 bis <30 ml/min/1,73 m2 auf.
Empagliflozin war bei der Risikoreduktion für den zusammengesetzten primären Endpunkt (kardiovaskulärer Tod oder Hospitalisierung aufgrund von Herzinsuffizienz) der Placebobehandlung überlegen. Darüber hinaus reduzierte Empagliflozin signifikant das Risiko für das Auftreten von HHF (erste und erneute) und reduzierte auch signifikant die Rate der eGFR-Abnahme (siehe Tabelle 10).
Tabelle 10: Behandlungseffekt für den zusammengesetzten primären Endpunkt, seine Komponenten und die beiden wichtigen sekundären Endpunkte, die in die vordefinierten Bestätigungstests einbezogen wurden
|
|
Placebo
|
Empagliflozin 10 mg
| |
n
|
2991
|
2997
| |
Zeit bis zum ersten Ereignis (KV-Tod oder HHF), n (%)
|
511 (17,1)
|
415 (13,8)
| |
Hazard Ratio vs. Placebo (95,03%-KI)**
|
|
0,79 (0,69, 0,90)
| |
p-Wert für Überlegenheit
|
|
0,0003
| |
KV-Tod, n (%)*
|
244 (8,2)
|
219 (7,3)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,91 (0.76, 1,09)
| |
p-Wert
|
|
0,2951
| |
HHF (erstes Auftreten), n (%)*
|
352 (11,8)
|
259 (8,6)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,71 (0,60, 0,83)
| |
p-Wert
|
|
<0,0001
| |
HHF (erste und erneute), Anzahl der Ereignisse
|
541
|
407
| |
Hazard Ratio vs. Placebo (95,03%-KI)**
|
|
0,73 (0,61, 0,88)
| |
p-Wert
|
|
0,0009
| |
eGFR (CKD-EPI)cr-Slope, Rate der Abnahme (ml/min/1,73m2/Jahr)
|
−2,62
|
−1,25
| |
Behandlungsunterschied vs. Placebo (99,9%-KI)***
|
|
1,36 (0,86, 1,87)
| |
p-Wert
|
|
<0,0001
|
KV = kardiovaskulär, HHF = Hospitalisierung aufgrund von Herzinsuffizienz, eGFR = geschätzte glomeruläre Filtrationsrate, CKD-EPI = Chronic Kidney Disease Epidemiology Collaboration-Formel
*nicht auf Fehler Typ 1 kontrolliert
**Aufgrund einer Zwischenanalyse wurde ein beidseitiges 95,03%-Konfidenzintervall angewandt, was einem p-Wert von weniger als 0,0497 für die Signifikanz entspricht. Die Ereignisse KV-Tod und HHF wurden von einer unabhängigen Kommission für klinische Ereignisse beurteilt und auf der Grundlage des randomisierten Sets analysiert.
***Wie im statistischen Testverfahren vordefiniert, wurde ein beidseitiges 99,9%-Konfidenzintervall angewandt, was einem p-Wert von weniger als 0,001 für die Signifikanz entspricht. Der eGFR-Slope wurde auf der Grundlage des behandelten Sets analysiert.
Abbildung 2: Zeit bis zum ersten Ereignis (adjudizierter KV-Tod oder adjudizierte HHF)
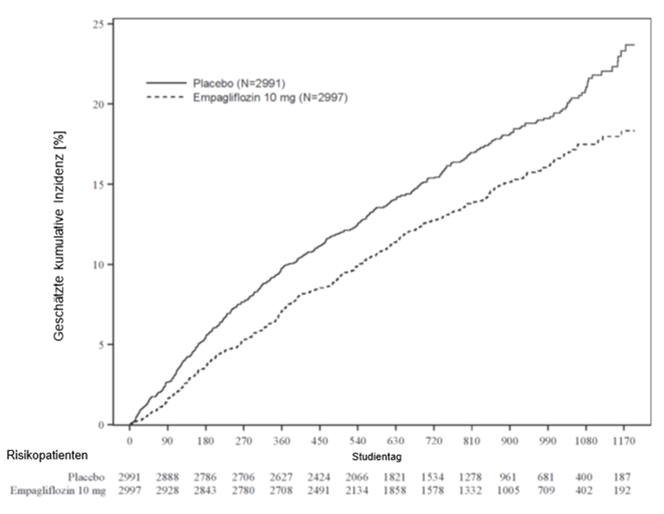
Die Ergebnisse für den zusammengesetzten primären Endpunkt waren für alle vordefinierten Subgruppen konsistent, unter anderem für die Subgruppen in Abhängigkeit von LVEF (siehe Abbildung 3).
Abbildung 3: Subgruppenanalysen für die Zeit bis zum ersten Ereignis (adjudizierter KV-Tod oder adjudizierte HHF)
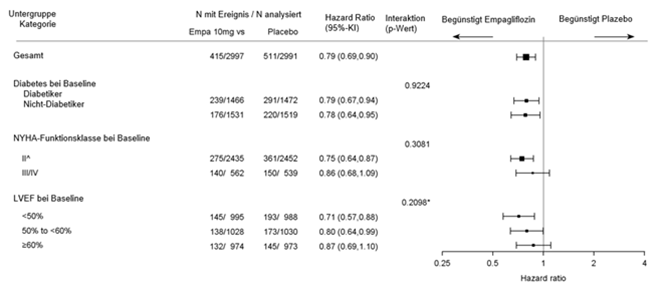
^4 Patienten mit NYHA-Funktionsklasse I werden zur Subgruppe NYHA-Funktionsklasse II gezählt
*Trendtest
Renaler Endpunkt
Während der Behandlungsphase nahm die eGFR in der Empagliflozin-Gruppe signifikant langsamer ab als in der Placebo-Gruppe (siehe Tabelle 10).
Chronische Nierenerkrankung
Eine randomisierte, doppelblinde, placebokontrollierte Studie zu Empagliflozin 10 mg einmal täglich (EMPA-KIDNEY) wurde bei 6609 Patienten mit chronischer Nierenerkrankung (eGFR ≥20–< 45 ml/min/1,73 m2 oder eGFR ≥45–< 90 ml/min/1,73 m2 mit einem Verhältnis von Albumin zu Kreatinin im Urin [urinary albumin to creatinine ratio, UACR] ≥200 mg/g) zur Beurteilung kardiorenaler Endpunkte als Add-on-Therapie zur Standardtherapie durchgeführt. Bei Patienten, die während der Studie dialysepflichtig wurden, konnte die Behandlung fortgesetzt werden. Zusammengesetzter primärer Endpunkt war die Zeit bis zum ersten Eintreten einer Progression der chronischen Nierenerkrankung (CKD; anhaltende Abnahme der eGFR um ≥40 % nach Randomisierung, anhaltende eGFR von < 10 ml/min/1,73 m², terminale Niereninsuffizienz oder renaler Tod) oder des kardiovaskulären (CV) Todes. Hospitalisierung unabhängig von der Ursache (erstmalig und wiederholt), erstes Eintreten einer Hospitalisierung wegen Herzinsuffizienz, kardiovaskulärer Tod und die Gesamtmortalität wurden in das bestätigende Testverfahren einbezogen. Der Grossteil der eingeschlossenen Patienten wurde zu Studienbeginn mit RAAS-Inhibitoren behandelt (85,2 % ACE-Hemmer oder Angiotensin-Rezeptor-Blocker).
Es wurden ingesamt 3304 bzw. 3305 Patienten randomisiert mit Empagliflozin 10 mg bzw. Placebo behandelt und über eine mediane Dauer von 24,3 Monaten beobachtet. Die Studienpopulation umfasste 66,8 % Männer und 33,2 % Frauen mit einem mittleren Alter von 63,3 Jahren (Spanne: 18–94 Jahre), 58,4 % davon waren weiss, 36,2 % asiatisch und 4,0 % schwarz/afroamerikanisch.
Zu Studienbeginn betrug die mittlere eGFR 37,3 ml/min/1,73 m2 (~78% mit einee eGFR < 45 ml/min/1,73 m2). Das mediane UACR betrug 329 mg/g. Die Hauptursachen chronischer Nierenerkrankung waren diabetische Nephropathie/diabetische Nierenerkrankung (31 %), Glomerulopathie (25 %), hypertensive/renovaskuläre Erkrankung (22 %).
Empagliflozin war Placebo bezüglich der Senkung des Risikos des primären zusammengesetzten Endpunktes aus Progression der CKD oder CV Tod überlegen. In einer vordefinierten Analyse reduzierte die Behandlung mit Empagliflozin das Risiko von terminaler Niereninsuffizienz oder CV Tod im Vergleich zu Placebo um 28 % (HR 0,72, 95%-KI 0,59 bis 0,89, nomineller p = 0,0017). Zusätzlich reduzierte Empagliflozin das Risiko von Hospitalisierung unabhängig von der Ursache signifikant (erstmalige und wiederholte) (siehe Tabelle 11).
Tabelle 11: Behandlungseffekt in Bezug auf den primären zusammengesetzten und wichtige sekundäre Endpunkte (Empa-KIDNEY), die in die vorgegebenen Bestätigungstests und ihre Komponenten aufgenommen wurden
|
|
Placebo
|
Empagliflozin 10 mg
| |
N
|
3305
|
3304
| |
Zeit bis zum ersten Eintreten einer Progression der Nierenerkrankung (anhaltende Abnahme der eGFR um ≥40 % nach Randomisierung, anhaltende eGFR von < 10 ml/min/1,73 m², terminale Niereninsuffizienz* oder renaler Tod) oder von kardiovaskulärem Tod, N (%)
|
558 (16,9)
|
432 (13,1)
| |
Hazard Ratio vs. Placebo (99,83 %-KI)
|
|
0,72 (0,59, 0,89)
| |
p-Wert für Überlegenheit
|
|
< 0,0001
| |
Anhaltende Abnahme der eGFR um ≥40 % nach Randomisierung, N (%)
|
474 (14,3)
|
359 (10,9)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,70 (0,61, 0,81)
| |
p-Wert
|
|
< 0,0001
| |
Terminale Niereninsuffizienz* oder anhaltende eGFR < 10 ml/min/1,73 m², N (%)
|
222 (6,7)
|
157 (4,8)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,68 (0,55, 0,84)
| |
p-Wert
|
|
0,0002
| |
Renaler Tod, N (%)**
|
4 (0,1)
|
4 (0,1)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
| |
p-Wert
|
|
| |
Kardiovaskulärer Tod, N (%)
|
70 (2,1)
|
59 (1,8)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,83 (0,59, 1,17)
| |
p-Wert
|
|
0,2932
| |
Eintreten von Hospitalisierung unabhängig von der Ursache (erstmalige und wiederholte), N der Ereignisse
|
1895
|
1612
| |
Hazard Ratio vs. Placebo (99,03 %-KI)
|
|
0,86 (0,76, 0,98)
| |
p-Wert
|
|
0,0022
| |
Zeit bis zum Tod jeder Ursache, N (%)
|
168 (5,1)
|
149 (4,5)
| |
Hazard Ratio vs. Placebo (97,1 %-KI)
|
|
0,87 (0,68, 1,11)
| |
p-Wert
|
|
0,2122
|
HHF = Hospitalisierung wegen Herzinsuffizienz, eGFR = geschätzte glomeruläre Filtrationsrate
* Terminale Niereninsuffizienz ist definiert als Beginn der bleibenden Dialysepflicht oder Erhalt eines Nierentransplantats.
** Es traten zu wenige Fälle von renalem Tod auf, um eine zuverlässige Hazard Ratio berechnen zu können.
Abbildung 4: Zeit bis zum ersten Eintreten von Progression der Nierenerkrankung oder adjudiziertem kardiovaskulärem Tod*
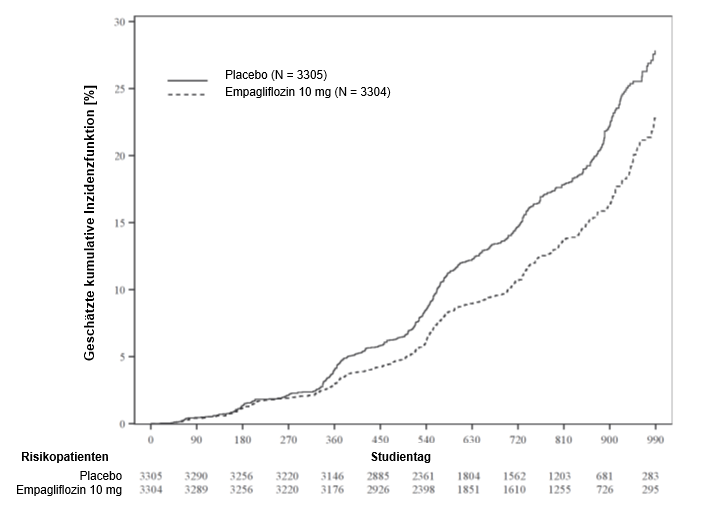
*geschätzte kumulative Inzidenzfunktion
Die Ergebnisse des primären zusammengesetzten Endpunkts waren über die vordefinierten Subgruppen, einschliesslich eGFR-Kategorien, Ursache der Nierenerkrankung, Diabetesstatus oder begleitende Anwendung von RAAS-Inhibitoren, allgemein konsistent. Der Behandlungsnutzen war bei Patienten mit höheren Albuminurie-Werten stärker ausgeprägt.
Empagliflozin verlangsamte die jährliche Rate der eGFR-Abnahme im Vergleich zu Placebo um 1,38 ml/min/1,73 m2/Jahr (95 %-KI 1,16, 1,59) basierend auf einer vordefinierten Analyse aller eGFR-Messungen, die ab dem Besuchstermin in Monat 2 bis zum letzten Nachbeobachtungstermin erfolgten.
Kinder und Jugendliche
Die klinische Wirksamkeit und Sicherheit von Empagliflozin 10 mg mit einer möglichen Dosiserhöhung auf 25 mg oder Linagliptin 5 mg einmal täglich wurde bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit T2DM im Rahmen einer doppelblinden, randomisierten, placebokontrollierten Parallelgruppenstudie (DINAMO) über einen Zeitraum von 26 Wochen untersucht, mit einer Verlängerungsphase mit doppelblinder wirkstoffhaltiger Behandlung zur Beurteilung der Sicherheit bis zu 52 Wochen.
Insgesamt 157 Patienten wurden entweder mit Empagliflozin (10 mg oder 25 mg; N = 52), Linagliptin (N = 52) oder Placebo (N = 53) behandelt. Zu den Hintergrundtherapien als Ergänzung zu diätetischen Massnahmen und körperlicher Aktivität gehörten Metformin (51 %), eine Kombination aus Metformin und Insulin (40,1 %), Insulin (3,2 %) oder aber es wurde keine Hintergrundtherapie verabreicht (5,7 %). Der mittlere HbA1c-Baselinewert lag bei 8,03 %. Die Studienpopulation umfasste 38,2 % männliche und 61,8 % weibliche Patienten bei einem Durchschnittsalter von 14,5 Jahren (Spanne: 10 bis 17 Jahre); 51,6 % waren mindestens 15 Jahre alt. Die Studienpopulation setzte sich ausserdem wie folgt zusammen: 49,7 % waren kaukasischer, 5,7 % asiatischer und 31,2 % afrikanischer/afroamerikanischer Herkunft. Der mittlere BMI betrug 36,04 kg/m², das mittlere Körpergewicht 99,92 kg. In die DINAMO-Studie wurden ausschliesslich Patienten mit einer eGFR ≥60 ml/min/1,73 m² aufgenommen.
Empagliflozin war Placebo hinsichtlich des primären Endpunkts – HbA1c-Reduktion nach 26 Wochen gegenüber Baseline – unabhängig von einer Bedarfsbehandlung oder einem Behandlungsabbruch, überlegen. Darüber hinaus führte die Behandlung mit Jardiance zu einer klinisch bedeutsamen FPG-Reduktion (Tabelle 12).
Tabelle 12: Ergebnisse einer 26-wöchigen placebokontrollierten Studie zu Empagliflozin bei Kindern und Jugendlichen mit Typ-2-Diabetes (modifiziertes Intention-To-Treat-Set)
|
|
Placebo
|
Empagliflozin
(10 und 25 mg, gepoolt)
| |
N
|
53
|
52
| |
HbA1c (%)¹
| |
Baseline (Mittelwert)
|
8,05
|
8,00
| |
Veränderung gegenüber Baseline²
|
0,68
|
-0,17
| |
Unterschied zu Placebo² (95%-KI)
|
|
-0,84
(-1,50, -0,19)
| |
p-Wert für Überlegenheit
|
|
0,0116
| |
N
|
52
|
48
| |
FPG (mg/dl) [mmol/l] 3,4
| |
Baseline (Mittelwert)
|
158,6 [8,80]
|
154,4 [8,57]
| |
Veränderung gegenüber Baseline²
|
15,7 [0,87]
|
-19,5 [-1,08]
| |
Unterschied zu Placebo² (95%-KI)
|
|
-35,2 (-58,6, -11,7)
[-1,95 (-3,25, -0,65)]
| |
nominaler p-Wert
|
|
0,0035
|
¹ Mehrfachimputation mit 500 Iterationen für fehlende Daten
² Im Hinblick auf Baseline und Stratifizierung adjustierter Mittelwert
³ Last Observation Carried Forward (LOCF), einschliesslich Baseline-Werte
4 nicht im Hinblick auf statistische Signifikanz beurteilt; nicht Teil des sequentiellen Testverfahrens
PharmakokinetikAbsorption
Die Pharmakokinetik von Empagliflozin wurde an gesunden Freiwilligen und T2DM-Patienten umfassend untersucht. Nach oraler Gabe wurde Empagliflozin schnell resorbiert, wobei die maximalen Plasmakonzentrationen (mediane tmax) 1,5 Stunden nach Einnahme der Dosis auftraten. Danach erfolgte eine biphasische Abnahme der Plasmakonzentrationen mit einer raschen Verteilungsphase und einer relativ langsamen terminalen Phase. Bei einmal täglicher (qd) Gabe von 10 mg Empagliflozin betrug die mittlere Plasma-AUC im Steady State 1,870 nmol.h/l und die Cmax 259 nmol/l. Bei einmal täglicher (qd) Gabe von 25 mg Empagliflozin betrug die mittlere Plasma-AUC im Steady State 4740 nmol.h/l und die Cmax 687 nmol/l. Die systemische Exposition von Empagliflozin stieg im Bereich von 10mg-100mg dosisproportional an. Die Pharmakokinetik von Empagliflozin ist in Bezug auf die Zeit linear. Die Pharmakokinetik von Empagliflozin bei gesunden Freiwilligen und Patienten mit Typ-2-Diabetes mellitus wies keine klinisch relevanten Unterschiede auf.
Die Gabe von 25 mg Empagliflozin nach Einnahme einer fett- und kalorienreichen Mahlzeit führte zu einer geringfügigen Abnahme der Bioverfügbarkeit; die AUC nahm im Vergleich zum nüchternen Zustand um etwa 16% ab, die Cmax um etwa 37%. Der beobachtete Einfluss von Nahrung auf die Pharmakokinetik von Empagliflozin wurde als nicht klinisch relevant eingestuft und Empagliflozin kann mit oder ohne Nahrung eingenommen werden.
Distribution
Das scheinbare Verteilungsvolumen im Steady State wurde auf Grundlage einer Populationspharmakokinetischen Analyse auf 73,8 l geschätzt. Nach oraler Verabreichung einer [14C]-Empagliflozin-Lösung an gesunde Probanden betrug die Erythrozytenpartitionierung etwa 36,8% und die Plasmaproteinbindung 86,2%.
Metabolismus
In einer Studie mit [14C]-markiertem Empagliflozin konnte der grösste Anteil der totalen Radioaktivität im Plasma unverändertem Empagliflozin zugeordnet werden.
Die häufigsten Metaboliten waren drei Glucuronidkonjugate (2-O-, 3-O- und 6-O-Glucuronid). Die systemische Exposition jedes Metaboliten betrug weniger als 10% der gesamten Radioaktivität im Plasma. Invitro-Studien deuten darauf hin, dass Empagliflozin beim Menschen primär über Glucuronidierung durch die Uridin-5'-diphosphat-Glucuronosyltransferasen UGT2B7, UGT1A3, UGT1A8 und UGT1A9 metabolisiert wird.
Elimination
Auf Grundlage der populationspharmakokinetischen Analyse wurde die apparente terminale Eliminationshalbwertszeit von Empagliflozin auf 12,4 Stunden geschätzt, die scheinbare orale Clearance betrug 10,6 l/h. Die Interindividualvariabilität der oralen Clearance von Empagliflozin betrug 39,1%. Bei einmal täglicher Dosierung von Empagliflozin wurden Steady-State-Plasmakonzentrationen mit der fünften Dosis erreicht. In Übereinstimmung mit der Halbwertszeit wurde im Steady State eine Akkumulation von bis zu 22% in Bezug auf die Plasma-AUC beobachtet. Nach oraler Verabreichung einer [14C]-Empagliflozin-Lösung an gesunde Probanden wurden etwa 41,2% der Radioaktivität in den Fäzes und 54,4% im Urin ausgeschieden. Der Hauptanteil der in den Fäzes wiedergefundenen Radioaktivität (82,9%) und 43,5% der im Urin ausgeschiedenen Radioaktivität war unveränderte Muttersubstanz.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Bei Patienten mit leichter, mittelschwerer und schwere Leberfunktionsstörung gemäss Child-Pugh-Klassifikation nahm die AUC von Empagliflozin im Vergleich zu Patienten mit normaler Leberfunktion um etwa 23%, 47% bzw. 75% und die Cmax um etwa 4%, 23% bzw. 48% zu. Auf Grundlage der pharmakokinetischen Daten ist für Patienten mit Leberfunktionsstörung keine Dosisanpassung erforderlich.
Nierenfunktionsstörungen
Bei Patienten mit leichter (eGFR: 60 - <90 ml/min/1,73 m2), mittelschwerer (eGFR: 30 - <60 ml/min/1,73 m2) und schwerer (eGFR: <30 ml/min/1,73 m2) Nierenfunktionsstörung und Patienten mit Nierenversagen/terminaler Niereninsuffizienz nahm die AUC von Empagliflozin im Vergleich zu Patienten mit normaler Nierenfunktion um etwa 18%, 20%, 66%, bzw. 48% zu. Die maximalen Plasmakonzentrationen von Empagliflozin waren bei Patienten mit mittelschwerer Nierenfunktionsstörung und Nierenversagen/terminaler Niereninsuffizienz und Patienten mit normaler Nierenfunktion vergleichbar. Die maximalen Plasmakonzentrationen von Empagliflozin waren bei Patienten mit leichter und schwerer Nierenfunktionsstörung im Vergleich zu Patienten mit normaler Nierenfunktion um annähernd 20% höher. In Übereinstimmung mit der Phase-I-Studie zeigte die populationspharmakokinetische Analyse, dass die Abnahme der eGFR mit einer Abnahme der scheinbaren oralen Clearance von Empagliflozin einherging und zu einem Anstieg der systemischen Exposition führte. Auf Grundlage der pharmakokinetischen Daten ist für Patienten mit Niereninsuffizienz keine Dosisanpassung erforderlich.
Body Mass Index (BMI)
Eine Dosisanpassung auf Grundlage des BMI ist nicht erforderlich. Auf Grundlage der populationspharmakokinetischen Analyse hat der Body Mass Index keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Empagliflozin.
Geschlecht
Eine geschlechtsspezifische Dosisanpassung ist nicht erforderlich. Auf Grundlage der populationspharmakokinetischen Analyse hat das Geschlecht keine klinisch relevanten Auswirkungen auf die Pharmakokinetik von Empagliflozin.
Ethnische Zugehörigkeit
Auf Grundlage der populationspharmakokinetischen Analyse wurde die AUC bei asiatischen Patienten mit einem BMI von 25 kg/m2 um 13,5% höher geschätzt als bei nichtasiatischen Patienten mit einem BMI von 25 kg/m2.
Ältere Patienten
Auf Grundlage der populationspharmakokinetischen Analyse hat das Alter keinen klinisch relevanten Einfluss auf die Pharmakokinetik von Empagliflozin.
Kinder und Jugendliche
Die Pharmakokinetik und Pharmakodynamik einer Einzeldosis Empagliflozin 5 mg, 10 mg und 25 mg wurden bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit T2DM untersucht. Die beobachtete Pharmakokinetik und das Pharmakokinetik-Pharmakodynamik-Verhältnis (Glukoseausscheidung im Urin) bei erwachsenen und pädiatrischen Patienten war nach Berücksichtigung signifikanter Kovariaten vergleichbar.
Die Pharmakokinetik und Pharmakodynamik (HbA1c-Veränderung gegenüber Baseline) von Empagliflozin 10 mg mit einer möglichen Dosiserhöhung auf 25 mg wurden bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit T2DM untersucht. Die beobachtete Expositions-Wirkungs-Beziehung war bei Erwachsenen, Kindern und Jugendlichen im Allgemeinen vergleichbar. Die perorale Verabreichung von Empagliflozin führte zu einer Exposition innerhalb des bei erwachsenen Patienten beobachteten Bereichs. Die beobachteten geometrischen Mittelwerte für die Talkonzentration und die Konzentration 1,5 Stunden nach der Verabreichung im Steady-State betrugen 26,6 nmol/l bzw. 308 nmol/l unter Empagliflozin 10 mg einmal täglich und 67,0 nmol/l bzw. 525 nmol/l unter Empagliflozin 25 mg einmal täglich.
Präklinische DatenIn Studien zur allgemeinen Toxizität bei Nagern und Hunden wurden Anzeichen einer Toxizität nach Expositionen beobachtet, die zumindest dem 10fachen der klinischen Dosis von 25 mg entsprachen. Die Toxizität stimmte zumeist mit der sekundären pharmakologischen Wirkung in Zusammenhang mit der Ausscheidung von Zucker im Urin überein und umfasste Gewichts- und Körperfettverlust, erhöhte Nahrungsaufnahme, Diarrhoe, Dehydrierung, Abnahme der Serumglukose und Anstieg anderer Serum-Parameter, die auf einen verstärkten Proteinmetabolismus, Glukoneogenese und Elektrolytungleichgewicht hinweisen, Veränderungen des Urins (z.B. Polyurie und Glukosurie) und mikroskopische Veränderungen in der Niere (einschliesslich tubulärer Dilatation sowie Mineralisation der Tubuli und des Nierenbeckens).
Empagliflozin ist nicht genotoxisch.
Empagliflozin führte bei weiblichen Ratten bis zur höchsten Dosierung von 700 mg/kg/Tag (dies entspricht etwa dem 72-Fachen der klinischen Exposition auf Basis der AUC bei einer Dosis von 25 mg) zu keiner erhöhten Tumorinzidenz. Bei männlichen Ratten wurden bei einer Dosierung von 700 mg/kg/Tag (dies entspricht etwa dem 42-Fachen der klinischen Exposition bei einer Dosis von 25 mg) behandlungsbedingte gutartige proliferative Gefässläsionen (Hämangiome) der mesenterischen Lymphknoten festgestellt. Diese Tumore kommen bei Ratten häufig vor und sind für den Menschen wahrscheinlich nicht von Relevanz.
Bei Dosierungen von 300 (entsprechend dem 26-Fachen der klinischen Exposition (AUC) bei einer Dosis von 25 mg) und 700 mg/kg/Tag wurden behandlungsbedingte gutartige testikuläre (Leydig-Zwischenzellen) Tumoren beobachtet. Diese Tumoren werden als höchstwahrscheinlich nicht relevant für den Menschen eingestuft.
Empagliflozin führte bei weiblichen CD-1 Mäusen bis zu einer Dosierung von 1000 mg/kg/Tag (dies entspricht etwa dem 62-Fachen der klinischen Exposition bei einer Dosis von 25 mg) zu keiner erhöhten Tumorinzidenz.
Bei männlichen Mäusen, die Empagliflozin in einer Dosierung von 1000 mg/kg/Tag (dies entspricht etwa dem 44-Fachen der klinischen Exposition bei einer Dosis von 25 mg) erhielten, traten Nierentumore auf. Der Wirkmechanismus, welcher der Entstehung dieser Tumoren zugrunde liegt, ist von der natürlichen Prädisposition der männlichen CD-1-Maus für Nierenerkrankungen sowie von einem Stoffwechselweg, welcher beim Menschen so nicht vorliegt, abhängig. Daher werden die bei männlichen CD-1-Mäusen beobachteten Nierentumore als für den Menschen wahrscheinlich nicht relevant eingestuft.
Während der Organogenese verabreichtes Empagliflozin war bei Ratten und Kaninchen in Dosen bis zu 300 mg/kg (dies entspricht etwa dem 48-Fachen bzw. dem 128-Fachen der klinischen Exposition auf Basis der AUC bei einer Dosis von 25 mg) nicht teratogen. Dosen von Empagliflozin, die bei der Ratte maternale Toxizität verursachten, führten nach Expositionen, die etwa dem 155-Fachen der klinischen Exposition bei einer Dosis von 25 mg entsprachen, auch zu Fehlbildungen (gekrümmte Extremitätenknochen). Dosen, die bei Kaninchen maternale Toxizität verursachten, führten bei einer Dosierung, die etwa dem 139-Fachen der klinischen Exposition bei einer Dosis von 25 mg entsprachen, auch zu einem Anstieg der embryofetalen Letalität.
In prä- und postnatalen Toxizitätsstudien an Ratten wurde bei den Jungen bei einer maternalen Exposition, die etwa dem 4-Fachen der klinischen Exposition bei einer Dosis von 25 mg entsprach, eine reduzierte Gewichtszunahme beobachtet.
Bei einer Toxizitätsstudie mit Jungratten wurde in weiblichen und männlichen Tieren bei einer Gabe von Empagliflozin von Tag 21 bis Tag 90 nach der Geburt eine nichtschädliche minimale aber Dosis-abhängige und nicht reversible renale Mineralisierung der Tubuli ab einer Dosis von 10mg/kg/Tag (entsprechend etwa dem 0.6-Fachen der klinischen Exposition bei einer Dosis von 25 mg) beobachtet. Eine minimale bis leichte renal-tubuläre und pelvine Dilatation wurde nur bei 100 mg/kg/Tag beobachtet (entsprechend etwa dem 13-fachen der klinischen Dosis von 25 mg), welche aber nach einer 13-wöchigen Regenerationsphase ohne Arzneimittelgabe nicht mehr feststellbar war.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25°C) und ausser Reichweite von Kindern lagern.
Zulassungsnummer63227 (Swissmedic)
PackungenFilmtabletten zu 10 mg: 30 und 90 (B)
Filmtabletten zu 25 mg: 30 und 90 (B)
ZulassungsinhaberinBoehringer Ingelheim (Schweiz) GmbH, Basel
Stand der InformationJuli 2025
|





