Eigenschaften/WirkungenATC-Code
A10BK03
Wirkungsmechanismus / Pharmakodynamik
Empagliflozin ist ein reversibler, stark wirksamer und selektiver kompetitiver SGLT2-Inhibitor mit einer IC50 von 1,3 nM. Es zeigt eine 5000-fache höhere Selektivität für SGLT2 gegenüber dem für die Glukose-Resorption im Darm verantwortlichen humanen SGLT1 (IC50: 6278 nM).
Weiter konnte keine hemmende Wirkung auf Glukosetransporter GLUTs gezeigt werden, welche für die Glukoseversorgung in verschiedenen Geweben verantwortlich sind.
SGLT-2 wird vorwiegend in der Niere exprimiert. Es ist als wichtigster Transporter für die Rückresorption der Glukose aus dem glomerulären Filtrat in den Blutkreislauf verantwortlich.
Empagliflozin reduziert insulinunabhängig die renale Glukose-Rückresorption. Die durch diesen Mechanismus über den Urin ausgeschiedene Menge an Glukose ist abhängig von der Blutzuckerkonzentration sowie der glomerulären Filtrationsrate.
Die erhöhte renale Glukoseausscheidung führt zu einer osmotischen Diurese und über diesen diuretischen Effekt zu einer Senkung des Blutdrucks (im Mittel rund 4-5 mmHg systolisch und 1-2 mmHg diastolisch) und zu einem Anstieg des Hämatokrits (rund 2-3%). Zudem wirkt Empagliflozin urikosurisch und reduziert so den Plasma-Harnsäurespiegel (rund 50µmol/L). Durch die renale Glukoseausscheidung ist das Risiko für urogenitale Infektionen insbesondere bei Frauen und älteren Menschen erhöht.
Die renale Glukose-Ausscheidung nach 10mg Empagliflozin beträgt ca. 64g pro Tag (entspricht rund 256 kcal). Nach Einnahme von 25 mg Empagliflozin beträgt die renale Glukose-Ausscheidung ca. 78g pro Tag (entspricht rund 312 kcal).
Bei T2DM-Patienten steigt die renale Ausscheidung von Zucker im Urin nach der ersten Dosis Empagliflozin an und bleibt über das gesamte 24stündige Dosierungsintervall auf ungefähr dem gleichen Niveau.
Die erhöhte Ausscheidung von Zucker im Urin führte bei T2DM-Patienten zu einer Reduktion der Plasmaglukosespiegel.
Die blutzuckersenkende Wirkung von Empagliflozin ist unabhängig von der Betazellfunktion und dem Insulinweg.
Empagliflozin reduziert zudem die Natrium-Rückresorption und verstärkt den Natriumtransport zum distalen Tubulus. Dies kann Auswirkungen auf verschiedene physiologische Funktionen haben, unter anderem: Erhöhung des tubuloglomerulären Feedbacks und Reduktion des intraglomerulären Drucks, Senkung der Vor- und Nachlast des Herzens, Herabregulierung der Sympathikusaktivität und Reduktion der Belastung der linksventrikulären Wand, was durch niedrigere NT-proBNP-Werte mit möglicherweise positiven Auswirkungen auf das kardiale Remodeling, den Fülldruck und die diastolische Funktion sowie den Erhalt der Nierenstruktur und -funktion nachgewiesen wird.
Klinische Wirksamkeit
Typ 2 Diabetes mellitus
Insgesamt 11250 Patienten mit Typ-2-Diabetes wurden in 10 doppelblinden, placebo- und aktivkontrollierten klinischen Studien behandelt, 3021 dieser Patienten erhielten Empagliflozin 10 mg. In vier Studien betrug die Behandlungsdauer 24 Wochen; in Verlängerungen dieser und anderer Studien waren die Patienten bis zu 102 Wochen lang mit Empagliflozin behandelt.
Die Behandlung mit Empagliflozin als Monotherapie und in Kombination mit Metformin, einem Sulfonylharnstoff, DPP-4-Inhibitoren und Insulin führte zu einer klinisch relevanten Verbesserung des HbA1c, Nüchtern-Plasmaglukose (NPG), Körpergewicht sowie systolischem und diastolischem Blutdruck.
Monotherapie
Die Wirksamkeit und Sicherheit von Empagliflozin als Monotherapie wurde bei nicht vorbehandelten Patienten in einer 24-wöchigen doppelblinden, placebo- und aktivkontrollierten Studie untersucht. Die Behandlung mit Empagliflozin führte im Vergleich zu Placebo zu einer statistisch signifikanten (p < 0,0001) Reduktion des HbA1c (Tabelle 1) sowie zu einer klinisch relevanten Abnahme der NPG.
In einer präspezifizierten Analyse von Patienten (N = 201) mit einem HbA1c-Ausgangswert ≥8,5 % führte die Behandlung zu einer Reduktion des HbA1c-Werts gegenüber dem Ausgangswert von -1,44 % für Empagliflozin 10 mg, -1,43 % für Empagliflozin 25 mg, -1,04 % für Sitagliptin und zu einer Zunahme um 0,01 % für Placebo.
In der doppelblinden, placebokontrollierten Verlängerungsperiode dieser Studie blieben die Reduktionen des HbA1c, Körpergewicht und Blutdruck bis Woche 76 bestehen.
Tabelle 1: Ergebnisse einer 24wöchigen (LOCF) placebokontrollierten Studie mit Jardiance als Monotherapie
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
|
Sitagliptin
100 mg
| |
N
|
228
|
224
|
224
|
223
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
7,91
|
7,87
|
7.86
|
7,85
| |
Veränderung gegenüber Baseline1
|
0,08
|
-0,66
|
-0.78
|
-0,66
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,74*
(-0,90, -0,57)
|
-0.85*
(-1.01, -0.69)
|
-0,73
(-0,88, -0,59)3
| |
N
|
208
|
204
|
202
|
200
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Wert zu Baseline ≥7%)4
|
12,0
|
35,3
|
43.6
|
37,5
| |
N
|
228
|
224
|
224
|
223
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
78,23
|
78,35
|
77.80
|
79,31
| |
Veränderung gegenüber Baseline1
|
-0,33
|
-2,26
|
-2.48
|
0,18
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,93*
(-2,48, -1,38)
|
-2.15*
(-2.70,-1.60)
|
0,52
(-0,04, 1,00)3
| |
N
|
228
|
224
|
224
|
223
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
130,4
|
133,0
|
129.9
|
132,5
| |
Veränderung gegenüber Baseline1
|
-0,3
|
-2,9
|
-3.7
|
0,5
| |
Unterschied zu Placebo1
(95 % KI)
|
|
-2,6* (-5,2, -0,0)
|
-3.4* (-6.0, -0.9)
|
0,8 (-1,4, 3,1)3
|
1 für Ausgangswert adjustierter Mittelwert
2 Last Observation Carried Forward (LOCF), Werte nach antihypertensiver Notfallbehandlung zensiert
3 95% KI
4 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Kombinationstherapie
Empagliflozin als Add-on-Therapie zu Metformin und Sulfonylharnstoff
Empagliflozin führte als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff im Vergleich zu Placebo zu einer statistisch signifikanten (p < 0,0001) Abnahme des HbA1c-Werts und des Körpergewichts (Tabelle 2). Zudem führte es im Vergleich zu Placebo zu einer klinischen bedeutsamen Abnahme der NPG sowie des systolischen und diastolischen Blutdrucks.
In der doppelblinden. placebokontrollierten Verlängerungsperiode dieser Studien blieben die Reduktionen von HbA1c, Körpergewicht und Blutdruck bis Woche 52 bestehen.
Tabelle 2: Ergebnisse einer 24wöchigen (LOCF) placebokontrollierten Studie mit Jardiance als Zusatz zu Metformin bzw. zu Metformin und einem Sulfonylharnstoff (Full Analysis Set)
|
Jardiance als Zusatz zu Metformin
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
207
|
217
|
213
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
7,90
|
7,94
|
7,86
| |
Veränderung gegenüber Baseline1
|
-0,13
|
-0,70
|
-0,77
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,57*
(-0,72, -0,42)
|
-0,64*
(-0,79, -0,48)
| |
N
|
184
|
199
|
191
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
12,5
|
37,7
|
38,7
| |
N
|
207
|
217
|
213
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
79,73
|
81,59
|
82,21
| |
Veränderung gegenüber Baseline1
|
-0,45
|
-2,08
|
-2,46
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,63*
(-2,17, -1,08)
|
-2,01*
(-2,56, -1,46)
| |
N
|
207
|
217
|
213
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
128,6
|
129,6
|
130,0
| |
Veränderung gegenüber Baseline1
|
-0,4
|
-4,5
|
-5,2
| |
Unterschied zu Placebo1
(95% KI)
|
|
-4,1* (-6,2, -2,1)
|
-4.8* (-6.9, -2.7)
|
|
Jardiance als Zusatz zu Metformin und einem Sulfonylharnstoff
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
225
|
225
|
216
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
8,15
|
8,07
|
8,10
| |
Veränderung gegenüber Baseline1
|
-0,17
|
-0,82
|
-0,77
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,64*
(-0,79, -0,49)
|
-0,59*
(-0,74, -0,44)
| |
N
|
216
|
209
|
202
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
9,3
|
26,3
|
32,2
| |
N
|
224
|
225
|
215
| |
NPG (mg/dl) [mmol/l]
| |
Baseline (Mittelwert)
|
151,7 [8,42]
|
151,0 [8,38]
|
156,5 [8,68]
| |
Veränderung gegenüber Baseline1
|
5,5 [0,31]
|
-23,3 [-1,29]
|
-23,3 [-1,29]
| |
Unterschied zu Placebo1
(95% KI)
|
|
-28,8
(-34,3, -23,4)
[-1,60
(-1,90, -1,30)]
|
-28,8
(-34,3, -23,3)
[-1,60
(-1,90, -1,29)]
| |
N
|
225
|
225
|
216
| |
Körpergewicht (kg)
| |
Baseline (Mittelwert)
|
76,23
|
77,08
|
77,50
| |
Veränderung gegenüber Baseline1
|
-0,39
|
-2,16
|
-2,39
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-1,76*
(-2,25, -1,28)
|
-1,99*
(-2,48, -1,50)
| |
N
|
225
|
225
|
216
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
128,8
|
128,7
|
129,3
| |
Veränderung gegenüber Baseline1
|
-1,4
|
-4,1
|
-3,5
| |
Unterschied zu Placebo1
(95% KI)
|
|
-2,7
(-4,6, -0,8)
|
-2,1
(-4,0, -0,2)
|
1 für Ausgangswert adjustierter Mittelwert
2 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Empagliflozin im Vergleich zu Placebo bei Patienten mit unzureichender Blutzuckerkontrolle unter Metformin und Linagliptin
Bei Patienten mit einer unzureichenden Blutzuckerkontrolle unter Metformin und Linagliptin führte eine 24-wöchige Behandlung mit 10 mg Empagliflozin zu statistisch signifikanten Verbesserungen des HbA1c-Werts, der NPG sowie des Körpergewichts im Vergleich zu Placebo (Hintergrundtherapie Linagliptin 5 mg und Metformin). (Tabelle 3).
Tabelle 3 Wirksamkeitsparameter zum Vergleich zwischen Empagliflozin und Placebo als Zusatztherapie bei Patienten mit unzureichender Blutzuckerkontrolle unter Metformin und Linagliptin 5 mg
|
|
Metformin + Linagliptin 5 mg
| |
|
Empagliflozin
10 mg1
|
Placebo2
| |
HbA1c (%) – 24 Wochen3
| |
N
|
109
|
106
| |
Baseline (Mittelwert)
|
7,97
|
7,96
| |
Veränderung gegenüber Baseline
(adjustierter Mittelwert)
|
-0,65
|
0,14
| |
Unterschied zu Placebo adjustierter Mittelwert
(95% KI)2
|
-0,79
(-1,02, -0,55)
p<0,0001
|
| |
NPG (mg/dL) – 24 Wochen3
| |
N
|
109
|
106
| |
Baseline (Mittelwert)
|
167,9
|
162,9
| |
Veränderung gegenüber Baseline
(adjustierter Mittelwert)
|
-26,3
|
6,1
| |
Unterschied zu Placebo adjustierter Mittelwert (95% KI)
|
-32,4 (-41,7, -23,0)
p<0,0001
|
| |
Körpergewicht – 24 Wochen3
| |
N
|
109
|
106
| |
Baseline (Mittelwert) in kg
|
88,4
|
82,3
| |
Veränderung gegenüber Baseline (adjustierter Mittelwert)
|
-3,1
|
-0,3
| |
Unterschied zu Placebo (adjustierter Mittelwert) (95% KI)1
|
-2,8 (-3,5, -2,1)
p<0,0001
|
|
1 Patienten, die in die Gruppe mit Empagliflozin 10 mg randomisiert wurden, erhielten Empagliflozin 10 mg/Linagliptin 5 mg mit Metformin als Hintergrundtherapie
2 Patienten, die in die Placebogruppe randomisiert wurden, erhielten Placebo plus Linagliptin 5 mg mit Metformin als Hintergrundtherapie
3 Das für das Full Analysis Set (OC) angewendete MMRM-Modell umfasst HbA1c-Ausgangswert, eGFR-Ausgangswert (MDRD-Formel), geographische Region, Untersuchungstermin, Therapie und zeitabhängigen Behandlungseffekt (treatment-by-visit-interaction). Für die NPG ist auch der NPG-Ausgangswert enthalten. Für das Gewicht ist auch der Gewichtsausgangswert enthalten.
Add-on-Therapie zu Insulin
Empagliflozin als Add-on-Therapie zu Basalinsulin
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu Basalinsulin mit oder ohne Metformin und/oder einem Sulfonylharnstoff wurde in einer doppelblinden, placebokontrollierten Studie mit einer Dauer von 78 Wochen untersucht. In den ersten 18 Wochen wurde die Insulindosis stabil gehalten, in den folgenden 60 Wochen konnte die Dosis angepasst werden, um einen NPG-Wert < 110 mg/dl zu erreichen.
Bis zur Woche 18 führte Empagliflozin zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 4).
Nach 78 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme von NPG, des Körpergewichts und des Blutdrucks.
Tabelle 4: Ergebnisse einer placebokontrollierten Studie mit Jardiance als Zusatz zu Basalinsulin mit oder ohne Metformin oder einem Sulfonylharnstoff (Full Analysis Set – Completer) nach 18 bzw. 78 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
125
|
132
|
117
| |
HbA1c (%) in Woche 18
| |
Baseline (Mittelwert)
|
8,10
|
8,26
|
8,34
| |
Veränderung gegenüber Baseline1
|
-0,01
|
-0,57
|
-0,71
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,56* (-0,78, -0,33)
|
-0,70* (-0,93, -0,47)
| |
N
|
112
|
127
|
110
| |
HbA1c (%) in Woche 78
| |
Baseline (Mittelwert)
|
8,09
|
8,27
|
8,29
| |
Veränderung gegenüber Baseline1
|
-0,02
|
-0,48
|
-0,64
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-0,46* (-0,73, -0,19)
|
-0,62* (-0,90, -0,34)
| |
N
|
112
|
127
|
110
| |
Dosis Basalinsulin (IE/Tag) in Woche 78
| |
Baseline (Mittelwert)
|
47,84
|
45,13
|
48,43
| |
Veränderung gegenüber Baseline1
|
5,45
|
-1,21
|
-0,47
| |
Unterschied zu Placebo1
(97,5% KI)
|
|
-6,66** (-11,56, -1,77)
|
-5,92** (-11,00, -0,85)
|
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p <0,025
Empagliflozin als Add-on-Therapie zu multiplen täglichen Insulininjektionen
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu mehrmals täglich verabreichtem Insulin mit oder ohne begleitende Metformin-Therapie wurde in einer doppelblinden, placebokontrollierten Studie mit einer Dauer von 52 Wochen untersucht.
In den ersten 18 Wochen und den letzten 12 Wochen wurde die Insulindosis stabil gehalten, zwischen Woche 19 und 40 jedoch angepasst, um präprandiale Glukosewerte < 100 mg/dl (5,5 mmol/l) und postprandiale Glukosewerte < 140 mg/dl (7,8 mmol/l) zu erreichen.
Bis zur Woche 18 führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Verbesserung des HbA1c (Tabelle 5).
Nach 52 Wochen führte Empagliflozin im Vergleich zu Placebo zu einer statistisch signifikanten Abnahme des HbA1c sowie zu einer Insulin-Ersparnis. Zudem führte Empagliflozin zu einer Abnahme der NPG und des Körpergewichts.
Tabelle 5: Ergebnisse zur Wirksamkeit in den Wochen 18 und 52 einer placebokontrollierten Studie zu Empagliflozin als Add-on-Therapie zu mehreren täglichen Dosen Insulin mit oder ohne Metformin
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
188
|
186
|
189
| |
HbA1c (%) in Woche 18
| |
Baseline (Mittel)
|
8,33
|
8,39
|
8,29
| |
Veränderung gegenüber Baseline1
|
-0,50
|
-0,94
|
-1,02
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,44* (-0,61, -0,27)
|
-0,52* (-0,69, -0,35)
| |
N
|
115
|
119
|
118
| |
HbA1c (%) in Woche 522
| |
Baseline (Mittel)
|
8,25
|
8,40
|
8,37
| |
Veränderung gegenüber Baseline1
|
-0,81
|
-1,18
|
-1,27
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-0,38*** (-0,62, -0,13)
|
-0,46* (-0,70, -0,22)
| |
N
|
113
|
118
|
118
| |
Patienten (%), die HbA1c <7% mit Baseline HbA1c ≥7% in Woche 52 erreichen
|
26,5
|
39,8
|
45,8
| |
N
|
115
|
118
|
117
| |
Insulindosis (IU/Tag) in Woche 522
| |
Baseline (Mittel)
|
89,94
|
88,57
|
90,38
| |
Veränderung gegenüber Baseline1
|
10,16
|
1,33
|
-1,06
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-8,83# (-15,69, -1,97)
|
-11,22**(-18,09, -4,36)
| |
N
|
115
|
119
|
118
| |
Körpergewicht (kg) in Woche 522
| |
Baseline (Mittel)
|
96,34
|
96,47
|
95,37
| |
Veränderung gegenüber Baseline1
|
0,44
|
-1,95
|
-2,04
| |
Unterschied zu Placebo1 (97,5% KI)
|
|
-2,39* (-3,54, -1,24)
|
-2,48* (-3,63, -1,33)
|
1 für Ausgangswert adjustierter Mittelwert
2 Woche 19-40: Treat-to-Target-Regime für Insulindosisanpassung, um vordefinierte Blutzucker-Zielwerte (präprandial <100 mg/dl (5,5 mmol/l), postprandial <140 mg/dl (7,8 mmol/l) zu erreichen
* p-Wert <0,0001
** p-Wert = 0,0003
*** p-Wert = 0,0005
# p-Wert = 0,0040
Spezifische Populationen
Patienten mit Nierenfunktionsstörung, 52-Wochen-Daten aus einer placebokontrollierten Studie
Die Wirksamkeit und Sicherheit von Empagliflozin als Add-on-Therapie zu einer antidiabetischen Behandlung bei Patienten mit Nierenfunktionsstörung wurde in einer doppelblinden placebokontrollierten Studie über eine Dauer von 52 Wochen untersucht. Die Behandlung mit Empagliflozin führte in Woche 24 im Vergleich zu Placebo zu einer statistisch signifikanten Reduktion des HbA1c (Tabelle 6) und zu einer klinisch relevanten Verbesserung der NPG. Die Verbesserung von HbA1c, Körpergewicht und Blutdruck blieb bis zu 52 Wochen lang bestehen.
Tabelle 6: Ergebnisse einer placebokontrollierten Studie mit Jardiance an Patienten mit Typ 2-Diabetes und Nierenfunktionsstörung (Full Analysis Set) nach 24 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin 10 mg
|
Empagliflozin
25 mg
|
Placebo
|
Empagliflozin
25 mg
| |
|
eGFR ≥60 bis
< 90 ml/min/1,73 m²
|
eGFR ≥30 bis
< 60 ml/min/1,73 m²
| |
N
|
95
|
98
|
97
|
187
|
187
| |
HbA1c (%)
| |
Baseline (Mittelwert)
|
8,09
|
8,02
|
7,96
|
8,04
|
8,03
| |
Veränderung gegenüber Baseline1
|
0,06
|
-0,46
|
-0,63
|
0.05
|
-0.37
| |
Unterschied zu Placebo1 (95% KI)
|
|
-0,52*
(-0,72; -0,32)
|
-0,68*
(-0,88; -0,49)
|
|
-0.42*
(-0.56, -0.28)
| |
N
|
89
|
94
|
91
|
178
|
175
| |
Patienten (%), die HbA1c <7% erreichen (HbA1c-Ausgangswert ≥7%)2
|
6,7
|
17,0
|
24,2
|
7.9
|
12.0
| |
N
|
95
|
98
|
97
|
187
|
187
| |
Körpergewicht (kg)2
| |
Baseline (Mittelwert)
|
86,00
|
92,05
|
88,06
|
82.49
|
83.22
| |
Veränderung gegenüber Baseline1
|
-0,33
|
-1,76
|
-2,33
|
-0.08
|
-0.98
| |
Unterschied zu Placebo1 (95% KI)
|
|
-1,43
(-2,09; -0,77)
|
-2,00
(-2,66; -1,34)
|
|
-0.91 (-1.41,
-0.41)
| |
N
|
95
|
98
|
97
|
187
|
187
| |
SBD (mmHg)2
| |
Baseline (Mittelwert)
|
134,69
|
137,37
|
133,68
|
136.38
|
136.64
| |
Veränderung gegenüber Baseline1
|
0,65
|
-2,92
|
-4,47
|
0.40
|
-3.88
| |
Unterschied zu Placebo1 (95% KI)
|
|
-3,57
(-6,86; -0,29)
|
-5,12
(-8,41; -1,82)
|
|
-4.28 (-6.88,
-1.68)
|
1 für Ausgangswert adjustierter Mittelwert
2 aufgrund des sequentiellen konfirmatorischen Testverfahrens nicht im Hinblick auf statistische Signifikanz beurteilt
* p<0,0001
Kardiovaskuläre Ergebnisse in Patienten mit manifester kardiovaskulärer Erkrankung
Die EMPA-REG OUTCOME Studie verglich das Risiko kardiovaskulärer Ereignisse in Patienten mit Typ 2 Diabetes mellitus und kardiovaskulärer Vorerkrankung unter Empagliflozin-Behandlung versus Placebo. In diese Studie wurden insgesamt 7020 Patienten mit koronarer Herzkrankheit (Ein- oder Mehrgefässerkrankung), Zustand nach Myokardinfarkt (MI), Zustand nach Schlaganfall und/oder peripherer arterieller Verschlusskrankheit eingeschlossen und für bis zu 4,5 Jahre (mediane Behandlungsdauer 2,6 Jahre und mediane Beobachtungsdauer 3,1 Jahre) zusätzlich zur vorbestehenden Therapie entweder mit Empagliflozin 10 mg (n=2.345), Empagliflozin 25 mg (n=2.342) oder Placebo (n=2.333) behandelt.
Die Population war zu 72,4 % kaukasisch, zu 21,6 % asiatisch und zu 5,1 % schwarz. Das Durchschnittsalter betrug 63 Jahre (9,3 % der Patienten waren ≥75 Jahre), 71,5 % der Patienten waren männlich. Zu Studienbeginn erhielten etwa 81 % der Patienten einen Hemmer des Renin-Angiotensin-Systems, 65 % Betablocker, 43 % Diuretika, 89 % Antikoagulantien und 81 % eine lipidsenkende Medikation. Etwa 74 % der Patienten nahmen bei Studienbeginn Metformin ein, 48 % wendeten Insulin an und 43 % erhielten einen Sulfonylharnstoff. Die EMPA-REG OUTCOME Studie war mit Ausnahme der ersten 12 Wochen nicht für die Messung der glykämischen Wirksamkeit konzipiert, sondern als Glukose-Gleichgewichtsstudie zur Bewertung des kardiovaskulären Endergebnisses ausgelegt. In den ersten 12 Wochen musste die glukosesenkende Basistherapie unverändert bleiben. Nach dieser Anfangsperiode konnte die blutzuckersenkende Behandlung gemäss den aktuellen Therapierichtlinien angepasst werden. Weitere Begleitmedikationen (z.B. für Hypertonie und Dyslipidämie) konnten während der gesamten Studie hinzugefügt oder verändert werden, um die beste Standardbehandlung zu erzielen.
Primärer Endpunkt (bestimmt für beide Empagliflozin-Arme zusammen) war die Zeit bis zum ersten Ereignis des kombinierten Endpunkts aus kardiovaskulären Todesfällen, nicht-tödlichen MI und nicht-tödlichen Schlaganfällen (3-point MACE [Major Adverse Cardiovascular Events]). Alle Endpunktereignisse und Todesfälle wurden von einem unabhängigen, externen, verblindeten Expertengremium (CEC) beurteilt. Gemäss Beurteilungsvorschrift wurden kardiovaskuläre Todesfälle als tödlicher MI, tödlicher Schlaganfall, Tod aufgrund von Herzinsuffizienz (durch Progression oder kardiogenen Schock), plötzlicher Tod oder andere tödliche kardiovaskuläre Ereignisse kategorisiert.
Reduktion des Risikos für kardiovaskuläre Todesfälle und Gesamtmortalität
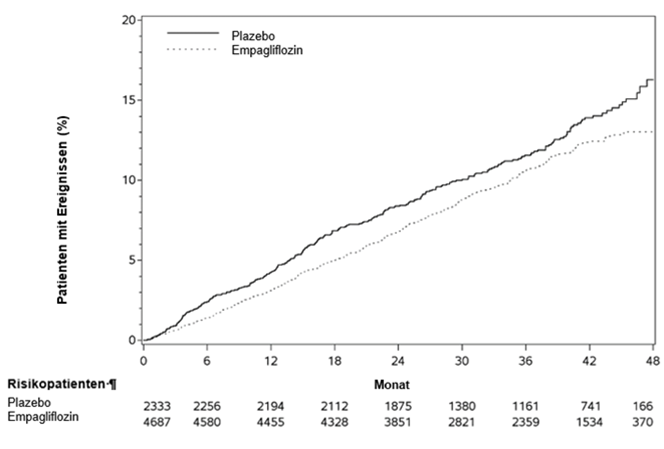
Empagliflozin war Placebo hinsichtlich des primären Endpunkts überlegen (d.h. bewirkte eine Senkung des Risikos kardiovaskulärer Ereignisse). Die signifikante Reduktion des primären Endpunkts beruhte grossteils auf der deutlichen Senkung der Inzidenz kardiovaskulärer Todesfälle (Tabelle 7 und Abbildung 1) und war nicht vollständig durch Unterschiede in der glykämischen Kontrolle der Behandlungsgruppen zu erklären. Ein präventiver Effekt wurde für alle Kategorien kardiovaskulärer Todesfälle beobachtet. Gleichzeitig wurde das Risiko nicht-tödlicher Myokardinfarkte nicht statistisch signifikant gesenkt. Empagliflozin hatte keinen präventiven Effekt für Schlaganfälle, eine numerische, jedoch nicht signifikante Reduktion wurde bei tödlichen Schlaganfällen (HR 0,72 (95%-KI 0,33-1,55) beobachtet. Für nicht tödliche Schlaganfälle wurde eine numerische, jedoch nicht signifikante Erhöhung beobachtet (HR 1,24 (95%-KI 0,92-1,67) (siehe «Warnhinweise und Vorsichtsmassnahmen»). Resultierend hauptsächlich aus der Reduktion kardiovaskulärer Todesfälle (Empagliflozin bewirkte keine statistisch signifikante Reduktion der nicht-kardiovaskulären Mortalität) verbesserte sich unter Empagliflozin-Behandlung auch die Gesamtmortalität.
Tabelle 7: Behandlungseffekt in Bezug auf den zusammengesetzten primären Endpunkt, seine Komponenten und die Mortalität (Behandelte Population*)
|
|
Placebo
|
Empagliflozin
(10 and 25 mg, gepoolt)
| |
N
|
2333
|
4687
| |
Zeit bis zum ersten Eintreten eines kardiovaskulären Todesfalls, nicht-tödlichen MI oder nicht-tödlichen Schlaganfalls
|
282 (12,1)
|
490 (10,5)
| |
Hazard Ratio vs. Placebo (95,02%-KI)**
|
|
0,86 (0,74; 0,99)
| |
p−Wert für Überlegenheit
|
|
0,0382
| |
Kardiovaskuläre Todesfälle N (%)
|
137 (5,9)
|
172 (3,7)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,62 (0,49; 0,77)
| |
p-Wert
|
|
<0,0001
| |
Nicht-tödliche MI N (%)
|
121 (5,2)
|
213 (4,5)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,87 (0,70; 1,09)
| |
p−Wert
|
|
0,2189
| |
Nicht-tödliche Schlaganfälle N (%)
|
60 (2,6)
|
150 (3,2)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
1,24 (0,92; 1,67)
| |
p−Wert
|
|
0,1638
| |
Gesamtmortalität N (%)
|
194 (8,3)
|
269 (5,7)
| |
Hazard Ratio vs . Placebo (95%-KI)
|
|
0,68 (0,57; 0,82)
| |
p-Wert
|
|
<0,0001
| |
Nicht-kardiovaskuläre Mortalität N (%)
|
57 (2,4)
|
97 (2,1)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,84 (0,60; 1,16)
|
* d.h. Patienten, die mindestens eine Dosis der Studienmedikation erhalten hatten
** Da Daten der Studie in einer Interim-Analyse berücksichtigt wurden, gilt ein zweiseitiges 95,02-%-Konfidenzintervall, das einem p-Wert von kleiner 0,0498 für Signifikanz entspricht.
Abbildung 1 Zeit bis zum erstmaligen Auftreten eines Ereignisses des zusammengesetzten primären Endpunkts (kardiovaskulärer Tod/nicht-tödlicher MI/nicht-tödlicher Schlaganfall)
In einer randomisierten, placebokontrollierten, wirkstoffkontrollierten Crossover-Studie an 30 gesunden Probanden wurde unter 25 mg bzw. 200 mg Empagliflozin kein Anstieg der QTc beobachtet.
Nüchtern-Plasma-Glukose
In vier placebokontrollierten Studien führte die Behandlung mit Empagliflozin als Monotherapie oder Add-on-Therapie zu Metformin oder Metformin plus einem Sulfonylharnstoff zu mittleren Änderungen der NPG gegenüber dem Ausgangswert von -20,5 mg/dl [-1,14 mmol/l] für Empagliflozin 10 mg und von -23,2 mg/dl [-1,29 mmol/l] für Empagliflozin 25 mg im Vergleich zu Placebo (7,4 mg/dl [0,41 mmol/l]). Diese Wirkung wurde nach 24 Wochen beobachtet und hielt für 76 Wochen an.
Postprandialer 2-Stunden-Glukosewert
Die Behandlung mit Empagliflozin als Add-on-Therapie zu Metformin oder zu Metformin und einem Sulfonylharnstoff führte nach 24 Wochen zu einer klinisch relevanten Abnahme des postprandialen 2-Stunden-Glukosewertes (Mahlzeittoleranztest) (Add-on-Therapie zu Metformin: Placebo +5,9 mg/dl [+0,33 mmol/l], Empagliflozin 10 mg: -46,0 mg/dl [-2,56 mmol/l], Empagliflozin 25 mg: -44,6 mg/dl [-2,5 mmol/l]. Add-on-Therapie zu Metformin und einem Sulfonylharnstoff: Placebo -2,3 mg/dl [-0,13 mmol/l], Empagliflozin 10 mg: -35,7 mg/dl [1,98 mmol/l], Empagliflozin 25 mg: -36,6 mg/dl [2 mmol/l].
Körpergewicht
In einer präspezifizierten gepoolten Analyse von vier placebokontrollierten Studien führte die Behandlung mit Empagliflozin nach 24 Wochen zu einer Abnahme des Körpergewichts (-0,24 kg für Placebo, -2,04 kg für Empagliflozin 10 mg, -2,26 kg für Empagliflozin 25 mg), die bis Woche 52 bestehen blieb (-0,16 kg für Placebo, -1,96 kg für Empagliflozin 10 mg und -2,25 kg für Empagliflozin 25 mg).
Blutdruck
Die Wirksamkeit und Sicherheit von Empagliflozin wurde in einer 12-wöchigen doppelblinden, placebokontrollierten Studie bei Patienten mit Typ-2-Diabetes und Bluthochdruck untersucht, die mit verschiedenen Antidiabetika und bis zu 2 Antihypertensiva behandelt wurden. Die Behandlung mit Empagliflozin einmal täglich führte zu einer statistisch signifikanten Verbesserung des HbA1c und des mit einem 24-Stunden-Monitoring gemessenen mittleren systolischen und diastolischen Blutdrucks (Tabelle 8). Die Behandlung mit Empagliflozin senkte den SBD und DBD im Sitzen.
Tabelle 8: Ergebnisse einer placebokontrollierten Studie mit Jardiance an Patienten mit Typ 2-Diabetes und unkontrolliertem Blutdruck (Full Analysis Set) nach 12 Wochen (LOCF)
|
|
Placebo
|
Empagliflozin
10 mg
|
Empagliflozin
25 mg
| |
N
|
271
|
276
|
276
| |
HbA1c (%) in Woche 12
| |
Baseline (Mittelwert)
|
7,90
|
7,87
|
7,92
| |
Veränderung gegenüber Baseline1
|
0,03
|
-0,59
|
-0,62
| |
Unterschied zu Placebo1
(95% KI)
|
|
-0,62* (-0,72, -0,52)
|
-0,65* (-0,75, -0,55)
| |
24-Stunden-SBD in Woche 12
| |
Baseline (Mittelwert)
|
131,72
|
131,34
|
131,18
| |
Veränderung gegenüber Baseline1
|
0,48
|
-2,95
|
-3,68
| |
Unterschied zu Placebo1
(95% KI)
|
|
-3,44* (-4,78, -2,09)
|
-4,16* (-5,50, -2,83)
| |
24-Stunden-DBD in Woche 12
| |
Baseline (Mittelwert)
|
75,16
|
75,13
|
74,64
| |
Veränderung gegenüber Baseline1
|
0,32
|
-1,04
|
-1,40
| |
Unterschied zu Placebo1
(95% KI)
|
|
-1,36** (-2,15, -0,56)
|
-1,72* (-2,51, -0,93)
|
1 für Ausgangswert adjustierter Mittelwert
* p <0,0001
** p < 0,001
In einer präspezifizierten gepoolten Analyse von vier placebokontrollierten Studien führte die Behandlung mit Empagliflozin in Woche 24 zu einer Senkung des systolischen Blutdrucks (Empagliflozin 10 mg: -3,9 mmHg, Empagliflozin 25 mg: -4,3 mmHg) im Vergleich zu Placebo (-0,5 mmHg) und zu einer Senkung des diastolischen Blutdrucks (Empagliflozin 10 mg: -1,8 mmHg, Empagliflozin 25 mg: -2,0 mmHg) im Vergleich zu Placebo (-0,5 mmHg); diese Verbesserungen blieben bis Woche 52 bestehen.
Laboratorparameter
Erhöhter Hämatokrit
In einer Sicherheitsanalyse (alle gepoolten Daten von Patienten mit Diabetes, n=13402) betrugen die mittleren Veränderungen des Hämatokrits gegenüber dem Ausgangswert 3,4% für Empagliflozin 10 mg und 3,6% für Empagliflozin 25 mg im Vergleich zu -0,1% für Placebo. In der EMPA-REG-Outcome-Studie sanken die Hämatokritwerte nach einer Nachbeobachtungsphase von 30 Tagen nach Absetzen der Medikation auf die Ausgangswerte.
Erhöhte Serumlipide
In einer Sicherheitsanalyse (alle gepoolten Daten von Patienten mit Diabetes, n=13402) betrug der mittlere prozentuelle Anstieg gegenüber dem Ausgangswert für Empagliflozin 10 mg bzw. 25 mg im Vergleich zu Placebo bei Gesamtcholesterin 4,9% bzw. 5,7% versus 3,5%; bei HDL-Cholesterin 3,3% bzw. 3,6% versus 0,4%; bei LDL-Cholesterin 9,5% bzw. 10,0% versus 7,5%; bei Triglyzeriden 9,2% bzw. 9,9% versus 10,5%.
Herzinsuffizienz
Empagliflozin bei Patienten mit Herzinsuffizienz und reduzierter Ejektionsfraktion
Es wurde eine randomisierte, doppelblinde, placebokontrollierte Studie (EMPEROR-Reduced) an 3730 Patienten mit chronischer Herzinsuffizienz (New York Heart Association [NYHA] II–IV) und reduzierter Ejektionsfraktion (LVEF ≤40%) zur Beurteilung der Wirksamkeit und Sicherheit von Empagliflozin 10 mg einmal täglich als Add-on zur Herzinsuffizienz-Standardtherapie durchgeführt.
Patienten mit einer eGFR<20 ml/min/1.73m2, extrem fettleibige Personen (BMI ≥45 kg/m2) und Patienten mit LVAD-Implantaten [linksventrikuläre Unterstützungssysteme] wurden von der Studie ausgeschlossen.
Primärer Endpunkt war die Zeit bis zum ersten Ereignis des kombinierten Endpunkts (kardiovaskulärer Tod und Hospitalisierung wegen Herzinsuffizienz). Konfirmatorische Sekundärendpunkte waren das Auftreten von Hospitalisierungen wegen Herzinsuffizienz [HHF] (erstmalig und wiederholt) sowie die Rate der eGFR-Abnahme im Zeitverlauf.
Die Baseline-Therapie bestand aus ACE-Inhibitoren/Angiotensin-Rezeptor-Blockern/Angiotensin-Rezeptor-Neprilysin-Inhibitor (88,3 %), Betablockern (94,7 %), Mineralokortikoid-Rezeptor-Antagonisten (71,3 %), Diuretika (95,0 %), implantierbarem Kardioverter-Defibrillator (ICD) (31,4 %) und kardialer Resynchronisationstherapie (CRT) (11,8 %).
Randomisiert wurden 1863 Patienten mit Empagliflozin 10 mg und 1867 Patienten mit Placebo behandelt und über einen medianen Zeitraum von 15,7 Monaten beobachtet. Das Durchschnittsalter der Studienpopulation (76,1 % männlich) betrug 66,8 Jahre (Bereich: 25–94 Jahre; 26,8 % ≥75 Jahre). Die Mehrheit waren Weisse (70,5%), 18,0 % Asiaten und 6,9 % Schwarze/Afroamerikaner. Der Grossteil der Studienteilnehmer entfiel auf die NYHA-Klasse II (75,1 %; 24,4 % in Klasse III und 0,5 % in Klasse IV). Zu Studienbeginn betrugen die mittlere LVEF 27,5 %, die mittlere eGFR 62,0 ml/min/1,73 m2 und das mediane Verhältnis von Albumin zu Kreatinin im Urin (urinary albumin to creatinine ratio, UACR) 22 mg/g. Etwa die Hälfte der Patienten (51,7 %) hatte eine eGFR von ≥60 ml/min/1,73 m2. Bei 24,1 % der Patienten lag die eGFR zwischen 45 - < 60 ml/min/1,73 m2, bei 18,6 % zwischen 30 - < 45 ml/min/1,73 m2, und bei 5,3 % zwischen 20 - < 30 ml/min/1,73 m2.
Die Behandlung mit Empagliflozin war der Placebo-Behandlung überlegen: Empagliflozin senkte das Risiko des zusammengesetzten primären Endpunkts und die Gesamtanzahl an HHF (erstmalige und wiederholte) signifikant (siehe Tabelle 9).
Tabelle 9: Behandlungseffekt in Bezug auf den zusammengesetzten primären Endpunkt, seine Komponenten und die beiden wichtigsten sekundären Endpunkte in den vorgegebenen Bestätigungstests
|
|
Placebo
|
Empagliflozin 10 mg
| |
N
|
1867
|
1863
| |
Zeit bis zum ersten Eintreten eines kardiovaskulären (KV) Todesfalls oder einer HHF, N (%)
|
462 (24,7)
|
361 (19,4)
| |
Hazard Ratio vs. Placebo (95,04 %-KI)**
|
|
0,75 (0,65, 0,86)
| |
p-Wert für Überlegenheit
|
|
< 0,0001
| |
Kardiovaskulärer (KV) Tod, N (%)*
|
202 (10,8)
|
187 (10,0)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,92 (0,75, 1,12)
| |
p-Wert
|
|
0,4113
| |
HHF (erstmaliges Eintreten), N (%)*
|
342 (18,3)
|
246 (13,2)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,69 (0,59, 0,81)
| |
p-Wert
|
|
< 0,0001
| |
HHF (erstmalig und wiederholt), N der Ereignisse
|
553
|
388
| |
Hazard Ratio vs. Placebo (95,04 %-KI)**
|
|
0,70 (0,58, 0,85)
| |
p-Wert
|
|
0,0003
| |
eGFR (CKD EPI)cr-Veränderungsrate, Rate der Abnahme (ml/min/1,73 m2/Jahr)
|
-2,28
|
-0,55
| |
Behandlungsunterschied vs. Placebo (99,9 %-KI)***
|
|
1,73 (0,67, 2,80)
| |
p-Wert
|
|
p < 0,0001
|
KV = kardiovaskulär, HHF = Hospitalisierung aufgrund von Herzinsuffizienz, eGFR = geschätzte glomeruläre Filtrationsrate, CKD EPI = Chronic Kidney Disease Epidemiology Collaboration Equation
* Nicht auf Fehler erster Art hin überprüft
** Aufgrund einer Interim-Analyse wurde ein zweiseitiges 95,04%-Konfidenzintervall angewendet, das einem p-Wert von kleiner 0,0496 für Signifikanz entspricht. KV-Tod- und HHF-Ereignisse wurden von einem unabhängigen Gremium zur Beurteilung klinischer Ereignisse anerkannt und basierend auf der randomisierten Gruppe analysiert.
*** Wie im statistischen Testverfahren vorgegeben, wurde ein zweiseitiges 99,9 %-Konfidenzintervall angewendet, das einem p-Wert von kleiner 0,001 für Signifikanz entspricht; die Rate der Veränderung der eGFR wurde basierend auf der behandelten Gruppe analysiert.
Die Subgruppenanalyse ergab keine signifikanten Unterschiede des Behandlungseffekts für den primären Endpunkt (HR konsistent <1) in Abhängigkeit von den vordefinierten Parametern, wie z.B. vom glykämischer Status (Vorliegen eines Typ-2-Diabetes oder nicht) und Grad der Einschränkung der Nierenfunktion (einschliesslich schwerwiegender Einschränkung eGFR < 30 ml/min/1.73m2 [siehe Ausschlusskriterien]).
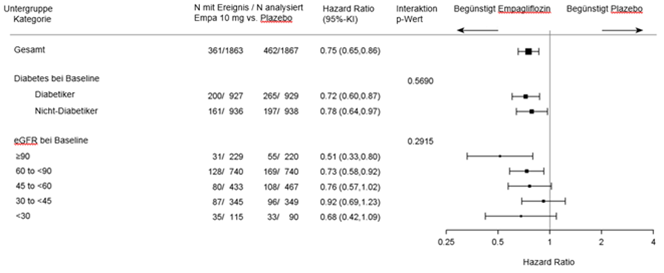
Nierenbezogenes Ergebnis
Die Behandlung mit Empagliflozin verlangsamte die Progression der Einschränkung der Nierenfunktion (Abnahme der eGFR über den Behandlungszeitraum; siehe Tabelle 9).
Empagliflozin bei Patienten mit Herzinsuffizienz und erhaltener Auswurffraktion
Eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Studie (EMPEROR-Preserved) untersuchte die Wirksamkeit und Sicherheit von Empagliflozin 10 mg einmal täglich als Ergänzung zur Standardtherapie an Patienten mit symptomatischer chronischer Herzinsuffizienz (NYHA-Funktionsklasse II-IV) und einer Auswurffraktion (LVEF) >40 %. Extrem fettleibige Personen (BMI ≥45 kg/m2) und Patienten mit LVAD-Implantaten [linksventrikuläre Unterstützungssysteme] wurden von der Studie ausgeschlossen.
Primärer (zusammengesetzter) Endpunkt war die Zeit bis zum ersten Auftreten eines der folgenden Ereignisse: kardiovaskulärer (KV) Tod oder Hospitalisierung wegen Herzinsuffizienz (HHF). Hauptsekundärendpunkte waren HHF generell (erste und erneute) und die Steilheit des Abfalls der eGFR(CKD-EPI)cr während der Studie (Veränderung gegenüber Baseline). Der Grossteil der Studienteilnehmer wurde bereits mit einem ACE-Hemmer/Angiotensinrezeptorblocker/Angiotensinrezeptor-Neprilysin-Inhibitor (80,7 %), Betablocker (86,3 %), Mineralokortikoidrezeptor-Antagonisten (37,5 %) und Diuretika (86,2 %) behandelt.
Insgesamt wurden 5988 Patienten (55,3% männlich; 75,9% «Weisse», 13,8 % «Asiaten» und 4,3 % «Schwarze/Afrikaner») mit einem Altersdurchschnitt von 71,9 Jahren (43,0 % ≥75 Jahre) randomisiert mit Empagliflozin 10 mg (N=2997) bzw. Placebo (N=2991) behandelt und über einen Zeitraum von median 26,2 Monaten beobachtet.
Zu Studienbeginn wies je ca. ein Drittel der Patienten eine LVEF von <50 % (33,1 %), 50 bis <60 % (34,4 %) bzw. ≥60 % (32,5 %) auf. Die überwiegende Mehrheit der Patienten (81,5 %) war in NHYHA Klasse II (18,1 % bzw. 0,3 % in NYHA Klasse III bzw. IV). Die mittlere eGFR und der mediane Albumin-Kreatinin-Quotient im Urin (UACR) lagen bei 60,6 ml/min/1,73 m2 und 21 mg/g. Etwa die Hälfte der Patienten (50,1 %) wies eine eGFR von ≥60 ml/min/1,73 m2, 26,1 % eine eGFR von 45 bis <60 ml/min/1,73 m2, 18,6% eine eGFR von 30 bis <45 ml/min/1,73 m2 und 4,9 % eine eGFR von 20 bis <30 ml/min/1,73 m2 auf.
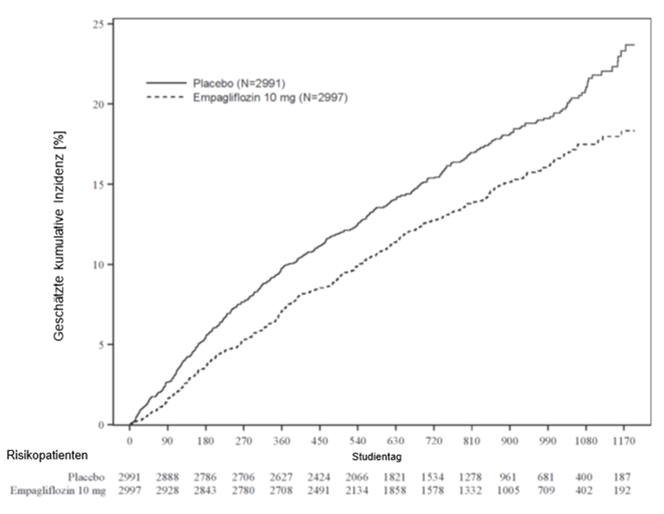
Empagliflozin war bei der Risikoreduktion für den zusammengesetzten primären Endpunkt (kardiovaskulärer Tod oder Hospitalisierung aufgrund von Herzinsuffizienz) der Placebobehandlung überlegen. Darüber hinaus reduzierte Empagliflozin signifikant das Risiko für das Auftreten von HHF (erste und erneute) und reduzierte auch signifikant die Rate der eGFR-Abnahme (siehe Tabelle 10).
Tabelle 10: Behandlungseffekt für den zusammengesetzten primären Endpunkt, seine Komponenten und die beiden wichtigen sekundären Endpunkte, die in die vordefinierten Bestätigungstests einbezogen wurden
|
|
Placebo
|
Empagliflozin 10 mg
| |
n
|
2991
|
2997
| |
Zeit bis zum ersten Ereignis (KV-Tod oder HHF), n (%)
|
511 (17,1)
|
415 (13,8)
| |
Hazard Ratio vs. Placebo (95,03%-KI)**
|
|
0,79 (0,69, 0,90)
| |
p-Wert für Überlegenheit
|
|
0,0003
| |
KV-Tod, n (%)*
|
244 (8,2)
|
219 (7,3)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,91 (0.76, 1,09)
| |
p-Wert
|
|
0,2951
| |
HHF (erstes Auftreten), n (%)*
|
352 (11,8)
|
259 (8,6)
| |
Hazard Ratio vs. Placebo (95%-KI)
|
|
0,71 (0,60, 0,83)
| |
p-Wert
|
|
<0,0001
| |
HHF (erste und erneute), Anzahl der Ereignisse
|
541
|
407
| |
Hazard Ratio vs. Placebo (95,03%-KI)**
|
|
0,73 (0,61, 0,88)
| |
p-Wert
|
|
0,0009
| |
eGFR (CKD-EPI)cr-Slope, Rate der Abnahme (ml/min/1,73m2/Jahr)
|
−2,62
|
−1,25
| |
Behandlungsunterschied vs. Placebo (99,9%-KI)***
|
|
1,36 (0,86, 1,87)
| |
p-Wert
|
|
<0,0001
|
KV = kardiovaskulär, HHF = Hospitalisierung aufgrund von Herzinsuffizienz, eGFR = geschätzte glomeruläre Filtrationsrate, CKD-EPI = Chronic Kidney Disease Epidemiology Collaboration-Formel
*nicht auf Fehler Typ 1 kontrolliert
**Aufgrund einer Zwischenanalyse wurde ein beidseitiges 95,03%-Konfidenzintervall angewandt, was einem p-Wert von weniger als 0,0497 für die Signifikanz entspricht. Die Ereignisse KV-Tod und HHF wurden von einer unabhängigen Kommission für klinische Ereignisse beurteilt und auf der Grundlage des randomisierten Sets analysiert.
***Wie im statistischen Testverfahren vordefiniert, wurde ein beidseitiges 99,9%-Konfidenzintervall angewandt, was einem p-Wert von weniger als 0,001 für die Signifikanz entspricht. Der eGFR-Slope wurde auf der Grundlage des behandelten Sets analysiert.
Abbildung 2: Zeit bis zum ersten Ereignis (adjudizierter KV-Tod oder adjudizierte HHF)
Die Ergebnisse für den zusammengesetzten primären Endpunkt waren für alle vordefinierten Subgruppen konsistent, unter anderem für die Subgruppen in Abhängigkeit von LVEF (siehe Abbildung 3).
Abbildung 3: Subgruppenanalysen für die Zeit bis zum ersten Ereignis (adjudizierter KV-Tod oder adjudizierte HHF)
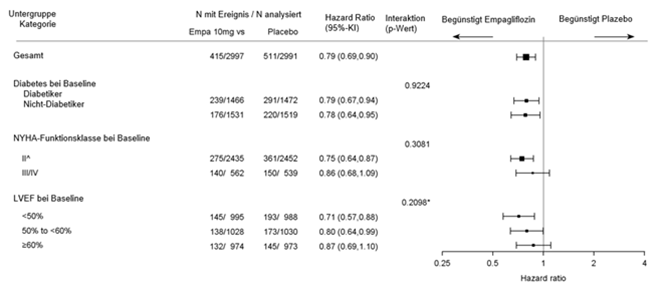
^4 Patienten mit NYHA-Funktionsklasse I werden zur Subgruppe NYHA-Funktionsklasse II gezählt
*Trendtest
Renaler Endpunkt
Während der Behandlungsphase nahm die eGFR in der Empagliflozin-Gruppe signifikant langsamer ab als in der Placebo-Gruppe (siehe Tabelle 10).
Chronische Nierenerkrankung
Eine randomisierte, doppelblinde, placebokontrollierte Studie zu Empagliflozin 10 mg einmal täglich (EMPA-KIDNEY) wurde bei 6609 Patienten mit chronischer Nierenerkrankung (eGFR ≥20–< 45 ml/min/1,73 m2 oder eGFR ≥45–< 90 ml/min/1,73 m2 mit einem Verhältnis von Albumin zu Kreatinin im Urin [urinary albumin to creatinine ratio, UACR] ≥200 mg/g) zur Beurteilung kardiorenaler Endpunkte als Add-on-Therapie zur Standardtherapie durchgeführt. Bei Patienten, die während der Studie dialysepflichtig wurden, konnte die Behandlung fortgesetzt werden. Zusammengesetzter primärer Endpunkt war die Zeit bis zum ersten Eintreten einer Progression der chronischen Nierenerkrankung (CKD; anhaltende Abnahme der eGFR um ≥40 % nach Randomisierung, anhaltende eGFR von < 10 ml/min/1,73 m², terminale Niereninsuffizienz oder renaler Tod) oder des kardiovaskulären (CV) Todes. Hospitalisierung unabhängig von der Ursache (erstmalig und wiederholt), erstes Eintreten einer Hospitalisierung wegen Herzinsuffizienz, kardiovaskulärer Tod und die Gesamtmortalität wurden in das bestätigende Testverfahren einbezogen. Der Grossteil der eingeschlossenen Patienten wurde zu Studienbeginn mit RAAS-Inhibitoren behandelt (85,2 % ACE-Hemmer oder Angiotensin-Rezeptor-Blocker).
Es wurden ingesamt 3304 bzw. 3305 Patienten randomisiert mit Empagliflozin 10 mg bzw. Placebo behandelt und über eine mediane Dauer von 24,3 Monaten beobachtet. Die Studienpopulation umfasste 66,8 % Männer und 33,2 % Frauen mit einem mittleren Alter von 63,3 Jahren (Spanne: 18–94 Jahre), 58,4 % davon waren weiss, 36,2 % asiatisch und 4,0 % schwarz/afroamerikanisch.
Zu Studienbeginn betrug die mittlere eGFR 37,3 ml/min/1,73 m2 (~78% mit einee eGFR < 45 ml/min/1,73 m2). Das mediane UACR betrug 329 mg/g. Die Hauptursachen chronischer Nierenerkrankung waren diabetische Nephropathie/diabetische Nierenerkrankung (31 %), Glomerulopathie (25 %), hypertensive/renovaskuläre Erkrankung (22 %).
Empagliflozin war Placebo bezüglich der Senkung des Risikos des primären zusammengesetzten Endpunktes aus Progression der CKD oder CV Tod überlegen. In einer vordefinierten Analyse reduzierte die Behandlung mit Empagliflozin das Risiko von terminaler Niereninsuffizienz oder CV Tod im Vergleich zu Placebo um 28 % (HR 0,72, 95%-KI 0,59 bis 0,89, nomineller p = 0,0017). Zusätzlich reduzierte Empagliflozin das Risiko von Hospitalisierung unabhängig von der Ursache signifikant (erstmalige und wiederholte) (siehe Tabelle 11).
Tabelle 11: Behandlungseffekt in Bezug auf den primären zusammengesetzten und wichtige sekundäre Endpunkte (Empa-KIDNEY), die in die vorgegebenen Bestätigungstests und ihre Komponenten aufgenommen wurden
|
|
Placebo
|
Empagliflozin 10 mg
| |
N
|
3305
|
3304
| |
Zeit bis zum ersten Eintreten einer Progression der Nierenerkrankung (anhaltende Abnahme der eGFR um ≥40 % nach Randomisierung, anhaltende eGFR von < 10 ml/min/1,73 m², terminale Niereninsuffizienz* oder renaler Tod) oder von kardiovaskulärem Tod, N (%)
|
558 (16,9)
|
432 (13,1)
| |
Hazard Ratio vs. Placebo (99,83 %-KI)
|
|
0,72 (0,59, 0,89)
| |
p-Wert für Überlegenheit
|
|
< 0,0001
| |
Anhaltende Abnahme der eGFR um ≥40 % nach Randomisierung, N (%)
|
474 (14,3)
|
359 (10,9)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,70 (0,61, 0,81)
| |
p-Wert
|
|
< 0,0001
| |
Terminale Niereninsuffizienz* oder anhaltende eGFR < 10 ml/min/1,73 m², N (%)
|
222 (6,7)
|
157 (4,8)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,68 (0,55, 0,84)
| |
p-Wert
|
|
0,0002
| |
Renaler Tod, N (%)**
|
4 (0,1)
|
4 (0,1)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
| |
p-Wert
|
|
| |
Kardiovaskulärer Tod, N (%)
|
70 (2,1)
|
59 (1,8)
| |
Hazard Ratio vs. Placebo (95 %-KI)
|
|
0,83 (0,59, 1,17)
| |
p-Wert
|
|
0,2932
| |
Eintreten von Hospitalisierung unabhängig von der Ursache (erstmalige und wiederholte), N der Ereignisse
|
1895
|
1612
| |
Hazard Ratio vs. Placebo (99,03 %-KI)
|
|
0,86 (0,76, 0,98)
| |
p-Wert
|
|
0,0022
| |
Zeit bis zum Tod jeder Ursache, N (%)
|
168 (5,1)
|
149 (4,5)
| |
Hazard Ratio vs. Placebo (97,1 %-KI)
|
|
0,87 (0,68, 1,11)
| |
p-Wert
|
|
0,2122
|
HHF = Hospitalisierung wegen Herzinsuffizienz, eGFR = geschätzte glomeruläre Filtrationsrate
* Terminale Niereninsuffizienz ist definiert als Beginn der bleibenden Dialysepflicht oder Erhalt eines Nierentransplantats.
** Es traten zu wenige Fälle von renalem Tod auf, um eine zuverlässige Hazard Ratio berechnen zu können.
Abbildung 4: Zeit bis zum ersten Eintreten von Progression der Nierenerkrankung oder adjudiziertem kardiovaskulärem Tod*
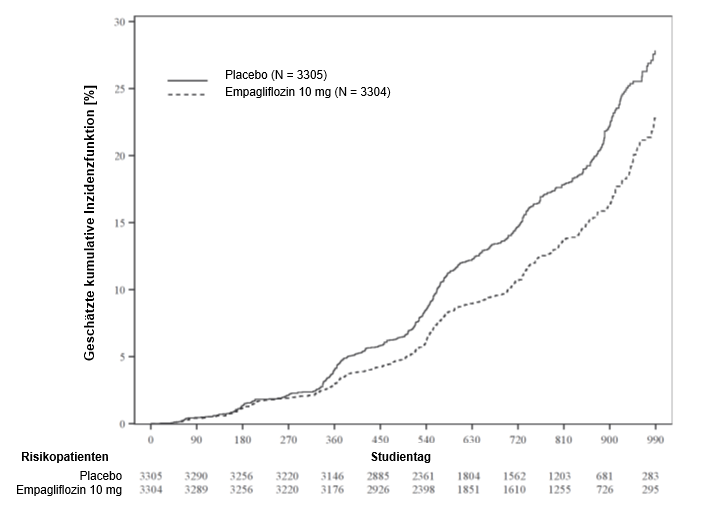
*geschätzte kumulative Inzidenzfunktion
Die Ergebnisse des primären zusammengesetzten Endpunkts waren über die vordefinierten Subgruppen, einschliesslich eGFR-Kategorien, Ursache der Nierenerkrankung, Diabetesstatus oder begleitende Anwendung von RAAS-Inhibitoren, allgemein konsistent. Der Behandlungsnutzen war bei Patienten mit höheren Albuminurie-Werten stärker ausgeprägt.
Empagliflozin verlangsamte die jährliche Rate der eGFR-Abnahme im Vergleich zu Placebo um 1,38 ml/min/1,73 m2/Jahr (95 %-KI 1,16, 1,59) basierend auf einer vordefinierten Analyse aller eGFR-Messungen, die ab dem Besuchstermin in Monat 2 bis zum letzten Nachbeobachtungstermin erfolgten.
Kinder und Jugendliche
Die klinische Wirksamkeit und Sicherheit von Empagliflozin 10 mg mit einer möglichen Dosiserhöhung auf 25 mg oder Linagliptin 5 mg einmal täglich wurde bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren mit T2DM im Rahmen einer doppelblinden, randomisierten, placebokontrollierten Parallelgruppenstudie (DINAMO) über einen Zeitraum von 26 Wochen untersucht, mit einer Verlängerungsphase mit doppelblinder wirkstoffhaltiger Behandlung zur Beurteilung der Sicherheit bis zu 52 Wochen.
Insgesamt 157 Patienten wurden entweder mit Empagliflozin (10 mg oder 25 mg; N = 52), Linagliptin (N = 52) oder Placebo (N = 53) behandelt. Zu den Hintergrundtherapien als Ergänzung zu diätetischen Massnahmen und körperlicher Aktivität gehörten Metformin (51 %), eine Kombination aus Metformin und Insulin (40,1 %), Insulin (3,2 %) oder aber es wurde keine Hintergrundtherapie verabreicht (5,7 %). Der mittlere HbA1c-Baselinewert lag bei 8,03 %. Die Studienpopulation umfasste 38,2 % männliche und 61,8 % weibliche Patienten bei einem Durchschnittsalter von 14,5 Jahren (Spanne: 10 bis 17 Jahre); 51,6 % waren mindestens 15 Jahre alt. Die Studienpopulation setzte sich ausserdem wie folgt zusammen: 49,7 % waren kaukasischer, 5,7 % asiatischer und 31,2 % afrikanischer/afroamerikanischer Herkunft. Der mittlere BMI betrug 36,04 kg/m², das mittlere Körpergewicht 99,92 kg. In die DINAMO-Studie wurden ausschliesslich Patienten mit einer eGFR ≥60 ml/min/1,73 m² aufgenommen.
Empagliflozin war Placebo hinsichtlich des primären Endpunkts – HbA1c-Reduktion nach 26 Wochen gegenüber Baseline – unabhängig von einer Bedarfsbehandlung oder einem Behandlungsabbruch, überlegen. Darüber hinaus führte die Behandlung mit Jardiance zu einer klinisch bedeutsamen FPG-Reduktion (Tabelle 12).
Tabelle 12: Ergebnisse einer 26-wöchigen placebokontrollierten Studie zu Empagliflozin bei Kindern und Jugendlichen mit Typ-2-Diabetes (modifiziertes Intention-To-Treat-Set)
|
|
Placebo
|
Empagliflozin
(10 und 25 mg, gepoolt)
| |
N
|
53
|
52
| |
HbA1c (%)¹
| |
Baseline (Mittelwert)
|
8,05
|
8,00
| |
Veränderung gegenüber Baseline²
|
0,68
|
-0,17
| |
Unterschied zu Placebo² (95%-KI)
|
|
-0,84
(-1,50, -0,19)
| |
p-Wert für Überlegenheit
|
|
0,0116
| |
N
|
52
|
48
| |
FPG (mg/dl) [mmol/l] 3,4
| |
Baseline (Mittelwert)
|
158,6 [8,80]
|
154,4 [8,57]
| |
Veränderung gegenüber Baseline²
|
15,7 [0,87]
|
-19,5 [-1,08]
| |
Unterschied zu Placebo² (95%-KI)
|
|
-35,2 (-58,6, -11,7)
[-1,95 (-3,25, -0,65)]
| |
nominaler p-Wert
|
|
0,0035
|
¹ Mehrfachimputation mit 500 Iterationen für fehlende Daten
² Im Hinblick auf Baseline und Stratifizierung adjustierter Mittelwert
³ Last Observation Carried Forward (LOCF), einschliesslich Baseline-Werte
4 nicht im Hinblick auf statistische Signifikanz beurteilt; nicht Teil des sequentiellen Testverfahrens
|





