ZusammensetzungWirkstoffe
Upadacitinib (als Upadacitinib Hemihydrat).
Hilfsstoffe
Mikrokristalline Cellulose, Hypromellose, Mannitol (E421), Weinsäure, hochdisperses Siliciumdioxid (wasserfrei), Magnesiumstearat, Polyvinylalkohol, Macrogol 3350, Talkum, Titandioxid (E171), Eisenoxid schwarz (E172) (nur in 15 mg Retardtabletten), Eisenoxid rot (E172), Eisenoxid gelb (E172) (nur in 45 mg Retardtabletten).
Indikationen/AnwendungsmöglichkeitenRheumatoide Arthritis
RINVOQ wird zur Behandlung von Erwachsenen mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis angewendet, die auf eine Behandlung mit einem oder mehreren konventionellen synthetischen krankheitsmodifizierenden Antirheumatika (csDMARD) unzureichend angesprochen haben oder diese nicht vertragen haben.
RINVOQ kann in Kombination mit Methotrexat oder anderen csDMARDs oder als Monotherapie bei erwachsenen Patienten angewendet werden.
Psoriasis-Arthritis
RINVOQ wird zur Behandlung von Erwachsenen mit aktiver Psoriasis-Arthritis angewendet, die auf eine Behandlung mit einem oder mehreren krankheitsmodifizierenden Antirheumatika (DMARDs) unzureichend angesprochen haben oder diese nicht vertragen haben. RINVOQ kann als Monotherapie oder in Kombination mit nicht-biologischen DMARDs angewendet werden.
Ankylosierende Spondylitis (Morbus Bechterew)
RINVOQ wird zur Behandlung von Erwachsenen mit aktiver ankylosierender Spondylitis angewendet, die auf nicht-steroidale Antirheumatika (NSAID) unzureichend angesprochen haben.
Riesenzellarteriitis
RINVOQ wird in Kombination mit einer ausschleichenden Kortikosteroidtherapie zur Behandlung von Erwachsenen mit aktiver rezidivierender Riesenzellarteriitis angewendet, die bei Einleitung der Gabe von RINVOQ nicht mehr als 60 mg Prednison pro Tag (oder einen äquivalenten Wirkstoff) benötigen.
Atopische Dermatitis
RINVOQ wird zur Behandlung von Erwachsenen mit mittelschwerer bis schwerer atopischer Dermatitis angewendet, wenn eine Therapie mit konventionellen topischen Medikamenten keine angemessene Krankheitskontrolle ermöglicht oder nicht angewendet werden kann.
Colitis ulcerosa
RINVOQ wird zur Behandlung von Erwachsenen mit mittelschwerer bis schwerer aktiver Colitis ulcerosa angewendet, die auf mindestens ein Biologikum unzureichend angesprochen haben, nicht mehr darauf ansprechen oder dieses nicht vertragen haben oder bei denen eine solche Therapie kontraindiziert ist.
Morbus Crohn
RINVOQ wird zur Behandlung von Erwachsenen mit mittelschwerem bis schwerem aktivem Morbus Crohn angewendet, die auf mindestens ein Biologikum unzureichend angesprochen haben, nicht mehr darauf ansprechen oder dieses nicht vertragen haben oder bei denen eine solche Therapie kontraindiziert ist.
Dosierung/AnwendungDie Behandlung mit RINVOQ sollte von Ärzten eingeleitet werden, die über Erfahrung in der Diagnose und Behandlung von Erkrankungen verfügen, für die RINVOQ indiziert ist.
Rheumatoide Arthritis, Psoriasis-Arthritis, Ankylosierende Spondylitis
Die empfohlene orale Dosis von RINVOQ beträgt 15 mg einmal täglich.
Riesenzellarteriitis
Die empfohlene Dosis von RINVOQ beträgt 15 mg einmal täglich in Kombination mit einem ausschleichenden Behandlungsschema mit Kortikosteroiden. Alle Patienten müssen vor dem Therapiebeginn mit RINVOQ vorgängig mit einer Kortikosteroidtherapie begonnen haben und die Dosis muss auf ≤60 mg Prednison-Aequivalent bis zum Therapiebeginn mit RINVOQ reduziert worden sein. Eine «de novo» Therapie mit RINVOQ bei gleichzeitigem Beginn einer Kortikosteroidtherapie ist nicht untersucht worden. RINVOQ 15 mg einmal täglich kann nach Beendigung der ausschleichenden Kortikosteroidtherapie als Monotherapie fortgeführt werden. Eine Behandlung über 52 Wochen hinaus kann unter Berücksichtigung der Krankheitsaktivität und des Risikos der Patienten für MACE, VTE und maligne Erkrankungen erwogen werden.
Atopische Dermatitis
Erwachsene
Die empfohlene orale Dosis von RINVOQ beträgt 15 mg einmal täglich.
Begleitende topische Therapie
RINVOQ kann mit oder ohne topische Kortikosteroide angewendet werden. Topische Calcineurin-Inhibitoren können intermittierend auf empfindlichen Bereichen wie Gesicht, Hals, intertriginöse Bereiche und Genitalbereich angewendet werden.
Die Behandlung mit RINVOQ soll abgebrochen werden, wenn die Behandlung nach 12 Wochen keinen therapeutischen Nutzen verspricht.
Colitis ulcerosa
Induktion
·Die empfohlene Induktionsdosis von RINVOQ beträgt 45 mg einmal täglich für 8 Wochen.
·Bei Patienten, die bis Woche 8 keinen ausreichenden therapeutischen Nutzen zeigen (s. Rubrik «Eigenschaften/Wirkungen»), kann unter Berücksichtigung des Risikos der Patienten für MACE, VTE und maligne Erkrankungen die Anwendung von RINVOQ 45 mg einmal täglich für weitere 8 Wochen erwogen werden.
·Es gibt keine Daten, die den Nutzen einer Induktionsbehandlung über 16 Wochen hinaus belegen. Bei Patienten, die bis Woche 16 keine Anzeichen für einen therapeutischen Nutzen zeigen, sollte RINVOQ dauerhaft abgesetzt werden.
Erhaltung (für Patienten mit klinischem Ansprechen nach 8 oder 16 Wochen Induktion)
·Die empfohlene Erhaltungsdosis von RINVOQ beträgt 15 mg oder 30 mg einmal täglich.
·Eine Dosis von 30 mg kann bei Patienten mit hoher Krankheitsaktivität oder Patienten, die eine Induktionsbehandlung über 16 Wochen benötigt haben oder auf 15 mg einmal täglich nicht genügend angesprochen haben (s. Rubrik «Eigenschaften/Wirkungen»), unter Berücksichtigung des Risikos der Patienten für MACE, VTE und maligne Erkrankungen (siehe «Warnhinweise und Vorsichtsmassnahmen») erwogen werden.
·Es soll immer die niedrigste wirksame Erhaltungsdosis angewendet werden.
·Bei Patienten ≥65 Jahre beträgt die empfohlene Erhaltungsdosis 15 mg einmal täglich.
·Bei Patienten, die auf die Behandlung mit RINVOQ angesprochen haben, können Kortikosteroide entsprechend dem Behandlungsstandard reduziert und/oder abgesetzt werden.
Für Dosisanpassungen bei gleichzeitiger Verabreichung mit starken Cytochrom P450 (CYP) 3A4-Inhibitoren, siehe «Interaktionen».
Morbus Crohn
Induktion
·Die empfohlene Induktionsdosis von RINVOQ beträgt 45 mg einmal täglich für 12 Wochen.
·Bei Patienten, die bis Woche 12 keinen ausreichenden therapeutischen Nutzen erzielen (s. Rubrik «Eigenschaften/Wirkungen»), kann unter Berücksichtigung des Risikos der Patienten für MACE, VTE und maligne Erkrankungen eine verlängerte Induktion für weitere 12 Wochen mit einer Dosis von 30 mg einmal täglich erwogen werden.
·Bei Patienten, die nach insgesamt 24 Wochen Behandlung keine Anzeichen für einen therapeutischen Nutzen zeigen, sollte RINVOQ dauerhaft abgesetzt werden.
Erhaltung (für Patienten mit klinischem Ansprechen nach 12 oder 24 Wochen Induktion)
·Die empfohlene Erhaltungsdosis von RINVOQ beträgt 15 mg oder 30 mg einmal täglich.
·Eine Dosis von 30 mg kann bei Patienten mit hoher Krankheitsaktivität oder Patienten, die eine Induktionsbehandlung über 24 Wochen benötigt haben oder auf 15 mg einmal täglich nicht genügend angesprochen haben (s. Rubrik «Eigenschaften/Wirkungen»), unter Berücksichtigung des Risikos der Patienten für MACE, VTE und maligne Erkrankungen (siehe «Warnhinweise und Vorsichtsmassnahmen») erwogen werden.
·Es soll immer die niedrigste wirksame Erhaltungsdosis angewendet werden.
·Bei Patienten ≥65 Jahre beträgt die empfohlene Erhaltungsdosis 15 mg einmal täglich.
Bei Patienten, die auf die Induktions- bzw. Erhaltungsbehandlung mit RINVOQ ansprechen, können Kortikosteroide entsprechend dem Behandlungsstandard reduziert und/oder abgesetzt werden.
Für Dosisanpassungen bei gleichzeitiger Verabreichung mit starken CYP3A4-Inhibitoren, siehe «Interaktionen».
Interaktionen
Für Patienten mit Colitis ulcerosa und Morbus Crohn, die starke CYP3A4-Inhibitoren (z.B. Ketoconazol, Clarithromycin) erhalten, ist die empfohlene Induktionsdosis 30 mg einmal täglich und die empfohlene Erhaltungsdosis ist 15 mg einmal täglich (siehe «Interaktionen»).
Art der Anwendung
Die empfohlene orale Dosis von RINVOQ kann mit oder ohne Nahrung eingenommen werden. RINVOQ Tabletten sind als Ganzes zu schlucken. Die Tabletten sollten nicht zerbrochen, zerkleinert oder zerkaut werden.
Therapieeinleitung
Es wird empfohlen, RINVOQ nicht bei Patienten mit einer absoluten Lymphozytenzahl (ALC) von weniger als 500 Zellen/mm3, einer absoluten Neutrophilenzahl (ANC) von weniger als 1000 Zellen/mm3 oder einem Hämoglobinspiegel von weniger als 8 g/dl anzuwenden.
Therapieunterbrechung
Wenn bei einem Patienten eine schwerwiegende Infektion auftritt, sollte die Behandlung mit RINVOQ unterbrochen werden, bis die Infektion unter Kontrolle ist (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Tabelle 1: Empfohlene Dosisunterbrechung bei abweichenden Laborwerten
|
Laborparameter
|
Massnahme
| |
Absolute Neutrophilenzahl (ANC)
|
Die Behandlung sollte bei einem ANC von < 1000 Zellen/mm3 unterbrochen werden und kann nach Anstieg des ANC über diesen Wert wieder begonnen werden.
| |
Absolute Lymphozytenzahl (ALC)
|
Die Behandlung sollte bei einem ALC von < 500 Zellen/mm3 unterbrochen werden und kann nach Anstieg des ALC über diesen Wert wieder begonnen werden.
| |
Hämoglobin (Hb)
|
Die Behandlung sollte bei einem Hb von < 8 g/dl unterbrochen werden und kann nach Anstieg des Hb über diesen Wert wieder begonnen werden.
| |
Hepatische Transaminasen
|
Bei Verdacht auf eine arzneimittelinduzierte Leberschädigung, sollte die Behandlung vorübergehend unterbrochen werden.
|
Versäumte Anwendung
Wenn eine Dosis RINVOQ versäumt wurde und dies mehr als 10 Stunden vor der nächsten geplanten Einnahme bemerkt wird, raten Sie dem Patienten/der Patientin, so bald wie möglich eine Dosis einzunehmen und dann die nächste Dosis zur gewohnten Zeit einzunehmen. Wenn eine Dosis versäumt wurde und dies weniger als 10 Stunden vor der nächsten geplanten Einnahme bemerkt wird, raten Sie dem Patienten/der Patientin, die versäumte Dosis auszulasssen und am nächsten Tag wie gewohnt nur eine einzelne Dosis einzunehmen. Raten Sie dem Patienten/der Patientin, die Dosis nicht zu verdoppeln, um eine versäumte Dosis nachzuholen.
Immunsuppressiva
Die Kombination mit anderen potenten Immunsuppressiva wie Azathioprin, 6-Mercapotpurin und Cyclosporin, Tacrolimus, und biologischen DMARDs oder anderen Januskinase (JAK)-Inhibitoren wurde in klinischen Studien nicht untersucht und wird nicht empfohlen.
Spezielle Dosierungsanweisungen
Patienten mit Leberfunktionsstörungen
Die Anwendung von RINVOQ bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh C) wird nicht empfohlen (siehe «Pharmakokinetik»).
Rheumatoide Arthritis, Psoriasis-Arthritis, Ankylosierende Spondylitis, Riesenzellarteriitis und Atopische Dermatitis
Bei Patienten mit leichter (Child-Pugh A) oder mittelschwerer (Child Pugh B) Leberfunktionsstörung ist keine Dosisanpassung erforderlich.
Colitis ulcerosa und Morbus Crohn
Bei Patienten mit leichter (Child-Pugh A) oder mittelschwerer (Child Pugh B) Leberfunktionsstörung ist die empfohlene Dosierung:
·Induktion: 30 mg einmal täglich
·Erhaltung: 15 mg einmal täglich
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter oder mittelschwerer Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Die Anwendung von RINVOQ wurde bei Patienten mit terminaler Niereninsuffizienz (geschätzte glomeruläre Filtrationsrate <15 ml/min/1,73 m2) nicht untersucht und ist daher bei diesen Patienten nicht empfohlen.
Bei Patienten mit schwerer Nierenfunktionsstörung wird folgende Dosierung empfohlen:
Tabelle 2: Empfohlene Dosis bei schwerer Nierenfunktionsstörunga
|
Indikation
|
Empfohlene Dosis (einmal täglich)
| |
Rheumatoide Arthritis, Psoriasis-Arthritis, ankylosierende Spondylitis, Riesenzellarteriitis, atopische Dermatitis
|
15 mg
| |
Colitis ulcerosa und Morbus Crohn
|
Induktionsdosis: 30 mg
| |
Erhaltungsdosis: 15 mg
| |
a
Geschätzte glomeruläre Filtrationsrate (eGFR) 15 bis < 30 ml/min/1.73m2
|
Ältere Patienten
Es liegen bei Patienten ab 75 Jahren limitierte Daten für alle Indikationen ausser Riesenzellarteriitis vor. Bei Patienten im Alter von 65 Jahren oder älter traten unerwünschte Wirkungen, einschliesslich schwerwiegender Infektionen, vermehrt auf.
Bei Colitis ulcerosa und Morbus Crohn werden Dosen über 15 mg einmal täglich für die Erhaltungstherapie bei Patienten im Alter von 65 Jahren und älter nicht empfohlen (siehe «Unerwünschte Wirkungen»).
Kinder und Jugendliche
Die Langzeit-Sicherheit von RINVOQ bei Kindern und Jugendlichen im Alter von 0 bis unter 18 Jahren wurde noch nicht gezeigt.
KontraindikationenÜberempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe (siehe «Zusammensetzung»).
Patienten mit aktiver Tuberkulose.
Warnhinweise und VorsichtsmassnahmenAnwendung bei Patienten über 65 Jahre
Angesichts des erhöhten Risikos für schwere Infektionen, Myokardinfarkt und maligne Erkrankungen im Zusammenhang mit JAK-Inhibitoren bei Patienten über 65 Jahren sollte RINVOQ bei Patienten in dieser Altersgruppe mit Colitis ulcerosa oder Morbus Crohn mit besonderer Vorsicht angewendet werden und bei Patienten in dieser Altersgruppe mit rheumatoider Arthritis, Psoriasis-Arthritis, ankylosierender Spondylitis, Riesenzellarteriitis oder atopischer Dermatitis nur, wenn keine geeigneten Behandlungsalternativen zur Verfügung stehen (siehe weitere Einzelheiten in «Warnhinweise und Vorsichtsmassnahmen»).
Bei Patienten ab 65 Jahren besteht unter 30 mg RINVOQ einmal täglich ein erhöhtes Risiko für Nebenwirkungen. Die empfohlene Dosis für die Langzeitanwendung beträgt für diese Patientengruppe 15 mg einmal täglich.
Verlängerte Induktion in Colitits Ulcerosa
Die Daten in den Patienten mit verlängerter Induktion (16 Wochen) sind limitiert. Es kann nicht ausgeschlossen werden, dass es für diese Patienten ein erhöhtes Risiko für Nebenwirkungen besteht.
Schwerwiegende Infektionen
Bei Patienten, die RINVOQ erhielten, wurde über schwerwiegende Infektionen, darunter auch solche mit tödlichem Ausgang, berichtet. Die häufigsten unter RINVOQ berichteten schwerwiegenden Infektionen waren Pneumonie, Zellulitis und Harnwegsinfektionen (siehe «Unerwünschte Wirkungen»). Bezüglich opportunistischer Infektionen unter RINVOQ wurde von Tuberkulose, multidermatomalem Herpes zoster, oraler/ösophagealer Candidose und Kryptokokkose berichtet.
Unter RINVOQ 30 mg wurde im Vergleich zu RINVOQ 15 mg eine höhere Rate von schwerwiegenden Infektionen beobachtet.
Die Anwendung von RINVOQ bei Patienten mit aktiver, schwerwiegender Infektion, einschliesslich lokalisierter Infektionen, ist zu vermeiden.
Vor Einleitung der Behandlung mit RINVOQ ist in folgenden Fällen eine Nutzen-Risiko-Abwägung anzustellen:
·bei Patienten mit chronischen oder rezidivierenden Infektionen,
·bei Patienten mit Tuberkulose Exposition,
·bei Patienten mit einer schwerwiegenden oder opportunistischen Infektion in der Anamnese,
·bei Patienten, die in Gebieten mit endemischer Tuberkulose oder endemischen Mykosen gelebt oder solche Gebiete bereist haben,
oder
·bei Patienten mit Grunderkrankungen, aufgrund derer sie anfällig für Infektionen sind.
Patienten sind während und nach Behandlung mit RINVOQ engmaschig auf Anzeichen und Symptome einer Infektion zu überwachen. Entwickelt ein Patient/eine Patientin eine schwerwiegende oder opportunistische Infektion, ist die Behandlung mit RINVOQ zu unterbrechen. Ein Patient/eine Patientin, bei dem/der während der Behandlung mit RINVOQ eine Neuinfektion auftritt, soll umgehend vollständigen diagnostischen Abklärungen unterzogen werden, welche für immungeschwächte Patienten angemessen sind; eine entsprechende antimikrobielle Therapie ist einzuleiten. Der Patient/die Patientin ist engmaschig zu überwachen und die Behandlung mit RINVOQ sollte unterbrochen werden, falls der Patient/die Patientin nicht auf die antimikrobielle Therapie anspricht. Sobald die Infektion unter Kontrolle ist, kann die Behandlung mit RINVOQ wieder aufgenommen werden.
Tuberkulose
Vor Therapiebeginn mit RINVOQ sollte ein Tuberkulose(TB)-Screening durchgeführt werden. RINVOQ soll nicht bei Patienten mit aktiver TB angewendet werden. Bei Patienten mit unbehandelter latenter TB muss vor Einleitung der Behandlung mit RINVOQ eine Tuberkuloseprophylaxe eingeleitet werden. Die Konsultation eines in der Tuberkulosebehandlung erfahrenen Arztes ist empfehlenswert, wenn entschieden werden soll, ob eine Anti-TB-Therapie im Einzelfall angemessen ist. Die Patienten sind auf die Entwicklung von Anzeichen und Symptomen einer TB zu überwachen; dies gilt auch für Patienten mit negativem Befund auf eine latente TB-Infektion vor Therapiebeginn.
Virusreaktivierung
Über Virusreaktivierung, einschliesslich über Fälle einer Reaktivierung von Herpesviren (z.B. Herpes zoster) und Hepatitis B, wurde in klinischen Studien berichtet (siehe «Unerwünschte Wirkungen»). In Japan scheint das Risiko für Herpes zoster höher zu sein unter einer Behandlung mit RINVOQ. Wenn ein Patient/eine Patientin einen Herpes zoster entwickelt, ist eine vorübergehende Unterbrechung von RINVOQ bis zum Abklingen der Episode in Erwägung zu ziehen.
Vor Beginn und während einer Therapie mit RINVOQ sollte entsprechend den klinischen Leitlinien ein Screening auf virale Hepatitis durchgeführt werden und auf eine Reaktivierung überwacht werden. Patienten, die positiv auf Hepatitis-C-Antikörper und Hepatitis-C-Virus-RNA getestet wurden, waren von den klinischen Studien ausgeschlossen. Patienten, die positiv auf das Hepatitis-B-Oberflächen-Antigen oder Hepatitis-B-Virus-DNA getestet wurden, waren von den klinischen Studien ausgeschlossen. Falls während der Behandlung mit RINVOQ Hepatitis-B-Virus-DNA festgestellt wird, ist ein Hepatologe zu konsultieren.
Impfungen
Es liegen keine Daten zum Ansprechen auf Impfungen mit Lebendimpfstoffen bei Patienten unter Behandlung mit RINVOQ vor. Anhand der aktuellen Datenlage kann nicht vollständig beurteilt werden, inwieweit RINVOQ die Immunantwort auf Neo- und/oder Booster-Antigene hemmt. Vor Einleitung der Therapie mit RINVOQ wird empfohlen, den Impfstatus der Patienten zu aktualisieren, dazu zählen je nach Situation auch Impfungen gegen Varizellen/Zosterinfektionen (siehe «Eigenschaften/Wirkungen»). Die Anwendung von attenuierten Lebendimpfstoffen wird während oder unmittelbar vor einer RINVOQ Behandlung nicht empfohlen. Wenn vor der Therapie mit RINVOQ eine Lebendimpfung in Betracht gezogen wird, muss das Zeitintervall zwischen einer Lebendimpfung und der Behandlung mit RINVOQ den aktuellen Impfleitlinien für immunmodulatorische Wirkstoffe entsprechen. In Übereinstimmung mit diesen Leitlinien sollte ein Lebendimpfstoff gegen Herpes zoster nur an Patienten mit bekannter Windpockenanamnese oder Windpocken-Zona-positiven verabreicht werden. Der Impfstoff sollte 4 Wochen vor der Behandlung mit einem aktiven immunmodulatorischen Wirkstoff wie RINVOQ verabreicht werden.
Gesamtmortalität
In einer grossen, randomisierten Sicherheitsstudie nach Markteinführung eines anderen JAK-Inhibitors bei RA-Patienten 50 Jahre und älter mit mindestens einem kardiovaskulären Risikofaktor wurde bei Patienten, die mit dem JAK-Inhibitor behandelt wurden, eine höhere Gesamtmortalitätsrate einschliesslich plötzlichem kardiovaskulärem Tod, im Vergleich zu mit Tumornekrosefaktor (TNF)-Inhibitoren behandelten Patienten, beobachtet. Wägen Sie Nutzen und Risiken für den einzelnen Patienten ab, bevor Sie eine Therapie mit RINVOQ beginnen oder fortsetzen.
Maligne Tumorerkrankungen
Tumorerkrankungen, einschliesslich Lymphome, wurden in klinischen Studien mit RINVOQ beobachtet (siehe «Unerwünschte Wirkungen»). Unter RINVOQ 30 mg wurde im Vergleich zu RINVOQ 15 mg eine höhere Rate an malignen Tumorerkrankungen (zurückzuführen auf NMSC) beobachtet. In einer grossen randomisierten Sicherheitsstudie nach Markteinführung bei Patienten ab 50 Jahren mit rheumatoider Arthritis und mindestens einem zusätzlichen kardiovaskulären Risikofaktor wurde unter einem anderen JAK-Inhibitor im Vergleich zu TNF-Inhibitoren eine erhöhte Inzidenz von Tumorerkrankungen, insbesondere Lungenkrebs, Lymphome und nicht-melanozytärer Hautkrebs (NMSC), beobachtet. In dieser Studie zeigte sich bei Patienten über 65 Jahren und bei Patienten, die aktuell rauchen oder in der Vergangenheit geraucht haben, ein zusätzlich erhöhtes Risiko für maligne Tumorerkrankungen.
RINVOQ sollte bei Patienten mit Colitis ulcerosa oder Morbus Crohn mit besonderer Vorsicht angewendet werden und bei Patienten mit rheumatoider Arthritis, Psoriasis-Arthritis, ankylosierender Spondylitis, Riesenzellarteriitis oder atopischer Dermatitis nur, wenn keine geeigneten Behandlungsalternativen zur Verfügung stehen. Dies gilt für:
·Patienten über 65 Jahre,
·Patienten, die gegenwärtig rauchen oder früher geraucht haben,
·Patienten mit anderen Risikofaktoren für maligne Erkrankungen (z.B. aktuelle maligne Erkrankung oder solche in der Vorgeschichte mit Ausnahme eines erfolgreich behandelten nicht-melanozytären Hautkrebses).
Nicht-melanozytärer Hautkrebs (NMSC)
Über NMSC wurde bei Patienten, welche mit RINVOQ behandelt wurden, berichtet. In einer grossen, randomisierten Sicherheitsstudie nach Markteinführung eines anderen JAK-Inhibitors bei RA-Patienten 50 Jahre und älter mit mindestens einem kardiovaskulären Risikofaktor wurde bei Patienten unter dem JAK-Inhibitor im Vergleich zu TNF-Inhibitoren insgesamt ein Anstieg von NMSC-Fällen, einschliesslich Plattenepithelkarzinome der Haut, beobachtet. Da die Inzidenz von NMSC bei älteren Patienten und bei Patienten mit NMSC in der Vorgeschichte höher ist, sollten diese Patienten mit Vorsicht behandelt werden. Bei Patienten mit erhöhtem Risiko für Hautkrebs werden regelmässige Hautuntersuchungen empfohlen (siehe «Unerwünschte Wirkungen»).
Thromboembolische Ereignisse
Unter der Behandlung mit JAK Inhibitoren einschliesslich RINVOQ wurden thromboembolische Ereignisse (tiefe Beinvenenthrombose, Lungenembolie und arterielle Thrombose) mit zum Teil fatalem Ausgang beobachtet.
In einer grossen randomisierten, aktiv kontrollierten Studie bei Patienten ab 50 Jahren mit rheumatoider Arthritis und mindestens einem zusätzlichen kardiovaskulären Risikofaktor wurde unter einem anderen JAK-Inhibitor im Vergleich zu TNF-Inhibitoren eine erhöhte und dosisabhängige Inzidenz von thromboembolischen Ereignissen inklusive Lungenembolien bei Patienten beobachtet, die mit dem JAK Inhibitor behandelt wurden, im Vergleich zu Patienten, die TNF-Inhibitoren erhielten. Die Mehrzahl dieser Ereignisse war schwerwiegend und einige führten zum Tod.
Verschreibende Ärzte sollen Patienten vor Behandlungsbeginn und während der Behandlung regelmässig auf Risikofaktoren für thrombembolische Ereignisse hin beurteilen. Untersuchen Sie Patienten mit Anzeichen und Symptomen eines thrombembolischen Ereignisses sofort und beenden Sie die Behandlung mit RINVOQ bei Patienten mit Verdacht auf ein thrombembolischen Ereignis, unabhängig von der Dosis oder Indikation.
Überempfindlichkeitsreaktionen
Schwerwiegende Überempfindlichkeitsreaktionen, darunter Anaphylaxie und Angioödem, wurden bei Patienten unter Behandlung mit RINVOQ in klinischen Studien gemeldet. Wenn eine klinisch signifikante Überempfindlichkeitsreaktion auftritt, ist die Behandlung mit RINVOQ abzubrechen und eine angemessene Therapie einzuleiten (siehe «Unerwünschte Wirkungen»).
Toxizität für den Embryo/Fötus
Tierexperimentelle Studien zeigten, dass RINVOQ dem Fötus schaden kann. Gebärfähige Frauen sind über das potenzielle Risiko für einen Fötus zu informieren und anzuhalten, eine zuverlässige Verhütungsmethode anzuwenden (siehe «Schwangerschaft, Stillzeit»).
Gastrointestinale Perforationen
Unter der Behandlung mit RINVOQ wurden selten gastrointestinale Perforationen beobachtet. Fälle von gastrointestinalen Perforationen wurden in klinischen Studien sowie nach der Markteinführung berichtet. RINVOQ sollte bei Patienten, welche ein Risiko für gastrointestinale Perforation haben könnten (z.B. Patienten mit divertikulärer Erkrankung, Divertikulitis in der Vergangenheit und Patienten, die nichtsteroidale Antirheumatika (NSAIDs), Kortikosteroide oder Opioide einnehmen) mit Vorsicht angewendet werden. Patienten mit neu auftretenden abdominalen Anzeichen und Symptomen sollten zur frühzeitigen Erkennung einer Divertikulitis oder einer gastrointestinalen Perforation umgehend untersucht werden.
Hämatologische Auffälligkeiten
Neutropenie – Die Behandlung mit RINVOQ war mit einer erhöhten Inzidenz von Neutropenie assoziiert (ANC < 1000 Zellen/mm3). Zwischen einer niedrigen Neutrophilenzahl und dem Auftreten schwerwiegender Infektionen bestand kein eindeutiger Zusammenhang.
Lymphopenie – In klinischen Studien mit RINVOQ wurde über ALCs < 500 Zellen/mm3 berichtet. Zwischen einer niedrigen Lymphozytenzahl und dem Auftreten schwerwiegender Infektionen bestand kein eindeutiger Zusammenhang.
Anämie – In klinischen Studien mit RINVOQ wurde über eine Abnahme des Hämoglobinspiegels auf < 8 g/dl berichtet.
Die Mehrzahl der oben genannten Blutwertveränderungen war vorübergehend und klang nach zeitweiliger Unterbrechung der Behandlung ab.
Die Werte sind vor Beginn und während der Behandlung entsprechend der routinemässigen Untersuchung des Patienten zu bestimmen. Bei Patienten, die die in Tabelle 1 dargestellten Kriterien erfüllen, sollte keine Behandlung begonnen werden bzw. sollte die Behandlung vorübergehend unterbrochen werden (siehe «Dosierung/Anwendung»).
Schwerwiegende unerwünschte kardiovaskuläre Ereignisse (MACE)
In einer grossen randomisierten, aktiv kontrollierten Studie bei Patienten ab 50 Jahren mit rheumatoider Arthritis und mindestens einem zusätzlichen kardiovaskulären Risikofaktor wurde unter einem anderen JAK-Inhibitor im Vergleich zu TNF-Inhibitoren eine erhöhte Inzidenz von MACE (definiert als kardiovaskulärer Tod, nicht tödlicher Myokardinfarkt und nicht tödlicher Schlaganfall) beobachtet. In dieser Studie zeigte sich bei Patienten über 65 Jahren, Patienten, die aktuell rauchen oder in der Vergangenheit geraucht haben, und bei Patienten mit kardiovaskulären Risikofaktoren ein zusätzlich erhöhtes Risiko für MACE.
RINVOQ sollte bei Patienten mit Colitis ulcerosa oder Morbus Crohn mit besonderer Vorsicht angewendet werden und bei Patienten mit rheumatoider Arthritis, Psoriasis-Arthritis, ankylosierender Spondylitis, Riesenzellarteriitis oder atopischer Dermatitis nur, wenn keine geeigneten Behandlungsalternativen zur Verfügung stehen. Dies gilt für:
·Patienten über 65 Jahre,
·Patienten, die gegenwärtig rauchen oder früher geraucht haben,
·Patienten mit anderen kardiovaskulären Risikofaktoren.
Lipide
Die Behandlung mit RINVOQ wurde mit einem Anstieg der Lipidwerte in Zusammenhang gebracht, darunter ein Anstieg des Gesamtcholesterins, des Low-Density Lipoprotein Cholesterin (LDL) und des High-Density Lipoprotein Cholesterin (HDL) (siehe «Unerwünschte Wirkungen»). Erhöhungen des LDL-Cholesterins gingen mit einer Statintherapie wieder auf die Werte vor Behandlungsbeginn zurück. Die Auswirkung dieser Lipidwerterhöhungen auf die kardiovaskuläre Morbidität und Mortalität wurden nicht untersucht.
Die Patienten sollten zwölf Wochen nach Beginn der Behandlung und danach entsprechend den internationalen klinischen Leitlinien für Hyperlipidämie zu überwachen.
Hypoglykämie bei Patienten, die aufgrund eines Diabetes behandelt werden
Nach Einleitung einer Therapie mit JAK-Inhibitoren bei Patienten, die Arzneimittel gegen Diabetes erhalten haben, wurden Fälle von Hypoglykämie berichtet. Bei Auftreten einer Hypoglykämie könnte eine Dosisanpassung der antidiabetischen Arzneimittel erforderlich sein.
Anstiege der hepatischen Transaminasen
Die Behandlung mit RINVOQ wurde im Vergleich zu Placebo mit häufigeren Anstiegen der Leberenzyme in Zusammenhang gebracht.
Die Werte sind vor Beginn und während der Behandlung entsprechend der routinemässigen Untersuchung des Patienten zu bestimmen. Es wird empfohlen, unverzüglich die Ursache des Anstiegs der Leberenzyme zu ermitteln, um eine mögliche arzneimittelbedingte Leberschädigung zu erkennen.
Falls im Rahmen von routinemässigen Untersuchungen des Patienten ALT- oder AST-Anstiege beobachtet werden und eine arzneimittelinduzierte Leberschädigung vermutet wird, sollte RINVOQ unterbrochen werden, bis eine solche Diagnose ausgeschlossen werden kann.
Arzneimittelrückstände im Stuhl
Bei Patienten unter RINVOQ wurden Arzneimittelrückstände im Stuhl oder in den Ausscheidungen des Stoma beobachtet. In den meisten Berichten wurden anatomische (z.B. Ileostomie, Stoma, Darmresektion) oder funktionelle gastrointestinale Erkrankungen mit verkürzten gastrointestinalen Transitzeiten beschrieben. Die Patienten sind anzuweisen, ihren Arzt zu kontaktieren, wenn Arzneimittelrückstände wiederholt auftreten. Die Patienten müssen klinisch überwacht und eine alternative Behandlung in Betracht gezogen werden, wenn das Therapieansprechen unzureichend ist.
InteraktionenMögliche Wirkungen anderer Arzneimittel auf die Pharmakokinetik von Upadacitinib
Upadacitinib wird in vitro durch CYP3A und in geringem Masse auch von CYP2D6 metabolisiert.
Starke CYP3A4 Inhibitoren
Die Upadacitinib-Exposition ist bei gleichzeitiger Verabreichung mit starken CYP3A4-Inhibitoren (z.B. Ketoconazol, Itraconazol, Posaconazol, Voriconazol, Clarithromycin und Grapefruit) erhöht. RINVOQ 15 mg einmal täglich sollte bei Patienten unter Langzeitbehandlung mit starken CYP3A4-Inhibitoren mit Vorsicht angewendet werden. Bei Patienten mit chronisch entzündlichen Darmerkrankungen, die starke CYP3A4 Inhibitoren anwenden, beträgt die empfohlene Induktionsdosis 30 mg einmal täglich und die empfohlene Erhaltungsdosis 15 mg einmal täglich (siehe «Dosierung/Anwendung»). Bei langfristiger Anwendung sind Alternativen zu starken CYP3A4-Inhibitoren in Betracht zu ziehen. Während der Anwendung von Upadacitinib sollten grapefruithaltige Speisen oder Getränke vermieden werden.
Starke CYP3A4 Induktoren
Die Upadacitinib-Exposition ist bei gleichzeitiger Verabreichung mit starken CYP3A4-Induktoren (z.B. Rifampicin) vermindert, was zu einer geringeren therapeutischen Wirkung von RINVOQ führen könnte (siehe «Pharmakokinetik»).
Die gleichzeitige Verabreichung von RINVOQ mit starken CYP3A4 Induktoren wird nicht empfohlen.
Andere Interaktionen
Methotrexat, Inhibitoren der OATP1B-Transporter und pH-modifizierende Arzneimittel (z. B. Antacida oder Protonenpumpeninhibitoren) haben keinen Einfluss auf die Plasmaexposition von Upadacitinib. Der metabolische Phänotyp von CYP2D6 hatte keinen Einfluss auf die Pharmakokinetik von Upadacitinib; dies lässt darauf schliessen, dass CYP2D6-Inhibitoren keine klinisch relevante Wirkung auf die Upadacitinib-Exposition haben.
Die Wirkung von gleichzeitig verabreichten Arzneimitteln auf die Upadacitinib Plasmaexposition ist in Tabelle 3 dargestellt.
Tabelle 3. Arzneimittelinteraktionen: Veränderung der Pharmakokinetik von Upadacitinib in Gegenwart gleichzeitig verabreichter Arzneimittel
|
|
Verhältnis (90 %-KI)a
|
| |
Gleichzeitig verabreichtes Arzneimittel
|
Behandlungsschema des gleichzeitig verabreichten Arzneimittels
|
Behandlungsschema von Upadacitinib
|
N
|
Cmax
|
AUC
|
Klinische Relevanz
| |
Methotrexat
|
10 bis 25 mg/Woche für mindestens 4 Wochen
|
6, 12 oder 24 mg zweimal täglichb x 26 Tage
|
10
|
0,97
(0,86-1,09)
|
0,99
(0,93-1,06)
|
Keine Dosisanpassung
| |
Starker CYP3A4-Inhibitor: Ketoconazol
|
400 mg einmal täglich x 6 Tage
|
Einzeldosis 3 mgb
|
11
|
1,70
(1,55-1,89)
|
1,75
(1,62-1,88)
|
Die empfohlene Dosis beträgt 15 mg einmal täglich bei rheumatoider Arthritis, Psoriasis- Arthritis, ankylosierender Spondylitis, Riesenzellarteriitis und atopischer Dermatitis. Bei Langzeit-anwendung mit Vorsicht anwenden.
Bei Colitis ulcerosa und Morbus Crohn sollte die Induktionsdosis auf 30 mg und die Erhaltungsdosis auf 15 mg reduziert werden, wenn sie mit starken CYP3A4-Inhibitoren kombiniert wird. Bei langfristiger Anwendung sind Alternativen zu starken CYP3A4-Inhibitoren in Betracht zu ziehen.
| |
Starker CYP3A4-Induktor: Rifampicin
|
600 mg einmal täglich x 9 Tage
|
Einzeldosis 12 mgb
|
12
|
0,49
(0,44-0,55)
|
0,39
(0,37-0,42)
|
Kann die Wirkung verringern.
Gleichzeitige Einnahme nicht empfohlen
| |
OATP1B-Inhibitor: Rifampicin
|
Einzeldosis 600 mg
|
Einzeldosis 12 mgb
|
12
|
1,14
(1,02-1,28)
|
1,07
(1,01-1,14)
|
Es ist keine Dosisanpassung empfohlen, wenn Upadacitinib gleichzeitig mit OATP1B-Inhibitoren verabreicht wird
|
KI: Konfidenzintervall
a Verhältnisse für Cmax und AUC wenn Upadacitinib gleichzeitig mit dem angegebenen Arzneimittel verabreicht wurde verglichen mit der alleinigen Verabreichung von Upadacitinib
b Upadacitinib wurde als Formulierung mit sofortiger Freisetzung verabreicht
Mögliche Wirkungen von Upadacitinib auf die Pharmakokinetik anderer Arzneimittel
In vitro Studien deuten darauf hin, dass Upadacitinib bei klinisch relevanten Konzentrationen die Aktivität von Cytochrom P450 (CYP) Enzymen (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 und CYP3A4) nicht inhibiert. In vitro Studien deuten darauf hin, dass Upadacitinib bei klinisch relevanten Konzentrationen CYP3A4 induziert, aber nicht CYP2B6 oder CYP1A2. In vitro Studien deuten darauf hin, dass Upadacitinib bei klinisch relevanten Konzentrationen die P-gp-, BCRP-, OATP1B1-, OATP1B3-, OCT1-, OCT2-, OAT1-, OAT3-, MATE1-, and MATE2K-Transporter nicht inhibiert.
Klinische Studien deuten darauf hin, dass Upadacitinib keine klinisch relevanten Auswirkungen auf die Pharmakokinetik gleichzeitig verabreichter Arzneimitteln hat. Nach 30 mg und 45 mg Upadacitinib einmal täglich waren die Auswirkungen der beiden Dosierungen auf die einzelnen CYP-Enzyme (CYP1A2, CYP3A, CYP2C9 und CYP2C19) ähnlich, mit Ausnahme der Auswirkung auf CYP2D6. Nach 30 mg und 45 mg Upadacitinib einmal täglich wurde eine schwache Induktion von CYP3A4 beobachtet. Eine schwache Inhibition von CYP2D6 wurde mit Upadacitinib 45 mg, aber nicht mit 30 mg beobachtet.
Die Wirkung von Upadacitinib auf die Plasmaexposition anderer Arzneimittel ist in Tabelle 4 dargestellt.
Tabelle 4. Arzneimittelinteraktionen: Veränderung der Pharmakokinetik gleichzeitig verabreichter Arzneimittel in Gegenwart von Upadacitinib
|
|
Verhältnis (90 %-KI)a
|
| |
Gleichzeitig verabreichtes Arzneimittel
|
Behandlungsschema des gleichzeitig verabreichten Arzneimittels
|
Behandlungsschema von Upadacitinib
|
N
|
Cmax
|
AUC
|
Klinische Relevanz
| |
Methotrexat
|
10 bis 25 mg/Woche für mindestens 4 Wochen
|
6, 12 oder 24 mg zweimal täglichb x 26 Tage
|
10
|
1,03
(0,86-1,23)
|
1,14
(0,91-1,43)
|
Keine Dosisanpassung
| |
Sensitives CYP1A2-Substrat: Koffein
|
Einzeldosis 200 mg
|
45 mg einmal täglichc x 11 Tage
|
18
|
1,05
(0,97-1,14)
|
1,04
(0,95-1,13)
|
Keine Dosisanpassung
| |
Sensitives CYP3A-Substrat: Midazolam
|
Einzeldosis 5 mg
|
30 mg einmal täglichc x 10 Tage
|
20
|
0,74
(0,68-0,80)
|
0,74
(0,68-0,80)
|
Keine Dosisanpassung
| |
Sensitives CYP3A-Substrat: Midazolam
|
Einzeldosis 5 mg
|
45 mg einmal täglichc x 10 Tage
|
19
|
0,75
(0,69-0,83)
|
0,76
(0,69-0,83)
|
Keine Dosisanpassung
| |
Sensitives CYP2D6-Substrat: Dextro-methorphan
|
Einzeldosis 30 mg
|
30 mg einmal täglichc x 11 Tage
|
20
|
1,09
(0,98-1,21)
|
1,07
(0,95-1,22)
|
Keine Dosisanpassung
| |
Sensitives CYP2D6-Substrat: Dextro-methorphan
|
Einzeldosis
30 mg
|
45 mg einmal täglichc x 11 Tage
|
19
|
1,30
(1,13- 1,50)
|
1,35
(1,18- 1,54)
|
Keine Dosisanpassung
| |
Sensitives CYP2C9-Substrat: Warfarin
|
Einzeldosis
10 mg
|
45 mg einmal täglichc x 11 Tage
|
18
|
1,18
(1,05-1,33)
|
1,12
(1,05-1,20)
|
Keine Dosisanpassung
| |
Sensitiver CYP2C19 Marker: Metabolisches Verhältnis (metabolic ratio) von 5-OH Omeprazol zu Omeprazol
|
Einzeldosis von 40 mg Omeprazol
|
45 mg einmal täglichc x 11 Tage
|
18
|
-
|
0,96
(0,90-1,02)
|
Keine Dosisanpassung
| |
CYP2B6 Substrat: Bupropion
|
Einzeldosis 150 mg
|
30 mg einmal täglichc x 11 Tage
|
22
|
0,87
(0,79-0,96)
|
0,92
(0,87-0,98)
|
Keine Dosisanpassung
| |
Rosuvastatin
|
Einzeldosis 5 mg
|
30 mg einmal täglichc x 10 Tage
|
12
|
0,77
(0,63-0,94)
|
0,67
(0,56-0,82)
|
Keine Dosisanpassung
| |
Atorvastatin
|
Einzeldosis 10 mg
|
30 mg einmal täglichc x 10 Tage
|
24
|
0,88
(0,79-0,97)
|
0,77
(0,70-0,85)
|
Keine Dosisanpassung
| |
Orales Kontrazeptivum: Ethinylestradiol
|
Einzeldosis 0,03 mg
|
30 mg einmal täglichc x 14 Tage
|
22
|
0,96
(0,89-1,02)
|
1,11
(1,04-1,19)
|
Keine Dosisanpassung
| |
Orales Kontrazeptivum: Levonorgestrel
|
Einzeldosis 0,15 mg
|
30 mg einmal täglichc x 14 Tage
|
22
|
0,96
(0,87-1,06)
|
0,96
(0,85-1,07)
|
Keine Dosisanpassung
|
KI: Konfidenzintervall
a Verhältnisse für Cmax und AUC wenn Upadacitinib gleichzeitig mit dem angegebenen Arzneimittel verabreicht wurde verglichen mit der alleinigen Verabreichung von Upadacitinib
b Formulierung mit sofortiger Freisetzung
c Formulierung mit verzögerter Freisetzung
Bei gleichzeitiger Verabreichung von Upadacitinib wird keine Dosisanpassung von CYP3A Substraten, CYP2D6 Substraten, Rosuvastatin oder Atorvastatin empfohlen. Upadacitinib hat keinen relevanten Einfluss auf die Plasmaexposition von Ethinylestradiol, Levonorgestrel, Methotrexat oder Arzneimitteln, die Substrate der Metabolisierung durch CYP1A2, CYP2B6, CYP2C19 oder CYP2C9 sind.
Schwangerschaft, StillzeitSchwangerschaft
Zur Anwendung von Upadacitinib bei Schwangeren liegen nur begrenzte Daten vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»). Upadacitinib war bei Ratten und Kaninchen teratogen und hatte bei Exposition in utero bei Rattenföten Auswirkungen auf die Knochen und bei Kaninchenföten Auswirkungen auf das Herz.
RINVOQ darf während der Schwangerschaft nicht angewendet werden, es sei denn, es ist klar notwendig. Gebärfähige Frauen sind anzuhalten, während der Behandlung und bis zu 4 Wochen nach der letzten Dosis von RINVOQ eine zuverlässige Verhütungsmethode anzuwenden.
Wird eine Patientin während der Behandlung mit RINVOQ schwanger, sind die werdenden Eltern über das potenzielle Risiko für den Fötus zu informieren.
Stillzeit
Es ist nicht bekannt, ob Upadacitinib oder dessen Metaboliten in die menschliche Muttermilch übergehen. Die zur Verfügung stehenden pharmakodynamischen/toxikologischen Daten vom Tier zeigten, dass Upadacitinib in die Milch übergeht.
Ein Risiko für Neugeborene/für Kinder ist möglich. RINVOQ sollte während der Stillzeit nicht angewendet werden. Eine Entscheidung muss getroffen werden, ob das Stillen oder die RINVOQ Therapie abgebrochen wird. Hierbei soll sowohl der Nutzen des Stillens für das Kind, als auch der Nutzen der Therapie für die Mutter berücksichtigt werden.
Fertilität
Der Einfluss von Upadacitinib auf die menschliche Fertilität wurde nicht untersucht. Tierexperimentelle Studien zeigten keinen Einfluss auf die Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenUpadacitinib kann einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben, weil ein Schwindelgefühl und Drehschwindel bei der Behandlung mit RINVOQ auftreten können (siehe «Unerwünschte Wirkungen»).
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
In den placebokontrollierten klinischen Studien zu rheumatoider Arthritis, Psoriasis-Arthritis und ankylosierender Spondylitis waren die am häufigsten berichteten unerwünschten Arzneimittelwirkungen (UAWs), die bei ≥2 % der mit RINVOQ 15 mg behandelten Patienten auftraten, Infektionen der oberen Atemwege, Kreatinphosphokinase (CPK) im Blut erhöht, erhöhte Alanintransaminase, Bronchitis, Übelkeit, Neutropenie, Husten, erhöhte Aspartattransaminase und Hypercholesterinämie.
In den placebokontrollierten klinischen Studien zur atopischen Dermatitis waren die am häufigsten berichteten unerwünschten Arzneimittelwirkungen (≥2 % der Patienten) unter RINVOQ 15 mg Infektionen der oberen Atemwege, Akne, Herpes simplex, Kopfschmerzen, CPK im Blut erhöht, Husten, Follikulitis, Abdominalschmerz, Übelkeit und Grippe.
In den placebokontrollierten klinischen Studien zur Induktions- und Erhaltungstherapie bei Colitis ulcerosa und Morbus Crohn waren die am häufigsten berichteten unerwünschten Arzneimittelwirkungen (≥3 % der Patienten) unter RINVOQ 45 mg, 30 mg oder 15 mg Infektionen der oberen Atemwege, Fieber, CPK im Blut erhöht, Anämie, Kopfschmerzen, Akne, Herpes zoster, Neutropenie, Ausschlag, Pneumonie, Hypercholesterinämie, Bronchitis, erhöhte Aspartattransaminase, Ermüdung, Follikulitis, erhöhte Alanintransaminase, Herpes simplex und Grippe.
Die häufigsten schwerwiegenden unerwünschten Wirkungen waren schwerwiegende Infektionen (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Rheumatoide Arthritis
Insgesamt wurden in klinischen Studien zu rheumatoider Arthritis 4443 Patienten mit RINVOQ behandelt, was einer Exposition von 5263 Patientenjahren entspricht. Von diesen Patienten wurden 2972 mindestens ein Jahr lang mit RINVOQ behandelt. In den Phase-III-Studien erhielten 2630 Patienten mindestens eine Dosis RINVOQ 15 mg; 1607 dieser Patienten wurden mindestens ein Jahr lang behandelt.
Drei placebokontrollierte Studien (1035 Patienten unter RINVOQ 15 mg einmal täglich und 1042 Patienten unter Placebo) wurden in die Auswertung zur Sicherheit von RINVOQ 15 mg im Vergleich zu Placebo für eine Behandlungsdauer von bis zu 12-14 Wochen nach Beginn der Behandlung einbezogen.
Psoriasis-Arthritis
Insgesamt wurden in klinischen Studien zu Psoriasis-Arthritis 1827 Patienten mit RINVOQ behandelt, was einer Exposition von 1639,2 Patientenjahren entspricht. Von diesen Patienten wurden 722 mindestens ein Jahr lang mit RINVOQ behandelt. In den Phase-III-Studien erhielten 907 Patienten mindestens eine Dosis RINVOQ 15 mg; 359 dieser Patienten wurden mindestens ein Jahr lang behandelt.
Zwei placebokontrollierte Studien (640 Patienten unter RINVOQ 15 mg einmal täglich und 635 Patienten unter Placebo) wurden in die Auswertung zur Sicherheit von RINVOQ 15 mg im Vergleich zu Placebo für eine Behandlungsdauer von bis zu 24 Wochen nach Beginn der Behandlung einbezogen.
Ankylosierende Spondylitis
Insgesamt wurden in den beiden klinischen Studien zu ankylosierender Spondylitis 596 Patienten mit RINVOQ 15 mg behandelt, was einer Exposition von 577.3 Patientenjahren entspricht. Von diesen Patienten wurden 228 mindestens ein Jahr lang mit RINVOQ 15 mg behandelt.
Riesenzellarteriitis
In der Phase-III-Studie erhielten 209 Patienten mit Riesenzellarteriitis mindestens eine Dosis RINVOQ 15 mg; von diesen wurden 122 während der 52wöchigen placebokontrollierten Phase mindestens ein Jahr lang behandelt.
Atopische Dermatitis
Insgesamt wurden in klinischen Studien zu atopischer Dermatitis 2898 Patienten mit RINVOQ behandelt, was einer Exposition von etwa 3255 Patientenjahren entspricht. Von diesen Patienten wurden 1920 mindestens ein Jahr lang behandelt. In den drei globalen Phase-III-Studien erhielten 1239 Patienten mindestens eine Dosis RINVOQ 15 mg, von diesen wurden 791 mindestens ein Jahr lang behandelt.
Vier globale placebokontrollierte Studien (eine Phase-II- und drei Phase-III-Studien) wurden in die Auswertung zur Sicherheit von RINVOQ 15 mg im Vergleich zu Placebo für eine Behandlungsdauer von bis zu 16 Wochen nach Beginn der Behandlung einbezogen. Dabei erhielten 899 Patienten RINVOQ 15 mg einmal täglich und 902 Patienten Placebo.
Colitis ulcerosa
RINVOQ wurde bei Patienten mit mittelschwerer bis schwerer aktiver Colitis ulcerosa in einer Phase IIb und in drei randomisierten, doppelblinden, placebokontrollierten klinischen Phase-III-Studien (UC-1, UC-2 und UC-3) und einer Langzeitstudie (siehe «Klinische Wirksamkeit») mit insgesamt 1313 Patienten (entsprechend einer Exposition von 3537 Patientenjahren) untersucht, von denen 959 Patienten mindestens ein Jahr lang behandelt wurden.
In den Induktionsstudien (Phase IIb, UC-1 und UC-2) erhielten 719 Patienten mindestens eine Dosis RINVOQ 45 mg, 513 wurden 8 Wochen lang behandelt und 127 Patienten bis zu 16 Wochen.
In der Erhaltungsstudie UC-3 und der Langzeitstudie erhielten 285 Patienten mindestens eine Dosis RINVOQ 15 mg, von denen 193 mindestens ein Jahr lang behandelt wurden, und 291 Patienten mindestens eine Dosis RINVOQ 30 mg, von denen 214 mindestens ein Jahr lang behandelt wurden.
Morbus Crohn
RINVOQ wurde bei Patienten mit mittelschwerem bis schwerem aktivem MC in drei randomisierten, doppelblinden, placebokontrollierten klinischen Phase-III-Studien (CD-1, CD-2 und CD-3, siehe «klinische Wirksamkeit») mit insgesamt 833 Patienten (entsprechend 1203 Patientenjahren) untersucht, von denen insgesamt 536 Patienten mindestens ein Jahr lang behandelt wurden.
In den Induktionsstudien (CD-1 und CD-2) erhielten 674 Patienten während der placebokontrollierten Phase mindestens eine Dosis RINVOQ 45 mg, 592 über mindestens 12 Wochen; 142 Patienten erhielten in der Fortsetzungsphase mindestens eine Dosis RINVOQ 30 mg.
In der Erhaltungsstudie CD-3 erhielten 221 Patienten mindestens eine Dosis RINVOQ 15 mg, 89 über mindestens ein Jahr, und 229 Patienten mindestens eine Dosis RINVOQ 30 mg, 107 wurden mindestens ein Jahr behandelt.
Zusammenfassung der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nachstehend nach Systemorganklasse und Häufigkeit aufgeführt. Die Häufigkeitskategorien sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, < 1/10), gelegentlich (≥1/1000, < 1/100), selten (≥1/10000, < 1/1000) oder sehr selten (< 1/10000). Die Häufigkeiten basieren auf den jeweils höchsten Raten der unerwünschten Wirkungen, die mit RINVOQ in den klinischen Studien von einer oder mehreren Indikationen (rheumatoide Erkrankungen (15 mg), atopische Dermatitis (15 mg und 30 mg), Colitis ulcerosa (15 mg, 30 mg und 45 mg) oder Morbus Crohn (15 mg, 30 mg und 45 mg)) berichtet wurden. Innerhalb jeder Häufigkeitsgruppe sind die unerwünschten Wirkungen nach abnehmendem Schweregrad angegeben. Wenn beträchtliche Unterschiede der Häufigkeit zwischen den Indikationen beobachtet wurden, werden diese in den Fussnoten weiter unten aufgezeigt.
Infektionen und parasitäre Erkrankungen
Sehr häufig: Infektionen der oberen Atemwege (URTI)a (22.6 % für 15 mg und 25.4 % für 30 mg in Studien zur atopischen Dermatitis)
Häufig: Bronchitisb,c, Herpes zosterd, Herpes simplexe, Follikulitis, Grippe, Pneumonief,g, Harnwegsinfektion
Gelegentlich: orale Candidose
Gutartige, bösartige und nicht spezifizierte Neubildungen (einschl. Zysten und Polypen)
Häufig: Nicht-melanozytärer Hautkrebsc,h,i
Erkrankungen des Blutes und des Lymphsystems
Häufig: Neutropeniej, Anämie, Lymphopeniek
Stoffwechsel- und Ernährungsstörungen
Häufig: Hypercholesterinämiec,l, Hyperlipidämiem, Gewicht erhöhth
Gelegentlich: Hypertriglyzeridämie
Erkrankungen des Nervensystems
Häufig: Kopfschmerzenn,w, Schwindelgefühl
Erkrankungen des Ohrs und des Labyrinths
Häufig: Drehschwindelo
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig: Husten
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Abdominalschmerzp
Gelegentlich: Gastrointestinale Perforationq
Leber- und Gallenerkrankungen
Häufig: ALT erhöhtc, AST erhöhtc
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: Akneh,r,s,t (9,6 % für 15 mg und 15,1 % für 30 mg in Studien zur atopischen Dermatitis)
Häufig: Urtikariah,s, Ausschlagu
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Kreatinphosphokinase (CPK) im Blut erhöht
Allgemeine Erkrankungen
Häufig: Fieber, Ermüdung, peripheres Ödemv,x
a URTI umfasst akute Sinusitis, Laryngitis, virale Laryngitis, Nasopharyngitis, Schmerzen im Oropharynx, Pharynxabszess, Pharyngitis, Pharyngitis durch Streptokokken, Pharyngotonsillitis, Atemwegsinfektion, Virusinfektion der Atemwege, Rhinitis, Rhinolaryngitis, Sinusitis, Tonsillitis, bakterielle Tonsillitis, Infektion der oberen Atemwege, virale Pharyngitis und virale Infektion der oberen Atemwege.
b Bronchitis umfasst Bronchitis, bakterielle Bronchitis, virale Bronchitis und Tracheobronchitis.
c In Studien zur atopischen Dermatitis traten Bronchitis, nicht-melanozytärer Hautkrebs, Hypercholesterinämie, erhöhte ALT und erhöhte AST gelegentlich auf.
d Herpes zoster umfasst Herpes zoster, disseminierte Herpes-zoster-Infektion, Herpes-zoster-Meningitis, postherpetische Neuralgie und Varizella-zoster-Virusinfektion.
e Herpes simplex umfasst genitalen Herpes, genitalen Herpes simplex, Herpesdermatitis, Zoster ophthalmicus, Herpes simplex, Herpes-simplex-Pharyngitis, Herpesvirus-Infektion, Nasenherpes, Herpes simplex am Auge und oralen Herpes.
f Pneumonie umfasst atypische Pneumonie, COVID-19-Pneumonie, Pneumonie, Pneumonie durch Bakterien, Pneumonie durch Pneumokokken und virale Pneumonie.
g Pneumonie trat bei Morbus Crohn häufig und bei anderen Indikationen gelegentlich auf.
h In Studien zu Morbus Crohn trat Akne häufig und Urtikaria, erhöhtes Gewicht und nicht-melanozytärer Hautkrebs gelegentlich auf.
i Nicht-melanozytärer Hautkrebs umfasst das Basalzellkarzinom.
j Neutropenie umfasst Granulozytenzahl erniedrigt, Neutropenie und Neutrophilenzahl erniedrigt.
k Lymphopenie umfasst Lymphozytenzahl erniedrigt, Lymphozytenprozentzahl erniedrigt und Lymphopenie.
l Hypercholesterinämie umfasst Cholesterin im Blut erhöht und Hypercholesterinämie.
m Hyperlipidämie umfasst Dyslipidämie, Hyperlipidämie und Low density Lipoprotein erhöht.
n Kopfschmerzen umfassen Kopfschmerzen, Sinuskopfschmerzen und Spannungskopfschmerzen.
o Drehschwindel umfasst Drehschwindel, Lagerungsvertigo, Labyrinthschwindel
p Abdominalschmerz umfasst Abdominalschmerz, Schmerzen Unterbauch, Schmerzen Oberbauch, abdominalen Druckschmerz und gastronintestinalen Schmerz.
q Die Häufigkeit basiert auf klinischen Studien zu Morbus Crohn.
r Akne umfasst Akne, Akne cystica und Dermatitis akneiform.
s In Studien zu den rheumatoiden Erkrankungen trat Akne häufig und Urtikaria gelegentlich auf.
t In Studien zur Colitis ulcerosa trat Akne häufig auf.
u Ausschlag umfasst Ausschlag, erythematösen Ausschlag, Ausschlag follikulär, makulösen Ausschlag, Ausschlag makulo-papulös, Ausschlag papulös, Ausschlag mit Juckreiz, Ausschlag pustulös und Ausschlag generalisiert
v Peripheres Ödem umfasst Ödem und peripheres Ödem.
w In der Studie zu Riesenzellarteriitis traten Kopfschmerzen sehr häufig auf.
x Die Häufigkeit basiert auf der Studie zur Riesenzellarteriitis.
Rheumatoide Arthritis
Beschreibung ausgewählter Nebenwirkungen
Infektionen
In placebokontrollierten klinischen Studien in Kombination mit DMARDs betrug die Infektionshäufigkeit über einen Zeitraum von 12/14 Wochen in der Gruppe unter RINVOQ 15 mg 27,4 % gegenüber 20,9 % in der Placebogruppe. In MTXkontrollierten Studien betrug die Infektionshäufigkeit über einen Zeitraum von 12/14 Wochen in der Monotherapiegruppe unter RINVOQ 15 mg 19,5 % im Vergleich zu 24,0 % in der MTX-Gruppe. Insgesamt betrug die langfristige Rate der Infektionen in der Gruppe unter RINVOQ 15 mg in allen fünf klinischen Phase-III-Studien (2630 Patienten) 93,7 Ereignisse auf 100 Patientenjahre.
In placebokontrollierten klinischen Studien in Kombination mit DMARDs betrug die Rate schwerwiegender Infektionen über einen Zeitraum von 12/14 Wochen in der Gruppe unter RINVOQ 15 mg 1,2 % gegenüber 0,6 % in der Placebogruppe. In MTXkontrollierten Studien betrug die Rate schwerwiegender Infektionen über einen Zeitraum von 12/14 Wochen in der Monotherapiegruppe unter RINVOQ 15 mg 0,6 % gegenüber 0,4 % in der MTX-Gruppe. Insgesamt betrug die langfristige Rate schwerwiegender Infektionen in der Gruppe unter RINVOQ 15 mg in allen fünf klinischen Phase-III-Studien 3,8 Ereignisse auf 100 Patientenjahre. Die am häufigsten berichteten schwerwiegenden Infektionen waren Pneumonie und Zellulitis. Die Rate für schwerwiegende Infektionen blieb unter Langzeitanwendung stabil.
Tuberkulose
In placebokontrollierten klinischen Studien in Kombination mit DMARDs wurden in keiner Behandlungsgruppe von Fällen aktiver Tuberkulose berichtet. In MTXkontrollierten Studien gab es über einen Zeitraum von 12/14 Wochen weder in der Monotherapiegruppe unter RINVOQ 15 mg noch in der MTX-Gruppe Fälle mit aktiver TB. Insgesamt betrug die langfristige Rate aktiver TB in der Gruppe unter RINVOQ 15 mg in allen fünf klinischen Phase-III-Studien 0,1 Ereignisse auf 100 Patientenjahre.
Opportunistische Infektionen (ausser Tuberkulose)
In placebokontrollierten klinischen Studien in Kombination mit DMARDs betrug die Rate opportunistischer Infektionen über einen Zeitraum von 12/14 Wochen in der Gruppe unter RINVOQ 15 mg 0,5 % gegenüber 0,3 % in der Placebogruppe. In MTXkontrollierten Studien gab es über einen Zeitraum von 12/14 Wochen in der Monotherapiegruppe unter RINVOQ 15 mg keine Fälle; in der MTX-Gruppe lag die Rate opportunistischer Infektionen bei 0,2 %. Insgesamt betrug die langfristige Rate opportunistischer Infektionen in der Gruppe unter RINVOQ 15 mg in allen fünf klinischen Phase-III-Studien 0,6 Ereignisse auf 100 Patientenjahre.
Die Langzeitrate von Herpes zoster unter RINVOQ 15 mg betrug in allen fünf klinischen Phase-III-Studien 3,7 Ereignisse auf 100 Patientenjahre. Die meisten Herpes-zoster-Ereignisse betrafen ein einzelnes Dermatom und waren nicht schwerwiegend.
Tumorerkrankungen
In placebokontrollierten klinischen Studien in Kombination mit DMARDs betrug die Rate an Tumorerkrankungen ausser NMSC über einen Zeitraum von 12/14 Wochen in der Gruppe unter RINVOQ 15 mg < 0,1 % gegenüber < 0,1 % in der Placebogruppe. In MTXkontrollierten Studien betrug die Rate an Tumorerkrankungen ausser NMSC über einen Zeitraum von 12/14 Wochen in der Monotherapiegruppe unter RINVOQ 15 mg 0,6 % gegenüber 0,2 % in der MTX-Gruppe. Insgesamt betrug die langfristige Inzidenz von Tumorerkrankungen ausser NMSC in der Gruppe unter RINVOQ 15 mg im klinischen Studienprogramm 0,8 Ereignisse auf 100 Patientenjahre.
Nicht-melanozytärer Hautkrebs (NMSC)
In placebokontrollierten klinischen Studien betrug die Rate vom NMSC über einen Zeitraum von 12/14 Wochen in der Gruppe unter RINVOQ 15 mg 0 % gegenüber < 0,1% in der Placebogruppe. Die langfristige Rate von NMSC war für alle Patienten im klinischen Studienprogramm, die mit RINVOQ 15 mg behandelt wurden, 0,3 Ereignisse auf 100 Patientenjahre.
Gastrointestinale Perforationen
In placebokontrollierten klinischen Studien in Kombination mit DMARDs betrug die Rate gastrointestinaler Perforationen in der Gruppe unter RINVOQ 15 mg 0,2 % gegenüber 0 % in der Placebogruppe. In MTXkontrollierten Studien gab es über einen Zeitraum von 12/14 Wochen weder in der Monotherapiegruppe unter RINVOQ 15 mg noch in der MTX-Gruppe Fälle gastrointestinaler Perforationen. Insgesamt betrug die langfristige Rate gastrointestinaler Perforationen in der Gruppe unter RINVOQ 15 mg in allen fünf klinischen Phase-III-Studien 0,08 Ereignisse auf 100 Patientenjahre.
Thrombose
In placebokontrollierten Studien in Kombination mit DMARDs kam es zu zwei (0,2 %) venösen Thrombose-Ereignissen (VTE; Lungenembolie oder tiefe Venenthrombose) in der Gruppe unter RINVOQ 15 mg gegenüber einem Ereignis (0,1 %) in der Placebogruppe. In MTXkontrollierten Studien gab es über einen Zeitraum von 12/14 Wochen in der Monotherapiegruppe unter RINVOQ 15 mg eine VTE (0,2 %); in der MTX-Gruppe trat kein Ereignis auf. Insgesamt betrug die langfristige VTE-Rate in der Gruppe unter RINVOQ 15 mg in allen fünf klinischen Phase-III-Studien 0,6 Ereignisse auf 100 Patientenjahre.
Anstiege der hepatischen Transaminasen
In placebokontrollierten Studien in Kombination mit DMARDs wurden über einen Zeitraum von bis zu 12/14 Wochen bei mindestens einer Bestimmung Anstiege der Alanintransaminase (ALT) und Aspartattransaminase (AST) von ≥3 x des oberen normalen Grenzwerts (ULN) bei 2,1 % bzw. 1,5 % der mit RINVOQ 15 mg behandelten Patienten beobachtet, verglichen mit 1,5 % bzw. 0,7 % bei den mit Placebo behandelten Patienten. Die meisten Fälle eines Anstiegs der hepatischen Transaminasen waren asymptomatisch und vorübergehend.
In MTXkontrollierten Studien wurden über einen Zeitraum von bis zu 12/14 Wochen bei mindestens einer Bestimmung ALT- und AST-Anstiege von ≥3 x des ULN bei 0,8 % bzw. 0,4 % der mit RINVOQ 15 mg behandelten Patienten beobachtet, verglichen mit 1,9 % bzw. 0,9 % bei den mit MTX behandelten Patienten.
Das Muster und die Inzidenz der ALT-/AST-Anstiege blieben im Zeitverlauf stabil; dies galt auch für die anschliessenden Langzeitstudien.
Anstiege der Lipidwerte
Die Behandlung mit RINVOQ 15 mg war mit einem Anstieg der Lipidwerte verbunden, einschliesslich einem Anstieg des Gesamtcholesterins, der Triglyzeride, des LDL-Cholesterins und HDL-Cholesterins. Anstiege des LDL- und HDL-Cholesterins waren nach 8 Wochen am höchsten und blieben danach stabil. Die Veränderungen der Lipidwerte gegenüber den Ausgangswerten, die in kontrollierten Studien über einen Zeitraum von bis zu 12/14 Wochen unter RINVOQ 15 mg auftraten, sind nachstehend zusammengefasst:
·Das mittlere LDL-Cholesterin stieg um 0,38 mmol/l an.
·Das mittlere HDL-Cholesterin stieg um 0,21 mmol/l an.
·Der mittlere LDL/HDL-Quotient blieb stabil.
·Der mittlere Triglyzeridwert stieg um 0,15 mmol/l an.
Kreatinphosphokinase (CPK)
In placebokontrollierten Studien in Kombination mit DMARDs wurden über einen Zeitraum von bis zu 12/14 Wochen Anstiege der Kreatinphosphokinase (CPK) beobachtet. CPK-Anstiege von > 5 x des ULN wurden nach 12/14 Wochen bei 1,0 % der Patienten in der Gruppe unter RINVOQ 15 mg und bei 0,3 % in der Placebogruppe beobachtet. Die meisten Erhöhungen von > 5 x des ULN waren vorübergehend und erforderten keinen Behandlungsabbruch. Die mittleren CPK-Werte stiegen bis Woche 4 an und blieben danach, auch unter verlängerter Behandlung, auf dem höheren Wert stabil.
Neutropenie
In placebokontrollierten Studien in Kombination mit DMARDs kam es über einen Zeitraum von bis zu 12/14 Wochen bei 1,1 % der Patienten in der Gruppe unter RINVOQ 15 mg und bei < 0,1 % in der Placebogruppe bei mindestens einer Bestimmung zu einem Rückgang der Neutrophilenzahl unter 1000 Zellen/mm3. In klinischen Studien wurde die Behandlung bei einem ANC von < 1000 Zellen/mm3 unterbrochen. Das Muster und die Inzidenz des Rückgangs der Neutrophilenzahl blieben im Zeitverlauf auch unter verlängerter Therapie stabil auf einem niedrigeren Wert als dem Ausgangswert.
Lymphopenie
In placebokontrollierten Studien in Kombination mit DMARDs kam es über einen Zeitraum von bis zu 12/14 Wochen bei 0,9 % der Patienten in der Gruppe unter RINVOQ 15 mg und bei 0,7 % in der Placebogruppe bei mindestens einer Bestimmung zu einem Rückgang der Lymphozytenzahl unter 500 Zellen/mm3.
Anämie
In placebokontrollierten Studien in Kombination mit DMARDs kam es über einen Zeitraum von bis zu 12/14 Wochen bei < 0,1 % der Patienten sowohl in der Gruppe unter RINVOQ 15 mg als auch in der Placebogruppe bei mindestens einer Bestimmung zu einem Rückgang des Hämoglobinwerts unter 8 g/dl.
Psoriasis-Arthritis
Insgesamt war das beobachtete Sicherheitsprofil bei Patienten mit aktiver Psoriasis-Arthritis unter Behandlung mit RINVOQ 15 mg konsistent mit dem Sicherheitsprofil der Patienten mit rheumatoider Arthritis. Es wurde ein erhöhtes Auftreten von Akne und Bronchitis in Patienten unter Behandlung mit RINVOQ 15 mg festgestellt (1,3 % bzw. 3,9 %) im Vergleich zu Placebo (0,3 % bzw. 2,7 %).
Riesenzellarteriitis
Im Allgemeinen entsprach das beobachtete Sicherheitsprofil bei Patienten mit Riesenzellarteriitis dem bekannten Sicherheitsprofil von RINVOQ. Während der 52wöchigen placebokontrollierten Phase wurden periphere Ödeme als unerwünschte Arzneimittelwirkung mit einer Inzidenzrate von 8,6 % bei Patienten unter RINVOQ 15 mg und einer 26wöchigen ausschleichenden Kortikosteroidtherapie festgestellt, im Vergleich zu 2,7 % bei Patienten unter Placebo und einer 52wöchigen ausschleichenden Kortikosteroidtherapie. Bei Patienten unter RINVOQ 15 mg wurde auch eine höhere Inzidenz von Kopfschmerzen beobachtet (16,3 %) als unter Placebo (11,6 %).
Atopische Dermatitis
Opportunistische Infektionen (ausser Tuberkulose)
In der placebokontrollierten Phase der klinischen Studien bei Patienten mit atopischer Dermatitis handelte es sich bei allen gemeldeten opportunistischen Infektionen (mit Ausnahme von TB und Herpes zoster) um ein Eczema herpeticum. Die Häufigkeit von Eczema herpeticum über 16 Wochen betrug in den Behandlungsarmen mit RINVOQ 15 mg 0,7 % gegenüber 0,4 % unter Placebo. Die Langzeitrate von Eczema herpeticum betrug in den Behandlungsarmen mit RINVOQ 15 mg 1,6 Ereignisse auf 100 Patientenjahre.
Colitis ulcerosa
Beschreibung ausgewählter Nebenwirkungen
Bei allen folgenden Raten unerwünschter Wirkungen erhielten sämtliche Patienten im Placeboarm und in den Behandlungsarmen mit RINVOQ 15 mg und 30 mg, welche in der placebokontrollierten Erhaltungsstudie referenziert werden, 8 Wochen lang RINVOQ 45 mg, bevor sie in die placebokontrollierte Erhaltungsstudie eintraten.
Das Sicherheitsprofil von RINVOQ bei Patienten mit Colitis ulcerosa unter Langzeit-Behandlung war konsistent mit jenem in der placebokontrollierten Erhaltungsphase.
Infektionen
In den placebokontrollierten Induktionsstudien betrug die Infektionshäufigkeit über einen Zeitraum von 8 Wochen in der Gruppe unter RINVOQ 45 mg 20,7 % gegenüber 17,5 % in der Placebogruppe. In der placebokontrollierten Erhaltungsstudie betrug die Infektionshäufigkeit über einen Zeitraum von bis zu 52 Wochen in den Gruppen unter RINVOQ 15 mg und 30 mg 40,4 % bzw. 44,2 % gegenüber 38,8 % in der Placebogruppe. Die langfristige Rate von Infektionen betrug in den Gruppen unter RINVOQ 15 mg und 30 mg 64,5 bzw. 77,8 Ereignisse auf 100 Patientenjahre.
Schwerwiegende Infektionen
In den placebokontrollierten Induktionsstudien betrug die Rate schwerwiegender Infektionen über einen Zeitraum von 8 Wochen in der Gruppe unter RINVOQ 45 mg 1,3 % gegenüber 1,3 % in der Placebogruppe. In der über 8 Wochen hinaus verlängerten Induktionsphase wurden in der Gruppe unter RINVOQ 45 mg keine weiteren schwerwiegenden Infektionen beobachtet. In der placebokontrollierten Erhaltungsstudie betrug die Rate schwerwiegender Infektionen über einen Zeitraum von bis zu 52 Wochen in den Gruppen unter RINVOQ 15 mg und 30 mg 3,6 % bzw. 3,2 % gegenüber 3,3 % in der Placebogruppe. Die langfristige Rate schwerwiegender Infektionen betrug in den Gruppen unter RINVOQ 15 mg und 30 mg 3,0 bzw. 4,6 Ereignisse auf 100 Patientenjahre. Die am häufigsten berichtete schwerwiegende Infektion in den Studien zu Colitis ulcerosa war die COVID-19-Pneumonie.
Tuberkulose
In den klinischen Studien zu Colitis ulcerosa trat in der Gruppe unter RINVOQ 15 mg in der Langzeitstudie ein Fall einer aktiven Tuberkulose auf.
Opportunistische Infektionen (ausser Tuberkulose)
In den placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen betrug die Häufigkeit opportunistischer Infektionen (ausser Tuberkulose und Herpes zoster) in der Gruppe unter RINVOQ 45 mg 0,4 % gegenüber 0,3 % in der Placebogruppe. In einer um 8 Wochen verlängerten Induktionsbehandlung mit RINVOQ 45 mg wurden keine weiteren opportunistischen Infektionen (ausser Tuberkulose und Herpes zoster) beobachtet. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen betrug die Rate opportunistischer Infektionen (ausser Tuberkulose und Herpes zoster) unter Placebo sowie in den Gruppen unter RINVOQ 15 mg und 30 mg 0,8 % . Die langfristige Rate opportunistischer Infektionen (ausser Tuberkulose und Herpes zoster) betrug in den Gruppen unter RINVOQ 15 mg und 30 mg 0,3 bzw. 0,6 Ereignisse auf 100 Patientenjahre.
In den placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen betrug die Rate von Herpes zoster in der Gruppe unter RINVOQ 45 mg 0,6 % gegenüber 0 % in der Placebogruppe. Die Rate von Herpes zoster betrug über einen 16-wöchigen Behandlungszeitraum mit RINVOQ 45 mg 3,9 %. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von 52 Wochen betrug die Rate von Herpes zoster in den Gruppen unter RINVOQ 15 mg und 30 mg 4,4 % bzw. 4,0 % gegenüber 0 % in der Placebogruppe. Die langfriste Rate von Herpes zoster betrug in den Gruppen unter RINVOQ 15 mg und 30 mg 4,5 bzw. 7,2 Ereignisse auf 100 Patientenjahre.
Maligne Erkrankung
In den placebokontrollierten Induktionsstudien mit Rinvoq 45 mg über einen Zeitraum von 8 Wochen wurden keine malignen Erkrankungen berichtet. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen betrug die Rate maligner Erkrankungen ausser NMSC in den Gruppen unter RINVOQ 15 mg und 30 mg 0,4 % bzw. 0,8 % gegenüber 0,4 % in der Placebogruppe.
Die langfristige Inzidenz maligner Erkrankungen ausser NMSC betrug in den Gruppen unter RINVOQ 15 mg und 30 mg 0,7 bzw. 0,4 pro 100 Patientenjahre. In einer ergänzenden Auswertung von Patienten, die während einer beliebigen Behandlungsphase eine beliebige Dosis RINVOQ erhielten (N = 1313, 3536,7 Patientenjahre, mittlere Exposition 141 Wochen), betrug die expositionsbereinigte Ereignisrate maligner Erkrankungen ausser NMSC 0,8 auf 100 Patientenjahre. In einer Auswertung mit begrenzten Langzeitdaten von Patienten, die während einer beliebigen Behandlungsphase vor der Anwendung einer beliebigen Dosis RINVOQ Placebo erhielten (N = 378, 152,4 Patientenjahre, mittlere Exposition 21 Wochen), wurden keine malignen Erkrankungen ausser NMSC vor der Umstellung auf RINVOQ bzw. dem Absetzen von Placebo beobachtet.
Schwerwiegende unerwünschte kardiovaskuläre Ereignisse (MACE)
In den placebokontrollierten Induktionsstudien mit Rinvoq 45 mg über einen Zeitraum von 8 Wochen wurden keine MACE berichtet. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen betrug die Häufigkeit von MACE in der Gruppe unter RINVOQ 30 mg 0,4 % gegenüber 0,4 % unter Placebo. Die langfristige Inzidenzrate von MACE betrug unter RINVOQ 30 mg 0,4 auf 100 Patientenjahre. In den durchgeführten Auswertungen wurden in der Gruppe unter RINVOQ 15 mg keine MACE berichtet.
In einer ergänzenden Auswertung von Patienten, die während einer beliebigen Behandlungsphase eine beliebige Dosis RINVOQ erhielten (N = 1313, 3536,7 Patientenjahre, mittlere Exposition 141 Wochen), betrug die expositionsbereinigte Ereignisrate von MACE 0,3 auf 100 Patientenjahre. In einer Auswertung mit begrenzten Langzeitdaten von Patienten, die während einer beliebigen Behandlungsphase vor der Anwendung einer beliebigen Dosis RINVOQ Placebo erhielten (N = 378, 152,4 Patientenjahre, mittlere Exposition 21 Wochen), wurden keine MACE vor der Umstellung auf RINVOQ bzw. dem Absetzen von Placebo beobachtet.
Gastrointestinale Perforationen
In der placebokontrollierten Erhaltungsphase wurde eine gastrointestinale Perforation bei 1 Patienten, der mit Placebo behandelt wurde (0,4 %) und bei keinen Patienten unter RINVOQ 15 mg oder 30 mg gemeldet. In der Langzeitstudie meldete 1 Patient, der mit RINVOQ 15 mg behandelt wurde (0,1 Ereignisse auf 100 Patientenjahre), und 1 Patient, der mit RINVOQ 30 mg behandelt wurde (<0,1 Ereignisse auf 100 Patientenjahre), solche Ereignisse.
Thrombose
In den placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen betrug die Rate von Venenthrombosen (Lungenembolien oder tiefe Venenthrombosen) in der Gruppe unter RINVOQ 45 mg 0,1 % gegenüber 0,3 % in der Placebogruppe. In der verlängerten Induktionsbehandlung mit RINVOQ 45 mg wurden keine weiteren Ereignisse von Venenthrombosen berichtet. In der placebokontrollierten Erhaltungsstudie betrug die Rate von Venenthrombosen über einen Zeitraum von bis zu 52 Wochen in den Gruppen unter RINVOQ 15 mg und 30 mg 0,8 % bzw. 0,8 % gegenüber 0 % in der Placebogruppe. Die langfristige Inzidenzrate venöser Thrombosen betrug unter RINVOQ 15 mg und 30 mg 0,7 bzw. 0,6 pro 100 Patientenjahre. In einer ergänzenden Auswertung von Patienten, die während einer beliebigen Behandlungsphase eine beliebige Dosis RINVOQ erhielten (N = 1313, 3536,7 Patientenjahre, mittlere Exposition 141 Wochen), betrug die expositionsbereinigte Ereignisrate von Venenthrombosen 0,6 auf 100 Patientenjahre. In einer Auswertung mit begrenzten Langzeitdaten von Patienten, die während einer beliebigen Behandlungsphase vor der Anwendung einer beliebigen Dosis RINVOQ Placebo erhielten (N = 378, 152,4 Patientenjahre, mittlere Exposition 21 Wochen), betrug die expositionsbereinigte Ereignisrate von Venenthrombosen vor der Umstellung auf RINVOQ bzw. dem Absetzen von Placebo 1,3 auf 100 Patientenjahre.
Anstiege der hepatischen Transaminasen
In placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen wurden bei mindestens einer Bestimmung Anstiege der Alanintransaminase (ALT) und Aspartattransaminase (AST) von ≥3 x des oberen normalen Grenzwerts (upper limit of normal, ULN) bei 1,5 % bzw. 1,5 % der mit RINVOQ 45 mg behandelten Patienten beobachtet, verglichen mit 0 % bzw. 0,3 % bei den mit Placebo behandelten Patienten. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen wurden bei mindestens einer Bestimmung ALT-Anstiege von ≥3 x des ULN bei 2,0 % bzw. 4,4 % der mit RINVOQ 15 mg und 30 mg behandelten Patienten beobachtet, gegenüber 1,2 % in der Placebogruppe. Bei mindestens einer Bestimmung wurden AST-Anstiege von ≥3 x des ULN bei 1,6 % bzw. 2,0 % der mit RINVOQ 15 mg und 30 mg behandelten Patienten beobachtet, verglichen mit 0,4 % bei den mit Placebo behandelten Patienten. Die meisten Fälle der Anstiege der Lebertransaminasen waren asymptomatisch und vorübergehend. Das Muster und die Inzidenz der ALT-/AST-Anstiege blieben im Zeitverlauf stabil; dies galt auch für die Langzeitstudien.
Anstiege der Lipidwerte
Die Behandlung mit RINVOQ war in den placebokontrollierten Induktions- und Erhaltungsstudien über einen Zeitraum von 8 bzw. bis zu 52 Wochen mit Anstiegen der Lipidparameter, einschliesslich Gesamtcholesterin, LDL-Cholesterin und HDL-Cholesterin, assoziiert. Die Veränderungen der Lipidparameter gegenüber Baseline sind nachstehend zusammengefasst:
·Das mittlere Gesamtcholesterin stieg in der Induktionsgruppe unter RINVOQ 45 mg um 0,95 mmol/l und in der Erhaltungsgruppe unter RINVOQ 15 mg und 30 mg um 0,87 mmol/l bzw. 1,19 mmol/l an.
·Der mittlere HDL-Wert stieg in der Induktionsgruppe unter RINVOQ 45 mg um 0,44 mmol/l und in der Erhaltungsgruppe unter RINVOQ 15 mg und 30 mg um 0,24 mmol/l bzw. 0,34 mmol/l an.
·Der mittlere LDL-Wert stieg in der Induktionsgruppe unter RINVOQ 45 mg um 0,52 mmol/l und in der Erhaltungsgruppe unter RINVOQ 15 mg und 30 mg um 0,64 mmol/l bzw. 0,80 mmol/l an.
·Der mittlere Triglyzeridwert nahm in der Induktionsgruppe unter RINVOQ 45 mg um 0,05 mmol/l ab und änderte sich in der Erhaltungsgruppe unter RINVOQ 15 mg und 30 mg um -0,02 mmol/l bzw. 0,12 mmol/l an.
Anstiege der Kreatinphosphokinase (CPK)
In den placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen wurden Anstiege der Kreatinphosphokinase (CPK)-Werte beobachtet. CPK-Anstiege von ≥5 x des ULN wurden bei 2,2 % bzw. 0,3 % der mit RINVOQ 45 mg bzw. Placebo behandelten Patienten beobachtet. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen wurden CPK-Anstiege von > 5 x des ULN bei 4,4 % bzw. 6,8 % der Patienten in den Gruppen unter RINVOQ 15 mg und 30 mg gegenüber 1,2 % in der Placebogruppe berichtet. Die meisten Anstiege von > 5 x des ULN waren vorübergehend und erforderten keinen Behandlungsabbruch.
Neutropenie
In den placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen wurde bei mindestens einer Bestimmung bei 2,8 % der Patienten in der Gruppe unter RINVOQ 45 mg und bei 0 % in der Placebogruppe Abnahmen der Neutrophilenzahl unter 1.000 Zellen/mm3 beobachtet. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen wurde bei mindestens einer Bestimmung bei 0,8 % bzw. 2,4 % der Patienten in den Gruppen unter RINVOQ 15 mg und 30 mg und bei 0,8 % in der Placebogruppe Abnahmen der Neutrophilenzahl unter 1.000 Zellen/mm3 beobachtet.
Lymphopenie
In den placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen wurde bei mindestens einer Bestimmung bei 2,0 % der Patienten in der Gruppe unter RINVOQ 45 mg gegenüber 0,8 % in der Placebogruppe Abnahmen der Lymphozytenzahl unter 500 Zellen/mm3 beobachtet. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen wurde bei mindestens einer Bestimmung bei 1,6 % bzw. 1,2 % der Patienten in den Gruppen unter RINVOQ 15 mg und 30 mg gegenüber 0,8 % in der Placebogruppe Abnahmen der Lymphozytenzahl unter 500 Zellen/mm3 beobachtet.
Anämie
In den placebokontrollierten Induktionsstudien über einen Zeitraum von 8 Wochen wurde bei mindestens einer Bestimmung bei 0,3 % der Patienten in der Gruppe unter RINVOQ 45 mg und bei 2,1 % in der Placebogruppe ein Rückgang des Hämoglobinwerts unter 8 g/dl beobachtet. In der placebokontrollierten Erhaltungsstudie über einen Zeitraum von bis zu 52 Wochen wurde bei mindestens einer Bestimmung bei 0 % bzw. 0,4 % der Patienten in den Gruppen unter RINVOQ 15 mg und 30 mg und 1,2 % in der Placebogruppe ein Rückgang des Hämoglobinwerts unter 8 g/dl beobachtet.
Morbus Crohn
Beschreibung ausgewählter Nebenwirkungen
Insgesamt war das beobachtete Sicherheitsprofil bei Patienten mit Morbus Crohn unter RINVOQ konsistent mit dem bekannten Sicherheitsprofil von RINVOQ.
Gastrointestinale Perforationen
In den placebokontrollierten klinischen Phase-III-Induktionsstudien wurde über einen Zeitraum von 12 Wochen bei 1 (0,1 %) mit RINVOQ 45 mg behandelten Patienten eine gastrointestinale Perforation berichtet, unter Placebo gab es keine Fälle. Von allen in den Induktionsstudien mit RINVOQ 45 mg behandelten Patienten (n = 938) wurde bei 4 Patienten (0,4 %) eine gastrointestinale Perforation berichtet.
In der placebokontrollierten Langzeitphase wurde bei jeweils 1 Patienten, der mit Placebo (0,7 pro 100 Patientenjahre), RINVOQ 15 mg (0,4 pro 100 Patientenjahre) und RINVOQ 30 mg (0,4 pro 100 Patientenjahre) behandelt wurde, eine gastrointestinale Perforation berichtet. Von allen mit RINVOQ 30 mg als Notfalltherapie behandelten Patienten (n = 336) wurde bei 3 Patienten (0,8 auf 100 Patientenjahre) während der Langzeittherapie eine gastrointestinale Perforation berichtet.
Maligne Erkrankung
In den placebokontrollierten Induktionsstudien wurden keine maligne Erkrankung ausser NMSC berichtet. In der placebokontrollierten Langzeitphase wurde bei einem mit Placebo behandelten Patienten (0,7 auf 100 Patientenjahre), bei einem mit RINVOQ 15 mg behandelten Patienten (0,4 auf 100 Patientenjahre) und bei 4 mit RINVOQ 30 mg behandelten Patienten (1,5 auf 100 Patientenjahre) maligne Erkrankungen ausser NMSC berichtet.
Nicht-melanozytärer Hautkrebs (NMSC)
In der Studie zur Erhaltungstherapie bei Patienten mit Morbus Crohn (siehe «Klinische Wirksamkeit») wurde 1 Fall eines NMSC bei Patienten (n = 51) dokumentiert, die nach fehlendem Ansprechen auf die Induktionstherapie mit 45 mg einmal täglich über 12 Wochen eine verlängerte Induktion mit 30 mg einmal täglich über erneut 12 Wochen und anschliessender Erhaltungstherapie mit 30 mg einmal täglich bis Woche 52 erhalten haben.
Unerwünschte Wirkungen aus der Postmarketingphase
Die folgenden Nebenwirkungen wurden während der Anwendung von RINVOQ nach der Zulassung festgestellt. Da diese Nebenwirkungen von einer Population unbekannter Grösse freiwillig berichtet wurden, ist es nicht immer möglich, die Häufigkeit zuverlässig zu schätzen oder einen kausalen Zusammenhang zur Medikamentenexposition herzustellen.
·Erkrankungen des Immunsystems: Überempfindlichkeit
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungUpadacitinib wurde in klinischen Studien in bezüglich der täglichen AUC äquivalenten Dosen von bis zu 60 mg einmal täglich als Retardtablette verabreicht. Die unerwünschten Wirkungen waren vergleichbar mit solchen bei niedrigerer Dosierung und es wurden keine spezifischen Toxizitäten erkannt. Etwa 90 % von Upadacitinib im systemischen Kreislauf werden innerhalb von 24 Stunden nach Verabreichung eliminiert (innerhalb des in klinischen Studien untersuchten Dosisbereichs). Im Falle einer Überdosierung wird empfohlen, Patienten auf Anzeichen und Symptome von unerwünschten Wirkungen zu überwachen. Bei Patienten, bei denen es zu unerwünschten Wirkungen kommt, ist eine adäquate Behandlung einzuleiten.
Eigenschaften/WirkungenATC-Code
L04AF03
Wirkungsmechanismus
Upadacitinib ist ein selektiver und reversibler Inhibitor von JAK1. Januskinasen (JAKs) sind wichtige intrazelluläre Enzyme, die Signale von Zytokinen oder Wachstumsfaktoren weiterleiten, die an einer Vielzahl von zellulären Prozessen, wie Entzündungsantworten, Hämatopoese und Immunüberwachung, beteiligt sind. Die JAK-Enzymfamilie umfasst vier Mitglieder – JAK1, JAK2, JAK3 und TYK2 –, die paarweise Signaltransduktoren und Transkriptionsaktivatoren (STATs) phosphorylieren und aktivieren. Diese Phosphorylierung moduliert wiederum die Genexpression und Zellfunktion. JAK1 ist für Signalwege von Entzündungszytokinen von Bedeutung, während JAK2 für die Reifung von Erythrozyten wichtig ist und JAK3-Signale eine Rolle im Rahmen der Immunüberwachung und Lymphozytenfunktion spielen.
Upadacitinib inhibiert JAK1 stärker als JAK2 oder JAK3. In zellbasierten Assays zur Wirkstärke, die mit pharmakodynamischen Antworten in vivo korrelierten, zeigte Upadacitinib eine 50- bis 70fach grössere Selektivität für JAK1 als für JAK2 und eine > 100fach grössere Selektivität für JAK1 gegenüber JAK3.
Pharmakodynamik
Hemmung der durch IL-6 induzierten STAT3-Phosphorylierung und durch IL-7 induzierten STAT5-Phosphorylierung
Bei gesunden Probanden führte die Verabreichung von Upadacitinib (Formulierung mit sofortiger Freisetzung) zu einer dosis- und konzentrationsabhängigen Inhibierung der durch IL-6 (JAK1/JAK2) induzierten STAT3-Phosphorylierung und durch IL-7 (JAK1/JAK3) induzierten STAT5-Phosphorylierung im Vollblut. Die maximale Inhibierung wurde eine Stunde nach Verabreichung beobachtet und fiel bis zum Ende des Verabreichungsintervalls wieder auf nahezu den Ausgangswert ab.
Lymphozyten
Bei Patienten mit rheumatoider Arthritis ging die Behandlung mit Upadacitinib mit einem geringen, vorübergehenden Anstieg der mittleren ALC gegenüber des Ausgangswerts bis zu Woche 36 einher, der unter weiterer Behandlung allmählich ganz oder nahezu auf die Ausgangswerte zurückging.
Immunglobuline
Bei Patienten mit rheumatoider Arthritis wurden unter Upadacitinib geringe Abnahmen der mittleren IgG- und IgM-Spiegel gegenüber des Ausgangswerts in der kontrollierten Phase beobachtet; die Mittelwerte zu Beginn und allen anderen Besuchen lagen jedoch innerhalb des üblichen Referenzbereichs.
hsCRP und andere Entzündungsmarker
Bei Patienten mit rheumatoider Arthritis war die Behandlung mit Upadacitinib bereits nach Woche 1 mit einem erheblichen Rückgang der mittleren hsCRP-Spiegel gegenüber dem Ausgangswert verbunden, der während der weiteren Behandlung erhalten blieb.
Bei Patienten mit Morbus Crohn wurden nach der Induktionsbehandlung mit Upadacitinib Verringerungen von hsCRP und fäkalem Calprotectin (FCP) beobachtet. Die Verringerung von hsCRP und FCP wurde bis Woche 52 der Erhaltungsstudie beibehalten.
Kardiale Elektrophysiologie
Die Wirkung von Upadacitinib auf das QTc-Intervall wurde bei Studienteilnehmern geprüft, die Einzel- und Mehrfachdosen von Upadacitinib erhielten.
Das 2.5-Fache der durchschnittlichen Exposition der maximalen therapeutischen Dosis von 45 mg einmal täglich ergab keinen klinisch relevanten Effekt auf das QTc-Intervall.
Impfstudien
Der Einfluss von RINVOQ auf das humorale Ansprechen nach Verabreichung eines adjuvantierten rekombinanten Glycoprotein-E-Herpes-Zoster-Impfstoffs wurde bei 93 Patienten älter als 50 Jahre mit rheumatoider Arthritis unter dauerhafter Behandlung (mediane Behandlungsdauer 3,9 Jahre) mit RINVOQ 15 mg untersucht. 98 % der Patienten (n = 91) erhielten gleichzeitig Methotrexat. 49 % der Patienten erhielten bei Baseline orale Kortikosteroide. Die Impfung führte unabhängig von der Ko-Medikation nach 16 Wochen (4 Wochen nach der zweiten Impfdosis) bei 88 % (95 %-KI: 81,0, 94,5) der mit RINVOQ 15 mg behandelten Patienten zu einem mindestens 4fachen Anstieg der Anti-Glycoprotein-E-Antikörperkonzentration gegenüber dem Ausgangswert vor der Impfung. Inwieweit diese Impfantwort einen Schutz vor Infektionen bzw. Reaktivierungen erlaubt, ist unklar.
Der Einfluss von RINVOQ auf das humorale Ansprechen nach Verabreichung von Prevenar 13®, eines inaktivierten 13-wertigen Pneumokokken-Konjugat-Impfstoffs wurde bei 111 Patienten mit rheumatoider Arthritis unter durchgehender Behandlung mit RINVOQ 15 mg (n=87) oder 30 mg (n=24) untersucht. 97% der Patienten (n=108) erhielten gleichzeitig Methotrexat. Die Impfung führte bei 67,5% (95% KI: 57,4, 77,5) und 56,5% (95% KI: 36,3, 76,8) der Patienten, die mit RINVOQ 15 mg bzw. 30 mg behandelt wurden, zu einem mindestens 2-fachen Anstieg der Antikörperkonzentration gegenüber dem Ausgangswert vor der Impfung bei mindestens 6 der einzelnen Pneumokokken-Antigene des Impfstoffes. Inwieweit diese Impfantwort einen Schutz vor Infektionen erlaubt, ist unklar.
Klinische Wirksamkeit
Rheumatoide Arthritis
Die Wirksamkeit und Sicherheit von RINVOQ 15 mg einmal täglich wurde in fünf randomisierten, doppelblinden, multizentrischen Phase-III-Studien bei Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis, die die ACR/EULAR-Klassifikationskriterien von 2010 erfüllten, untersucht (siehe Tabelle 5). Patienten, die 18 Jahre und älter waren, konnten an den Studien teilnehmen. Das Vorliegen von mindestens 6 druckschmerzempfindlich und 6 geschwollenen Gelenken sowie der Nachweis einer systemischen Entzündung auf Basis der hsCRP-Erhöhung waren bei Baseline erforderlich. Vier Studien schlossen Langzeitfortsetzungsphasen ein mit einer Dauer bis zu 5 Jahren und eine Studie (SELECT-COMPARE) schloss eine Langzeitfortsetzungsphase ein mit einer Dauer bis zu 10 Jahren.
Tabelle 5: Zusammenfassung der klinischen Studien
|
Studienname
|
Population
(n)
|
Behandlungsarme
|
Wesentliche Endpunkte
| |
SELECT-EARLY
|
MTXnaiva
(947)
|
·15 mg Upadacitinib
·30 mg Upadacitinib
·MTX
Monotherapie
|
Primärer Endpunkt:
·ACR50 in Woche 12
Wichtige Sekundäre Endpunkte:
·Klinische Remission (DAS28-CRP < 2,6) in Woche 24
·Niedrige Krankheitsaktivität (DAS28-CRP ≤3,2) in Woche 12
·Δ Körperliche Funktionsfähigkeit (HAQ-DI) in Woche 12
·Radiologische Progression (ΔmTSS) in Woche 24
·SF-36 PCS
| |
SELECT-MONOTHERAPY
|
MTX-IRb
(648)
|
·Upadacitinib 15 mg
·Upadacitinib 30 mg
·MTX
Monotherapie
|
Primärer Endpunkt:
·ACR20 in Woche 14
Wichtige Sekundäre Endpunkte:
·Niedrige Krankheitsaktivität (DAS28-CRP ≤3,2) in Woche 14
·Klinische Remission (DAS28-CRP < 2,6) in Woche 14
·Δ Körperliche Funktionsfähigkeit (HAQ-DI) in Woche 14
·SF-36 PCS
·Morgensteifigkeit
| |
SELECT-NEXT
|
csDMARD-IRc
(661)
|
·Upadacitinib 15 mg
·Upadacitinib 30 mg
·Placebo
In Kombination mit csDMARDs
|
Primärer Endpunkt:
·ACR20 in Woche 12
Wichtige Sekundäre Endpunkte:
·Niedrige Krankheitsaktivität (DAS28-CRP ≤3,2) in Woche 12
·Klinische Remission (DAS28-CRP < 2,6) in Woche 12
·Δ Körperliche Funktionsfähigkeit (HAQ-DI) in Woche 12
·SF-36 PCS
·Morgensteifigkeit
·FACIT-F
| |
SELECT-COMPARE
|
MTX-IRd
(1629)
|
·15 mg Upadacitinib
·Placebo
·40 mg Adalimumab
In Kombination mit MTX
|
Primärer Endpunkt:
·ACR20 in Woche 12
Wichtige Sekundäre Endpunkte:
·Klinische Remission (DAS28-CRP < 2,6) in Woche 12
·Niedrige Krankheitsaktivität (DAS28-CRP ≤3,2) in Woche 12
·ACR50 vs. Adalimumab in Woche 12
·Δ Körperliche Funktionsfähigkeit (HAQ-DI) in Woche 12
·Radiologische Progression (ΔmTSS) in Woche 26
·SF-36 PCS
·Morgensteifigkeit
·FACIT-F
| |
SELECT-BEYOND
|
bDMARD-IRe
(499)
|
·15 mg Upadacitinib
·30 mg Upadacitinib
·Placebo
In Kombination mit csDMARDs
|
Primärer Endpunkt:
·ACR20 in Woche 12
Wichtige Sekundäre Endpunkte:
·Niedrige Krankheitsaktivität (DAS28-CRP ≤3,2) in Woche 12
·Δ Körperliche Funktionsfähigkeit (HAQ-DI) in Woche 12
·SF-36 PCS
| |
Abkürzungen: ACR20 (oder 50) = Verbesserung um ≥20 % (oder ≥50 %) gemäss American College of Rheumatology; bDMARD = biologic disease-modifying antirheumatic drug; CR = Clinical Response, CRP = Creaktives Protein; DAS28 = Disease Activity Score 28 joints, mTSS = modifizierter Total-Sharp-Score; csDMARD = konventionelle synthetische krankheitsmodifizierende Antirheumatika; HAQ-DI = Health Assessment Questionnaire Disability Index; IR = inadequate responder; MTX = Methotrexat
a MTXnaive Patienten oder Behandlung mit nicht mehr als drei wöchentlichen MTX-Dosen
b Patienten mit unzureichendem Ansprechen auf MTX
c Patienten mit unzureichendem Ansprechen auf csDMARDs; Patienten mit Vorbehandlung mit höchstens einem bDMARD konnten teilnehmen (max. 20 % der Zahl an Studienteilnehmern insgesamt), wenn sie nur eine begrenzte Zeit (< 3 Monate) behandelt worden waren oder die Behandlung mit dem bDMARD wegen Unverträglichkeit abbrechen mussten
d Patienten mit unzureichendem Ansprechen auf MTX; Patienten mit Vorbehandlung mit höchstens einem bDMARD (ausser Adalimumab) konnten teilnehmen (max. 20 % der Zahl an Studienteilnehmern insgesamt), wenn sie nur eine begrenzte Zeit (< 3 Monate) behandelt worden waren oder die Behandlung mit dem bDMARD wegen Unverträglichkeit abbrechen mussten
e Patienten mit unzureichendem Ansprechen auf oder Unverträglichkeit gegen mindestens ein bDMARD
|
Klinisches Ansprechen
Remission und niedrige Krankheitsaktivität
In allen Studien erreichte ein grösserer Patientenanteil unter RINVOQ 15 mg eine niedrige Krankheitsaktivität (DAS28-CRP ≤3,2) und klinische Remission (DAS28-CRP < 2,6) im Vergleich zu Placebo, MTX oder Adalimumab (Tabelle 6). Im Vergleich zu Adalimumab wurden bereits nach 8 Wochen höhere Ansprechraten erzielt, die bis Woche 48 anhielten. Ebenso wurde ein stärkeres Ansprechen für andere Masse der Krankheitsaktivität beobachtet, einschliesslich einer Remission definiert als CDAI ≤2,8, SDAI ≤3,3 und Boolesche Remission. Insgesamt waren die Ansprechraten in Bezug auf niedrige Krankheitsaktivität und klinische Remission über alle Patientenpopulationen hinweg mit oder ohne MTX vergleichbar. Nach drei Jahren blieben 297 von 651 (45,6 %) ursprünglich mit RINVOQ 15 mg randomisierten Patienten bzw. 111 von 327 (33,9 %) ursprünglich mit Adalimumab randomisierten Patienten in der Studie SELECT-COMPARE und 216 von 317 (68,1 %) ursprünglich mit RINVOQ 15 mg randomisierten Patienten bzw. 149 von 315 (47,3 %) ursprünglich mit MTX-Monotherapie randomisierten Patienten in der Studie SELECT-EARLY bei ihrer Behandlung. Bei den Patienten, die ihre ursprünglich zugewiesene Behandlung beibehielten, blieben die niedrige Krankheitsaktivität und die klinische Remission über 3 Jahre erhalten.
ACR-Ansprechen
In allen Studien erzielten mehr mit RINVOQ 15 mg behandelte Patienten im Vergleich zu Placebo, MTX oder Adalimumab ein ACR20, ACR50 und ACR70 Ansprechen nach 12 Wochen (Tabelle 6). Bei allen Parametern war die Dauer bis zum Eintreten der Wirkung kurz, wobei höhere ACR20 Ansprechraten bereits nach einer Woche verzeichnet wurden. Es wurde ein anhaltendes Ansprechen beobachtet (mit oder ohne MTX) und die Ansprechraten bezüglich ACR20/50/70 konnten bei Patienten, die ihre ursprünglich zugewiesene Behandlung beibehielten, über 3 Jahre aufrechterhalten werden.
Die Behandlung mit RINVOQ 15 mg, allein oder in Kombination mit csDMARDs, führte im Vergleich zu Placebo, einer MTX-Monotherapie oder Adalimumab zu einer grösseren Verbesserung in allen einzelnen ACR-Komponenten, einschliesslich der Anzahl druckschmerzempfindlicher und geschwollener Gelenke, der allgemeinen Beurteilung durch den Arzt (Physician Global Assessment) und den Patienten (Patient Global Assessment), des HAQ-DI, der Schmerzbeurteilung und des hsCRP (Tabelle 7).
In der Studie SELECT-COMPARE erreichte ein grösserer Patientenanteil unter RINVOQ 15 mg im Vergleich zu Adalimumab in Woche 12 bis Woche 48 ein ACR20/50/70 Ansprechen (Tabelle 6).
Tabelle 6: Ansprechen und Remission
|
Studie
|
SELECT
EARLY
MTXnaiv
|
SELECT
MONO
MTX-IR
|
SELECT
NEXT
csDMARD-IR
|
SELECT
COMPARE
MTX-IR
|
SELECT
BEYOND
bDMARD-IR
| |
|
MTX
|
UPA
15 mg
|
MTX
|
UPA
15 mg
|
PBO
|
UPA
15 mg
|
PBO
|
UPA
15 mg
|
ADA
40 mg
|
PBO
|
UPA
15 mg
| |
N
|
314
|
317
|
216
|
217
|
221
|
221
|
651
|
651
|
327
|
169
|
164
| |
Woche
|
| |
ACR20 (% Patienten)
| |
12a/14b
|
54
|
76g
|
41
|
68e
|
36
|
64e
|
36
|
71e,i
|
63
|
28
|
65e
| |
24c/26d
|
59
|
79g
|
|
|
|
|
36
|
67g,i,
|
57
|
|
| |
48
|
57
|
74g
|
|
|
|
|
|
65i
|
54
|
|
| |
ACR50 (% Patienten)
| |
12a/14b
|
28
|
52e
|
15
|
42g
|
15
|
38g
|
15
|
45g,h
|
29
|
12
|
34g
| |
24c/26d
|
33
|
60g
|
|
|
|
|
21
|
54g,i
|
42
|
|
| |
48
|
43
|
63g
|
|
|
|
|
|
49i
|
40
|
|
| |
ACR70 (% Patienten)
| |
12a/14b
|
14
|
32g
|
3
|
23g
|
6
|
21g
|
5
|
25g,i
|
13
|
7
|
12
| |
24c/26d
|
18
|
44g
|
|
|
|
|
10
|
35g,i,
|
23
|
|
| |
48
|
29
|
51g
|
|
|
|
|
|
36i
|
23
|
|
| |
LDA DAS28-CRP ≤3,2 (% Patienten)
| |
12a/14b
|
28
|
53f
|
19
|
45e
|
17
|
48e
|
14
|
45e,i
|
29
|
14
|
43e
| |
24c26d
|
32
|
60g
|
|
|
|
|
18
|
55g,i
|
39
|
|
| |
48
|
39
|
59g
|
|
|
|
|
|
50i
|
35
|
|
| |
CR DAS28-CRP < 2,6 (% Patienten)
| |
12a/14b
|
14
|
36g
|
8
|
28e
|
10
|
31e
|
6
|
29e,i
|
18
|
9
|
29g
| |
24c26d
|
18
|
48f
|
|
|
|
|
9
|
41g,i
|
27
|
|
| |
48
|
29
|
49g
|
|
|
|
|
|
38i
|
28
|
|
| |
SDAI ≤3,3 (% Patienten)
| |
12a14b
|
6
|
16g
|
1
|
14g
|
3
|
10g
|
3
|
12g,i
|
7
|
5
|
9
| |
24c/26d
|
9
|
28g
|
|
|
|
|
5
|
24g,i
|
14
|
|
| |
48
|
16
|
32g
|
|
|
|
|
|
25i
|
17
|
|
| |
CDAI ≤2,8 (% Patienten)
| |
12a/14b
|
6
|
16g
|
1
|
13g
|
3
|
9g
|
3
|
13g,i
|
8
|
5
|
8
| |
24c/26d
|
11
|
28g
|
|
|
|
|
6
|
23g,i
|
14
|
|
| |
48
|
17
|
32g
|
|
|
|
|
|
25i
|
17
|
|
| |
Boolesche Remission (% Patienten)
| |
12a/14b
|
6
|
13g
|
1
|
9g
|
4
|
10g
|
2
|
10g,i
|
4
|
2
|
7g
| |
24c/26d
|
7
|
24g
|
|
|
|
|
4
|
18g,i
|
10
|
|
| |
48
|
13
|
28g
|
|
|
|
|
|
21i
|
15
|
|
| |
Abkürzungen: ACR20 (oder 50 oder 70) = Verbesserung ≥20 % (oder ≥50 % oder ≥70 %) gemäss American College of Rheumatology; ADA = Adalimumab; bDMARD = biologic disease-modifying anti-rheumatic drug; CDAI = Clinical Disease Activity Index; CR = Clinical Remission; CRP = Creaktives Protein; csDMARD = conventional synthetic disease-modifying anti-rheumatic drug; DAS28 = Disease Activity Score 28 joints; IR= inadequate responder; LDA = Low Disease Activity; MTX = Methotrexat; PBO = Placebo; SDAI = Simple Disease Activity Index; UPA = Upadacitinib
a SELECT-NEXT, SELECT-EARLY, SELECT-COMPARE, SELECT-BEYOND
b SELECT-MONOTHERAPY
c SELECT-EARLY
d SELECT-COMPARE
e p ≤0,001 Upadacitinib im Vergleich zu Placebo oder MTX
f p ≤0,01 Upadacitinib im Vergleich zu Placebo oder MTX
g Upadacitinib im Vergleich zu Placebo oder MTX (diese Vergleiche sind für Multiples Testen nicht kontrolliert)
h p ≤0,001 Upadacitinib im Vergleich zu Adalimumab
i Upadacitinib im Vergleich zu Adalimumab (diese Vergleiche sind für Multiples Testen nicht kontrolliert)
|
Tabelle 7: Komponenten des ACR-Ansprechens (mittlere Veränderung gegenüber dem Ausgangswert)a
|
Studie
|
SELECT
EARLY
MTX-naiv
|
SELECT
MONO
MTX-IR
|
SELECT
NEXT
csDMARD-IR
|
SELECT
COMPARE
MTX-IR
|
SELECT
BEYOND
bDMARD-IR
| |
|
MTX
|
UPA
15
mg
|
MTX
|
UPA
15
mg
|
PBO
|
UPA
15
mg
|
PBO
|
UPA
15
mg
|
ADA
40
mg
|
PBO
|
UPA
15
mg
| |
N
|
314
|
317
|
216
|
217
|
221
|
221
|
651
|
651
|
327
|
169
|
164
| |
Woche
|
| |
Anzahl druckschmerzempfindlicher Gelenke (0-68)
| |
12b/
14c
|
-13
|
-17h
|
-11
|
-15h
|
-8
|
-14h
|
-10
|
-16h,l
|
-14
|
-8
|
-16h
| |
24d/
26e
|
-16
|
-19h
|
|
|
|
|
-9
|
-18h,I
|
-15
|
|
| |
Anzahl geschwollener Gelenke (0-66)
| |
12b/
14c
|
-10
|
-12h
|
-8
|
-11h
|
-6
|
-9h
|
-7
|
-11h,l
|
-10
|
-6
|
-11h
| |
24d/
26e
|
-12
|
-14h
|
|
|
|
|
-6
|
-12h,l
|
-11
|
|
| |
Schmerzenf
| |
12b/
14c
|
-25
|
-36h
|
-14
|
-26h
|
-10
|
-30h
|
-15
|
-32h,j
|
-25
|
-10
|
-26h
| |
24d/
26e
|
-28
|
-40h
|
|
|
|
|
-19
|
-37h,l
|
-32
|
|
| |
Allgemeine Beurteilung durch den Patientenf (Patient Global Assessment)
| |
12b/
14c
|
-25
|
-35h
|
-11
|
-23h
|
-10
|
-30h
|
-15
|
-30 h,l
|
-24
|
-10
|
-26h
| |
24d/
26e
|
-28
|
-39h
|
|
|
|
|
-18
|
-36h,l
|
-30
|
|
| |
Körperliche Funktionsfähigkeit (HAQ-DI)g
| |
12b/
14c
|
-0.5
|
-0.8i
|
-0.3
|
-0.7i
|
-0.3
|
-0.6i
|
-0.3
|
-0.6i,k
|
-0.5
|
-0.2
|
-0.4i
| |
24d/
26e
|
-0.6
|
-0.9h
|
|
|
|
|
-0.3
|
-0.7h,l
|
-0.6
|
|
| |
Allgemeine Beurteilung durch den Arztf (Physician Global Assessment)
| |
12b/
14c
|
-35
|
-46h
|
-26
|
-40h
|
-23
|
-38h
|
-25
|
-39h
|
-36
|
-26
|
-39h
| |
24d/
26e
|
-45
|
-50h
|
|
|
|
|
-27
|
-45h,l
|
-41
|
|
| |
hsCRP (mg/l)
| |
12b/
14c
|
-10.6
|
-17.5h
|
-1.1
|
-10.2h
|
-0.4
|
-10.1h
|
-1.7
|
-12.5h,l
|
-9.2
|
-1.1
|
-11.0h
| |
24d/
26e
|
-11.6
|
-18.4h
|
|
|
|
|
-1.5
|
-13.5h,l
|
-10.3
|
|
| |
Abkürzungen: ACR = American College of Rheumatology; ADA = Adalimumab; bDMARD = biologic disease-modifying anti-rheumatic drug; CRP = Creaktives Protein; csDMARD = conventional synthetic disease-modifying anti-rheumatic drug; HAQ-DI = Health Assessment Questionnaire Disability Index; IR = inadequate responder; MTX = Methotrexat; PBO = Placebo; UPA = Upadacitinib
a Daten angegeben als Mittelwerte
b SELECT-NEXT, SELECT-EARLY, SELECT-COMPARE, SELECT-BEYOND
c SELECT-MONOTHERAPY
d SELECT-EARLY
e SELECT-COMPARE
f Visuelle Analogskala: 0 = bester Wert, 100 = schlechtester Wert
g Health Assessment Questionnaire-Disability Index: 0 = bester Wert, 3 = schlechtester Wert; 20 Fragen; 8 Kategorien: Ankleiden und Körperpflege, Aufstehen, Essen, Gehen, Hygiene, Greifen, Festhalten und andere Tätigkeiten.
h Upadacitinib im Vergleich zu Placebo oder MTX (diese Vergleiche sind für multiples Testen nicht kontrolliert)
i p ≤0,001 Upadacitinib im Vergleich zu Placebo oder MTX
j p ≤0,001 Upadacitinib im Vergleich zu Adalimumab
k p ≤0,01 Upadacitinib im Vergleich zu Adalimumab
l Upadacitinib im Vergleich zu Adalimumab (diese Vergleiche sind für multiples Testen nicht kontrolliert)
|
Radiologisches Ansprechen
Die Hemmung der Progression struktureller Gelenkschäden wurde anhand des modifizierten Total-Sharp-Score (mTSS) und seiner Komponenten, dem Score für die Erosion und dem Score für Gelenkspaltverschmälerung, in Woche 26 und Woche 48 (SELECT-COMPARE) sowie in Woche 24 (SELECT-EARLY) untersucht.
Die Behandlung mit RINVOQ 15 mg führte im Vergleich zu Placebo in Woche 26 und Woche 48 in der Studie SELECT-COMPARE und als Monotherapie im Vergleich zu MTX in Woche 24 in der Studie SELECT-EARLY zu einer signifikant grösseren Hemmung der Progression struktureller Gelenkschäden (Tabelle 8). Statistisch signifikante Ergebnisse wurden auch beim Score für die Erosion und dem Score für Gelenkspaltverschmälerung erzielt. Der Anteil an Patienten ohne radiologische Progression (mTSS-Veränderung ≤0) war unter RINVOQ 15 mg im Vergleich zu Placebo in Woche 26 und Woche 48 (SELECT-COMPARE) und im Vergleich zu MTX in Woche 24 (SELECT-EARLY) signifikant grösser. Die Hemmung der Progression struktureller Gelenkschäden konnte in Patienten, die ihre ursprünglich zugewiesene Behandlung mit RINVOQ 15 mg beibehielten, in beiden Studien über 96 Wochen aufrechterhalten werden (basierend auf den verfügbaren Ergebnissen von 327 Patienten in der Studie SELECT-COMPARE und 238 Patienten in der Studie SELECT-EARLY).
Tabelle 8: Radiologische Veränderungen
|
Studie
|
SELECT
EARLY
MTXnaiv
|
SELECT-
COMPARE
MTX-IR
| |
Behandlungsgruppe
|
MTX
|
UPA
15 mg
|
PBOa
|
UPA
15 mg
|
ADA
40 mg
| |
Modifizierter Total-Sharp-Score, mittlere Veränderung gegenüber dem Ausgangswert
| |
Woche 24b/26c
|
0,7
|
0,1f
|
0,9
|
0,2e
|
0,1
| |
Woche 48
|
|
|
1,7
|
0,3e
|
0,4
| |
Score für die Erosion, mittlere Veränderung gegenüber dem Ausgangswert
| |
Woche 24b/26c
|
0,3
|
0,1e
|
0,4
|
0e
|
0
| |
Woche 48
|
|
|
0,8
|
0,1e
|
0,2
| |
Score für die Gelenkspaltverschmälerung, mittlere Veränderung gegenüber dem Ausgangswert
| |
Woche 24b/26c
|
0,3
|
0,1g
|
0,6
|
0,2e
|
0,1
| |
Woche 48
|
|
|
0,8
|
0,2e
|
0,2
| |
Anteil der Patienten ohne radiologische Progressiond
| |
Woche 24b/26c
|
77,7
|
87,5f
|
76,0
|
83,5f
|
86,8
| |
Woche 48
|
|
|
74,1
|
86,4e
|
87,9
| |
Abkürzungen: ADA = Adalimumab; IR = inadequate responder; MTX = Methotrexat; PBO = Placebo; UPA = Upadacitinib
a Alle Placebodaten in Woche 48 mittels linearer Extrapolation abgeleitet
b SELECT-EARLY
c SELECT-COMPARE
d Keine Progression definiert als mTSS-Veränderung ≤0.
e p ≤0,001 Upadacitinib im Vergleich zu Placebo oder MTX
f p ≤0,01 Upadacitinib im Vergleich zu Placebo oder MTX
g p ≤0,05 Upadacitinib im Vergleich zu Placebo oder MTX
|
Körperliche Funktionsfähigkeit und gesundheitsbezogene Ergebnisse
Die Behandlung mit RINVOQ 15 mg, allein oder in Kombination mit csDMARDs, führte zu einer signifikanten Verbesserung der körperlichen Funktionsfähigkeit im Vergleich zu allen Vergleichspräparaten (Placebo, MTX, Adalimumab), gemessen mittels des HAQ-DI. Verbesserungen wurden in den Studien SELECT-NEXT und SELECT-BEYOND im Vergleich zu Placebo bereits nach Woche 1 beobachtet und konnten bis zu 60 Wochen aufrechterhalten werden.
In allen Studien führte die Behandlung mit RINVOQ 15 mg, allein oder in Kombination mit csDMARDs, zu einer signifikant grösseren Schmerzlinderung im Vergleich zu allen Vergleichspräparaten; dies wurde auf einer visuellen Analogskala von 0–100 nach 12/14 Wochen gemessen und das Ansprechen konnte bis zu 48–60 Wochen aufrecht erhalten werden. Bereits in Woche 1 wurde im Vergleich zu Placebo bzw. in Woche 4 im Vergleich zu Adalimumab eine grössere Schmerzlinderung beobachtet.
In allen Studien führte die Behandlung mit RINVOQ 15 mg zu einer signifikant grösseren Verbesserung der mittleren Dauer und der Schwere der Morgensteifigkeit im Vergleich zu Placebo oder MTX.
Verbesserungen des HAQ-DI und Schmerzlinderung wurden gemäss verfügbaren Ergebnissen der Studien SELECT-COMPARE und SELECT-EARLY bei Patienten, die ihre ursprünglich zugewiesene Behandlung mit RINVOQ 15 mg beibehielten, über 3 Jahre aufrechterhalten.
In allen Studien wurde im Vergleich zu Placebo oder MTX eine grössere Verbesserung auf der körperlichen Summenskala des Fragebogens zum Gesundheitszustand, SF-36, verzeichnet. In den Studien SELECT-EARLY, SELECT-MONOTHERAPY und SELECT-COMPARE wurde im Vergleich zu Placebo oder MTX bei mit RINVOQ 15 mg behandelten Patienten eine signifikant grössere Verbesserung auf der psychischen Summenskala und in allen 8 Teilbereichen des SF-36 verzeichnet.
Fatigue wurde in den Studien SELECT-EARLY, SELECT-NEXT und SELECT- COMPARE anhand der Scores auf der Skala zur Fatigue in der Funktionsbeurteilung bei Therapie chronischer Erkrankungen (FACIT-F) gemessen. Die Behandlung mit RINVOQ 15 mg führte im Vergleich zu Placebo, MTX oder Adalimumab zu einer Verbesserung der Fatigue.
Die RA-assoziierte Arbeitsunfähigkeit wurde bei Patienten mit einem Anstellungsverhältnis in den Studien SELECT-NEXT und SELECT-COMPARE anhand der Skala zur Arbeitsunfähigkeit bei RA (RA-WIS) beurteilt. Die Behandlung mit RINVOQ 15 mg führte im Vergleich zu Placebo zu einer signifikant stärkeren Verringerung der Arbeitsunfähigkeit.
Psoriasis-Arthritis
Die Wirksamkeit und Sicherheit von RINVOQ 15 mg einmal täglich wurden in zwei randomisierten, doppelblinden, multizentrischen, placebokontrollierten Phase-III-Studien bei Patienten im Alter von mindestens 18 Jahren mit mittelschwerer bis schwerer aktiver Psoriasis-Arthritis beurteilt (Tabelle 9). Bei allen Patienten lag die aktive Psoriasis-Arthritis auf Grundlage der CASPAR-Kriterien (Classification Criteria for Psoriatic Arthritis) mindestens 6 Monate lang vor; weiterhin hatten sie mindestens 3 druckschmerzempfindliche Gelenke und mindestens 3 geschwollene Gelenke sowie eine aktive Plaque-Psoriasis oder eine Vorgeschichte mit Plaque-Psoriasis. Bei beiden Studien konnte eine vorherige Behandlung mit cDMARD unverändert fortgesetzt werden. Die Studien beinhalteten langfristige Fortsetzungen um bis zu 5 Jahre (SELECT-PsA 1) und 3 Jahre (SELECT PsA 2).
Tabelle 9: Zusammenfassung der klinischen Studien
|
Studienname
|
Population
(n)
|
Behandlungsarme
|
Wesentliche Endpunkte
| |
SELECT-
PsA 1
|
Non- bDMARD-IRa
(1705)
|
·15 mg Upadacitinib
·30 mg Upadacitinib
·Placebo
·40 mg Adalimumab
|
Primärer Endpunkt:
·ACR20 in Woche 12
| |
Wichtige sekundäre Endpunkte:
·MDA in Woche 24
·Abheilung der Enthesis (LEI=0) und Daktylitis (LDI=0) in Woche 24
·PASI 75 in Woche 16
·sIGA in Woche 16
·SAPS in Woche 16
·Radiologische Progression (ΔmTSS) in Woche 24
·Δ Körperliche Funktionsfähigkeit (HAQ-DI) in Woche 12
·SF-36 PCS in Woche 12
·FACIT-F in Woche 12
·ACR20, Schmerz und Δ Körperliche Funktionsfähigkeit (HAQ-DI) im Vergleich zu Adalimumab in Woche 12
| |
SELECT-
PsA 2
|
bDMARD-IRb
(642)
|
·15 mg Upadacitinib
·30 mg Upadacitinib
·Placebo
|
Primärer Endpunkt:
·ACR20 in Woche 12
| |
Wichtige sekundäre Endpunkte:
·MDA in Woche 24
·PASI 75 in Woche 16
·sIGA in Woche 16
·SAPS in Woche 16
·Δ Körperliche Funktionsfähigkeit (HAQ-DI) in Woche 12
·SF-36 PCS in Woche 12
·FACIT-F in Woche 12
| |
Abkürzungen: ACR20 = Verbesserung um ≥20% gemäss American College of Rheumatology; bDMARD = biologic disease-modifying anti-rheumatic drug; FACIT-F = Functional Assessment of Chronic Illness Therapy-Fatigue score; HAQ-DI = Health Assessment Questionnaire-Disability Index; IR = inadequate responder (unzureichendes Ansprechen); MDA = minimal disease activity; mTSS = modifizierter Total-Sharp-Score; PASI = Psoriasis Area and Severity Index; SAPS = Self-Assessment of Psoriasis Symptoms; SF-36 PCS = Short Form (36) Health Survey (SF-36) Physical Component Summary; sIGA = static Investigator Global Assessment of psoriasis
a Patienten mit einem unzureichenden Ansprechen auf oder einer Intoleranz gegenüber mindestens einem nicht-biologischen DMARD
b Patienten mit einem unzureichenden Ansprechen auf oder einer Intoleranz gegenüber mindestens einem bDMARD
|
Klinisches Ansprechen
In beiden Studien erreichte ein signifikant grösserer Patientenanteil unter RINVOQ 15 mg ein ACR20 Ansprechen im Vergleich zu Placebo in Woche 12 (Tabelle 10, Abbildung 1). In SELECT-PsA 1 erreichte RINVOQ 15 mg eine Nichtunterlegenheit im Vergleich zu Adalimumab im Patientenanteil mit ACR20 Ansprechen in Woche 12. Ein höherer Patientenanteil unter RINVOQ 15 mg erreichte ein ACR50- und ACR70-Ansprechen in Woche 12 im Vergleich zu Placebo. Die Dauer bis zum Eintreten der Wirkung war über alle Messungen schnell, mit höheren Ansprechraten bereits in Woche 2 für ACR20.
Die Behandlung mit RINVOQ 15 mg führte zu Verbesserungen bei den einzelnen ACR-Komponenten, einschliesslich der Anzahl druckschmerzempfindlicher/schmerzhafter und geschwollener Gelenke, der allgemeinen Beurteilung durch den Patienten (Patient Global Assessment) und den Arzt (Physician Global Assessment), des HAQ-DI, der Schmerzbeurteilung und des hsCRP im Vergleich zu Placebo (Tabelle 11). Die Behandlung mit RINVOQ 15 mg erreichte grössere Verbesserungen der Schmerzen im Vergleich zu Adalimumab in Woche 24.
In beiden Studien wurden konsistente Ansprechraten allein oder in Kombination mit nicht-biologischen DMARDs für primäre und wichtige sekundäre Endpunkte beobachtet.
Die Wirksamkeit von RINVOQ 15 mg zeigte sich unabhängig von den beurteilten Subgruppen, einschliesslich Baseline-BMI, Baseline-hsCRP und der Anzahl der vorherigen nicht-biologischen DMARDs (≤1 oder >1).
Abbildung 1. Prozentzahl der Patienten, die ACR20 in SELECT-PsA 1 erreicht haben
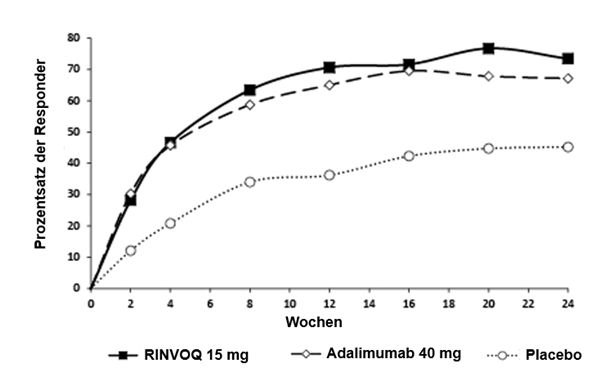
Tabelle 10: Klinisches Ansprechen
|
Studie
|
SELECT-PsA 1
Non-bDMARD-IR
|
SELECT-PsA 2
bDMARD-IR
| |
Behandlungsgruppe
|
PBO
|
UPA
15 mg
|
ADA
40 mg
|
PBO
|
UPA
15 mg
| |
N
|
423
|
429
|
429
|
212
|
211
| |
ACR20 (% der Patienten)
| |
Woche 12
|
36
|
71e
|
65
|
24
|
57e
| |
Woche 24
|
45
|
73f,g
|
67
|
20
|
59f
| |
Woche 56
|
|
74g
|
69
|
|
60
| |
ACR50 (% der Patienten)
| |
Woche 12
|
13
|
38f,g
|
38
|
5
|
32f
| |
Woche 24
|
19
|
52f,g
|
44
|
9
|
38f
| |
Woche 56
|
|
60g
|
51
|
|
41
| |
ACR70 (% der Patienten)
| |
Woche 12
|
2
|
16f,g
|
14
|
1
|
9f
| |
Woche 24
|
5
|
29f,g
|
23
|
1
|
19f
| |
Woche 56
|
|
41g
|
31
|
|
24
| |
MDA (% der Patienten)
| |
Woche 12
|
6
|
25f,g
|
25
|
4
|
17f
| |
Woche 24
|
12
|
37e,g
|
33
|
3
|
25e
| |
Woche 56
|
|
45g
|
40
|
|
29
| |
Abheilung der Enthesitis (LEI = 0; % der Patienten)a
| |
Woche 12
|
33
|
47f,g
|
47
|
20
|
39f
| |
Woche 24
|
32
|
54e,g
|
47
|
15
|
43f
| |
Woche 56
|
|
59g
|
54
|
|
43
| |
Abheilung der Daktylitis (LDI = 0; % der Patienten)b
| |
Woche 12
|
42
|
74f,g
|
72
|
36
|
64f
| |
Woche 24
|
40
|
77f,g
|
74
|
28
|
58f
| |
Woche 56
|
|
75g
|
74
|
|
51
| |
PASI 75 (% der Patienten)c
| |
Woche 16
|
21
|
63e,g
|
53
|
16
|
52e
| |
Woche 24
|
27
|
64f.g
|
59
|
19
|
54f
| |
Woche 56
|
|
65g
|
61
|
|
52
| |
PASI 90 (% der Patienten)c
| |
Woche 16
|
12
|
38f,g
|
39
|
8
|
35f
| |
Woche 24
|
17
|
42f,g
|
45
|
7
|
36f
| |
Woche 56
|
|
49g
|
47
|
|
41
| |
PASI 100 (% der Patienten)c
| |
Woche 16
|
7
|
24f,g
|
20
|
6
|
25f
| |
Woche 24
|
10
|
27f,g
|
28
|
5
|
22f
| |
Woche 56
|
|
35g
|
31
|
|
27
| |
sIGA 0/1 (% der Patienten)d
| |
Woche 16
|
11
|
42e,g
|
39
|
9
|
37e
| |
Woche 24
|
12
|
45f,g
|
41
|
10
|
33f
| |
Woche 56
|
|
52g
|
47
|
|
33
| |
Abkürzungen: ACR20 (oder 50 oder 70) = Verbesserung um ≥20% (oder ≥50% oder ≥70%) gemäss American College of Rheumatology; ADA = Adalimumab; bDMARD = biologic disease-modifying anti-rheumatic drug; IR = inadequate responder (unzureichendes Ansprechen); MDA = minimal disease activity; MTX = Methotrexat; PASI 75 (oder 90 oder 100) = Verbesserung um ≥75% (oder ≥90% oder 100%) gemäss Psoriasis Area and Severity Index; PBO = Placebo; sIGA = static Physician Global Assessment; UPA= Upadacitinib
Patienten, die die randomisierte Behandlung abgesetzt haben oder bei denen Daten in der Woche der Beurteilung fehlten, galten als Non-Responder in den Analysen. In Bezug auf MDA, die Abheilung der Enthesitis und die Abheilung der Daktylitis in Woche 24 und Woche 56 galten Patienten die in Woche 16 eine Rescue Therapie erhielten, als Nicht-Responder in den Analysen.
a Bei Patienten mit Enthesitis bei Baseline (n = 241, 270 bzw. 265 für SELECT-PsA 1 und n = 144 bzw. 133 für SELECT-PsA 2)
b Bei Patienten mit Daktylitis bei Baseline (n = 126, 136 bzw. 127 für SELECT-PsA 1 und n = 64 bzw. 55 für SELECT-PsA 2)
c Bei Patienten mit BSA Psoriasis ≥3% bei Baseline (n = 211, 214 bzw. 211 für SELECT-PsA 1 und n = 131 bzw. 130 für SELECT-PsA 2)
d Bei Patienten mit sIGA ≥2 bei Baseline (n = 313, 322 bzw. 330 für SELECT-PsA 1 und n = 163 bzw. 171 für SELECT-PsA 2)
e p ≤0,001 Upadacitinib im Vergleich zu Placebo
f Upadacitinib im Vergleich zu Placebo (diese Vergleiche sind für multiples Testen nicht kontrolliert)
g Upadacitinib im Vergleich zu Adalimumab (diese Vergleiche sind für multiples Testen nicht kontrolliert)
|
Tabelle 11: Komponenten des ACR-Ansprechens (mittlere Änderung gegenüber dem Ausgangswert)
|
Studie
|
SELECT-PsA 1
Non-bDMARD-IR
|
SELECT-PsA 2
bDMARD-IR
| |
Behandlungsgruppe
|
PBO
|
UPA
15 mg
|
ADA
40 mg
|
PBO
|
UPA
15 mg
| |
N
|
423
|
429
|
429
|
212
|
211
| |
Anzahl der druckschmerzempfindlichen/schmerzhaften Gelenke (0–68)
| |
Woche 12
|
-7,1
|
-11,3d,e
|
-10,3
|
-6,2
|
-12,4d
| |
Woche 24
|
-9,2
|
-13,7d,e
|
-12,5
|
-6,6
|
-14,0d
| |
Anzahl der geschwollenen Gelenke (0–66)
| |
Woche 12
|
-5,3
|
-7,9d,e
|
-7,6
|
-4,8
|
-7,1d
| |
Woche 24
|
-6,3
|
-9,0d,e
|
-8,6
|
-5,6
|
-8,3d
| |
Beurteilung des Schmerzes durch den Patientena
| |
Woche 12
|
-0,9
|
-2,3d
|
-2,3
|
-0,5
|
-1,9d
| |
Woche 24
|
-1,4
|
-3,0d,e
|
-2,6
|
-0,7
|
-2,2d
| |
Allgemeine Beurteilung durch den Patienten (Patient Global Assessment)a
| |
Woche 12
|
-1,2
|
-2,7d,e
|
-2,6
|
-0,6
|
-2,3d
| |
Woche 24
|
-1,6
|
-3,4d,e
|
-2,9
|
-0,8
|
-2,6d
| |
Körperliche Funktionsfähigkeit (HAQ-DI)b
| |
Woche 12
|
-0,14
|
-0,42c
|
-0,34
|
-0,10
|
-0,30c
| |
Woche 24
|
-0,19
|
-0,51d,e
|
-0,39
|
-0,08
|
-0,33d
| |
Allgemeine Beurteilung durch den Arzt (Physician Global Assessment)a
| |
Woche 12
|
-2,1
|
-3,6d,e
|
-3,4
|
-1,4
|
-3,1d
| |
Woche 24
|
-2,8
|
-4,3d,e
|
-4,1
|
-1,8
|
-3,8d
| |
hsCRP (mg/l)
| |
Woche 12
|
-1,3
|
-7,1d,e
|
-7,6
|
0,3
|
-6,6d
| |
Woche 24
|
-2,1
|
-7,6d,e
|
-7,3
|
-0,9
|
-6,3d
| |
Abkürzungen: ACR = American College of Rheumatology; ADA = Adalimumab; hsCRP = C-reaktives Protein; HAQ-DI = Health Assessment Questionnaire-Disability Index; IR = inadequate responder (unzureichendes Ansprechen); PBO = Placebo; UPA = Upadacitinib
a Numerische Ratingskala (NRS): 0 = bester Wert, 10 = schlechtester Wert
b Health Assessment Questionnaire-Disability Index: 0 = bester Wert, 3 = schlechtester Wert; 20 Fragen; 8 Kategorien: Ankleiden und Körperpflege, Aufstehen, Essen, Gehen, Hygiene, Greifen, Festhalten und Aktivitäten
c p ≤0,001 Upadacitinib im Vergleich zu Placebo
d Upadacitinib im Vergleich zu Placebo (diese Vergleiche sind für multiples Testen nicht kontrolliert)
e Upadacitinib im Vergleich zu Adalimumab (diese Vergleiche sind für multiples Testen nicht kontrolliert)
|
In beiden Studien wurden die Ansprechraten für ACR20/50/70, MDA, PASI 75/90/100, sIGA, die Abheilung der Enthesitis und Daktylitis bei mit RINVOQ 15 mg behandelten Patienten bis Woche 56 aufrechterhalten.
Radiologisches Ansprechen
Bei SELECT-PsA 1 wurde in Woche 24 die Hemmung der Progression struktureller Schäden radiologisch beurteilt und als Veränderung gegenüber dem Ausgangswert anhand des modifizierten Total-Sharp-Scores (mTSS) und seinen Komponenten, dem Score für die Erosion und dem Score für Gelenkspaltverschmälerung, dargestellt.
Die Behandlung mit RINVOQ 15 mg führte im Vergleich zu Placebo in Woche 24 zu einer signifikant grösseren Inhibierung der Progression struktureller Gelenkschäden (Tabelle 12). Statistisch signifikante Ergebnisse wurden auch beim Score für die Erosion und dem Score für Gelenkspaltverschmälerung erzielt. Der Anteil an Patienten ohne radiologische Progression (mTSS-Veränderung ≤0,5) war unter RINVOQ 15 mg im Vergleich zu Placebo in Woche 24 höher.
Tabelle 12: Radiologische Veränderungen in SELECT-PsA 1
|
Behandlungsgruppe
|
PBO
|
UPA
15 mg
|
ADA
40 mg
| |
Modifizierter Total-Sharp-Score, mittlere Veränderung gegenüber dem Ausgangswert
| |
Woche 24
|
0,25
|
-0,04c
|
0,01
| |
Woche 56a
|
0,44
|
-0,05d
|
-0,06
| |
Score für die Erosion, mittlere Veränderung gegenüber dem Ausgangswert
| |
Woche 24
|
0,12
|
-0,03d
|
0,01
| |
Woche 56a
|
0,30
|
-0,03d
|
-0,05
| |
Score für die Gelenkspaltverschmälerung, mittlere Veränderung gegenüber dem Ausgangswert
| |
Woche 24
|
0,10
|
-0,00d
|
-0,02
| |
Woche 56a
|
0,14
|
-0,03d
|
-0,03
| |
Anteil der Patienten ohne radiologische Progressiona
| |
Woche 24
|
92
|
96d
|
95
| |
Week 56a
|
89
|
97d
|
94
| |
Abkürzungen: ADA = Adalimumab; PBO = Placebo; UPA= Upadacitinib
a Alle Placebodaten in Woche 56 wurden mittels linearer Extrapolation abgeleitet
b «Ohne Progression» definiert als mTSS-Veränderung ≤0,5
c p ≤0,001 Upadacitinib im Vergleich zu Placebo
d Upadacitinib im Vergleich zu Placebo (diese Vergleiche sind für multiples Testen nicht kontrolliert)
|
Körperliche Funktionsfähigkeit und gesundheitsbezogene Ergebnisse
In beiden Studien führte die Behandlung mit RINVOQ 15 mg bei Patienten zu einer signifikanten Verbesserung der körperlichen Funktionsfähigkeit gegenüber dem Ausgangswert im Vergleich zu Placebo gemäss HAQ-DI in Woche 12 (Tabelle 11); dies wurde bis Woche 56 aufrechterhalten.
Der Anteil der HAQ-DI-Responder (≥0,35 Verbesserung gegenüber dem Ausgangswert bezüglich des HAQ-DI-Scores) in Woche 12 bei SELECT-PsA 1 und SELECT-PsA 2 lag bei 58% bzw. 45% bei Patienten, die RINVOQ 15 mg erhielten, bei 33% bzw. 27% bei Patienten, die Placebo erhielten, und bei 47% bei Patienten, die Adalimumab erhielten (SELECT-PsA 1).
Die gesundheitsbezogene Lebensqualität wurde gemäss SF-36 beurteilt. In beiden Studien wurde bei Patienten unter RINVOQ 15 mg im Vergleich zu Placebo eine signifikant grössere Verbesserung auf der körperlichen Summenskala gegenüber dem Ausgangswert in Woche 12 verzeichnet. Eine grössere Verbesserung wurde auch im Vergleich zu Adalimumab beobachtet. Es wurde im Vergleich zu Placebo eine grössere Verbesserung auf der psychischen Summenskala und in allen 8 Teilbereichen des SF-36 (körperliche Funktionsfähigkeit, körperlicher Schmerz, Vitalität, soziale Funktionsfähigkeit, körperliche Rolle, allgemeine Gesundheit, emotionale Rolle und psychische Gesundheit) verzeichnet. Die Verbesserungen gegenüber dem Ausgangswert wurden in beiden Studien bis Woche 56 aufrechterhalten.
In beiden Studien wurde bei Patienten unter RINVOQ 15 mg im Vergleich zu Placebo eine signifikant grössere Verbesserung der Müdigkeit, gemessen anhand der Scores auf der Skala zur Fatigue in der Funktionsbeurteilung bei Therapie chronischer Erkrankungen (FACIT F), gegenüber dem Ausgangswert in Woche 12 verzeichnet. Die Verbesserungen gegenüber dem Ausgangswert wurden in beiden Studien bis Woche 56 aufrechterhalten.
Es wurde in beiden Studien bei Patienten unter RINVOQ 15 mg im Vergleich zu Placebo und Adalimumab eine grössere Verbesserung der von Patienten gemeldeten Psoriasis-Symptome, gemessen anhand der Self-Assessment of Psoriasis Symptoms (SAPS), in Woche 16 verzeichnet. Die Verbesserungen gegenüber dem Ausgangswert wurden in beiden Studien bis Woche 56 aufrechterhalten.
Mit RINVOQ 15 mg behandelte Psoriasis-Arthritis Patienten mit Spondylitis zeigten Verbesserungen gegenüber dem Ausgangswert bezüglich der Scores des Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) und der Ankylosing Spondylitis Disease Activity (ASDAS) im Vergleich zu Placebo in Woche 24. Die Verbesserungen gegenüber dem Ausgangswert wurden in beiden Studien bis Woche 56 aufrechterhalten.
Ankylosierende Spondylitis
Die Wirksamkeit und Sicherheit von RINVOQ 15 mg einmal täglich wurden in zwei randomisierten, doppelblinden, multizentrischen, placebokontrollierten Studien bei Patienten im Alter von mindestens 18 Jahren mit aktiver ankylosierender Spondylitis auf Grundlage des Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) ≥4 und der Beurteilung der Gesamt-Rückenschmerzen durch den Patienten bei einem Score ≥4 beurteilt (Tabelle 13). Beide Studien umfassten eine offene Fortsetzung um bis zu 2 Jahre nach einer doppelblinden, placebokontrollierten Periode über 14 Wochen.
Tabelle 13: Zusammenfassung der klinischen Studie
|
Studienname
|
Population
(n)
|
Behandlungsarme
|
Wesentliche Endpunkte
| |
SELECT-AXIS 1
|
NSAID-IRa,b bDMARD-naiv
(187)
|
·15 mg Upadacitinib
·Placebo
|
Primärer Endpunkt:
·ASAS40 in Woche 14
| |
Wichtige sekundäre Endpunkte in Woche 14:
·ASAS-Teilremission
·BASDAI 50
·ASDAS-CRP
·BASFI (Funktionsfähigkeit)
·SPARCC MRI-Score (Wirbelsäule)
·AS Qualtiy of Life
·BASMI (Mobilität der Wirbelsäule)
·MASES (Enthesitis)
·WPAI
·ASAS Health Index
| |
SELECT-AXIS 2
|
bDMARD-IRa,c
(420)
|
·15 mg Upadacitinib
·Placebo
|
Primärer Endpunkt:
·ASAS40 in Woche 14
| |
Wichtige sekundäre Endpunkte in Woche 14:
·ASAS-Teilremission
·BASDAI50
·ASDAS-CRP
·BASFI (Funktionsfähigkeit)
·SPARCC-MRI-Score (Wirbelsäule)
·AS Quality of Life
·BASMI (Mobilität der Wirbelsäule)
·MASES (Enthesitis)
·ASAS Health Index
·ASAS20
·ASDAS inaktive Erkrankung
·Gesamt-Rückenschmerzen
·Nächtliche Rückenschmerzen
·ASDAS niedrige Krankheitsaktivität
| |
Abkürzungen: ASAS40 = Verbesserung um ≥40 % gemäss Assessment of SpondyloArthritis international Society; ASAS HI = ASAS Health Index; ASDAS-CRP = Ankylosing Spondylitis Disease Activity Score C-Reactive Protein; ASQoL = AS Quality of Life Questionnaire; BASDAI = Bath Ankylosing Spondylitis Disease Activity Index; BASFI = Bath Ankylosing Spondylitis Functional Index; BASMI = Bath Ankylosing Spondylitits Metrology Index; bDMARD = biologic disease-modifying anti-rheumatic drug; IR = inadequate responder; MASES = Maastricht Ankylosing Spondylitis Enthesitis Score; NSAID = Nonsteroidal Anti-inflammatory Drug; SPARCC MRI = Spondyloarthritis Research Consortium of Canada Magnetic Resonance Imaging; WPAI = Work Productivity and Activity Impairment
a Patienten mit einem unzureichenden Ansprechen auf mindestens zwei NSAIDs oder Intoleranz gegenüber NSAIDs oder bei denen NSAIDs kontraindiziert sind.
b Bei Baseline erhielten ungefähr 16 % der Patienten ein begleitendes csDMARD.
c Bei Baseline zeigten 77,4 % entweder gegenüber einem TNF-Inhibitor oder einem Interleukin-17-Inhibitor (IL-17i) eine mangelnde Wirksamheit; bei 30,2 % lag eine Unverträglichkeit vor; bei 12,9 % waren zuvor zwei bDMARDs verabreicht worden, zeigten jedoch keine mangelnde Wirksamkeit gegenüber diesen.
|
Klinisches Ansprechen
In beiden Studien erreichte ein signifikant grösserer Patientenanteil unter RINVOQ 15 mg ein ASAS40-Ansprechen im Vergleich zu Placebo in Woche 14 (51,6% vs. 25,5%; p<0,001 für SELECT-AXIS 1 und 44,5% vs. 18,2%; p<0,001 für SELECT-AXIS 2) (Tabelle 14, Abbildung 2 und 3). Höhere Ansprechraten für ASAS40 zeigten sich ab Woche 2 in SELECT-AXIS 1 (16,1% vs. 1,1%; nomineller p-Wert <0,001) und ab Woche 4 in SELECT-AXIS 2 (21,8% vs. 12,4%; nomineller p-Wert = 0,01).
Die Behandlung mit RINVOQ 15 mg führte in beiden Studien zu Verbesserungen bei den einzelnen ASAS-Komponenten (allgemeine Beurteilung der Krankheitsaktivität durch den Patienten, Beurteilung der Gesamt-Rückenschmerzen, Entzündungen und Funktionen) und andere Messungen der Krankheitsaktivität, einschliesslich hsCRP, in Woche 14 im Vergleich zu Placebo.
Die Wirksamkeit von RINVOQ 15 mg zeigte sich in beiden Studien unabhängig von den beurteilten Subgruppen, einschliesslich Geschlecht, Baseline-BMI, Dauer der Symptome der ankylosierenden Spondylitis, Baseline-hsCRP und in SELECT-AXIS 2 auch vorherige Anwendung von bDMARDs.
|
Abbildung 2: Prozentzahl der Patienten, die in SELECT-AXIS 1 ASAS40 erreicht haben
|
Abbildung 3: Prozentzahl der Patienten, die in SELECT-AXIS 2 ASAS40 erreicht haben
| |
|
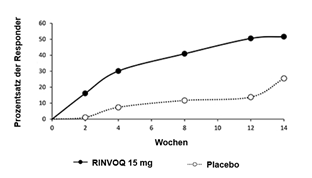
|
|
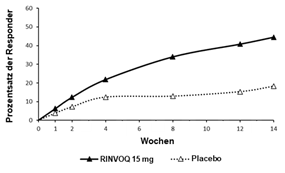
|
Tabelle 14: Klinisches Ansprechen
|
Studie
|
SELECT-AXIS 1
bDMARD-naiv
|
SELECT-AXIS 2
bDMARD-IR
| |
Behandlungsgruppe
|
PBO
|
UPA 15 mg
|
PBO
|
UPA 15 mg
| |
N
|
94
|
93
|
209
|
211
| |
ASAS40 (% der Patienten)
| |
Woche 14
|
25,5
|
51,6a
|
18,2
|
44,5a
| |
ASAS20 (% der Patienten)
| |
Woche 14
|
40,4
|
64,5c
|
38,3
|
65,4a
| |
ASAS Teilremission (% der Patienten)
| |
Woche 14
|
1,1
|
19,4a
|
4,3
|
17,5a
| |
BASDAI 50 (% der Patienten)
| |
Woche 14
|
23,4
|
45,2b
|
16,7
|
43,1a
| |
ASDAS-CRP (Veränderung gegenüber dem Ausgangswert)
| |
Woche 14
|
-0,54
|
-1,45a
|
-0,49
|
-1,52a
| |
ASDAS inaktive Erkrankung (% der Patienten)
| |
Woche 14
|
-
|
-
|
1,9
|
12,8a
| |
ASDAS niedrige Krankheitsaktivität (% der Patienten)
| |
Woche 14
|
-
|
-
|
10,1
|
44,1a
| |
Abkürzungen: ASAS20 (oder 40) = Verbesserung um ≥20% (oder ≥40%) gemäss Assessment of SpondyloArthritis international Society; ASDAS-CRP = Ankylosing Spondylitis Disease Activity Score C-Reactive Protein; BASDAI = Bath Ankylosing Spondylitis Disease Activity Index; IR= inadequate responder; PBO = Placebo; UPA= Upadacitinib
a p ≤0,001 Upadacitinib im Vergleich zu Placebo
b p ≤0,01 Upadacitinib im Vergleich zu Placebo
c Upadacitinib im Vergleich zu Placebo (dieser Vergleich ist für multiples Testen nicht kontrolliert)
Für binäre Endpunkte basieren die Ergebnisse in Woche 14 auf der Non-Responder-Imputation (SELECT-AXIS 1) und auf der Non-Responder-Imputation in Verbindung mit der multiplen Imputation (SELECT-AXIS 2). Für kontinuierliche Endpunkte basieren die Ergebnisse in Woche 14 auf der mittleren Veränderung der least squares gegenüber dem Ausgangswert unter Verwendung gemischter Modelle für die Analyse wiederholter Messungen.
|
Die Ansprechraten für ASAS40, ASAS20, ASAS Teilremission, BASDAI 50, ASDAS inaktive Erkrankung, ASDAS niedrige Krankheitsaktivität, die Veränderung von ASDAS-CRP gegenüber dem Ausgangswert und hsCRP bei Patienten, die mit RINVOQ 15 mg behandelt wurden, wurden in beiden Studien bis Woche 104 beibehalten.
Körperliche Funktionsfähigkeit und gesundheitsbezogene Ergebnisse
In beiden Studien führte die Behandlung mit RINVOQ 15 mg bei Patienten zu einer signifikanten Verbesserung (p = 0,001 für SELECT-AXIS 1 und p <0,0001 für SELECT-AXIS 2) der körperlichen Funktionsfähigkeit im Vergleich zu Placebo, gezeigt gemäss BASFI-Score-Änderung zur Baseline in Woche 14 (Rinvoq 15 mg -2,29 in SELECT-AXIS 1 und -2,26 in SELECT-AXIS 2 vs. Placebo -1,30 und -1,09). Die Standardabweichung der Veränderung innerhalb der Gruppe im Vergleich zur Baseline in Woche 14 betrug in SELECT-AXIS 1 2,44 für Patienten, welche mit RINVOQ 15 mg behandelt wurden, und 2,05 für Patienten, welche mit Placebo behandelt wurden, und in SELECT-AXIS 2 2,28 für Patienten, welche mit RINVOQ 15 mg behandelt wurden, und 1,67 für Patienten, welche mit Placebo behandelt wurden.
In SELECT-AXIS 1 führte die Behandlung mit RINVOQ 15 mg bei Patienten zu einer grösseren Verbesserung der Rückenschmerzen beurteilt anhand der Gesamt-Rückenschmerz-Komponente des ASAS-Ansprechens im Vergleich zu Placebo in Woche 14.
Eine Verbesserung der nächtlichen Rückenschmerzen im Vergleich zu Placebo in Woche 14 wurde gezeigt, welche bereits ab Woche 2 festgestellt wurde.
In SELECT-AXIS 2 führte die Behandlung mit RINVOQ 15 mg bei Patienten zu signifikanten Verbesserungen der Gesamt- und nächtlichen Rückenschmerzen im Vergleich zu Placebo in Woche 14. Ein Ansprechen wurde bereits in Woche 1 bei Gesamt-Rückenschmerzen und in Woche 2 bei nächtlichen Rückenschmerzen beobachtet.
In beiden Studien wurden Verbesserungen auch bei peripheren Schmerzen und Schwellungen (gemessen anhand der BASDAI-Frage 3 zu allgemeinen Schmerzen in den Gelenken mit Ausnahme des Nackens, Rückens oder der Hüften) im Vergleich zu Placebo in Woche 14 beobachtet.
In beiden Studien wurden bei Patienten unter RINVOQ 15 mg die Ansprechraten von Woche 14 im BASFI, bei den Gesamt-Rückenschmerzen und bei den nächtlichen Rückenschmerzen bis Woche 104 aufrechterhalten.
In SELECT-AXIS 2 führte die Behandlung mit RINVOQ 15 mg im Vergleich zu Placebo bei Patienten zu im Vergleich zur Baseline signifikanten Verbesserungen der gesundheitsbezogenen Lebensqualität und der allgemeinen Gesundheit, gemessen anhand des ASQoL-Fragebogens und des ASAS-Gesundheitsindex in Woche 14. Die Verbesserungen beim ASQoL-Fragebogen und im ASAS-Gesundheitsindex wurden bis Woche 104 aufrechterhalten.
Enthesitis
In SELECT-AXIS 2 führte die Behandlung mit RINVOQ 15 mg bei Patienten mit bereits bestehender Enthesitis zu einer signifikanten Verbesserung der Enthesitis im Vergleich zu Placebo, gemessen anhand der Veränderung des MASES gegenüber Baseline in Woche 14. Die Verbesserung der Enthesitis wurde bis Woche 104 aufrechterhalten.
Beweglichkeit der Wirbelsäule
In SELECT-AXIS 2 führte die Behandlung mit RINVOQ 15 mg bei Patienten zu einer signifikanten Verbesserung der Beweglichkeit der Wirbelsäule im Vergleich zu Placebo, gemessen anhand der Veränderung des Bath Ankylosing Spondylitis Metrology Index (BASMI) gegenüber Baseline in Woche 14. Die Verbesserung des BASMI wurde bis Woche 104 aufrechterhalten.
In SELECT-AXIS 1 wurden bei Patienten unter RINVOQ 15 mg bei vordefinierten sekundären Endpunkten von BASMI, MASES, ASQoL, ASAS HI und WPAI im Vergleich zur Baseline in Woche 14 Verbesserungen im Vergleich zu Placebo beobachtet, die jedoch in den multiplizitätsbereinigten Analysen statistisch nicht signifikant waren. Die in Woche 14 beobachteten Ansprechraten wurden bei Patienten unter RINVOQ 15 mg bis Woche 104 aufrechterhalten.
Objektive Messung von Entzündungen
Anzeichen von Entzündungen wurden per MRI beurteilt und als Veränderung gegenüber dem Ausgangswert im SPARCC-Score für die Wirbelsäule wiedergegeben. In beiden Studien wurde in Woche 14 eine signifikante Verbesserung der Entzündungsanzeichen in der Wirbelsäule bei Patienten unter RINVOQ 15 mg im Vergleich zu Placebo verzeichnet. Die in Woche 14 beobachteten Ansprechraten im Hinblick auf Entzündung, ermittelt per MRI, wurden bis Woche 104 aufrechterhalten.
Riesenzellarteriitis
Die Wirksamkeit und Sicherheit von RINVOQ 15 mg einmal täglich wurden in SELECT-GCA, einer randomisierten, doppelblinden, multizentrischen, placebokontrollierten Phase-III-Studie bei Patienten im Alter von 50 Jahren und älter mit neu auftretender oder rezidivierender Riesenzellarteriitis untersucht. Patienten mit einem Rezidiv unter einer vorherigen IL6-Inhibitor-Therapie waren von der Studie ausgeschlossen. SELECT-GCA war eine 52wöchige Studie mit 428 Patienten, die im Verhältnis 2:1:1 randomisiert wurden und einmal täglich entweder Upadacitinib (RINVOQ) 15 mg, Upadacitinib 7,5 mg oder Placebo erhielten. Alle Patienten erhielten eine Hintergrundtherapie mit Kortikosteroiden. Die beiden Behandlungsarme mit Upadacitinib befolgten eine vorgegebene ausschleichende Kortikosteroidtherapie mit dem Ziel von 0 mg in Woche 26. Der Placeboarm befolgte eine vorgegebene ausschleichende Kortikosteroidtherapie mit dem Ziel von 0 mg in Woche 52. Der primäre Endpunkt war der Anteil der Patienten, die in Woche 52 eine anhaltende Remission erreichten, definiert als das Fehlen von Anzeichen und Symptomen einer Riesenzellarteriitis von Woche 12 bis Woche 52 und die Einhaltung der im Studienprotokoll festgelegten ausschleichenden Kortikosteroidtherapie. Die Studie beinhaltete eine 52wöchige Fortsetzungsphase für eine Gesamtstudiendauer von bis zu 2 Jahren.
Klinisches Ansprechen
Upadacitinib 7,5 mg und eine 26wöchige ausschleichende Kortikosteroidtherapie zeigten keine statistisch signifikante Differenz im primären Endpunkt im Vergleich zu Placebo und einer 52wöchigen ausschleichenden Kortikosteroidtherapie (die entsprechenden Daten sind nicht weiter aufgeführt).
Von 209 Patienten, die zur Behandlung mit Upadacitinib 15 mg randomisiert wurden, hatten 61 Patienten eine aktive rezidivierende Riesenzellarteriitis.
Upadacitinib 15 mg und eine 26wöchige ausschleichende Kortikosteroidtherapie zeigten eine Überlegenheit in Bezug auf das Erreichen einer kortikosteroidfreien, anhaltenden Remission in Woche 52 im Vergleich zu Placebo und einer 52wöchigen ausschleichenden Kortikosteroidtherapie (Tabelle 15).
Tabelle 15. Klinisches Ansprechen der Population mit rezidivierender RZA in der Studie SELECT-GCA
|
Behandlungsarm
|
PBO + 52wöchige ausschleichende Kortikosteroidtherapie
N = 36
|
UPA 15 mg + 26wöchige ausschleichende Kortikosteroidtherapie
N = 61
|
Behandlungsunterschied
(95 %-KI)
| |
Anhaltende Remission in Woche 52a
|
22,2%
|
42,3%
|
20,1% (1,7; 38,6)
| |
Anhaltende komplette Remission in Woche 52b
|
8,3%
|
32,7%
|
24,4% (9,5; 39,2)
| |
Abkürzungen: BSG = Blutsenkungsgeschwindigkeit; hsCRP = hochsensitives Creaktives Protein; PBO = Placebo; RZA = Riesenzellarteriitis; UPA = Upadacitinib
a Anhaltende Remission wird definiert als das Erreichen eines Fehlens von Anzeichen und Symptomen einer RZA von Woche 12 bis Woche 52 und die Einhaltung der im Studienprotokoll festgelegten ausschleichenden Kortikosteroidtherapie.
b Anhaltende komplette Remission wird definiert als das Erreichen eines Fehlens von Anzeichen und Symptomen einer RZA von Woche 12 bis Woche 52, einer Normalisierung der BSG (auf ≤30 mm/h; falls BSG > 30 mm/h und Erhöhung nicht auf RZA zurückzuführen, kann dieses Kriterium dennoch erfüllt werden) von Woche 12 bis Woche 52, einer Normalisierung des hsCRP auf < 1 mg/dl ohne Erhöhung auf ≥1 mg/dl (bei 2 aufeinanderfolgenden Besuchen) von Woche 12 bis Woche 52 und die Einhaltung der im Studienprotokoll festgelegten ausschleichenden Kortikosteroidtherapie.
|
Gesundheitsbezogene Ergebnisse
Fatigue wurde anhand des FACIT-Fatigue-Scores beurteilt. Patienten, die mit Upadacitinib 15 mg und einer 26wöchigen ausschleichenden Kortikosteroidtherapie behandelt wurden, zeigten in Woche 52 eine grössere Verbesserung des FACIT-Fatigue-Scores gegenüber Baseline (3,7; 95%-CI: 0,88 – 6,54) als Patienten unter Placebo und einer 52wöchigen ausschleichenden Kortikosteroidtherapie (-4,1; 95%-CI: -8,16 – 0,02).
Atopische Dermatitis
Die Wirksamkeit und Sicherheit von RINVOQ 15 mg und 30 mg einmal täglich wurden in drei randomisierten, doppelblinden, multizentrischen Phase-III-Studien (MEASURE UP 1, MEASURE UP 2 und AD UP) bei insgesamt 2584 Patienten (im Alter von mindestens 12 Jahren) bewertet (Tabelle 16). RINVOQ wurde bei 344 jugendlichen und 2240 erwachsenen Patienten mit mittelschwerer bis schwerer atopischer Dermatitis (AD) untersucht, die nicht genügend durch topische Medikamente kontrolliert wurden. Bei Baseline musste bei den Patienten Folgendes vorliegen: ein Investigator Global Assessment-(vIGA-AD-)Score ≥3 bei der allgemeinen AD-Bewertung (Erythem, Induration/Papulation und Nässen/Verkrustung) auf einer Skala mit zunehmendem Schweregrad von 0 bis 4, ein Eczema Area and Severity Index(EASI)-Score ≥16 (zusammengesetzter Score, der das Ausmass und den Schweregrad des Erythems, Ödems/der Papulation, Kratzer und Lichenifikation an 4 verschiedenen Körperstellen erfasst), eine minimale Beteiligung der Körperoberfläche (BSA) von ≥10 % und ein durchschnittlicher wöchentlicher Score auf der Worst Pruritus Numerical Rating Scale (NRS) von ≥4.
In allen drei Studien haben die Patienten über einen Zeitraum von 16 Wochen RINVOQ einmal täglich 15 mg bzw. 30 mg oder ein entsprechendes Placebo erhalten. In der AD UP-Studie haben die Patienten zusätzlich topische Kortikosteroide (TCS) als Begleitmedikation erhalten. Nach Abschluss des doppelblinden Abschnitts wurden die Patienten, welche ursprünglich RINVOQ erhielten, bis Woche 136 mit der gleichen Dosis weiterbehandelt. Die Patienten in der Placebo-Gruppe wurden im Verhältnis 1:1 erneut randomisiert und erhielten bis Woche 136 RINVOQ 15 mg oder 30 mg.
Tabelle 16. Zusammenfassung der klinischen Studie
|
Studienname
|
Behandlungsarme
|
Wichtige Ergebnismessungen
| |
MEASURE UP 1
und
MEASURE UP 2
|
·Upadacitinib 15 mg
·Upadacitinib 30 mg
·Placebo
|
Co-primäre Endpunkte nach Woche 16:
·EASI 75
·vIGA-AD 0/1
| |
Wichtige sekundäre Endpunkte (nach Woche 16, wenn nicht anders vermerkt)
·EASI 90/100
·EASI 75 nach Woche 2
·% Änderung des EASI
·% Änderung des SCORAD
·Verbesserung des Worst Pruritus NRS ≥4 in Woche 1 und 16
·Verbesserung des Worst Pruritus NRS ≥4 an Tag 2 (30 mg); Tag 3 (15 mg)
·% Änderung der Worst Pruritus NRS
·EASI-Anstieg ≥6,6 Punkte (Aufflammen) während des doppelblinden Abschnitts
·ADerm-SS TSS-7 Verbesserung ≥28
·ADerm-SS Hautschmerzen Verbesserung ≥4
·ADerm-IS Schlaf Verbesserung ≥12
·ADerm-IS Gemütszustand Verbesserung ≥11
·ADerm-IS Tägliche Aktivitäten Verbesserung ≥14
·POEM Verbesserung ≥4
·HADS-A < 8 und HADS-D < 8
·DLQI 0/1
·DLQI Verbesserung ≥4
| |
AD UP
|
·Upadacitinib 15 mg + TCS
·Upadacitinib 30 mg +TCS
·Placebo +TCS
|
Co-primäre Endpunkte nach Woche 16:
·EASI 75
·vIGA-AD 0/1
Wichtige sekundäre Endpunkte (nach Woche 16, wenn nicht anders vermerkt)
·EASI 75 nach Woche 2 und 4
·EASI 90 nach Woche 4 und 16
·EASI 100 (30 mg)
·% Änderung des EASI
·Verbesserung des Worst Pruritus NRS ≥4 nach Woche 1, 4 und 16
·% Änderung des Worst Pruritus NRS
| |
Abkürzungen: SCORAD = SCORing Atopic Dermatitis, POEM: Patient Oriented Eczema Measure, DLQI: Dermatology Life Quality Index, HADS: Hospital Anxiety and Depression Scale, ADerm-SS = Atopic Dermatitis Symptom Scale, ADerm-IS: Atopic Dermatitis Impact Scale
|
Baseline Charakteristika
In den Monotherapie Studien (MEASURE UP 1 und 2) hatten 50,0% der Patienten einen Baseline vIGA-AD Score von 3 (moderat) und 50,0% der Patienten einen vIGA-AD Score von 4 (schwer). Die mittlere Baseline des EASI Score war 29,3 und die mittlere Baseline der wöchentlichen Worst Pruritus NRS war 7,3. In den Monotherapie-Studien betrug das Durchschnittsalter über alle Behandlungsgruppen 33,8 Jahre, das Durchschnittskörpergewicht 74,8 kg, 44,9% waren Frauen, 67,3% waren Weisse, 22,9% waren Asiaten und 6,3% waren Schwarze.
In der Studie mit begleitend verabreichten TCS (AD UP), hatten 47,1% der Patienten einen Baseline vIGA-AD Score von 3 (moderat) und 52,9% der Patienten hatten einen vIGA-AD Score von 4 (schwer). Die mittlere Baseline des EASI Score war 29,7 und die mittlere Baseline des wöchentlichen Worst Pruritus NRS war 7,2. In der AD UP-Studie betrug das Durchschnittsalter in allen Behandlungsgruppen 34,1 Jahre, das Durchschnittskörpergewicht 75,5 kg, 39,3% waren Frauen, 71,8% waren Weisse, 20,5% waren Asiaten und 5,5% waren Schwarze.
Klinisches Ansprechen
Monotherapie-Studien (MEASURE UP 1 UND MEASURE UP 2)
In den MEASURE UP-Studien erreichte ein signifikant höherer Anteil der mit RINVOQ 15 mg behandelten Patienten nach Woche 16 ein vIGA-AD-Ansprechen von 0 oder 1 und einen EASI 75 im Vergleich zu Placebo (Tabelle 17). Es wurde bei RINVOQ 15 mg im Vergleich zu Placebo eine schnelle Verbesserung des Hautbildes (gemäss EASI 75 bereits nach Woche 2) erreicht (p < 0,001).
Bei einem signifikant höheren Anteil der mit RINVOQ 15 mg behandelten Patienten wurde nach Woche 16 eine klinisch bedeutungsvolle Verbesserung des Juckreizes (als ≥4-Punkte-Verringerung des Worst Pruritus NRS definiert) im Vergleich zu Placebo erreicht. Es wurde eine schnelle Verbesserung des Juckreizes (als ≥4-Punkte-Verringerung des Worst Pruritus NRS nach Woche 1 definiert) bei RINVOQ 15 mg im Vergleich zu Placebo (p < 0,001) erreicht; Unterschiede wurden dabei bereits zwei Tage nach Beginn der Behandlung mit RINVOQ 15 mg (Tag 3, p < 0,001) beobachtet.
Bei einem signifikant tieferen Anteil der mit RINVOQ 15 mg behandelten Patienten trat während der ersten 16 Wochen Behandlung im Vergleich zu Placebo (p < 0,001) ein Aufflammen der Erkrankung auf, definiert als klinisch bedeutungsvolle Verschlechterung der Krankheit (Anstieg des EASI um ≥6,6).
Abbildung 4 und Abbildung 5 zeigen den Anteil der Patienten, die ein EASI-75-Ansprechen erreicht haben bzw. den Anteil der Patienten mit einer ≥4-Punkte-Verbesserung des Worst Pruritus NRS bis zu Woche 16.
Tabelle 17: Wirksamkeitsergebnisse der RINVOQ-Monotherapie-Studien nach Woche 16
|
Studie
|
MEASURE UP 1
|
MEASURE UP 2
| |
Behandlungsgruppe
|
PBO
|
UPA
15 mg
|
PBO
|
UPA
15 mg
| |
Anzahl der randomisierten Teilnehmer
|
281
|
281
|
278
|
276
| |
% Responder
| |
vIGA-AD 0/1a,b
|
8,4%
|
48,1%f
|
4,7%
|
38,8%f
| |
EASI 75a
|
16,3%
|
69,6%f
|
13,3%
|
60,1%f
| |
EASI 90 a
|
8,1%
|
53,1%f
|
5,4%
|
42,4%f
| |
EASI 100 a
|
1,8 %
|
16,7%f
|
0,7%
|
14,1%f
| |
Worst Pruritus NRSc
(≥4-Punkte-Verbesserung)
|
11,8%
N=272
|
52,2%f
N=274
|
9,1%
N=274
|
41,9%f
N=270
| |
Worst Pruritus NRS 0 oder 1d
|
5,5%
N=275
|
36,6%g
N=279
|
4,3%
N=277
|
26,9%g
N=275
| |
Mittlere prozentuale Änderung (SE)e
| |
EASI
|
-40,7% (2,28)
|
-80,2%f (1,91)
|
-34,5% (2,59)
|
-74,1%f (2,20)
| |
SCORAD
|
-32,7% (2,33)
|
-65,7%f (1,78)
|
-28,4% (2,50)
|
-57,9%f (2,01)
| |
Worst Pruritus NRS
|
-26,1% (5,41)
|
-62,8%f (4,49)
|
-17,0% (2,73)
|
-51,2%f (2,34)
| |
Abkürzungen: UPA= Upadacitinib (RINVOQ); PBO = Placebo
a Basierend auf der Anzahl randomisierter Patienten
b Responder wurde als Patient mit vIGA-AD 0 oder 1 («klar» oder «fast klar») mit einer Verringerung um ≥2 Punkte auf einer Ordnungsskala von 0 bis 4 definiert
c N = Anzahl der Patienten, deren Worst Pruritus NRS bei Baseline bei ≥4 ist
d N = Anzahl der Patienten, deren Worst Pruritus NRS bei Baseline bei > 1 ist
e % Veränderung = mittlere prozentuale Veränderung der «least squares» gegenüber dem Ausgangswert
f für multiples Testen kontrollierter p < 0,001 Upadacitinib im Vergleich zu Placebo
g nominal p < 0,001 Upadacitinib im Vergleich zu Placebo
|
Abbildung 4: Anteil der Patienten, die ein EASI-75-Ansprechen in den Monotherapie-Studien erreicht haben
|
MEASURE UP 1
|
MEASURE UP 2
| |
|
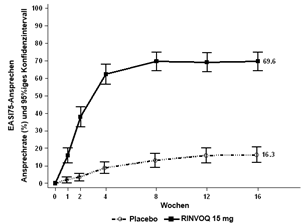
|
|
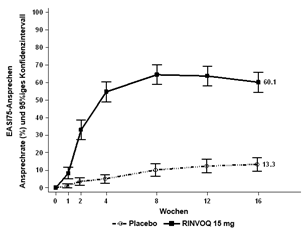
|
Abbildung 5: Anteil der Patienten mit einer ≥4-Punkte-Verbesserung des Worst Pruritus NRS in den Monotherapie-Studien
|
MEASURE UP 1
|
MEASURE UP 2
| |
|
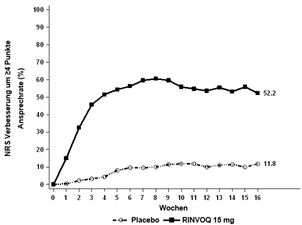
|
|
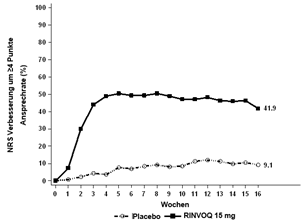
|
Das Behandlungsansprechen in Subgruppen (Gewicht, Alter, Geschlecht, ethnische Herkunft und vorherige Behandlung mit Immunsuppressiva) waren in beiden Studien mit den Ergebnissen in der allgemeinen Studienpopulation konsistent.
Bei beiden Studien wurden die Ergebnisse nach Woche 16 bis Woche 52 bei mit RINVOQ 15 mg behandelten Patienten weiterhin beobachtet.
Studie zu begleitend verabreichten TCS (AD UP)
In der AD UP-Studie erreichte ein signifikant höherer Anteil der mit RINVOQ 15 mg plus TCS behandelten Patienten nach Woche 16 ein vIGA-AD-Ansprechen mit 0 oder 1 und ein EASI-75-Ansprechen im Vergleich zu Placebo plus TCS (Tabelle 18). Es wurde im Vergleich zu Placebo plus TCS eine schnelle Verbesserung des Hautbildes (gemäss EASI 75 nach Woche 2) erreicht (p < 0,001). Zusätzlich wurde im Vergleich zu Placebo plus TCS nach Woche 4 eine höhere EASI-90-Ansprechrate erreicht (p < 0,001).
Bei einem signifikant höheren Anteil an mit RINVOQ 15 mg plus TCS behandelten Patienten wurde nach Woche 16 eine klinisch bedeutungsvolle Verbesserung des Juckreizes (als ≥4-Punkte-Verringerung des Worst Pruritus NRS definiert) im Vergleich zu Placebo erreicht. Es wurde im Vergleich zu Placebo eine schnelle Verbesserung des Juckreizes (als eine ≥4-Punkte-Verringerung des Worst Pruritus NRS bereits nach Woche 1 definiert) erreicht (p < 0,001).
Abbildung 6 und Abbildung 7 zeigen den Anteil der Patienten, die ein EASI-75-Ansprechen erreicht haben bzw. den Anteil der Patienten mit einer ≥4-Punkte-Verbesserung des Worst Pruritus NRS bis zu Woche 16.
Tabelle 18: Wirksamkeitsergebnisse von RINVOQ mit begleitenden TCS nach Woche 16
|
Behandlungsgruppe
|
Placebo + TCS
|
UPA 15 mg + TCS
| |
Anzahl der randomisierten Teilnehmer
|
304
|
300
| |
% Responder
| |
vIGA-AD 0/1a,b
|
10,9%
|
39,6%f
| |
EASI 75a
|
26,4%
|
64,6%f
| |
EASI 90a
|
13,2%
|
42,8%f
| |
EASI 100a
|
1,3%
|
12,0% g
| |
Worst Pruritus NRSc
(≥4-Punkte-Verbesserung)
|
15,0%
N=294
|
51,7%f
N=288
| |
Worst Pruritus NRS 0 oder 1d
|
7,3%
N=300
|
33,1%g
N=296
| |
Mittlere prozentuale Änderung (SE)e
| |
EASI
|
-45,9% (2,16)
|
-78,0%f (1,98)
| |
SCORAD
|
-33,6% (1,90)
|
-61,2%g (1,70)
| |
Worst Pruritus NRS
|
-25,1% (3,35)
|
-58,1%f (3,11)
| |
Abkürzungen: UPA= Upadacitinib (RINVOQ); PBO = Placebo
a Basierend auf der Anzahl randomisierter Patienten
b Responder wurde als Patient mit vIGA-AD 0 oder 1 («klar» oder «fast klar») mit einer Verringerung um ≥2 Punkte auf einer Ordnungsskala von 0 bis 4 definiert
c N = Anzahl der Patienten, deren Worst Pruritus NRS bei Baseline bei ≥4 ist
d N = Anzahl der Patienten, deren Worst Pruritus NRS bei Baseline bei > 1 ist
e % Veränderung = mittlere prozentuale Veränderung der least squares gegenüber dem Ausgangswert
f für multiples Testen kontrolliert p < 0,001 Upadacitinib + TCS im Vergleich zu Placebo + TCS
g nominal p < 0,001 Upadacitinib + TCS im Vergleich zu Placebo + TCS
|
Abbildung 6: Anteil der Patienten, die ein EASI-75-Ansprechen in der AD UP-Studie erreicht haben
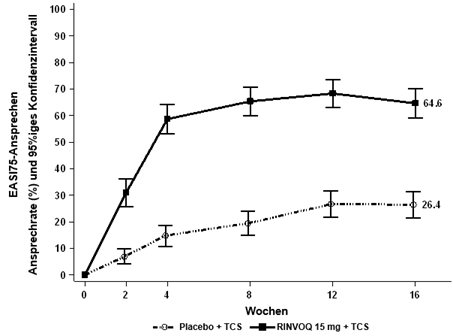
Abbildung 7: Anteil der Patienten mit einer ≥4-Punkte-Verbesserung des Worst Pruritus NRS in der AD UP-Studie
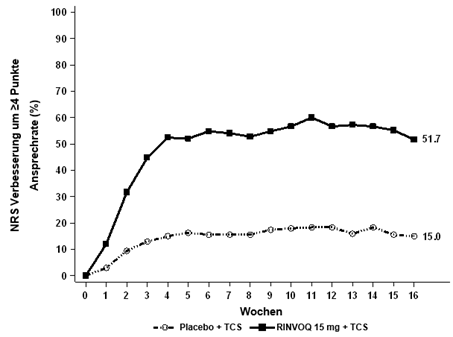
Die Behandlungswirkungen in Subgruppen (Gewicht, Alter, Geschlecht, ethnische Herkunft und vorherige Behandlung mit Immunsuppressiva) waren in der AD UP-Studie mit den Ergebnissen in der allgemeinen Studienpopulation konsistent.
Patienten, die mit RINVOQ 15 mg behandelt wurden, hatten signifikant mehr Tage ohne TCS-Anwendung bei einem gleichzeitigen EASI-75-Ansprechen (Mittelwert: 33,5 Tage) über einen Zeitraum von 16 Wochen im Vergleich zur Placebogruppe (Mittelwert: 7,9 Tage).
Die Ergebnisse nach Woche 16 wurden bis Woche 52 bei mit RINVOQ 15 mg behandelten Patienten weiterhin beobachtet.
Lebensqualität / von Patienten berichtete Ergebnisse
In den MEASURE UP-Studien berichtete ein signifikant höherer Anteil der mit RINVOQ 15 mg behandelten Patienten nach Woche 16 klinisch bedeutungsvolle Linderungen der AD-Symptome und Verringerungen der AD-Auswirkung auf die gesundheitsbezogene Lebensqualität im Vergleich zu Placebo (Tabelle 19). Ein signifikant höherer Anteil der mit RINVOQ behandelten Patienten erreichten nach Woche 16 klinisch bedeutungsvolle Verringerungen des Schweregrads der AD-Symptome gemäss ADerm SS TSS-7 und ADerm SS Hautschmerzen im Vergleich zu Placebo. Ein höherer Anteil der mit RINVOQ behandelten Patienten erreichte nach Woche 16 klinisch bedeutungsvolle Verringerungen der von Patienten berichteten Auswirkungen von AD auf den Schlaf, tägliche Aktivitäten und den Gemütszustand gemäss ADerm IS-Domänen-Scores im Vergleich zu Placebo. Im Vergleich zu Placebo erreichte in gleicher Weise ein höherer Anteil der mit RINVOQ behandelten Patienten nach Woche 16 klinisch bedeutungsvolle Verbesserungen der AD-Symptomhäufigkeit und gesundheitsbezogenen Lebensqualität gemäss POEM und DLQI.
Symptome von Angst und Depressionen gemäss HADS-Score waren signifikant verringert; bei Patienten mit Ausgangswerten auf der HADS-Angst- oder HADS-Depressionssubskala ≥8 (Cut-off-Wert für Angstzustände oder Depressionen) erreichte ein höherer Anteil der Patienten in der mit RINVOQ 15 mg nach Woche 16 HADS-Angst- und HADS-Depressions-Scores < 8 im Vergleich zu Placebo (Tabelle 19).
Tabelle 19: Von Patienten berichtete Ergebnisse der RINVOQ-Monotherapie-Studien nach Woche 16
|
Studie
|
MEASURE UP 1
|
MEASURE UP 2
| |
Behandlungsgruppe
|
PBO
|
UPA
15 mg
|
PBO
|
UPA
15 mg
| |
Anzahl der randomisierten Teilnehmer
|
281
|
281
|
278
|
276
| |
% Responder
| |
ADerm-SS TSS-7
(≥28-Punkte-Verbesserung)a,b
|
15,0%
N=226
|
53,6%h
N=233
|
12,7%
N=244
|
53,0%h
N=230
| |
ADerm-SS Hautschmerzen
(≥4-Punkte-Verbesserung)a
|
15,0%
N=233
|
53,6% h
N=237
|
13,4%
N=247
|
49,4%h
N=237
| |
ADerm-IS Schlaf
(≥12-Punkte-Verbesserung)a,c
|
13,2%
N=220
|
55,0%h
N=218
|
12,4%
N=233
|
50,2%h
N=219
| |
ADerm-IS Tägliche Aktivitäten
(≥14-Punkte-Verbesserung) a,d
|
20,3%
N=197
|
65,0%h
N=203
|
18,9%
N=227
|
57,0%h
N=207
| |
ADerm-IS Gemütszustand
(≥11-Punkte-Verbesserung)a,d
|
19,8%
N=212
|
62,6%h
N=227
|
16,7%
N=234
|
57,0%h
N=228
| |
DLQI
(DLQI 0/1)f
|
4,4%
N=252
|
30,3%h
N=258
|
4,7%
N=257
|
23,8%h
N=252
| |
DLQI
(≥4-Punkte-Verbesserung)a
|
29,0%
N=250
|
75,4%h
N=254
|
28,4%
N=250
|
71,7%h
N=251
| |
POEM
(≥4-Punkte-Verbesserung)a
|
22,8%
N=276
|
75,0%h
N=278
|
28,7%
N=268
|
70,9%h
N=268
| |
HADS
(HADS-A < 8 und HADS-D < 8)g
|
14,3%
N=126
|
45,5%h
N=145
|
11,4%
N=140
|
46,0%h
N=137
| |
Abkürzungen: UPA= Upadacitinib (RINVOQ); PBO = Placebo
Die festgelegten Grenzwerte entsprechen dem geringsten klinisch relevanten Unterschied (MCID) und wurden zur Bestimmung des Ansprechens verwendet.
a N = Anzahl der Patienten, deren Ausgangswert grösser oder gleich MCID ist.
b ADerm-SS TSS-7 bewertet das Jucken beim Schlafen und im Wachzustand, Hautschmerzen, Hautrisse, durch Hautrisse verursachten Schmerz, trockene Haut und Hautschuppung aufgrund von AD.
c ADerm-IS Schlaf bewertet die Schwierigkeit beim Einschlafen, Auswirkung auf den Schlaf und das Aufwachen in der Nacht aufgrund von AD.
d ADerm-IS Tägliche Aktivitäten bewertet die Auswirkung von AD auf Haushalts- Aktivitäten, körperliche Aktivitäten, soziale Aktivitäten und die Konzentration.
e ADerm-IS Gemütszustand bewertet das Selbstbewusstsein, emotionalen Stress und Traurigkeit aufgrund von AD.
f N ist die Anzahl der Patienten, deren Ausgangs-DLQI-Score > 1 beträgt.
g N ist die Anzahl der Patienten, deren Ausgangs-HADS-A- oder HADS-D-Score ≥8 beträgt.
h für multiples Testen kontrolliert p < 0,001 Upadacitinib im Vergleich zu Placebo
|
Colitis ulcerosa
Die Wirksamkeit und Sicherheit von RINVOQ wurde in drei multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studien untersucht: zwei Replikatinduktionsstudien – UC-1 (U-ACHIEVE Induction) und UC-2 (U-ACCOMPLISH) – und eine Erhaltungsstudie UC-3 (U-ACHIEVE Maintenance). Zusätzlich wurde die Wirksamkeit und Sicherheit von RINVOQ in einer Langzeitstudie, UC-4 (U-ACTIVATE), beurteilt.
Die Krankheitsaktivität basierte auf dem adaptierten Mayo-Score (aMS, Mayo-Scoring-System ohne die allgemeine Beurteilung durch den Arzt), der zwischen 0 und 9 lag und drei Subscores mit einem Wert von 0 (normal) bis 3 (äusserst schwer) umfasst: Subscore zur Stuhlfrequenz (SFS), Subscore zur Darmblutung (RBS) und einen zentral überprüften endoskopischen Subscore (ES).
Tabelle 20: Zusammenfassung der klinischen Studien
|
Name der Studie
|
Population (n)
|
Behandlungsarme
|
Wichtige Endpunkte
| |
Induktion
| |
U-ACHIEVE
(UC-1)
U-ACCOMPLISH (UC-2)
|
Versagen der Biologikatherapie*
(246/473)
Kein Versagen der Biologikatherapie+(227/473)
Versagen der Biologikatherapie
(262/515)
Kein Versagen der Biologikatherapie (253/515)
|
·Upadacitinib 45 mg
·Placebo
|
Primärer Endpunkt:
·Klinische Remission gemäss adaptiertem Mayo-Score in Woche 8
| |
Sekundäre Endpunkte in Woche 8 oder wie angegeben:
·Endoskopische Verbesserung
·Endoskopische Remission
·Klinisches Ansprechen
·Klinisches Ansprechen in Woche 2
·Histologisch-endoskopische Verbesserung der Mukosa
·Kein Stuhldrang
·Keine Bauchschmerzen
·Histologische Verbesserung
·Veränderung des Gesamtscores auf der IBDQ gegenüber Baseline
·Mukosaheilung
·Veränderung des FACIT-F gegenüber Baseline
| |
Erhaltung
| |
U-ACHIEVE
(UC-3)
|
Versagen der Biologikatherapie
(225/451)
Kein Versagen der Biologikatherapie (226/451)
|
·Upadacitinib 15 mg
·Upadacitinib 30 mg
·Placebo
|
Primärer Endpunkt:
·Klinische Remission gemäss adaptiertem Mayo-Score in Woche 52
| |
Sekundäre Endpunkte in Woche 52:
·Endoskopische Verbesserung
·Aufrechterhaltung der klinischen Remission
·Kortikosteroidfreie klinische Remission
·Aufrechterhaltung der endoskopischen Verbesserung
·Endoskopische Remission
·Aufrechterhaltung des klinischen Ansprechens
·Histologisch-endoskopische Verbesserung der Mukosa
·Veränderung des IBDQ-Gesamtscores gegenüber Baseline
·Mukosaheilung
·Kein Stuhldrang
·Keine Bauchschmerzen
·Veränderung des FACIT-F gegenüber Baseline
| |
*Versagen der Biologikatherapie: unzureichendes Ansprechen, Verlust des Ansprechens oder Unverträglichkeit gegenüber einer vorherigen Biologikatherapie
+Kein Versagen der Biologikatherapie: unzureichendes Ansprechen, Verlust des Ansprechens oder Unverträglichkeit gegenüber einer konventionellen Therapie, aber kein Versagen der Biologikatherapie
Abkürzungen: IBDQ: Fragebogen zu chronisch entzündlichen Darmerkrankungen (Inflammatory Bowel Disease Questionnaire), FACIT-F: Fragebogen zur Fatigue in der Funktionsbeurteilung bei Therapie chronischer Krankheiten (Functional Assessment of Chronic Illness Therapy-Fatigue)
|
Induktionsstudien (UC-1 und UC-2)
In den Studien UC-1 und UC-2 wurden 979 erwachsene und 9 jugendliche Patienten (473 bzw. 515 Patienten) im Verhältnis 2:1 randomisiert und 8 Wochen lang mit RINVOQ 45 mg einmal täglich oder Placebo behandelt und in die Auswertung zur Wirksamkeit eingeschlossen. Alle in Frage kommenden Patienten hatten eine mittelschwere bis schwere aktive Colitis ulcerosa, definiert als aMS von 5 bis 9 mit einem ES von 2 oder 3, und ein vorheriges Therapieversagen, einschliesslich unzureichendem Ansprechen, Verlust des Ansprechens oder Unverträglichkeit gegenüber einer vorherigen konventionellen und/oder Biologikatherapie. Patienten mit einer vorherigen JAK-Inhibitor-Therapie waren von den Studien ausgeschlossen.
Von diesen 979 erwachsenen Patienten hatten 500 unzureichend auf die Behandlung mit einem oder mehreren Biologika angesprochen oder diese nicht vertragen (vorheriges Versagen einer Biologikatherapie)(246 bzw. 254 Patienten). Bei Baseline erhielten 46 % bzw. 47 % der Patienten Kortikosteroide, 1 % bzw. 1 % Methotrexat und 57 % bzw. 61 % Aminosalicylate. Die gleichzeitige Anwendung von Thiopurinen war in den Studien nicht erlaubt. Die Krankheitsaktivität war bei 59 % bzw. 59 % der Patienten mittelschwer (aMS ≤7) und bei 41 % bzw. 41 % schwer (aMS > 7).
Die Resultate des primären Endpunkts der klinischen Remission und der sekundären Endpunkte in Woche 8 bei erwachsenen Patienten mit vorherigem Versagen einer Biologikatherapie sind in Tabelle 21 aufgeführt. Die gepoolten Ergebnisse des klinischen Ansprechens im Zeitverlauf pro paMS bei UC-1 und UC-2 sind in Abbildung 8 dargestellt.
Tabelle 21: Anteil der erwachsenen Patienten mit vorherigem Versagen einer Biologikatherapie, die in Woche 8 die primären und sekundären Endpunkte zur Wirksamkeit in den Induktionsstudien UC-1 und UC-2 erreichten
|
|
UC-1
(U-ACHIEVE)
|
UC-2
(U-ACCOMPLISH)
| |
Endpunkt
|
PBO
N = 78
|
UPA
45 mg
N = 168
|
Behandlungsunterschied
(95 %-KI)
|
PBO
N = 86
|
UPA
45 mg
N = 168
|
Behandlungsunterschied
(95 %-KI)
| |
Krankheitsaktivität und UC-Symptome
| |
Klinische Remissiona
|
0,4 %
|
17,9 %
|
17,5 %***
(11,4; 23,6)
|
2,5 %
|
29,9 %
|
27,3 %***
(19,6; 35,1)
| |
Klinisches Ansprechenb
|
12,8 %
|
64,4 %
|
51,6 %***
(41,2; 61,9)
|
19,9 %
|
69,0 %
|
49,1 %***
(38,1; 60,1)
| |
Kein Stuhldrang
|
14,1 %
|
40,2 %
|
26,1 %***
(15,4; 36,8)
|
17,4 %
|
50,0 %
|
32,6 %***
(21,5 43,6)
| |
Keine Bauchschmerzen
|
20,5 %
|
42,6 %
|
22,1 %***
(10,4; 33,8)
|
18,6 %
|
53,0 %
|
34,4 %***
(23,2; 45,5)
| |
Endoskopische und histologische Bewertung
| |
Endoskopische Remissionc
|
0
|
8,9 %
|
8,9 %**
(4,6; 13,3)
|
1,2 %
|
12,5 %
|
11,3 %**
(5,8; 16,8)
| |
Endoskopische Verbesserungd
|
1,7 %
|
27,0 %
|
25,3 %***
(17,8; 32,7)
|
5,0 %
|
37,0 %
|
32,0 %***
(23,3; 40,7)
| |
Histologische Verbesserunge
|
17,5 %
|
51,0 %
|
33,5 %***
(22,1; 44,9)
|
21,0 %
|
58,9 %
|
37,9 %***
(26,4; 49,4)
| |
Histologisch-endoskopische Mukosaverbesserungf
|
1,4 %
|
22,7 %
|
21,3 %***
(14,4; 28,2)
|
4,8 %
|
30,4 %
|
25,6 %***
(17,3; 34,0)
| |
Mukosaheilungg
|
0
|
6,5 %
|
6,5 %*
(2,8; 10,3)
|
1,2 %
|
8,9 %
|
7,8 %*
(2,9; 12,6)
| |
Lebensqualität
| |
Veränderung des FACIT-F-Scores gegenüber Baseline
|
N = 65
1,3
|
N = 154
9,6
|
8,3***
(5,66; 11,01)
|
N = 76
3,3
|
N = 154
9,8
|
6,6***
(4,15; 8,99)
| |
Veränderung des Gesamtscores auf der IBDQ gegenüber Baseline
|
N = 65
14,6
|
N = 155
55,7
|
41,1***
(31,53; 50,64)
|
N = 76
17,4
|
N = 156
53,5
|
36,1***
(27,57; 44,72)
| |
Abkürzung: PBO = Placebo
*p ≤0.05
**p ≤0.01
***p ≤0,001, Behandlungsunterschied (95 %-KI)
a Gemäss aMS: SFS ≤1 und nicht grösser als bei Baseline, RBS = 0, ES ≤1 ohne Friabilität
b Gemäss aMS: Verringerung um ≥2 Punkte und ≥30 % gegenüber Baseline und Verringerung des RBS um ≥1 gegenüber Baseline oder ein absoluter RBS-Wert von ≤1
c ES von 0
d ES ≤1 ohne Friabilität
e Verringerung des Geboes-Score gegenüber Baseline. Die histologischen Ergebnisse wurden anhand des Geboes-Scores beurteilt.
f ES ≤1 ohne Friabilität und Geboes-Score ≤3,1 (weist auf eine Neutrophileninfiltration in < 5 % der Krypten hin, keine Zerstörung der Krypten und keine Erosionen, Ulzerationen oder Granulationsgewebe).
g ES = 0, Geboes-Score < 2 (weist darauf hin, dass keine Neutrophile in Krypten oder der Lamina propria vorliegen und die Eosinophilen nicht erhöht sind, keine Zerstörung der Krypten und keine Erosionen, Ulzerationen oder Granulationsgewebe)
|
Abbildung 8: Anteil der erwachsenen Patienten mit vorherigem Versagen einer Biologikatherapie, die ein klinisches Ansprechen gemäss paMS (SFS und RBS) erreichten, im Zeitverlauf in den Induktionsstudien UC-1 und UC-2
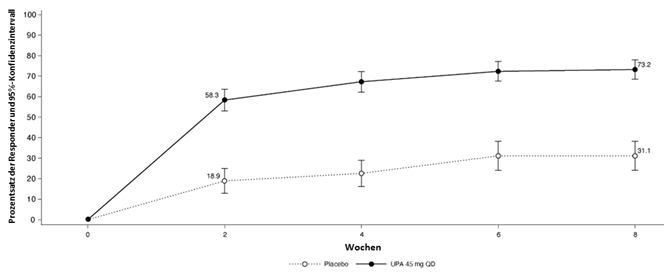
Verlängerte Induktionsphase
Insgesamt 124 erwachsene Patienten in UC-1 und UC-2, die nach 8wöchiger Behandlung mit RINVOQ 45 mg einmal täglich kein klinisches Ansprechen erreichten, traten in eine 8wöchige, offene, verlängerte Induktionsphase ein. Von den Patienten mit vorherigem Versagen einer Biologikatherapie, welche die Behandlung mit RINVOQ 45 mg einmal täglich für weitere 8 Wochen (insgesamt 16 Wochen) erhielten (82 Patienten), erreichten 48,7 % der Patienten ein klinisches Ansprechen gemäss aMS. Von den Patienten, die auf die Behandlung mit RINVOQ 45 mg einmal täglich über 16 Wochen ansprachen, zeigten unter einer Erhaltungstherapie mit RINVOQ 15 mg und 30 mg einmal täglich 36,4 % der Patienten (N=11) bzw. 86,7 % der Patienten (N=15) weiterhin ein klinisches Ansprechen gemäss aMS. Nach der 16-wöchigen Behandlung mit RINVOQ 45 mg einmal täglich, erreichten 20,0 % der Patienten (N=15) unter einer Erhaltungstherapie mit RINVOQ 15 mg bzw. 41,2 % der Patienten (N=17) unter einer Erhaltungstherapie mit RINVOQ 30 mg einmal täglich eine klinische Remission gemäss aMS in Woche 52.
Erhaltungsstudie (UC-3)
In die Auswertung zur Wirksamkeit für UC-3 wurden 223 erwachsene Patienten mit vorherigem Versagen einer Biologikatherapie aufgenommen, die mit einer 8wöchigen Induktionstherapie mit RINVOQ 45 mg einmal täglich ein klinisches Ansprechen gemäss aMS erreichten. Die Patienten wurden randomisiert und erhielten bis zu 52 Wochen lang einmal täglich RINVOQ 15 mg, RINVOQ 30 mg oder Placebo.
Primärer Endpunkt war die klinische Remission in Woche 52. Die primären und sekundären Endpunkte sind in Tabelle 22 aufgeführt. Die symptomatische Remission pro paMS im Zeitverlauf ist in Abbildung 9 dargestellt.
Tabelle 22: Anteil der erwachsenen Patienten mit vorherigem Versagen einer Biologikatherapie, welche die primären und sekundären Endpunkte zur Wirksamkeit in Woche 52 in der Erhaltungsstudie UC-3 erreichten
|
Endpunkt
|
PBO
N = 80
|
UPA
15 mg
N = 71
|
UPA
30 mg
N = 72
|
Behandlungsunterschied
15 mg vs. PBO (95 %-KI)
|
Behandlungsunterschied
30 mg vs. PBO
(95 %-KI)
| |
Krankheitsaktivität und Colitis ulcerosa-Symptome
| |
Klinische Remissiona
|
7,6 %
|
40,5 %
|
49,8 %
|
32,9 %**
(20,0; 45,8)
|
42,2 %**
(29,1; 55,4)
| |
Aufrechterhaltung der klinischen Remissionb
|
N = 21
14,3 %
|
N = 17
76,5 %
|
N = 20
73,0 %
|
62,2 %**
(37,1; 87,3)
|
58,7 %**
(33,6; 83,9)
| |
Kortikosteroidfreie klinische Remissionc
|
N = 21
14,3 %
|
N = 17
70,6 %
|
N = 20
73,0 %
|
56,3 %**
(30,0; 82,6)
|
58,7 %**
(33,6; 83,9)
| |
Aufrechterhaltung des klinischen Ansprechensd
|
N = 70
14,4 %
|
N = 64
60,9 %
|
N = 65
69,9 %
|
46,6 %**
(32,0; 61,1)
|
55,5 %**
(41,5; 69,6)
| |
Kein Stuhldrang
|
47,5 %
|
59,2 %
|
56,9 %
|
11,7 %
(-4,2; 27,5)
|
9,4%
(-6,4; 25,3)
| |
Keine Bauchschmerzen
|
46,3 %
|
53,5 %
|
50,0 %
|
7,3 %
(-8,7; 23,2)
|
3.7%
(-12,1; 19,6)
| |
Endoskopische und histologische Beurteilung
| |
Aufrechterhaltung der endoskopischen Verbesserunge
|
N = 31
9,7 %
|
N = 24
70,8 %
|
N = 29
60,7 %
|
61,2 %**
(40,2; 82,1)
|
51,0 %**
(30,1; 72,0)
| |
Endoskopische Remissionf
|
2,5 %
|
21,5 %
|
20,3 %
|
19,0 %**
(8,7; 29,3)
|
17,8 %**
(7,5; 28,0)
| |
Histologisch-endoskopische Mukosaverbesserungg
|
5,3 %
|
32,9 %
|
48,2 %
|
27,6 %**
(15,5; 39,8)
|
43,0 %**
(30,1; 55,8)
| |
Endoskopische Verbesserungh
|
7,9 %
|
43,3 %
|
56,9 %
|
35,4 %**
(22,3; 48,5)
|
48,9 %**
(35,6; 62,2)
| |
Mukosaheilungi
|
2,5 %
|
17,2 %
|
16,3 %
|
14,7 %*
(5,2; 24,2)
|
13,8 %*
(4,3; 23,3)
| |
Lebensqualität
| |
Veränderung des FACIT-F-Scores gegenüber Baseline
|
3,2
|
8,2
|
9,8
|
5,0*
(1,51; 8,53)
|
6,6**
(3,06; 10,10)
| |
Veränderung des Gesamtscores auf der IBDQ gegenüber Baseline
|
17,0
|
47,0
|
56,0
|
30,0**
(16,09; 43,90)
|
39,0**
(24,62; 53,30)
| |
* p ≤0.01
** p ≤0,001, Behandlungsunterschied (95 %-KI)
a Gemäss aMS: SFS ≤1 und nicht grösser als bei Baseline, RBS = 0, ES ≤1 ohne Friabilität
b Klinische Remission gemäss aMS in Woche 52 bei Patienten mit klinischer Remission am Ende der Induktionsphase
c Klinische Remission gemäss aMS in Woche 52 und Kortikosteroidfreiheit für ≥90 Tage unmittelbar vor Woche 52 bei Patienten mit klinischer Remission am Ende der Induktionstherapie
d Klinische Remission gemäss aMS in Woche 52 bei Patienten mit klinischer Remission am Ende der Induktionsphase
e Aufrechterhalten der Mukosaheilung, ES ≤1 ohne Friabilität, bei Patienten mit Mukosaheilung in der Induktionsphase
f ES-Subscore = 0
g ES ≤1 ohne Friabilität und Geboes-Score ≤3,1 (weist auf eine Neutrophileninfiltration in < 5 % der Krypten hin, keine Zerstörung der Krypten und keine Erosionen, Ulzerationen oder Granulationsgewebe).
h ES ≤1 ohne Friabilität
i ES = 0, Geboes-Score < 2 (weist darauf hin, dass keine Neutrophile in Krypten oder der Lamina propria vorliegen und die Eosinophilen nicht erhöht sind, keine Zerstörung der Krypten und keine Erosionen, Ulzerationen oder Granulationsgewebe
|
Abbildung 9: Anteil der erwachsenen Patienten mit vorherigem Versagen einer Biologikatherapie, die eine symptomatische Remission gemäss paMS (SFS ≤1 und RBS = 0) erreichten, im Zeitverlauf der Erhaltungsstudie UC-3
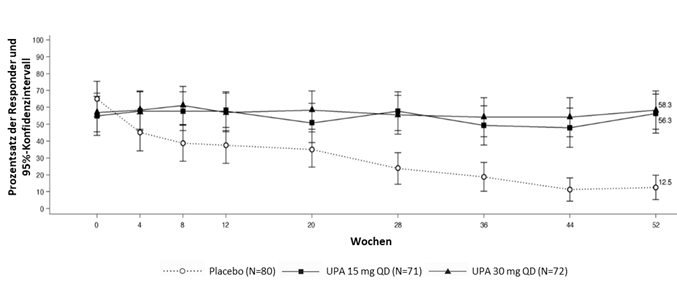
Langzeitstudie (UC-4)
Patienten, welche in UC-3 nach 1 Jahr eine klinische Remission gemäss aMS erreichten, konnten mit der gleichen Dosis in der Fortsetzungsstudie (UC-4) fortfahren. Nach insgesamt 3 Jahren zeigten 77,1 % (27/35) und 87,8 % (36/41) der erwachsenen Patienten mit vorherigem Versagen einer Biologikatherapie weiterhin eine klinische Remission und 60,0 % (9/15) und 68,4 % (13/19) der erwachsenen Patienten mit vorherigem Versagen einer Biologikatherapie weiterhin eine endoskopische Remission mit RINVOQ 15 mg bzw. RINVOQ 30 mg. Auch die Verbesserungen der Lebensqualität blieben über 3 Jahre Therapie erhalten.
Morbus Crohn
Die Wirksamkeit und Sicherheit von RINVOQ wurden in drei multizentrischen, doppelblinden, placebokontrollierten Phase-III-Studien untersucht: zwei Induktionsstudien – CD-1 (U-EXCEED) und CD-2 (U-EXCEL), gefolgt von einer 52wöchigen Erhaltungsstudie mit einer anschliessenden Langzeitstudie CD-3 (U-ENDURE). Die co-primären Endpunkte waren die klinische Remission und das endoskopische Ansprechen in Woche 12 für CD-1 und CD-2 und in Woche 52 für CD-3.
Die in Frage kommenden Patienten waren zwischen 18 und 75 Jahre alt und hatten mittelschweren bis schweren aktiven Morbus Crohn (MC), definiert als eine durchschnittliche tägliche Stuhlfrequenz (SF) mit sehr weichem oder flüssigem Stuhl von ≥4 und/oder einen durchschnittlichen täglichen Score für Bauchschmerzen (BS) von ≥2 und einen von einem zentralen Prüfer bestätigten einfachen endoskopischen Score für MC (Simple Endoscopic Score for CD, SES-CD) von ≥6 bzw. ≥4 bei isolierter Erkrankung des Ileums, abgesehen von einer vorliegenden Verengungskomponente.
Induktionsstudien (CD-1 und CD-2)
In den Studien CD-1 und CD-2 wurden 1'021 Patienten (495 bzw. 526 Patienten) im Verhältnis 2:1 randomisiert und 12 Wochen lang mit RINVOQ 45 mg einmal täglich oder Placebo behandelt.
In CD-1 hatten alle Patienten ein vorheriges Versagen einer Biologikatherapie. Von diesen Patienten hatten 61 % (301/495) ein unzureichendes Ansprechen auf oder eine Unverträglichkeit gegenüber zwei oder mehr Biologikatherapien.
In CD-2 hatten 45 % (239/526) der Patienten ein vorheriges Versagen einer Biologikatherapie, und 55 % (287/526) hatten ein unzureichendes Ansprechen auf oder eine Unverträglichkeit gegenüber einer Behandlung mit konventionellen Therapien, aber nicht mit Biologika (ohne vorheriges Versagen der Biologikatherapie).
Nachfolgend werden nur Studienresultate für Patienten mit vorherigem Versagen einer Biologikatherapie präsentiert. Bei Baseline erhielten in CD-1 und CD-2 34 % bzw. 44 % dieser Patienten Kortikosteroide, 7 % bzw. 3 % Immunmodulatoren und 15 % bzw. 12 % Aminosalicylate.
In beiden Studien begannen die Patienten, die bei Baseline Kortikosteroide erhielten, ab Woche 4 mit einer ausschleichenden Behandlung mit Kortikosteroiden.
Klinische Krankheitsaktivität und Symptome
In CD-1 und CD-2 erreichte in Woche 12 im Vergleich zu Placebo ein signifikant grösserer Anteil an Patienten mit vorherigem Versagen einer Biologikatherapie unter RINVOQ 45 mg den koprimären Endpunkt der klinischen Remission (Tabelle 23). In beiden Studien trat die Wirksamkeit im Vergleich zu Placebo bereits in Woche 2 ein, wobei ein signifikant grösserer Anteil der Patienten, die mit RINVOQ 45 mg einmal täglich behandelt wurden, ein klinisches Ansprechen (CR-100) erreichte. Ein signifikant grösserer Anteil der Patienten erreichte in Woche 4 im Vergleich zu Placebo ein klinisches Ansprechen.
In den Studien CD-1 und CD-2 erreichte ein signifikant grösserer Anteil der mit RINVOQ 45 mg behandelten Patienten mit vorherigem Versagen einer Biologikatherapie (51 % bzw. 59 %) im Vergleich zu Placebo (27 % bzw. 25 %) ein klinisches Ansprechen gemäss CDAI in Woche 12.
In beiden Studien verzeichneten Patienten, die RINVOQ 45 mg erhielten, in Woche 12 im Vergleich zu Placebo eine signifikant grössere Verbesserung der Fatigue gegenüber Baseline, gemessen anhand des FACIT-F-Scores.
Endoskopische Beurteilung
In CD-1 und CD-2 erreichte in Woche 12 im Vergleich zu Placebo ein signifikant grösserer Anteil an Patienten mit vorherigem Versagen einer Biologikatherapie, die mit RINVOQ 45 mg behandelt wurden, den koprimären Endpunkt des endoskopischen Ansprechens (Tabelle 23). In den Studien CD-1 und CD-2 erreichte ein grösserer Anteil der mit RINVOQ 45 mg behandelten Patienten mit vorherigem Versagen einer Biologikatherapie (17 % bzw. 16 %) im Vergleich zu Placebo (0 % bzw. 1 %) eine Mukosaheilung (SES-CD-Teilscore für Ulzerationen auf der Oberfläche von 0 bei Patienten mit SES-CD-Teilscore für Ulzerationen auf der Oberfläche ≥1 bei Baseline) in Woche 12.
In CD-1 und CD-2 erreichte im Vergleich zu Placebo (0 % bzw. 1 %) ein grösserer Anteil an Patienten mit vorherigem Versagen einer Biologikatherapie, die mit RINVOQ 45 mg behandelt wurden (14% bzw. 12 %) einen SES-CD von 0-2.
Tabelle 23: Anteil der Patienten mit vorherigem Versagen einer Biologikatherapie, welche die primären und weiteren Endpunkte zur Wirksamkeit in den Induktionsstudien CD-1 und CD-2 erreichten
|
Studie
|
CD-1
(U-EXCEED)
|
CD-2
(U-EXCEL)
| |
Behandlungsgruppe
|
PBO
N = 171
|
UPA
45 mg
n = 324
|
Behandlungs-unterschied (95 %-KI)
|
PBO
N = 78
|
UPA
45 mg
n = 161
|
Behandlungs-unterschied (95 %-KI)
| |
Koprimäre Endpunkte in Woche 12
| |
Klinische Remissiona
|
14 %
|
40 %
|
26 %
(19, 33)*
|
14 %
|
47 %
|
33 %
(22; 44)*
| |
Endoskopisches Ansprechenb
|
4 %
|
35 %
|
31 %
(25, 37)*
|
9 %
|
38 %
|
29 %
(19, 39)*
| |
Weitere Endpunkte in Woche 12
| |
Klinische Remission gemäss CDAIc
|
21 %
|
39 %
|
18 %
(10, 26)*
|
16 %
|
44 %
|
28 %
(17; 39)*
| |
Kortikosteroidfreie klinische Remissiona,d
|
N=60
7%
|
N=108
37%
|
30%
(19, 41)*
|
N=36
6 %
|
N=70
39 %
|
33 %
(19; 47)*
| |
Endoskopische Remissione
|
2 %
|
19 %
|
17 %
(12, 22)*
|
4 %
|
21 %
|
17 %
(9; 24)*
| |
Abkürzung: PBO = Placebo; UPA = Upadacitinib
* p ≤0,001, UPA im Vergleich zu PBO, Behandlungsunterschied (95 %-KI)
a Durchschnittliche tägliche sehr weiche oder flüssige SF ≤2,8 und BS ≤1,0 und beide nicht grösser als bei Baseline
b Verringerung des SES-CD > 50 % gegenüber Baseline der Induktionsstudie (bzw. bei Patienten mit einem SES-CD von 4 bei Baseline der Induktionsstudie eine Verringerung um mindestens 2 Punkte gegenüber Baseline der Induktionsstudie)
c CDAI < 150
d Absetzen der Steroidbehandlung und Erreichen einer klinischen Remission bei Patienten, die bei Baseline Steroide erhielten
e SES-CD von ≤4 und mindestens 2 Punkte niedriger als bei Baseline und kein Teilscore einer einzelnen Variable > 1
|
Erhaltungsstudie (CD-3)
In die primäre Auswertung zur Wirksamkeit für CD-3 wurden 502 Patienten aufgenommen, die mit einer 12wöchigen Induktionstherapie mit RINVOQ 45 mg einmal täglich ein klinisches Ansprechen gemäss SF/BS (≥30 % Verringerung der durchschnittlichen täglichen SF mit sehr weichem oder flüssigem Stuhl und/oder ≥30 % Verringerung der durchschnittlichen täglichen BS gegenüber Baseline und beide nicht grösser als bei Baseline) erreichten. Die Patienten wurden erneut randomisiert und erhielten über 52 Wochen eine Erhaltungstherapie mit RINVOQ 15 mg oder 30 mg einmal täglich bzw. Placebo; sie kamen somit auf eine Gesamtbehandlungsdauer von mindestens 64 Wochen. Von den erneut randomisierten Responder in der primären Auswertung hatten 377 Patienten ein vorheriges Versagen einer Biologikatherapie. Nachfolgend werden nur Studienresultate für Patienten mit vorherigem Versagen einer Biologikatherapie präsentiert.
Klinische Krankheitsaktivität und Symptome
Ein signifikant grösserer Anteil der Patienten, die mit RINVOQ 15 mg bzw. 30 mg behandelt wurden, erreichte in Woche 52 im Vergleich zu Placebo den koprimären Endpunkt einer klinischen Remission nach SF/BS (Abbildung 10, Tabelle 24).
Abbildung 10: Anteil an Patienten mit vorherigem Versagen einer Biologikatherapie, die eine klinische Remission in der Erhaltungsstudie CD-3 erreichten
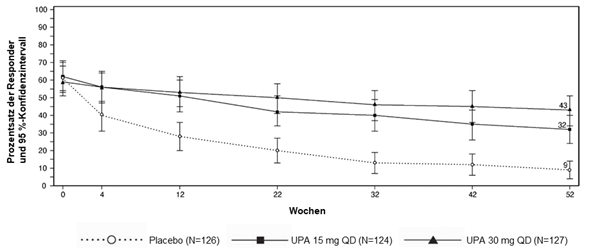
Patienten, die RINVOQ 30 mg erhielten, verzeichneten in Woche 52 im Vergleich zu Placebo eine signifikant grössere Verbesserung der Fatigue gegenüber Baseline, gemessen anhand des FACIT-F-Scores.
Tabelle 24: Anteil der Patienten mit vorherigem Versagen einer Biologikatherapie, welche die primären und weiteren Endpunkte zur Wirksamkeit in Woche 52 in der Erhaltungsstudie CD-3 (U-ENDURE) erreichten
|
Behandlungsgruppe
|
PBO+
N = 126
|
UPA
15 mg
n = 124
|
UPA
30 mg
n = 127
|
Behandlungsunterschied 15 mg vs. PBO (95 %-KI)
|
Behandlungsunterschied 30 mg vs. PBO (95 %-KI)
| |
Koprimäre Endpunkte
| |
Klinische Remissiona
|
9 %
|
32 %
|
43 %
|
24 %
(14; 33)**
|
34 %
(24; 44)**
| |
Endoskopisches Ansprechenb
|
4 %
|
23 %
|
39 %
|
19 %
(11; 27)**
|
35%
(26; 44)**
| |
Weitere Endpunkte
| |
Klinische Remission gemäss CDAIc
|
12 %
|
34 %
|
45 %
|
22 %
(12; 32)**
|
33 %
(23; 43)**
| |
Kortikosteroidfreie klinische Remissiona,d
|
9 %
|
32 %
|
41 %
|
24 %
(14; 33)**
|
32 %
(22; 42)**
| |
Aufrechterhaltung der klinischen Remissiona,e
|
N=77
13 %
|
N=77
44 %
|
N=75
60 %
|
31 %
(18; 45)**
|
47 %
(34; 60)**
| |
Endoskopische Remissionf
|
2 %
|
16 %
|
27 %
|
14 %
(7; 21)**
|
24 %
(16; 33)**
| |
Tiefe Remissiona,f,g
|
2 %
|
13 %
|
21 %
|
11 %
(4; 17)*
|
19 %
(11; 26)**
| |
Abkürzung: PBO = Placebo; UPA = Upadacitinib
+ Der Placeboarm bestand aus Patienten, die mit RINVOQ 45 mg am Ende der Induktionsstudie ein klinisches Ansprechen gemäss SF/BS erreicht hatten. Sie wurden zu Beginn der Erhaltungstherapie zu Placebo randomisiert.
* p ≤0,01, UPA im Vergleich zu PBO, angepasster Behandlungsunterschied (95 %-KI)
** p ≤0,001, UPA im Vergleich zu PBO, angepasster Behandlungsunterschied (95 %-KI)
a Durchschnittliche tägliche sehr weiche oder flüssige SF ≤2,8 und BS ≤1,0 und beide nicht grösser als bei Baseline
b Verringerung des SES-CD > 50 % gegenüber Baseline der Induktionsstudie (bzw. bei Patienten mit einem SES-CD von 4 bei Baseline der Induktionsstudie eine Verringerung um mindestens 2 Punkte gegenüber Baseline der Induktionsstudie)
c CDAI < 150
d Kortikosteroidfrei für 90 Tage vor Woche 52 und Erreichen einer klinischen Remission. In der Untergruppe von Patienten, die bei Baseline der Induktionsstudie mit Kortikosteroiden behandelt wurden, waren 35 % (N = 46) im Behandlungsarm mit RINVOQ 15 mg, 40 % (N = 50) im Behandlungsarm mit RINVOQ 30 mg und 2 % (N = 50) im Placeboarm für 90 Tage vor Woche 52 kortikosteroidfrei und in klinischer Remission.
e Definiert als Erreichen einer klinischen Remission in Woche 52 bei Patienten mit klinischer Remission zu Beginn der Erhaltungsstudie.
f SES-CD ≤4 und mindestens 2 Punkte niedriger als bei Baseline und kein Teilscore einer einzelnen Variable > 1
g Klinische Remission und endoskopische Remission
|
Patienten, die in Woche 12 der Induktionsphase mit RINVOQ in CD-1 und CD-2 nicht in klinischer Remission gemäss SF/BS waren, erhielten weitere 12 Wochen RINVOQ 30 mg einmal täglich (122 Patienten). Patienten, welche die verlängerte Behandlung erhielten, hatten eine längere durchschnittliche Krankheitsdauer (12,3 Jahre), einen höheren Anteil von vorherigem Biologika-Versagen (79,5 %) und häufiger ein Versagen von mindestens drei Biologika-Therapien (42,3 %) als die gesamte Patientenpopulation, welche in den Induktionsstudien eingeschlossen wurde. Von den Patienten mit vorherigem Versagen einer Biologikatherapie (97 Patienten) erreichten 23 % eine klinische Remission und 54 % ein klinisches Ansprechen in Woche 24. Von den Patienten, die auf die erweiterte Behandlungsphase ansprachen und weiterhin eine Erhaltungstherapie mit RINVOQ 30 mg erhielten, erreichten in Woche 52 18 % eine klinische Remission und 15 % eine endoskopische Remission.
Endoskopische Beurteilungen
Von den Patienten mit vorherigem Versagen einer Biologikatherapie in CD-3 erreichte in Woche 52 im Vergleich zu Placebo ein signifikant grösserer Anteil an Patienten, die mit RINVOQ 15 mg bzw. 30 mg behandelt wurden, den koprimären Endpunkt des endoskopischen Ansprechens (Tabelle 24). Ein grösserer Anteil der Patienten, die mit RINVOQ 15 mg und 30 mg (12 % bzw. 20 %) behandelt wurden, erreichte im Vergleich zu Placebo (2 %) eine Mukosaheilung (SES-CD-Teilscore für Ulzerationen auf der Oberfläche von 0 bei Patienten mit einem SES-CD-Teilscore für Ulzerationen auf der Oberfläche von ≥1 bei Baseline) in Woche 52. Ein grösserer Anteil der Patienten, die mit RINVOQ 15 mg und 30 mg (11 % bzw. 18 %) behandelt wurden, erreichte im Vergleich zu Placebo (2 %) in Woche 52 einen SES-CD von 0-2. Eine kortikosteroidfreie endoskopische Remission von Patienten, die bei Baseline Steroide erhielten, wurde in Woche 52 im Vergleich zu Placebo (0 %) von einem grösseren Anteil an Patienten erreicht, die mit RINVOQ 15 mg bzw. 30 mg (15 % bzw. 24 %) behandelt wurden.
Notfallbehandlung
In CD-3 kamen Patienten mit unzureichendem Ansprechen oder einem Verlust des Ansprechens in der Erhaltungsphase für eine Notfallbehandlung mit RINVOQ 30 mg infrage. Von den Patienten mit vorherigem Versagen einer Biologikatherapie, die in den Behandlungsarm mit RINVOQ 15 mg randomisiert worden waren und eine Notfallbehandlung mit RINVOQ 30 mg erhielten, erreichten 12 bzw. 24 Wochen nach Einleitung der Notfallbehandlung 83 % bzw. 88 % ein klinisches Ansprechen gemäss SF/BS und 42 % bzw. 55 % eine klinische Remission. Von den Patienten, die in den Placeboarm randomisiert worden waren und eine Notfallbehandlung mit RINVOQ 30 mg erhielten, erreichten 12 bzw. 24 Wochen nach Einleitung der Notfallbehandlung 87 % bzw. 93 % ein klinisches Ansprechen gemäss SF/BS und 52 % bzw. 55 % eine klinische Remission.
Gesundheitsbezogene Ergebnisse und Lebensqualität
In CD-1 und CD-2 erreichten die mit RINVOQ behandelten Patienten in Woche 12 im Vergleich zu Placebo eine grössere Verbesserung gegenüber Baseline beim IBDQ-Gesamtscore, in allen IBDQ-Bereichsscores, u.a. Darmsymptome, systemische Symptome, emotionale und soziale Funktionsfähigkeit. Diese Verbesserungen wurden bei Patienten, die mit RINVOQ 15 mg und 30 mg behandelt wurden in CD-3 bis Woche 52 aufrechterhalten.
PharmakokinetikDie Plasmaexposition von Upadacitinib ist im gesamten therapeutischen Dosisbereich proportional zur Dosis. Innerhalb von 4 Tagen wurden Steady-State-Konzentrationen im Plasma erreicht, wobei es nach mehrfacher Verabreichung einmal täglich zu einer minimalen Akkumulation kam.
Absorption
Nach oraler Verabreichung der Upadacitinib Retard Formulierung wird Upadacitinib mit einer median Tmax von 2 bis 4 Stunden absorbiert. Die gleichzeitige Einnahme von Upadacitinib mit einer fettreichen Mahlzeit hatte keinen klinisch relevanten Einfluss auf die Upadacitinib Exposition (AUCinf wurde um 29 % erhöht und Cmax um 39 % bis 60 %). In klinischen Studien wurde RINVOQ unabhängig von Mahlzeiten verabreicht (siehe «Dosierung/Anwendung»).
Distribution
Upadacitinib ist zu 52 % an Plasma Proteine gebunden. Das Blut-zu-Plasma Verhältnis von Upadacitinib ist 1,0. Dies zeigt, dass der Wirkstoff sich gleichmässig zwischen Plasma und Blutzellkomponenten verteilt.
Metabolismus
Upadacitinib wird durch CYP3A4 metabolisiert mit möglicher geringfügiger Beteiligung von CYP2D6. Die pharmakologische Aktivität von Upadacitinib wird dem unveränderten Wirkstoff zugeschrieben. In einer Studie mit radioaktiven Markern in Menschen wurde 79 % der Gesamtradioaktivität im Plasma Upadacitinib zugeschrieben während 13 % bzw. 7,1 % den zwei entdeckten Hauptmetaboliten (Produkte der Monooxidation gefolgt von Glukuronidierung oder Produkte der Monooxidation gefolgt von einer Ringöffnung) zugeschrieben wurde. Für Upadacitinib wurden keine aktiven Metabolite identifiziert.
Elimination
Nach einer einzelnen Verabreichung von 14C-markierter Upadacitinib sofort freisetzender Lösung, wurde Upadacitinib hauptsächlich als unveränderter Wirkstoff im Urin (24 %) und im Fäzes (38 %) eliminiert. Ungefähr 34 % der Upadacitinib Dosis wurde als Metaboliten eliminiert. Die mittlere terminale Eliminations-Halbwertszeit lag zwischen 9 bis 14 Stunden.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Die AUC von Upadacitinib war bei Probanden mit leichter (Child-Pugh A) und mittelschwerer Leberfunktionsstörung (Child-Pugh B) im Vergleich zu Probanden mit normaler Leberfunktion um 28 % bzw. 24 % höher. Die Cmax von Upadacitinib war im Vergleich zu Probanden mit normaler Leberfunktion bei Probanden mit leichter Leberfunktionsstörung unverändert und bei Probanden mit mittelschwerer Leberfunktionsstörung um 43 % höher. Upadacitinib wurde bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh C) nicht untersucht (siehe «Dosierung/Anwendung»).
Nierenfunktionsstörungen
Die AUC von Upadacitinib war im Vergleich zu Probanden mit normaler Nierenfunktion bei Probanden mit leichter Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate 60 bis 89 ml/min/1.73 m2) um 18 %, mit mittelschwerer Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate 30 bis 59 ml/min/1.73 m2) um 33 % und mit schwerer Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate 15 bis 29 ml/min/1.73 m2) um 44 % höher. Die Cmax von Upadacitinib war bei Probanden mit normaler und beeinträchtigter Nierenfunktion vergleichbar. Upadacitinib wurde bei Probanden mit einer Nierenfunktionsstörung im Endstadium (geschätzte glomeruläre Filtrationsrate <15 ml/min/1.73 m2) oder bei Probanden unter Dialyse nicht untersucht (siehe «Dosierung/Anwendung»).
Andere intrinsische Faktoren
Geschlecht, Körpergewicht, Rasse, Alter und ethnische Zugehörigkeit hatten keine klinisch bedeutungsvolle Auswirkung auf die Exposition mit Upadacitinib.
Die Upadacitinib-Pharmakokinetik ist bei Patienten mit rheumatoider Arthritis, Psoriasis-Arthritis, ankylosierender Spondylitis, Riesenzellarteriitis, atopischer Dermatitis, Colitis ulcerosa und Morbus Crohn gleichbleibend.
Präklinische DatenToxizität bei wiederholter Gabe
In nicht-klinischen Studien bei Tieren wurden bei Ratten und Hunden in klinisch relevanten Dosen ein Rückgang zirkulierender Lymphozyten und eine verminderte Zellularität von Lymphgewebe sowie eine Suppression der Erythropoese beobachtet. Sekundäre Effekte im Zusammenhang mit opportunistischen Infektionen, wie Demodikose (Räude) bei Hunden, wurden bei Expositionen verzeichnet, die etwa zweimal höher als die erwartete Exposition (AUC) nach Verabreichung einer klinischen Dosis von 15 mg waren, sowie bei ähnlichen Expositionen zur erwarteten Exposition bei der Dosis von 30 mg und bei Expositionen, die dem 0,9-Fachen der erwarteten Exposition bei einer klinischen Dosis von 45 mg entsprachen.
Genotoxizität
Upadacitinib war auf Grundlage der Ergebnisse der in vitro und in vivo Tests für Genmutationen und Chromosomenaberrationen weder mutagen noch genotoxisch.
Karzinogenität
Bei Expositionsspiegeln, die etwa 4- und 10mal höher als die klinische Dosis von 15 mg (auf AUC-Basis bei oraler Verabreichung an männliche und weibliche Ratten von 15 bzw. 20 mg/kg/Tag), 2- und 5-mal höher als die klinische Dosis von 30 mg und 1,7- und 4-mal höher als die klinische Dosis von 45 mg waren, war Upadacitinib nicht karzinogen. Dieses Ergebnis basiert auf einer 2jährigen Karzinogenitätsstudie bei Sprague-Dawley-Ratten. Upadacitinib war in einer 26wöchigen Karzinogenitätsstudie bei transgenen CByB6F1-Tg(HRAS)2Jic-Mäusen nicht karzinogen.
Reproduktionstoxizität
Upadacitinib ist teratogen in Ratten und Kaninchen, wenn es in Expositionen angewendet wird, die dem 1.6-Fachen (bei Ratten) bzw. dem 15-Fachen (bei Kaninchen) der klinischen Dosis von 15 mg, dem 0,8-Fachen (bei Ratten) bzw. dem 7.6-Fachen (bei Kaninchen) der klinischen Dosis von 30 mg und dem 0,6- bzw. 6-Fachen der klinischen Dosis von 45 mg entsprechen (auf Basis der AUC bei oralen Dosen der Muttertiere von 4 bzw. 25 mg/kg/Tag). Bei Ratten umfassten die Wirkungen eine Zunahme von zwei bestimmten skelettalen Fehlbildungen (deformierter Oberarmknochen und gebogenes Schulterblatt) und von gebogenen Knochen der vorderen und hinteren Gliedmassen. Entwicklungsbezogene Wirkungen bei Kaninchen umfassten eine Zunahme der Postimplantationsverluste, eine erhöhte Frühresorption und Resorption insgesamt, ein geringeres Körpergewicht des Fötus und eine erhöhte Inzidenz von Missbildungen des Herzens. In einer prä-/postnatalen Entwicklungsstudie in Ratten zeigte Upadacitinib keinen maternalen Effekt, keinen Einfluss auf die Geburt, Laktation oder auf die maternale Verhaltensweise. Es war auch kein Einfluss beim Nachwuchs sichtbar.
Upadacitinib hatte in einer Studie zur Fertilität und frühen embryonalen Entwicklung nach Verabreichung von bis zu 50 mg/kg/Tag an männliche Ratten und nach Verabreichung von bis zu 75 mg/kg/Tag an weibliche Ratten keinen Einfluss auf die Fertilität von männlichen oder weiblichen Ratten. Dosisabhängige Anstiege der fötalen Resorption im Zusammenhang mit Postimplantationsverlusten bei 25 und 75 mg/kg/Tag in dieser Studie wurden auf die entwicklungstoxischen/teratogenen Wirkungen von Upadacitinib bei Ratten zurückgeführt.
Nach Verabreichung von Upadacitinib an laktierende Ratten entsprach die Konzentration von Upadacitinib in der Milch im Zeitverlauf in der Regel jener im Plasma, wobei die Exposition in der Milch im Verhältnis zum mütterlichen Plasma etwa um ein 30-Faches höher war. Bei etwa 97 % des Substanzmaterials in der Milch handelte es sich um die Muttersubstanz.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 25°C lagern.
Im Originalblister aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer67257 (Swissmedic)
PackungenRINVOQ 15 mg: Blisterpackung mit 28 Retardtabletten (B)
RINVOQ 30 mg: Blisterpackung mit 28 Retardtabletten (B)
RINVOQ 45 mg: Blisterpackung mit 28 Retardtabletten (B)
ZulassungsinhaberinAbbVie AG, 6330 Cham.
Stand der InformationAugust 2025
|












