Eigenschaften/WirkungenATC-Code
L01EX22
Wirkungsmechanismus
Selpercatinib aus der Gruppe der kleinen Moleküle ist ein Inhibitor der RET (Rearranged during transfection)-Rezeptor-Tyrosinkinase. Selpercatinib hemmte den RET-Wildtyp und mehrere mutierte RET-Isoformen, sowie VEGFR1 und VEGFR3 mit IC50-Werten im Bereich von 0.92 nM bis 67.8 nM. In anderen Enzymtests hemmte Selpercatinib ausserdem bei höheren, klinisch noch erreichbaren Konzentrationen FGFR 1, 2 und 3. Selpercatinib war 250-fach selektiver für RET als für 98% von ~300 Kinasen, einschliesslich VEGFR2, dies wurde in präklinischen Studien untersucht. In Zelltests hemmte Selpercatinib RET bei einer etwa 60-fach niedrigeren Konzentrationen als FGFR1 und 2 und bei etwa 8-fach niedrigeren Konzentrationen als VEGFR3.
Bestimmte Punktmutationen der RET oder chromosomale Neuanordnungen mit In-frame-Fusionen der RET mit verschiedenen Partnern können zu konstitutiv aktivierten, chimeren RET Fusionsproteinen führen, die als onkogene Treiber fungieren können, indem sie die Zellproliferation von Tumorzelllinien fördern. In Tumormodellen zeigte Selpercatinib in vitro und in vivo antitumorale Aktivität in Zellen, die infolge von Genfusionen und Genmutation einschliesslich CCDC6 RET, KIF5B RET, RET V804M und RET M918T eine konstitutive Aktivierung des RET-Protein erworben haben. Darüber hinaus zeigte Selpercatinib antitumorale Aktivität bei Mäusen mit intrakranialer Implantation eines von Patienten stammenden RET-fusionspositiven Tumors.
Pharmakodynamik
Kardiale Elektrophysiologie
In einer eingehenden QT-Studie mit positiver Kontrolle bei 32 gesunden Probanden zeigte eine Expositions-Response-Analyse, dass supra-therapeutische Konzentrationen zu einem Anstieg des QTc >20 ms führen könnten.
Verlängerungen des QT-Intervalls wurden bei Patienten unter Selpercatinib berichtet. Daher können bei Patienten Unterbrechungen der Behandlung oder Dosisanpassungen erforderlich sein (siehe «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Klinische Wirksamkeit
Die Wirksamkeit von Retsevmo wurde bei erwachsenen Patienten mit fortgeschrittenem RET-fusionspositivem NSCLC sowie bei Patienten mit RET-mutiertem MTC und RET-fusionspositivem Schilddrüsenkarzinom mit oder ohne vorausgegangene Standard-Erstlinientherapie untersucht, die in die multizentrische, offene, einarmige klinische Studie der Phase 1/2 LIBRETTO-001 aufgenommen worden waren.
Patienten in den Phase 1- und Phase 2-Abschnitten wiesen einen Progress unter Standardtherapie auf, vertrugen die Standardtherapie nicht, oder es gab keine Standardtherapie.
Patienten mit ZNS-Metastasen waren einschlussfähig, sofern sie stabil waren, während Patienten mit symptomatischen primären ZNS-Tumoren, Metastasen, leptomeningealer Karzinomatose oder Rückenmarkkompression ausgeschlossen wurden. Patienten mit bekannter primärer Treiberveränderung ausser RET, klinisch signifikanter aktiver Herz-Kreislauf-Erkrankung oder Herzinfarkt in der Anamnese, QTcF-Intervall > 470 ms wurden ausgeschlossen.
Im Phase-2-Abschnitt der Studie erhielten die Patienten Retsevmo 160 mg oral zweimal täglich bis zum Auftreten einer nicht-akzeptablen Toxizität oder bis zur Progression. Das Vorhandensein einer RET-Gen-Veränderung wurde prospektiv in lokalen Laboratorien mithilfe von Next Generation Sequencing (NGS), Polymerase-Kettenreaktion (PCR) oder Fluorescence In Situ Hybridization (FISH) bestimmt. Die wichtigen Wirksamkeitsendpunkte waren die Gesamtansprechrate (overall response rate, ORR) und die Ansprechdauer (duration of response, DOR), die durch ein verblindetes unabhängiges Komitee (blinded independent review committee, BIRC) auf Basis von RECIST v1.1 bestimmt wurden.
Therapienaives RET-fusionspositives nicht-kleinzelliges Lungenkarzinom
LIBRETTO-431
Die Wirksamkeit von Retsevmo bei RETfusionspositivem NSCLC wurde in der Studie LIBRETTO-431 untersucht, eine multizentrische, randomisierte, offene Phase 3 Studie zum Vergleich von Selpercatinib zu platinbasierter Pemetrexed-Therapie, mit oder ohne Pembrolizumab, bei Patienten mit fortgeschrittenem oder metastasiertem, RET-fusionspositivem NSCLC. Eingeschlossen wurden erwachsene Patienten mit histologisch bestätigtem, nicht-resezierbarem, lokal fortgeschrittenem oder metastasiertem NSCLC ohne vorherige systemische Therapie der metastasierten Erkrankung. Patienten mit adjuvanter oder neoadjuvanter Therapie wurden ebenfalls eingeschlossen, wenn die letzte Gabe der systemischen Behandlung mindestens 6 Monate vor der Randomisierung abgeschlossen war. Patienten mit plattenepithelialer Histologie und Patienten mit kardiovaskulärer Erkrankung, Myokardinfarkt in den letzten 6 Monaten, QTc-Intervall >470 ms oder einer Begleitmedikation, von der bekannt ist, dass sie QTc-Verlängerung verursacht, wurden ausgeschlossen. Die Patienten erhielten 160 mg Selpercatinib zweimal täglich (Anfangsdosis) oder eine platinbasierte Therapie und Pemetrexed, mit oder ohne Pembrolizumab. Die Feststellung einer RET-Genveränderung erfolgte prospektiv unter Verwendung von NGS (Next-Generation Sequencing) oder PCR (Polymerase-Kettenreaktion). Die Patienten wurden stratifiziert nach geographischer Region (Ostasien vs. andere), Status hinsichtlich der durch den Prüfarzt bewerteten ZNS-Metastasierung zu Studienbeginn (fehlend oder unbekannt vs. vorhanden), und ob der Prüfarzt (vor der Randomisierung) eine Behandlung des Patienten mit oder ohne Pembrolizumab beabsichtigt hatte.
Der primäre Endpunkt war das progressionsfreie Überleben (progression-free survival, PFS) auf Basis von RECIST 1.1 durch ein verblindetes unabhängiges Komitee (blinded, independent review committee, BICR). Das PFS wurde sequentiell zuerst in der Population derjenigen Patienten ermittelt, bei welchen der Prüfarzt die Anwendung von Pembrolizumab beabsichtigt hatte (ITT-Pembrolizumab), wenn sie in die Kontrollgruppe randomisiert wurden, und dann in der gesamten ITT-Population. Zu den fehlerkontrollierten sekundären Wirksamkeitsendpunkten gehörte das Gesamtüberleben (overall survival, OS).
Das mediane Alter der Patienten in der ITT-Population betrug 62.5 Jahre (Bereich 31 bis 87 Jahre). 54.8% der Patienten waren Frauen. 40.2% der Patienten waren weisser, 57.4% asiatischer, 0.8% schwarzer Abstammung. 67.4% hatten nie geraucht. In der ITT-Population wiesen 93.5% eine metastasierte Erkrankung auf, 19.5% der Patienten hatten ZNS-Metastasen zu Studienbeginn. Der berichtete ECOG-Performance-Status betrug 0-1 (96.9%) oder 2 (3.1%). Die häufigsten Fusionspartner waren KIF5B (46.0%), gefolgt von CCDC6 (9.6%).
Von den 261 Patienten, die in die Intention-to-treat (ITT)-Population der LIBRETTO-431-Studie eingeschlossen und randomisiert wurden, wurden 212 in die ITT-Pembrolizumab-Population stratifiziert. In der ITT-Pembrolizumab-Population erhielten 129 Patienten Selpercatinib, während 83 eine platinbasierte Pemetrexed-Chemotherapie mit Pembrolizumab erhielten.
Das mediane Alter der Patienten in der ITT-Pembrolizumab-Population betrug 61.5 Jahre (Bereich 31 bis 84 Jahre). 53.3% der Patienten waren Frauen. 41.3% der Patienten waren weisser, 56.3% asiatischer und 1% schwarzer Abstammung. 67.9% haben nie geraucht. In der ITT-Pembrolizumab-Population hatten 93% eine metastasierte Erkrankung, 20.3% der Patienten hatten ZNS-Metastasen zu Studienbeginn. Der berichtete ECOG-Performance-Status betrug 0-1 (96.7%) oder 2 (3.3%). Der häufigste Fusionspartner war KIF5B (44.8%), gefolgt von CCDC6 (9.9%). Die Studie erreichte die primären Endpunkte einer Verbesserung des PFS in der ITT-Pembrolizumab-Population und in der ITT-Population.
Zum Zeitpunkt der zuvor geplanten Wirksamkeitszwischenauswertung (Stand Mai 2023) in der ITT-Population betrug das mediane progressionsfreie Überleben 24.84 Monate (95% Konfidenzintervall [CI]: 17.31, nicht schätzbar [NE]) mit Selpercatinib und 11.17 Monate (95% CI: 8.77, 16.76) im Kontrollarm, bei einer Hazard-Ratio (HR) für Progress oder Tod, 0.482 (95% CI: 0.331, 0.700; p=0.0001).
Zum Zeitpunkt einer zuvor geplanten Wirksamkeitszwischenauswertung (Stand Mai 2023) in der ITT-Pembrolizumab-Population betrug das mediane progressionsfreie Überleben 24.84 Monate (95% Konfidenzintervall [CI], 16.89 bis NE) mit Selpercatinib und 11.17 Monate (95% CI, 8.77 bis 16.76) mit Kontrollbehandlung (Hazard-Ratio für Progress oder Tod, 0.465; 95% CI, 0.309 bis 0.699; P=0.0002).
Das OS war zum Zeitpunkt der primären PFS-Analyse nicht reif. Zum Zeitpunkt einer interim deskriptiven Zwischenanalyse des OS (01 May 2024) (43 % der vorab festgelegten OS-Ereignisse, die für die endgültige Analyse erforderlich sind) wurden in der ITT-Population 75 Ereignisse in beiden Armen beobachtet (49 (31% der ITT ) im Selpercatinib-Arm und 26 (25%) im Kontrollarm) und die HR betrug 1.259 ([95 % KI: 0.777-2.040]).
Abbildung 1. LIBRETTO-431: Kaplan-Meier-Diagramm des OS (BICR-Bewertung, ITT-Population)
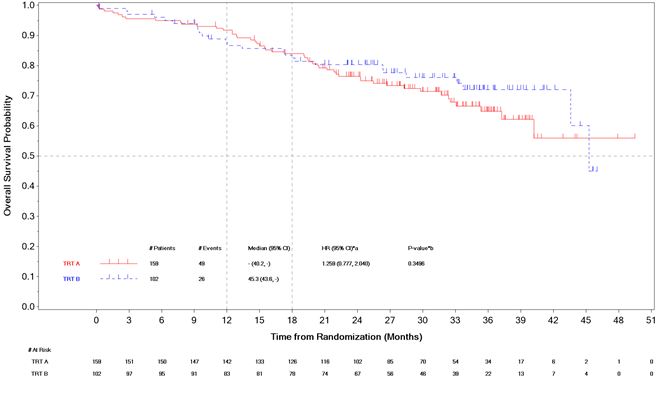
Abbreviations: CI = confidence interval; HR = hazard ratio; TRT A = Selpercatinib; TRT B = Carboplatin or Cisplatin+Pemetrexed+/-Pembrolizumab.
*a HR - IWRS stratified hazard ratio from Cox proportional hazard model and 95% CI of TRT A versus TRT B.
*b Log-rank IWRS stratified p-value(2-sided) for comparison of TRT A versus TRT B
Cut-off datum: 01 Mai 2024.
Von 68 Patienten im Kontrollarm, bei denen die Krankheit fortschritt, erhielten 50 Patienten (74 %) Selpercatinib bei der Progression. Von den 71 Patienten im Selpercatinib-Arm, bei denen es zu einem Fortschreiten der Krankheit kam, erhielten 16 (23 %) eine Chemotherapie und/oder eine Therapie mit Immuncheckpoint-Inhibitoren und 44 (62 %) setzten die Behandlung mit Selpercatinib fort.
Vorbehandeltes RET-fusionspositives nicht-kleinzelliges Lungenkarzinom
Insgesamt hatten 247 Patienten mit RET-Fusions-positivem NSCLC, welche in der LIBRETTO-001 eingeschlossen wurden, zuvor eine Platin-basierte Chemotherapie erhalten. Das mediane Alter lag bei 61 Jahren (Bereich 23 bis 81 Jahre). 56.7% der Patienten waren weiblich. 43.7% der Patienten waren Weisse, 47.8% waren Asiaten, 4.9% waren Schwarz und 66.8% waren Nie-Raucher. Die meisten Patienten (98.8%) hatten bei Studieneinschluss eine metastasierte Erkrankung, und 31.2% hatten nach Aussage des Prüfarztes bei Baseline ZNS-Metastasen. Der ECOG-Performance-Status wurde mit 0-1 (97.1%) oder 2 (2.8 %) angegeben. Der häufigste Fusionspartner war KIF5B (61.9%), gefolgt von CCDC6 (21.5%) und dann NCOA4 (2.0%). Zwei Patienten hatten ein lokal fortgeschrittenes NSCLC, ein Patient hatte ein plattenepitheliales NSCLC. Die mediane Anzahl vorangegangener systemischer Therapien lag bei 2 (Bereich 1 bis 15), und 43.3% (n=107/247) hatten 3 oder mehr systemische Behandlungen erhalten. Zu den vorausgegangenen Behandlungen gehörten eine Anti-PD1/PDL1-Therapie (58.3%), Multikinase-Inhibitoren (MKI) (31.6%) und Taxane (34.8%); 41.3% hatten eine andere systemische Therapie.
Zum Stichtag 13. Januar 2023 in der für die Wirksamkeit geeigneten Patientenpopulation (Patienten, die zuvor eine Platin-basierten Chemotherapie erhalten und mindestens 6 Monate Beobachtung in der LIBRETTO-001 Studie abgeschlossen hatten, n=247) betrug die objektive Ansprechrate (objective response rate, ORR) 61.5% (95% CI: 55.2, 67.6) und die mediane Ansprechdauer 31.6 Monate (95% CI: 20.4, 42.3) bei einer medianen Beobachtungszeit von 39.52 Monaten.
Vandetanib- und Cabozantinib-naive Patienten mit RET-mutiertem medullärem Schilddrüsenkarzinom
LIBRETTO-531
Die Wirksamkeit von Retsevmo bei RET-mutiertem MTC wurde in der LIBRETTO-531 untersucht, eine multizentrische, randomisierte, offene Vergleichsstudie Phase 3 zum Vergleich von Selpercatinib mit Cabozantinib oder Vandetanib nach Entscheidung des Prüfarztes, bei Patienten mit progressivem, fortgeschrittenem, Kinase-Inhibitor-naivem, RET-mutiertem MTC. Eingeschlossen wurden erwachsene oder jugendliche Patienten mit histologisch bestätigtem, nicht-resezierbarem, lokal fortgeschrittenem oder metastasiertem MTC ohne vorausgegangene Behandlung mit einem Kinase-Inhibitor.
Patienten mussten zum Screening eine radiologisch progressive Erkrankung nach RECIST 1.1 aufweisen, im Vergleich zu einem Bild, das in den letzten 14 Monaten aufgenommen wurde. Patienten mit kardiovaskulärer Erkrankung, Myokardinfarkt in den letzten 6 Monaten, QTc-Intervall >470 ms oder einer Begleitmedikation, von der bekannt ist, dass sie QTc-Verlängerung verursacht, wurden ausgeschlossen. Die Patienten erhielten 160 mg Selpercatinib zweimal täglich (Anfangsdosis) oder nach Wahl des Prüfarztes Cabozantinib (140 mg einmal täglich) oder Vandetanib (300 mg einmal täglich). Die RET-Genveränderung wurde prospektiv unter Verwendung von NGS (Next-Generation Sequencing) oder PCR (Polymerase-Kettenreaktion) ermittelt. Die Patienten wurden stratifiziert nach RET-Mutation (M918T vs. andere) und beabsichtigter Behandlung, bei Randomisierung in den Kontrollarm (Cabozantinib vs. Vandetanib). Primärer Wirksamkeitsendpunkt war das PFS nach RECIST 1.1 durch BIRC. Wesentliche sekundäre Wirksamkeitsendpunkte umfassten das therapieversagenfreie Überleben (treatment-failure-free survival, TFFS) und die Verträglichkeit im Vergleich. Zu den anderen sekundären Wirksamkeitsendpunkten gehörte das OS.
Von den 291 Patienten der Intention-to-treat (ITT)-Population, die in die LIBRETTO-531-Studie eingeschlossen und randomisiert wurden, wurden 193 in den Arm Selpercatinib randomisiert, 98 in den Kontrollarm. Von den 98 in den Kontrollarm randomisierten Patienten wurden 73 für Cabozantinib stratifiziert, und 25 für Vandetanib. Das mediane Alter der Patienten in der ITT-Population betrug 55 Jahre (Bereich: 12 bis 84 Jahre). 37.1% der Patienten waren Frauen. 69.4% der Patienten waren weisser, 27.7% asiatischer und 2.9% schwarzer Abstammung.
Bei Studieneinschluss hatten die meisten Patienten (77%) eine metastasierte Erkrankung. 8.2 % der Patienten befanden sich im Stadium M0 (d.h. keine Fernmetastasen zum Zeitpunkt der Studienaufnahme).
Der ECOG-Performance-Status betrug 0-1 (98.3%) oder 2 (1%). Die häufigste Mutation war M918T (62.5%).
Die Studie erreichte den primären Endpunkt einer Verbesserung des PFS in der ITT-Population (cut off Datum 22 May 2023).
Bei einer medianen Beobachtungszeit von 12 Monaten war das mediane progressionsfreie Überleben mit Selpercatinib auf Basis des verblindeten, unabhängigen, zentralen Reviews nicht erreicht, und betrug 16.8 Monate (95% Konfidenzintervall [CI], 12.22 bis 25.10) in der Kontrollgruppe (Hazard-Ratio für Erkrankungsprogression oder Tod, 0.280; 95% CI, 0.165 bis 0.475; P<0.0001).
Die mediane Dauer des therapieversagenfreien Überlebens (TFFS) mit Selpercatinib war noch nicht erreicht, und betrug 13.9 Monate in der Kontrollgruppe (27 Ereignisse im Selpercatinib-Arm, 37 Ereignisse im Kontrollarm, (HR 0.254; 95% CI: 0.153, 0.423; p<0.0001)).
Bei einer späteren OS-Auswertung mit Stichtag 11. März 2024 waren in den zwei Armen 26 Ereignisse beobachtet worden, 10 mit Selpercatinib und 16 im Kontrollarm. und die HR betrug 0.275 (95% CI: 0.124, 0.608). Die PFS HR in dieser Auswertung betrug 0.202 (95% CI: 0.128, 0.320).
Wirksamkeit bei pädiatrischen Patienten
Die Evidenz für die Wirksamkeit und Sicherheit von Selpercatinib in der jugendlichen Population ist limitiert. Nur ein Patient unter 18 Jahren wurde in LIBRETTO-531 mit einem therapienaiven MTC eingeschlossen und es liegen insgesamt Resultate von 3 Patienten aus der LIBRETTO-001 vor, von denen 2 mit therapienaiven MTC. Weiter sind Resultate von insgesamt 14 pädiatrischen Patienten mit MTC aus der Phase-1/2-studie LIBRETTO-121 eingeschlossen. Die ORR für Patienten mit MTC in LIBRETTO-121 betrug 42.9% (95% KI: 17,7%-71.1%) in der RET-mutierten MTC-Population (n=14) und 60% (95% CI 26.2, 87.8) in der RET-Fusions-positiven Schilddrüsenkrebspopulation (n=10), verglichen mit der ORR bei Erwachsenen (77.5% bei RET-mutierten MTC-Patienten (n=117) und 89.2% bei RET-fusionspositiven Schilddrüsenkrebspatienten (n=58)).
Vorbehandeltes RET-fusionspositives Schilddrüsenkarzinom
Von den Patienten mit RETfusionspositivem Schilddrüsenkarzinom, die zuvor mit einer anderen systemischen Therapie als radioaktivem Iod behandelt worden waren und in die LIBRETTO-001 Studie eingeschlossen wurden, konnten (am Stichtag 13. Januar 2023) 41 Patienten über mindestens 6 Monate beobachtet werden und die Wirksamkeit wurde als auswertbar angesehen. Alle 41 Patienten hatten zuvor eine eine systemische Therapie erhalten, und 31 Patienten waren zudem mit radioaktivem Jod behandelt worden.
Bei den 41 vorbehandelten Patienten des primären Analysenset zeigten sich folgende Histologien: papillar (n=31), schwach differenziert (n=5), anaplastisch (n=4) und Hürthle-Zell (n=1).
Das mediane Alter betrug 58 Jahre (Bereich 25 bis 88 Jahre). 43.9% der Patienten waren männlich. 58.5% der Patienten waren weisser, 29.3% asiatischer und 7.3% schwarzer Abstammung. Der ECOG-Performance-Status betrug 0-1 (92.7%) oder 2 (7.3%). 100% der Patienten hatten eine metastasierte Erkrankung.
Die Patienten hatten zuvor im Median 3 systemische Therapien erhalten (Bereich: 1-7). Zu den häufigsten vorausgegangenen Therapien gehörten radioaktives Jod (73.2%), MKI (85.4%) und 9.8% hatten andere systemische Therapien erhalten.
Im primären Analysensatz, welcher 41 vorbehandelte Patienten mit RET-fusionspositivem Schilddrüsenkarzinom umfasste, betrug die objektive Ansprechrate (ORR) 85.4% (95% CI: 70.8, 94.4) und die mediane Ansprechdauer 26.7 Monate (95% CI: 12.1-NB) bei einer medianen Beobachtungszeit von 33.87 Monaten.
In der schlecht differenzierten Schilddrüsenkarzinom-Population (n=5) betrug die ORR 100 % (95 %-KI: 47, 82,100). In der anaplastischen Schilddrüsenkarzinom-Population (n=4) betrug die ORR 75 % (19, 41, 99, 37). Der einzige Patient mit Hurthle-Zell- Schilddrüsenkarzinom zeigte ein partielles Ansprechen.
Vorbehandeltes RET-mutiertes medulläres Schilddrüsenkarzinom
Von den Patienten mit RETmutiertem MTC, die in die LIBRETTO-001 Studie eingeschlossen wurden, wurden 152 Patienten zuvor mit Cabozantinib und/oder Vandetanib behandelt und konnten über mindestens 6 Monate beobachtet werden, sodass die Wirksamkeit als auswertbar angesehen wurde. Das mediane Alter betrug 58 Jahre (Bereich 17 Jahre bis 90 Jahre); 1 Patient (0.7%) hatte ein Alter von <18 Jahren. 63.8% der Patienten waren Männer. 90.1% der Patienten waren weisser, 1.3% asiatischer und 1.3% schwarzer Abstammung. Der ECOG-Performance-Status betrug 0-1 (92.7%) oder 2 (7.2%). 98.0% der Patienten hatten eine metastasierte Erkrankung. 100% (n = 152) der Patienten hatten zuvor eine systemische Therapie mit median 2 vorherigen systemischen Therapien erhalten, und 27.6% (n=42) hatten 3 oder mehr vorherige systemische Therapien erhalten. Die häufigste Mutation war M918T (65.1%), gefolgt von extrazellulären Cystein-Mutationen (15.8%).
Bei den 152 zuvor behandelten Patienten mit RET-mutiertem MTC betrug die objektive Ansprechrate (ORR) 77.6% (70.2, 84.0) und die mediane Ansprechdauer betrug 45.3 Monate (95% CI: 33.6, NB) bei einer medianen Beobachtungszeit von 38.3 Monaten.
Kinder und Jugendliche
Die Evidenz für die Wirksamkeit und Sicherheit von Selpercatinib in der jugendlichen Population ist limitiert. Es wurden Resultate von insgesamt 14 pädiatrischen Patienten mit MTC aus der Phase-1/2-studie LIBRETTO-121 vorgelegt. LIBRETTO-121 ist eine laufende Phase-1/2 Studie bei pädiatrischen Patienten mit einem fortgeschrittenen soliden oder primären ZNS-Tumor, welche eine aktivierende RET-Veränderung aufweisen.
Die objektive Ansprechrate (ORR) in der RET-mutierten MTC-Population (n=14) in LIBRETTO-121 betrug 42.9% (95% KI: 17,7%-71.1%).
|

