CompositionPrincipes actifs
Acidum penteticum (DTPA)
Excipients
Stannosi(II) chloridum dihydricum, Acidum gentisicum, Calcii chloridum dihydricum, Acidum hydrochloridum concentratum, Natrii hydroxidum.
Le lyophilisat du produit contient 4.72 mg de sodium par flacon-ampoule.
Après la reconstitution avec 10 ml d’une solution de pertechnétate de sodium, le produit contient 4.01mg/ml de sodium.
Mécanisme de réaction
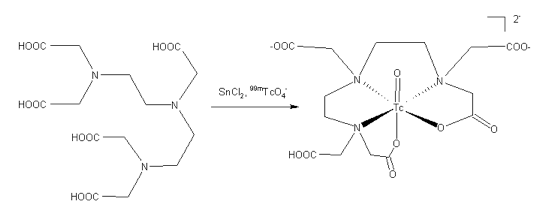
DTPA 99mTc - DTPA
Spécifications du produit marqué
Solution aqueuse, exempte d’endotoxines, stérile, apyrogène, claire à légèrement opalescente, incolore pour administration intraveineuse ou pour inhalation après fabrication d’un aérosol,
pH: 4,0 - 5,0;
Rendement de marquage: ≥ 95%.
Indications/Possibilités d’emploiTechneScan DTPA est une préparation radiodiagnostique, qui est indiquée, après reconstitution à l’aide du pertechnétate [99mTc] de sodium, pour:
-Scintigraphie rénale
-Scintigraphie cérébrale
-Scintigraphie pulmonaire de ventilation après préparation d’un aérosol adapté à son inhalation.
Posologie/Mode d’emploiLe 99mTc-DTPA est administré par injection unique, intraveineuse ou par inhalation au moyen d’un générateur d’aérosol. Le contenu marqué d'un flacon de TechneScan DTPA est destiné à l'examen de plusieurs patients. Dans certaines conditions particulières, on peut aussi administrer à un seul patient tout un flacon dont le contenu est marqué avec une activité adéquate.
Le produit ne doit pas être administré au patient sous forme non marquée.
Posologie pour un adulte
-Scintigraphie rénale: 40 - 400 MBq
-Scintigraphie cérébrale: 200 - 750 MBq
-Etude de ventilation pulmonaire: 50-100 MBq se déposent dans les poumons, 500 -1000 MBq dans le générateur aérosol en fonction de l’appareil.
Posologie chez les enfants et les adolescents :
Scintigraphie rénale :
L’utilisation chez les enfants et les adolescents doit être soigneusement reconsidérée et doit dépendre de la nécessité clinique ainsi que du rapport bénéfice/risque dans cette population. Les activités à administrer par voie intraveineuse chez les enfants et les adolescents peuvent être calculées selon les recommandations de la « Paediatric Dosage Card » de l’EANM (European Association of Nuclear Medicine) de 2016. Pour ce faire, il convient de choisir les formules pour chaque indication et le facteur de correction pertinent en fonction du poids corporel du jeune patient.
Administration de pentétate de technétium (99mTc) en cas d’insuffisance rénale:
Activité administrée [MBq] = activité initiale [MBq] x multiplicateur (pour une activité initiale de 14,0)
Tableau 1
|
Masse corporelle
|
Facteur de multiplication
|
Masse corporelle
|
Facteur de multiplication
|
Masse corporelle
|
Facteur de multiplication
| |
3 kg
|
1
|
22 kg
|
5,29
|
42 kg
|
9,14
| |
4 kg
|
1,14
|
24 kg
|
5,71
|
44 kg
|
9,57
| |
6 kg
|
1,71
|
26 kg
|
6,14
|
46 kg
|
10,00
| |
8 kg
|
2,14
|
28 kg
|
6,43
|
48 kg
|
10,29
| |
10 kg
|
2,71
|
30 kg
|
6,86
|
50 kg
|
10,71
| |
12 kg
|
3,14
|
32 kg
|
7,29
|
52-54 kg
|
11,29
| |
14 kg
|
3,57
|
34 kg
|
7,72
|
56-58 kg
|
12,00
| |
16 kg
|
4,00
|
36 kg
|
8,00
|
60-62 kg
|
12,71
| |
18 kg
|
4,43
|
38 kg
|
8,43
|
64-66 kg
|
13,43
| |
20 kg
|
4,86
|
40 kg
|
8,86
|
68 kg
|
14,00
|
Administration de pentétate de technétium (99mTc) en cas de fonction rénale normale:
Activité administrée [MBq] = activité initiale [MBq] x multiplicateur (pour une activité initiale de 34,0)
Tableau 2
|
Masse corporelle
|
Facteur de multiplication
|
Masse corporelle
|
Facteur de multiplication
|
Masse corporelle
|
Facteur de multiplication
| |
3 kg
|
1
|
22 kg
|
3,06
|
42 kg
|
4,41
| |
4 kg
|
1,12
|
24 kg
|
3,18
|
44 kg
|
4,53
| |
6 kg
|
1,47
|
26 kg
|
3,35
|
46 kg
|
4,65
| |
8 kg
|
1,71
|
28 kg
|
3,47
|
48 kg
|
4,77
| |
10 kg
|
1,94
|
30 kg
|
3,65
|
50 kg
|
4,88
| |
12 kg
|
2,18
|
32 kg
|
3,77
|
52-54 kg
|
5,00
| |
14 kg
|
2,35
|
34 kg
|
3,88
|
56-58 kg
|
5,24
| |
16 kg
|
2,53
|
36 kg
|
4,00
|
60-62 kg
|
5,47
| |
18 kg
|
2,71
|
38 kg
|
4,18
|
64-66 kg
|
5,65
| |
20 kg
|
2,88
|
40 kg
|
4,29
|
68 kg
|
5,77
|
Chez les enfants jusqu’à 1 an, lors de l’emploi de TechneScan DTPA marqué au 99mTc une dose minimale de 20 MBq est nécessaire afin d’obtenir des images de qualité suffisante.
Scintigraphie pulmonaire:
-Scintigraphie pulmonaire de ventilation: 10 MBq se déposent dans les poumons, 500–1000 MBq dans le générateur d’aérosol.
Acquisition d'images
-Perfusion rénale: l'examen est effectué par imagerie dynamique au cours de la première minute suivant l'injection. Le moment optimal pour l’imagerie statique est 1 heure après l’injection. En cas de scintigraphie rénale avec test au captopril (IEC), le captopril est administré par voie intraveineuse avant l’administration du pentétate de technétium (99mTc). L’enregistrement de la fonction de chaque rein est réalisée par imagerie dynamique après l’injection. Si l’un ou les deux reins ne se sont pas vidés correctement dans les 20 premières minutes, une charge de furosémide est effectuée. L’imagerie dynamique doit être poursuivie 15 minutes après l’administration du diurétique. Les clichés statiques peuvent être réalisés 1 heure après l'injection.
-Scintigraphie cérébrale: l'examen doit commencer immédiatement après l'injection par des acquisitions dynamiques. Les images statiques sont prises 1 heure et, si nécessaire, plusieurs heures après l’injection.
-Scintigraphie pulmonaire de ventilation: les images des poumons sont prises dans les 180 minutes. Pour la scintigraphie pulmonaire de ventilation, un générateur d’aérosol est nécessaire, en dosant en fonction du type d'appareil (consulter le mode d'emploi correspondant).
Répétition de l'examen
On peut envisager de répéter l'examen avec le TechneScan DTPA 48 heures au plus tôt (8 demi-vies de 99mTc) après la première administration de la préparation.
Posologie spéciale
Lors de limitation de la fonction rénale, la dose irradiée peut être accrue, ce dont il faut tenir compte lors du calcul de la dose.
Exposition aux rayonnements
Le technétium (99mTc) est préparé à l'aide d'un générateur (99Mo/99mTc) et se désintègre avec émission de rayons gamma ayant une énergie de 140 keV et une demi-vie de 6,01 heures en technétium (99Tc), qui peut être considéré comme quasi stable en raison de sa longue demi-vie de 2,13 x 105 ans.
Les données figurant dans le tableau proviennent de l’ICRP 128 et ont été calculées selon les hypothèses suivantes:
-L’injection intraveineuse de pentétate de technétium (99mTc) entraîne une distribution initiale dans le liquide extracellulaire. Après cette distribution initiale, la substance est éliminée uniquement par les reins. En cas de fonction rénale normale, la rétention corporelle totale peut être décrite comme une fonction biexponentielle avec des demi-vies pour les composants de 100 minutes (0,99) et 7 jours (0,01). La fraction excrétée par le rein est de 1,0 (1,0). Le débit rénal est de 5 minutes. En cas d’insuffisance rénale, on estime que la demi-vie de rétention du composant principal s'élève à 1000 minutes et le débit rénal est porté à 20 minutes.
Selon l’ICRP publication No. 128 les doses suivantes absorbées sont indiquées pour les patients avec fonction rénale normale:
Dose estimée absorbée par unité (mGy/MBq) d'activité administrée
|
Organ
|
Adulte
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
0,0014
|
0,0018
|
0,0027
|
0,004
|
0,0072
| |
Surface osseuse
|
0,0024
|
0,0029
|
0,0043
|
0,0061
|
0,010
| |
Cerveau
|
0,00086
|
0,0011
|
0,0017
|
0,0028
|
0,0049
| |
Sein
|
0,00072
|
0,00092
|
0,0013
|
0,0022
|
0,0041
| |
Paroi de la vésicule biliaire
|
0,0015
|
0,0021
|
0,0038
|
0,005
|
0,0061
| |
Tractus gastro-intestinal
|
| |
Paroi stomacale
|
0,0013
|
0,0017
|
0,0028
|
0,0040
|
0,0068
| |
Paroi de l’intestin grêle
|
0,0025
|
0,0031
|
0,0049
|
0,0070
|
0,010
| |
Paroi du côlon
|
0,0031
|
0,0039
|
0,0060
|
0,0081
|
0,011
| |
Paroi du côlon ascendant
|
0,0021
|
0,0028
|
0,0043
|
0,0065
|
0,0092
| |
Paroi du côlon descendant
|
0,0043
|
0,0054
|
0,0082
|
0,010
|
0,013
| |
Paroi cardiaque
|
0,0012
|
0,0015
|
0,0022
|
0,0033
|
0,0059
| |
Reins
|
0,0044
|
0,0053
|
0,0075
|
0,011
|
0,018
| |
Foie
|
0,0012
|
0,0016
|
0,0025
|
0,0038
|
0,0064
| |
Poumons
|
0,001
|
0,0013
|
0,002
|
0,003
|
0,0055
| |
Muscles
|
0,0016
|
0,002
|
0,003
|
0,0043
|
0,0068
| |
Œsophage
|
0,001
|
0,0013
|
0,0019
|
0,003
|
0,0054
| |
Ovaires
|
0,0042
|
0,0053
|
0,0077
|
0,01
|
0,013
| |
Pancréas
|
0,0014
|
0,0018
|
0,0028
|
0,0043
|
0,0074
| |
Moelle osseuse rouge
|
0,0015
|
0,0018
|
0,0027
|
0,0037
|
0,0057
| |
Peau
|
0,00087
|
0,001
|
0,0017
|
0,0026
|
0,0044
| |
Rate
|
0,0013
|
0,0016
|
0,0026
|
0,0039
|
0,0068
| |
Testicules
|
0,0029
|
0,004
|
0,0068
|
0,0094
|
0,013
| |
Thymus
|
0,001
|
0,0013
|
0,0019
|
0,0030
|
0,0054
| |
Thyroïde
|
0,001
|
0,0013
|
0,0021
|
0,0033
|
0,006
| |
Paroi vésicale
|
0,062
|
0,078
|
0,11
|
0,15
|
0,17
| |
Utérus
|
0,0079
|
0,0096
|
0,015
|
0,018
|
0,022
| |
Autres tissus
|
0,0017
|
0,0021
|
0,0030
|
0,0042
|
0,0066
| |
| |
Dose efficace (mSv/MBq)
|
0,0049
|
0,0063
|
0,0094
|
0,012
|
0,016
|
La dose efficace d’irradiation est d’environ 3,6 mSv lorsque l’activité maximale recommandée de 740 MBq est administrée chez les adultes ayant un poids corporel de 70 kg.
Pour une activité administrée de 740 MBq, l’exposition aux rayonnements typique de l’organe cible (reins) est de 3,3 mGy et l’exposition aux rayonnements typique de l’organe critique (paroi de la vessie) est de 46 mGy.
Les valeurs suivantes sont valables selon l’ICRP 128 pour les patients avec fonction rénale limitée:
Dose estimée absorbée par unité (mGy/MBq) d'activité administrée
|
Organ
|
Adulte
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
0,0041
|
0,0051
|
0,0076
|
0,011
|
0,021
| |
Surface osseuse
|
0,006
|
0,0071
|
0,011
|
0,015
|
0,028
| |
Cerveau
|
0,0028
|
0,0035
|
0,0057
|
0,0091
|
0,016
| |
Sein
|
0,0023
|
0,003
|
0,0042
|
0,0068
|
0,013
| |
Paroi de la vésicule biliaire
|
0,0042
|
0,0057
|
0,0092
|
0,013
|
0,016
| |
Tractus gastro-intestinal
|
| |
Paroi stomacale
|
0,0038
|
0,005
|
0,0079
|
0,011
|
0,019
| |
Paroi de l’intestin grêle
|
0,0045
|
0,0056
|
0,0085
|
0,013
|
0,022
| |
Paroi du côlon
|
0,0045
|
0,0058
|
0,0087
|
0,013
|
0,022
| |
Paroi du côlon ascendant
|
0,0043
|
0,0056
|
0,0081
|
0,013
|
0,021
| |
Paroi du côlon descendant
|
0,0049
|
0,0061
|
0,0095
|
0,013
|
0,023
| |
Paroi cardiaque
|
0,0037
|
0,0047
|
0,007
|
0,01
|
0,018
| |
Reins
|
0,0077
|
0,0092
|
0,013
|
0,019
|
0,032
| |
Foie
|
0,0037
|
0,0046
|
0,0071
|
0,011
|
0,019
| |
Poumons
|
0,0033
|
0,0042
|
0,0062
|
0,0095
|
0,017
| |
Muscles
|
0,0032
|
0,004
|
0,0061
|
0,0091
|
0,017
| |
Œsophage
|
0,0033
|
0,0042
|
0,0062
|
0,0096
|
0,017
| |
Ovaires
|
0,005
|
0,0062
|
0,0092
|
0,014
|
0,023
| |
Pancréas
|
0,0043
|
0,0053
|
0,008
|
0,012
|
0,021
| |
Moelle osseuse rouge
|
0,0034
|
0,0042
|
0,0064
|
0,0093
|
0,016
| |
Peau
|
0,0022
|
0,0026
|
0,0042
|
0,0067
|
0,012
| |
Rate
|
0,0038
|
0,0047
|
0,0073
|
0,011
|
0,019
| |
Testicules
|
0,0035
|
0,0045
|
0,0069
|
0,01
|
0,018
| |
Thymus
|
0,0033
|
0,0042
|
0,0062
|
0,0096
|
0,017
| |
Thyroïde
|
0,0034
|
0,0042
|
0,0067
|
0,011
|
0,019
| |
Paroi vésicale
|
0,021
|
0,027
|
0,039
|
0,05
|
0,066
| |
Utérus
|
0,0061
|
0,0074
|
0,011
|
0,016
|
0,025
| |
Autres tissus
|
0,0033
|
0,0041
|
0,0063
|
0,0097
|
0,017
| |
| |
Dose efficace (mSv/MBq)
|
0,0046
|
0,0058
|
0,0087
|
0,013
|
0,021
|
La demi-vie physique de (99mTc) est de 6,01 heures.
La paroi de la vessie contribue à jusqu’à 57% de la dose efficace.
Les données ci-dessous proviennent de l’ICRP 53 et ont été calculées selon les hypothèses suivantes:
-Inhalation de pentétate de technétium (99mTc):
l’inhalation d’aérosols composés de particules de diamètre inférieur à 2–3 micromètres entraîne des dépôts principalement dans les alvéoles pulmonaires. Les particules sont rapidement éliminées des poumons par la circulation sanguine. La demi-vie biologique du pentétate de technétium (99mTc) dans les poumons est de 60 à 80 minutes chez les non-fumeurs normaux; elle est raccourcie chez les fumeurs et chez la plupart des patients souffrant de maladies pulmonaires. Une valeur de 60 min est reprise ci-dessous. La substance qui pénètre dans le sang est éliminée selon le modèle du pentétate de technétium (99mTc) administré par voie intraveineuse.
En cas d’administration de DTPA marqué au 99mTc sous forme d’aérosol, les valeurs suivantes sont valables selon l’ICRP 53:
Dose estimée absorbée par unité (mGy/MBq) d'activité administrée
|
Organ
|
Adulte
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
0.0021
|
0.0029
|
0.0044
|
0.0067
|
0.012
| |
Paroi de la vésicule biliaire
|
0.047
|
0.058
|
0.084
|
0.12
|
0.23
| |
Surface osseuse
|
0.0019
|
0.0024
|
0.0035
|
0.0053
|
0.0098
| |
Seins
|
0.0019
|
0.0019
|
0.0033
|
0.0048
|
0.0078
| |
Tractus gastro-intestinal
|
| |
Paroi stomacale
|
0.0017
|
0.0022
|
0.0035
|
0.0051
|
0.0089
| |
Paroi de l’intestin grêle
|
0.0021
|
0.0026
|
0.0041
|
0.0063
|
0.011
| |
Paroi du côlon ascendant
|
0.0019
|
0.0024
|
0.0038
|
0.0061
|
0.01
| |
Paroi du côlon descendant
|
0.0032
|
0.0042
|
0.0063
|
0.0088
|
0.015
| |
Reins
|
0.0041
|
0.0051
|
0.0072
|
0.011
|
0.019
| |
Foie
|
0.0019
|
0.0025
|
0.0037
|
0.0055
|
0.0097
| |
Poumons
|
0.017
|
0.026
|
0.036
|
0.054
|
0.1
| |
Ovaires
|
0.0033
|
0.0041
|
0.0061
|
0.0089
|
0.015
| |
Pancréas
|
0.0021
|
0.0026
|
0.004
|
0.0061
|
0.011
| |
Moelle osseuse rouge
|
0.0027
|
0.0034
|
0.0047
|
0.0062
|
0.0096
| |
Rate
|
0.0019
|
0.0024
|
0.0036
|
0.0056
|
0.0099
| |
Testicules
|
0.0021
|
0.0031
|
0.0052
|
0.0079
|
0.015
| |
Thyroïde
|
0.00099
|
0.0017
|
0.0027
|
0.0044
|
0.0078
| |
Utérus
|
0.0059
|
0.0072
|
0.011
|
0.016
|
0.027
| |
Autres tissus
|
0.0018
|
0.0022
|
0.0032
|
0.0049
|
0.0086
| |
| |
Dose efficace (mSv/MSq)
|
0.007
|
0.0091
|
0.013
|
0.02
|
0.036
|
Contre-indicationsHypersensibilité avérée au DTPA non marqué, au 99mTc-DTPA ou à un des autres composants contenu dans la préparation.
-Grossesse.
-Pendant l’allaitement.
-Administration intra-thécale.
Mises en garde et précautionsRéactions d’hypersensibilité ou anaphylactiques potentielles
Si des réactions d’hypersensibilité ou anaphylactiques surviennent, l'utilisation du médicament doit être interrompue et un traitement par voie intraveineuse doit être instauré si nécessaire. Afin de pouvoir réagir rapidement en cas d’urgence, des médicaments et des instruments d’urgence appropriés (par ex. tube trachéal, respirateur) doivent être disponibles.
Évaluation individuelle des bénéfices et des risques
Pour chaque patient, l’exposition aux rayonnements doit être justifiée par le bénéfice potentiel. Dans tous les cas, l’activité administrée doit être aussi faible que possible pour obtenir le résultat diagnostique souhaité.
Troubles de la fonction rénale/hépatique
L’activité à administrer doit être soigneusement reconsidérée car une exposition accrue aux rayonnements peut être observée dans cette population de patients.
Enfants et adolescents
Pour plus d’informations sur l’utilisation chez les enfants et les adolescents, voir rubrique «Posologie/Mode d’emploi».
L’indication doit être posée de manière particulièrement stricte car la dose efficace par MBq est plus élevée que chez l’adulte (voir rubrique «Exposition aux rayonnements»).
Préparation du patient
Il faut veiller à ce que le patient soit suffisamment hydraté avant l'examen. Afin de réduire le plus possible l'exposition aux rayonnements, les patients doivent être invités à vider la vessie le plus souvent possible pendant les premières heures suivant l'examen.
Mises en garde particulières
La solution injectable de Technescan DTPA ne doit pas être injectée dans l’espace subarachnoïdien et n’est pas adaptée à la scintigraphie du flux de la moelle épinière.
Selon l’heure à laquelle vous administrez l’injection, la teneur en sodium administrée au patient peut, dans certains cas, être supérieure à 1 mmol. Ceci doit être pris en compte chez les patients suivant un régime hyposodé.
InteractionsScintigraphie rénale
Dans certains cas, lors des tests pharmacologiques, l'administration unique d'un diurétique ou d'un IEC est utilisée pour permettre un diagnostic différentiel de troubles néphrologiques et urologiques.
-Les IEC diminuent la circulation sanguine dans les reins.
-Le diclofénac, le furosémide et d’autres diurétiques tels que l’hydrochlorothiazide peuvent modifier la sécrétion rénale et donc la clairance du pentétate de technétium (99mTc).
-Les agents néphrotoxiques tels que les aminoglycosides, le cisplatine et les produits de contraste administrés peuvent réduire l’excrétion rénale et affecter ainsi la clairance du pentétate de technétium (99mTc).
Scintigraphie cérébrale
Les médicaments psychotropes augmentent la perfusion sanguine dans la région de l’artère carotide externe. Cela peut entraîner une captation rapide de 99mTc-DTPA par le rhinopharynx.
Afin d’assurer une qualité de scintigraphie optimale, il vaut mieux ne pas administrer cette ou d'autres substances pendant un examen par TechneScan DTPA, ni les administrer dans un intervalle proche, sauf si le but d’examen implique un tel procédé. Dans tous les cas, l'évaluation des scintigrammes doit tenir en compte des médicaments pris par le patient au moment de l’examen.
Grossesse, AllaitementFemmes en âge de procréer
Si l’utilisation d’un produit radiopharmaceutique est envisagée chez une femme en âge de procréer, il est impératif de déterminer si une grossesse est en cours. Tant que le contraire n’a pas été démontré, une grossesse doit être présumée en l'absence de règles. En cas de doute (absence de règles, règles très irrégulières, etc.), il convient de proposer à la patiente d'autres méthodes d'examen ne recourant pas aux rayonnements ionisants (si de telles méthodes sont disponibles).
Grossesse
Les examens au moyen de radionucléides chez la femme enceinte entraînent également une irradiation du fœtus. Par conséquent, seuls les examens essentiels dont le bénéfice attendu est largement supérieur au risque encouru par la mère et le fœtus doivent être réalisés pendant la grossesse.
Allaitement
Avant l’administration d’un produit radiopharmaceutique pendant l’allaitement, il convient d’envisager la possibilité de reporter l’administration du radionucléide après la fin de l’allaitement et de tenir compte également de l’excrétion de la radioactivité dans le lait maternel lors du choix du produit radiopharmaceutique le plus approprié. Si l’administration est jugée nécessaire, l’allaitement doit être interrompu pendant au moins 12 heures et le lait tiré pendant cette période doit être éliminé.
Fertilité
Aucune étude de fertilité n’a été réalisée.
Effet sur l’aptitude à la conduite et l’utilisation de machinesLe pentétate de technétium (99mTc) n’a aucune influence ou a une influence négligeable sur l’aptitude à la conduite ou l'utilisation de machines.
Effets indésirablesLes effets indésirables présentés dans le tableau ci-dessous sont résumés par classe de systèmes d’organes. Leur fréquence est inconnue (la fréquence ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes
|
Symptôme
|
Fréquence
| |
Affections du système nerveux
|
Sensations vertigineuses
|
Fréquence inconnue
| |
Affections respiratoires, thoraciques et médiastinales
|
Dyspnée
|
Fréquence inconnue
| |
Affections de la peau et du tissu sous-cutané
|
Urticaire, prurit
|
Fréquence inconnue
| |
Affections vasculaires
|
Hypotension, bouffées vasomotrices
|
Fréquence inconnue
|
Les rayonnements ionisants peuvent provoquer des cancers et des modifications du patrimoine génétique. La dose efficace étant de 3,6 mSv lorsque l’activité maximale recommandée de 740 MBq est administrée, ces effets sont peu probables.
Dans de cas rares, particulièrement chez des patients avec une allergie contre l'aspirine, on a observé des réactions anaphylactiques dues à l’acide gentisique (acide dihydroxy-benzoique) contenue dans TechneScan DTPA comme excipient. Des telles réactions peuvent être traitées par l’emploi d’antihistaminiques ou l’administration parentérale de stéroïdes.
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn respectant les consignes d'utilisation, aucun surdosage n'est à envisager. En cas de surdosage accidentel de 99mTc-DTPA, l'importante dose absorbée qui en résulte diminue rapidement en raison de la courte demi-vie du 99mTc (6,02 heures). L'élimination devrait si possible être accélérée par une diurèse forcée et en demandant au patient de vider aussi souvent que possible sa vessie.
Propriétés/EffetsCode ATC
V09CA01
Mécanisme d’action
-Comme l’inuline, le pentétate de technétium (99mTc) circule dans la circulation sanguine avec une liaison négligeable aux protéines plasmatiques. Il est filtré par la membrane glomérulaire et ne subit ni sécrétion tubulaire ni réabsorption. Il ne traverse pas la barrière hémato-encéphalique (BHE) normale.
-Le pentétate de technétium (99mTc) est aérosolisé en particules ayant une taille de 1,2 à 2 micromètres à partir d'une solution aqueuse. Après l'inhalation, les gouttelettes d'aérosol sont distribuées et déposées dans les voies respiratoires et les alvéoles en fonction de leurs propriétés aérodynamiques, en particulier leur diamètre aérodynamique moyen.
Pharmacodynamique
Aux activités recommandées pour la scintigraphie et aux quantités administrées, on ne peut s'attendre à aucun effet pharmacodynamique particulier du 99mTc-DTPA.
Efficacité clinique
Les propriétés du 99mTc-DTPA qui sont importantes pour les examens de diagnostic reposent sur sa clearance plasmatique prolongée lors de maladies rénales, sa accumulation dans les lésions intracrâniennes et – après administration comme aérosol – sur sa distribution dans les poumons.
PharmacocinétiqueAprès injection intraveineuse le 99mTc-DTPA se distribue rapidement dans l’espace liquidien extra-cellulaire et il est rapidement excrété hors de l’organisme par filtration glomérulaire.
Le chélate n’est guère lié par le parenchyme rénal. Les protéines sériques lient le 99mTc-DTPA, en cas d’injection unique, jusqu’à env. 4% et, lors de perfusion prolongée, jusqu’à env. 10%. Bien que le chélate fournisse des indications utiles concernant le taux de filtration glomérulaire, cette fraction liée au plasma entraîne des taux de filtration glomérulaires plus faibles que, par exemple, ceux attendus lors de clearance à l’inuline.
Puisque le 99mTc-DTPA est excrété par filtration glomérulaire, la scintigraphie met en évidence, au cours des premières minutes après injection, le système vasculaire rénal. Les prises ultérieures montrent l’activité urinaire, tout comme celle des tubules collecteurs et du bassinet.
Le 99mTc-DTPA s’accumule dans les lésions intra-crâniennes, mais pas dans le plexus choroïde.
Après inhalation dans le cadre d’une scintigraphie de ventilation pulmonaire, le 99mTc-DTPA diffuse rapidement (avec une demi-vie biologique de 60 minutes environ) via la membrane alvéolaire dans le sang, où il se comporte comme mentionné plus haut après injection i.v., et d’où il est rapidement excrété par voie rénale.
Absorption
Voir «Pharmacocinétique».
Distribution
Voir «Pharmacocinétique».
Métabolisme
Non disponible.
Élimination
Voir «Pharmacocinétique».
Cinétique pour certains groupes de patients
Lors de maladies rénales, la clearance plasmatique du 99mTc-DTPA peut être prolongée.
Lors des lésions intra-crâniennes associées à une néo-vascularisation excessive ou à une modification de la perméabilité de la barrière hémato-encéphalique, l’accumulation de 99mTc-DTPA est élevée. En cas des troubles de ventilation pulmonaire, les régions mal- ou non-ventilées s’imposent comme zones avec peu ou sans activité.
Données précliniquesLes études animales effectuées avec l’acide pentétique non marqué (DTPA) n’ont montré, à des doses comprises entre 5 et 50 mg/kg i.v., aucun signe de toxicité aiguë. Même les résultats d’autopsie 14 jours après administration répétée se sont avérés négatifs. La dose maximale pour les patients est de 20,8 mg d’acide pentétique (0,30 mg/kg), ce qui est 2 grandeurs d’ordre ou moins au dessous des doses utilisées pendant les études précliniques.
On ne dispose d'aucune donnée sur le 99mTc-DTPA quant à son potentiel mutagène, carcinogène ou toxique pour la reproduction. Les dangers potentiels des rayons ionisants sont toutefois connus.
Le produit n’est pas destiné à être administré de manière fréquente ou régulière.
Remarques particulièresIncompatibilités
Aucune incompatibilité n’est connue. Il est toutefois recommandé de ne pas administrer le 99mTc-DTPA en même temps que d’autres médicaments.
Stabilité
Stabilité du TechneScan DTPA non marqué
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité du produit marqué
La préparation marquée peut être conservée dans le flacon d'origine pendant 8 heures après le marquage - ensuite, le produit n'est plus utilisable.
Remarques particulières concernant le stockage
Stockage du TechneScan DTPA non marqué
Le TechneScan DTPA non marqué doit être conservé à l’abri de la lumière, pas en dessus de 25 ºC.
Stockage du produit marqué
La préparation marquée doit être conservée pas en dessus de 25 °C, dans un conteneur de plomb d’épaisseur appropriée. Ne pas congeler.
Remarques concernant la manipulation
Le contenu d'un flacon de TechneScan DTPA est reconstitué à l'aide du [99mTc]pertechnétate de sodium en 99mTc-pentétate de calcium trisodique marqué (99mTc-DTPA), qui est le véritable agent diagnostique. Le marquage doit être effectué par du personnel qualifié, dans des conditions aseptiques strictes, sans air et en tenant compte des mesures de radioprotection (travail en conteneur ou derrière un écran de plomb).
Marquage
1.Oter le couvercle de fermeture flip-off du flacon TechneScan DTPA, désinfecter le bouchon en caoutchouc avec de l'alcool et mettre le flacon dans un conteneur en plomb.
2.Selon le nombre d'examens prévus, introduire dans le flacon l'activité correspondante à 110 MBq - 10 GBq de solution de [99mTc]pertechnétate de sodium dans un volume de 2 - 10 ml au moyen d'une seringue à injection stérile et protégée des radiations, sans bulle d'air et sans utiliser de seringue d'évacuation d'air. Ensuite, au moyen de la même seringue, prélever un volume équivalent de gaz afin de supprimer la surpression dans le flacon.
3.Recouvrir le flacon dans le conteneur en plomb par un couvercle en plomb et le retourner plusieurs fois ou le secouer légèrement sur un dispositif prévu à cet usage jusqu'à ce que la substance sèche soit entièrement dissoute.
4.Laisser reposer encore 15 à 30 minutes à température ambiante. Après cet intervalle de réaction le marquage est complet. La préparation est prête pour l’injection i.v. ou pour administration par inhalation au moyen d’un générateur d’aérosol.
5.Mesurer la radioactivité de la préparation marquée dans un activimètre adéquat. Remplir l'étiquette de précaution/protocole en indiquant l'activité totale, le volume, la concentration, l’heure et la date de mesure, puis affixer l’étiquette au flacon.
Le produit marqué doit être utilisé en l'espace de 8 heures. Dans ce laps de temps, le produit peut être conservé au-dessous de 25 °C et ne pas congeler – en tenant compte des mesures de protection envers les radiations.
Avant administration il faut déterminer le rendement de marquage.
Remarques concernant le marquage
Pour le marquage, il convient de n'utiliser que des éluats de 99mTc-pertechnétate produits avec des générateurs enregistrés et autorisés en Suisse. Les caractéristiques des éluats doivent correspondre aux exigences de la Ph. Eur., les éluats doivent en particulier ne pas contenir d'oxydants et doivent contenir moins de 5ppm d'aluminium. Pour garantir un rendement de marquage nécessaire d'au moins 95%, les éluats ne devraient plus être utilisés 6 heures après élution.
En cas d'activité trop importante, la solution de 99mTc-DTPA peut être diluée au moyen d'une solution de chlorure de sodium physiologique. La solution de chlorure de sodium physiologique choisie doit être stérile et exempte d’endotoxines, elle ne doit contenir ni bactériostatiques ni agents de conservations et elle devrait provenir d'un conteneur en verre (une ampoule) et non de conteneurs en plastique.
Contrôle de qualité
Le rendement du marquage et la pureté radiochimique sont déterminés à l'aide de la radiochromatographie. Cet examen peut être effectué à l'aide de deux chromatographies sur couche mince (A et B). La première chromatographie est destinée à la détection d'impuretés dues au pertechnétate libre et la seconde à la détection d'impuretés dues au technétium réduit, hydrolysé.
Les deux chromatographies permettent d'obtenir la somme des impuretés et de déterminer le rendement de marquage et la pureté radiochimique de la préparation marquée.
A: Détermination de pertechnétate libre (99mTcO4¯) par chromatographie sur couche mince:
Matériel nécessaire
Cuve à chromatographie
Gel de silice sur fibre de verre – Gelman ITLC-SG
Méthyl Ethyl Cétone
Seringue à 1 ml avec canule
Réalisation de la chromatographie
|
Direction du processus:
|
ascendante
| |
Durée du processus:
|
environ 5 min
|
Le pertechnétate libre (99mTcO4ˉ) se déplace avec le solvant, le 99mTc-DTPA, ainsi que le 99mtechnétium (99mTc(OH)2) réduit et hydrolysé restent au point de départ.
Procédure de chromatographie A
1.Recouvrir le fond de la cuve pour chromatographie de 1 cm de solvant Méthyl Ethyl Cétone; refermer le récipient et laisser reposer pendant 15 minutes pour que la vapeur de solvant puisse s'étaler régulièrement.
2.Marquer la bande ITLC-SG avec un crayon à papier 3 cm à partir de l'extrémité inférieure, refaire une marque avec un marqueur à encre 15 cm au-dessus de cette ligne. Le trait de crayon à papier indique l'endroit où il faut appliquer le liquide à analyser. Le trait marqué à l'encre disparaît lorsque le solvant a atteint la ligne marquée en couleur et indique que la chromatographie doit être arrêtée.
3.Refaire une autre marque au crayon à papier (= l'endroit où il faudra couper à Rf = 0,4) 6 cm au-dessus de la première ligne au crayon à papier.
4.Appliquer sur la première marque au crayon à papier (ligne d'application) 5 - 10 µL de la solution prête à injecter au moyen d'une seringue de 1 ml et d'une canule. Placer immédiatement la bande dans la cuve pour chromatographie pour ne pas laisser sécher le point et refermer la cuve aussitôt. Aucun endroit de la bande ne doit entrer en contact avec la paroi de la cuve pour chromatographie. Remarque: 5 - 10 µL de liquide doivent donner un point d'un diamètre de 7 - 10 mm. Des volumes d'échantillons inférieurs donneraient des valeurs pas fiables concernant la pureté radiochimique.
5.Dès que le solvant a atteint le trait d'encre, retirer la bande de la cuve pour chromatographie et le laisser sécher.
6.Couper la bande au niveau de l'emplacement marqué au crayon de papier et mesurer la radioactivité des parties au moyen d'un appareil de mesures adapté. Les deux parties devraient être rapidement mesurées et ce, si possible, dans des conditions identiques. On peut aussi envisager d'évaluer la totalité de la bande à l'aide d'un scanner à couche mince.
Calcul
|
Valeurs Rf:
|
| |
Pertechnétate libre (99mTcO4ˉ):
|
Rf = 0,9 - 1,0
| |
[99mTc]-DTPA:
|
Rf = 0,0
| |
Téchnetium réduit, hydrolysé (99mTc(OH)2):
|
Rf = 0,0
|
On calcule la proportion de pertechnétate libre (99mTcO4ˉ) au moyen de la formule suivante:
|
% 99mTcO4ˉ =
|
Activité de l’extrémité supérieure de la bande x 100
| |
Activité de l’ensemble de la bande
|
B: Détermination de technétium réduit et hydrolysé (99mTc(OH)2) par chromatographie sur couche mince:
Matériel nécessaire
Cuve à chromatographie
Gel de silice sur fibre de verre – Gelman ITLC-SG
Chlorure de sodium 0,9% (m/V)
Seringue à 1ml avec canule
Réalisation de la chromatographie
|
Direction du processus:
|
ascendante
| |
Durée du processus:
|
environ 5 min
|
Le 99mTc-DTPA, ainsi que pertechnétate libre (99mTcO4ˉ) se déplacent avec le solvant, le 99mtechnétium (99mTc(OH)2) réduit et hydrolysé reste au point de départ.
Procédure de chromatographie B
Recouvrir le fond de la cuve pour chromatographie de 1 cm de solvant chlorure de sodium 0,9%; refermer le récipient et laisser reposer pendant 15 minutes pour que la vapeur de solvant puisse s'étaler régulièrement. Pour la suite (points 2. – 6.), voir les consignes relatives à la chromatographie A.
Calcul
|
Valeurs Rf:
|
| |
Technétium réduit, hydrolysé (99mTc(OH)2):
|
Rf = 0,0
| |
[99mTc]-DTPA:
|
Rf = 0,9 - 1,0
| |
Pertechnétate libre (99mTcO4ˉ):
|
Rf = 0,9 - 1,0
|
On calcule la proportion de technétium réduit, hydrolysé (99mTc(OH)2) au moyen de la formule suivante:
|
% 99mTc(OH)2 =
|
Activité de l’extrémité inférieure de la bande x 100
| |
Activité de l’ensemble de la bande
|
Résultats
La concentration en pertechnétate libre (99mTcO4ˉ) peut atteindre, avec le technétium réduit, hydrolysé (99mTc(OH)2), au maximum 5% de l'activité totale. Cela entraîne un rendement de marquage d'au moins 95% pour le [99mTc]-DTPA. La proportion de 99mtechnétium réduit et hydrolysé (99mTc(OH)2) doit se monter au maximum à 0,1%.
Il ne faut pas utiliser des préparations dont le rendement de marquage est inférieur à 95%.
Elimination des déchets
La radioactivité excrétée par les patients nécessite des mesures de précautions adéquates, afin d'éviter toute contamination.
Les étiquettes caractéristiques doivent être enlevées avant élimination des déchets. L'élimination doit avoir lieu conformément aux prescriptions nationales en vigueur. Les flacons périmés (non entamés) de TechneScan DTPA au contenu lyophilisé ne sont pas radioactifs et peuvent être jetés avec les déchets de laboratoire normaux.
Pour les prescriptions et recommandations concernant la conservation, l'utilisation et l'élimination du générateur ayant servi de source de production de la solution à injecter de [99mTc]pertechnétate de sodium en vue du marquage de TechneScan DTPA, veuillez vous référer aux informations spécialisées accompagnant le générateur.
Mise en garde de radioprotection
L'utilisation de substances radioactives chez l'être humain est réglée en Suisse par l'Ordonnance fédérale sur la protection des radiations. De même, l'utilisation de produits radiopharmaceutiques n'est autorisée que par des personnes disposant d'une autorisation délivrée par l'Office fédéral de la santé.
La manipulation de substances radioactives et l'élimination de déchets radioactifs doivent respecter les dispositions de protection de cette ordonnance. Toute irradiation inutile des patients et du personnel doit être évitée.
Mises en garde générales
Le contenu du flacon est exclusivement destiné à la préparation de pentétate de technétium (99mTc) et ne doit pas être utilisé directement chez le patient, c'est-à-dire sans la procédure de préparation prescrite.
Si l’intégrité du flacon est altérée à tout moment au cours de la préparation, le produit ne doit pas être utilisé.
Le contenu de la trousse n’est pas radioactif avant la reconstitution. Après l’ajout du pertechnétate (99mTc) de sodium, la solution finale préparée doit être protégée de manière adéquate.
Numéro d’autorisation42809 (Swissmedic)
PrésentationUne boîte en carton contient 5 flacons de TechneScan DTPA.
Les flacons de verre (Type I, Ph. Eur.) sont fermés par un bouchon de caoutchouc en bromure de butyle et protégés par un couvercle de fermeture flip-off. (A)
Titulaire de l’autorisationb.e.imaging SA, Schwyz
Mise à jour de l’informationMars 2024
|

