CompositionPrincipes actifs
Losartan potassique.
Excipients
Excipiens pro compresso obducto.
Indications/Possibilités d’emploiHypertension
Losartan Spirig HC est indiqué pour le traitement de l'hypertension essentielle.
Hypertension artérielle avec hypertrophie ventriculaire gauche
Réduction du risque d'accident vasculaire cérébral chez les patients hypertendus atteints d'hypertrophie ventriculaire gauche (voir sous «Propriétés/Effets, Etude LIFE, Patients de peau noire»).
Insuffisance cardiaque
Insuffisance cardiaque légère à modérée, normalement en association avec des diurétiques et des digitaliques, lorsqu'un traitement par des inhibiteurs de l'ECA en raison d'effets secondaires spécifiques des inhibiteurs de l'ECA (toux) ne convient pas. Des effets secondaires apparus suite à un traitement par des inhibiteurs de l'ECA et dus à une influence générale sur le système rénine-angiotensine-aldostérone (p.ex. insuffisance rénale progressive, hyperkaliémie) ne constituent pas une indication pour Losartan Spirig HC.
Néphropathie chez les diabétiques de type 2
Pour le traitement d'une néphropathie diabétique chez les diabétiques de type 2 présentant une hypertension avec une créatininémie élevée et une protéinurie (quotient albumine urinaire/créatinine ≥300 mg/g).
Posologie/Mode d’emploiHypertension
Chez la plupart des patients, la dose initiale et la dose d'entretien sont de 50 mg/jour en prise unique. L'effet antihypertenseur maximal est atteint après 3 à 6 semaines. Chez quelques patients, le résultat thérapeutique peut être amélioré par une augmentation de la posologie à 1 comprimé pelliculé de Losartan Spirig HC 100 une fois par jour ou par l'association avec de l'hydrochlorothiazide (12,5 ou 25 mg).
Réduction du risque d'accident vasculaire cérébral lors d'hypertension artérielle avec hypertrophie ventriculaire gauche
La dose initiale est de 50 mg de Losartan Spirig HC une fois par jour. Selon la baisse de la pression artérielle obtenue, une faible dose d'hydrochlorothiazide devrait être ajoutée et/ou la dose de Losartan Spirig HC devrait être portée à 100 mg une fois par jour.
Insuffisance cardiaque
La dose initiale de Losartan Spirig HC chez les patients souffrant d'insuffisance cardiaque est de 12,5 mg, prise une fois par jour. La dose devrait généralement être augmentée par paliers hebdomadaires (c'est-à-dire 12,5 mg/jour, 25 mg/jour, 50 mg/jour, 100 mg/jour, jusqu'à une dose maximale de 150 mg une fois par jour) en fonction de la tolérance.
Néphropathie chez les patients diabétiques de type 2 présentant une hypertension
La dose initiale habituelle est de 50 mg une fois par jour. Selon la baisse de la pression artérielle obtenue, la dose peut être portée à 100 mg une fois par jour. Losartan Spirig HC peut être administré en même temps que d'autres antihypertenseurs (p.ex. diurétiques, antagonistes du calcium, alpha ou bêta-bloquants, médicaments agissant sur le système nerveux central) ainsi que l'insuline et d'autres antidiabétiques usuels (p.ex. les dérivés des sulfonylurées, les glitazones et les inhibiteurs de la glucosidase).
Losartan Spirig HC peut être pris lors des repas ou entre ceux-ci.
Instructions spéciales pour la posologie
Hypovolémie
Chez les patients présentant une hypovolémie (p.ex. lors d'un traitement avec des diurétiques à hautes doses), une dose initiale de 25 mg en prise journalière unique doit être envisagée (voir «Mises en garde et précautions»).
Patients âgés/Troubles rénaux et hépatiques
Chez les patients âgés et chez les patients souffrant d'affections rénales y compris les patients dialysés, aucune adaptation de la posologie n'est nécessaire. Une dose réduite devrait être prévue en cas de restriction de la fonction hépatique (voir «Mises en garde et précautions»).
Enfants et adolescents
Losartan Spirig HC ne devrait pas être utilisé chez les enfants et les adolescents, car la sécurité et l'efficacité chez les enfants et les adolescents n'ont pas été étudiées.
Losartan Spirig HC peut être utilisé seul ou en association avec d'autres antihypertenseurs.
Contre-indicationsLosartan Spirig HC est contre-indiqué chez les patients témoignant d'une hypersensibilité au produit ou à l'un de ses composants ou encore chez ceux souffrant d'une insuffisance hépatique sévère.
Losartan Spirig HC est en outre contre-indiqué chez les patients présentant un angioœdème héréditaire ou chez ceux ayant développé un œdème de Quincke lors d'un traitement antérieur par un inhibiteur de l'ECA ou par un antagoniste du récepteur de l'angiotensine II.
Deuxième et troisième trimestre de la grossesse (voir «Mises en garde et précautions» et «Grossesse/Allaitement»).
L’utilisation concomitante de Losartan Spirig HC et de médicaments contenant de l'aliskirène est contre-indiquée chez les patients souffrant de diabète ou d’insuffisance rénale (DFG ˂60 ml/min/1,73 m2).
Mises en garde et précautionsToxicité fœtale
Au cours du deuxième et du troisième trimestre de la grossesse, l'utilisation de médicaments agissant sur le système rénine-angiotensine tels que par exemple Losartan Spirig HC est associée à une réduction de la fonction rénale du fœtus et à une augmentation de la morbi-mortalité fœtale et néonatale. Un oligohydramnios dû au médicament peut être associé à une hypoplasie pulmonaire fœtale et à une déformation du squelette. Les effets indésirables potentiels chez le nouveau-né englobent une hypoplasie crânienne, une anurie, une hypotension, une défaillance rénale et la mort. L'administration de Losartan Spirig HC doit donc être arrêtée le plus rapidement possible dès qu'une grossesse est constatée (voir «Grossesse/Allaitement»).
Hypersensibilité: angioœdème – voir sous «Effets indésirables».
Hypotension et troubles de l'équilibre hydro-électrolytique
Chez les patients présentant une hypovolémie (p.ex. après un traitement avec des diurétiques à hautes doses), il faut prévoir à une chute de tension symptomatique. Dans ce cas, il convient de corriger initialement l'hypovolémie ou de réduire la dose initiale de Losartan Spirig HC (voir «Posologie/Mode d'emploi»).
Des troubles des électrolytes peuvent apparaître chez les patients présentant une insuffisance rénale – avec ou sans diabète – et doivent être pris en compte. Dans le cadre d'une étude clinique réalisée chez des diabétiques de type 2 présentant une protéinurie, l'incidence d'une hyperkaliémie chez les patients traités au losartan était plus élevée que dans le groupe placebo. Mais seuls quelques patients ont interrompu le traitement en raison d'une hyperkaliémie (voir sous «Effets indésirables» et «Résultats de laboratoire»).
L'emploi simultané d'autres médicaments susceptibles d'augmenter le potassium sérique peut entraîner une hyperkaliémie (voir «Interactions»).
Insuffisance hépatique
Des données pharmacocinétiques ont montré une augmentation significative des concentrations plasmatiques de losartan chez les patients cirrhotiques. C'est pourquoi il convient d'envisager une posologie initiale réduite chez les patients dont l'anamnèse révèle des troubles de la fonction hépatique (voir «Posologie/Mode d'emploi» et «Pharmacocinétique»).
Insuffisance rénale
Chez quelques rares patients, on a rapporté des modifications de la fonction rénale, y compris des défaillances rénales, consécutives à l'inhibition du système rénine-angiotensine; ces changements peuvent être réversibles après arrêt du médicament.
Lors de sténose artérielle rénale, il est possible que l'usage du médicament ait pour conséquence une baisse massive de la pression artérielle.
Chez les patients avec insuffisance rénale sévère (clairance à la créatinine <10 ml/min), présentant une hypovolémie, ou traités par de hautes doses de diurétiques, le losartan doit être utilisé avec précaution. La posologie initiale devrait être réduite.
D'autres médicaments exerçant une influence sur le système rénine-angiotensine peuvent entraîner une élévation des valeurs d'uricémie et de la créatininémie chez les patients présentant une sténose uni- ou bilatérale de l'artère rénale. Des effets semblables ont été rapportés pour Losartan Spirig HC; ces altérations de la fonction rénale peuvent être réversibles après arrêt du médicament.
Patients souffrant d'insuffisance cardiaque
L'expérience avec le traitement de patients souffrant d'insuffisance cardiaque NYHA IV est insuffisante. Chez ces patients, le losartan ne devrait être utilisé que sous contrôle strict.
Enfants
L'efficacité et la sécurité du traitement n'ont pas été étudiées chez l'enfant.
Nouveau-nés ayant une anamnèse d'exposition à Losartan Spirig HC in utero
En présence d'une oligurie ou d'une hypotension, il faut veiller au soutien de la tension artérielle et de la circulation rénale. Une exsanguino-transfusion ou une dialyse peut être nécessaire pour corriger une hypotension et/ou substituer la fonction rénale insuffisante.
Utilisation chez les patients âgés
Des études cliniques ont montré l'absence d'effets liés à l'âge en ce qui concerne l'efficacité ou la sécurité du traitement par losartan.
Grossesse
Un traitement aux ARA II ne doit pas être débuté pendant la grossesse. Les patientes qui envisagent une grossesse doivent passer à un traitement antihypertenseur alternatif offrant un profil de sécurité approprié pour la femme enceinte, sauf si une poursuite du traitement par ARA II est indispensable. Si une grossesse est constatée, il faut immédiatement arrêter le traitement par ARA II et commencer au besoin un traitement alternatif (voir «Contre-indications» et «Grossesse/Allaitement»).
«Double blocage» du système rénine-angiotensine-aldostérone
Voir sous «Interactions».
InteractionsLe métabolisme du losartan est soumis à l'influence d'inducteurs et d'inhibiteurs enzymatiques connus.
Dans le cadre d'études cliniques pharmacocinétiques, aucune interaction cliniquement significative n'a été observée avec les substances suivantes: hydrochlorothiazide, digoxine, warfarine, cimétidine, phénobarbital, kétoconazole et érythromycine. Une réduction des taux du métabolite actif a été rapportée pour la rifampicine et le fluconazole. Les conséquences cliniques de cette interaction n'ont pas fait l'objet d'études.
Comme avec d'autres médicaments qui bloquent l'angiotensine II ou ses effets, l'emploi simultané de diurétiques d'épargne potassique (p.ex. la spironolactone, le triamtérène, l'amiloride), de suppléments potassiques, de sels de régime contenant du potassium ou d'autres médicaments susceptibles d'augmenter le potassium sérique (tels que les médicaments contenant du triméthoprime) peuvent provoquer une hausse des taux sériques de potassium.
Comme avec d'autres médicaments qui influencent l'excrétion du sodium, l'excrétion du lithium peut diminuer. C'est pourquoi les taux sériques de lithium doivent faire l'objet d'une surveillance étroite lorsque des sels de lithium sont administrés en même temps que des antagonistes du récepteur de l'angiotensine II.
Le phénobarbital, un inducteur enzymatique, a produit une diminution d'env. 20% de l'AUC du losartan et de son métabolite actif. La cimétidine, un inhibiteur enzymatique, a conduit à une augmentation de 18% de l'AUC du losartan, mais non de son métabolite actif. Ces effets n'ont pas été considérés comme cliniquement significatifs.
Des interactions potentielles du Losartan Spirig HC avec les anticoagulants oraux acénocoumarol et phenprocoumone n'ont pas été étudiées.
Les anti-inflammatoires non stéroïdiens (AINS), y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2), peuvent diminuer l'effet des diurétiques et d'autres médicaments antihypertenseurs. C'est pourquoi l'effet hypotenseur des antagonistes du récepteur de l'angiotensine II ou des inhibiteurs de l'ECA peut diminuer sous l'effet des AINS, y compris des inhibiteurs sélectifs de la COX-2.
Chez les patients présentant une fonction rénale diminuée (par exemple patients âgés ou hypovolémiques, y compris patients sous diurétiques) et traités aux anti-inflammatoires non stéroïdiens, y compris des inhibiteurs sélectifs de la cyclooxygénase 2, l'administration simultanée d'antagonistes du récepteur de l'angiotensine II ou d'inhibiteurs de l'ECA peut provoquer une aggravation supplémentaire de la fonction rénale pouvant aller jusqu'à une éventuelle défaillance rénale aiguë. Ces effets sont habituellement réversibles. Par conséquent, ces associations seront administrées avec prudence chez des patients présentant une fonction rénale diminuée.
Double blocage du système rénine-angiotensine-aldostérone (SRAA)
Il existe des données indiquant que l’utilisation concomitante d’inhibiteurs de l’ECA, d’antagonistes des récepteurs de l’angiotensine II ou de l'aliskirène augmente le risque d’hypotension, d’hyperkaliémie et de diminution de la fonction rénale (y compris une défaillance rénale aiguë). C’est pour cette raison qu’un double blocage du SRAA par l’utilisation concomitante d’inhibiteurs de l’ECA, d’antagonistes des récepteurs de l’angiotensine II ou de l’aliskirène n’est pas recommandé.
Si le traitement par double blocage est considéré comme absolument nécessaire, celui-ci doit avoir lieu exclusivement sous la supervision d’un spécialiste et sous contrôle étroit de la fonction rénale, des valeurs électrolytiques et de la pression artérielle.
Les inhibiteurs de l’ECA et les antagonistes des récepteurs de l’angiotensine II ne doivent pas être utilisés simultanément chez des patients souffrant de néphropathie diabétique.
Le jus de pamplemousse contient des éléments inhibant l'enzyme CYP 450 et susceptibles de diminuer la concentration des métabolites actifs de Losartan Spirig HC, ce qui peut amoindrir l'effet thérapeutique. La consommation de jus de pamplemousse doit être évitée pendant la prise de Losartan Spirig HC.
Grossesse, AllaitementGrossesse
L'utilisation du Losartan Spirig HC n'est pas recommandée pendant le 1er trimestre de la grossesse (voir «Mises en garde et précautions»). Le Losartan Spirig HC est contre-indiqué pendant le deuxième et le troisième trimestre de la grossesse (voir sous «Contre-indications» et «Mises en garde et précautions»). L'administration de Losartan Spirig HC doit être arrêtée le plus rapidement possible dès qu'une grossesse est constatée.
On ne dispose pas de données épidémiologiques définitives concernant le risque tératogène après une exposition aux inhibiteurs de l'ECA au cours du premier trimestre de la grossesse; une légère augmentation du risque ne peut cependant pas être exclue. Bien qu'il n'existe pas de données épidémiologiques contrôlées sur le risque associé aux antagonistes des récepteurs de l'angiotensine II (ARA II), un risque comparable pourrait exister avec cette classe de médicaments. À moins que le traitement par ARA II soit considéré comme nécessaire, les patientes qui envisagent une grossesse doivent passer à un traitement antihypertenseur alternatif offrant un profil de sécurité approprié pour la femme enceinte. Si une grossesse est constatée, il faut immédiatement arrêter le traitement par ARA II et commencer au besoin un traitement alternatif (voir «Mises en garde et précautions»).
Dans les rares cas sans possibilité de traitement alternatif approprié chez la patiente en question, celle-ci doit être informée du risque potentiel pour le fœtus. Des examens échographiques doivent être faits régulièrement pour évaluer l'environnement intra-amniotique. Si un oligohydramnios est détecté, l'administration de Losartan Spirig HC doit être arrêtée, sauf si on estime que le traitement sauve la vie de la mère. Des examens du fœtus peuvent être indiqués, en fonction de la semaine de gestation. La patiente et le médecin doivent être conscients que le fœtus peut déjà avoir subi des dommages irréversibles permanents avant qu'un oligohydramnios soit constatable. Les enfants ayant une anamnèse d'exposition à Losartan Spirig HC in utero doivent être surveillés étroitement à la recherche d'une hypotension, d'une oligurie et d'une hyperkaliémie.
On sait qu'un traitement aux ARA II pendant les deuxième et troisième trimestres de la grossesse entraîne des effets fœtotoxiques (diminution de la fonction rénale, oligohydramnios, retard d'ossification des os du crâne) et une toxicité chez le nouveau-né (défaillance rénale, hypotension, hyperkaliémie) (voir «Données précliniques»).
En cas d'exposition à un Losartan Spirig HC à partir du deuxième trimestre de la grossesse, il est recommandé de contrôler la fonction rénale et le crâne par des examens échographiques.
Ces effets indésirables sont normalement associés à l'utilisation de ce type de médicaments au cours du deuxième et du troisième trimestre de la grossesse. La plupart des études épidémiologiques ayant examiné les anomalies fœtales à la suite d'un traitement antihypertenseur administré pendant le premier trimestre de la grossesse n'ont révélé aucune différence entre les antihypertenseurs agissant sur le système rénine-angiotensine et les autres types d'antihypertenseurs. Le traitement approprié d'une hypertension chez la femme enceinte est important pour optimiser les résultats aussi bien chez la mère que chez le fœtus.
Allaitement
Vu l'absence d'informations disponibles sur l'utilisation de losartan dans la période d'allaitement, le losartan est déconseillé. Il est préférable d'utiliser un traitement antihypertenseur alternatif offrant un profil de sécurité approprié pour la femme qui allaite, surtout dans le cas d'un enfant nouveau-né ou prématuré.
Effet sur l’aptitude à la conduite et l’utilisation de machinesEn raison des effets secondaires possibles, une prudence particulière est de mise lors de la conduite de véhicules et l'utilisation de machines.
Effets indésirablesLes effets indésirables sont répartis en fonction de classes d'organes et mentionnés dans l'ordre décroissant des fréquences: très fréquents (≥1/10), fréquents (≥1/100, <1/10), occasionnels (≥1/1'000, <1/100), rares (≥1/10'000, <1/1'000) et très rares (<1/10'000, y compris des cas isolés rapportés).
Au cours d'études contrôlées chez des patients atteints d'hypertension essentielle, d'hypertrophie du ventricule gauche et d'hypertension artérielle, des patients atteints de diabète de type 2 avec protéinurie et hypertension artérielle ainsi que des patients atteints d'insuffisance cardiaque, les effets indésirables ci-après ont été observés:
Infections et infestations
Fréquents: infections des voies respiratoires supérieures.
Affections psychiatriques
Fréquents: insomnie.
Affections du système nerveux
Très fréquents: céphalées (14%).
Au cours d'une étude contrôlée, menée en double-aveugle, chez des patients atteints d'hypertension artérielle, des céphalées ont été observées chez 14,1% des patients traités au losartan, par rapport à 17,2% des patients dans le groupe sous placebo.
Fréquents: étourdissements..
Au cours d'une étude contrôlée chez des patients atteints d'insuffisance cardiaque (ELITE), des vertiges ont été observés indépendamment de la causalité chez 15,1% des patients traités au losartan et chez 15,4% des patients sous captopril.
Affections de l'oreille et du labyrinthe
Fréquents: vertiges rotatoires.
Affections cardiaques
Fréquents: palpitations, tachycardie.
Affections vasculaires
Fréquents: hypotension artérielle.
Occasionnels: problèmes orthostatiques dépendants de la dose.
Affections respiratoires, thoraciques et médiastinales
Fréquents: toux, pharyngite, nez bouché, troubles du sinus.
Affections gastro-intestinales
Fréquents: diarrhée, nausées, douleurs abdominales, dyspepsie.
Affections de la peau et du tissu souscutané
Occasionnels: éruption cutanée.
Affections musculosquelettiques et du tissu conjonctif
Fréquents: douleurs dorsales, crampes musculaires.
Troubles généraux et anomalies au site d'administration
Fréquents: asthénie/fatigue, œdème/tuméfaction, douleurs thoraciques.
Investigations
Fréquents: hyperkaliémie et protéinurie (voir sous «Mises en garde et précautions», «Hypotension et troubles de l'équilibre hydro-électrolytique»), augmentation du taux d'ALAT.
Les effets indésirables médicamenteux cliniquement importants observés plus souvent chez les patients sous losartan 150 mg que chez les patients sous losartan 50 mg dans l'étude HEAAL («Heart Failure Endpoint Evaluation of Angiotensin II Antagonist Losartan») – (voir «Propriétés/Effets/Efficacité clinique/Etude HEAAL») – ont été: hyperkaliémie, restriction de la fonction rénale, défaillance rénale, hypotension et augmentation des taux sanguins de créatinine, de potassium et d'urée. Ces effets indésirables n'ont cependant pas entraîné un nombre significativement supérieur d'arrêts du traitement dans le groupe des patients sous losartan 150 mg.
Les effets indésirables supplémentaires ci-après ont été annoncés après l'introduction sur le marché (rapports spontanés, pour lesquels il n'est pas possible de donner des indications précises concernant la fréquence):
Affections hématologiques et du système lymphatique
Anémie, thrombocytopénie (rare).
Affections du système immunitaire
De rares cas de réactions anaphylactiques, d'angioœdèmes y compris de gonflements du larynx et de la glotte (à l'origine d'une obstruction des voies respiratoires) et/ou des gonflements du visage, des lèvres, du pharynx et/ou de la langue ont été rapportés chez des patients sous traitement de losartan; quelques-uns de ces patients avaient présenté dans le passé un angioœdème sous d'autres médicaments, y compris des inhibiteurs de l'ECA.
Affections du système nerveux
Migraine, dysgueusie.
Affections vasculaires
Rares: vascularite y compris un purpura de Henoch-Schoenlein.
Affections gastro-intestinales
Vomissements.
Affections hépatobiliaires
Rares: hépatite.
Affections de la peau et du tissu souscutané
Urticaire, prurit, érythrodermie, photosensibilité.
Affections musculosquelettiques et du tissu conjonctif
Myalgie, arthralgie.
Affections des organes de reproduction et du sein
Dysfonction érectile/impuissance.
Troubles généraux et anomalies au site d'administration
Malaise.
Investigations
Troubles de la fonction hépatique.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageConcernant l'administration per os, on a observé une létalité significative chez la souris pour des doses de 1000 mg/kg (3000 mg/m²) et de 2000 mg/kg (11'800 mg/m²) chez le rat, doses qui sont respectivement 500 ou 1000 fois supérieures à celles recommandées chez l'homme (rapportées à un patient de 50 kg).
Les données dont on dispose sur le surdosage du losartan chez l'être humain sont limitées.. Les signes les plus probables d'un surdosage devraient être une chute de la pression artérielle et une tachycardie. Une bradycardie pourrait survenir consécutivement à une stimulation du système parasympathique (stimulation vagale). En cas d'hypotension symptomatique, un traitement de soutien approprié pour stimuler la circulation devrait être administré.
Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse.
Propriétés/EffetsCode ATC
C09CA01
Mécanisme d'action
Le losartan est un antagoniste oral des récepteurs de l'angiotensine II (type AT1). L'angiotensine II se lie au récepteur AT1 que l'on trouve dans de nombreux tissus du corps humain (par ex. la musculature lisse des vaisseaux, les glandes surrénales, les reins et le cœur) où elle produit divers effets biologiques importants comprenant la vasoconstriction et la sécrétion d'aldostérone. L'angiotensine II stimule également la prolifération des cellules musculaires lisses. Des expérimentations biologiques et pharmacologiques ont montré que le losartan se lie sélectivement au récepteur AT1. Le losartan et son métabolite pharmacologiquement actif sous forme d'acide carboxylique (E-3174) bloquent aussi bien in vivo que in vitro tous les effets physiologiques significatifs de l'angiotensine II, indépendamment de son origine ou de son mode de synthèse.
Pharmacodynamique
Lors de l'administration de losartan, l'inhibition du rétrocontrôle négatif de l'angiotensine II sur la sécrétion de rénine conduit à une augmentation de l'activité de la rénine dans le plasma. L'accroissement de l'activité de la rénine plasmatique entraîne une augmentation de l'angiotensine II dans le plasma. En dépit de cette augmentation, l'effet hypotenseur et la diminution de la concentration d'aldostérone dans le plasma sont conservés, ce qui témoigne d'un blocage effectif des récepteurs de l'angiotensine II.
Le losartan se lie sélectivement aux récepteurs AT1; il ne se lie ni ne bloque aucun autre récepteur hormonal ou canal ionique intervenant dans le contrôle des mécanismes cardiovasculaires. L'enzyme de conversion de l'angiotensine (kininase II), qui dégrade la bradykinine n'est pas inhibée par le losartan. Par conséquent, les effets qui ne reposent pas sur le blocage des récepteurs AT1 tels que l'augmentation des effets dus à la bradykinine ou la formation des œdèmes (losartan 1,7%, placebo 1,9%) ne doivent pas être attribués au losartan.
Efficacité clinique
Dans des études cliniques, l'administration d'une dose journalière unique de losartan chez des patients présentant une hypertension essentielle légère à modérée a induit une baisse statistiquement significative de la pression artérielle systolique et diastolique. Dans les études cliniques, cet effet hypotenseur a pu être maintenu durant une période se prolongeant jusqu'à un an. Les mesures de la pression artérielle au terme de l'intervalle posologique (24 heures après la prise) ont montré, comparativement à l'effet maximum (après 5–6 heures), un contrôle stable de la pression au cours des 24 heures. L'effet antihypertenseur correspondait au rythme journalier naturel. L'abaissement de la pression au terme de l'intervalle posologique se maintenait encore à des valeurs correspondant à 70–80% de la baisse obtenue après 5–6 heures. Une interruption du traitement avec le losartan n'a pas entraîné de montée brutale de la pression artérielle. En dépit d'une baisse notable de la pression artérielle, le losartan n'a pas exercé d'effet cliniquement significatif sur la fréquence cardiaque.
Chez des patients non diabétiques présentant une hypertension avec protéinurie, le losartan diminue la protéinurie et l'excrétion fractionelle d'albumine et d’IgG. Le losartan maintient la filtration glomérulaire et réduit la fraction filtrée. Le losartan a entraîné une légère diminution des taux d'urémie, même pendant les traitements prolongés.
Chez des patients présentant une insuffisance cardiaque gauche, des doses de 25 à 50 mg de losartan ont provoqué des réactions hémodynamiques et neuro-hormonales positives telles que l'élévation de l'index cardiaque et l'abaissement de la pression pulmonaire capillaire, de la résistance vasculaire systémique, de la pression artérielle moyenne, de la fréquence cardiaque et des taux sanguins d'aldostérone et de noradrénaline. Chez ces patients insuffisants cardiaques, la survenue d'une hypotension était dépendante de la dose administrée de losartan..
Losartan présente une efficacité comparable chez l'homme et la femme, ainsi que chez les hypertendus jeunes (moins de 65 ans) et âgés (plus de 65 ans). Bien que Losartan provoque une baisse de la pression artérielle chez toutes les races, l'efficacité d'une monothérapie de losartan était cependant en moyenne plus faible chez les patients de couleur noire que chez les Caucasiens à l'instar d'ailleurs des autres médicaments agissant sur le système rénine-angiotensine.
Dans le cadre d'une étude portant sur des patients souffrant d'insuffisance cardiaque (ELITE II), conçue de manière prospective pour la détermination de la mortalité, un traitement avec 50 mg de losartan une fois par jour (dose initiale de 12,5 mg, portée à 25 mg et 50 mg une fois par jour) a été comparé à 50 mg de captopril trois fois par jour (dose initiale de 12,5 mg portée à 25 mg et 50 mg trois fois par jour). Dans le cadre de cette étude, 3'152 patients souffrant d'insuffisance cardiaque (principalement classes NYHA II-III) ont été traités durant près de 2 ans (médiane 1,5 ans), dans le but d'évaluer si le losartan est supérieur au captopril en ce qui concerne la baisse de la mortalité totale. Le critère d'évaluation principal n'a pas montré de différence statistiquement significative entre le losartan et le captopril en ce qui concerne la baisse de la mortalité totale (17,7% pour le losartan et 15,9% pour le captopril, p= 0,16), mais une tendance en faveur du captopril. Il n'a pas été démontré d'équivalence thérapeutique entre les deux traitements.
L'étude portant sur la réduction des valeurs évaluées lors de diabète sucré non insulino-dépendant (DNID) avec l'antagoniste du récepteur de l'angiotensine II losartan (= étude RENAAL) était une étude internationale à grande échelle, randomisée, contrôlée par placebo, menée en double aveugle, multicentrique. Un total de 1'513 diabétiques de type 2 souffrant de protéinurie (751 traités par losartan), majoritairement avec hypertension artérielle (96,5%), ont été inclus. L'objectif de cette étude était de montrer qu'en plus de son effet hypotenseur, le losartan possède un effet protecteur des reins. Pour atteindre cet objectif, l'étude a été planifiée de manière à ce que des valeurs de la tension comparables soient atteintes dans les deux groupes de traitement. Les patients présentant une protéinurie (>0,5 g/dl) et des valeurs de la créatinine sérique situées entre 1,3 et 3,0 mg/dl ont été inclus soit dans le groupe avec le losartan 50 mg une fois par jour, soit dans le groupe placebo, tout en bénéficiant en même temps d'un traitement conventionnel de l'hypertension artérielle. Les inhibiteurs de l'ECA et les antagonistes de l'angiotensine II n'étaient pas permis dans le traitement conventionnel. Les médecins de l'étude devaient, si nécessaire, augmenter la dose du médicament étudié jusqu'à 100 mg une fois par jour; 72% des patients ont reçu la dose quotidienne de 100 mg durant la période de participation à l'étude. D'autres antihypertenseurs (diurétiques, antagonistes du calcium, alpha- ou bêta-bloquants et médicaments agissant sur le système nerveux central) pouvaient être ajoutés dans les deux groupes, si nécessaire. Les patients ont été suivis dans le cadre de l'étude durant 4,6 ans (en moyenne 3,4 ans).
Le critère d'évaluation principal combiné de l'étude était composé de la multiplication par deux de la créatinine sérique, d'une défaillance rénale terminale (dialyse ou transplantation rénale) ou du décès. Les résultats ont montré une réduction du risque de 16,1% (p= 0,022) sous traitement par losartan, par rapport au placebo. Dans le groupe des patients traités par losartan, 327 événements principaux (valeurs évaluées) ont été recensés, par rapport à 359 dans le groupe placebo. Les résultats des composantes individuelles et combinées ci-après du critère d'évaluation principal montrent également une réduction significative du risque dans le groupe de traitement par losartan: réduction du risque de 25,3% en ce qui concerne la multiplication par deux de la créatinine sérique (p= 0,006); réduction du risque de 28,6% en ce qui concerne le stade terminal de l'affection rénale (p= 0,002); réduction du risque de 19,9% en ce qui concerne le stade terminal de l'affection rénale ou le décès (p= 0,009); réduction du risque de 21,0% en ce qui concerne la multiplication par deux de la créatinine sérique ou le stade terminal de l'affection rénale (p= 0,010). Le taux concernant les décès, toutes causes confondues, n'était pas significativement différent entre les deux groupes de traitement.
Les critères d'évaluation secondaires de l'étude étaient les suivants: modification de la protéinurie; taux de progression de l'affection rénale; le critère d'évaluation composite de morbi-mortalité cardio-vasculaire (hospitalisation en raison d'une insuffisance cardiaque, infarctus du myocarde, revascularisation, accident vasculaire cérébral, hospitalisation en raison d'une angine de poitrine instable, ou décès cardiovasculaire). Les résultats ont montré, dans le groupe de traitement par losartan, une réduction moyenne de 34,3% en ce qui concerne l'ampleur de la protéinurie (p <0,001). Au cours de l'étude, le traitement par losartan a provoqué une diminution de 13,9% (p= 0,003) (taux médian de la diminution de 18,5%, p= 0,01) du taux relatif à l'altération de la fonction rénale. Cette valeur a été mesurée comme étant une valeur réciproque de la concentration sérique de créatinine. Pour le critère d'évaluation composite relatif à la morbidité et à la mortalité cardiovasculaire, aucune différence significative entre le groupe de traitement par losartan (247 événements) et le groupe placebo (268 événements) n'a été notée.
Etude LIFE
L'étude interventionnelle avec le losartan sur la réduction des critères d'évaluation lors d'hypertension artérielle (Losartan Intervention For Endpoint Reduction in Hypertension, LIFE) était une vaste étude multicentrique, multinationale, randomisée, menée en triple aveugle et contrôlée activement, incluant 9193 patients hypertendus âgés entre 55 et 80 ans (moyenne 67 ans) présentant une hypertrophie ventriculaire gauche documentée par ECG. Parmi les patients inclus au début de l'étude, 1195 (13%) présentaient un diabète sucré, 1326 (14%) une hypertension systolique isolée, 1468 (17%) une cardiopathie coronarienne et 728 (8%) une affection cérébrovasculaire.
L'objectif de l'étude était de démontrer l'existence d'un effet protecteur cardiovasculaire du losartan par rapport à l'aténolol, dépassant l'effet protecteur obtenu grâce à la baisse de la pression artérielle. La pression artérielle a été mesurée 24 h après l'administration de la dernière dose. Selon la conception de l'étude, une réduction comparable de la pression artérielle devait être obtenue à cette fin dans les deux groupes de traitement. Les patients ont reçu, de manière randomisée, soit le losartan 50 mg ou l'aténolol 50 mg une fois par jour. Lorsque la pression artérielle visée (<140/90 mmHg) n'avait pas été atteinte, de l'hydrochlorothiazide (12,5 mg) était ajouté en premier, puis, le cas échéant, la dose de losartan ou d'aténolol était portée à 100 mg une fois par jour. Si nécessaire, d'autres antihypertenseurs (p.ex. augmentation des doses d'hydrochlorothiazide à 25 mg ou adjonction d'autres diurétiques, d'antagonistes du calcium, d'alpha-bloquants, d'antihypertenseurs à action centrale, mais non des inhibiteurs de l'ECA, des antagonistes de l'angiotensine II ou des β-bloquants) ont été administrés en plus afin d'atteindre la pression artérielle visée.
Dans les deux groupes de traitement, la pression artérielle a été réduite de manière significative jusqu'à des valeurs comparables, et une fraction comparativement importante de patients a atteint la pression artérielle visée. La durée moyenne d'observation était de 4,8 ans.
Le critère d'évaluation principal était la combinaison des cas de morbidité et de mortalité cardiovasculaires et il était mesuré en termes de réduction des événements cardiovasculaires combinés de décès cardiovasculaire, d'accident vasculaire cérébral et d'infarctus du myocarde. Les résultats ont montré que le traitement par le losartan a permis, par rapport à l'aténolol, une réduction du risque de 13,0% (p= 0,021) du critère d'évaluation principal combiné (voir le graphique 1).
La significativité statistique a été démontrée pour la réduction du nombre d'accidents vasculaires cérébraux, alors que les critères d'évaluation associés à la mortalité cardiovasculaire et aux infarctus du myocarde n'étaient pas statistiquement significatifs.
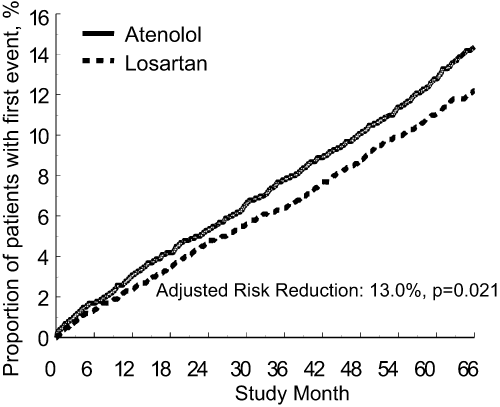
Graphique 1) Courbes de Kaplan-Meier décrivant le critère d'évaluation principal combiné (décès cardiovasculaire, accident vasculaire cérébral ou infarctus du myocarde) dans les groupes traités par le losartan et l'aténolol, ajustées au «Framingham Baseline Risk Score» et au degré d'hypertrophie cardiaque gauche documentée par ECG.
Le traitement par le losartan a réduit le risque d'accident vasculaire cérébral par rapport à l'aténolol de 25% (p= 0,001). Le taux des événements de mortalité cardiovasculaire de et des infarctus du myocarde n'était pas significativement différent entre les groupes de traitement. L'effet du losartan sur le critère d'évaluation combiné principal semblait dépasser l'avantage obtenu grâce à la seule baisse de la pression artérielle (voir le tableau ci-dessous).
|
Critères d'évaluation de l'étude LIFE
| |
Résultat
|
Losartan (N=4605)
n (%)
|
Taux*
|
Aténolol (N=4588)
n (%)
|
Taux *
|
Réduction du risque**
|
Valeur p
| |
Critère d'évaluation combiné principal
|
508 (11 %)
|
23,8
|
588 (13 %)
|
27,9
|
13 %
|
0,021
| |
Composantes du critère d'évaluation combiné principal
| |
Mortalité cardiovasculaire
|
204 (4 %)
|
9,2
|
234 (5 %)
|
10,6
|
11 %
|
0,206
| |
Accident vasculaire cérébral
|
232 (5 %)
|
10,8
|
309 (7 %)
|
14,5
|
25 %
|
0,001
| |
Infarctus du myocarde
|
198 (4 %)
|
9,2
|
188 (4 %)
|
8,7
|
-7 %
|
0,491
|
* Par 1000 années-patients de suivi.
** Ajusté au «Framingham Baseline Risk Score» et aux mesures de l'HVG documentées par ECG.
D'autres critères d'évaluation cliniques de l'étude LIFE étaient: la mortalité totale, les hospitalisations en raison d'une insuffisance cardiaque ou d'une angine de poitrine, des mesures de revascularisation coronarienne ou périphérique ainsi qu'une réanimation après un arrêt cardiaque. Aucune différence significative en termes de fréquences de ces critères d'évaluation entre les groupes de traitement n'a été observée. Les patients traités par le losartan ont montré, par rapport aux patients traités par l'aténolol, une réduction significativement plus élevée des valeurs d'HVG dans l'ECG.
L'effet du losartan par rapport à l'aténolol sur la morbidité et la mortalité cardiovasculaires a été étudié dans des sous-groupes chez des patients atteints de diabète sucré (n= 1195) et présentant une hypertension systolique isolée (n= 1326) dans leurs antécédents. En ce qui concerne principal critère d'évaluation combiné, les résultats de ces sous-groupes correspondaient au résultat favorable du traitement par le losartan de l'ensemble de la population étudiée: chez les diabétiques, une réduction de 24% du risque (p= 0,03) et, chez les patients présentant une hypertension systolique isolée (HSI), une réduction de 25% du risque (p= 0,06) ont été observées.
Différences concernant la couleur de peau
Les résultats favorables sur la morbidité et la mortalité cardiovasculaires du losartan par rapport à l'aténolol, observés au cours de l'étude LIFE, ne sont pas valables pour les patients de couleur de peau noire qui souffrent d'hypertension artérielle et d'hypertrophie ventriculaire gauche, bien que les deux médicaments permettent des baisses efficaces de la pression artérielle chez les patients de couleur de peau noire.
En revanche au cours de l'étude LIFE, le losartan a abaissé, par rapport à l'aténolol, le risque de morbidité et de mortalité cardiovasculaires chez des patients hypertendus non-noirs souffrant d'hypertrophie ventriculaire gauche (n= 8660) de manière significative (p= 0,003) en ce qui concerne le critère d'évaluation principal combiné.
Il s'est avéré que les patients noirs traités par l'aténolol étaient exposés à un risque plus faible d'atteindre le critère d'évaluation principal combiné que les patients noirs traités par le losartan (p= 0,03). Dans le sous-groupe des patients de couleur de peau noire (n= 533; 6% des patients de l'étude LIFE), 29 événements du critère d'évaluation principal ont été observés parmi les 263 patients traités par l'aténolol (11%, 25,9 par 1000 années-patients) contre 46 événements parmi les 270 patients traités par le losartan (17%, 41,8 par 1000 années-patients).
Au cours de l'étude LIFE, une fréquence significativement plus faible des interruptions du traitement en raison d'effets secondaires indésirables a été observée sous le losartan par rapport à l'aténolol.
Etude HEAAL
L'étude HEAAL («Heart Failure Endpoint Evaluation of Angiotensin II Antagonist Losartan») est une étude clinique contrôlée réalisée dans le monde entier auprès de 3834 patients présentant une insuffisance cardiaque (classes NYHA II à IV) et une intolérance aux IECA. Les patients ont été observés pendant plus de 4 ans (durée médiane de 4,7 ans) pour une comparaison des effets du losartan 50 mg versus 150 mg en termes de réduction de la mortalité totale et des hospitalisations dues à l'insuffisance cardiaque. Le losartan 150 mg a permis une réduction significative du risque de mortalité totale et d'hospitalisation pour insuffisance cardiaque en comparaison avec le losartan 50 mg.
PharmacocinétiqueAbsorption
Après administration orale, le losartan est bien absorbé et subit un effet de premier passage au cours duquel se forment un métabolite actif sous forme d'acide carboxylique et d'autres métabolites inactifs. La biodisponibilité des comprimés de losartan se situe aux environs de 33%. Les pics de concentration moyens du losartan sont atteints après 1 heure, ceux du métabolite actif après 3 à 4 heures. Lors de l'absorption simultanée d'un repas normal, on n'a constaté aucune variation cliniquement significative du profil des concentrations plasmatiques.
Distribution
Le losartan comme son métabolite actif sont liés aux protéines plasmatiques dans une proportion de 99% au moins, principalement à l'albumine. Le volume de distribution du losartan est de 34 litres. Des études chez le rat ont montré que le losartan ne traverse pratiquement pas la barrière hémato-encéphalique.
Métabolisme
Environ 14% d'une dose de losartan administrée per os sont transformés en métabolite actif. Des études in vitro montrent que les cytochromes P450 2C9 et 3A4 contribuent à la transformation du losartan en ses métabolites. Chez 1% des patients, cette transformation a été moins importante du fait d'une altération génétique affectant une enzyme particulière (moins de 1% de la dose en comparaison de 14% de la dose pour des patients normaux). Après administration orale de losartan marqué au 14C, la radioactivité circulante dans le plasma est due principalement au losartan et à son métabolite actif.
Outre le métabolite actif, des métabolites inactifs sont également formés parmi lesquels deux principaux par hydroxylation de la chaîne latérale butyle et un autre métabolite, un glucuronide N-2 tétrazole.
Élimination
La clairance plasmatique du losartan est de 600 ml/min, celle du métabolite actif de 50 ml/min. La clairance rénale du losartan est de 74 ml/min, respectivement de 26 ml/min pour le métabolite actif. Lors d'administration orale, 4% environ de la dose restent inchangés, environ 6% de la dose sont éliminés dans l'urine sous forme de métabolite actif. La pharmacocinétique du losartan et de son métabolite actif suit une courbe linéaire jusqu'à des doses de 200 mg.
Après administration orale, les concentrations plasmatiques de losartan et de son métabolite actif diminuent de manière polyexponentielle avec une demi-vie respective d'environ 2 et 6–9 heures. Avec une posologie journalière unique de 100 mg, on n'a pas observé de phénomène significatif d'accumulation du losartan ni de son métabolite actif dans le plasma.
L'élimination du losartan et de ses métabolites est assurée par les voies biliaire et rénale. Après administration orale de losartan marqué au 14C, on retrouve chez l'homme 35% de la radioactivité dans l'urine et 58% dans les selles.
Cinétique pour certains groupes de patients
Chez les patients présentant une cirrhose alcoolique légère à modérée, les concentrations plasmatiques de losartan et de son métabolite actif après prise per os se sont révélées respectivement 5 et 1,7 fois plus élevées que celles mesurées chez des hommes jeunes et sains.
Ni le losartan ni son métabolite actif ne peuvent être éliminés par hémodialyse.
Données précliniquesLes études précliniques – y compris les études conventionnelles concernant la pharmacologie générale, la génotoxicité et le potentiel cancérigène – n'ont révélé aucun risque particulier pour l'homme. Dans les études de toxicité, l'administration répétée de losartan a induit une réduction des paramètres érythrocytaires (taux de globules rouges, hémoglobine, hématocrite), une augmentation du taux sérique d'azote uréique et parfois une augmentation du taux sérique de créatinine, une réduction de la masse cardiaque (sans corrélat histologique) et des altérations gastro-intestinales (lésions des muqueuses, ulcères, érosions, hémorragies). Comme pour d'autres substances influençant le système rénine-angiotensine, on a démontré sous losartan une induction d'effets indésirables sur la phase tardive du développement foetal, conduisant à des malformations et à la mort du foetus.
Remarques particulièresStabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP.» sur le récipient.
Remarques particulières concernant le stockage
Conserver Losartan Spirig HC à l'abri de la lumière dans l'emballage d'origine et à 15–25 °C. Tenir hors de portée des enfants.
Numéro d’autorisation58486 (Swissmedic).
PrésentationLosartan Spirig HC 12.5, comprimés pelliculés: 7 [B]
Losartan Spirig HC 50, comprimés pelliculés (sécables): 28, 98 [B]
Losartan Spirig HC 100, comprimés pelliculés (sécables): 28, 98 [B]
Titulaire de l’autorisationSpirig HealthCare SA, 4622 Egerkingen/Suisse.
Mise à jour de l’informationMai 2022.
|

