Propriétés/EffetsCode ATC
A10AE56
Mécanisme d'action
Xultophy est un médicament combiné composé d'insuline dégludec et de liraglutide, possédant un mécanisme d'action complémentaire permettant d'améliorer la glycémie.
L'insuline dégludec est une insuline basale qui forme des multi-hexamères solubles après injection sous-cutanée, ce qui entraîne un dépôt à partir duquel l'insuline dégludec est lentement absorbée en continu dans la circulation. Cela entraîne un effet hypoglycémiant faible et stable de l'insuline dégludec, qui ne varie que très peu d'un jour à l'autre.
L'insuline dégludec se lie spécifiquement au récepteur de l'insuline humaine et a donc les mêmes effets pharmacologiques que l'insuline humaine.
L'effet hypoglycémiant de l'insuline dégludec est dû à la liaison de l'insuline aux récepteurs des cellules musculaires et adipeuses, facilitant ainsi l'assimilation du glucose, et à l'inhibition simultanée de la production hépatique de glucose.
Le liraglutide est un «glucagon-like peptide-1» (GLP-1) présentant une homologie de séquence de 97% avec le GLP-1 humain, qui se lie au récepteur du GLP-1 (GPL-1R) et qui l'active. Dans le cas de l'administration sous-cutanée, le délai existant avant le pic d'action est dû à trois mécanismes: l'auto-association, qui entraîne un ralentissement de la résorption, la liaison à l'albumine, ainsi que l'augmentation de la stabilité enzymatique par rapport aux enzymes dipeptidyl-peptidase-4 (DPP-4) et endopeptidase neutre (NEP), qui provoque un allongement de la demi-vie plasmatique.
L'effet du liraglutide est médié par une interaction spécifique avec les récepteurs du GLP-1, qui mène à une augmentation du taux d'AMPc. Le liraglutide stimule la sécrétion d'insuline de façon glucose-dépendante. Le liraglutide diminue également la sécrétion excessive de glucagon de façon glucose-dépendante. Par conséquent, en cas de glycémie élevée, la sécrétion d'insuline est stimulée et la sécrétion de glucagon est freinée. À l'inverse, en cas d'hypoglycémie, le liraglutide diminue la sécrétion d'insuline mais n'a pas d'effet sur la sécrétion de glucagon. Le mécanisme hypoglycémiant induit, en outre, un léger retard de la vidange gastrique. Grâce à des mécanismes permettant de réduire la sensation de faim et l'absorption d'énergie, le liraglutide entraîne une diminution du poids et de la masse de graisse corporels.
Le GLP-1 est un régulateur physiologique de l'appétit et de la prise alimentaire. Les récepteurs du GLP-1 (GLP-1R) sont présents dans diverses régions du cerveau impliquées dans la régulation de l'appétit. Des études chez l'animal ont montré qu'après administration périphérique, le liraglutide est absorbé dans les régions du cerveau impliquées dans la régulation de l'appétit, p.ex. l'hypothalamus. L'activation des récepteurs du GLP-1 dans ces régions du cerveau a augmenté la satiété et diminué les principaux signaux de la faim, ce qui a entraîné une perte de poids.
Les récepteurs du GLP-1 se trouvent également à des endroits précis du cœur, du système vasculaire, du système immunitaire et des reins. Des études effectuées chez l'homme et l'animal ont montré que l'activation de ces récepteurs par le liraglutide peut induire des effets cardiovasculaires et microvasculaires, y compris une réduction des inflammations. Dans des études effectuées chez l'animal, le liraglutide a inhibé le développement de l'athérosclérose.
Par ailleurs, des études effectuées chez l'animal ont montré que le liraglutide induisait une réduction significative des lésions de la plaque de l'aorte. Cependant, le liraglutide n'a montré aucune inhibition sur le développement ultérieur de la plaque de l'aorte ni aucun effet sur les plaques existantes. De plus, le liraglutide a induit une diminution de l'inflammation des tissus environnants et a eu un effet positif sur les lipides plasmatiques.
Pharmacodynamique
La durée d'action de l'insuline dégludec et du liraglutide permet d'administrer Xultophy une fois par jour indépendamment des heures de repas.
Xultophy améliore le contrôle glycémique en diminuant de façon prolongée la glycémie à jeun et postprandiale après tous les repas. Ces effets permettent de contrôler la glycémie pendant toute la journée, y compris au moment des pics glycémiques postprandiaux.
Efficacité clinique
La sécurité et l'efficacité de Xultophy ont été évaluées dans six études de phase 3 randomisées, contrôlées et menées en groupes parallèles chez des adultes atteints de diabète sucré de type 2 et divers prétraitements antihyperglycémiques. Les thérapies comparatives étaient l'insuline basale, la thérapie avec l'agoniste des récepteurs GLP-1, le placebo et la thérapie selon le schéma bolus-basal. La durée de l'étude était de ≥26 semaines, avec 199 à 833 patients dans le groupe Xultophy. Xultophy a été titré deux fois par semaine dans toutes les études (voir tableau 2). Le même algorithme de titrage a été appliqué dans le groupe de comparaison avec l'insuline basale.
Tableau 2: titration de Xultophy et de l'insuline basale
|
Glucose plasmatique mesuré avant le petit-déjeuner*
|
Adaptation de la dose
(deux fois par semaine)
| |
mmol/l
|
mg/dl
|
Xultophy (doses unitaires)
| |
<4.0
|
<72
|
-2
| |
4.0–5.0
|
72–90
|
0
| |
>5.0
|
>90
|
+2
|
* Glucose plasmatique mesuré par le patient
Xultophy utilisé en association avec la metformine
L'efficacité et la sécurité de Xultophy par rapport à l'insuline dégludec et le liragultide, administrés tous une fois par jour, ont été évaluées dans le cadre d'une étude treat-to-target, ouverte, contrôlée, randomisée, de 26 semaines, chez des patients atteints du diabète de type 2, avec une prolongation de 26 semaines. La dose initiale de Xultophy et d'insuline dégludec se montait à 10 doses unitaires ou 10 unités, la dose ayant été titrée deux fois par semaine conformément au tableau 2 ci-dessus.
Chez les patients sous liraglutide, la dose a été augmentée de manière fixe, avec une dose initiale de 0.6 mg et une hausse hebdomadaire de la dose de 0.6 mg, jusqu'à l'obtention d'une dose d'entretien de 1.8 mg. La dose maximale de Xultophy était de 50 doses unitaires, alors qu'aucune dose maximale n'a été fixée pour l'insuline dégludec. Une partie des patients (140/833) a reçu de la pioglitazone en plus de Xultophy et de la metformine.
Les principaux résultats de l'étude figurent dans le Tableau 3 et sur la Figure 1.
Tableau 3: Résultats d'une étude de 26 semaines portant sur Xultophy chez des patients présentant un contrôle glycémique insuffisant sous metformine seule ou associée à de la pioglitazone
|
|
Traitement précédent par met ± pioglitazone
| |
Xultophy
|
Insuline dégludec
|
Liraglutide
| |
N
|
833
|
413
|
414
| |
HbA1c (%)
|
|
|
| |
Valeur de base → fin de l'étude
|
8.3 → 6.4
|
8.3 → 6.9
|
8.3 → 7.0
| |
Modification moyenne
|
-1.91
|
-1.44
|
-1.28
| |
Différence estimée
|
|
-0.47AB
[-0.58; -0.36]
|
-0.64AB
[-0.75; -0.53]
| |
Nombre de cas confirmés d'hypoglycémie* par patient-année d'exposition (pourcentage de patients)
|
1.80 (31.9%)
|
2.57 (38.6%)
|
0.22 (6.8%)
| |
Nombre estimé
|
|
0.68AC
[0.53; 0.87]
|
7.61B
[5.17; 11.21]
| |
Poids corporel (kg)
|
|
|
| |
Valeur de base → fin de l'étude
|
87.2 → 86.7
|
87.4 → 89.0
|
87.4 → 84.4
| |
Modification moyenne
|
-0.5
|
1.6
|
-3.0
| |
Différence estimée
|
|
-2.22AB
[-2.64; -1.80]
|
2.44B
[2.02; 2.86]
| |
Augmentation postprandiale du glucose (mmol/l) Test au moment des repas (moyenne sur 4 heures)
|
|
|
| |
Valeur de base → fin de l'étude
|
4.11 → 3.22
|
4.12 → 3.95
|
4.12 → 3.36
| |
Modification moyenne
|
-0.87
|
-0.17
|
-0.78
| |
Différence estimée
|
|
-0.71AC
[-1.17; -0.26]
|
-0.09
[-0.56; 0.37]
| |
Dose à la fin de l'étude
|
|
|
| |
Insuline dégludec (unités)
|
38
|
53
|
-
| |
Liraglutide (mg)
|
1.4
|
-
|
1.8
| |
Différence estimée, dose d'insuline dégludec
|
|
-14.90AB
[-17.14; -12.66]
|
|
La valeur de base, la fin de l'étude et la modification moyenne sont considérées comme «Last observation carried forward» (LOCF). L'intervalle de confiance de 95% figure entre crochets: [].
* L'hypoglycémie confirmée était définie par une hypoglycémie sévère (épisode nécessitant qu'une tierce personne aide le patient) et/ou une hypoglycémie légère (glucose plasmatique <3.1 mmol/l, quels que soient les symptômes).
** Le test réalisé au moment des repas a été mené lors d'une étude partielle comprenant 260 patients dont la glycémie n'était pas suffisamment contrôlée par le traitement par metformine ± pioglitazone (131 patients ont été traités par Xultophy, 64 par l'insuline dégludec et 65 par le liraglutide).
A Critères avec supériorité confirmée de Xultophy vs substance de comparaison
B p<0.0001
C p<0.05
Le pourcentage d'hypoglycémies confirmées était plus faible avec Xultophy qu'avec l'insuline dégludec, quel que soit le contrôle glycémique. Voir Figure 1.
Fig.1a
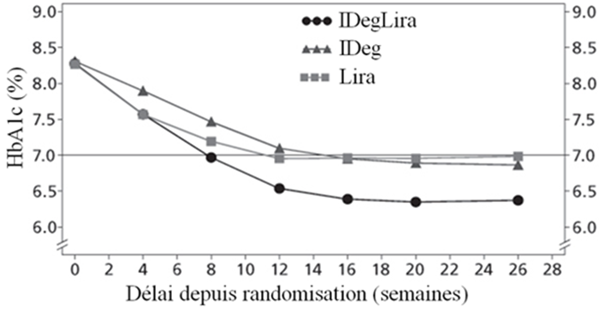
Fig. 1b
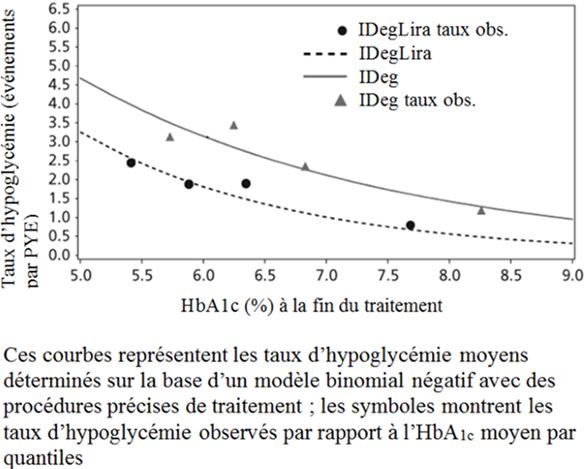
Fig. 1c

Fig. 1d

IDegLira =Xultophy, IDeg = insuline dégludec, Lira = liraglutide, taux obs. = taux observé, PYE = patient-année d'exposition
Figure 1: Taux moyen de l'HbA1c (%) selon le nombre de semaines de traitement (Fig. 1a), nombre d'hypoglycémies confirmées par patient-année d'exposition par rapport au taux moyen de l'HbA1c (%) (Fig. 1b), modification moyenne du poids corporel selon le nombre de semaines de traitement (Fig. 1c) et nombre moyen cumulé d'événements d'hypoglycémie selon le nombre de semaines de traitement (Fig. 1d)
Le taux par année-patient sous exposition (pourcentage des patients) d'hypoglycémies sévères, définies comme étant des épisodes ayant nécessité de l'aide de tierces personnes, était de 0.01 (2 patients sur 825) pour Xultophy, de 0.01 (2 patients sur 412) pour l'insuline dégludec et de 0.00 (0 patients sur 412) pour le liraglutide.
Le taux d'hypoglycémies nocturnes était semblable sous le traitement par Xultophy et par l'insuline dégludec malgré le taux de l'HbA1c plus faible pour Xultophy par rapport à l'insuline dégludec.
Globalement, les patients traités par Xultophy présentaient moins d'effets indésirables gastro-intestinaux que les patients traités par liraglutide mais plus que ceux sous insuline dégludec. Cette différence pourrait être due à une hausse plus lente de la dose de la composante liraglutide au début du traitement avec Xultophy par rapport à une thérapie au liraglutide seul.
Données à long terme (52 semaines)
L'efficacité et la sécurité de Xultophy se sont maintenues pendant les 52 semaines de traitement. La diminution d'HbA1c entre la valeur de base et la semaine 52 était, pour Xultophy, de 1.84% et la différence entre les traitements a été estimée à -0.65% [-0.76; -0.53]IC à 95% par rapport au liraglutide et à -0.46% [-0.57; -0.34]IC à 95% par rapport à l'insuline dégludec. Le poids corporel a diminué de 0.4 kg, la différence entre Xultophy et l'insuline dégludec étant estimée à -2.80 kg. Le taux d'hypoglycémies confirmées était de 1.8 événements par patient-année pour Xultophy et de 2.8 événements pour l'insuline dégludec avec une différence entre les traitements estimée de 0.63 [0.50; 0.79]IC à 95%.
Utilisation de Xultophy en association avec une sulfonylurée seule ou combinée avec de la metformine
L'efficacité et la sécurité de Xultophy, administré en association avec une sulfonylurée seule ou combinée avec de la metformine, ont fait l'objet d'une étude «treat-to-target» de 26 semaines, randomisée, en double aveugle, contrôlée par placebo et comprenant 435 patients, dont 289 étaient traités par Xultophy. 259 patients sur 289 ont reçu Xultophy plus de la metformine plus des sulfonylurées, 30 patients sur 289 Xultophy plus des sulfonylurées sans metformine. La dose initiale de Xultophy était de 10 doses unitaires et la dose a été titrée deux fois par semaine, comme indiqué dans le Tableau 2 ci-dessus, avec une cible de titration située entre 4 et 6 mmol/l.
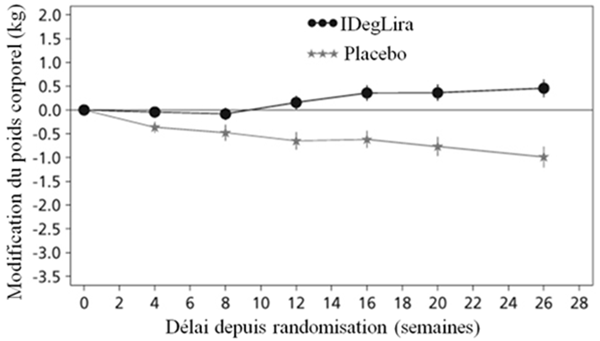
La diminution du taux initial d'HbA1c était de -1.45%, passant ainsi de 7.9% à 6.4% pour Xultophy; la diminution du taux initial d'HbA1c était de -0.46%, passant ainsi de 7.9% à 7.4% pour le placebo et la différence entre les traitements a été estimée à -1.02% [-1.18; -0.87] IC à 95% (voir Figure 2).
Fig. 2a
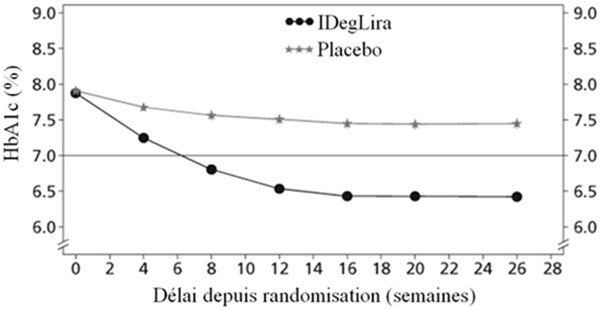
Fig. 2b
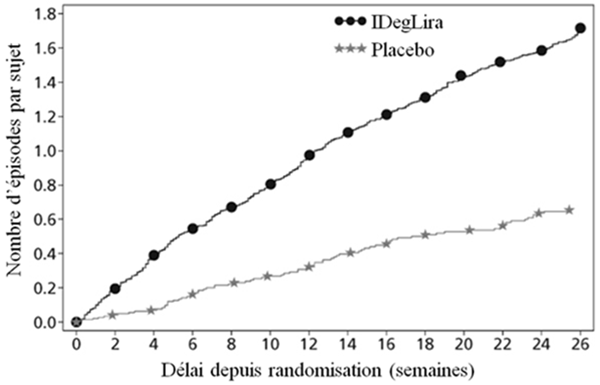
Fig. 2c
IDegLira = Xultophy
Figure 2: HbA1c moyenne (%) selon le nombre de semaines de traitement (Fig. 2a), nombre cumulé moyen d'événements d'hypoglycémie (Fig. 2b) et modification moyenne du poids corporel selon le nombre de semaines de traitement (Fig. 2c) chez des patients présentant un contrôle glycémique insuffisant sous SU±Met
41.7% des patients sous Xultophy et 17.1% des patients sous placebo ont subi au moins un épisode d'hypoglycémie confirmée au cours de l'étude. Cela correspond à un taux d'hypoglycémie estimé de 3.52 par patient-année sous Xultophy vs. 1.35 sous placebo. Les patients traités par Xultophy ont connu une prise de poids corporel moyenne de 0.5 kg tandis que les patients du groupe placebo ont perdu, en moyenne, 1.0 kg (différence estimée entre traitements: 1.48 kg; [0.90; 2.06]IC à 95%).
La dose moyenne de Xultophy était de 28 doses unitaires à la fin de l'étude, ce qui correspond à 28 unités d'insuline dégludec et 1.0 mg de liraglutide.
En ajout aux iSGLT2 seuls ou en association avec la metformine: Xultophy par rapport à l'insuline glargine U100
Dans un essai en ouvert comparant l'efficacité et la sécurité de Xultophy et de l'insuline glargine U100 en ajout aux iSGLT2 ± ADO, Xultophy était supérieur à l'insuline glargine en termes de réduction de l'HbA1c moyenne après 26 semaines. Une réduction de 1.9% (de 8.2% à 6.3%) a été obtenue avec Xultophy et de 1.7% (de 8.4% à 6.7%) avec l'insuline glargine, correspondant à une différence de traitement estimée à -0.36% [-0.50; -0.21].
Comparativement à la valeur initiale, Xultophy n'a pas entraîné de changement au niveau du poids corporel moyen alors qu'une augmentation du poids moyen de 2,0 kg a été observée chez les patients traités par l'insuline glargine (différence de traitement estimée à -1.92 kg [IC à 95%: -2.64; -1.19]). Le pourcentage de patients ayant présenté une hypoglycémie sévère ou symptomatique confirmée par une glycémie était de 12.9% dans le groupe Xultophy et de 19.5% dans le groupe de l'insuline glargine (le ratio estimé était de 0.42 [IC à 95%: 0.23; 0.75]). La dose journalière moyenne d'insuline à la fin de l'essai était de 36 unités pour les patients traités avec Xultophy et de 54 unités pour les patients traités avec l'insuline glargine.
Xultophy en remplacement d'une thérapie par des agonistes du récepteur du GLP-1
L'efficacité et la sécurité de Xultophy (une fois par jour) par rapport à une thérapie inchangée à un agoniste du récepteur du GLP-1 (posologie selon la notice d'emballage) ont été examinées dans le cadre d'une étude randomisée de 26 semaines, menée en ouvert, treat-to-target, chez des patients atteints du diabète de type 2 qui présentaient un contrôle glycémique insuffisant sous un agoniste du récepteur du GLP-1 et la metformine (Met) seule (74.2%) ou en association avec la pioglitazone (2.5%), des sulfonylurées (21.2%) ou les deux.
La dose initiale de Xultophy et de l'insuline dégludec était de 16 doses unitaires (16 unités d'insuline dégludec et 0.6 mg de liraglutide) et la dose a été titrée deux fois par semaine selon le tableau 2. Les patients du bras de l'agoniste du récepteur du GLP-1 ont poursuivi leur traitement aux agonistes du récepteur du GLP-1 comme avant l'étude.
Les résultats de l'étude sont présentés dans le tableau 4 et la figure 3.
Tableau 4: Résultats d'une étude de 26 semaines avec Xultophy chez des patients atteints du diabète de type 2 avec un contrôle glycémique insuffisant sous des agonistes du récepteur du GLP-1
|
|
Traitement antérieur à l'agoniste du récepteur du GLP-1
| |
Xultophy
|
Agoniste du récepteur du GLP-1
| |
N
|
292
|
146
| |
HbA1c (%)
|
|
| |
Valeur initiale → fin de l'étude
|
7.8 → 6.4
|
7.7 → 7.4
| |
Modification moyenne
|
-1.3
|
-0.3
| |
Différence évaluée
|
|
-0.94AB
[-1.11; -0.78]
| |
Patients (%) ayant obtenu une HbA1c <7%
|
|
| |
Tous les patients
|
75.3
|
35.6
| |
Odds-Ratio estimé
|
|
6.84B
[4.28; 10.94]
| |
Patients (%) ayant obtenu une HbA1c <6.5%
|
|
| |
Tous les patients
|
63.0
|
22.6
| |
Odds-Ratio estimé
|
|
7.53B
[4.58; 12.38]
| |
Nombre d'hypoglycémies confirmées* par patient- année sous exposition (fraction en pour-cent de patients)
|
2.82 (32.0%)
|
0.12 (2.8%)
| |
Nombre estimé
|
|
25.36B
[10.63; 60.51]
| |
Poids corporel (en kg)
|
|
| |
Valeur initiale → fin de l'étude
|
95.6 → 97.5
|
95.5 → 94.7
| |
Modification moyenne
|
2.0
|
-0.8
| |
Différence estimée
|
|
-2.89B
[2.17; 3.62]
| |
GAJ (mmol/l)
|
|
| |
Valeur initiale → fin de l'étude
|
9.0 → 6.0
|
9.4 → 8.8
| |
Modification moyenne
|
-2.98
|
-0.60
| |
Différence estimée
|
|
-2.64B
[-3.03; -2.25]
| |
Dose à la fin de l'étude
|
|
| |
Insuline dégludec (unités)
|
43
|
| |
Liraglutide (mg)
|
1.6
|
La dose de l'agoniste du récepteur du GLP-1 a été maintenue sans être modifiée par rapport à la valeur initiale
| |
Différence estimée, dose d'insuline dégludec
|
|
Valeur initiale, fin de l'étude et modification moyenne ont été notées comme „Last observation carried forward” (LOCF). L'intervalle de confiance à 95% est indiqué entre «[]».
* Hypoglycémie confirmée définie comme hypoglycémie sévère (épisode nécessitant l'aide d'une tierce personne) et/ou hypoglycémies modérées (glucose plasmatique <3.1 mmol/l, indépendamment de symptômes).
A Critères d'évaluation avec supériorité confirmée de Xultophy vs. substance de comparaison
B p<0.001
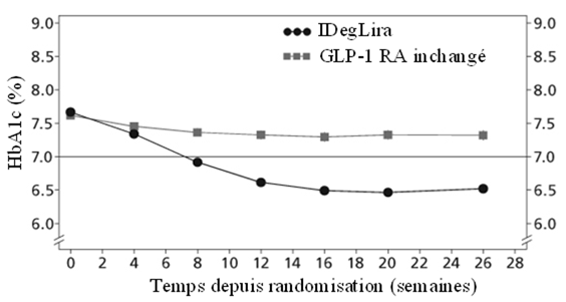
IDegLira=Xultophy, GLP-1 RA= Agoniste des récepteurs du GLP-1
Figure 3: HbA1c (%) moyenne en fonction du nombre de semaines de traitement chez des patients atteints du diabète sucré de type 2 avec contrôle glycémique insuffisant sous agonistes du récepteur du GLP-1.
Le nombre d'hypoglycémies sévères confirmées par patient-année sous exposition (fraction en pourcent de patients) était de 0.01 (1 patient sur 291) pour Xultophy et de 0.00 (0 patients sur 199) pour les agonistes du récepteur du GLP-1.
Intensification de l'insulinothérapie basale par le passage à Xultophy
Comparaison avec la thérapie selon le schéma bolus basal
L'efficacité et la sécurité de Xultophy par rapport à un schéma insulinique basal-bolus composé d'insuline glargine 100 U en combinaison avec de l'insuline asparte prise au moment des repas principaux ont été étudiées dans un essai randomisé, mené en ouvert, «treat-to-treat», d'une durée de 26 semaines, chez des patients diabétiques de type 2 n'ayant pas obtenu un contrôle glycémique adéquat sous insuline glargine 100 U (20 à 50 unités) et metformine. La dose initiale de Xultophy était de 16 doses unitaires. Dans le bras de l'essai du schéma basal-bolus, la dose initiale d'insuline glargine 100 U correspondait à la dose quotidienne avant l'étude et la dose initiale d'insuline asparte liée au repas était de 4 unités avant les repas principaux. Les doses de Xultophy et d'insuline glargine 100 U ont été titrées deux fois par semaine selon le tableau 2, tandis que l'insuline asparte liée au repas a été titrée deux fois par semaine selon les mesures de la glycémie effectuées par les patients (SMPG) durant les trois jours précédents. La dose quotidienne maximale pour Xultophy était de 50 doses unitaires, tandis qu'il n'y avait pas de dose maximale pour l'insuline glargine 100 U et l'insuline asparte.
Les principaux résultats de l'essai sont mentionnés dans le Tableau 5 et la Figure 4.
Dans le groupe Xultophy ou du schéma basal-bolus, après 26 semaines de traitement, 57.6% et 33.5% des patients respectivement ont atteint une valeur cible d'HbA1c de <7% sans épisodes hypoglycémiques symptomatiques graves ou confirmés (p<0.0001).
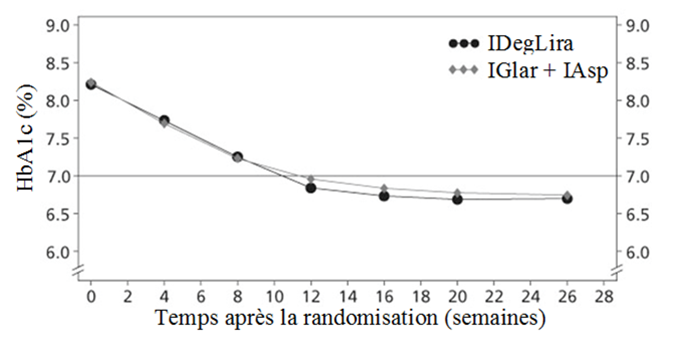
IDegLira = Xultophy, IGlar + IAsp = insuline glargine 100 U + insuline asparte
Figure 4 HbA1c moyenne (%) par semaine de traitement chez des patients diabétiques de type 2 n'ayant pas obtenu un contrôle glycémique adéquat sous insuline glargine 100 U
Le taux d'hypoglycémies sévères par patient-année d'exposition était de 0.02 (3 patients sur 252) pour Xultophy et de 0.08 (4 patients sur 253) pour le schéma basal-bolus.
Le taux d'évènements d'hypoglycémie grave, symptomatique et nocturne sévère ou confirmée était statistiquement significativement plus faible avec Xultophy qu'avec le schéma basal-bolus (taux lié au traitement estimé à 0.08, p <0.0001).
Tableau 5: Résultats d'un essai d'une durée de 26 semaines avec Xultophy chez des patients atteints de diabète sucré de type 2 n'ayant pas obtenu un contrôle glycémique adéquat sous insuline glargine 100 U
|
|
Xultophy
|
Basal-bolus
(insuline glargine + insuline asparte)
| |
n
|
252
|
254
| |
HbA1c (%)
|
|
| |
Valeur initiale → Fin de l'étude
|
8.2→6.7
|
8.2→6.7
| |
Changement moyen
|
-1.49
|
-1.48
| |
Différence estimée
|
|
-0.02A [-0.16;-0.12]
| |
Patients (%) ayant obtenu une HbA1c <7%
|
|
| |
Tous les patients
|
66.0
|
67.0
| |
Odds ratio estimé
|
|
0.91 [0.62; 1.33]
| |
Patients (%) ayant obtenu une HbA1c <6,5%
|
|
| |
Tous les patients
|
49.6
|
44.6
| |
Odds ratio estimé
|
|
1.26 [0.88; 1.82]
| |
Taux d'hypoglycémies* par patient-année d'exposition (pourcentage de patients)
|
|
| |
Taux estimé
|
1.07 (19.8%)
|
8.17 (52.6%)
0.11B [0.08; 0.17]
| |
Poids corporel (kg)
|
|
| |
Valeur initiale → Fin de l'étude
|
87.2→85.8
|
88.2→90.7
| |
Changement moyen
|
-0.9
|
2.6
| |
Différence estimée
|
|
-3.57B [-4.19; -2.95]
| |
Glycémie à jeun (mmol/l)
|
|
| |
Valeur initiale → Fin de l'étude
|
8.5→6.1
|
8.3→6.4
| |
Changement moyen
|
-2.35
|
-1.88
| |
Différence estimée
|
|
-0.31 [-0.67; 0.05]
| |
Dose à la fin de l'étude
|
|
| |
Insuline dégludec (unités)
|
40
|
| |
Liraglutide (mg)
|
1.4
|
| |
Insuline glargine (unités)
|
|
52
| |
Insuline asparte (unités)
|
|
32
| |
Différence estimée, dose totale d'insuline
|
|
-44.5 [-48.3; -40.7]
| |
Différence estimée, dose d'insuline basale
|
|
-12.6 [-14.9; -10.3]
|
Aucune imputation pour les données manquantes. L'intervalle de confiance de 95% figure entre crochets: [].
* L'hypoglycémie symptomatique grave ou confirmée par la glycémie se définit comme un épisode nécessitant l'aide d'une tierce personne qui administre activement des glucides ou du glucagon ou qui effectue d'autres actions correctives, ou comme un épisode confirmé par une glycémie de <3.1 mmol/l (56 mg/dl) et associé aux symptômes typiques de l'hypoglycémie.
A Non-infériorité confirmée de Xultophy par rapport au produit de comparaison (intervalle de 0.3%). p <0.0001
B Supériorité confirmée de Xultophy par rapport au produit de comparaison. p <0.0001.
Comparaison avec l'insulinothérapie basale optimisée
L'efficacité et la sécurité de Xultophy ont été étudiées par rapport à l'insuline glargine, administrés tous deux une fois par jour, dans un essai randomisé, mené en ouvert, «treat-to-target», d'une durée de 26 semaines, chez des patients diabétiques de type 2 n'ayant pas obtenu un contrôle glycémique adéquat sous insuline glargine (20 à 50 unités) et metformine. La dose initiale de Xultophy était de 16 doses unitaires et la dose initiale de l'insuline glargine était égale à la dose quotidienne antérieure à l'essai. Une titration de la dose dans chaque bras a eu lieu deux fois par semaine conformément au Tableau 2. La dose maximale autorisée était de 50 doses unitaires pour Xultophy tandis qu'il n'y avait pas de dose maximale pour l'insuline glargine.
Les principaux résultats de l'essai sont mentionnés dans le Tableau 5 et la Figure 5.
54.3% des patients traités avec Xultophy ont atteint le taux cible de HbA1c <7% sans épisode d'hypoglycémie confirmée, contre 29.4% des patients traités avec l'insuline glargine (odds ratio à 3.24, p <0.001).
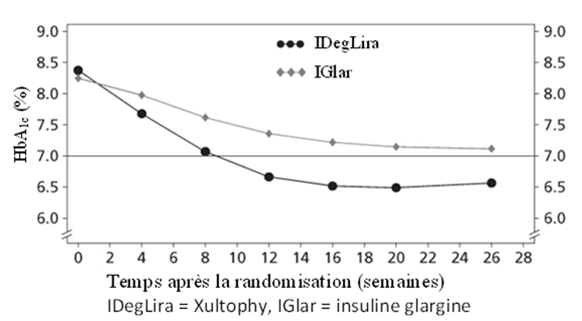
Figure 5 - HbA1c moyenne (%) selon la semaine de traitement chez des patients diabétiques de type 2 n'ayant pas obtenu un contrôle glycémique adéquat sous insuline glargine
Le taux d'hypoglycémies sévères par patient-année d'exposition (pourcentage de patients) était de 0.00 (0 patient sur 278) avec Xultophy et de 0.01 (1 patient sur 279) avec l'insuline glargine. Le taux d'évènements d'hypoglycémie nocturne était significativement plus bas avec Xultophy par rapport à l'insuline glargine (taux lié au traitement estimé à 0.17, p <0.001).
L'efficacité et la sécurité de Xultophy ont été comparées à celles de l'insuline dégludec (tous les deux administrés une fois par jour) dans une étude «treat-to-target» randomisée, en double aveugle, de 26 semaines. Cette étude comprenait des patients présentant un diabète de type 2 et un contrôle glycémique insuffisant sous insuline basale (20 à 40 unités) et metformine (Met) seule ou associée à des sulfonylurées/glinides. L'insuline basale et les sulfonylurées/glinides ont été arrêtées au moment de la randomisation.
La dose initiale de Xultophy et d'insuline dégludec était de 16 doses unitaires ou, respectivement, 16 unités, et la dose a été titrée deux fois par semaine comme indiqué dans le Tableau 2. La dose maximale autorisée était de 50 doses unitaires pour Xultophy et de 50 unités pour l'insuline dégludec.
Les résultats concernant le critère d'évaluation principal de l'étude, ainsi que la dose d'insuline et l'incidence de l'hypoglycémie, sont résumés dans le Tableau 5 et la Figure 6.
Un total de 48.7% des patients a obtenu un taux-cible de l'HbA1c <7% sans épisodes hypoglycémiques confirmés; cette fraction était significativement plus importante que chez les patients traités par l'insuline dégludec (15.6%, odds ratio 5.57; p<0.0001).
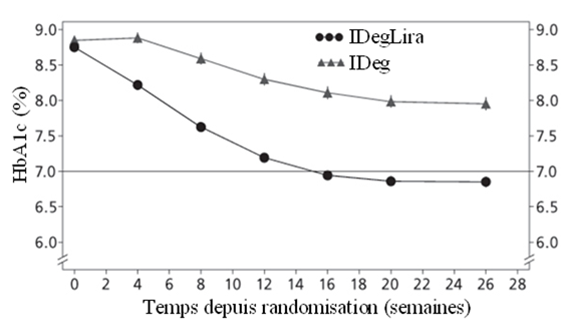
Figure 6: HbA1c moyen (%) selon le nombre de semaines de traitement chez des patients présentant un contrôle glycémique insuffisant sous insuline basale.
Tableau 6 - Résultats de deux essais d'une durée de 26 semaines avec Xultophy chez des patients diabétiques de type 2 n'ayant pas obtenu un contrôle glycémique adéquat sous insuline glargine (gauche) ou sous insuline basale (droite)
|
|
Traitement antérieur par insuline glargine
|
Traitement antérieur, par insuline basale (NPH, insuline détémir, insuline glargine)
| |
|
Xultophy
|
Insuline glargine, sans limitation des doses
|
Xultophy
|
Insuline dégludec, 50 unités au maximum autorisées
| |
N
|
278
|
279
|
199
|
199
| |
HbA1c (%)
|
|
|
|
| |
Début→Fin de l'étude
|
8.4→6.6
|
8.2→7.1
|
8.7→6.9
|
8.8→8.0
| |
Changement moyen
|
-1.81
|
-1.13
|
-1.90
|
-0.89
| |
Différence estimée
|
|
-0.59AB
[-0.74; -0.45]
|
|
-1.05AB
[-1.25; -0.84]
| |
Patients (%) atteignant un taux de HbA1c <7%
|
|
|
|
| |
Tous les patients
|
71.6
|
47.0
|
|
| |
Odds ratio estimé
|
|
3.45B
[2.36; 5.05]
|
|
| |
Taux d'hypoglycémies confirmées par patient-année d'exposition (pourcentage de patients)
|
2.23 (28.4%)
|
5.05 (49.1%)
|
1.53 (24.1%)
|
2.63 (24.6%)
| |
Taux estimé
|
|
0.43AB
[0.30;0.61]
|
|
0.66
[0.39; 1.13]
| |
Poids (kg)
|
|
|
|
| |
Début→Fin de l'étude
|
88.3→86.9
|
87.3→89.1
|
|
| |
Changement moyen
|
-1.4
|
1.8
|
|
| |
Différence estimée
|
|
-3.20AB
[-3.77; -2.64]
|
|
| |
Glycémie à jeun (mmol/l)
|
|
|
|
| |
Début→Fin de l'étude
|
8.9→6.1
|
8.9→6.1
|
|
| |
Changement moyen
|
-2.83
|
-2.77
|
|
| |
Différence estimée
|
|
-0.01
[-0.35;0.33]
|
|
| |
Dose à la fin de l'étude
|
|
|
|
| |
Insuline (unités)
|
41
|
66D
|
45
|
45
| |
Liraglutide (mg)
|
1.5
|
-
|
1.7
|
-
| |
Différence estimée, dose d'insuline basale
|
|
-25.47B
[-28.90;-22.05]
|
|
-0.02
[-1.88; 1.84]
|
La valeur de base, la fin de l'étude et la modification moyenne sont considérées comme «Last observation carried forward» (LOCF). L'intervalle de confiance de 95% figure entre crochets: [].
A Critères d'évaluation avec supériorité confirmée de Xultophy par rapport au produit de comparaison
B p <0.0001
C p <0.05
D La dose moyenne d'insuline glargine antérieure à l'essai était de 32 unités
Sécurité cardiovasculaire
Aucune étude cardiovasculaire (CV) n'a été réalisée spécifiquement pour la préparation combinée Xultophy. La sécurité cardiovasculaire de ses deux composants a été démontrée dans les études CV associées, LEADER et DEVOTE. D'autres analyses post-hoc ont porté sur l'effet chez les patients de ces deux études qui ont été traités simultanément avec du liraglutide et une insuline à action prolongée (y compris l'insuline dégludec). Les résultats de ces analyses post-hoc confirment la transférabilité des résultats positifs de LEADER et de DEVOTE à Xultophy (sécurité et bénéfice cardiovasculaire).
Liraglutide (Victoza®)
LEADER - Analyse primaire
L'étude LEADER (Liraglutide Effect and Action in Diabetes Evaluation of Cardiovascular Outcome Results) a examiné l'incidence des événements cardiovasculaires graves (MACE: décès cardiovasculaire, infarctus du myocarde non mortel, accident vasculaire cérébral non mortel) chez 9340 patients atteints de diabète sucré de type 2 et présentant un risque élevé d'événements cardiovasculaires. Après randomisation (1:1), les patients ont reçu, en plus du traitement standard, soit jusqu'à 1.8 mg de liraglutide par jour (4668) soit un placebo (4672) (durée moyenne du traitement environ 3.5 ans). Le critère d'évaluation principal était le délai avant la première occurrence d'un MACE. Le rapport des risques estimé jusqu'au premier MACE a été considérablement réduit par le liraglutide à la dose étudiée (rapport des risques 0.87 [0.78; 0.97] IC à 95%.
Une réduction de l'HbA1c par rapport aux valeurs initiales à 36 mois a été observée avec le liraglutide par rapport au placebo, en plus du traitement standard (-1.16% vs -0.77%; différence de traitement estimée [ETD] -0.40% [-0.45; -0.34]).
LEADER - Analyse post-hoc
L'analyse primaire LEADER a été répétée pour 2 118 patients recevant de l'insuline à action prolongée de base afin de déterminer l'applicabilité des résultats de l'analyse primaire pour l'association du liraglutide et de l'insuline à action prolongée. Les caractéristiques de base de ce sous-groupe étaient comparables à celles de la population totale. Les résultats de l'analyse post-hoc pour la période précédant la première analyse MACE étaient conformes à l'analyse primaire LEADER (RR estimé [IC à 95%] dans le sous-groupe: 0.82 [0.66; 1.03]).
Insuline dégludec (Tresiba®)
DEVOTE – Analyse primaire
DEVOTE (Trial Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events) était un essai clinique randomisé en double aveugle qui comparait la sécurité cardiovasculaire de l'insuline dégludec à celle de l'insuline glargine (100 unités/ml) chez 7637 patients atteints de diabète sucré de type 2 et présentant un risque élevé d'événements cardiovasculaires. La durée de l'étude était «événementielle», c'est-à-dire que l'étude était menée jusqu'à ce que le nombre d'événements soit ≥633. La durée moyenne du traitement était de 1.83 an, la durée d'observation moyenne étant de 1.99 an.
L'analyse primaire couvrait la période allant de la randomisation à la première occurrence d'un événement cardiovasculaire grave (MACE: décès d'origine cardiovasculaire, infarctus du myocarde non mortel ou accident vasculaire cérébral non mortel). L'analyse primaire a montré un RR estimé à [IC à 95%] pour l'insuline dégludec par rapport à l'insuline glargine de 0.91 [0.78; 1.06].
Le taux d'HbA1c initial était de 8.4% dans les deux groupes de thérapie et après 2 ans, l'HbA1c était de 7.5% pour l'insuline dégludec et l'insuline glargine.
DEVOTE - Analyse post-hoc
Afin de déterminer la transférabilité des résultats de l'analyse primaire à l'association d'une insuline à action prolongée (y compris l'insuline dégludec) avec du liraglutide, une analyse post-hoc a été effectuée pour le sous-groupe de patients qui étaient déjà traités par du liraglutide dans le groupe de référence.
Les caractéristiques de base des 436 patients traités avec le liraglutide de référence étaient semblables à celles des 7 201 patients traités avec un traitement de référence sans liraglutide. L'analyse post-hoc du délai avant le premier MACE a révélé un RR estimé à [IC à 95%] 0.65 [0.45; 0.96] chez les patients traités avec du liraglutide comparativement aux patients non traités avec du liraglutide.
Évaluation microvasculaire
Dans l'étude LEADER, les événements microvasculaires comprenaient la néphropathie et la rétinopathie. L'analyse du temps avant le premier événement microvasculaire sous liraglutide par rapport au placebo a montré un RR de 0.84 [0.73, 0.97]. Le RR pour le liraglutide par rapport au placebo était de 0.78 [0.67, 0.92] pour la période précédant la première occurrence de néphropathie et de 1.15 [0.87, 1.52] pour la période précédant la première occurrence de rétinopathie.
|











