ZusammensetzungWirkstoffe
Natrii chloridum, Kalii chloridum (Duosol 2 mmol/l K und Duosol 4 mmol/l K), Calcii chloridum dihydricum, Magnesii chloridum hexahydricum, Glucosum monohydricum, Natrii hydrogencarbonatum.
Hilfsstoffe
Acidum hydrochloricum, Carbonii dioxidum, Aqua ad iniectabilia.
Indikationen/AnwendungsmöglichkeitenDie gebrauchsfertige Lösung wird zur kontinuierlichen Hämofiltrationsbehandlung von Patienten mit akutem Nierenversagen jeglicher Genese angewendet.
Dosierung/AnwendungDie Anwendung von Hämofiltrationslösungen bei Patienten mit akutem Nierenversagen sollte unter der Leitung eines Arztes mit Erfahrung im Umgang mit einer solchen Behandlung erfolgen.
Übliche Dosierung
Die vorgeschriebene Filtrationsrate ist abhängig vom klinischen Zustand und dem Körpergewicht des Patienten. Soweit nicht anders verordnet, wird je nach Stoffwechsellage des Patienten eine Filtrationsrate von 20-25 ml/kg Köpergewicht pro Stunde zur Entfernung der harnpflichtigen Substanzen empfohlen.
Das Dosierungsvolumen unterliegt dem Ermessen des Arztes, da das Volumen an Substitutionslösung abhängig ist von der Intensität der Therapie und von der Flüssigkeitsmenge, die erforderlich ist, um einen Flüssigkeitsausgleich zu erreichen.
Kinder und Jugendliche
Die oben genannten Dosierungsempfehlungen gelten auch für Kinder und Jugendliche.
Art der Anwendung
Zur intravenösen Anwendung.
Die gebrauchsfertige Hämofiltrationslösung muss durch Öffnen der Peelnaht hergestellt werden. Durch fünfmaliges Wenden des Beutels wird die Mischung erhalten. Weitere Hinweise zur Handhabung: siehe «Sonstige Hinweise: Hinweise für die Handhabung».
Die gebrauchsfertige Hämofiltrationslösung wird mittels einer Infusionspumpe in den extrakorporalen Kreislauf infundiert.
Die Hämofiltrationslösung ersetzt das bei der Hämofiltration dem Blut entzogene Ultrafiltrat unter Berücksichtigung der Gesamtflüssigkeitsbilanz.
Die Behandlung bei akutem Nierenversagen ist zeitlich begrenzt und wird beendet bei Wiederherstellung der Nierenfunktion.
KontraindikationenGegenanzeigen aufgrund der gebrauchsfertigen Hämofiltrationslösung:
·Duosol ohne K und 2 mmol/l K: Hypokaliämie (eine Hypokaliämie muss vor Therapiebeginn korrigiert werden, insbesondere wenn Duosol ohne K verwendet werden soll)
·Duosol 4 mmol/l K: Hyperkaliämie.
·Metabolische Alkalose.
Gegenanzeigen aufgrund der Hämofiltration:
·Akutes Nierenversagen mit ausgeprägtem Hyperkatabolismus, wenn die urämische Symptomatik mit der Hämofiltration nicht mehr behoben werden kann
·Unzureichender Blutfluss aus dem Blutgefässzugang
Alle Zustände mit erhöhtem Blutungsrisiko aufgrund systemischer Antikoagulation.
Warnhinweise und VorsichtsmassnahmenVor und während der Hämofiltration sollten der hämodynamische Zustand, das Flüssigkeits-, Elektrolyt- und das Säure-Basen-Gleichgewicht, die Blutglucosekonzentration und die Spiegel von Harnstoff und Plasma-Kreatinin engmaschig überwacht werden.
Die Kaliumkonzentration im Serum muss vor und während der Hämofiltration regelmässig kontrolliert werden. Bei zu starker Abnahme der Kaliumkonzentration und Entstehung einer Hypokaliämie sollte Kalium substituiert werden und/oder der Wechsel auf eine Substitutionslösung mit einer höheren Kaliumkonzentration kann erforderlich sein. Bei erhöhter Kaliumkonzentration im Serum, bei einer Hyperkaliämie, kann es notwendig sein, neben den sonstigen Massnahmen der Intensivmedizin einen Anstieg der Filtrationsrate und/oder einen Wechsel zu einer Substitutionslösung mit einer geringeren Kaliumkonzentration in Betracht zu ziehen.
Während der Hämofiltration sollte die anorganische Phosphatkonzentration regelmässig gemessen werden. Im Falle einer Hypophosphatämie müssen anorganische Phosphate substituiert werden.
Die Hämofiltrationslösung sollte entweder durch ein integriertes oder ein externes Heizelement ungefähr auf Körpertemperatur erwärmt werden. Die Lösung darf unter keinen Umständen unterhalb von Raumtemperatur infundiert werden.
Während der Anwendung dieses Arzneimittels wurden in seltenen Fällen weisse Calciumcarbonatausfällungen in den Schlauchleitungen beobachtet, insbesondere in der Nähe der Pumpeneinheit und dem Heizelement. Daher sollte die Lösung in den Schlauchleitungen während der Hämofiltration alle 30 Minuten engmaschig visuell inspiziert werden, um sicherzustellen, dass die Lösung im Schlauchsystem klar und frei von Ausfällungen ist. Ausfällungen können auch mit erheblicher Verzögerung nach dem Beginn der Behandlung auftreten. Wenn eine Ausfällung beobachtet wird, müssen die Lösung und die Schlauchleitungen sofort ersetzt und der Patient sorgfältig überwacht werden.
InteraktionenWährend der Therapie kann es zu einer Abnahme der Blutspiegel von filtrierbaren Arzneimitteln kommen, z.B. bei Arzneimitteln mit geringer Proteinbindungskapazität. Falls erforderlich sollte eine entsprechende korrigierende Behandlung erfolgen.
Wechselwirkungen mit anderen Arzneimitteln können durch korrekte Dosierung der Hämofiltrationslösung und genauem Monitoring der klinischen Chemie- und Vitalparameter vermieden werden.
Folgende Wechselwirkungen sind jedoch denkbar:
·Elektrolytsubstitutionen, parenterale Ernährung und andere Infusionen, die üblicherweise in der Intensivmedizin gegeben werden, interagieren mit der Serumzusammensetzung und dem Flüssigkeitsstatus des Patienten. Dies ist bei der Verordnung einer Hämofiltrationsbehandlung zu berücksichtigen.
·Toxische Wirkungen von Digitalis können durch Hyperkaliämie, Hypokalzämie und Hypermagnesämie maskiert werden. Die Korrektur dieser Elektrolyte durch Hämofiltration kann Anzeichen und Symptome einer Digitalis-Toxizität, z.B. Herzrhythmusstörungen, verschlimmern.
·Wenn Kaliumspiegel niedrig oder Calciumspiegel hoch sind, kann eine Digitalis-Toxizität bei suboptimalen Dosen der Digitalis-Therapie auftreten.
·Vitamin D und calciumhaltige Arzneimittel, z.B. Calciumcarbonat als Phosphatbinder, können das Risiko einer Hypercalciämie erhöhen.
·Zusätzliche Natriumbicarbonat-Substitution kann das Risiko einer metabolischen Alkalose erhöhen.
·Die Gabe von Insulin kann eine Hypokaliämie, eine Hypoglykämie und eine Hypophosphatämie verstärken.
·Eine parenterale Ernährung kann Elektrolytstörungen und eine Hypophosphatämie verstärken.
·Das Volumen anderer Infusionen, z.B. der parenteralen Ernährung, muss mit dem Ultrafiltrations- und Substitutionsvolumen bilanziert werden, um eine Hyperhydratation oder Dehydratation zu vermeiden.
Schwangerschaft, StillzeitZur Zeit liegen hierzu keine klinischen Erfahrungen vor. Die bicarbonatgepufferte Hämofiltrationslösung darf nur nach Abwägung der potentiellen Risiken und Vorteile für Mutter und Kind angewendet werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNicht zutreffend.
Unerwünschte WirkungenEs sind keine unerwünschten Ereignisse oder Nebenwirkungen berichtet worden, die möglicherweise mit der bicarbonatgepufferten Hämofiltrationslösung in Zusammenhang gebracht werden können.
Die folgenden Nebenwirkungen können jedoch Folge der Behandlung sein oder durch die verwendete Hämofiltrationslösung hervorgerufen werden:
Stoffwechsel- und Ernährungsstörungen
Hyperhydrierung oder Dehydratation, Elektrolytstörung, Hypophosphatämie, Hyperglykämie, metabolische Alkalose.
Gefässerkrankungen
Hypertonie, Hypotonie.
Erkrankungen des Gastrointestinaltrakts
Übelkeit, Erbrechen.
Skelettmuskulatur-, Bindegewebs-, und Knochenerkrankungen
Muskelkrämpfe.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungBei bestimmungsgemässer Dosierung ist das Auftreten von Notsituationen noch nicht bekannt geworden, insbesondere da die Zufuhr der Lösung jederzeit unterbrochen werden kann. Bei ungenauer Bilanzierung kann es entweder zu einer Hyperhydrierung oder zu einer Dehydratation kommen. Diese manifestieren sich in entsprechenden Veränderungen des Blutdrucks, des zentralen Venendrucks, der Pulsfrequenz und des Pulmonalarteriendrucks.
Bei einer Hyperhydrierung sollten die Ultrafiltration erhöht und die Rate und das Volumen der infundierten Hämofiltrationslösung reduziert werden.
Im Falle einer zu starken Dehydratation ist es notwendig, die Ultrafiltration zu verringern oder zu beenden und die Zufuhr der Hämofiltrationslösung entsprechend zu erhöhen.
Eine Bicarbonat-Überdosierung kann auftreten, wenn ein zu grosses Volumen an Hämofiltrationslösung angewendet wurde. Dies kann zu metabolischer Alkalose, Abnahme des ionisierten Calciums oder Tetanie führen.
Eine Überdosierung kann ein kongestives Herzversagen und/oder einen Lungenstau verursachen und zu Störungen des Elektrolyt- und Säure-Basen-Gleichgewichtes führen.
Eigenschaften/WirkungenATC-Code
B05ZB
Pharmakotherapeutische Gruppe: Hämofiltrate
Wirkungsmechanismus
Grundprinzipien der Hämofiltration
Während einer kontinuierlichen Hämofiltration werden Wasser und gelöste Substanzen wie urämische Toxine, Elektrolyte und Bicarbonat durch Ultrafiltration aus dem Blut entfernt. Das Ultrafiltrat wird durch eine Hämofiltrationslösung mit bilanzierter Elektrolyt- und Pufferkonzentration ersetzt.
Die gebrauchsfertige Lösung, bestehend aus einer Bicarbonat- und einer Elektrolytlösung, ist eine bicarbonatgepufferte Hämofiltrationslösung zur Behandlung des akuten Nierenversagens mittels kontinuierlicher Hämofiltration.
Pharmakodynamik
Die Elektrolyte Na+, K+, Mg2+, Ca2+, Cl- und Bicarbonat sind für die Aufrechterhaltung und Korrektur der Flüssigkeits- und Elektrolythomöostase (Blutvolumen, osmotisches Gleichgewicht, Säure-Basen-Haushalt) unentbehrlich.
Klinische Wirksamkeit
Die Wirksamkeit vergleichbarer intravenös angewendeter Lösungen zur Aufrechterhaltung des Säure-Basen-Gleichgewichts während der Hämofiltration hat sich in Studien und in langjährigem klinischem Einsatz eindeutig erwiesen. Ihre Verträglichkeit und Sicherheit sind belegt. Die Pharmakologie von intravenös angewendeten Elektrolyten und Bicarbonat ist hinreichend bekannt.
PharmakokinetikAbsorption
Die gebrauchsfertige Hämofiltrationslösung ist intravenös anzuwenden.
Distribution
Die Verteilung von Elektrolyten und Bicarbonat wird abhängig von Bedarf, metabolischen Bedingungen und residualer Nierenfunktion geregelt.
Metabolismus
Die Inhaltsstoffe der Hämofiltrationslösung werden mit Ausnahme der Glucose nicht metabolisiert.
Elimination
Die Ausscheidung von Wasser und Elektrolyten ist abhängig vom zellulären Bedarf, metabolischen Zustand, residualen Nierenfunktion und von Flüssigkeitsverlusten z.B. über Darm, Lunge und Haut.
Kinetik spezieller Patientengruppen
Keine Angaben vorhanden
Präklinische DatenDa alle Inhaltsstoffe der Hämofiltrationslösung physiologische Substanzen sind, die der Substitution der bei der Hämofiltration entfernten essentiellen Plasmabestandteile dienen, wurden toxikologische Studien nicht durchgeführt.
Sonstige HinweiseInkompatibilitäten
Aufgrund des Risikos von Inkompatibilitäten darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden. Wenn die Zugabe eines Arzneimittels zu der Hämofiltrationslösung erforderlich ist, sollte dies nur nach einer umfassenden Beurteilung der Kompatibilität mit der Hämofiltrationslösung und nur, nachdem die beiden Lösungen im Zweikammerbeutel gründlich gemischt wurden, durchgeführt werden.
Beeinflussung diagnostischer Methoden
Keine Angaben vorhanden
Haltbarkeit
Nach Ablauf des mit «EXP» angegebenen Verfallsdatum nicht mehr anzuwenden.
Haltbarkeit nach Anbruch
Die gemischte Lösung sollte möglichst sofort angewendet werden. Die gemischte Lösung ist 24 Stunden bei 25°C physikalisch und chemisch stabil.
Besondere Lagerungshinweise
Nicht über 25°C lagern. Nicht kühlen oder einfrieren.
Hinweise für die Handhabung
Hinweise zur Herstellung der gebrauchsfertigen Hämofiltrationslösung
Der Behälter muss vor Gebrauch visuell überprüft werden. Die Hämofiltrationslösung nur verwenden, wenn der Behälter (Umverpackung und Zweikammerbeutel), die Peelnaht und die Anschlüsse unbeschädigt und intakt sind, und wenn die Lösung klar, farblos und frei von sichtbaren Partikeln ist.
Umverpackung erst unmittelbar vor der Anwendung entfernen.
1. Umverpackung des Beutels entfernen.
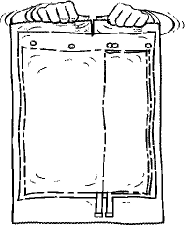
2. Den Beutel aufklappen und auf eine saubere, ebene Unterlage legen.
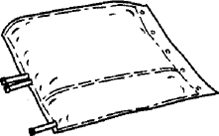
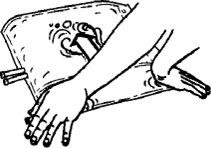
3. Mit beiden Händen auf die kleine Kammer des Beutels drücken, bis sich die Peelnaht vollständig entlang ihrer gesamten Länge geöffnet hat.
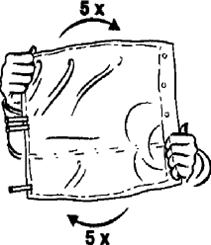
4. Durch 5-maliges Hin- und Herdrehen des Beutels sicherstellen, dass der Inhalt sorgfältig gemischt wird.
Hinweise zur Anwendung der gebrauchsfertigen Hämofiltrationslösung
Nur zum einmaligen Gebrauch. Nicht verbrauchte Lösung und beschädigte Behälter sind zu verwerfen.
Behältnisse aus Kunststoff können gelegentlich auf dem Transport vom Hersteller in das Dialysezentrum oder innerhalb einer Klinik beschädigt werden. Dadurch kann es zu einer Kontamination mit mikrobiellem oder fungiformen Wachstum in der Hämofiltrationslösung kommen. Eine sorgfältige Sichtkontrolle des Behälters und der Hämofiltrationslösung ist daher vor dem Anschliessen des Behälters und vor Anwendung der Hämofiltrationslösung in jedem Fall geboten. Dabei ist insbesondere auf geringste Beschädigungen am Verschluss, an den Verschlussnähten und der Peelnaht sowie an den Behälterecken als Quelle einer möglichen Kontamination zu achten.
Die Hämofiltrationslösung nur verwenden, wenn der Behälter (Umverpackung und Zweikammerbeutel), die Peelnaht und die Anschlüsse unbeschädigt und intakt sind, und wenn die Lösung klar, farblos und frei von sichtbaren Partikeln ist. Die Lösung darf nur nach dem Öffnen der Peelnaht und dem Mischen der beiden Lösungen verwendet werden.
Zulassungsnummer65600, 65637, 65638 (Swissmedic).
PackungenZweikammerbeutel auf Polypropylen-Basis (PP) in einer Umverpackung auf PP-Basis, der 4445 ml Natriumhydrogencarbonatlösung und 555 ml Elektrolytlösung, getrennt durch eine Peelnaht, enthält, mit zwei Schläuchen auf PP-Basis, die mit Luer-Lock-Anschlüssen auf Polycarbonat-Basis auf der grossen Kammer verschlossen sind. Der Schlauch auf der kleinen Kammer wird nur bei der Herstellung verwendet und ist nicht für den Gebrauch bestimmt.
Packung zu 2× 5000 ml.
ZulassungsinhaberinB. Braun Medical AG, Sempach.
Stand der InformationFebruar 2020
| 



