ZusammensetzungWirkstoffe
Betiatidum (Benzoyl-mercapto-acetyl-triglycin).
Hilfsstoffe
Stannosi chloridum dihydricum, dinatrii tartras dihydricus, acidum hydrochloridum concentratum.
Das Lyophilisat des Produktes enthält 4,7 mg Natrium pro Durchstechflasche. Nach der Rekonstitution mit 10 ml Natriumpertechnetat-Lösung enthält das Produkt 4,01 mg/ml Natrium.
Spezifikationen
Reaktionsmechanismus
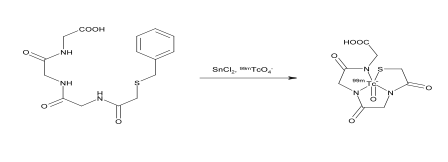
Betiatid (99mTc)Technetium-Mertiatid
Spezifikationen des markierten Präparates
Endotoxinfreie, sterile, farblose, klare bis leicht opaleszente, wässrige Lösung zur intravenösen Anwendung, pH: 5,0 - 6,0.
Markierungsausbeute gemäss HPLC: ≥ 95% sofort nach Markierung, ≥ 94% 8 Stunden nach Markierung (Endvolumen 10 ml).
Darreichungsform und Wirkstoffmenge pro EinheitMarkierungsbesteck zur Herstellung von 99mTechnetium-markiertem Mertiatid (99mTc-Mercapto-acetyl-triglycin). Ein Fläschchen enthält 1 mg Betiatid. Gräulich-weißes bis leicht gelbliches gefriergetrocknetes Pulver.
Zur intravenösen Anwendung nach Markierung mit Tc 99m
Indikationen/AnwendungsmöglichkeitenTechneScan MAG3 ist ein Radiodiagnostikum, das nach Rekonstitution mit Natriumpertechnetat [99mTc] indiziert ist für die:
szintigraphische Untersuchung der Nierendurchblutung und der Nierenausscheidung,
statische oder dynamische Darstellung der Harnwege (Renographie und Sequenzszintigraphie).
Bei Patienten mit stark reduzierter Nierenfunktion ist (99mTc)Technetium-Mertiatid für präzise Untersuchungen des maximalen effektiven renalen Blut- oder Plasmaflusses (ERBF/ERPF) nicht geeignet.
Dosierung/AnwendungDosierung
Erwachsene
Die übliche Dosierung bei einem Erwachsenen (70kg) beträgt 100 MBq. Je nach Art der Untersuchung und Nierenfunktion muss die Dosierung angepasst werden.
Zur Bestimmung der Nierendurchblutung oder des Durchflusses durch die Harnleiter benötigt man im allgemeinen höhere Dosierungen als zur Bestimmung des intra-renalen Durchflusses. Renographien sind mit niedrigeren Dosierungen als Sequenzszintigraphien möglich.
Ältere Menschen
Für ältere Patienten ist kein besonderes Dosierungsschema erforderlich.
Eingeschränkte Nierenfunktion
Eine sorgfältige Abwägung der anzuwendenden Aktivität ist erforderlich, da bei diesen Patienten eine erhöhte Strahlenexposition möglich ist.
Kinder und Jugendliche
Die Anwendung bei Kindern und Jugendlichen muss sorgfältig geprüft werden, und unter Berücksichtigung der klinischen Notwendigkeit und Einbeziehung des Nutzen-Risiko-Verhältnisses in dieser Patientengruppe erfolgen.
Bei Kindern und Jugendlichen wird die zu verabreichende Aktivität entsprechend der EANM Dosierungskarte (2016) unter Verwendung folgender Formel ermittelt:
zu verabreichende Aktivität A [MBq] = Basisaktivität (von 11,9 MBq) x Multiplikationsfaktor
Die zu verabreichende Aktivitäten sind in der folgenden Tabelle aufgeführt:
Gewicht (kg) Aktivität (MBq) Gewicht (kg) Aktivität (MBq) Gewicht (kg) Aktivität (MBq)
3 15 22 36 42 52
4 15 24 38 44 54
6 18 26 40 46 55
8 20 28 41 48 57
10 23 30 43 50 58
12 26 32 45 52 - 54 60
14 28 34 46 56 - 58 62
16 30 36 48 60 - 62 65
18 32 38 50 64 - 66 67
20 34 40 51 68 69
Bei sehr jungen Kindern ist eine Mindestdosis von 15 MBq notwendig, um Bilder in ausreichender Qualität zu erhalten.
Gleichzeitig angewendete Arzneimittel für diagnostische Tests
Die Gabe eines Diuretikums oder eines ACE-Hemmers während des diagnostischen Verfahrens wird manchmal zur Differentialdiagnose von nephrologischen und urologischen Störungen verwendet.
Wiederholung der Untersuchung
Die Untersuchung kann im Prinzip wiederholt werden, sobald die Aktivität aus der Zirkulation, bzw. aus Nierenparenchym, -becken und evtl. Harnblase ausreichend eliminiert ist. Während den klinischen Prüfungen haben Intervalle von 45 - 60 Minuten zwischen zwei Untersuchungen brauchbare klinische Resultate ergeben.
Art der Anwendung
Mehrdosen-Durchstechflasche.
Dieses Arzneimittel muss vor der Verabreichung an den Patienten rekonstituiert werden.
Hinweise zur Rekonstitution des Arzneimittels, siehe Abschnitt „Hinweise für die Handhabung“.
Hinweise zur Vorbereitung des Patienten, siehe Abschnitt „Warnhinweise und Vorsichtsmassnahmen“.
Bilderfassung
Die szintigraphische Untersuchung wird in der Regel unmittelbar nach der Verabreichung durchgeführt.
Strahlenexposition
(99mTc)Technetium wird mittels eines (99Mo/99mTc)-Generators hergestellt und zerfällt unter Emission von Gammastrahlung mit einer mittleren Energie von 140 keV und einer Halbwertszeit von 6,01 Stunden zu (99Tc)Technetium, das aufgrund seiner langen Halbwertzeit von 2,13 x 105 Jahren quasi als stabil angesehen werden kann.
Die in der Tabelle aufgeführten Daten stammen aus ICRP 128 und wurden unter folgenden Annahmen berechnet:
-Im Normalfall wird MAG3 nach intravenöser Gabe schnell im extrazellulären Raum verteilt und durch das Nierensystem vollständig nach dem Nieren-Blasen-Modell ausgeschieden. Die Gesamtkörperretention wird durch tri-exponentielle Funktionen beschrieben (Stabin et al., 1992). Die renale Durchflusszeit wird mit 4 Minuten angenommen.
-Wenn die Funktion beider Nieren eingeschränkt ist, wird angenommen, dass die Clearance-Rate der Substanz ein Zehntel der normalen Clearance beträgt, die renale Durchflusszeit auf 20 Minuten erhöht ist und dass 4% in die Leber aufgenommen werden.
-Als Beispiel für eine akute einseitige Nierenobstruktion wird eine Aufnahme von 50 % des verabreichten Radiopharmazeutikums durch eine Niere angenommen. Das Radiopharmazeutikum wird langsam mit einer Halbwertzeit von 5 Tagen ins Blut freigegeben und durch die gesunde Niere ausgeschieden.
Nach ICRP Veröffentlichung Nr. 128 (Vol. 44, 2015)
Geschätzte absorbierte Dosis: 99mTc-MAG3 bei normaler Nierenfunktion (µGy/MBq)
Organ Erwachsene 15 Jahre 10 Jahre 5 Jahre 1 Jahr
Nebennieren 0,39 0,51 0,82 1,20 2,50
Knochenoberfläche 1,30 1,60 2,10 2,40 4,30
Gehirn 0,10 0,13 0,22 0,35 0,61
Brust 0,10 0,14 0,24 0,39 0,82
Gallenblase 0,57 0,87 2,00 1,70 2,80
GI Trakt
Magenwand 0,39 0,49 0,97 1,30 2,50
Dünndarmwand 2,30 3,00 4,20 4,60 7,80
Dickdarmwand 3,40 4,30 5,90 6,00 9,80
Obere Dickdarmwand 1,70 2,30 3,40 4,00 6,70
Untere Dickdarmwand 5,70 7,00 9,20 8,70 14,00
Herzwand 0,18 0,24 0,37 0,57 1,20
Nieren 3,40 4,20 5,90 8,40 15,00
Leber 0,31 0,43 0,75 1,10 2,10
Lunge 0,15 0,21 0,33 0,50 1,00
Muskeln 1,40 1,70 2,20 2,40 4,10
Speiseröhre 0,13 0,18 0,28 0,44 0,82
Ovarien 5,40 6,90 8,70 8,70 14,00
Pankreas 0,40 0,50 0,93 1,30 2,50
rotes Knochenmark 0,93 1,20 1,60 1,50 2,10
Haut 0,46 0,57 0,83 0,97 1,80
Milz 0,36 0,49 0,79 1,20 2,30
Testes 3,70 5,30 8,10 8,70 16,00
Thymus 0,13 0,18 0,28 0,44 0,82
Schilddrüse 0,13 0,16 0,27 0,44 0,82
Harnblasenwand 110 140 170 180 320
Uterus 12,00 14,00 19,00 19,00 31,00
Übrige Organe 1,30 1,60 2,10 2,20 3,60
Effektive Dosis (µSv/MBq) 7,00 9,00 12,00 12,00 22,00
Die Blasenwand trägt bis zu 80% der effektiven Dosis bei.
Die effektive Dosis (µSv/MBq) nach Blasenentleerung nach 1 Stunde bzw., 30 Minuten nach Verabreichung beträgt:
1 Stunde 2,5 3,1 4,5 6,4 6,4
30 Minuten 1,7 2,1 2,9 3,9 6,8
Die effektive Dosis beträgt bei einem Erwachsenen mit einem Körpergewicht von 70 kg nach Verabreichung von 100 MBq etwa 0,7 mSv. Bei einer verabreichten Aktivität von 100 MBq beträgt die typische Strahlenbelastung des Zielorgans (Nieren 0,34 mGy und die typische Strahlenbelastung des kritischen Organs (Blasenwand) 10,8 mGy.
Geschätzte absorbierte Dosis: 99mTc-MAG3 bei gestörter Nierenfunktion (µGy/MBq)
Organ Erwachsene 15 Jahre 10 Jahre 5 Jahre 1 Jahr
Nebennieren 1,60 2,10 3,20 4,80 8,60
Knochenoberfläche 2,20 2,70 3,80 5,00 9,10
Gehirn 0,61 0,77 1,30 2,00 3,60
Brust 0,54 0,70 1,10 1,70 3,20
Gallenblase 1,60 2,20 3,80 4,60 6,40
GI-Trakt
Magenwand 1,20 1,50 2,60 3,50 6,10
Dünndarmwand 2,70 3,50 5,00 6,00 10,00
Dickdarmwand 3,50 4,40 6,10 6,90 11,00
Obere Dickdarmwand 2,20 3,00 4,30 5,60 9,30
Untere Dickdarmwand 5,10 6,30 8,50 8,60 14,00
Herzwand 0,91 1,20 1,80 2,70 4,80
Nieren 14,00 17,00 24,00 34,00 59,00
Leber 1,40 1,80 2,70 3,80 6,60
Lunge 0,79 1,10 1,60 2,40 4,50
Muskeln 1,70 2,10 2,90 3,60 6,40
Speiseröhre 0,74 0,97 1,50 2,30 4,10
Ovarien 4,90 6,30 8,10 8,70 14,00
Pankreas 1,50 1,90 2,90 4,30 7,40
rotes Knochenmark 1,50 1,90 2,60 3,10 5,00
Haut 0,78 0,96 1,50 2,00 3,80
Milz 1,50 1,90 2,90 4,30 7,40
Testes 3,40 4,70 7,10 7,80 14,00
Thymus 0,74 0,970 1,50 2,30 4,10
Schilddrüse 0,73 0,95 1,50 2,40 4,40
Harnblasenwand 83,00 110,00 130,00 130,00 230,00
Uterus 10,00 12,00 16,00 16,00 27,00
Übrige Organe 1,70 2,10 2,80 3,40 6,00
Effektive Dosis (µSv/MBq) 6,10 7,80 10,00 11,00 19,00
Die effektive Dosis beträgt bei einem Erwachsenen mit einem Körpergewicht von 70 kg nach Verabreichung der empfohlenen Höchstaktivität von 100 MBq etwa 0,61 mSv. Bei einer verabreichten Aktivität von 100 MBq beträgt die typische Strahlenbelastung des Zielorgans (Nieren) 1,4 mGy und die typische Strahlenbelastung des kritischen Organs (Blasenwand) 8,3 mGy.
Geschätzte absorbierte Dosis: 99mTc-MAG3 bei akuter einseitiger Nierenblockade (µGy/MBq)
Organ Erwachsene 15 Jahre 10 Jahre 5 Jahre 1 Jahr
Nebennieren 11,00 14,00 22,00 32,00 55,00
Knochenoberfläche 3,10 4,00 5,80 8,40 17,00
Gehirn 0,11 0,14 0,23 0,39 0,75
Brust 0,38 0,51 1,00 1,60 3,00
Gallenblase 6,20 7,30 10,00 16,00 23,00
GI-Trakt
Magenwand 3,90 4,40 7,00 9,30 12,00
Dünndarmwand 4,30 5,50 8,50 12,00 19,00
Dickdarmwand 3,90 5,00 7,20 9,20 1,50
Obere Dickdarmwand 4,00 5,10 7,60 10,00 16,00
Untere Dickdarmwand 3,80 4,80 6,70 8,20 13,00
Herzwand 1,30 1,60 2,70 4,00 6,10
Nieren 200,00 240,00 330,00 470,00 810,00
Leber 4,40 5,40 8,10 11,00 17,00
Lunge 1,10 1,60 2,50 3,90 7,20
Muskeln 2,20 2,70 3,70 5,10 8,90
Speiseröhre 0,38 0,54 0,85 1,50 2,30
Ovarien 3,80 5,10 7,10 9,20 15,00
Pankreas 7,40 9,00 13,00 18,00 29,00
rotes Knochenmark 3,00 3,60 5,00 6,00 8,30
Haut 0,82 1,00 1,50 2,20 4,20
Milz 9,80 12,00 18,00 26,00 40,00
Testes 2,00 2,90 4,50 5,00 9,80
Thymus 0,38 0,54 0,85 1,50 2,30
Schilddrüse 0,17 0,23 0,45 0,92 1,60
Harnblasenwand 56,00 71,00 91,00 93,00 170,00
Uterus 7,20 8,70 12,00 13,00 22,00
Übrige Organe 2,10 2,60 3,60 4,70 8,00
Effektive Dosis (µSv/MBq) 10,00 12,00 17,00 22,00 38,00
Die effektive Dosis beträgt bei einem Erwachsenen mit einem Körpergewicht von 70 kg nach Verabreichung der empfohlenen Höchstaktivität von 100 MBq in etwa 1,0 mSv. Bei einer verabreichten Aktivität von 100 MBq beträgt die typische Strahlenbelastung des Zielorgans (Nieren) 20 mGy und die typische Strahlenbelastung des kritischen Organs (Blasenwand) 5,6 mGy.
KontraindikationenÜberempfindlichkeit gegenüber unmarkiertem Betiatid, markiertem 99mTc-Tiatid oder einem Hilfsstoff gemäss Zusammensetzung.
Warnhinweise und VorsichtsmassnahmenMögliche Überempfindlichkeits- oder anaphylaktische Reaktionen
Treten Überempfindlichkeits- bzw. anaphylaktische Reaktionen auf, muss die Anwendung des Arzneimittels sofort abgebrochen und bei Bedarf eine intravenöse Behandlung eingeleitet werden. Um im Notfall unverzüglich reagieren zu können, müssen geeignete Arzneimittel und Notfallinstrumente (z. B. Trachealtubus, Beatmungsgerät) bereitstehen.
Individuelle Nutzen-Risiko-Abwägung
Für jeden Patienten muss die Strahlenbelastung durch den möglichen Nutzen gerechtfertigt sein. Die verabreichte Aktivität soll in jedem Fall so niedrig wie möglich sein, um die erwünschte diagnostische Information zu erhalten.
Eingeschränkte Nierenfunktion
Eine sorgfältige Abwägung des Nutzen-Risiko-Verhältnisses ist erforderlich, da bei diesen Patienten eine erhöhte Strahlenexposition möglich ist.
Kinder und Jugendliche
Informationen zur Anwendung bei Kindern und Jugendlichen, siehe Abschnitt „Dosierung/Anwendung“.
Die Indikation muss besonders streng gestellt werden, da die effektive Dosis pro MBq höher ist als bei Erwachsenen (siehe Abschnitt „Strahlenexposition“).
Patientenvorbereitung
Der Patient soll vor dem Beginn der Untersuchung gut hydriert sein und aufgefordert werden, während der ersten Stunden nach der Untersuchung so oft wie möglich die Blase zu entleeren, um die Strahlenexposition zu verringern.
Nach der Untersuchung
Der enge Kontakt mit Kleinkindern und schwangeren Frauen muss nach der Injektion nicht eingeschränkt werden.
Besondere Warnhinweise
Ausscheidung über die Gallenblase
Es können geringe Mengen von 99mTc-markierten Verunreinigungen vorhanden sein und/oder bei der Markierung entstehen. Da einige dieser Verunreinigungen in der Leber verteilt werden und über die Gallenblase ausgeschieden werden, können diese die späte Phase (nach 30 Minuten) einer dynamischen Nierenuntersuchung beeinflussen, da sich in diesem untersuchten Bereich die Niere und die Leber überlagern.
Natriumgehalt
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Durchstechflasche, d.h. es ist nahezu „natriumfrei“.
Umweltgefährdung
Vorsichtsmaßnahmen bzgl. der Umweltgefahren, siehe Abschnitt „Hinweise für die Handhabung“.
InteraktionenEs sind keine Wechselwirkungen bei der Verabreichung von (99mTc)Technetium-Mertiatid mit üblicherweise für Patienten, die diese Untersuchungen erhalten, verschriebenen Arzneimitteln bekannt (z.B. Antihypertensiva oder Arzneimittel zur Behandlung/Vorbeugung der Abstoßung transplantierter Organe). Allerdings erfolgt manchmal zur Differentialdiagnose von nephrologischen und urologischen Störungen eine einmalige Gabe eines Diuretikums oder eines ACE-Hemmers.
Alle Arzneimittel, die einen Einfluss auf den renalen Blutfluss (z.B. Acetylsalicylsäure) oder auf die tubuläre Nierenausscheidung (z.B. verabreichte Kontrastmittel, Probenecid, Hydrochlorothiazid, NSARs wie Diclofenac, Sulfonamide) haben, können die tubuläre Nierenausscheidung beeinträchtigen und dadurch die (99mTc)Technetium-Mertiatid-Clearance beeinflussen.
Kalziumantagonisten können zu falsch-positiven Captopril-Renogrammen führen. Diese Arzneimittel sollten vor der Captopril-Nierenszintigraphie abgesetzt werden, und die Ärzte sollten sich dieser möglichen Arzneimittelinteraktion bewusst sein, wenn im Captopril-Renogramm eines Patienten eine beidseitige symmetrische Verschlechterung der Nierenfunktion festgestellt wird.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Falls beabsichtigt ist, bei einer Frau im gebärfähigen Alter ein radioaktives Arzneimittel anzuwenden, muss unbedingt festgestellt werden, ob eine Schwangerschaft vorliegt. Solange nicht das Gegenteil nachgewiesen wurde, muss grundsätzlich von einer Schwangerschaft ausgegangen werden, wenn eine Regelblutung ausgeblieben ist. Im Zweifelsfall (Ausbleiben der Regelblutung, sehr unregelmäßige Periode etc.) sind der Patientin alternative Untersuchungsmethoden, bei denen keine ionisierenden Strahlen angewandt werden, anzubieten (sofern solche Methoden verfügbar sind).
Schwangerschaft
Untersuchungen mit Radionukliden an Schwangeren führen auch zur Bestrahlung des Fötus. Daher dürfen während der Schwangerschaft nur zwingend erforderliche Untersuchungen durchgeführt werden, bei denen der erwartete Nutzen das Risiko für Mutter und Fötus bei weitem überwiegt.
Stillzeit
Natrium(99mTc)pertechnetat geht in die Muttermilch über. Vor der Verabreichung eines Radiopharmazeutikums während der Stillzeit sollte eine Verschiebung der Radionuklidbehandlung bis nach dem Abstillen in Betracht gezogen werden, da die Radioaktivität in die Muttermilch ausgeschieden wird. Sollte eine Behandlung notwendig sein, muss das Stillen für 4 Stunden unterbrochen und die abgepumpte Milch verworfen werden. Enger Kontakt mit Säuglingen muss während dieser Zeit nicht eingeschränkt werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenTechneScan MAG3 hat keinen oder einen zu vernachlässigenden Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte WirkungenIonisierende Strahlen können Krebs und Erbgutveränderungen verursachen. Da die effektive Strahlendosis bei Gabe der maximal empfohlenen Aktivität von 100 MBq bei 0,7 mSv liegt, sind diese Effekte mit geringer Wahrscheinlichkeit zu erwarten.
Informationen zu unerwünschten Wirkungen sind aus Spontanmeldungen verfügbar.
Tabellarische Auflistung der Nebenwirkungen
Die folgende Tabelle enthält Nebenwirkungen, sortiert nach Systemorganklassen gemäß MedDRA.
Die Häufigkeiten sind folgendermaßen definiert:
Sehr häufig (≥ 1/10); Häufig (≥ 1/100, <1/10); Gelegentlich (≥1/ 1000, <1/100); Selten (≥1/ 10 000, <1/1000); Sehr selten (<1/10 000); nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Nebenwirkungen sortiert nach Systemorganklasse
Systemorganklasse (SOC) Nebenwirkungen Häufigkeit
Erkrankungen des Überempfindlichkeitsreaktionen einschließlich Nicht bekannt
Immunsystems Anaphylaxie (z.B. Nesselausschlag, Schwellung der
Augenlider, Husten, Übelkeit, Erbrechen)
Erkrankungen des Vasovagale Reaktion (z.B. Krampfanfall, Dyspnoe, Nicht bekannt
Nervensystems Flush, Kopfschmerz, Gesichtsödem, Schmerz,
anormale Empfindung, Schwindelgefühl, Hypotonie,
Tachykardie).
Allgemeine Erkrankungen Reaktionen an der Injektionsstelle (z.B. Nicht bekannt
und Beschwerden am Hautausschlag, Schmerz, Schwellung)
Verabreichungsort
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungBei vorschriftsmässiger Anwendung ist nicht mit einer Überdosierung zu rechnen. Im Fall einer unbeabsichtigten Überdosierung geht die damit verbundene erhöhte Strahlenbelastung wegen der kurzen Halbwertszeit von 99mTc (6,02 h) rasch zurück, und es ist zu erwarten, dass ihre Elimination durch eine forcierte Diurese beschleunigt wird.
Eigenschaften/WirkungenPharmakotherapeutische Gruppe: Radiodiagnostika für das Nierensystem, (99mTc)Technetium-Verbindungen
ATC-Code
V09CA03
Wirkungsmechanismus
Physikalische Eigenschaften
Das an Mertiatid gebundene 99mTechnetium zerfällt durch isomeren Übergang mit einer Halbwertszeit von 6,01 Stunden in quasi stabiles 99Technetium. Die für die szintigraphische Diagnostik wichtige Gammastrahlung hat eine mittlere Energie von 140,5 keV (89%).
Pharmakodynamik
In den für die Szintigraphie empfohlenen Dosen sind von (99mTc) Technetium-Mertiatid keine pharmakodynamischen Wirkungen zu erwarten.
Klinische Wirksamkeit
Keine Angaben.
PharmakokinetikAbsorption
Keine Daten vorhanden.
Distribution
(99mTc)Technetium-Mertiatid hat eine relativ hohe Bindung an Plasmaproteine. Diese Bindung ist jedoch reversibel und (99mTc)Technetium-Mertiatid wird schnell über die Nieren ausgeschieden.
Metabolismus
Keine Daten vorhanden.
Elimination
Nach intravenöser Injektion wird (99mTc)Technetium-Mertiatid schnell über die Nieren aus dem Blut eliminiert. Die Ausscheidung erfolgt überwiegend durch tubuläre Sekretion. Die glomeruläre Filtration macht 11% der Gesamtclearance aus. Bei normaler Nierenfunktion sind nach 30 Minuten 70% und nach 3 Stunden mehr als 95% der verabreichten Dosis ausgeschieden. Diese letzteren Prozentsätze sind abhängig von der Pathologie der Nieren und des urogenitalen Systems.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
Die Eliminationshalbwertszeit von (99mTc)Technetium-Mertiatid steigt bei kompensierter Niereninsuffizienz auf bis zu mehrere Stunden und bei terminaler Niereninsuffizienz auf einige Tage an.
Die bei normaler Nierenfunktion geringe hepatobiliäre Elimination kann bei hochgradiger Niereninsuffizienz bis auf 4 % ansteigen.
Präklinische DatenIn Untersuchungen der akuten Toxizität in der Maus (bis 1000 mal der vorgesehenen Humandosis) und im Kaninchen (bis 100 mal der vorgesehenen Humandosis), wie auch in Untersuchungen der subakuten Toxizität in Ratte und Kaninchen (jeweils bis 30 mal der vorgesehenen maximalen Humandosis während 14 Tagen) wurden keine toxikologisch bedeutsamen Veränderungen festgestellt.
Untersuchungen über onkogene, karzinogene oder reproduktionstoxische Wirkungen von 99mTc-Tiatid sind bisher nicht verfügbar. Beim Menschen ist in der empfohlenen Dosierung nicht mit toxischen Wirkungen zu rechnen.
Sonstige HinweiseInkompatibilitäten
Das Arzneimittel darf, außer mit den unter Abschnitt „Hinweise für die Handhabung“ aufgeführten, nicht mit anderen Arzneimitteln gemischt werden.
Beeinflussung diagnostischer Methoden
Nicht zutreffend.
Haltbarkeit
Haltbarkeit des unmarkierten TechneScan MAG3
TechneScan MAG3 verfällt 12 Monate nach dem Herstelldatum. Das Arzneimittel darf nur bis zu dem auf dem Behälter mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit des markierten Präparates
Nach radioaktiver Markierung: 8 Stunden. Nach der radioaktiven Markierung nicht über 25 °C lagern.
Besondere Lagerungshinweise
Lagerung des unmarkierten TechneScan MAG3
Das unmarkierte TechneScan MAG3 muss im Kühlschrank zwischen +2 und +8 °C gelagert werden.
Lagerung des markierten Präparates
Das markierte Präparat ist in einem Bleibehälter geeigneter Stärke nicht über 25 °C zu lagern.
Hinweise für die Handhabung
Markierung
Der Inhalt der Durchstechflasche muss mit Natrium(99mTc)pertechnetat-Lösung markiert werden. Nach Markierung erhält man durch Erhitzen das Diagnostikum (99mTc)Technetium-Mertiatid.
Die Markierung muss von fachkundigem Personal unter streng aseptischen Bedingungen, Ausschluss von Luft und Beachtung der Strahlenschutzvorschriften (Arbeiten im Bleibehälter bzw. hinter einer Bleiwand) durchgeführt werden. Wenn die Unversehrtheit der Durchstechflasche beeinträchtigt ist, darf das Produkt nicht verwendet werden.
Markierungsvorschrift
1.Die flip-off Verschlusskappe des Fläschchens TechneScan MAG3 entfernen, den Gummistopfen mit Alkohol desinfizieren und das Fläschchen in einem Bleibehälter stellen.
2.Maximal 3 ml Natrium-[99mTc]-Pertechnetat mit einer maximalen Aktivität von 3000 MBq mit 0,9 % Natriumchlorid-Lösung auf ein Volumen von 10 ml verdünnen.
3.Die 10 ml verdünnte Natrium-[99mTc]-Pertechnetat-Lösung mit einer sterilen, strahlengeschützten Spritze ohne Luftblase und ohne Verwendung einer Belüftungskanüle in das Fläschchen TechneScan MAG3 hinzufügen. Anschliessend mit derselben Spritze durch Zurückziehen des gleichen Gasvolumens den Überdruck im Fläschchen ausgleichen. Hierzu ist eine möglichst dünne Nadel zu verwenden, G20 oder höher, damit das Einstichloch dicht schliesst und so während des anschliessenden Koch- und Abkühlvorgangs kein Wasser in das Fläschchen dringen kann.
4.Das Fläschchen sofort während 10 Minuten in einem Heizblock oder in einem Wasserbad mit kochendem Wasser erhitzen. Dabei ist darauf zu achten, dass das Fläschchen aufrecht stehen bleibt, um zu vermeiden, dass Metallspuren aus dem Gummistopfen den Markierungsvorgang beeinträchtigen.
5.Anschliessend das Fläschchen in kaltem Wasser auf Raumtemperatur abkühlen. Die Markierung ist nun abgeschlossen und die Lösung zur i.v.-Applikation nach erfolgter Qualitätskontrolle geeignet.
6.Die Radioaktivität des markierten Präparates in einem geeigneten Aktivimeter messen. Gesamtaktivität, Volumen, Konzentration, Messzeit und Datum auf dem beigelegten Warn-/Protokolletikett vermerken und damit das Präparat kennzeichnen.
Bemerkungen:
Das (99mTc)Technetium-Mertiatid-Präparat kann bis zu 8 Stunden nach Abschluss des Erhitzungsvorgangs verwendet werden. Bis dahin kann es unter Beachtung der Strahlenschutzvorschriften unter 25 °C aufbewahrt werden.
Vor der Verabreichung muss die radiochemische Reinheit bestimmt werden.
Anmerkungen zur Markierung
Zur Markierung dürfen nur 99mTc-Pertechnetat-Eluate aus Generatoren verwendet werden, die in der Schweiz registriert und zum Vertrieb zugelassen sind. Die Qualität der Eluate muss den Anforderungen der gültigen Ph. Eur. entsprechen, die Eluate müssen insbesondere frei von Oxidantien sein, und sie sollten weniger als 5ppm Aluminium enthalten. Um das Entstehen von radiochemischen Verunreinigungen in der Präparation so gering wie möglich zu halten und eine möglichst hohe Markierungsausbeute sicherzustellen, sollten Eluate mit höchstmöglicher radioaktiver Konzentration verwendet werden. Der Generator sollte gemäss der fraktionierten Elutionstechnik in 5 ml eluiert werden. Es sollten nur Eluate verwendet werden, die von einem (99mTc)-Generator stammen und innerhalb der letzten 24 Stunden eluiert wurden. Darüber hinaus dürfen nur Eluate verwendet werden, die aus einem (99mTc)-Generator gewonnen wurden, der weniger als eine Woche im Einsatz war.
Bei zu hoher Aktivität der (99mTc)Technetium-Mertiatid-Lösung kann diese mit physiologischer Natriumchloridlösung verdünnt werden. Die dazu verwendete Natriumchloridlösung muss steril und endotoxinfrei sein, sie darf keine Bakteriostatika oder Konservierungsmittel enthalten, und sie sollte aus Glasbehältern (Glasampullen), nicht aus Plastikbehältnissen entnommen werden.
Qualitätskontrolle
Vereinfachtes dünnschicht-chromatographisches Verfahren
Chromatographisches System 1
Teststreifen: ITLC-SG (2 - 2,5 cm x 10 cm)
Laufmittel: Ethylacetat/Methylethylketon (MEK) 60:40 % v/v
Chromatographisches System 2
Teststreifen: ITLC-SG (2 - 2,5 cm x 10 cm)
Laufmittel: Ethanol/Wasser 90:10 % v/v
Durchführung
1.Zwei ITLC-SG-Streifen mit je einem Bleistiftstrich 1,5 cm (= Start) und 8,5 cm (= Front) ab der unteren Kante kennzeichnen
2.Die Streifen werden für 1 Stunde bei 100°C getrocknet und in einer Trockenkammer mit Silica Gel aufbewahrt. Die Streifen sollen maximal 30min vor Gebrauch aus der Kammer genommen werden.
3.Für jedes chromatographisches System das Laufmittel in die Chromatographiekammer einfüllen und die Kammer verschliessen, damit sich der Lösungsmitteldampf gleichmässig verteilen kann (10 – 15 Minuten).
4.Die Probe an den Startlinien der Streifen auftragen und die Streifen in die Chromatographiekammern geben.
5.Sobald das Laufmittel die jeweilige Front erreicht hat (5-15min) , werden die Streifen aus der Kammer genommen und bei Raumtemperatur getrocknet.
Auswertung
Die Streifen werden mit einem TLC-Scanner ausgewertet. Wenn kein Scanner vorhanden ist, werden die Streifen 6cm vom unteren Rand zerschnitten und die Radioaktivität beider Teile separat gemessen.
Berechnung
Radiochemische Reinheit = 100% - ( [%] + [%])
wobei

Anforderung radiochemische Reinheit:
direkt nach Markierung: ≥ 95 % 99mTc-Tiatid
8 Stunden nach Markierung: ≥ 94 % 99mTc-Tiatid
Bestimmung der radiochemischen Reinheit
Die Europäische Pharmakopöe gibt 2 Prüfverfahren (Papierchromatographie und HPLC) zur Bestimmung der radiochemischen Reinheit vor (Monographie [99mTc]Technetium-Mertiatid-Injektionslösung (Ph. Eur. 01/2008: 1372, corrected 7.00). Eine Prüfung auf radiochemische Reinheit der [99mTc]Technetium Mertiatid-Injektionslösung ([99mTc]-Mertiatid) vor der Anwendung am Patienten ist entsprechend den Prüfverfahren der Monographie im Europäischen Arzneibuch (s.o.) durchzuführen.
1.Die HPLC-Methode ist hierunter beschrieben:
Material:
Säule: 25 cm Chromopack Lichrosorb 10RP18
Mobile Phase A: Phosphatlösung pH 6 : Ethanol = 93 : 7
Phosphatlösung: 1,36 g KH2PO4 eingestellt mit 0,1 M NaOH auf pH 6
Mobile Phase B: Wasser : Methanol = 1 : 9
Verwenden Sie eine Gradienten Elution mit folgenden Parametern zu verwenden:
Zeit (min): Flussrate (ml/min): % A % B
10 1 100 0
15 1 0 100
Detektion: radiochemischer Detektor
Vorgang:
1.Die Chromatographiesäule mit mobiler Phase A einstellen.
2.20 µL der markierten Präparation injizieren.
3.Bei einer Durchflussgeschwindigkeit von 1,0 ml/min. (max. Totalcounts pro Kanal 30'000) erscheint der Tiatid-Peak am Ende der mobilen Phase A.
Anforderung radiochemische Reinheit:
T=0 Nach 8 Stunden
(99mTc)Technetium-Mertiatid ≥ 95,0%≥ 95 % 99mTc-Tiatid ≥ 94,0%
Gesamte Frontfraktion ≤ 3,0%≥ 94 % 99mTc-Tiatid ≤ 3,0%
Methanolfraktion ≤ 4,0% ≤ 4,0%
2.Vereinfachtes Sep-Pak Schnellverfahren
Diese Methode kann als eine Alternative zu den oben angeführten Methoden angewendet werden. Sie dient der Überprüfung des vom Anwender im Krankenhaus durchgeführten Markierungsverfahrens.
Die Methode basiert auf Kartuschen, deren Einsatz bei der Probenvorbereitung von wässrigen Lösungen für die Chromatographie weit verbreitet ist.
Material:
-1 ml und 10 ml Spritzen
-Waters Sep-Pak C18 Plus Short Kartusche, 360 mg Sorbens pro Kartusche; Artikelnummer WAT020515
-Ethanol absolut
-0,001 N Salzsäure
-Ethanol/Kochsalzlösung (Ethanol-Natriumchlorid-Lösung 9 g/l (Verhältnis 1:1))
Vorgehensweise:
Die Kartusche (z. B. Sep-Pak C18 Plus Short) wird mit 10 ml Ethanol absolut gespült, gefolgt von 10 ml 0,001 N Salzsäure (HCl). Jegliche Lösungsrückstände werden mit 5 ml Luft entfernt.
Die Technetium(99mTc)markierte Mertiatid-Lösung (0,1 ml) wird auf die Kartusche appliziert. Es ist wichtig, dass die Säule während der verschiedenen Schritte nicht austrocknet. Durch tropfenweise Zugabe von 10 ml 0,001 N HCl eluieren und das Eluat auffangen. Dieses erste Eluat enthält alle hydrophilen Verunreinigungen.
Anschließend die Kartusche durch tropfenweise Zugabe von 10 ml Ethanol-Kochsalzlösung im eluieren. Dieses zweite Eluat enthält Technetium(99mTc) Mertiatid. Die Kartusche enthält alle nicht eluierbaren Verunreinigungen.
Bestimmung der radiochemischen Reinheit/Verunreinigungen:
Setzen Sie die kombinierte eluierte Radioaktivität plus Kartusche als 100 % ein.

Anforderung:
direkt nach Markierung: T = 0≥ 94,0 % 99mTc-Tiatid nach 8 Stunden
Technetium(99mTc)-Mertiatid (2. Eluat) ³ 94,0 % ³ 94,0 %
Hydrophile Verunreinigungen (1. Eluat) £ 3,0 %≤ 3 % £ 3,0 %
Nicht eluierbare Verunreinigungen (Kartusche) £ 4,0 %≤ 4 % £ 4,0 %
Allgemeine Warnhinweise
Radioaktive Arzneimittel müssen vom Anwender so hergestellt werden, dass sowohl die Strahlenschutzbestimmungen als auch die pharmazeutischen Qualitätsanforderungen eingehalten werden. Es müssen geeignete aseptische Vorkehrungen getroffen werden.
Der Inhalt der Durchstechflasche ist ausschließlich für die Zubereitung von (99mTc)Technetium-Mertiatid vorgesehen und darf beim Patienten nicht direkt, d. h. ohne das vorgeschriebene Zubereitungsverfahren, angewendet werden.
Der Inhalt des Kits ist vor der Rekonstitution nicht radioaktiv. Nach der Zugabe von Natrium(99mTc)pertechnetat muss die zubereitete Substanz angemessen abgeschirmt werden.
Gesetzliche Bestimmungen
Abfallbeseitigung
Die von den Patienten ausgeschiedene Radioaktivität erfordert geeignete Vorsichtsmassnahmen, um jegliche Kontaminierung zu vermeiden.
Die Kennzeichnungsetiketten sind vor der Entsorgung zu vernichten. Die Entsorgung von Abfall muss gemäss den nationalen Vorschriften erfolgen. Verfallene (unversehrte) Fläschchen TechneScan MAG3 mit gefriergetrocknetem Inhalt sind nicht radioaktiv und können mit dem normalen Laborabfall entsorgt werden.
Für die Vorschriften und Empfehlungen zu Lagerung, Verwendung und Entsorgung des Generators, der als Quelle für die Natrium[99mTc]pertechnetat-Injektionslösung zur Markierung von TechneScan MAG3 dient, wird auf die den Generator begleitende Fachinformation verwiesen.
Strahlenschutzhinweis
Die Anwendung radioaktiver Stoffe am Menschen ist in der Schweiz durch die Strahlenschutzverordnung gesetzlich geregelt. Entsprechend ist für die Anwendung von Radiopharmaka nur autorisiert, wer über die erforderliche Bewilligung des Bundesamtes für Gesundheit verfügt.
Beim Umgang mit radioaktiven Stoffen sowie bei der Beseitigung radioaktiven Abfalls sind die Schutzvorkehrungen der obenerwähnten Verordnung zu beachten, um jede unnötige Bestrahlung von Patienten und Personal zu vermeiden.
Zulassungsnummer49796 (Swissmedic)
PackungenEine Kartonschachtel enthält 5 Fläschchen TechneScan MAG3.
Die Glasfläschchen (Typ I Ph. Eur.) sind verschlossen mit einem Brombutylgummistopfen und versiegelt mit einer flip-off-Verschlusskappe. (A)
Zulassungsinhaberinb.e.imaging AG, Schwyz
Stand der InformationAugust 2024
|



