ZusammensetzungWirkstoffe
Methylphenidati hydrochloridum.
Hilfsstoffe
Kapsel zu 10 mg: Saccharose (34 - 49 mg), Maisstärke, Povidon, Hypromellose, Macrogole, Ethylcellulose, Dibutylsebacat, Indigotin (E 132), Titandioxid (E 171), Eisenoxide (E 172), Gelatine, Schellack, Propylenglycol, Natriumhydroxid, Ammoniumhydroxid.
Kapsel zu 20 mg: Saccharose (68 – 100 mg), Maisstärke, Povidon, Hypromellose, Macrogole, Ethylcellulose, Dibutylsebacat, Indigotin (E 132), Titandioxid (E 171), Eisenoxide (E 172), Gelatine, Schellack, Propylenglycol, Natriumhydroxid, Ammoniumhydroxid.
Kapsel zu 30 mg: Saccharose (102 – 150 mg), Maisstärke, Povidon, Hypromellose, Macrogole, Ethylcellulose, Dibutylsebacat, Indigotin (E 132), Titandioxid (E 171), Eisenoxide (E 172), Gelatine, Schellack, Propylenglycol, Natriumhydroxid, Ammoniumhydroxid.
Indikationen/AnwendungsmöglichkeitenEquasym XR ist im Rahmen einer therapeutischen Gesamtstrategie zur Behandlung von Aufmerksamkeitsdefizit-Hyperaktivitäts-Störungen (ADHS, Attention Deficit Hyperactivity Disorder, ADHD) bei Kindern ab 6 Jahren und Jugendlichen bis 18 Jahren indiziert, wenn sich andere therapeutische Massnahmen allein als unzureichend erwiesen haben. Die Behandlung soll nur von Ärztinnen bzw. Ärzten die auf Verhaltensstörungen von Kindern und Jugendlichen spezialisiert sind, begonnen werden und muss auch von ihnen überwacht werden. Die Diagnose sollte entsprechend der DSM-IV-Kriterien oder der ICD-10-Klassifikation gestellt werden und sollte sich auf eine vollständige Anamnese und Untersuchung des Patienten stützen.
Die Wirksamkeit von Equasym XR bei der Behandlung von ADHS wurde in kontrollierten klinischen Studien an Kindern und Jugendlichen zwischen 6 und 17 Jahren, die die DSM-IV-Kriterien für ADHS aufwiesen, dokumentiert.
Weitere Informationen zur sicheren Anwendung des Arzneimittels:
ADHS ist auch unter dem Begriff der Aufmerksamkeitsdefizit-Störung (ADS) bekannt. Andere Ausdrücke zur Beschreibung dieser Verhaltensauffälligkeit sind: hyperkinetische Störung, minimale Gehirnschäden, minimale Gehirnfunktionsstörung bei Kindern, leichte zerebrale Funktionsstörung und psycho-organisches Syndrom bei Kindern.
Die Anwendung von Equasym XR sollte sich auf jene Patienten und Patientinnen beschränken, welche ein Präparat benötigen, bei dem die Wirkungen bei morgendlicher Einnahme bis zum Ende des Schultags andauern. Equasym XR sollte als Teil eines umfassenden Therapieprogramms eingesetzt werden, wenn sich Verhaltensmassnahmen allein als unzureichend erwiesen haben. Ein umfassendes Therapieprogramm zur Behandlung von ADHS kann psychologische, pädagogische und soziale Massnahmen beinhalten. Durch die Behandlung mit Equasym XR können die Hauptsymptome des ADHS wie mässige bis starke Ablenkbarkeit, rasch nachlassende Aufmerksamkeit, Impulsivität, verstärkte motorische Aktivität und gestörtes Sozialverhalten gemildert werden.
Eine Behandlung mit Equasym XR ist nicht bei allen Kindern und Jugendlichen mit ADHS angezeigt, und die Entscheidung über die Anwendung des Arzneimittels muss auf einer sehr sorgfältigen Beurteilung des Schweregrads der Symptome des Patienten beruhen. Stimulanzien sind nicht zur Anwendung bei Patienten vorgesehen, die sekundäre umfeldbedingte Symptome und/oder andere primäre psychiatrische Störungen, einschliesslich Psychosen, zeigen. Geeignete pädagogische Massnahmen sind essentiell und eine psychosoziale Betreuung ist oft hilfreich.
Die spezifische Ätiologie dieses Syndroms ist unbekannt. Eine adäquate Diagnose kann nicht durch einen einzelnen diagnostischen Test gestellt werden. Sie erfordert den Einsatz medizinischer, spezieller psychologischer, pädagogischer und sozialer Ressourcen. Das Lernen kann, muss aber nicht, beeinträchtigt sein.
Dosierung/AnwendungAbklärungen vor Behandlungsbeginn
Vor Beginn der Behandlung mit Equasym XR ist es notwendig einen kardiovaskulären Status zu erheben und zu dokumentieren, Blutdruck und Herzfrequenz einschliessend. Da keine Langzeitdaten vorliegen, sollten regelmässige kardiovaskuläre Untersuchungen bei Vorliegen eines Risikofaktoren-Profils erfolgen (siehe unter «Warnhinweise und Vorsichtsmassnahmen»).
Weiterhin ist vor Beginn der Behandlung das Gewicht und die Grösse zu erheben und in einer Wachstumskurve zu dokumentieren.
Equasym XR wurde bei Erwachsenen nicht untersucht und sollte daher in dieser Altersgruppe nicht angewendet werden.
Kinder und Jugendliche (über 6 Jahren)
Patienten, die erstmalig Methylphenidat erhalten: Um unnötig hohe Dosen von Methylphenidat zu vermeiden, ist eine sorgfältige Dosistitration durch den behandelnden Arzt erforderlich. Bei Patienten, die erstmalig Methylphenidat erhalten, können niedrige Dosen der schnell wirkenden Methylphenidat-Formulierung bereits ausreichend sein. Die empfohlene Anfangsdosis von Equasym XR beträgt einmal täglich 10 mg für Patienten, die zurzeit kein Methylphenidat einnehmen oder die unter Behandlung mit anderen Stimulanzien als Methylphenidat stehen.
Patienten, die zurzeit Methylphenidat einnehmen: Patienten, die auf eine schnell freisetzende Methylphenidat-Formulierung eingestellt sind, können auf die äquivalente tägliche Dosis in Milligramm von Equasym XR umgestellt werden. Zum Beispiel werden 20 mg Equasym XR als äquivalent zu 10 mg einer schnell freisetzenden Methylphenidat-Formulierung zum Frühstück und 10 mg zum Mittag betrachtet.
Equasym XR setzt sich aus einer sofort freisetzenden Komponente (30 % der Dosis) und einer verzögert freisetzenden Komponente (70 % der Dosis) zusammen. Entsprechend enthält z.B. Equasym XR 10 mg 3 mg des sofort freisetzenden und 7 mg des verzögert freisetzenden Dosisanteils. Der verzögert freisetzende Anteil der Einzeldosis wurde entwickelt, um den Behandlungserfolg über den Nachmittag ohne die Notwendigkeit einer mittäglichen Dosis aufrecht zu erhalten. Equasym XR wurde entwickelt, um therapeutische Plasmaspiegel für Zeiträume wie einen Schultag (eher als einen ganzen Tag) zu sichern (vgl. «Pharmakokinetik»).
Wenn die Wirkung des Arzneimittels am Abend zu früh nachlässt, können gestörtes Verhalten und/oder Einschlafstörungen auftreten. Eine niedrige Dosis einer sofort freisetzenden Methylphenidat-Tablette am Abend kann dazu beitragen, dieses Problem zu lösen.
Die maximal tägliche Dosis von Equasym XR beträgt 60 mg.
Equasym XR Retardkapseln sollten am Morgen vor dem Frühstück verabreicht werden. Die Retardkapseln müssen geschluckt und dürfen nicht zerkleinert oder gekaut werden. Die Retardkapseln können geöffnet und der gesamte Kapselinhalt kann sofort mit einer kleinen Menge (Esslöffel) Apfelmus oder Brei (gefolgt von einem Getränk) verabreicht werden. Auch bei dieser Verabreichungsart ist darauf zu achten, dass das Granulat nicht zerkaut wird.
Spezielle Dosierungsanweisungen
In kontrollierten Studien wurde die Anwendung von Equasym XR bei Patienten unter sechs Jahren nicht untersucht. Equasym XR darf bei Patienten unter sechs Jahren nicht angewendet werden.
Hinweis: Wenn sich die Symptome nach Dosissteigerung über einen Monat nicht bessern, sollte das Arzneimittel abgesetzt werden. Die medikamentöse Behandlung der ADHS wird normalerweise während oder nach der Pubertät eingestellt.
Weiterführung/Längerfristige Behandlung
Es liegen keine schlüssigen Daten aus kontrollierten Studien darüber vor, wie lange ADHS-Patienten mit Equasym XR behandelt werden sollten. Im Allgemeinen ist man sich jedoch darüber einig, dass es erforderlich sein kann, eine pharmakologische Behandlung von ADHS über einen längeren Zeitraum fortzuführen. Der verschreibende Arzt, der für einen ADHS-Patienten eine längerfristige Behandlung vorsieht, sollte jedoch den längerfristigen Nutzen des Arzneimittels für den betreffenden Patienten in regelmässigen Abständen prüfen, indem er das Arzneimittel zeitweilig absetzt (spätestens nach 12 Monaten) und den Krankheitsverlauf ohne Pharmakotherapie beurteilt. Eine erreichte Verbesserung kann erhalten bleiben, wenn die Behandlung zeitweilig oder dauerhaft abgesetzt wird.
Eingeschränkte Nierenfunktion
Es liegen keine systematischen Untersuchungen zu Patienten mit eingeschränkter Nierenfunktion vor (s. «Pharmakokinetik»).
Eingeschränkte Leberfunktion
Es liegen keine systematischen Untersuchungen zu Patienten mit eingeschränkter Leberfunktion vor.
Erwachsene und ältere Patienten
Die Sicherheit und Wirksamkeit von Equasym XR wurde bei Erwachsenen und älteren Patienten nicht untersucht.
KontraindikationenEquasym XR darf nicht angewendet werden bei bekannter Überempfindlichkeit gegenüber Methylphenidat oder einem der Hilfsstoffe.
Bei ausgeprägten Angst- und Spannungszuständen sowie ausgeprägter Agitiertheit darf Equasym XR nicht angewendet werden, da es zu einer Verstärkung dieser Symptome kommen könnte. Equasym XR darf nicht angewendet werden bei Patienten mit bestehenden motorisch-verbalen Tics, mit bestehenden Tics bei Geschwistern oder bei diagnostiziertem oder in der Familie vorgekommenem Tourette-Syndrom.
Equasym XR darf nicht angewendet werden, während einer Behandlung mit Monoaminooxidase-Hemmern (MAO-Hemmern) und während mindestens14 Tagen im Anschluss an die Absetzung eines Monoamniooxidase-Hemmers (Gefahr einer hypertensiven Krise) (siehe «Interaktionen»).
Darüber hinaus darf Equasym XR nicht angewendet werden
·bei Patienten mit Phäochromozytom
·bei Patienten mit Glaukom
·bei Patienten mit Hyperthyreoidismus
·bei Patienten mit Thyreotoxikose
·bei Patienten mit Herzrhythmusstörungen
·bei Patienten mit vorbestehenden Herzkreislauferkrankungen einschliesslich schwerer Hypertonie, Herzinsuffizienz, Angina pectoris, hämodynamisch signifikanter, angeborener Herzfehler, Kardiomyopathien, Herzinfarkt, potentiell lebensbedrohender Arrhythmien und Kanalopathien (Erkrankungen, die aufgrund von Dysfunktionen der Ionenkanäle verursacht wurden)
·bei Patienten mit arterieller Verschlusskrankheit
·bei Patienten mit der Diagnose oder Anamnese von schwerer Depression, Anorexia nervosa, psychotischen Symptomen, Suizidneigung, Manie, Schizophrenie, Borderline Persönlichkeitsstörung, da Methylphenidat diese Umstände verschlechtern kann.
·bei Patienten mit bekannter Drogenabhängigkeit bzw. mit Arzneimittel- oder Alkoholmissbrauch
·bei Patienten mit vorbestehenden zerebrovaskulären Erkrankungen, wie zum Beispiel zerebrale Aneurysmen, Gefässabnormitäten einschliesslich Vaskulitis oder Schlaganfall
Warnhinweise und VorsichtsmassnahmenZur Wirksamkeit und Sicherheit und zur Dosierung bei Kindern unter 6 Jahren liegen keine ausreichenden Daten vor.
Equasym XR sollte nicht zur Behandlung von schweren exogenen oder endogenen Depressionen angewendet werden.
Plötzlicher Herztod und vorbestehende strukturelle Herzerkrankungen sowie andere schwere Herzkrankheiten
Kinder und Jugendliche
Bei Kindern mit kardialen strukturellen Anomalien am Herzen, die mit Stimulantien, einschliesslich Methylphenidat, behandelt wurden, wurde über plötzliche Todesfälle berichtet. Bei Kindern mit strukturellen kardialen Anomalien oder kardiovaskulären Vorerkrankungen sollte Methylphenidat deshalb nicht angewendet werden.
Arterielle Hypertonie und andere kardiovaskuläre Erkrankungen
Die Anwendung von Stimulantien verursacht eine moderate durchschnittliche Zunahme des Blutdrucks (um etwa 2-4 mmHg) und der Herzfrequenz (um etwa 3-6 Schläge pro Minute). Bei einzelnen Patienten können die Zunahmen deutlicher sein. Alle Patienten mit klinisch relevanten Veränderungen von Herzfrequenz und Blutdruck müssen überwacht werden. Besondere Vorsicht ist bei der Behandlung von Patienten geboten, deren Begleiterkrankungen durch eine Erhöhung des Blutdrucks und der Herzfrequenz beeinträchtigt werden könnten, wie Patienten mit vorbestehender arterieller Hypertension, Herzversagen, kürzlich aufgetretenem Myokardinfarkt oder ventrikulärer Arrhythmie.
Einschätzung des kardiovaskulären Status von Patienten, die mit Stimulantien behandelt werden
Um bestehende Herzkrankheiten zu erkennen, sollte bei Patienten, bei denen eine Behandlung mit Equasym XR vorgesehen ist, eine sorgfältige Anamnese (einschliesslich Abklärung der Familiengeschichte in Bezug auf plötzliche Todesfälle oder ventrikuläre Arrhythmien) und eine körperliche Untersuchung durchgeführt werden. Falls erste Befunde auf eine solche Erkrankung hinweisen, sollten weitere kardiologische Untersuchungen durchgeführt werden (z.B. Elektrokardiogramm, Echokardiogramm).
Der kardiovaskuläre Status sollte beobachtet werden. Blutdruck und Herzfrequenz sollten bei jeder Dosisanpassung oder in angemessenen Abständen (mindestens aber alle 6 Monate) überprüft und dokumentiert werden und anschliessend, falls immer klinisch indiziert.
Bei Kindern, die während der Behandlung mit Equasym XR Symptome entwickeln wie Palpitationen, Schmerzen in der Brust bei körperlicher Anstrengung, Synkopen oder andere Symptome, die auf eine Herzkrankheit deuten könnten, muss unverzüglich eine Herzuntersuchung vorgenommen werden.
Vorbestehende zerebrale Erkrankungen einschliesslich zerebraler struktureller Veränderungen
Patienten mit vorbestehenden zerebralen Anomalien, z.B. zerebralem Aneurysma und/oder Gefässanomalien wie Vaskulitis oder vorbestehendem Hirnschlag, sollten nicht mit Equasym XR behandelt werden.
Psychiatrische unerwünschte Wirkungen
Vorbestehende Psychose
Durch die Verabreichung von Stimulantien können bei Patienten mit vorbestehender psychotischer Störung die Symptome einer Verhaltensstörung, einer Gedankenstörung und von psychotischem Erleben verschlimmert werden.
Bipolare Störung
Vorsicht gilt auf jeden Fall bei der Anwendung von Stimulantien zur Behandlung von ADHS bei Patienten, bei denen eine komorbide bipolare Störung vorliegen könnte, die sich aber aktuell im gesunden Intervall befinden, da bei solchen Patienten eine gemischte/manische Episode ausgelöst werden kann (vergleiche «Kontraindikationen»). Vor dem Behandlungsbeginn mit Stimulantien muss bei Patienten mit komorbiden depressiven Symptomen sehr sorgfältig abgeklärt werden, ob bei ihnen ein Risiko für eine bipolare oder für eine psychotische Störung besteht. Zu diesen Abklärungen gehört die Aufnahme einer detaillierten psychiatrischen Krankengeschichte, einschliesslich einer Familien-Anamnese von Suiziden, bipolaren Störungen und Depressionen.
Auftreten neuer psychotischer oder manischer Symptome
Durch die Behandlung mit Stimulantien können bei Kindern und Jugendlichen ohne bisher festgestellte psychotische Störungen oder Manien bei normalen Dosen psychotische oder manische Symptome wie Halluzinationen, wahnhafte Störungen oder Manien ausgelöst werden. Wenn solche Symptome beobachtet werden, ist zu erwägen, ob das Stimulans in einem ursächlichen Zusammenhang steht und ein Abbruch der Behandlung angebracht ist. In einer Meta-Analyse von mehreren placebokontrollierten Kurzzeit-Studien wurden solche Symptome bei etwa 0,1% der mit Stimulantien behandelten Patienten festgestellt (4 Patienten mit Ereignissen bei insgesamt 3'482 Patienten, die über mehrere Wochen mit Methylphenidat oder Amphetamin bei normalen Dosen behandelt wurden), gegenüber 0% bei den mit Placebo behandelten Patienten.
Aggression
Bei Kindern und Jugendlichen mit ADHS wird oft aggressives Verhalten oder Feindseligkeit festgestellt. Auch in klinischen Studien und Postmarketing-Beobachtungen zu Arzneimitteln für die Behandlung von ADHS wurde darüber berichtet. Obwohl es keine eindeutigen Hinweise dafür gibt, dass Stimulantien aggressives Verhalten oder Feindseligkeit hervorrufen, sollten Patienten am Anfang der ADHS-Behandlung sorgfältig auf das Auftreten oder die Verschlimmerung von aggressivem Verhalten oder Feindseligkeit überwacht werden (s. auch Abschnitt zu Suizidalität, da Feindseligkeit auch im Zusammenhang mit Suizidalität auftreten kann).
Bei Patienten, die eine Therapie mit Methylphenidat beginnen, sollte auf das Auftreten oder die Verstärkung von aggressivem Verhalten geachtet werden.
Eine sorgfältige Überwachung ist nötig. Aggression ist häufig mit ADHS assoziiert; dennoch wurde von unerwartetem Auftreten oder einer Verstärkung von Aggression während der Therapie mit Methylphenidat berichtet. Ein Therapieabbruch kann in Betracht gezogen werden. (siehe «Unerwünschte Wirkungen»)
Serotoninsyndrom
Wie auch bei anderen serotonerg wirkenden Substanzen kann unter Methylphenidat ein Serotoninsyndrom, eine potentiell lebensbedrohliche Situation, auftreten, insbesondere dann, wenn Methylphenidat gleichzeitig verabreicht wird mit anderen serotonergen Arzneimitteln. Dazu gehören selektive Serotonin-Wiederaufnahmehemmer (SSRI), Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI), trizyklische Antidepressiva, Phenothiazine, Triptane, Lithium, Fentanyl, Dextromethorphan, Tramadol, Tapentadol, Meperin, Methadon, Pentacocin, Johanneskraut (Hypericum) oder Wirkstoffe, die den Metabolismus von Serotonin beeinflussen, wie der antibiotische Wirkstoff Linezolid und der nicht-selektive MAO-Inhibitor Methylenblau, mit reversibler nicht-selektiver MAO-Hemmung oder Serotonin-Vorstufen (wie Tryptophan).
Die gleichzeitige Verabreichung von Methylphenidat und serotonergen Arzneimitteln wird nicht empfohlen, da dies zur Entwicklung eines Serotoninsyndroms führen kann. Die Symptome des Serotoninsyndroms können umfassen: Veränderungen des mentalen Status (z.B. Agitation, Halluzinationen, Delirium und Koma), autonome Instabilität (z.B. Tachykardie, labiler Blutdruck, Schwindel, Diaphorese, Flush, Hyperthermie), neuromuskuläre Symptome (z.B. Tremor, Rigidität, Myoklonus, Hyperreflexie, Koordinationsstörungen), Krampfanfälle und/oder gastrointestinale Symptome (z.B. Übelkeit, Erbrechen, Diarrhö). Das Serotonin-Syndrom in seiner schwersten Ausprägung kann einem malignen neuroleptischen Syndrom ähneln, das Symptome umfasst wie Hyperthermie, Muskelrigidität, autonome Instabilität mit möglicher schneller Fluktuation der Vitalzeichen und Veränderungen des mentalen Zustands. Rasches Erkennen dieser Symptome ist wichtig.
Methylphenidat und serotonerge Arzneimittel müssen unverzüglich abgesetzt werden und eine geeignete Behandlung eingeleitet werden (Siehe «Interaktionen»).
Im Zusammenhang mit der Behandlung mit methylphenidathaltigen Produkten wurden sowohl bei Kindern und Jugendlichen als auch bei Erwachsenen über Einzelfälle von lang anhaltenden und schmerzhaften Erektionen (Priapismus) berichtet, die eine sofortige ärztliche Behandlung, gelegentlich auch eine chirurgische Intervention erforderten. (siehe «Unerwünschte Wirkungen»).
Priapismus wurde meist nicht während des Therapiebeginns berichtet, sondern entwickelte sich nach einiger Zeit der Einnahme des Arzneimittels, oft im Anschluss an eine Dosiserhöhung.
Priapismus trat auch während einer methylphenidatfreien Zeit (Therapiepause oder Therapieunterbruch) auf.
Patienten, die eine schmerzhafte Erektion entwickeln, die ungewöhnlich lang anhalten (mehr als 2 Stunden) oder häufig sind, sollten unverzüglich eine Ärztin oder einen Arzt aufsuchen. Die Medizinalpersonen sollen Patienten und ihre Eltern ausdrücklich auf dieses Problem und dessen Dringlichkeit hinweisen.
Suizidalität
Psychiatrische Erkrankungen sind mit einem wissenschaftlich nachgewiesenen erhöhtem Risiko für Selbstmordgedanken, Selbstverletzung und Selbstmord verbunden. Suizidale Verhaltensweisen (Suizidversuch und Suizidgedanken) wurden auch bei Patienten festgestellt, die mit Methylphenidat behandelt wurden.
Patienten, die wegen ADHS behandelt werden, sind um Hinblick auf das Auftreten oder die Verschlimmerung von psychopathologischen Symptomen wie Feindseligkeit und emotionale Labilität sorgfältig zu überwachen. Grundsätzlich ist nicht auszuschliessen, dass unter Therapie mit Methylphenidat sich Suizidalität (suizidale Gedanken, suizidales Verhalten) entwickelt oder sich verschlechtert.
Auch bei allgemeiner Verschlechterung des Zustandes, selbst ohne spezifische Hinweise auf Suizidalität, ist an eine mögliche Entwicklung von Suizidalität zu denken, und entsprechende Massnahmen sind durch Fachärzte einzuleiten (s. auch «Kontraindikationen»).
Solche Patienten müssen daher während der Behandlung besonders sorgfältig überwacht werden. Patienten (und deren Betreuer) sollten auf die dringende Notwendigkeit einer Überwachung des Zustandes (einschliesslich der Entwicklung von neuen Symptomen) und/oder der potentiellen Möglichkeit des Auftretens von Suizidgedanken, suizidalem Verhalten und selbstschädigenden Absichten hingewiesen werden und sofort medizinischen Rat einholen, wenn derartige Symptome auftreten. Dabei ist zu beachten, dass das Auftreten von manchen Symptomen, wie z.B. Ruhelosigkeit, sowohl auf den zugrunde liegenden Krankheitszustand, als auch auf die Arzneimitteltherapie zurückzuführen sein könnte.
Ein Missbrauch von Arzneimitteln, welche das zentrale Nervensystem stimulieren, ist möglicherweise assoziiert mit plötzlichem Tod oder anderen schweren kardiovaskulären Ereignissen.
Eine Behandlung mit Methylphenidat ist nicht in allen Fällen von Aufmerksamkeitsdefizit-Hyperaktivitäts-Störungen angezeigt und sollte nur nach vollständiger und eingehender Anamnese und Untersuchung des Kindes in Betracht gezogen werden. Die Entscheidung zur Verordnung von Methylphenidat sollte von einer Einschätzung der Schwere der Symptome und ihrer Relation zum Alter des Kindes erfolgen und nicht nur vom Vorhandensein einer oder mehrerer abnormaler Verhaltenseigenschaften abhängen. Wenn solche Symptome zusammen mit akuten Stressreaktionen einhergehen, ist die Behandlung mit Equasym XR üblicherweise nicht angezeigt.
Es gibt klinische Hinweise darauf, dass während der Verabreichung von Arzneimitteln mit dem Wirkstoff Methylphenidat vermehrt psychiatrische Störungen (einschliesslich Suchtverhalten und suizidales Verhalten) sowie Gewichts- und Appetitverlust auftreten. Eine sorgfältige Erfassung solcher Veränderungen oder aber von Anzeichen für Fehlgebrauch und Missbrauch des Medikamentes muss bei jedem Besuch und jeder Dosisanpassung vorgenommen werden.
Bei der Langzeitanwendung von Kindern mit Methylphenidat wurde über Wachstumshemmung (reduzierte Zunahme von Gewicht und/oder Körpergrösse) berichtet.
Follow-up Untersuchungen bei Kindern zwischen 7 und 10 Jahren deuten darauf hin, dass Kinder, die konstant (z.B. 7 Tage pro Woche während 1 Jahr) Methylphenidat einnehmen, eine vorübergehende Verlangsamung der Wachstumsrate (im Durchschnitt 2 cm weniger Längenwachstum und 2,7 kg weniger Gewichtszunahme über 3 Jahre) zeigen können. Aus diesem Grunde sollten Patienten, die eine Langzeitbehandlung benötigen, sorgfältig (mindestens 6 Monate) bezüglich Grösse, Gewicht und Appetit überwacht und in einer Wachstumskurve dokumentiert werden. Bei Patienten, bei denen Wachstum oder Gewichtszunahme nicht den Erwartungen entsprechen, sollte die Behandlung unterbrochen werden.
Equasym XR soll nicht zur Prävention oder Behandlung normaler Ermüdungszustände verwendet werden.
Chronischer Missbrauch von Methylphenidat kann zu ausgeprägter Toleranz und psychischer Abhängigkeit mit unterschiedlichen Graden von abnormalem Verhalten führen. Insbesondere bei parenteralem Abusus kann es zu psychotischen Episoden kommen.
Vorsicht ist bei emotional instabilen Patienten angezeigt, etwa bei Drogenabhängigkeit oder Alkoholismus in der Vorgeschichte, da solche Patienten die Dosis möglicherweise eigenständig erhöhen.
Equasym XR sollte bei Patienten mit epileptischen Anfällen in der Anamnese, oder mit vorbestehenden Abnormalitäten des EEG ohne epileptische Anfälle oder bei Patienten ohne vorherige epileptische Anfälle und Hinweise im EEG nur mit Vorsicht angewendet werden, da klinische Erfahrungen gezeigt haben, dass es bei einer kleinen Anzahl von Patienten die Krampfschwelle herabsetzen kann. Wenn die Häufigkeit der Anfälle steigt, sollte Methylphenidat abgesetzt werden.
Wird das Arzneimittel abgesetzt, ist eine sorgfältige Überwachung erforderlich, da es zu Entzugserscheinungen sowie zur Demaskierung von Depressionen oder von Effekten chronischer Überaktivität kommen kann. Gewisse Patienten müssen daher möglicherweise während längerer Zeit beobachtet werden.
Vorsicht bei der Anwendung zentral wirksamer alpha-2-Agonisten, wie Clonidin (siehe «Interaktionen»).
In seltenen Fällen sind Symptome von Sehstörungen vorgekommen. Dabei ist über Akkomodationsstörungen und verschwommenes Sehen unter Therapie mit Methylphenidat berichtet worden.
Stimulanzien mit Wirkung auf das Zentralnervensystem einschliesslich Methylphenidat sind mit der Auslösung oder Verschlimmerung motorischer oder verbaler Tics in Verbindung gebracht worden. Vor jeder Behandlung mit Stimulanzien sollte deshalb eine klinische Beurteilung der Patienten hinsichtlich Tics durchgeführt werden. Dabei ist auch die Familienanamnese beizuziehen.
Das langfristige Sicherheits- und Wirksamkeitsprofil von Methylphenidat ist nicht vollständig bekannt. Patienten, die eine Langzeittherapie benötigen, sollten daher sorgfältig überwacht werden, und in regelmässigen Abständen sollte ein Blutbild, ein Differentialblutbild und die Anzahl der Thrombozyten bestimmt werden.
Eine sorgfältige Überwachung ist beim Absetzen des Arzneimittels erforderlich, da es dabei zur Aufdeckung von Depression oder auch chronischer Überaktivität kommen kann. Einige Patienten benötigen möglicherweise Nachuntersuchungen über einen längeren Zeitraum.
Patientinnen im gebärfähigen Alter (ab der ersten Monatsblutung) sollen Methylphenidat nicht einnehmen, es sei denn, die Anwendung ist unbedingt erforderlich (siehe Schwangerschaft, Stillzeit und Präklinische Daten).
Patienten mit der seltenen hereditären Fructose-/Galactose-Intoleranz, einer Glucose-Galactose-Malabsorption oder einer Sucrase-Isomaltase-Insuffizienz sollten dieses Arzneimittel nicht anwenden.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Kapsel, d.h. es ist nahezu «natriumfrei».
InteraktionenHumanmedizinische pharmakologische Studien haben gezeigt, dass Methylphenidat den Metabolismus von Cumarin-Antikoagulanzien, einigen Antikonvulsiva (Phenobarbital, Phenytoin, Primidon), Phenylbutazon und bestimmten Antidepressiva (trizyklische Antidepressiva, selektive Serotonin-Wiederaufnahmehemmer) hemmen kann. Die Dosis dieser Arzneimittel muss möglicherweise verringert werden. Aufgrund der möglichen Erhöhung des Blutdrucks sollte Equasym XR in Kombination mit vasopressorischen Substanzen nur mit Vorsicht angewendet werden (siehe «Warnhinweise und Vorsichtsmassnahmen»).
Methylphenidat kann die blutdrucksenkende Wirkung von Antihypertensiva reduzieren.
Bei gleichzeitiger Anwendung mit Clonidin wurden schwerwiegende Nebenwirkungen einschliesslich des plötzlichen Herztodes gemeldet. Die Sicherheit der Anwendung von Methylphenidat in Kombination mit Clonidin oder anderen zentral wirksamen alpha-2-Agonisten wurde nicht systematisch untersucht.
Anwendung mit dopaminergen Arzneimitteln
Bei der Anwendung von Methylphenidat mit dopaminergen Arzneimitteln (einschliesslich Antipsychotika) ist Vorsicht geboten. Da die Erhöhung der extrazellulären Dopaminkonzentrationen zu den Hauptwirkungen von Methylphenidat gehört, kann die Substanz zu pharmakodynamischen Wechselwirkungen führen, wenn sie gleichzeitig mit direkten und indirekten Dopaminagonisten (einschliesslich DOPA und trizyklischen Antidepressiva) oder mit Dopaminantagonisten (einschliesslich Antipsychotika) verabreicht wird.
Gleichzeitige Anwendung mit serotonergen Arzneimitteln
Die gleichzeitige Verabreichung von Methylphenidat und anderen serotonergen Arzneimitteln (einschliesslich Triptane, SSRIs, SNRIs, Lithium, Fentanyl und seine Analoga, Tramadol, Dextromethorphan, Tapentadol, Meperidin, Methadon, Pentacocin oder Johanniskraut (Hypericum), von Arzneimitteln, die den Serotonin-Stoffwechsel hemmen (einschliesslich MAOI, wie z.B. Methylenblau), oder von Serotonin-Vorstufen (z.B. Tryptophan) wird nicht empfohlen, da dies zur Entwicklung eines Serotoninsyndroms führen kann (siehe «Warnhinweise und Vorsichtsmassnahmen»). Es wurde gezeigt, dass Methylphenidat die extrazelluläre Konzentration von Serotonin und Noradrenalin erhöht und dass es eine schwache Fähigkeit zur Bindung an den Serotonintransporter zu haben scheint.
Alkohol kann die ZNS-Nebenwirkungen von psychoaktiven Arzneimitteln einschliesslich Methylphenidat verstärken. Daher sollten die Patienten während des Behandlungszeitraums keinen Alkohol zu sich nehmen.
Halogenierte Narkosemittel:
Während einer Operation besteht das Risiko einer plötzlichen Erhöhung des Blutdrucks. Wenn eine Operation geplant ist, sollte die Therapie mit Methylphenidat nach Rücksprache mit den behandelnden Psychiatern bzw. Kinder- und Jugendpsychiatern und den Narkoseärzten vorübergehend den Umständen angepasst werden (z.B. keine Anwendung am Tag der Operation).
Schwangerschaft, StillzeitSchwangerschaft
Daten aus einer Kohortenstudie mit insgesamt etwa 3400 im ersten Trimenon exponierten Schwangerschaften deuten nicht auf ein insgesamt erhöhtes Risiko von Geburtsfehlern hin. Die Häufigkeit kardialer Fehlbildungen war leicht erhöht (gepooltes adjustiertes relatives Risiko 1,3; 95%-KI: 1,0–1,6), entsprechend 3 zusätzlichen Kindern mit kongenitaler kardialer Fehlbildung auf 1000 Frauen, die Methylphenidat im ersten Trimenon erhalten, im Vergleich zu nicht exponierten Schwangerschaften.
Es liegen Spontanberichte von kardiorespiratorischer Toxizität bei Neugeborenen vor, insbesondere wurde von fetaler Tachykardie und Atemnot berichtet.
In tierexperimentelle Studien fand sich eine Reproduktionstoxizität (nähere Angaben unter dem Kapitel «Präklinische Daten»). Das potentielle Risiko für den Menschen ist nicht bekannt.
Während der Schwangerschaft darf das Arzneimittel nicht verabreicht werden, es sei denn dies ist eindeutig erforderlich.
Stillzeit
Es ist nicht bekannt, ob Methylphenidat oder seine Metaboliten in die Muttermilch übertreten; aus Sicherheitsgründen sollen stillende Mütter Equasym XR jedoch nicht anwenden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEquasym XR kann Schwindel, Schläfrigkeit und Sehstörungen (Akkomodationsstörungen, verschwommenes Sehen) verursachen. Es ist daher ratsam, beim Führen von Fahrzeugen, Bedienen von Maschinen oder anderen potenziell gefährlichen Aktivitäten Vorsicht walten zu lassen.
Unerwünschte WirkungenHäufigkeitseinschätzung: sehr häufig ≥10%; häufig ≥1% bis <10%; gelegentlich ≥0,1% bis <1%; selten ≥0,01% bis <0,1%; sehr selten <0,01%, unbekannt (Häufigkeit kann aufgrund der vorhandenen Daten nicht abgeschätzt werden).
Bei der Anwendung von methylphenidathaltigen Arzneimitteln sind unerwünschte Arzneimittelwirkungen beobachtet worden, die als Klasseneffekte zu deuten sind.
Die dabei am häufigsten beobachteten Nebenwirkungen sind:
Infektionen und parasitäre Erkrankungen: Nasopharyngitis
Stoffwechsel- und Ernährungsstörungen: Anorexie, verminderter Appetit, mässig verringerte Gewichts- und Grössenzunahme bei längerer Anwendung bei Kindern
Psychiatrische Störungen: Schlaflosigkeit, Nervosität, Anorexie, Affektlabilität, Aggression, Unruhe, Angst, Depression, Reizbarkeit, anormales Verhalten
Erkrankungen des Nervensystems: Kopfschmerzen, Schwindel, Dyskinesie, psychomotorische Hyperaktivität, Somnolenz
Herzerkrankungen: Arrhythmie, Tachykardie, Palpitationen
Gefässerkrankungen: Hypertonie
Erkrankungen der Atemwege, des Brustraums und Mediastinums: Husten, Rachen- und Kehlkopfschmerzen
Erkrankungen des Gastrointestinaltrakt: Bauchschmerzen, Durchfall, Übelkeit, Magenbeschwerden und Erbrechen, Mundtrockenheit, Dyspepsie, Zahnschmerzen
Erkrankungen der Haut und des Unterhautzellgewebes: Alopezie, Pruritus, Hautausschlag, Urtikaria
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen: Arthralgie
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort: Pyrexie, Wachstumsverzögerung unter längerer Anwendung bei Kindern, Unruhegefühl
Untersuchungen: Veränderungen von Blutdruck und Herzfrequenz (meist eine Erhöhung), Gewichtsabnahme
Unabhängig von ihrer Häufigkeit muss auch auf die folgenden klinisch bedeutsamen oder schwerwiegenden Nebenwirkungen bei methylphenidathaltigen Arzneimitteln hingewiesen werden:
Psychiatrische Erkrankungen: Suizid, Suizidversuch, Suizidgedanken, stereotype (krankhaft häufig wiederholte) Verhaltensweisen, taktile Halluzinationen
Erkrankungen des Nervensystems: choreatische Bewegungsstörungen, Tics oder Verschlechterung bestehender Tics, reversible Nervenausfälle, Migräne, malignes neuroleptisches Syndrom
Augenerkrankungen: Akkomodationsstörungen
Herzerkrankungen: Plötzlicher Herztod, Herzinfarkt
Gefässerkrankungen: zerebrovaskuläre Störungen bzw. Hämorrhagie, Vaskulitis, Raynaud-Syndrom, peripheres Kältegefühl (kalte Hände und Füsse)
Erkrankungen des Gastrointestinaltrakt: Leberfunktionsstörung
Erkrankungen der Haut und des Unterhautzellgewebes: Exfoliative Dermatitis, Steven-Johnson-Syndrom, Erythema multiforme, Arzneimittelexanthem
Erkrankungen der Geschlechtsorgane und der Brustdrüse: Gynäkomastie
Daneben wurde über unerwünschte Arzneimittelwirkungen im Zusammenhang mit der Anwendung von Equasym XR berichtet:
Nervosität und Schlaflosigkeit sind sehr häufige Nebenwirkungen zu Beginn der Behandlung, die sich jedoch normalerweise durch eine Reduzierung der Dosis und/oder durch Weglassen der Nachmittags- oder Abenddosis kontrollieren lassen.
Verminderter Appetit ist ebenfalls häufig, jedoch normalerweise eine vorübergehende Erscheinung.
Erkrankungen des Bluts und des Lymphsystems
Sehr selten: Leukopenie, Thrombozytopenie, Anämie.
Stoffwechsel- und Ernährungsstörungen
Häufig: Anorexie (verminderter Appetit), verlangsamte Gewichtszunahme bei Langzeitanwendung bei Kindern.
Psychiatrische Erkrankungen
Sehr häufig: Schlaflosigkeit, Nervosität.
Häufig: abnormes Verhalten, Aggression, Erregung, Ängstlichkeit, Depression, Reizbarkeit, Schlafstörungen, Bruxismus*.
Sehr selten: Halluzinationen, psychotische Störungen, suizidale Verhaltensweisen (einschliesslich vollendetem Suizid), Tics oder Verschlechterung bestehender Tics sowie Tourette-Syndrom, vorübergehende depressive Verstimmung.
Unbekannt: Logorrhö, Libidostörung.
Erkrankungen des Nervensystems
Sehr häufig: Schlaflosigkeit, Nervosität.
Häufig: Kopfschmerzen, Schläfrigkeit, Schwindel, Dyskinesie, Tremor, Mattigkeit, Hyperaktivität.
Sehr selten: Konvulsionen, choreoathetotische Bewegungen.
Sehr selten wurden Fälle von mangelhaft dokumentiertem neuroleptischem malignem Syndrom (NMS) berichtet. In den meisten dieser Berichte erhielten die Patienten zusätzlich andere Arzneimittel. Die Rolle von Methylphenidat in diesen Fällen ist ungeklärt.
Unbekannt: Dysphemie.
Augenerkrankungen
Selten: Schwierigkeiten bei der visuellen Akkommodation sowie verschwommenes Sehen.
Herzerkrankungen
Häufig: Tachykardie, Herzklopfen, Arrhythmie, Änderung des Blutdrucks und der Herzfrequenz (üblicherweise eine Erhöhung).
Selten: Angina pectoris.
Sehr selten: Herzstillstand.
Unbekannt: Cardiomyopathie.
Gefässerkrankungen
Sehr selten: zerebrale Arteriitis und/oder Verschluss.
Unbekannt: Kontusion, Epistaxis.
Erkrankungen des Gastrointestinaltrakts
Häufig: Bauchschmerzen, Übelkeit und Erbrechen. Diese Erscheinungen treten normalerweise zu Beginn der Behandlung auf und lassen sich durch begleitende Nahrungsaufnahme lindern. Trockener Mund.
Leber- und Gallenerkrankungen
Sehr selten: Abnorme Leberfunktion, die von einer Transaminasen-Erhöhung bis zum Leberkoma reichen kann.
Erkrankungen des Immunsystems
Gelegentlich: Überempfindlichkeitsreaktionen wie Angiödeme, anaphylaktische Reaktionen, aurikuläre Schwellungen, bullöse Reaktionen, exfoliative Reaktionen, Urticaria, Pruritus, Hautausschläge und Eruptionen.
Erkrankungen der Haut und des Unterhautzellgewebes
Häufig: Ausschlag, Pruritus, Urtikaria, Ausfall der Kopfbehaarung.
Sehr selten: Thrombozytopenische Purpura, exfoliative Dermatitis und Erythema multiforme.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufig: Arthralgie.
Sehr selten: Muskelkrämpfe.
Unbekannt: Trismus*.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Hämaturie.
Unbekannt: Inkontinenz.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Unbekannt: Erektile Dysfunktion.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Fieber.
Gelegentlich: Hyperhidrosis.
Selten: Wachstumsverzögerungen wurden bei Langzeiteinsatz von Stimulanzien bei Kindern berichtet.
Sehr selten: plötzlicher Tod.
* Auf der Grundlage der in ADHS-Studien bei Erwachsenen berechneten Häufigkeit (es wurden keine Fälle in pädiatrischen Studien berichtet)
Unerwünschte Wirkungen nach Markteinführung
Nachstehend sind unerwünschte Wirkungen aufgeführt, die nach der Markteinführung von Equasym als unerwünschte Wirkung identifiziert wurden. Die unerwünschten Wirkungen sind nach Häufigkeitskategorie entsprechend den Spontanberichtsraten aufgeführt. Die Häufigkeitsangaben entsprechen dabei folgender Konvention:
Sehr häufig: ≥1/10
Häufig: ≥1/100 bis <1/10;
Gelegentlich: ≥1/1'000 bis <1/100;
Selten: ≥1/10'000 bis <1/1'000;
Sehr selten: <1/10'000, einschliesslich Einzelfälle
Funktionsstörungen des Reproduktionssystems und der Brust:
Sehr selten: verlängerte und/oder schmerzhafte Erektionen (Priapismus).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungBei der Behandlung von Patienten mit einer Überdosierung muss auch der verzögert freigesetzte Anteil von Methylphenidat-Formulierungen berücksichtigt werden.
Anzeichen und Symptome
Zu den Anzeichen und Symptomen einer Methylphenidat-Überdosierung, welche hauptsächlich von einer Überstimulierung des ZNS und überschiessenden sympathikomimetischen Wirkungen resultieren, gehören, Erbrechen, Agitiertheit, Muskelzuckungen, zerebrale Krampfanfälle mit nachfolgendem Koma, Verwirrung, Halluzinationen (akustisch und/oder visuell), übermässiges Schwitzen, Kopfschmerzen, Pyrexie, Tachykardie, Palpitationen, erhöhte Herzfrequenz, Sinusarrhythmie, Hypertonie, Mydriasis, Mundtrockenheit und Rhabdomyolyse.
Behandlung
Es gibt kein spezielles Antidot bei einer Überdosierung von Equasym XR.
Die Behandlung besteht aus geeigneten unterstützenden Massnahmen, wobei eine Selbstverletzung des Patienten verhindert und der Patient vor äusseren Stimuli, die eine bereits vorhandene Übererregbarkeit noch verschärfen könnten, geschützt werden soll. Wenn die Symptomatik nicht zu schwer ist und der Patient bei Bewusstsein ist, kann der Magen durch Auslösen von Erbrechen oder durch eine Magenspülung entleert werden. Bei einer schweren Intoxikation sollte vor Beginn einer Magenspülung eine sorgfältig titrierte Dosis eines kurzfristig wirkenden Barbiturats gegeben werden.
Es ist genauestens darauf zu achten, dass Blutdruck und Atmung aufrechterhalten werden; bei Hyperpyrexie kann eine äusserliche Kühlung erforderlich sein.
Die Wirksamkeit einer peritonealen Dialyse oder extrakorporalen Hämodialyse bei einer Überdosierung von Equasym XR ist nicht nachgewiesen.
Eigenschaften/WirkungenATC-Code
N06BA04
Wirkungsmechanismus
Wirkungsweise: Equasym XR ist ein mildes ZNS-Stimulans mit stärker ausgeprägter Wirkung auf mentale als auf motorische Aktivitäten. Seine Wirkungsweise beim Menschen ist nicht vollständig geklärt. Es wird angenommen, dass seine Wirkung durch kortikale Stimulierung und mögliche Stimulierung des retikulär aufsteigenden Aktivierungssystems erfolgt.
Der Wirkmechanismus, durch den Equasym XR mentale Veränderungen und Verhaltensänderungen bei Kindern bewirkt, ist nicht eindeutig geklärt, auch gibt es keinen endgültigen Beweis dafür, wie diese Wirkungen mit dem Zustand des zentralen Nervensystems zusammenhängen.
Pharmakodynamik
Es wird angenommen, dass der «re-uptake» von Noradrenalin und Dopamin in die präsynaptischen Nervenenden blockiert und die Freisetzung dieser Monoamine in den extraneuronalen Raum erhöht wird. Equasym XR ist ein razemisches Gemisch bestehend aus den d- und l-threo-Enantiomeren von Methylphenidat. Das d-Enantiomer ist pharmakologisch aktiver als das l-Enantiomer.
Klinische Wirksamkeit
Methylphenidat ist ein Amphetamin-ähnliches ZNS-Stimulans.
In einer Pivot-Studie erhielten von 327 randomisierten Patienten 318 Patienten im Alter zwischen 6 und 12 Jahren wenigstens eine Dosis der Studienmedikation. Die Punktwerte der IOWA Conner's Skala, der Bewertung des primären Zielparameters während des Schultags durch den Lehrer, ergaben für die Per Protocol Population (279 Patienten, die über 21 Tage behandelt wurden) folgende Ergebnisse:
|
|
Placebo
(N = 39)a
|
Sofort freisetzende Methylphenidat- Formulierung
(N = 120)b
|
Equasym Retard
(N = 120)
| |
Lehrergesamturteil
IOWA Conners I/O Skala
Mittelwert
(Standardabweichung)
|
6,0 (3,64)
|
6,1 (3,74)
|
5,8 (3,59)
| |
Tag 21/Absetzen
| |
LS-Mittelwert
(Standardfaktor)
|
7,7 (0,50)
|
4,3 (0,29)
|
4,5 (0,29)
| |
95 % Konfidenzintervall
|
6,69; 8,66
|
3,71; 4,84
|
3,98; 51,0
| |
Unterschied zu Placebo
|
–
|
–3,4
|
–3,1
| |
95 % Konfidenzintervall
für den Unterschied
|
–
|
–4,53; –2,26
|
–4,26; –2,00
| |
p-Wertc
|
–
|
< 0,001
|
< 0,001
| |
Unterschied zu sofort freisetzender Methylphenidat-Formulierung
|
–
|
–
|
–0,3
| |
97,5 % untere Konfidenzintervall-
Grenze für den Unterschied
|
–
|
–
|
–1,06
| |
a
N = 38 an Tag 7; b N = 118 an Tag 7; c Zum Vergleich der Behandlungsgruppen wurde ANCOVA eingesetzt, mit dem Behandlungseffekt und dem Ausgangswert als Kovariaten
|
Im Gegensatz zu den Ergebnissen des primären Zielparameters wurden für die sekundären Zielvariable, Elternurteil IOWA Conner's, Unterschiede zwischen der Equasym Retard-Gruppe und der sofort freisetzenden Methylphenidat-Gruppe beobachtet. Dies basierte auf Bewertungen, die später am Abend durchgeführt wurden und die darauf hindeuteten, dass es im Vergleich zu der zweimal täglichen Gabe der sofort freisetzenden Methylphenidat-Formulierung bei Equasym Retard spät am Tag zu einem teilweisen Verlust der Wirksamkeit kommt. Siehe auch Rubrik Pharmakokinetik und Dosierung und Anwendung.
Razemisches Gemisch
Equasym XR ist ein razemisches Gemisch bestehend aus den d- und l-threo-Enantiomeren von Methylphenidat. Das d-Enantiomer ist pharmakologisch aktiver als das l-Enantiomer.
PharmakokinetikAbsorption
Das Plasmaprofil von Equasym XR zeigte eine bi-phasische Wirkstofffreisetzung: einen steilen initialen Anstieg (ähnlich Methylphenidat-Tabletten mit sofortiger Wirkstofffreisetzung) und einen zweiten Anstieg etwa drei Stunden später, gefolgt von einem schrittweisen Absinken (siehe nachfolgende Darstellung mit Werten von Kindern mit ADHD. Die Werte nach über 8,5 Stunden wurden mittels pharmakokinetischer Modelle berechnet).
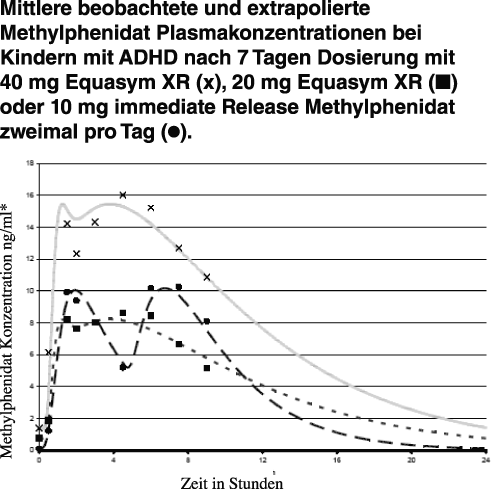
* Bei den Werten bis 8 h handelt es sich um Messergebnisse, die Kurven beruhen auf Extrapolation.
Spitzen-Plasmakonzentrationen von etwa 40 nmol/Liter (11 ng/ml) werden im Durchschnitt 1-2 Stunden nach der Verabreichung von 0,30 mg/kg erreicht. Die Spitzen-Plasmakonzentrationen weisen beträchtliche interindividuelle Variabilität auf.
Der beobachtete Konzentrationsbereich nach 1,5 Stunden lag bei 3,2–13,3 ng/ml mit einem Durchschnitt von 7,7 ng/ml. Die zweite Freisetzungsphase führte bei der Mehrheit der Versuchspersonen 4,5 Stunden nach der Einnahme zu einem zweiten Konzentrationsmaximum im Bereich von 4,9–15,5 ng/ml und einem Durchschnitt von 8,2 ng/ml.
Die Verabreichung einer extended Release Formulierung beim Frühstück anstelle von 2 Verabreichungen von immediate Release Tabletten (Frühstück und Mittagessen) kann den Methylphenidat-Peak nach dem Mittagessen verringern und so bei einigen Patienten zu einem Unterschied im Verhalten führen. Dies sollte bei der Beurteilung der individuellen Bedürfnisse in Betracht gezogen werden.
Der Bereich unter der Plasmakonzentrations-Kurve (AUC) sowie die Spitzen-Plasmakonzentration sind proportional zur Dosis.
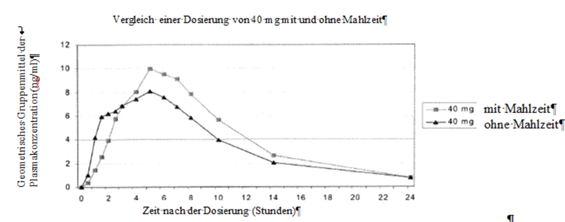
Gleichzeitige Aufnahme mit Nahrungsmitteln: Eine Studie mit gesunden Freiwilligen zeigte, dass die Aufnahme zusammen mit Nahrungsmitteln mit hohem Fettanteil die Resorption (Tmax) um etwa eine Stunde verlangsamt und die Maximalkonzentration (Cmax) um etwa 30% sowie die resorbierte Menge (AUC) um etwa 17% erhöht (siehe Tabelle und Darstellung).
Pharmakokinetik von Equasym XR bei Erwachsenen gefastet bzw. nach dem Essen:
|
Arzneimittel
|
Dosis
|
Pharmakokinetische Parameter
Mittelwerte (SD)
| |
|
|
Cmax (ng/ml)
|
Tmax (h)
|
AUC (0-inf) (ng.h/ml)
| |
Equasym XR
|
2 × 20 mg – nach dem Essen
|
11.7 (4.6)
|
5.7 (1.7)
|
116.5 (48.0)
| |
Equasym XR
|
2 × 20 mg – gefastet
|
8.7 (3.0)
|
4.8 (1.2)
|
99.8 (41.3)
|
Öffnen der Kapsel und über die Nahrung streuen: Cmax, Tmax und AUC des über das Essen gestreuten Inhalts von Equasym XR-Kapseln sind ähnlich (bioequivalent) zu den Werten der intakten Kapseln. Deshalb kann Equasym XR entweder als intakte Kapsel oder geöffnet über Apfelmus oder ähnlich weiche Nahrungsmittel gestreut, eingenommen werden. Bei beiden Verabreichungsarten ist darauf zu achten, dass das Granulat nicht zerkaut wird.
Systemische Verfügbarkeit: Aufgrund des ausgedehnten «first-pass»-Metabolismus liegt die systemische Verfügbarkeit bei etwa 30 % (11–51 %) der Dosis.
Distribution
Im Blut werden Methylphenidat und seine Metaboliten im Plasma (57 %) und in den Erythrozyten (43 %) verteilt. Methylphenidat und seine Metaboliten haben eine geringe Plasma-Proteinbindungsrate (10–33 %). Die Berechnung des ersichtlichen Verteilungsvolumens ergab 13,1 Liter/kg.
Metabolismus
Methylphenidat wird rasch und in grossem Umfang metabolisiert. Maximale Plasmakonzentrationen des entesterten Hauptmetaboliten Alpha-Phenyl-2-Poperidinessigsäure werden etwa 2h nach Verabreichung von Methylphenidat erreicht und liegen 30 – 50 mal höher als die Plasmakonzentrationen des unveränderten Wirkstoffs. Die Halbwertszeit von Alpha-Phenyl-2-Piperidinessigsäure ist etwa doppelt so lang wie jene von Methylphenidat und die systemische Clearance beträgt durchschnittlich 0,17l/h/kg. Es sind nur geringe Mengen an hydroxylierten Metaboliten, wie z.B. Hydroxymethylphenidat oder Hydroxyritalinsäure nachweisbar. Für den therapeutischen Effekt scheint in erster Linie der unveränderte Wirkstoff verantwortlich zu sein.
Elimination
Methylphenidat wird mit einer durchschnittlichen Halbwertszeit von 2 Stunden aus dem Plasma ausgeschieden, und die berechnete durchschnittliche systemische Clearance liegt bei 10 Liter/h/kg.
Die mittlere Halbwertszeit (t½) von Methylphenidat bei gesunden Freiwilligen nach der Verabreichung von Equasym XR (t½=6.8h) ist länger als die mittlere Halbwertszeit nach der Verabreichung von Methylphenidat Hydrochlorid in Form von immediate Release Tabletten (t½=2.9h). Das bedeutet, dass der für Equasym XR beobachtete Eliminationsprozess von der Freisetzungsrate von Methylphenidat aus der extended Release Formulierung kontrolliert wird.
Innerhalb von 48 96 Stunden werden 78–97 % der verabreichten Dosis als Metaboliten mit dem Urin und 1–3 % mit den Faeces ausgeschieden.
Der Grossteil der Dosis wird als 2-Phenyl-2-Piperidyl-Essigsäure (PPAA, 60–86 %) mit dem Urin ausgeschieden.
Kinetik spezieller Patientengruppen
Nierenfunktionsstörungen
Daten zur Elimination bei Patienten mit normaler Nierenfunktion deuten darauf hin, dass die renale Elimination von unverändertem Methylphenidat durch eine Niereninsuffizienz kaum vermindert wird. Die renale Elimination des Metaboliten Alpha-Phenyl-2-Piperidinessigsäure kann jedoch vermindert sein.
Leberfunktionsstörungen
Es liegen keine Erfahrungen zur Anwendung von Equasym XR bei Patienten mit Leberinsuffizienz vor.
Kinder und Jugendliche
Die Pharmakokinetik von Equasym XR bei Kindern unter 7 Jahren wurde nicht untersucht.
Präklinische DatenMutagenität
Im In-vitro-Ames-Test (Reverse Mutation Assay) und im In-vitro Mouse Lymphoma Cell Forward Mutation Assay waren keine mutagenen Wirkungen von Methylphenidat nachweisbar. Der Austausch von Schwesterchromatiden (sister chromatid exchange) und Chromosom-Veränderungen (chromosome aberrations) zeigten in einem in-vitro-Test mit Eierstock-Zellkulturen des chinesischen Hamsters erhöhte Werte, wenn auch erst nach hohen zytotoxischen Dosen. Methylphenidat war in vivo im Mikrokern-Test von Knochenmark von Mäusen negativ.
Karzinogenität
In Langzeitstudien zur Karzinogenität an Ratten und Mäusen wurde nur bei männlichen Mäusen eine vermehrte Anzahl an malignen Lebertumoren beobachtet. Die Bedeutung dieser Befunde für den Menschen ist nicht bekannt.
Reproduktionstoxizität
Es liegen Hinweise bei zwei Tierarten vor, dass Methylphenidat teratogen wirken kann. Über Spina bifida und Fehlbildungen der Gliedmassen wurde bei Kaninchen berichtet, während bei Ratten keine eindeutigen Hinweise auf die Induktion von Wirbelanomalien gefunden wurden.
Auch bei Dosierungen, die um einige Faktoren über der therapeutischen Dosis lagen, hatte Methylphenidat keine negativen Auswirkungen auf die Reproduktionsleistung oder Fruchtbarkeit.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25°C) lagern.
In der Originalverpackung aufbewahren.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer57'295 (Swissmedic).
PackungenRetardkapseln zu 10 mg: 30 und 60 [A]
Retardkapseln zu 20 mg: 30 und 60 [A]
Retardkapseln zu 30 mg: 30 und 60 [A]
ZulassungsinhaberinTakeda Pharma AG, 8152 Opfikon
Stand der InformationMärz 2023
|


