ZusammensetzungWirkstoffe
Humaner Alpha1-Proteinase-Inhibitor.
Hilfsstoffe
Natriumchlorid, Natriumdihydrogenphosphat-Monohydrat, Mannitol, Natriumhydroxid und Salzsäure (entspricht 1,9 mg/ml Natrium bzw. ca. 1,6 mmol Natrium pro 1000 mg Flasche und ca. 6,5 mmol Natrium pro 4000 mg Flasche).
Lösungsmittel: Wasser für Injektionszwecke.
Das Pulver ist weiss bis cremefarbig. Das Lösungsmittel ist eine klare und farblose Lösung.
Die rekonstituierte Lösung weist eine Osmolalität von ungefähr 279 mOsmol/kg und einen pH-Wert von 7,0 auf.
Indikationen/AnwendungsmöglichkeitenRespreeza ist als Erhaltungstherapie für Erwachsene mit schwerem Alpha1-Proteinase-Inhibitor-Mangel (Phänotyp (Z, Z), (Z, Null), (Null, Null) oder (S, Z)) und klinisch manifester Lungenerkrankung (forcierte Einsekundenkapazität (FEV1) oder Diffusionskapazität (DLCO) <70% des Sollwertes) bestimmt. Respreeza verlangsamt die zugrundeliegende Zerstörung des Lungengewebes, die zu Emphysem führt. Die Daten zur klinischen Wirksamkeit sind auf spirale CT-Densitometrie beschränkt.
Dosierung/AnwendungDosierung für Erwachsene und Kinder
Die Therapie sollte von einem Arzt eingeleitet und überwacht werden, welcher in der Behandlung von Alpha1-Proteinase-Inhibitor-Mangel erfahrenen ist.
Die darauffolgenden Infusionen können von einer Betreuungsperson oder vom Patienten selbst verabreicht werden (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Bei jeder Verabreichung von Respreeza an den Patienten wird dringend empfohlen, den Namen und die Chargenbezeichnung des Präparates zu dokumentieren, um gegebenenfalls einen Zusammenhang zwischen Patient und Produktcharge herstellen zu können.
Dosierung
Respreeza soll nach der Rekonstitution ausschliesslich als intravenöse Infusion verabreicht werden.
Sofern nicht anders vorgeschrieben beträgt die empfohlene Dosis 60 mg/kg Körpergewicht (KG) Respreeza einmal wöchentlich zur Erzielung der gewünschten klinischen Antwort und des gewünschten Serumspiegels des Alpha1-Proteinase-Inhibitors. Die Dosis kann in Abhängigkeit von diesen beiden Parametern angepasst werden. Es können Dosierungen von bis zu 120 mg/kg KG verabreicht werden.
Ältere Patienten
Die Sicherheit und Wirksamkeit von Respreeza bei älteren Patienten (65 Jahre oder älter) wurde nicht in spezifischen klinischen Studien untersucht. Die Erfahrungen nach der Markteinführung deuten jedoch auf keine Unterschiede bei älteren Patienten hin. Es wird keine Dosisanpassung empfohlen.
Patienten mit eingeschränkter Nieren- oder Leberfunktion
Es wurden keine speziellen Untersuchungen bei Patienten mit eingeschränkter Nieren- oder Leberfunktion durchgeführt. Es wird kein alternatives Dosierungsregime bei diesen Patienten empfohlen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Respreeza bei Kindern und Jugendlichen (unter 18 Jahren) wurde bislang nicht untersucht. Es liegen keine Daten vor.
Art der Anwendung
Zur intravenösen Verabreichung.
Das Produkt muss mit Wasser für Injektionszwecke rekonstituiert und mit einem intravenösen Infusionsbesteck verabreicht werden (siehe «Hinweise für die Handhabung» im Kapitel «Sonstige Hinweise»).
Die rekonstituierte Lösung sollte intravenös über eine separate Infusionsleitung mit einer Infusionsrate von etwa 0,08 ml/kg KG/min verabreicht werden. Diese Infusionsrate kann abhängig von der Verträglichkeit angepasst werden. Für die empfohlene Dosis von 60 mg/kg KG wird eine Infusionsdauer von ungefähr 15 Minuten benötigt.
Eine Durchstechflasche Respreeza ist zur einmaligen Anwendung bestimmt.
Weitere Instruktionen zur Verabreichung der rekonstituierten Lösung finden sich in Kapitel «Sonstige Hinweise».
KontraindikationenÜberempfindlichkeit gegenüber Respreeza, dem Wirkstoff oder einem der Hilfsstoffe von Respreeza (siehe Kapitel «Zusammensetzung»).
Patienten mit IgA-Mangel und mit Antikörpern gegen IgA aufgrund des Risikos von schwerer Überempfindlichkeit und anaphylaktischen Reaktionen.
Dekompensiertes Cor pulmonale.
Warnhinweise und VorsichtsmassnahmenRauchen ist ein wichtiger Risikofaktor für die Entwicklung eines Emphysems. Daher ist Respreeza ausschliesslich für nachweisliche Nichtraucher (>6 Monate) bestimmt. Patienten müssen auch andere Risikofaktoren für Lungenerkrankungen meiden (z.B. passives Rauchen, Luftverschmutzung).
Die in Kapitel «Dosierung/Anwendung» aufgeführte empfohlene Infusionsrate ist einzuhalten. Im Verlauf der ersten Infusionen sollte der klinische Zustand des Patienten, einschliesslich der Vitalzeichen, während des gesamten Infusionszeitraumes eng überwacht werden. Tritt eine unerwünschte Reaktion auf, die im Zusammenhang mit der Verabreichung von Respreeza stehen könnte, sollte, soweit dem klinischen Zustand des Patienten nach erforderlich, die Infusionsrate verringert oder die Verabreichung gestoppt werden. Klingen die Symptome nach dem Anhalten schnell ab, kann die Infusion mit einer niedrigeren, für den Patienten angenehmen Infusionsrate wieder fortgesetzt werden.
Überempfindlichkeit
Überempfindlichkeitsreaktionen können auftreten, einschliesslich bei Patienten, die vorherige Behandlungen mit dem humanen Alpha1-Proteinase-Inhibitor vertragen haben.
Der Verdacht auf allergische oder anaphylaktische Reaktionen kann ein sofortiges Abbrechen der Infusion erfordern, in Abhängigkeit von der Art und Schwere der Reaktion. Im Fall eines Schocks ist eine medizinische Notfallbehandlung einzuleiten.
Häusliche Behandlung/Selbstverabreichung
Es liegen begrenzte Daten hinsichtlich häuslicher Behandlung/Selbstverabreichung mit diesem Arzneimittel vor.
Potentielle Risiken häuslicher Behandlung/Selbstverabreichung sind auf die Handhabung und Verabreichung des Präparats sowie auf den Umgang mit unerwünschten Wirkungen, insbesondere Überempfindlichkeitsreaktionen, zurückzuführen. Die Patienten müssen über die ersten Anzeichen von Überempfindlichkeitsreaktionen informiert werden.
Die Entscheidung hinsichtlich einer häuslichen Behandlung beziehungsweise der Infusionsverabreichung durch den Patienten selbst obliegt dem behandelnden Arzt (siehe auch Kapitel «Warnhinweise und Vorsichtsmassnahmen»). Dieser sollte sicherstellen, dass eine adäquate Schulung des Patienten erfolgt (unteranderem bezüglich der Rekonstitution, der Verwendung der Transfervorrichtung und des Filters, des Zusammensetzens des Infusionsbestecks, der Infusionstechniken, des Führens eines Behandlungstagebuches sowie der Identifizierung von unerwünschten Nebenwirkungen und der Massnahmen, die im Falle des Auftretens solcher unerwünschten Wirkungen getroffen werden müssen) und dass die korrekte Anwendung in regelmässigen Abständen überprüft wird.
Zur Sicherheit bezüglich übertragbaren Erregern
Respreeza wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen, die aus der Anwendung von aus menschlichem Blut oder Plasma hergestellten Arzneimitteln resultieren könnten, beinhalten die Spenderauswahl, die Testung der Einzelspenden und der Plasmapools auf spezifische Infektionsmarker sowie die Durchführung wirksamer Herstellungsschritte zur Inaktivierung/Eliminierung von Viren. Dennoch kann bei der Verabreichung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt wurden, die Möglichkeit einer Übertragung infektiöser Erreger nicht vollständig ausgeschlossen werden. Dies gilt auch für bislang unbekannte oder neu auftretende Viren und andere Krankheitserreger.
Die ergriffenen Sicherheitsmassnahmen werden als wirksam gegen umhüllte Viren wie humaner Immunschwächevirus (HIV), Hepatitis-B-Virus (HBV) und Hepatitis-C-Virus (HCV) sowie gegen nicht umhüllte Viren wie Hepatitis A-Virus (HAV) und Parvovirus B19 betrachtet.
Bei Patienten, die regelmässig/wiederholt aus menschlichem Plasma stammende Proteinase-Inhibitoren erhalten, ist eine angemessene Impfung (Hepatitis A und B) in Erwägung zu ziehen.
Natriumgehalt
Respreeza enthält etwa 37 mg Natrium pro 1000 mg Flasche und 149 mg Natrium pro 4000 mg Flasche, entsprechend 1,9%, resp. 7,4% der von der WHO für einen Erwachsenen empfohlenen maximalen täglichen Natriumaufnahme mit der Nahrung von 2 g. Dies ist bei Patienten, die eine Diät mit kontrollierter Natriumaufnahme erhalten, zu berücksichtigen.
InteraktionenEs wurden keine Interaktionsstudien durchgeführt.
Schwangerschaft, StillzeitSchwangerschaft
Es wurden keine Reproduktionsstudien mit Respreeza an Tieren durchgeführt. Die Sicherheit der Anwendung von Respreeza bei schwangeren Frauen wurde in kontrollierten klinischen Studien nicht untersucht. Da Alpha1-Proteinase-Inhibitor ein körpereigenes humanes Protein ist, wird eine schädigende Wirkung von Respreeza auf den Fötus als unwahrscheinlich angesehen. Dennoch sollte Respreeza schwangeren Frauen nur mit Vorsicht verabreicht werden.
Stillzeit
Es ist nicht bekannt, ob Respreeza oder seine Metaboliten in die Muttermilch übergehen. Die Ausscheidung des humanen Alpha1-Proteinase-Inhibitors in die Muttermilch wurde an Tieren nicht untersucht. Bei der Anwendung während der Stillperiode ist Vorsicht geboten. Gegebenenfalls muss abgewogen werden, ob das Stillen fortgeführt oder unterbrochen werden soll, oder ob die Behandlung mit Respreeza fortgeführt oder unterbrochen werden soll. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie mit humanem Alpha1-Proteinase-Inhibitor für die Mutter zu berücksichtigen.
Fertilität
Es wurden keine Fertilitätsstudien mit Respreeza an Tieren durchgeführt. Die Wirkung auf die menschliche Fertilität wurde in kontrollierten klinischen Studien nicht untersucht. Da der Alpha1-Proteinase-Inhibitor ein körpereigenes humanes Protein ist, sind keine schädlichen Wirkungen auf die Fertilität zu erwarten.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNach der Verabreichung von Respreeza kann ein Schwindelgefühl auftreten (siehe Abschnitt «Unerwünschte Wirkungen»). Dadurch kann Respreeza einen geringen Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen, haben.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
In sehr seltenen Fällen wurden während der Behandlung Überempfindlichkeitsreaktionen oder allergische Reaktionen beobachtet. In den schwerwiegendsten Fällen können allergische Reaktionen zu schweren anaphylaktischen Reaktionen führen, auch wenn der Patient bei den vorherigen Verabreichungen keine Überempfindlichkeitsreaktionen gezeigt hat (siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen»).
Auflistung unerwünschter Arzneimittelwirkungen
Die unerwünschten Arzneimittelwirkungen (UAW), die in sechs klinischen Studien an 221 Patienten und aus den Erfahrungen nach der Markeinführung erfasst wurden, sind in der untenstehenden Liste gemäss den Organklassen der MedDRA Terminologie (SOC, Systemorganklasse und Bevorzugter Begriff) aufgeführt. Die Häufigkeit pro Infusion wurde nach den folgenden Definitionen beurteilt: gelegentlich (≥1/1000 bis <1/100), selten (≥1/10'000 bis <1/1000), sehr selten (<1/10'000).
Innerhalb jeder Häufigkeitsgruppe sind die UAW nach abnehmendem Schweregrad aufgeführt.
Erkrankungen des Blutes und des Lymphsystems:
Nicht bekannt: Lymphknotenschmerzen.
Erkrankungen des Immunsystems:
Gelegentlich: Überempfindlichkeitsreaktionen (einschliesslich Tachykardie, Hypotonie, Verwirrtheit, Synkope, Hypoxie und Pharynxödem).
Sehr selten: Anaphylaktische Reaktionen.
Erkrankungen des Nervensystems:
Häufig: Schwindelgefühl, Kopfschmerzen.
Gelegentlich: Parästhesie.
Sehr selten: Hypoästhesie.
Augenerkrankungen:
Nicht bekannt: Schwellung des Auges.
Gefässerkrankungen:
Gelegentlich: Hitzewallung.
Erkrankungen der Atemwege, des Brustraums und Mediastinums:
Häufig: Dyspnoe.
Erkrankungen des Gastrointestinaltrakts:
Häufig: Übelkeit.
Nicht bekannt: Lippenschwellung.
Erkrankungen der Haut und des Unterhautgewebes:
Gelegentlich: Urtikaria, Hautausschlag (einschliesslich exfoliativ und generalisiert).
Sehr selten: Hyperhidrose, Pruritus.
Nicht bekannt: Gesichtsschwellung.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort:
Gelegentlich: Asthenie, Reaktionen an der Infusionsstelle (einschliesslich Hämatom an der Infusionsstelle).
Sehr selten: Brustschmerzen, Schüttelfrost, Fieber
Unerwünschte Wirkungen nach Markteinführung
Zuverlässige Schätzungen zur Häufigkeit dieser ausschliesslich nach der Markeinführung beobachteten Reaktionen oder die Ermittlung eines kausalen Zusammenhangs zur Produktexposition sind nicht möglich, da die Nebenwirkungsmeldung freiwillig und von Patientenpopulationen unbekannter Grösse erfolgt. Die Häufigkeit dieser UAWs wird daher als «nicht bekannt (ist anhand der verfügbaren Daten nicht abschätzbar)» eingestuft.
Informationen zur Virussicherheit: siehe Kapitel «Warnhinweise und Vorsichtsmassnahmen».
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungDie Folgen einer Überdosierung sind unbekannt.
Im Falle einer Überdosierung ist der Patient sorgfältig auf das Auftreten von UAW zu überwachen. Zugleich sollten notwendige unterstützende Massnahmen zur Verfügung stehen.
Eigenschaften/WirkungenATC-Code
B02AB02
Pharmakotherapeutische Gruppe: Antihämorrhagica, Proteinase-Inhibitor
Wirkungsmechanismus
Der humane Alpha1-Proteinase-Inhibitor wird als der wichtigste Proteinase-Inhibitor zur Hemmung der neutrophilen Elastase in den unteren Atemwegen verstanden. Bei gesunden Menschen verhindert die produzierte Menge an Alpha1-Proteinase-Inhibitor eine übermässige Proteolyse des Lungengewebes durch Inaktivierung der von aktivierten neutrophilen Granulozyten erzeugten NE. Umstände wie z.B. Atemwegsinfektionen und Rauchen, die eine vermehrte Produktion von neutrophilen Granulozyten und deren Aktivierung in der Lunge anregen, erhöhen wiederum die NE-Konzentration. Patienten mit einem Mangel an körpereigenem Alpha1-Proteinase-Inhibitor können keine ausreichende Proteinase-Inhibitor-Abwehr aufrechterhalten und leiden unter einer raschen Proteolyse der Alveolarwände, die zur Entwicklung einer klinisch evidenten, chronisch obstruktiven Lungenerkrankung in der dritten beziehungsweise vierten Dekade führen kann.
Pharmakodynamik
Die Verabreichung von Respreeza erhöht und erhält den Serumspiegel des Alpha1-Proteinase-Inhibitors und dessen Spiegel im Flüssigkeitsfilm, der das Lungenepithel auskleidet (epithelial lining fluid (ELF)), wodurch das Emphysem langsamer fortschreitet.
Klinische Wirksamkeit
RAPID Studie und RAPID Verlängerungsstudie
Die Sicherheit und Wirksamkeit von Respreeza wurde in einer randomisierten, Placebo-kontrollierten, multizentrischen Doppelblindstudie (RAPID) und einer anschliessenden 2-jährigen offenen Verlängerungsstudie (RAPID Verlängerungsstudie) untersucht.
Insgesamt wurden 180 Patienten (93 Respreeza- und 87 Placebo-behandelte Patienten) mit Alpha1-Proteinase-Inhibitor-Mangel und klinischer Manifestation eines Emphysems bis zu 24 Monate mit einer wöchentlichen intravenösen Dosis von 60 mg/kg KG Respreeza beziehungsweise Placebo behandelt. Anschliessend wurden 140 Patienten in die RAPID Verlängerungsstudie eingeschlossen (76 zuvor mit Respreeza und 64 zuvor mit Placebo behandelten Patienten aus der RAPID Hauptstudie) und bis zu 24 Monate mit einer intravenösen Dosis von 60 mg/kg KG Respreeza einmal wöchentlich behandelt.
Die Daten zur klinischen Wirksamkeit beruhen in den beiden Studien auf spiraler Computertomographie (CT), mit der die Wirkung von Respreeza auf die Abnahme der Lungendichte und das Fortschreiten des Emphysems untersucht wurde.
Die jährliche Abnahmerate der Lungendichte, gemessen anhand der CT-Aufnahmen bei Gesamtlungenkapazität über 2 Jahre, war unter Respreeza signifikant geringer (-1,45 g/l) als unter Placebo (-2,19 g/l), was einer Verringerung von 34% entspricht (p=0,017; 1-seitig). Höhere CT-Messwerte der Lungendichte korrelierten mit einem höheren, FEV1 (0,31; p<0,001), einer höheren DLCO (0,46; p<0,001), einer höheren Belastbarkeit (0,26; p=0,002) und einem niedrigeren Aktivitäts-Score auf dem St. George's Respiratory Fragebogen (-0,26; p=0,002) im gesamten Studienverlauf.
Die finale Analyse der RAPID Studien zeigte:
·dass die verringerte Abnahmerate der Lungendichte bei Patienten erhalten wurde, die mit Respreeza kontinuierlich 4 Jahre lang behandelt wurden;
·dass in der RAPID Verlängerungsstudie eine verringerte Abnahmerate der Lungendichte bei den zuvor in der RAPID Hauptstudie mit Placebo behandelten Patienten erzielt wurde;
·dass bei den zuvor in der RAPID Hauptstudie mit Respreeza nicht behandelten Patienten die Verluste in der Lungendichte trotz der darauffolgenden Respreeza-Therapie in der Verlängerungsstudie irreversibel blieben.
In der RAPID Studie zeigte Respreeza ein ähnliches Sicherheits- und Verträglichkeitsprofil wie Placebo. Die Einzeldosen von 120 mg/kg KG Respreeza, die 75 Patienten verabreicht wurden, ergaben gleichermassen keine besonderen Probleme bezüglich Sicherheit. Eine regelmässige wöchentliche Dosierung mit 120 mg/kg KG wurde nicht untersucht.
PharmakokinetikZur Beurteilung der Wirkung von Respreeza auf die Serumspiegel des Alpha1-Proteinase-Inhibitors wurden vier klinische Studien mit Respreeza an 89 Patienten (59 Männer und 30 Frauen) durchgeführt. Die Patienten waren im Alter von 29 bis 68 Jahren (Altersdurchschnitt: 49 Jahre). Beim Screening lagen die Alpha1-Proteinase-Inhibitor- Serumspiegel bei 3,2 bis 10,1 µM (Mittelwert: 5,6 µM).
Basierend auf einer Pharmakokinetik-Studie mit 13 Männern und 5 Frauen mit Alpha1-Proteinase-Inhibitor-Mangel im Alter von 36 bis 66 Jahren wurden die folgenden pharmakokinetischen Daten beobachtet (siehe Tabelle 1):
Tabelle 1: Pharmakokinetische Parameter für den Alpha1-Proteinase-Inhibitor nach einer Einzeldosis von 60 mg/kg KG Respreeza
|
Pharmakokinetische Parameter
|
Mittelwert
(±Standardabweichung)*
| |
Fläche unter der Kurve (AUC0-∞)
|
144 (±27) µM x Tag
| |
Maximale Konzentration (Cmax)
|
44,1 (±10,8) µM
| |
Terminale Halbwertszeit (t½β)
|
5,1 (±2,4) Tage
| |
Gesamtclearance
|
603 (±129) ml/Tag
| |
Verteilungsvolumen im Steady State
|
3,8 (±1,3) l
|
* n=18 Patienten.
Eine pharmakokinetische Populationsanalyse wurde anhand von Daten von 90 mit Respreeza behandelten Patienten aus der RAPID Studie durchgeführt. Die Schätzung der mittleren Halbwertszeit in der Population betrug 6,8 Tage. Das Modell wies mittlere Fliessgleichgewicht (Steady State)-Serumkonzentrationen von 21,8 µM nach einer Dosis von 60 mg/kg/Woche vor. Die pharmakokinetische Populationsanalyse ergab keine Hinweise darauf, dass das Alter, das Geschlecht, das Gewicht oder die Baseline-Konzentration des antigenen Alpha1-Proteinase-Inhibitors im Serum signifikante Auswirkungen auf die Clearance von Respreeza hatten.
Pharmakokinetik/Pharmakodynamik-Beziehung
In einer kontrollierten klinischen Doppelblindstudie zur Untersuchung der Sicherheit und der biochemischen Wirksamkeit von Respreeza wurden 44 Patienten mit einer intravenösen Dosis von 60 mg/kg KG Respreeza oder mit einem Vergleichspräparat für 10 Wochen randomisiert. Nach 10 Wochen erhielten die Patienten in beiden Gruppen weitere 14 Wochen Respreeza. Die Patienten wurden zur Vervollständigung der Sicherheitsbeurteilung insgesamt 24 Wochen beobachtet. Die mittleren Serumtalspiegel des Alpha1-Proteinase-Inhibitors im Steady State (Woche 7-11) der mit Respreeza behandelten Patienten waren statistisch äquivalent zu den Serumtalspiegeln der mit dem Vergleichspräparat behandelten Patienten in einem Bereich von ±3 µM. Bei beiden Gruppen wurden Alpha1-Proteinase-Inhibitor-Serumtalspiegel über 11 µM aufrechterhalten. Der Mittelwert (± Standardabweichung) des Alpha1-Proteinase-Inhibitor-Serumtalspiegels im Steady State betrug bei Respreeza-behandelten Patienten 17,7 µM (±2,5 µM) und bei mit dem Vergleichspräparat behandelten Patienten 19,1 µM (±2,2 µM). Der Unterschied zwischen den Respreeza- und Vergleichspräparat-Gruppen war statistisch nicht signifikant.
Bei einer Untergruppe von Patienten, die in diese Studie eingeschlossen waren (10 mit Respreeza- und 5 mit Vergleichspräparat behandelte Patienten), wurde eine Bronchoalveolar-Lavage durchgeführt. Die gemessenen Alpha1-Proteinase-Inhibitor-Spiegel im ELF der mit Respreeza behandelten Patienten war nicht tiefer als bei Patienten, die mit dem Vergleichsprodukt behandelt wurden, und zeigten einen konsistenten Anstieg nach der Behandlung.
ELF-Spiegel des antigenen Alpha1-Proteinase-Inhibitors und die des Alpha1-Proteinase-Inhibitors:
NE-Komplexe waren erhöht im Vergleich zur Baseline. Die Menge an freier Elastase war in allen Patientenproben unmessbar gering.
Im Rahmen der Finalisierung der RAPID Studie wurde eine Analyse der erreichten medianen Alpha1-Proteinase-Inhibitor-Spiegeln und der Lungendichte-Abnahme durchgeführt. Diese Analyse zeigte einen inversen linearen Zusammenhang zwischen den Alpha1-Proteinase-Inhibitor-Serumtalspiegeln und der jährlichen Abnahme der Lungendichte, gemessen anhand Volumen-bereinigten CT-Aufnahmen bei Patienten, die eine intravenöse Dosis von 60 mg/kg KG Respreeza erhielten.
Präklinische DatenDie Sicherheit von Respreeza wurde in mehreren präklinischen Studien untersucht. Nicht-klinische Daten ergeben keine Hinweise auf ein spezielles Risiko für den Menschen aufgrund der Pharmakologie- und Kurzzeit-Toxizitätsstudien. Geringfügige Veränderungen an Milz, Uterus, Lunge oder Herz traten bei Studien in Ratten und/oder Kaninchen bei einer Dosis auf, die der doppelten therapeutischen Maximaldosis entsprach. Bei der empfohlenen therapeutischen Dosis von 60 mg/kg/Tag wurde keine Toxizität festgestellt. Die Langzeitsicherheit kann im Tier wegen der Antikörperbildung gegen das humane Protein nicht untersucht werden. Da der humane Alpha1-Proteinase-Inhibitor ein physiologischer Bestandteil des menschlichen Blutes ist, wird davon ausgegangen, dass er keine karzinogene, genotoxische oder teratogene Wirkungen ausübt.
Sonstige HinweiseInkompatibilitäten
Dieses Arzneimittel darf nur mit den unter Kapitel «Hinweise für die Handhabung» aufgeführten Arzneimitteln gemischt werden.
Haltbarkeit
Respreeza ist bis zu dem auf Etikette und Faltschachtel unter «EXP» angegebenen Verfalldatum haltbar. Nach Ablauf des aufgedruckten Verfalldatums (EXP) darf das Präparat nicht mehr verwendet werden.
Haltbarkeit nach Anbruch
Aus mikrobiologischen Gründen sollte die gebrauchsfertige Zubereitung unmittelbar nach Rekonstitution verwendet werden. Dennoch wurde die chemische und physikalische Stabilität für 3 Stunden bei Raumtemperatur (bis zu 25 °C) gezeigt. Die gebrauchsfertige Zubereitung darf nicht eingefroren werden.
Besondere Lagerungshinweise
Nicht über 25 °C lagern. Nicht einfrieren. Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Allgemeine Hinweise
·Die Rekonstitution muss gemäss der untenstehenden Instruktion durchgeführt werden.
·Die Rekonstitution, Verabreichung und Handhabung muss sorgfältig und unter aseptischen Bedingungen erfolgen.
·Keines der zur Rekonstitution beigefügten sterilen Medizinprodukte verwenden, wenn die Verpackung geöffnet ist oder wenn es defekt ist.
·Überprüfen Sie die rekonstituierte Lösung vor der Verabreichung auf das Vorhandensein von Partikeln und Verfärbungen.
·Die Lösung sollte farblos, klar oder leicht opaleszent und frei von sichtbaren Partikeln sein.
·Das lyophilisierte Pulver muss mit sterilem Lösungsmittel (Wasser für Injektionszwecke) rekonstituiert werden. Die Rekonstitution einer 1000 mg Produktflasche sollte innerhalb von 5 Minuten durchgeführt sein. Die Rekonstitution einer 4000 mg Produktflasche sollte innerhalb von 10 Minuten durchgeführt sein.
Bitte befolgen Sie die folgenden Instruktionen für die Rekonstitution:
|
1. Vergewissern Sie sich, dass die Respreeza Durchstechflasche mit dem Pulver und die Durchstechflasche mit dem Lösungsmittel Raumtemperatur (bis 25 °C) haben.
|
| |
2.Entfernen Sie die Plastikabdeckung von der Lösungsmittelflasche.
|
| |
3. Reinigen Sie den Gummistopfen der Durchstechflasche mit dem Lösungsmittel mit antiseptischer Lösung und lassen Sie ihn trocknen.
|
| |
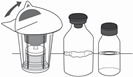
4. Öffnen Sie das Filter Transfer Set 20/20 (Mix2Vial™) durch Abziehen des Deckpapiers (Abbildung 1).
Das Transfer Set dabei nicht aus dem Blister entnehmen.
|
Abbildung 1
|
| |
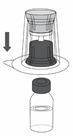
5. Die Lösungsmittelflasche auf eine ebene, saubere Oberfläche stellen und gut festhalten. Das Transfer Set zusammen mit dem Blister greifen und den Dorn der blauen Seite des Adapters gerade nach unten durch den Stopfen der Lösungsmittelflasche drücken (Abbildung 2).
|
Abbildung 2
|
| |
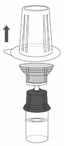
6. Den Blister vorsichtig vom Transfer Set entfernen, indem er am Siegelrand festgehalten und senkrecht nach oben gezogen wird. Stellen Sie sicher, dass Sie nur die Blisterpackung und nicht das Transfer Set entfernen (Abbildung 3).
|
Abbildung 3
|
| |
7. Entfernen Sie die Plastikabdeckung von der Respreeza Durchstechflasche.
|
| |
8. Reinigen Sie den Gummistopfen der Respreeza Produktflasche mit antiseptischer Lösung und lassen Sie ihn trocknen.
|
| |
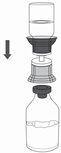
9. Die Respreeza Produktflasche auf eine ebene und feste Oberfläche stellen. Die Lösungsmittelflasche mit dem aufgesetzten Transfer Set herumdrehen und den Dorn der transparenten Seite des Adapters senkrecht nach unten in den Stopfen der Respreeza Produktflasche einstechen (Abbildung 4). Das Lösungsmittel läuft automatisch in die Respreeza Produktflasche über.
ACHTUNG: Vergewissern Sie sich, dass alles Lösungsmittel in die Respreeza Produktflasche übergeleitet wurde.
|
Abbildung 4
|
| |
10. Befolgen Sie die nachfolgenden Schritte um das komplette Transfer Set von der Respreeza Produktflasche zu entfernen:
·Mit der einen Hand die Produktseite und mit der anderen Hand die Lösungsmittelseite mit dem blauen Adapter gut greifen (Abbildung 5).
·Das komplette Transfer Set mit der Lösungsmittelflasche zur Seite biegen bis es sich von der Respreeza Produktflasche löst (Abbildung 5).
Die Lösungsmittelflasche mit dem kompletten Transfer Set entsorgen.
|
Abbildung 5
|

| |
11. Schwenken Sie die Respreeza Produktflasche vorsichtig, bis das Pulver vollständig aufgelöst ist (Abbildung 6). NICHT SCHÜTTELN. Stellen Sie sicher, dass Sie den Gummistopfen nicht berühren.
|
Abbildung 6
|
| |
12. Kontrollieren Sie die rekonstituierte Lösung visuell. Die Lösung sollte klar, farblos bis schwach gelb und frei von sichtbaren Partikeln sein. Verwenden Sie keine Lösungen, die verfärbt oder trüb sind oder Partikel aufweisen.
|
|
Sollte mehr als eine Respreeza Produktflasche für die erforderliche Dosis benötigt werden, müssen Sie die oben geschilderte Anweisungen 1 bis 11 mit einer neuen, ungebrauchten Mix2Vial Transfervorrichtung aus einer weiteren Packung wiederholen.
Verwenden Sie für jede Respreeza Produktflasche ein ungebrauchtes Mix2Vial Transfer Set und eine sterile Lösungsmittelflasche.
Die Überleitung der rekonstituierten Lösungen aus den Durchstechflaschen in den Verabreichungsbehälter (z.B. leerer Infusionsbeutel oder Glasflasche; im Lieferumfang nicht enthalten) mittels eines handelsüblichen Transfer Sets für intravenöse Infusionen (im Lieferumfang nicht enthalten) muss unter aseptischen Bedingungen erfolgen.
Verabreichung:
Die rekonstituierte Lösung muss mit einem i.v. Infusionsbesteck (im Lieferumfang nicht enthalten) verabreicht werden.
|
1. Stellen Sie sicher, dass die Entlüftungskappe und die Rollenklemme am Infusionsbesteck geschlossen sind. Stechen Sie den Dorn des Infusionsbestecks SENKRECHT in die Respreeza Produktflasche ein und drehen ihn dabei leicht oder befestigen Sie das Infusionsbesteck am Verabreichungsbehälter.
| |
2. Heben Sie die Respreeza Produktflasche bzw. den Verabreichungsbehälter hoch (falls ein i.v.-Infusionsbeutel verwendet wird, hängen Sie diesen an einem Infusionsständer auf).
| |
3. Drücken Sie die Tropfkammer zusammen, bis Respreeza die Tropfkammer zur Hälfte aufgefüllt hat.
| |
4. Öffnen Sie langsam die Rollenklemme des Infusionsbestecks und lassen Sie Respreeza hineinfliessen, bis das Ende des Schlauches keine Luftblasen mehr aufweist.
| |
5. Schliessen Sie die Rollenklemme.
| |
6. Verbinden Sie das Infusionsbesteck mit dem Injektionsset (z.B. Schmetterlings-/Flügelkanüle oder Infusionskatheter) und öffnen Sie die Rollenklemme wieder.
| |
7. Verabreichen Sie die rekonstituierte Lösung in eine Vene. Die Lösung sollte mit einer Infusionsrate von etwa 0,08 ml/kg KG/min verabreicht werden, in Abhängigkeit von Ihrem klinischen Zustand und Wohlbefinden. Für die empfohlene Dosis von 60 mg/kg KG wird eine Infusionsdauer von ungefähr 15 Minuten benötigt.
|
Nicht verwendetes Arzneimittel und Abfallmaterial sind gemäss den lokalen Anforderungen zu entsorgen.
Zulassungsnummer65337 (Swissmedic).
Packungen1000 mg Lyophilisat und Lösungsmittel (20 ml). (B)
4000 mg Lyophilisat und Lösungsmittel (76 ml). (B)
Eine Packung enthält:
·Eine Durchstechflasche mit Pulver
·Eine Durchstechflasche mit Lösungsmittel
·Ein Filter Transfer Set 20/20
ZulassungsinhaberinCSL Behring AG, Bern.
Stand der InformationMärz 2020.
|






