CompositionPrincipes actifs
Souche OKA du virus de la varicelle.
Excipients
Poudre: acides aminés (contient de la phénylalanine 331 µg), lactose, mannitol (E 421), sorbitol (E 420) 6 mg.
Solvant: eau pour préparations injectables.
Résidus
Sulfate de néomycine.
Indications/Possibilités d’emploiVarilrix est indiqué pour l'immunisation active contre la varicelle:
·des enfants dès l'âge de 12 mois révolus, des adolescents et des adultes en bonne santé.
Varilrix peut être administré à partir de l'âge de 9 mois dans des circonstances particulières (par ex. conformément aux recommandations nationales en matière de vaccination, dans des situations épidémiques, ou si l'enfant présente un risque élevé de contracter une varicelle grave ou s'il est en contact étroit avec un patient à risque).
·des personnes présentant un risque élevé de varicelle sévère (voir «Contre-indications», «Mises en garde et précautions» et «Propriétés/Effets»).
La vaccination est recommandée chez les personnes susceptibles en bonne santé qui sont en contact étroit avec des personnes à haut risque de varicelle sévère afin de diminuer le risque de transmission du virus de type sauvage à ces personnes. Cette catégorie englobe les parents et frères et sœurs des patients à haut risque ainsi que le personnel médical et paramédical.
Les données d'études cliniques pour l'utilisation de Varilrix chez les patients à haut risque de varicelle sévère étant limitées, les recommandations sont les suivantes si une vaccination est envisagée:
·La chimiothérapie d'entretien doit être suspendue pendant une semaine avant et une semaine après l'immunisation de patients en phase aiguë de leucémie. En principe, les patients sous radiothérapie ne doivent pas être vaccinés pendant la phase de traitement. Généralement, les patients sont vaccinés lorsqu'ils sont en rémission hématologique complète de leur maladie.
·Le nombre total de lymphocytes doit être au moins de 1 200 par mm3 ou il n'existe aucun autre signe d'absence d'immunité cellulaire compétente.
·La vaccination doit être effectuée quelques semaines avant l'administration d'un traitement immunosuppresseur pour les patients subissant une transplantation d'organe (par ex. greffe de rein).
Varilrix doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploiPosologie usuelle
Une dose de vaccin est de 0,5 mL de vaccin reconstitué.
Sujets sains
Pour garantir une protection optimale contre la varicelle, 2 doses de vaccin sont recommandées pour les enfants à partir de l'âge de 9 mois, les adolescents et les adultes (voir «Propriétés/Effets»). Les deux doses doivent généralement être administrées à 6 semaines d'intervalle. Cet intervalle ne doit en aucun cas être inférieur à 4 semaines.
Pour assurer un effet protecteur du vaccin, il faut administrer la dose recommandée entièrement.
Personnes à haut risque de varicelle sévère
Les personnes à haut risque de varicelle sévère peuvent bénéficier d'un rappel de vaccination selon le schéma à 2 doses (voir «Propriétés/Effets»).
Un dosage périodique des anticorps anti-varicelle peut être indiqué afin d'administrer une vaccination de rappel chez les patients dont le titre d'anticorps a fortement diminué.
L'intervalle entre les doses de vaccin ne doit en aucun cas être inférieur à 4 semaines.
Interchangeabilité des vaccins
Il est possible d'administrer une dose de vaccin Varilrix à des sujets ayant déjà reçu auparavant une dose unique d'un autre vaccin contre la varicelle et inversement.
Mode d'administration
Varilrix est à injecter de préférence par voie sous-cutanée (sc) ou par voie intramusculaire (im) dans la région deltoïdienne de la partie supérieure du bras ou dans la région antérolatérale de la cuisse.
Chez les personnes présentant des troubles hémorragiques (par ex. thrombocytopénie ou troubles de la coagulation), le vaccin doit être administré par voie sous-cutanée.
Pour les instructions concernant la reconstitution du vaccin avant administration, voir «Remarques particulières».
Contre-indicationsVarilrix est contre-indiqué chez les personnes ayant un déficit sévère de l'immunité humorale ou cellulaire (primaire ou acquis), tel que:
·personnes en états de déficit immunitaire primaires ou acquis, avec un nombre total de lymphocytes inférieur à 1 200 par mm3, ou
·personnes présentant d'autres signes d'absence d'immunité cellulaire compétente, par exemple chez les personnes ayant une leucémie, un lymphome, une dyscrasie sanguine ou une infection à VIH avec des manifestations cliniques, ou
·personnes recevant un traitement immunosuppresseur, y compris des corticostéroïdes à dose élevée (voir «Mises en garde et précautions»), ou
·immunodéficience combinée sévère,
·agammaglobulinémie, ou
·SIDA ou infection symptomatique due au VIH ou taux âge-dépendant de lymphocytes T CD4+ de <25% (chez les nourrissons de moins de 12 mois), <20% (chez les enfants de 12 à 35 mois), <15% (chez les enfants de 36 à 59 mois).
Varilrix est contre-indiqué chez les personnes ayant une hypersensibilité connue à la néomycine ou à un autre composant du vaccin (voir «Composition»). Un antécédent de dermatite de contact à la néomycine n'est par contre pas une contre-indication.
Varilrix est contre-indiqué chez les personnes qui ont présenté des signes d'hypersensibilité après une administration précédente d'un vaccin contre la varicelle.
Varilrix est contre-indiqué chez les femmes enceintes. Une grossesse doit être évitée pendant les trois mois suivant la vaccination (voir «Grossesse, allaitement»).
Mises en garde et précautionsVarilrix ne doit pas être administré par voie intradermique et ne doit en aucun cas être injecté par voie intravasculaire!
Avant la vaccination d'une femme en âge de procréer, une grossesse doit être exclue. Après la vaccination, une contraception fiable doit être pratiquée pendant une période de 3 mois (voir «Grossesse, allaitement»).
Comme pour d'autres vaccins, il faut différer l'injection de Varilrix en cas de maladie aiguë s'accompagnant d'une fièvre élevée. Chez les sujets sains, une infection légère ne constitue par contre pas une contre-indication.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme pour tous les vaccins injectables, il est recommandé de disposer d'un traitement médical approprié (par ex. solution d'adrénaline à 1/1'000) pour le rare cas où surviendrait une réaction anaphylactique.
Avant d'injecter le vaccin, laisser entièrement s'évaporer l'alcool et les autres désinfectants de la peau, car ces substances peuvent inactiver les virus atténués du vaccin.
Il n'existe que des données publiées limitées sur la prévention de la varicelle après un contact avec le virus de la varicelle. Une protection limitée contre la varicelle peut être obtenue par la vaccination 3 à 5 jours après une exposition naturelle à la maladie (voir «Propriétés/Effets»).
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Des varicelles peuvent aussi apparaître chez des personnes qui ont été précédemment vaccinées avec un vaccin vivant contre la varicelle. Cependant, l'évolution de ces maladies a le plus souvent été bénigne. Par comparaison aux sujets non vaccinés, la fièvre est apparue plus rarement et les manifestations cutanées étaient moins fréquentes et moins marquées.
Transmission
Il a été montré que le virus vaccinal OKA est transmis à un taux très faible par les personnes vaccinées ayant développé une éruption cutanée après la vaccination à des personnes de contact séronégatives. Une transmission du virus vaccinal OKA par une personne vaccinée qui n'a pas développé d'éruption cutanée à des personnes de contact séronégatives ne peut être exclue.
Contrairement aux sujets vaccinés sains, un exanthème papulo-vésiculaire apparaît plus fréquemment chez les patients leucémiques (voir aussi «Effets indésirables»). Dans ces cas également, l'évolution de la maladie chez les personnes de contact était bénigne.
Les sujets vaccinés, même ceux qui ne développent pas une éruption de type varicelle, doivent éviter dans la mesure du possible d'avoir des contacts étroits avec des sujets à haut risque réceptifs à la varicelle jusqu'à 6 semaines après la vaccination. S'il s'avère impossible au sujet vacciné d'éviter tout contact avec des sujets à haut risque réceptifs à la varicelle, le risque potentiel de transmission du virus vaccinal varicelleux doit être évalué par rapport au risque de contracter et transmettre le virus sauvage de la varicelle.
Sont considérés comme sujets à haut risque réceptifs à la varicelle:
·les sujets immunodéprimés (voir «Contre-indications» et «Mises en garde et précautions»);
·les femmes enceintes sans antécédent documenté de varicelle ou sans sérologie indiquant une infection antérieure;
·les nouveau-nés de mères sans antécédent documenté de varicelle ou sans sérologie indiquant une infection antérieure.
La nature bénigne de l'éruption cutanée chez des personnes de contact indique que le virus vaccinal de la varicelle reste atténué après passage par des hôtes humains.
Personnes à haut risque de varicelle sévère
On ne dispose que de données limitées sur l'utilisation de Varilrix chez les patients immunodéprimés. La vaccination ne doit donc être envisagée qu'avec prudence et seulement si le médecin estime que les bénéfices sont supérieurs aux risques.
Les patients immunodéprimés, pour lesquels aucune contre-indication à la vaccination n'existe (voir «Contre-indications»), peuvent ne pas répondre aussi bien à la vaccination que des personnes immunocompétentes, de telle sorte que certains de ces patients peuvent malgré tout contracter la varicelle. Les patients immunodéprimés doivent faire l'objet d'une surveillance étroite afin de détecter tout signe de varicelle, en particulier des évolutions sévères et éventuellement fatales.
Très peu de rapports sont disponibles en ce qui concerne la varicelle disséminée avec une implication des organes internes après la vaccination avec la souche OKA; ceux-ci concernaient en particulier, mais pas exclusivement, des personnes immunodéprimées. Dans des cas isolés, une issue fatale a été rapportée, malgré un traitement à base d'aciclovir.
L'apparition d'un zona, manifestation tardive connue survenant après une infection naturelle par le virus de la varicelle, ne peut pas être non plus exclue après la vaccination (voir «Effets indésirables»).
Des données à long terme relatives à l'incidence du zona sur plusieurs décennies ne sont pas encore disponibles; il n'est donc pas encore possible d'évaluer la fréquence d'apparition du zona après la vaccination en comparaison à celle observée suite à une infection naturelle.
Encéphalite
Après la mise sur le marché de vaccins contre la varicelle (vivants, atténués), y compris Varilrix, des cas d'encéphalite ont été rapportés. Des issues fatales ont été observées, notamment chez des personnes immunodéprimées (voir «Contre-indications»). Il faut indiquer aux personnes vaccinées ou aux parents/tuteurs légaux de faire immédiatement appel à une aide médicale si, après la vaccination, des symptômes pouvant évoquer une encéphalite apparaissent, p.ex. une perte de connaissance ou une diminution de la conscience, des crises convulsives ou une ataxie, en particulier en association avec de la fièvre et des céphalées.
Autres composants à effet notoire
Le médicament contient 6 mg de sorbitol par dose vaccinale.
Ce médicament contient 331 µg de phénylalanine par dose. La phénylalanine peut être nocive pour les patients atteints de phénylcétonurie.
InteractionsSi un test tuberculinique doit être fait, il est impératif de le faire avant ou en même temps que la vaccination, car il a été rapporté que les vaccins vivants peuvent entraîner une diminution temporaire de la sensibilité tuberculinique de la peau. Cette diminution de la sensibilité cutanée pouvant persister jusqu'à six semaines au maximum, le test tuberculinique ne doit pas être réalisé pendant cette période post-vaccinale, afin d'éviter des résultats faussement négatifs. L'utilisation de méthodes alternatives et plus précises (par exemple basées sur les cytokines) pour la détermination de la tuberculose doit être envisagée.
Chez les personnes ayant reçu des immunoglobulines ou des transfusions sanguines, il faut attendre au moins 3 mois avant de vacciner, étant donné que les anticorps apportés par ces traitements risquent d'empêcher une immunisation.
Il faut éviter la prise de salicylés dans les 6 semaines qui suivent une vaccination contre la varicelle, des cas de syndrome de Reye ayant été signalés après l'utilisation de salicylés pendant une infection naturelle de varicelle.
Sujets sains
Les études cliniques avec un vaccin contenant le virus de la varicelle (ROR-varicelle/Priorix-Tetra) montrent que Varilrix peut être administré en même temps que l'un des vaccins monovalents ou combinés suivants:
Vaccin rougeole-oreillon-rubéole (ROR), vaccin diphtérie-tétanos-coqueluche acellulaire (DTPa), vaccin diphtérie-tétanos-coqueluche acellulaire à teneur réduite en antigènes (dTpa), vaccin Haemophilus influenzae de type b (Hib), vaccin poliomyélitique inactivé (IPV), vaccin hexavalent (DTPa-HBV-IPV+Hib), vaccin conjugué méningococcique du groupe C (MenC), vaccin hépatite B (HBV).
L'administration concomitante du vaccin ROR-Varicelle avec un vaccin méningococcique du groupe B (Bexsero) a également été évaluée. La non-infériorité du taux de séroconversion après une administration concomitante a été démontrée pour la varicelle avec la valeur seuil de ≥1,25 (séroconversion) lors de la mesure par gpELISA, mais n'a pas pu être démontrée pour la valeur seuil de ≥5 unités gp ELISA/mL (séroprotection).
Plusieurs vaccins doivent toujours être administrés à des sites d'injection différents. Les vaccins inactivés peuvent être administrés indépendamment de la date de la vaccination contre la varicelle.
Si une vaccination contre la rougeole n'est pas réalisée en même temps que celle par Varilrix, un intervalle d'au moins un mois entre les deux vaccinations doit être respecté, car la vaccination contre la rougeole peut entraîner une suppression à court terme de la réponse immunitaire cellulaire.
Personnes à haut risque de varicelle sévère
Varilrix ne doit pas être administré en même temps que d'autres vaccins à virus vivants atténués. Les vaccins inactivés peuvent être administrés indépendamment de la date de la vaccination contre la varicelle, à condition qu'il n'y ait pas de contre-indication spécifique.
Plusieurs vaccins doivent toujours être administrés à des sites d'injection différents.
Grossesse, allaitementGrossesse
Il n'existe pas de données adéquates concernant l'emploi de Varilrix pendant la grossesse. Des études sur la toxicité de reproduction n'ont pas été effectuées en expérimentation animale.
Les femmes enceintes ne doivent pas être vaccinées avec Varilrix (voir «Contre-indications»). Avant la vaccination d'une femme en âge de procréer, une grossesse doit être exclue. Après la vaccination par Varilrix, une contraception fiable doit être effectuée sur une période de trois mois.
Allaitement
Des études avec des données sur l'utilisation chez les femmes qui allaitent ne sont pas disponibles. La transmission post-partum de la souche OKA de mères vaccinées aux nouveau-nés a été publiée dans des cas isolés (voir «Mises en garde et précautions»).
Fertilité
Aucune donnée disponible.
Effet sur l’aptitude à la conduite et l’utilisation de machinesAucune étude sur les effets de Varilrix sur l'aptitude à la conduite et l'utilisation de machines n'a été réalisée. Des effets secondaires tels que de la fièvre, des maux de tête ou de la fatigue peuvent avoir une influence négative sur l'aptitude à la conduite et l'utilisation de machines (voir aussi «Effets indésirables»).
Effets indésirablesDonnées des études cliniques
Sujets sains
Plus de 7'900 personnes ont participé à des études cliniques dans lesquelles le profil de réactogénicité du vaccin administré par voie sous-cutanée, soit seul soit en association avec d'autres vaccins, a été examiné.
Le profil de sécurité présenté ci-après repose sur l'expérience acquise lors de l'administration d'un total de 5'369 doses de Varilrix seul à des enfants, des adolescents et des adultes.
Les fréquences sont indiquées comme suit: «très fréquent» (≥1/10), «fréquent» (< 1/10, ≥1/100), «occasionnel» (< 1/100, ≥1/1000), «rare» (< 1/1000, ≥1/10'000), «très rare» (< 1/10'000).
Infections et infestations
Occasionnels: infections des voies respiratoires supérieures, pharyngite.
Affections hématologiques et du système lymphatique
Occasionnels: lymphadénopathie.
Affections psychiatriques
Occasionnels: irritabilité.
Affections du système nerveux
Occasionnels: céphalée, somnolence.
Affections oculaires
Rares: conjonctivite.
Affections respiratoires, thoraciques et médiastinales
Occasionnels: toux, rhinite.
Affections gastro-intestinales
Occasionnels: nausées, vomissements.
Rares: douleur abdominale, diarrhée.
Affections de la peau et du tissu sous-cutané
Fréquents: éruption cutanée
Occasionnels: éruption cutanée comme dans la varicelle, démangeaisons
Rares: urticaire
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: arthralgie, myalgie.
Troubles généraux et anomalies au site d'administration
Très fréquents: douleur, rougeur (17,0% chez l'enfant et 19,9% chez l'adolescent et l'adulte), fièvre (10,1%) (température orale/axillaire ≥37,5°C ou température rectale ≥38,0°C)*.
Fréquents: gonflement au site d'injection*.
Occasionnels: fièvre (température orale/axillaire > 39,0°C ou température rectale > 39,5°C), fatigue, malaise.
* Dans les études réalisées chez l'adolescent et l'adulte, un gonflement au site d'injection et une fièvre ont été très fréquemment signalés. Chez les enfants de moins de 13 ans, des gonflements ont également été très fréquemment observés après la deuxième dose.
Une tendance à une incidence plus élevée des douleurs, rougeurs et gonflements a été observée après la deuxième dose comparée à la première dose.
Aucune différence n'a été observée au niveau de la réactogénicité entre les patients initialement séropositifs et les patients initialement séronégatifs.
Dans une étude clinique, 328 enfants âgés de 11 à 21 mois ont reçu, soit par voie sous-cutanée (sc) soit par voie intramusculaire (im), le vaccin combiné de GSK contre la rougeole, les oreillons, la rubéole et la varicelle (contenant la même souche de varicelle que Varilrix). Un profil de sécurité comparable a été observé pour les deux voies d'administration.
Personnes à haut risque de varicelle sévère
On ne dispose que de données d'études cliniques limitées chez les personnes à haut risque de développer une forme sévère de varicelle. Les réactions liées au vaccin, essentiellement des éruptions cutanées papulo-vésiculaires et une fièvre, sont généralement légères. Contrairement aux sujets vaccinés sains, l'apparition d'un exanthème papulo-vésiculaire est plus fréquente chez les patients leucémiques. Ces symptômes varicelliformes ont été observés chez environ un quart des patients leucémiques. Comme chez les sujets sains, les rougeurs, les gonflements et les douleurs au site d'injection sont légers et de nature passagère.
Effets indésirables identifiés après la mise sur le marché
Après la mise sur le marché, les réactions supplémentaires suivantes ont été rapportées après une vaccination contre la varicelle:
Infections et infestations
Rares: zona.
Affections hématologiques et du système lymphatique
Rares: thrombocytopénie.
Affections du système immunitaire
Rares: hypersensibilité, réactions anaphylactiques.
Affections du système nerveux
Rares: encéphalite (voir «Mises en garde et précautions»), accident vasculaire cérébral (dans certains cas avec la mise en évidence du virus vaccinal dans le vaisseau atteint), cérébellite, symptômes de type cérébellite (y compris des troubles transitoires de la locomotion et une ataxie transitoire), convulsions.
Affections vasculaires
Rares: vascularite (y compris purpura de Henoch-Schönlein et syndrome de Kawasaki).
Affections de la peau et du tissu sous-cutané
Rares: érythème exsudatif multiforme.
Une administration intravasculaire accidentelle peut provoquer des réactions sévères pouvant aller jusqu'à un choc. Prendre les mesures immédiates en fonction du degré de gravité, voir «Mises en garde et précautions».
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageDes cas d'administration accidentelle d'une dose supérieure à la dose recommandée de Varilrix ont été signalés. Parmi ces cas, les effets indésirables suivants ont été signalés: léthargie et convulsions. Aucun des autres cas de surdosage rapportés n'a été associé à des effets indésirables.
Propriétés/EffetsCode ATC
J07BK01
Varilrix est un lyophilisat de virus atténué de la varicelle, souche OKA, fabriqué par multiplication du virus dans des cultures cellulaires diploïdes humaines (MRC-5). Varilrix répond aux exigences de l'OMS relatives aux substances biologiques et aux vaccins contre la varicelle.
Mécanisme d'action
Varilrix produit une infection à varicelle atténuée, cliniquement inapparente, chez les personnes réceptives.
Des données publiées limitées suggèrent un certain effet protecteur chez les patients qui reçoivent le vaccin peu après (dans les 3 à 5 jours) une exposition au virus naturel de la varicelle. Une protection contre une infection à varicelle quel que soit le grade de sévérité n'a pas pu être démontrée. Toutefois, le risque d'une varicelle modérée à grave (définie comme le taux de lésions cutanées [> 50 et > 100, respectivement]) était plus faible après la vaccination.
Les anticorps dans le sang confirment la protection vaccinale, sans qu'il n'y ait toutefois de valeur seuil sérologique établie pour la protection contre une infection à varicelle.
Pharmacodynamique
Efficacité clinique
Sujets sains
L'efficacité des vaccins OKA contre la varicelle de GlaxoSmithKline (1 dose de Varilrix ou 2 doses de vaccin tétravalent rougeole-oreillons-rubéole-varicelle Priorix-Tetra administrées à un intervalle de 42 jours) a été évaluée dans la grande étude clinique OKA-H-179 (suivi OKAH-182 EXT 179:Y4-Y6-Y8-Y10), contrôlée contre traitement actif et réalisée dans plusieurs pays, en comparaison avec 2 doses de vaccin rougeole-oreillons-rubéole sans composante varicelle données à un intervalle de 42 jours. Différents critères d'efficacité ont été utilisés pour le diagnostic d'une varicelle manifeste. 5803 enfants ont participé à la phase A (vaccination à l'âge de 12-24 mois). 4580 enfants ont été inclus dans la phase B de suivi au long terme. 3298 enfants (56,8%) ont terminé la totalité de l'étude OKAH-182 EXT 179:Y4-Y6-Y8-Y10 d'une durée de 10 ans. Il n'était prévu aucune hypothèse statistique pour la phase B de l'étude, mais seulement des observations descriptives. Le diagnostic primaire reposait sur la déclaration d'une affection de type varicelle par les parents qui, en cas de confirmation prévue par l'investigateur, était suivie d'un examen par PCR. Des contacts téléphoniques avaient lieu tous les 6 mois. L'investigateur a tout d'abord évalué les varicelles supposées au niveau clinique. Les cas de varicelle supposés ont ensuite encore été évalués par un panel d'experts. De plus, une mise en évidence directe du virus par PCR (Polymerase Chain Reaction) a été réalisée ainsi qu'une vérification de l'anamnèse quant à une exposition possible à la varicelle.
Dans la première analyse (cas confirmés de varicelle), la condition pour évaluer le succès de la vaccination contre la varicelle quelle que soit la sévérité et contre les cas de varicelle modérés à sévères était la mise en évidence définitive du virus par PCR et/ou la confirmation de l'exposition à la varicelle. Dans une deuxième analyse moins stricte (cas cliniques de varicelle), ont été considérés pour l'évaluation du succès de la vaccination tous les cas confirmés de varicelle mais aussi tous les cas de varicelle identifiés par le panel d'experts, indépendamment d'une confirmation par PCR ou d'une exposition dans l'anamnèse.
L'efficacité du vaccin pour prévenir les cas de varicelle confirmée quelle que soit la sévérité ainsi que les cas de varicelle confirmée modérés ou sévères a été démontrée après une période de suivi principale de 2 ans chez 5803 enfants vaccinés (durée médiane de 3,2 ans). Une efficacité durable a été observée durant les périodes de suivi au long terme de 6 ans (durée médiane de 6,4 ans) et de 10 ans (durée médiane de 9,8 ans, 3298 enfants ont participé entièrement à l'étude dans les 3 bras) de la même étude OKAH-182 EXT 179:Y4-Y6-Y8-Y10. Les résultats sont présentés dans le tableau ci-dessous.
|
Groupe
|
Période de suivi
|
Efficacité contre une varicelle confirmée, quelle que soit la sévérité
|
Efficacité contre une varicelle confirmée modérée ou sévère
| |
Vaccin monovalent contre la varicelle (OKA) (Varilrix)
(1 dose)
N=2'487
|
à 2 ans
|
65,4%
(IC à 97,5%: 57,2;72,1)
|
90,7%
(IC à 97,5%: 85,9;93,9)
| |
à 6 ans(1)
|
67,0%
(IC à 95%: 61,8;71,4)
|
90,3%
(IC à 95%: 86,9;92,8)
| |
à 10 ans(1)
|
67,2%
(IC à 95%: 62,3;71,5)
|
89,5%
(IC à 95%: 86,1;92,1)
| |
Vaccin combiné contre la rougeole, les oreillons, la rubéole et la varicelle (OKA) (Priorix-Tetra)
(2 doses)
N=2'489
|
à 2 ans
|
94,9%
(IC à 97,5%: 92,4;96,6)
|
99,5%
(IC à 97,5%: 97,5;99,9)
| |
à 6 ans(1)
|
95,0%
(IC à 95%: 93,6;96,2)
|
99,0%
(IC à 95%: 97,7;99,6)
| |
à 10 ans(1)
|
95,4%
(IC à 95%: 94,0;96,4)
|
99,1%
(IC à 95%: 97,9;99,6)
|
N=nombre de sujets inclus dans l'étude et vaccinés. Le suivi sur 10 ans a été réalisé chez 3298 enfants au total inclus dans les 3 bras (Priorix-Tetra, Varilrix, Priorix).
(1) analyse descriptive
Les données d'efficacité contre les cas cliniques de varicelle quelle que soit la sévérité ainsi que contre les cas cliniques de varicelle modérés ou sévères observés après une période de suivi principale de 2 ans et après les périodes de suivi de 6 ans et de 10 ans sont présentées dans le tableau ci-dessous.
|
Groupe
|
Période de suivi
|
Efficacité contre une varicelle clinique, quelle que soit la sévérité
|
Efficacité contre une varicelle clinique modérée ou sévère
| |
Vaccin monovalent contre la varicelle (OKA) (Varilrix)
(1 dose)
N=2'266
|
à 2 ans
|
64,6%
(IC à 95%: 57,5;70,5)
|
90,2%
(IC à 95%: 85,9;93,1)
| |
à 6 ans(1)
|
66,2%
(IC à 95%: 61,0;70,7)
|
89,8%
(IC à 95%: 86,4;92,4)
| |
à 10 ans(1)
|
66,3%
(IC à 95%: 61,4;70,6)
|
89,0%
(IC à 95%: 85,5;91,6)
| |
Vaccin combiné contre la rougeole, les oreillons, la rubéole et la varicelle (OKA) (Priorix-Tetra)
(2 doses)
N=2'279
|
à 2 ans
|
92,5%
(IC à 95%: 89,9;94,4)
|
99,3%
(IC à 95%: 94,7;99,8)
| |
à 6 ans(1)
|
93,4%
(IC à 95%: 91,7;94,7)
|
98,7%
(IC à 95%: 97,4;99,4)
| |
à 10 ans(1)
|
93,6%
(IC à 95%: 92,1;94,9)
|
98,5%
(IC à 95%: 97,1;99,2)
|
N=nombre de sujets inclus dans chaque groupe. Le suivi sur 10 ans a été réalisé chez 3298 enfants au total inclus dans les 3 bras (Priorix-Tetra, Varilrix, Priorix).
(1) analyse descriptive
Dans les études cliniques, la majorité des sujets vaccinés qui ont ensuite été exposés au virus de la varicelle de type sauvage ont été soit complètement protégés contre la varicelle clinique, soit ont développé une forme plus légère de la maladie (par ex. nombre réduit de vésicules, absence de fièvre). L'efficacité d'une dose de Varilrix ou de 2 doses du vaccin combiné ROR-varicelle était de 20-92% contre tous les cas de varicelle et de 86-100% contre les cas de maladie modérés ou graves.
Les données disponibles sont insuffisantes pour établir le taux de protection contre les complications de la varicelle telles qu'encéphalite, hépatite ou pneumonie.
Les données d'efficacité d'une utilisation à grande échelle issues d'observations dans différents contextes (épidémies, études cas-témoins, études observationnelles, bases de données, modèles) suggèrent un niveau de protection plus élevé et une diminution de la survenue des cas de varicelle après deux doses de vaccin comparé à une seule dose.
Dans une étude réalisée en Uruguay, la diminution des séjours hospitaliers et des visites médicales en ambulatoire était de 81% et 87% chez des enfants après l'administration d'une dose de Varilrix.
Réponse immunitaire après administration sous-cutanée
Sujets sains
Chez les enfants âgés de 11 à 21 mois, le taux de séroconversion mesuré par Enzyme-linked Immunosorbent Assay (ELISA) (50 mUI/mL) était de 89,6% 6 semaines après la première dose et de 100% 6 semaines après la deuxième dose.
Chez des enfants âgés de 9 mois à 12 ans, le taux moyen de séroconversion mesuré par immunofluorescence (IFA) était supérieur à 98% 6 semaines après la première vaccination.
Le taux de séroconversion mesuré par IFA chez des adolescents de 13 ans et plus était de 100% 6 semaines après la 2ème dose. Une année après la vaccination, tous les adolescents testés étaient encore séropositifs.
Personnes à haut risque de varicelle sévère
Chez les personnes à haut risque de varicelle sévère, le taux moyen de séroconversion était de 80%, atteignant environ 90% chez les patients leucémiques. Après l'immunisation, des mesures périodiques des anticorps contre la varicelle peuvent être indiquées pour dépister les patients pouvant bénéficier d'une nouvelle immunisation.
Dans une étude, l'incidence du zona était plus faible chez les patients leucémiques immunodéprimés que chez les patients leucémiques infectés par le virus naturel.
Chez des patients très immunodéprimés, des cas de varicelle significatifs sur le plan clinique sont apparus après la vaccination par Varilrix et des virus vaccinaux ont pu être isolés à partir des vésicules.
Réponse immunitaire après administration intramusculaire
L'immunogénicité de Varilrix administré par voie intramusculaire se base sur les données d'une étude comparative dans laquelle des enfants en bonne santé âgés de 11 à 21 mois ont reçu par voie soit sous-cutanée soit intramusculaire le vaccin combiné de GSK contre la rougeole, les oreillons, la rubéole et la varicelle (contenant la même souche de varicelle que Varilrix). Pour les deux voies d'administration, une immunogénicité comparable a été démontrée 6 semaines après la 2ème dose dans la population per protocole après exclusion des enfants préalablement positifs à la varicelle (n=258).
Efficacité clinique
Voir sous «Pharmacodynamique».
PharmacocinétiqueL'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesSur la base des études générales de sécurité menées chez l'animal, les données précliniques ne permettent pas d'identifier des dangers particuliers pour l'être humain.
Remarques particulièresIncompatibilités
Varilrix ne doit pas être mélangé avec d'autres vaccins dans la même seringue.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. La chaîne du froid doit être respectée.
La congélation ne modifie pas l'efficacité de Varilrix (poudre).
Remarques concernant la manipulation
Le solvant et le vaccin reconstitué doivent être examinés visuellement avant la reconstitution et l'administration pour détecter des particules étrangères et/ou des modifications de l'aspect.
En raison de petites variations du pH, la couleur du vaccin reconstitué peut varier de pêche clair à rose vif. Après la reconstitution, des particules translucides liées au produit peuvent être observées. Ceci est normal et n'affecte pas l'efficacité du vaccin. Si le vaccin présente une autre coloration ou contient d'autres particules, le vaccin reconstitué ne doit pas être utilisé.
Instructions pour la reconstitution du vaccin avec le solvant contenu dans la seringue préremplie:
Varilrix est reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon-ampoule contenant la poudre.
Pour fixer l'aiguille à la seringue, suivez les instructions ci-dessous. La seringue fournie avec Varilrix peut toutefois légèrement différer de la seringue illustrée (c.-à-d. - sans filetage). Dans ce cas, l'aiguille ne doit pas être vissée pour être connectée à la seringue.
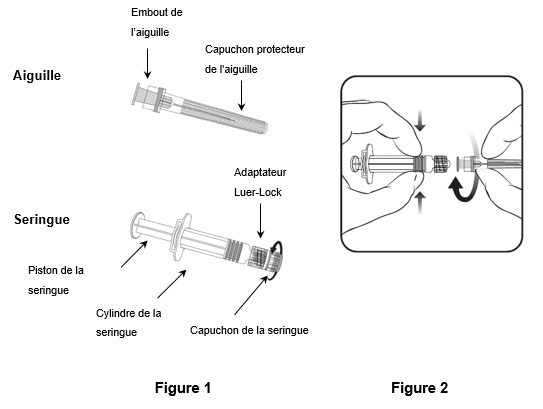
Tenez toujours la seringue par le cylindre. Ne tenez pas la seringue par le piston ou l'adaptateur Luer-Lock (ALL).
1.Tenez la seringue par le cylindre et retirez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre (comme illustré dans la figure 1).
2.Pour fixer l'aiguille à la seringue, introduisez prudemment l'embout de l'aiguille dans l'ALL et tournez l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit solidement fixée (comme illustré dans la figure 2). Veillez pendant cette opération à ce que l'aiguille soit dans l'axe de la seringue (comme illustré dans la figure 2). L'ALL risquerait sinon de se tordre et de ne plus être étanche. Si l'ALL se détache pendant la fixation de l'aiguille, il faut utiliser une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon-ampoule).
3.Retirez le capuchon protecteur de l'aiguille, qui peut parfois résister.
4.Ajoutez le solvant à la poudre. Puis agitez soigneusement le mélange jusqu'à ce que la poudre soit entièrement dissoute dans le solvant.Le vaccin doit être administré immédiatement après la reconstitution.
5.Prélevez la totalité du contenu du flacon-ampoule dans la seringue.
6.Une nouvelle aiguille doit être utilisée pour l'administration du vaccin. Retirez l'aiguille de la seringue en la dévissant et fixez une aiguille d'injection en répétant l'étape 2.
Il est recommandé d'injecter le vaccin aussi rapidement que possible après sa reconstitution. Cependant, il a été démontré que le vaccin reconstitué peut être conservé jusqu'à 90 minutes à température ambiante (25°C) et jusqu'à 8 heures au réfrigérateur (2°C-8°C). Une fois ces délais dépassés, le vaccin reconstitué ne doit plus être utilisé.
Avant l'injection, laisser s'évaporer complètement l'alcool et autres désinfectants de la peau, car ces substances peuvent inactiver le virus.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la règlementation nationale.
Numéro d’autorisation00585 (Swissmedic)
PrésentationFlacon-ampoule avec une dose de vaccin lyophilisé et seringue préremplie avec solvant (B)
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationOctobre 2025
|

