CompositionPrincipes actifs
Polysaccharide capsulaire de la bactérie Haemophilus influenzae de type b, lié à une protéine tétanique.
Excipients
Poudre: lactose.
Solvant: chlorure de sodium, eau pour préparations injectables.
Après reconstitution, une dose de vaccin contient 1,77 mg de sodium.
Indications/Possibilités d’emploiHiberix est indiqué pour l'immunisation active de tous les enfants dès l'âge de 2 mois contre l'Haemophilus influenzae de type b.
Hiberix ne protège pas contre les maladies provoquées par d'autres types d'Haemophilus influenzae, ni contre les méningites qui sont causées par d'autres organismes.
Hiberix doit être administré selon les recommandations officielles de vaccination.
Posologie/Mode d’emploiPosologie usuelle
La dose recommandée de 0,5 ml doit être administrée en totalité.
Immunisation de base:
Hiberix peut être administré individuellement ou simultanément avec la vaccination DTP (injection controlatérale). L'immunisation de base comporte trois vaccinations (enfants dès l'âge de 2 mois) ou deux vaccinations (enfants dès l'âge de 3 mois) administrées à des intervalles de deux mois.
Primovaccination à partir du 2ème mois:
1ère dose à l'âge de 2 mois.
2ème dose à l'âge de 4 mois.
3ème dose à l'âge de 6 mois.
Primovaccination à partir du 3ème mois:
1ère dose à l'âge de 3 ou 4 mois.
2ème dose à l'âge de 5 ou 6 mois.
Vaccination de rappel:
Afin de garantir une protection à long terme, il est recommandé de procéder à une vaccination de rappel avec une dose d'Hiberix au cours de la 2ème année de vie, le cas échéant simultanément avec la 4ème vaccination DTP.
Conformément au plan de vaccination suisse, la vaccination a lieu à l'âge de 15 mois.
Mode d'administration
Le vaccin reconstitué doit être administré par voie intramusculaire.
Il est de pratique courante que le vaccin puisse être administré par voie sous-cutanée chez les patients atteints de thrombocytopénie ou présentant des troubles de la coagulation sanguine (voir «Mises en garde et précautions»).
Les vaccinations contre l'Haemophilus influenzae de type b devraient de préférence être administrées conjointement avec les vaccinations DTP, de manière controlatérale. Il n'est pas nécessaire d'observer un intervalle avec d'autres vaccinations.
Contre-indicationsHiberix ne doit être administré ni aux sujets présentant une hypersensibilité connue à l'un des composants du vaccin (de même qu'au toxoïde de tétanos), ni aux personnes ayant développé des réactions d'hypersensibilité après une vaccination antérieure contre le Hib.
Comme avec d'autres vaccins, la vaccination sera repoussée en cas de maladie aiguë, grave et accompagnée de fièvre.
Une infection légère ne constitue pas une contre-indication.
Mises en garde et précautionsHiberix ne doit jamais être injecté par voie intraveineuse!
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l'injection. Ceci peut s'accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d'éviter des blessures en cas d'évanouissement.
Comme avec tous les vaccins injectables, un traitement médical approprié doit être disponible en cas de réaction anaphylactique après la vaccination.
Une infection par le VIH ne constitue pas une contre-indication.
Malgré une réaction limitée au toxoïde de tétanos, une vaccination par Hiberix seul ne peut pas être considérée comme un substitut des vaccinations antitétaniques de routine.
Après l'administration de vaccins Hib, l'excrétion d'antigènes de polysaccharide capsulaire dans les urines a été décrite. La valeur diagnostique d'un dosage des antigènes lors d'une infection Hib présumée peut donc être remise en question pendant une période de 1 à 2 semaines après la vaccination.
Hiberix doit être utilisé avec prudence chez les enfants présentant une thrombocytopénie ou un trouble de la coagulation sanguine. Etant donné que chez ces enfants une hémorragie peut survenir après une injection intramusculaire, il est recommandé d'administrer Hiberix par voie sous-cutanée.
Le risque potentiel d'apnée et la nécessité d'une surveillance respiratoire pendant 48-72 h doivent être soigneusement pris en compte lors de la primovaccination des grands prématurés (nés avant la fin de la 28ème semaine de grossesse) et particulièrement chez ceux qui ont des antécédents d'immaturité pulmonaire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose de vaccin, c.-à-d. qu'il est pratiquement «sans sodium».
InteractionsIl se peut qu'une réponse immunitaire adéquate ne soit pas obtenue chez les patients sous traitement immunosuppresseur ou chez les patients présentant une réponse immunitaire limitée.
Grossesse, allaitementEtant donné qu'Hiberix n'est pas destiné à être utilisé chez les adultes, aucune donnée sur la sécurité d'emploi du vaccin pendant la grossesse et l'allaitement n'est disponible.
Il n'a pas non plus été effectué d'études portant sur la reproduction chez l'animal.
Effet sur l’aptitude à la conduite et l’utilisation de machinesNon pertinent.
Effets indésirablesLes données de fréquence suivantes reposent sur l'analyse de données d'environ 3'000 nourrissons dans l'étude Hib-097 et d'environ 1'200 nourrissons dans l'étude DTPa-HBV-IPV-011. D'autres effets indésirables et leur fréquence provenant de rapports après la commercialisation sont signalés par un astérisque*.
Les effets indésirables sont rangés par classe de système d'organes de la classification MedDRA et par fréquence selon la convention suivante: «très fréquents» (≥1/10), «fréquents» (≥1/100 à <1/10), «occasionnels» (≥1/1000 à <1/100), «rares» (≥1/10 000 à <1/1000), «très rares» (<1/10 000).
Affections du système immunitaire
Très rares: réactions allergiques (y compris réactions anaphylactiques et anaphylactoïdes), angio-œdème*.
Troubles du métabolisme et de la nutrition
Très fréquents: perte d'appétit (27,1% après la primovaccination, 25,6% après la vaccination de rappel).
Affections psychiatriques
Très fréquents: cris (16% après la primovaccination), irritabilité, agitation (67,1% après la primovaccination, 56,4% après la vaccination de rappel).
Affections du système nerveux
Très fréquents: somnolence (52,7% après la primovaccination, 36,7% après la vaccination de rappel).
Rares: convulsions (y compris convulsions fébriles), épisodes d'hypotonie-hyporéactivité, syncope ou réponses vasovagales à l'injection*.
Affections respiratoires, thoraciques et médiastinales
Très rares: apnée chez les grands prématurés (nés avant la fin de la 28ème semaine de grossesse), voir «Mises en garde et précautions».
Des cas d'apnée ont également été rapportés chez des enfants plus âgés.
Affections gastro-intestinales
Très fréquents: diarrhée (11% après la primovaccination).
Fréquents: vomissements.
Affections de la peau et du tissu sous-cutané
Rares: éruption cutanée, urticaire.
Troubles généraux et anomalies au site d'administration
Très fréquents: fièvre (14,7% après la primovaccination, 12,6% après la vaccination de rappel), gonflement (15,6% après la primovaccination, 17,6% après la vaccination de rappel), douleurs (45,9% après la primovaccination, 41,3% après la vaccination de rappel) et rougeur (24,3% après la primovaccination, 29,6% après la vaccination de rappel) au site d'injection.
Très rares: gonflement étendu de l'extrémité du membre ayant reçu le vaccin*, induration au site d'injection*.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn général, le profil d'effets secondaires rapportés après un surdosage était comparable à celui décrit après l'administration de la dose recommandée d'Hiberix.
Propriétés/EffetsCode ATC
J07AG01
Hiberix contient un polysaccharide capsulaire de phosphate de polyribosyl-ribitol de la bactérie Hib lyophilisé et purifié, lié de manière covalente au toxoïde de tétanos.
Le polysaccharide Hib est obtenu à partir de la souche 20'752 de la bactérie de Haemophilus influenzae de type b et lié au toxoïde de tétanos. Après purification, le conjugué est lyophilisé avec du lactose comme stabilisateur.
Hiberix est conforme aux exigences de l'OMS pour les produits biologiques et pour les vaccins Hib conjugués.
Mécanisme d'action
Non pertinent.
Pharmacodynamique
Un mois après la dernière dose de l'immunisation de base, un titre supérieur à 0,15 µg/ml a été obtenu chez 95 à 100% des enfants.
Un mois après la dose de rappel, un titre supérieur à 0,15 µg/ml a été atteint chez 100% des enfants (chez 94,7% d'entre eux, titre supérieur à 1,0 µg/ml).
Chez les enfants à partir de l'âge de 2 mois révolus, on obtient une protection sûre par l'administration de 4 x 0,5 ml d'Hiberix.
Efficacité clinique
Voir sous «Pharmacodynamique».
PharmacocinétiqueL'évaluation des propriétés pharmacocinétiques n'est pas requise pour les vaccins.
Absorption
Non pertinent.
Distribution
Non pertinent.
Métabolisme
Non pertinent.
Élimination
Non pertinent.
Données précliniquesNon disponibles.
Remarques particulièresIncompatibilités
Hiberix ne doit pas être mélangé avec d'autres vaccins dans la même seringue, sauf mention particulière du fabricant.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur le récipient.
La stabilité à partir de la date de fabrication est de 36 mois lorsque Hiberix est conservé entre 2°C et 8°C.
Remarques particulières concernant le stockage
Conserver au réfrigérateur (2-8°C), à l'abri de la lumière dans l'emballage d'origine et hors de portée des enfants. Ne pas congeler!
Remarques concernant la manipulation
Le vaccin Hib lyophilisé est disponible sous la forme d'une poudre blanche dans un flacon-ampoule.
Le solvant contenu dans la seringue préremplie est limpide et incolore.
Le vaccin reconstitué est une solution limpide à opalescente et incolore.
Le solvant et le vaccin reconstitué doivent être soumis avant la reconstitution ou l'administration à un contrôle visuel pour s'assurer de l'absence de particules étrangères et/ou de modifications de l'aspect physique. Si l'on observe de quelconques modifications, le solvant ou le vaccin reconstitué ne doivent pas être utilisés.
Instructions pour la reconstitution du vaccin avec le solvant contenu dans la seringue préremplie
Hiberix est reconstitué en ajoutant la totalité du contenu de la seringue préremplie de solvant dans le flacon-ampoule contenant la poudre.
Pour fixer l'aiguille à la seringue, suivez les instructions ci-dessous. La seringue fournie avec Hiberix peut toutefois légèrement différer de la seringue illustrée (c.-à-d. sans filetage). Dans ce cas, l'aiguille ne doit pas être vissée pour être connectée à la seringue.
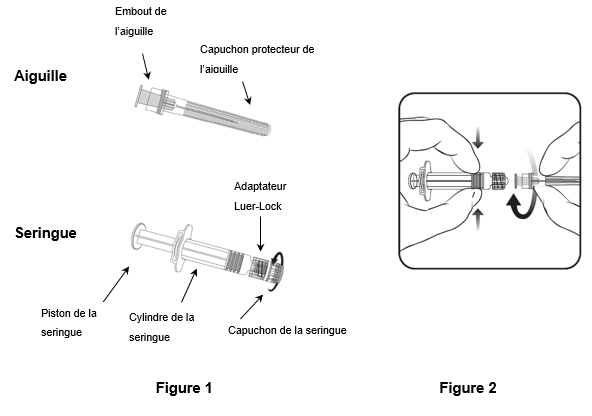
Tenez toujours la seringue par le cylindre. Ne tenez pas la seringue par le piston ou l'adaptateur Luer-Lock (ALL).
1.Tenez la seringue par le cylindre et retirez le capuchon de la seringue en le tournant dans le sens inverse des aiguilles d'une montre (comme illustré dans la figure 1).
2.Pour fixer l'aiguille à la seringue, introduisez prudemment l'embout de l'aiguille dans l'ALL et tournez l'aiguille dans le sens des aiguilles d'une montre jusqu'à ce qu'elle soit solidement fixée (comme illustré dans la figure 2). Veillez pendant cette opération à ce que l'aiguille soit dans l'axe de la seringue (comme illustré dans la figure 2). L'ALL risquerait sinon de se tordre et de ne plus être étanche. Si l'ALL se détache pendant la fixation de l'aiguille, il faut utiliser une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon-ampoule).
3.Retirez le capuchon protecteur de l'aiguille, qui peut parfois résister.
4.Ajoutez le solvant à la poudre. Puis agitez soigneusement le mélange jusqu'à ce que la poudre soit entièrement dissoute dans le solvant.Le vaccin reconstitué est une solution limpide à opalescente et incolore.Le vaccin doit être administré immédiatement après la reconstitution.
5.Prélevez la totalité du contenu du flacon-ampoule dans la seringue.
6.Une nouvelle aiguille doit être utilisée pour l'administration du vaccin. Retirez l'aiguille de la seringue en la dévissant et fixez une aiguille d'injection en répétant l'étape 2.
Les résidus de vaccin non utilisés et les déchets doivent être éliminés conformément à la règlementation nationale.
Numéro d’autorisation00603 (Swissmedic)
Présentation1 flacon-ampoule avec la poudre et 1 seringue préremplie avec le solvant avec deux aiguilles séparées (B)
Titulaire de l’autorisationGlaxoSmithKline AG, 6340 Baar
Mise à jour de l’informationNovembre 2022
| 
