CompositionPrincipes actifs
Dantrolenum natricum.
Excipients
Mannitolum (E421), Natrii hydroxidum (pour ajustement du pH).
Indications/Possibilités d’emploiHyperthermie maligne.
Posologie/Mode d’emploiPerfusion i.v. rapide de 2,5 mg/kg de poids corporel en l'espace de quelques minutes. Poursuivre la perfusion tant que les principaux signes cliniques de tachycardie, hypoventilation, hyperacidité persistante et hyperthermie persistent (surveillance nécessaire du pH et de la pCO2). Cette posologie doit être répétée avec 5 minutes d'intervalle jusqu'à une dose totale de 10 mg/kg de poids corporel. Dans la plupart des cas, une quantité totale de 10 mg/kg du poids corporel (pc) par jour (24 heures) suffit. Lorsqu'une dose cumulée de 10 mg/kg de poids corporel ne produit pas l'effet attendu, le diagnostic doit être remis en cause. Une dose cumulée de plus de 10 mg/kg de poids corporel peut parfois être nécessaire pour maîtriser définitivement une hyperthermie maligne. Des doses totales de plus de 40 mg/kg de poids corporel sont connues dans des cas isolés. Sur la base de cette expérience, des doses plus élevées peuvent être administrées dans des cas individuels si nécessaire.
Enfants et adolescents
La posologie est identique pour enfants et adultes.
Contre-indicationsHypersensibilité au principe actif ou à l'un des autres composants, voir au chapitre «Composition».
Mises en garde et précautionsL'administration de DANTROLEN i.v. peut entraîner une faiblesse musculaire entravant la fonction respiratoire. La respiration doit donc être contrôlée.
L'utilisation de DANTROLEN i.v. dans le traitement de l'hyperthermie maligne ne remplace pas les autres mesures de soutien. Ceux-ci doivent être poursuivis individuellement.
DANTROLEN i.v. ne peut être administré que par voie intraveineuse. Le pH élevé de la solution – 9,5 – interdit l'injection paraveineuse qui pourrait provoquer une nécrose des tissus. La perfusion intra-artérielle est à éviter en raison du danger d'oblitération vasculaire.
En outre, l'utilisation d'un dispositif de filtration pour le prélèvement de la solution injectable est indispensable en raison de la présence éventuelle de cristaux non dissous ou de particules dans la solution après reconstitution et du risque qui en résulte d'une aggravation de la réaction au site de perfusion, resp. d'une nécrose des tissus provoquée par la présence de cristaux dans les flacons concernés.
Chaque flacon perforable de DANTROLEN i.v. contient 3 g de mannitol (pour l'ajustage d'une solution isotonique). Cette quantité doit être prise en compte si le mannitol est utilisé pour prévenir et traiter les complications rénales associées à l'hyperthermie maligne.
Le dantrolène i.v. contient moins de 1 mmol de sodium (23 mg) par flacon, c'est-à-dire qu'il est pratiquement «sans sodium».
La prudence s'impose en cas d'apparition de symptômes d'hyperkaliémie (paralysie musculaire, modification de l'ECG, arythmies cardiaques avec bradycardie) ou en cas d'hyperkaliémie pré-existante (insuffisance rénale, intoxication digitalique, etc.); car les essais sur les animaux ont révélé que le dantrolène entraînait une augmentation du potassium sérique.
Des doses supérieures à 10 mg de principe actif par kg de poids corporel et par 24 h peuvent entraîner une faiblesse musculaire.
InteractionsInteractions pharmacodynamiques
L'expérimentation animale suggère la possibilité d'une interaction entre dantrolène et le vérapamil (éventuellement aussi avec d'autres antagonistes du calcium) provoquant une fibrillation. DANTROLEN i.v. ainsi que le vérapamil ou d'autres antagonistes du calcium ne doivent donc pas être administrés en même temps.
Effet de DANTROLEN iv sur d'autres médicaments
La prise concomitante de DANTROLEN i.v. et d'un relaxant musculaire non-dépolarisant tel que le vécuronium peut renforcer leur effet respectif.
Grossesse, allaitementGrossesse
Les données sur l'utilisation du dantrolène chez la femme enceinte sont insuffisantes. Des études sur les animaux ont révélé une toxicité pour la reproduction (voir «Données précliniques»).
Il n'existe pas de données disponibles sur le traitement avec DANTROLEN i.v. chez la femme enceinte, c'est pourquoi l'administration ne devrait uniquement être effectuée que si elle s'avère absolument nécessaire (indication vitale).
Allaitement
Dantrolène traverse le placenta et a pu être décelé dans le lait maternel. DANTROLEN i.v. ne devrait pas être administré aux femmes qui allaitent. Si un traitement avec DANTROLEN i.v. est nécessaire, l'allaitement devrait être interrompu.
Fertilité
Il n'existe pas de données cliniques concernant les effets du dantrolène sur la fertilité. Les études sur les animaux ne fournissent pas de preuves d'un effet direct du dantrolène sur la fertilité (voir «Données précliniques»).
Effet sur l’aptitude à la conduite et l’utilisation de machinesDANTROLEN i.v. affecte l'aptitude à conduire et à utiliser des machines, en raison de risques de vertige, obnubilation et faiblesse. Cela est particulièrement vrai en cas d'association avec l'alcool ou d'autres médicaments qui dépriment le système nerveux central (sédatifs). Jusqu'à 48 heures post opératoire, il faut s'attendre à une faiblesse de préhension et une faiblesse de la musculature des jambes, qui se manifeste principalement en montant les escaliers.
Effets indésirablesComme il n'existe pas de données à ce sujet, la fréquence des troubles suivants ne peut pas faire l'objet d'une estimation:
·Affections du système immunitaire: réactions allergiques, anaphylaxie
·Troubles du métabolisme et de la nutrition: hyperkaliémie
·Affections du système nerveux: somnolence, convulsions, troubles de l'élocution, vertiges, sensation de faiblesse, maux de tête
·Affections cardiaques: insuffisance cardiaque, bradycardie, tachycardie
·Affections vasculaires: thrombophlébite
·Affections respiratoires, thoraciques et médiastinales: épanchement pleural, insuffisance respiratoire, dépression respiratoire, œdème pulmonaire
·Affections gastro-intestinaux: nausées, vomissements, diarrhées, douleurs/crampes abdominales, hémorragies gastro-intestinales
·Affections hépatobiliaries: ictère, hépatite/hépatotoxicité, dysfonctionnement hépatique y compris insuffisance hépatique fatale, maladie hépatique idiosyncrasique ou hypertensive
·Affections de la peau et du tissu sous-cutané: hyperhidrose, urticaire, érythème
·Affections musculosquelettiques et du tissu conjonctif: faiblesse musculaire, fatigue musculaire
·Affections du rein et des voies urinaires: cristallurie
·Affections des organes de reproduction et du sein: hypotonie utérine
·Troubles généraux et anomalies au site d'administration: réactions au point d'administration, fatigue
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageL'hyperthermie maligne est une situation d'urgence, dans laquelle une infusion rapide d'une dose élevée de DANTROLEN i.v. est nécessaire.
Signes et symptômes
Des symptômes spécifiques liés à un surdosage de DANTROLEN i.v. ne sont pas connus. Il faut rester vigilant aux signes d'une hyperkaliémie.
Traitement
L'utilisation d'une dialyse n'est pas connue.
Propriétés/EffetsCode ATC
M03CA01
Mécanisme d'action
Le dantrolène dissocie le couplage excitation-contraction du muscle strié en inhibant la libération du calcium stocké dans les membranes du réticulum sarcoplasmique. Il exerce à cet égard une action ciblée et n'influence pas la transmission neuromusculaire. Il n'exerce également pas d'effet mesurable sur l'excitabilité de la membrane sarcoplasmique.
Le syndrome d'hyperthermie maligne, qui se manifeste en réponse à l'inhalation d'agents anesthésiques, renvoie à une anomalie génétique du transport calcique dans la cellule musculaire. On estime que les substances déclenchantes provoquent une augmentation subite du taux de calcium myoplasmique en renforçant sa libération et inhibant son stockage dans le réticulum sarcoplasmique. Cette augmentation du taux de calcium myoplasmique aboutit à une activité métabolique intense qui est à l'origine de l'hyperthermie, de l'acidose métabolique et des autres symptômes caractérisant l'hyperthermie maligne.
Pharmacodynamique
Le dantrolène peut prévenir les processus cataboliques aigus au sein de la cellule musculaire en inhibant la libération du calcium stocké dans les membranes du réticulum sarcoplasmique. Les altérations physiologiques, métaboliques et biochimiques accompagnant l'hyperthermie maligne peuvent ainsi être inversées ou atténuées.
Efficacité clinique
Aucune information.
PharmacocinétiqueAbsorption
Aucune information.
Distribution
Des concentrations plasmatiques de l'ordre de 4,3–6,5 mg/l ont été trouvées chez 6 patients à hyperthermie maligne ayant reçu à titre préventif une perfusion i.v. de 2,5 mg/kg pendant 10 à 30 min.
Métabolisme
Le dantrolène est métabolisé dans le foie en 5-hydroxydantrolène et acétylamino-dantrolène. L'activité du 5-hydroxydantrolène représente environ 50% de celle de la molécule mère tandis que l'acétylamino-dantrolène n'a pas d'activité myorelaxante.
Élimination
La demi-vie biologique du dantrolène est de 12 h chez les patients atteints d'hyperthermie maligne. Un facteur de 0,4 a été trouvé pour le passage de la barrière placentaire.
Données précliniquesToxicité à long terme
Lors des essais de toxicité chronique chez le rat, le chien et le singe, l'administration orale de > 30 mg/kg/d de dantrolène (doses équivalentes pour l'homme respectivement de 4,8 mg/kg, 16,2 mg/kg et 9,6 mg/kg) a entraîné une diminution de la croissance ou de la prise de poids, ainsi que des effets toxiques sur le foie et de probables néphropathies occlusives réversibles.
Mutagénicité
Le dantrolène s'est révélé positif dans les essais de mutagénicité in vitro (tests d'Ames) sur certaines souches bactériennes en présence et en l'absence d'homogénat de foie de rat.
Cancérogénicité
L'administration de dantrolène par voie orale chez le rat, à des doses allant jusqu'à 60 mg/kg/jour (dose équivalente pour l'homme de 9,6 mg/kg) pendant une période allant jusqu'à 18 mois a entraîné une augmentation des régénérations hépatiques bénignes des vaisseaux lymphatiques, une augmentation des lymphangiomes hépatiques et des angiosarcomes hépatiques, et une augmentation des tumeurs mammaires chez les animaux femelles uniquement.
La pertinence de ces données pour l'utilisation clinique du dantrolène n'est pas connue.
Toxicité pour la reproduction
Chez les rats adultes mâles et femelles, le dantrolène n'a pas eu d'effets indésirables sur la fertilité ou la capacité générale de reproduction jusqu'à une dose orale de 45 mg/pc/jour (dose équivalente pour l'homme de 7,3 mg/kg/jour). L'administration de dantrolène à des rats femelles en gestation (à partir de 20 mg/kg/jour; dose équivalente chez l'homme de 3,2 mg/kg/jour) et à des lapines (45 mg/kg/jour; dose équivalente chez l'homme de 14,5 mg/kg/jour) a entraîné une augmentation de la formation de côtes surnuméraires unilatérales ou bilatérales chez les jeunes.
Remarques particulièresUne fois préparée, la solution de DANTROLEN i.v. ne doit pas être mélangée à d'autres solutions de perfusion.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date de péremption imprimée sur l'emballage avec la mention «Verwendbar bis».
Après reconstitution et filtration, la solution est prête à l'emploi et doit être utilisée IMMÉDIATEMENT. Éliminer la solution restante.
Remarques particulières concernant le stockage
Tenir hors de portée des enfants.
Conserver la substance sèche au-dessous de 25 °C.
Protéger la solution de la lumière directe et la conserver entre 15-25 °C.
Remarques concernant la manipulation
Instructions pour la préparation de la solution: Ajouter 60 ml d'eau pour préparations injectables à chaque flacon de DANTROLEN i.v. et agiter jusqu'à ce que la solution soit claire.
Informations importantes à lire avant l'emploi:
Reconstitution de DANTROLEN i.v. (dantrolène-sodique)
La solution de DANTROLEN i.v. reconstituée doit être filtrée avant d'être administrée au patient afin de garantir l'absence de particules. Pour ce faire, procédez comme suit:
1.Reconstituez le flacon avec 60 ml d'eau pour préparations injectables. Pour ajouter l'eau, NE PAS utiliser le dispositif de filtration à usage unique.
2.Après la reconstitution, la solution doit être filtrée au moyen du dispositif de filtration fourni lors du prélèvement dans la seringue. Lorsqu'on utilise un nouveau flacon de DANTROLEN i.v., utiliser systématiquement un NOUVEAU dispositif de filtration à usage unique. La solution doit être utilisée dans les 6 heures suivant la reconstitution, mais doit être filtrée juste avant utilisation.
3.Enlevez le dispositif de filtration à usage unique de la seringue avant de connecter celle-ci à une canule intraveineuse ou un set d'administration et administrer la préparation IMMÉDIATEMENT après filtration.
4.Jetez le dispositif de filtration et le flacon avec le produit dans un collecteur pour objets pointus et tranchants approuvé.
Attention: Pour injection par voie intraveineuse uniquement. Utiliser uniquement le dispositif de filtration à usage unique fourni. Une réutilisation du dispositif de filtration peut engendrer une infection ou une autre maladie/blessure. Ne pas stériliser le dispositif de filtration en autoclave. Ne pas utiliser si l'emballage individuel est endommagé.
Le médicament non utilisé et les déchets doivent être éliminés conformément aux dispositions nationales en vigueur.
Informations sur la reconstitution et la filtration de DANTROLEN i.v.
|
|

|
1) Mettre une canule sur une seringue et prélever 60 ml d'eau pour préparations injectables.
| |
|

|
2) Reconstituer un flacon de DANTROLEN i.v. avec l'eau pour préparations injectables prélevée auparavant. Agiter légèrement jusqu'à ce que la poudre soit entièrement dissoute. Jeter la canule.
| |
|

|
3) Retirer la capsule de sécurité et insérer la pointe du dispositif de filtration à usage unique dans le flacon.
| |
|

|
4) Connecter la seringue et aspirer la totalité des 60 ml de solution reconstituée du flacon dans la seringue, puis jeter le dispositif de filtration.
| |
|
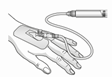
|
5) Connecter la seringue contenant la solution reconstituée filtrée directement à la canule intraveineuse ou à un set d'administration. En fonction de la nécessité clinique, le produit est administré immédiatement ou par perfusion manuelle, resp. au moyen d'une pompe. Voir la rubrique Posologie/Mode d'emploi pour la dose maximale.
|
Mises en garde concernant la manipulation:
|
|
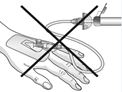
|
Attention:
Ne pas utiliser le dispositif de filtration pour le transfert de la solution filtrée de la seringue à la canule intraveineuse ou au set d'administration!
|
Numéro d’autorisation45217 (Swissmedic).
Présentation1x12 et 3x12 flacons pour injection (flacons perforables de 20 mg dantrolène sodique).
Avec chaque flacon perforable un dispositif de filtration à usage unique est fourni.
Titulaire de l’autorisationNorgine AG, 6005 Lucerne
Mise à jour de l’informationFévrier 2021
| 





