CompositionPrincipe actif
Betiatidum (benzoyl-mercapto-acétyl-triglycine).
Excipients
Stannosi chloridum dihydricum, dinatrii tartras dihydricus, acidum hydrochloridum concentratum.
Le lyophilisat du produit contient 4,7 mg de sodium par flacon-ampoule.
Après la reconstitution avec 10 ml d’une solution de pertechnétate de sodium, le produit contient 4,01 mg/ml de sodium.
Spécifications
Mécanisme de réaction
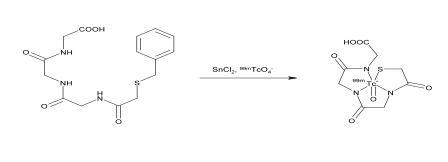
bétiatide (99mTc)Technétium-Mertiatide
Spécifications du produit marqué
Solution aqueuse exempte d’endotoxines, stérile, incolore, claire à légèrement opalescente, destinée à l’administration intraveineuse, pH: 5,0 - 6,0.
Rendement de marquage conformément à l’HPLC: ≥ 95% immédiatement après marquage, ≥ 94% 8 heures après marquage (volume final de 10 ml).
Indications/Possibilités d'emploiTechneScan MAG3 est une préparation radiodiagnostique, qui est indiquée, après reconstitution à l’aide du pertechnétate [99mTc] de sodium, pour:
examen scintigraphique de la perfusion rénale et de l’excrétion rénale,
mise en évidence statique ou dynamique des voies urinaires (néphrographie et scintigraphie séquentielle).
Chez les patients avec fonction rénale fortement réduite, le (99mTc) technétium mertiatide ne convient pas aux études précises du flux sanguin ou plasmatique rénal effectif maximal (ERBF/ERPF).
Posologie/Mode d'emploiPosologie
Adultes
La posologie usuelle chez un adulte (70 kg) est de 100 MBq. La posologie doit être ajustée en fonction du type d’examen et de la fonction rénale.
Afin de déterminer la perfusion rénale, ou le passage à travers les uretères, les doses nécessaires sont en général plus élevées pour l’examen du flux que pour la mesure de la perfusion intra-rénale. La néphrographie est possible avec des posologies inférieures à celles nécessaires pour les scintigraphies séquentielles.
Personnes âgées
Aucun schéma posologique spécifique n’est nécessaire chez les patients âgés.
Insuffisance rénale
Une évaluation minutieuse de l’activité à utiliser est nécessaire car une exposition accrue aux rayonnements peut être observée chez ces patients.
Enfants et adolescents
L’utilisation chez l’enfant et l’adolescent doit être soigneusement évaluée et doit tenir compte de la nécessité clinique et intégrer le rapport bénéfice-risque dans cette population.
Chez l’enfant et l’adolescent, l’activité à administrer est déterminée conformément à la carte de posologie EANM (2016) en utilisant la formule suivante:
activité à administrer A [MBq] = activité de base (de 11,9 MBq) x facteur de multiplication
Les activités à administrer sont indiquées dans le tableau suivant:
|
Poids
(kg)
|
Activité
(MBq)
|
Poids
(kg)
|
Activité
(MBq)
|
Poids
(kg)
|
Activité
(MBq)
| |
3
|
15
|
22
|
36
|
42
|
52
| |
4
|
15
|
24
|
38
|
44
|
54
| |
6
|
18
|
26
|
40
|
46
|
55
| |
8
|
20
|
28
|
41
|
48
|
57
| |
10
|
23
|
30
|
43
|
50
|
58
| |
12
|
26
|
32
|
45
|
52 - 54
|
60
| |
14
|
28
|
34
|
46
|
56 - 58
|
62
| |
16
|
30
|
36
|
48
|
60 - 62
|
65
| |
18
|
32
|
38
|
50
|
64 - 66
|
67
| |
20
|
34
|
40
|
51
|
68
|
69
|
Répétition de l’examen
L’examen peut être en principe répété, dès que l’activité est suffisamment éliminée de la circulation, du parenchyme rénal, du bassinet, et évt. de la vessie. Pendant les examens cliniques, des intervalles de 45 - 60 minutes entre deux examens ont donné des résultats cliniques valables.
Mode d’administration
Flacon multidose.
Ce médicament doit être reconstitué avant administration au/à la patient(e).
Pour les instructions concernant la reconstitution du médicament, voir rubrique «Remarques concernant la manipulation».
Pour les instructions de préparation du/de la patient(e), voir la rubrique «Mises en garde et
précautions».
Acquisition d’images
L’examen scintigraphique est généralement effectué immédiatement après l’administration.
Exposition aux rayonnements
Le technétium (99mTc) est préparé à l’aide d’un générateur (99Mo/99mTc) et se désintègre avec émission de rayons gamma ayant une énergie moyenne de 140 keV et une demi-vie de 6,01 heures en technétium (99Tc), qui peut être considéré comme quasi stable en raison de sa longue demi-vie de 2,13 x 105 ans.
Les données figurant dans le tableau proviennent de l’ICRP 128 et ont été calculées selon les hypothèses suivantes:
-En général, après administration intraveineuse, MAG3 est rapidement distribué dans l’espace extracellulaire et complètement éliminé par le système rénal selon le modèle reins-vessie. La rétention corporelle totale est décrite par des fonctions tri-exponentielles (Stabin et al., 1992). Le temps de passage rénal est supposé être de 4 minutes.
-Si la fonction des deux reins est réduite, on suppose que le taux de clairance de la substance est égale à un dixième de la clairance normale, que le temps de passage rénal est augmenté à 20 minutes et que 4% sont absorbés par le foie.
-En cas d’obstruction rénale aiguë unilatérale, on suppose que l’absorption de 50% de l’agent radiopharmaceutique administré est assumée par un rein. L’agent radiopharmaceutique est libéré lentement dans le sang avec une demi-vie de 5 jours et éliminé par le rein sain.
Selon l'ICRP publication No. 128 (Vol. 44, 2015)
Dose estimée absorbée par unité d'activité administrée: 99mTc-MAG3 lors de fonction rénale normale (µGy/MBq)
|
Organe cible
|
adultes
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
0,39
|
0,51
|
0,82
|
1,20
|
2,50
| |
Surface osseuse
|
1,30
|
1,60
|
2,10
|
2,40
|
4,30
| |
Cerveau
|
0,10
|
0,13
|
0,22
|
0,35
|
0,61
| |
Seins
|
0,10
|
0,14
|
0,24
|
0,39
|
0,82
| |
Paroi de la vésicule
|
0,57
|
0,87
|
2,00
|
1,70
|
2,80
| |
Tube digestif
|
|
|
|
|
| |
Paroi de l’estomac
|
0,39
|
0,49
|
0,97
|
1,30
|
2,50
| |
Paroi de l’Intestin grêle
|
2,30
|
3,00
|
4,20
|
4,60
|
7,80
| |
Paroi du côlon
|
3,40
|
4,30
|
5,90
|
6,00
|
9,80
| |
Paroi du côlon supérieur
|
1,70
|
2,30
|
3,40
|
4,00
|
6,70
| |
Paroi du côlon inférieur
|
5,70
|
7,00
|
9,20
|
8,70
|
14,00
| |
Paroi du cœur
|
0,18
|
0,24
|
0,37
|
0,57
|
1,20
| |
Reins
|
3,40
|
4,20
|
5,90
|
8,40
|
15,00
| |
Foie
|
0,31
|
0,43
|
0,75
|
1,10
|
2,10
| |
Poumons
|
0,15
|
0,21
|
0,33
|
0,50
|
1,00
| |
Muscles
|
1,40
|
1,70
|
2,20
|
2,40
|
4,10
| |
Œsophage
|
0,13
|
0,18
|
0,28
|
0,44
|
0,82
| |
Ovaires
|
5,40
|
6,90
|
8,70
|
8,70
|
14,00
| |
Pancréas
|
0,40
|
0,50
|
0,93
|
1,30
|
2,50
| |
Moelle osseuse
|
0,93
|
1,20
|
1,60
|
1,50
|
2,10
| |
Peau
|
0,46
|
0,57
|
0,83
|
0,97
|
1,80
| |
Rate
|
0,36
|
0,49
|
0,79
|
1,20
|
2,30
| |
Testicules
|
3,70
|
5,30
|
8,10
|
8,70
|
16,00
| |
Thymus
|
0,13
|
0,18
|
0,28
|
0,44
|
0,82
| |
Thyroïde
|
0,13
|
0,16
|
0,27
|
0,44
|
0,82
| |
Paroi de la vessie
|
110
|
140
|
170
|
180
|
320
| |
Utérus
|
12,00
|
14,00
|
19,00
|
19,00
|
31,00
| |
Autres organes
|
1,30
|
1,60
|
2,10
|
2,20
|
3,60
| |
Dose efficace (µSv/MBq)
|
7,00
|
9,00
|
12,00
|
12,00
|
22,00
|
Les parois de la vessie contribuent jusqu’à 80% de la dose efficace.
La dose efficace (µSv/MBq) après vidange de la vessie après 1 heure et après 30 minutes après l’administration est de:
|
1 heure
|
2,5
|
3,1
|
4,5
|
6,4
|
6,4
| |
30 minutes
|
1,7
|
2,1
|
2,9
|
3,9
|
6,8
|
La dose efficace se situe à environ 0,7 mSv chez un adulte ayant un poids corporel de 70 kg après administration de 100 MBq. Pour une activité administrée de 100 MBq, l’exposition typique de l’organe cible (reins) aux rayonnements est de 0,34 mGy et l’exposition typique de l’organe critique (paroi de la vessie) aux rayonnements est de 10,8 mGy.
Dose estimée absorbée par unité d'activité administrée: 99mTc-MAG3 en cas de fonction rénale anormale (µGy/MBq)
|
Organe cible
|
adultes
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
1,60
|
2,10
|
3,20
|
4,80
|
8,60
| |
Surface osseuse
|
2,20
|
2,70
|
3,80
|
5,00
|
9,10
| |
Cerveau
|
0,61
|
0,77
|
1,30
|
2,00
|
3,60
| |
Seins
|
0,54
|
0,70
|
1,10
|
1,70
|
3,20
| |
Paroi de la vésicule
|
1,60
|
2,20
|
3,80
|
4,60
|
6,40
| |
Tube digestif
|
|
|
|
|
| |
Paroi de l’estomac
|
1,20
|
1,50
|
2,60
|
3,50
|
6,10
| |
Paroi de l’Intestin grêle
|
2,70
|
3,50
|
5,00
|
6,00
|
10,00
| |
Paroi du côlon
|
3,50
|
4,40
|
6,10
|
6,90
|
11,00
| |
Paroi du côlon supérieur
|
2,20
|
3,00
|
4,30
|
5,60
|
9,30
| |
Paroi du côlon inférieur
|
5,10
|
6,30
|
8,50
|
8,60
|
14,00
| |
Paroi du cœur
|
0,91
|
1,20
|
1,80
|
2,70
|
4,80
| |
Reins
|
14,00
|
17,00
|
24,00
|
34,00
|
59,00
| |
Foie
|
1,40
|
1,80
|
2,70
|
3,80
|
6,60
| |
Poumons
|
0,79
|
1,10
|
1,60
|
2,40
|
4,50
| |
Muscles
|
1,70
|
2,10
|
2,90
|
3,60
|
6,40
| |
Œsophage
|
0,74
|
0,97
|
1,50
|
2,30
|
4,10
| |
Ovaires
|
4,90
|
6,30
|
8,10
|
8,70
|
14,00
| |
Pancréas
|
1,50
|
1,90
|
2,90
|
4,30
|
7,40
| |
Moelle osseuse
|
1,50
|
1,90
|
2,60
|
3,10
|
5,00
| |
Peau
|
0,78
|
0,96
|
1,50
|
2,00
|
3,80
| |
Rate
|
1,50
|
1,90
|
2,90
|
4,30
|
7,40
| |
Testicules
|
3,40
|
4,70
|
7,10
|
7,80
|
14,00
| |
Thymus
|
0,74
|
0,97
|
1,50
|
2,30
|
4,10
| |
Thyroïde
|
0,73
|
0,95
|
1,50
|
2,40
|
4,40
| |
Paroi de la vessie
|
83,00
|
110,00
|
130,00
|
130,00
|
230,00
| |
Utérus
|
10,00
|
12,00
|
16,00
|
16,00
|
27,00
| |
Autres organes
|
1,70
|
2,10
|
2,80
|
3,40
|
6,00
| |
Dose efficace (µSv/MBq)
|
6,10
|
7,80
|
10,00
|
11,00
|
19,00
|
La dose efficace se situe à environ 0,61 mSv chez un adulte ayant un poids corporel de 70 kg après administration de l’activité maximale recommandée de 100 MBq. Pour une activité administrée de 100 MBq, l’exposition typique de l’organe cible (reins) aux rayonnements est de 1,4 mGy et l’exposition typique de l’organe critique (paroi de la vessie) aux rayonnements est de 8,3 mGy.
Dose estimée absorbée par unité d'activité administrée: 99mTc-MAG3 MAG3 en cas de blocage rénal aigu unilatéral (µGy/MBq)
|
Organe cible
|
adultes
|
15 ans
|
10 ans
|
5 ans
|
1 an
| |
Surrénales
|
11,00
|
14,00
|
22,00
|
32,00
|
55,00
| |
Surface osseuse
|
3,10
|
4,00
|
5,80
|
8,40
|
17,00
| |
Cerveau
|
0,11
|
0,14
|
0,23
|
0,39
|
0,75
| |
Seins
|
0,38
|
0,51
|
1,00
|
1,60
|
3,00
| |
Paroi de la vésicule
|
6,20
|
7,30
|
10,00
|
16,00
|
23,00
| |
Tube digestif
|
|
|
|
|
| |
Paroi de l’estomac
|
3,90
|
4,40
|
7,00
|
9,30
|
12,00
| |
Paroi de l’intestin grêle
|
4,30
|
5,50
|
8,50
|
12,00
|
19,00
| |
Paroi du côlon
|
3,90
|
5,00
|
7,20
|
9,20
|
1,50
| |
Paroi du côlon supérieur
|
4,00
|
5,10
|
7,60
|
10,00
|
16,00
| |
Paroi du côlon inférieur
|
3,80
|
4,80
|
6,70
|
8,20
|
13,00
| |
Paroi du cœur
|
1,30
|
1,60
|
2,70
|
4,00
|
6,10
| |
Reins
|
200,00
|
240,00
|
330,00
|
470,00
|
810,00
| |
Foie
|
4,40
|
5,40
|
8,10
|
11,00
|
17,00
| |
Poumons
|
1,10
|
1,60
|
2,50
|
3,90
|
7,20
| |
Muscles
|
2,20
|
2,70
|
3,70
|
5,10
|
8,90
| |
Œsophage
|
0,38
|
0,54
|
0,85
|
1,50
|
2,30
| |
Ovaires
|
3,80
|
5,10
|
7,10
|
9,20
|
15,00
| |
Pancréas
|
7,40
|
9,00
|
13,00
|
18,00
|
29,00
| |
Moelle osseuse
|
3,00
|
3,60
|
5,00
|
6,00
|
8,30
| |
Peau
|
0,82
|
1,00
|
1,50
|
2,20
|
4,20
| |
Rate
|
9,80
|
12,00
|
18,00
|
26,00
|
40,00
| |
Testicules
|
2,00
|
2,90
|
4,50
|
5,00
|
9,80
| |
Thymus
|
0,38
|
0,54
|
0,85
|
1,50
|
2,30
| |
Thyroïde
|
0,17
|
0,23
|
0,45
|
0,92
|
1,60
| |
Paroi de la vessie
|
56,00
|
71,00
|
91,00
|
93,00
|
170,00
| |
Utérus
|
7,20
|
8,70
|
12,00
|
13,00
|
22,00
| |
Autres organes
|
2,10
|
2,60
|
3,60
|
4,70
|
8,00
| |
Dose efficace (µSv/MBq)
|
10,00
|
12,00
|
17,00
|
22,00
|
38,00
|
La dose efficace se situe à environ 1,0 mSv chez un adulte ayant un poids corporel de 70 kg après administration de l’activité maximale recommandée de 100 MBq. Pour une activité administrée de 100 MBq, l’exposition typique de l’organe cible (reins) aux rayonnements est de 20 mGy et l’exposition typique de l’organe critique (paroi de la vessie) aux rayonnements est de 5,6 mGy.
Contre-indicationsHypersensibilité au bétiatide non marqué, au tiatide marqué au 99mTc ou à un excipient selon la composition.
Mises en garde et précautionsRéactions d’hypersensibilité ou anaphylactiques possibles
Si des réactions d’hypersensibilité ou anaphylactiques surviennent, l’utilisation du médicament doit être immédiatement arrêtée et un traitement par voie intraveineuse doit être instauré si nécessaire. Afin de pouvoir réagir rapidement en cas d’urgence, les médicaments et les instruments d’urgence appropriés (p. ex. sonde d’intubation endotrachéale, respirateur) doivent être prêts.
Évaluation individuelle des bénéfices et des risques
Pour chaque patient, l’exposition aux rayonnements doit être justifiée par le bénéfice potentiel. Dans tous les cas, l’activité administrée doit être aussi faible que possible pour obtenir l’information diagnostique souhaitée.
Insuffisance rénale
Chez ces patients, une évaluation minutieuse du rapport bénéfice-risque est nécessaire car une exposition accrue aux rayonnements est possible.
Enfants et adolescents
Pour les informations concernant l’utilisation chez l’enfant et l’adolescent, voir rubrique «Posologie/Mode d’emploi».
L’indication doit être particulièrement stricte car la dose efficace par MBq est plus élevée que chez l’adulte (voir rubrique «Exposition aux rayonnements»).
Préparation du patient
Le patient doit être bien hydraté avant le début de l’examen et être invité à vider sa vessie le plus souvent possible pendant les premières heures suivant l’examen afin de réduire l’exposition aux rayonnements.
Après l’examen
Le contact étroit avec les jeunes enfants et les femmes enceintes ne doit pas être limité après l’injection.
Mises en garde particulières
Excrétion via la vésicule biliaire
De petites quantités d’impuretés marquées au 99mTc peuvent être présentes et/ou produites lors du marquage. Certaines de ces impuretés étant distribuées dans le foie et éliminées par la vésicule biliaire, elles peuvent affecter la phase tardive (après 30 minutes) d’un examen rénal dynamique, car les reins et le foie se superposent dans cette zone étudiée.
Teneur en sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par flacon, c’est-à-dire qu’il est essentiellement «sans sodium».
Risque environnemental
Voir la rubrique «Remarques concernant la manipulation» pour les mesures de précaution relatives aux risques pour l’environnement.
InteractionsAucune interaction n’est connue en cas d’administration du technétium (99mTc) mertiatide avec des médicaments habituellement prescrits aux patients passant ces examens (p. ex. les antihypertenseurs ou les médicaments utilisés pour traiter/prévenir le rejet de greffes). Cependant, un diurétique ou un IEC peut parfois être administré une seule fois pour le diagnostic différentiel de troubles néphrologiques et urologiques.
Tous les médicaments qui influent sur le flux sanguin rénal (p. ex. l’acide acétylsalicylique) ou sur l’excrétion tubulaire rénale (p. ex. les produits de contraste administrés, le probénécide, l’hydrochlorothiazide, les AINS tels que le diclofénac, les sulfamides) peuvent affecter l’excrétion tubulaire rénale et ainsi affecter la clairance du technétium (99mTc) mertiatide.
Les antagonistes calciques peuvent être à l’origine de rénogrammes au captopril faussement positifs. Ces médicaments doivent être arrêtés avant la scintigraphie rénale au captopril et les médecins doivent être conscients de cette interaction médicamenteuse possible si une détérioration bilatérale symétrique de la fonction rénale est établie dans le rénogramme au captopril d’un(e) patient(e).
Grossesse, AllaitementFemmes en âge de procréer
Si l’utilisation d’un produit radiopharmaceutique est envisagée chez une femme en âge de procréer, il est impératif de déterminer si une grossesse est en cours. Tant que le contraire n’a pas été démontré, une grossesse doit être présumée en l’absence de règles. En cas de doute (absence de règles, règles très irrégulières, etc.), il convient de proposer à la patiente d’autres méthodes d’examen ne recourant pas aux rayonnements ionisants (si de telles méthodes sont disponibles).
Grossesse
Les examens au moyen de radionucléides chez la femme enceinte entraînent également une irradiation du fœtus. Par conséquent, seuls les examens essentiels dont le bénéfice attendu est largement supérieur au risque encouru par la mère et le fœtus doivent être réalisés pendant la grossesse.
Allaitement
Le pertechnétate (99mTc) de sodium est excrété dans le lait maternel. Avant l’administration d’un radiopharmaceutique pendant l’allaitement, un report du traitement par radionucléide après la fin de l’allaitement doit être envisagé, car la radioactivité est excrétée dans le lait maternel. Si un traitement est nécessaire, l’allaitement doit être interrompu pendant 4 heures et le lait tiré doit être éliminé. Le contact étroit avec les nourrissons ne doit pas être limité pendant cette période.
Effet sur l'aptitude à la conduite et l’utilisation de machinesTechneScan MAG3 n’a aucune influence ou a une influence négligeable sur l’aptitude à la conduite ou l’utilisation de machines.
Effets indésirablesLes rayonnements ionisants peuvent provoquer des cancers et des modifications du patrimoine génétique. La dose de radiation effective lors de l’administration de l’activité maximale recommandée de 100 MBq se situant à 0,7 mSv, ces effets sont peu probables.
Des informations sur les effets indésirables provenant de notifications spontanées sont disponibles.
Liste des effets indésirables sous forme de tableau
Le tableau suivant présente les effets indésirables classés par classe de systèmes d’organes selon la terminologie MedDRA.
Les fréquences sont définies comme suit:
Très fréquent (≥ 1/10); fréquent (≥ 1/100 à < 1/10); occasionnel (≥ 1/1000 à < 1/100); rare (≥ 1/10 000 à < 1/1000); très rare (< 1/10 000); fréquence inconnue (la fréquence ne peut être estimée sur la base des données disponibles).
Effets indésirables classés par classe de systèmes d’organes
|
Classe de systèmes d’organes (SOC)
|
Effets indésirables
|
Fréquence
| |
Affections du système immunitaire
|
Réactions d’hypersensibilité incluant anaphylaxie (p. ex. urticaire, gonflement des paupières, toux, nausées, vomissements)
|
Fréquence inconnue
| |
Affections du système nerveux
|
Réaction vasovagale (p. ex. convulsions, dyspnée, bouffées vasomotrices, céphalées, œdème du visage, douleur, sensation anormale, sensation vertigineuse, hypotension, tachycardie)
|
Fréquence inconnue
| |
Troubles généraux et anomalies au site d’administration
|
Réactions au site d’injection (p. ex. éruption cutanée, douleur, gonflement)
|
Fréquence inconnue
|
L’annonce d’effets secondaires présumés après l’autorisation est d’une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d’effet secondaire nouveau ou grave via le portail d’annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageEn cas d’utilisation conforme, aucun surdosage n’est à craindre. En cas de surdosage accidentel, l’excès d’irradiation associé diminue rapidement en raison de la courte demi-vie du 99mTc (6,02 h), et son élimination devrait pouvoir être accélérée grâce à une diurèse forcée.
Propriétés/EffetsClasse pharmacothérapeutique: radiopharmaceutiques à usage diagnostique pour le système rénal, composés du technétium (99mTc).
Code ATC
V09CA03
Mécanisme d’action
Caractéristiques physiques
Le 99mtechnétium fixé au tiatide se désintègre par transformation isomérique avec une demi-vie de 6,02 heures en 99technétium quasi stable. Le rayonnement gamma nécessaire au diagnostic scintigraphique possède une énergie de 140,5 keV (89%).
Pharmacodynamique
Aux quantités recommandées pour la scintigraphie, on ne peut s'attendre à aucun effet pharmacodynamique particulier du (99mTc) technétium mertiatide.
Efficacité clinique
Aucune information.
PharmacocinétiqueAbsorption
Aucune donnée disponible.
Distribution
La liaison du technétium (99mTc) mertiatide aux protéines plasmatiques est relativement élevée. Cependant, cette liaison est réversible et le technétium (99mTc) mertiatide est rapidement éliminé par les reins.
Métabolisme
Aucune donnée disponible.
Élimination
Après injection intraveineuse, le technétium (99mTc) mertiatide est rapidement éliminé du sang par les reins. L’excrétion se fait principalement par sécrétion tubulaire. La filtration glomérulaire représente 11% de la clairance totale. En cas de fonction rénale normale, 70% de la dose administrée sont éliminés après 30 minutes et plus de 95% après 3 heures. Ces derniers pourcentages dépendent de la pathologie rénale et du système urogénital.
Cinétique pour certains groupes de patients
Troubles de la fonction rénale
En insuffisance rénale compensée, la demi-vie d’élimination du (99mTc) technétium mertiatide augmente jusqu’à plusieurs heures et en insuffisance rénale terminale, elle augmente à quelques jours.
L‘élimination hépatobiliaire qui est minime pour une fonction rénale normale, peut atteindre 4 % en cas d’insuffisance rénale sévère.
Données précliniquesLors d’études de toxicité aiguë chez la souris (jusqu’à 1000 fois la dose humaine recommandée) et le lapin (jusqu’à 100 fois la dose humaine recommandée), ainsi que dans les études de toxicité subaiguë chez le rat et le lapin (chez tous deux, jusqu’à 30 fois la dose humaine maximale recommandée pendant 14 jours) aucune modification toxicologique notable n’a été constatée.
Les études concernant les effets oncogènes, carcinogènes ou toxiques du 99mTc-tiatide sur la reproduction ne sont pas disponibles à ce jour. Chez l’homme, aux posologies recommandées, aucun effet toxique n’est à craindre.
Remarques particulièresIncompatibilités
Ce médicament ne doit pas être mélangé à d’autres médicaments, hormis ceux mentionnés à la rubrique «Remarques concernant la manipulation».
Influence sur les méthodes de diagnostic
Non pertinent.
Stabilité
Stabilité du TechneScan MAG3 non marqué
TechneScan MAG3 se périme 12 mois après la date de fabrication.
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l’emballage.
Stabilité du produit marqué
Après radiomarquage: 8 heures. Après radiomarquage, ne pas conserver au-dessus de 25 °C.
Remarques particulières concernant le stockage
Stockage du TechneScan MAG3 non marqué
Le TechneScan MAG3 non marqué doit être conservé dans le réfrigérateur entre +2 et +8 ºC.
Stockage du produit marqué
La préparation marquée doit être conservée à une température au-dessous de 25 °C, dans un conteneur de plomb d’épaisseur appropriée.
Remarques concernant la manipulation
Marquage
Le contenu du flacon doit être marqué avec une solution de pertechnétate (99mTc) de sodium. Après le marquage, on obtient le produit diagnostique technétium (99mTc) mertiatide par chauffage.
Le marquage doit être effectué par du personnel qualifié, dans des conditions aseptiques strictes, sans air et en tenant compte des mesures de radioprotection (travail en conteneur ou derrière un écran de plomb). Si l’intégrité du flacon est altérée, le produit ne doit pas être utilisé.
Consignes de marquage
1.Oter le couvercle de fermeture flip-off du flacon TechneScan MAG3, désinfecter le bouchon en caoutchouc avec de l'alcool et mettre le flacon dans un conteneur en plomb.
2.Diluer max. 3 ml de pertechnétate [99mTc] de sodium ayant une activité max. de 3000 MBq (80 mCi) avec une solution injectable de chlorure de sodium à 0,9 % pour atteindre un volume de 10 ml.
3.Introduire dans le flacon TechneScan MAG3 les 10 ml de solution de pertechnétate [99mTc] de sodium au moyen d'une seringue à injection stérile et protégée des radiations, sans bulle d'air et sans utiliser de seringue d'évacuation d'air. Ensuite, au moyen de la même seringue, prélever un volume équivalent d’azote afin de supprimer la surpression dans le flacon. Utiliser pour cela une aiguille fine (G20 ou plus), afin que le trou d’injection se referme de manière étanche et que l’eau ne puisse pas pénétrer dans le flacon pendant le processus d’ébullition et de refroidissement ultérieur.
4.Placer immédiatement le flacon au sein d’un bloc chauffant ou d’un bain-marie d’eau bouillante pendant 10 minutes. Veiller à ce que le flacon reste en position verticale, afin d’éviter que des traces de métal provenant du capuchon de caoutchouc n’altèrent le processus de marquage.
5.Ensuite, refroidir le flacon dans l’eau froide à température ambiante. Le marquage est terminé. La solution est alors prête pour l’injection i.v. après le contrôle de qualité.
6.Mesurer la radioactivité de la préparation marquée dans un activimètre adéquat. Remplir l'étiquette de précaution/protocole en indiquant l'activité totale, le volume, la concentration, l’heure et la date de mesure, puis fixer l’étiquette sur le flacon.
Remarques:
La préparation de technétium (99mTc) mertiatide peut être utilisée jusqu’à 8 heures après la fin du chauffage. Dans ce laps de temps, le produit peut être conservé à une température au-dessous de 25 ºC - en tenant compte des mesures de radioprotection.
Avant administration, il faut déterminer la pureté radiochimique.
Remarques concernant le marquage
Pour le marquage, il convient de n'utiliser que des éluats de 99mTc-pertechnétate produits avec des générateurs enregistrés et autorisés en Suisse. Les caractéristiques des éluats doivent correspondre aux exigences de la Ph. Eur., les éluats doivent en particulier ne pas contenir d'oxydants et doivent contenir moins de 5 ppm d'aluminium. Afin de maintenir le taux d’impuretés radiochimiques aussi faible que possible dans la préparation, et d’assurer un rendement de marquage optimal de TechneScan MAG3, il est recommandé d’utiliser des éluats dont la concentration radioactive est aussi élevée que possible. Un générateur au technétium doit être élué conformément à la technique d’élution fractionnée, avec un volume de 5 ml. Seuls les éluats obtenus à partir d'un générateur de (99mTc) et ayant été élués au cours des dernières 24 heures doivent être utilisés. En outre, il convient de se servir uniquement d'éluats obtenus à partir d'un générateur de (99mTc) ayant été utilisé pendant moins d'une semaine.
En cas d'activité trop importante, la solution de (99mTc) technétium mertiatide peut être diluée au moyen d'une solution injectable de chlorure de sodium à 0,9 %. La solution injectable de chlorure de sodium à 0,9% choisie doit être stérile et exempte d’endotoxines, elle ne doit contenir ni bactériostatiques ni agents de conservations et elle devrait provenir d'un conteneur en verre (une ampoule) et non de conteneurs en plastique.
Contrôle de qualité
Procédé simplifié de chromatographie sur couche mince
Système chromatographique 1
Bandes de test: ITLC-SG (2 - 2,5 cm x 10 cm)
Éluant: acétate d’éthyle/méthyléthylcétone (MEK) 60:40 % v/v
Système chromatographique 2
Bandes de test: ITLC-SG (2 - 2,5 cm x 10 cm)
Éluant: éthanol/eau 90:10 % v/v
Exécution
1.Marquer deux bandes ITLC-SG à l’aide d’un trait de crayon à 1,5 cm (= départ) et 8,5 cm (= ligne de front) du bord inférieur.
2.Sécher les bandes pendant 1 heure à 100 °C et les conserver dans un dessiccateur contenant du gel de silice. Les bandes doivent être retirées du dessiccateur au maximum 30 minutes avant utilisation.
3.Pour chaque système chromatographique, verser l’éluant dans la chambre de chromatographie et fermer la chambre afin que la vapeur de solvant puisse se répartir uniformément (10 à 15 minutes).
4.Déposer l’échantillon sur la ligne de départ des bandes et placer les bandes dans les chambres de chromatographie.
5.Une fois que l’éluant atteint la ligne de front (5 à 15 min), les bandes sont retirées de la chambre et séchées à température ambiante.
Analyse
Les bandes sont évaluées à l’aide d’un scanner TLC. S’il n’y a pas de scanner, les bandes sont découpées à 6 cm du bord inférieur et la radioactivité des deux parties est mesurée séparément.
Calcul
Pureté radiochimique = 100% - ( [%] + [%])
avec

Exigence de pureté radiochimique:
|
directement après le marquage:
|
≥ 95% de tiatide 99mTc
| |
8 heures après le marquage:
|
≥ 94% de tiatide 99mTc
|
Détermination de la pureté radiochimique
La Pharmacopée européenne reconnaît 2 méthodes de contrôle (chromatographie sur papier et HPLC) permettant d’évaluer la pureté radiochimique (monographie de la solution à injecter de mertiatide marqué au technétium (99mTc) (Ph. Eur. 01/2008: 1372, corrigé 7.00). Un contrôle de la pureté radiochimique de la solution à injecter de mertiatide marqué au technétium (99mTc) en conformité avec les méthodes de contrôle de la monographie de la pharmacopée européenne (cf. ci-dessus) doit avoir lieu avant l’administration au patient.
1.La méthode de HPLC est décrite ci-dessous:
Matériel:
Colonne: 25 cm Chromopack Lichrosorb 10RP18
Phase mobile A: Solution de phosphate pH 6 : éthanol = 93 : 7
Solution de phosphate: 1,36 g de KH2PO4 ajusté avec NaOH 0,1 M à un pH de 6
Phase mobile B: Eau : méthanol = 1 : 9
Utilisez un gradient d’élution avec les paramètres suivants:
|
Temps (min):
|
Débit (ml/min):
|
% A
|
% B
| |
10
|
1
|
100
|
0
| |
15
|
1
|
0
|
100
|
Détection: détecteur radiochimique
Méthode:
1.Équilibrer la colonne à chromatographie avec la phase mobile A.
2.Injecter 20 µL du produit marqué.
3.Avec une vitesse de flux de 1,0 ml/min. (coups totaux max. par canal 30'000) le pic de tiatide apparaît à la fin de la phase mobile A.
Exigences en matière de pureté radiochimique
|
|
T = 0
|
Après 8 heures
| |
Technétium (99mTc) mertiatide
|
≥ 95,0%≥ 95% de tiatide 99mTc
|
≥ 94,0%
| |
Fraction totale
|
≤ 3,0%≥ 94% de tiatide 99mTc
|
≤ 3,0%
| |
Fraction méthanolique
|
≤ 4,0%
|
≤ 4,0%
|
2.Procédure Sep-Pak rapide simplifiée
Cette méthode peut être utilisée comme alternative aux méthodes mentionnées ci-dessus. Elle sert à vérifier le procédé de marquage exécuté par l'utilisateur à l'hôpital.
La méthode est basée sur des cartouches dont l'utilisation pour la préparation d'échantillons de solutions aqueuses pour la chromatographie est très répandue.
Matériel:
-Seringues de 1 ml et 10 ml
-Cartouche Waters Sep-Pak C18 Plus Short, 360 mg de sorbant par cartouche; numéro d'article WAT020515
-Éthanol absolu
-Acide chlorhydrique 0,001 N
-Éthanol/solution saline (solution d'éthanol et de chlorure de sodium 9 g/l (rapport 1:1))
Procédure à suivre:
Rincer la cartouche (p. ex. Sep-Pak C18 Plus Short) avec 10 ml d'éthanol absolu, puis avec 10 ml d'acide chlorhydrique (HCl) 0,001 N. Éliminer les résidus de solution avec 5 ml d'air.
Appliquer la solution de tiatide marqué au technétium (99mTc) mertiatide (0,1 ml) sur la cartouche.
Il est important que la colonne ne se dessèche pas pendant les différentes étapes. Éluer en ajoutant goutte à goutte 10 ml d'HCl 0,001 N et recueillir l'éluat. Ce premier éluat contient toutes les impuretés hydrophiles.
Ensuite, éluer en ajoutant goutte à goutte 10 ml de solution saline d'éthanol. Ce deuxième éluat contient le tiatide marqué au technétium (99mTc). La cartouche contient toutes les impuretés non éluables. Utiliser la somme de la radioactivité éluée et celle de la cartouche en tant que 100%.
Détermination de la pureté radiochimique / Impuretés:
Définir la radioactivité éluée combinée plus la cartouche à 100%.

Exigences en matière de pureté radiochimique:
|
directement après le marquage:
|
T = 0 ≥ 94,0% de tiatide 99mTc
|
Après 8 heures
| |
Technétium (99mTc) mertiatide
(2e éluat)
|
³ 94,0%
|
³ 94,0%
| |
Impuretés hydrophiles
(1er éluat)
|
£ 3,0%≤ 3%
|
£ 3,0%
| |
Impuretés non éluables (cartouche)
|
£ 4,0%≤ 4%
|
£ 4,0%
|
Mises en garde générales
Les produits radiopharmaceutiques doivent être préparés par l’utilisateur de manière à respecter les exigences en matière de radioprotection et de qualité pharmaceutique. Des précautions d’asepsie appropriées doivent être prises.
Le contenu du flacon est exclusivement destiné à la préparation du technétium (99mTc) mertiatide et ne doit pas être utilisé directement chez le/la patient(e), c’est-à-dire sans la procédure de préparation prescrite.
Le contenu de la trousse n’est pas radioactif avant la reconstitution. Après l’ajout du pertechnétate (99mTc) de sodium, la substance préparée doit être protégée par un blindage adéquat.
Dispositions légales
Elimination des déchets
La radioactivité excrétée par les patients nécessite des mesures de précautions adéquates, afin d'éviter toute contamination.
Les étiquettes d’identification doivent être enlevées avant élimination des déchets. L'élimination doit avoir lieu conformément aux prescriptions nationales en vigueur. Les flacons périmés (non entamés) de TechneScan MAG3 au contenu lyophilisé ne sont pas radioactifs et peuvent être jetés avec les déchets de laboratoire normaux.
Pour les prescriptions et recommandations concernant la conservation, l'utilisation et l'élimination du générateur ayant servi de source de production de la solution à injecter de [99mTc]-pertechnétate de sodium en vue du marquage de TechneScan MAG3, veuillez vous référer aux informations spécialisées accompagnant le générateur.
Mise en garde de radioprotection
L'utilisation de substances radioactives chez l'être humain est réglementée en Suisse par l'Ordonnance fédérale sur la protection des radiations. De même, l'utilisation de produits radiopharmaceutiques n'est autorisée que par des personnes disposant d'une autorisation délivrée par l'Office fédéral de la santé.
La manipulation de substances radioactives et l'élimination de déchets radioactifs doivent respecter les dispositions de protection de cette ordonnance. Toute irradiation inutile des patients et du personnel doit être évitée.
Numéro d’autorisation49796 (Swissmedic)
PrésentationUne boîte en carton contient 5 flacons de TechneScan MAG3.
Les flacons de verre (Type I, Ph. Eur.) sont fermés par un bouchon de caoutchouc en bromure de butyle et protégés par un couvercle de fermeture flip-off. (A)
Titulaire de l'autorisationb.e.imaging AG, Schwyz
Mise à jour de l'informationAoût 2024
|



