CompositionPrincipes actifs
Étonogestrel, éthinylestradiol.
Excipients
Copolymère éthylène-acétate de vinyle, stéarate de magnésium.
Indications/Possibilités d’emploiContraception hormonale à usage vaginal.
La décision de prescrire NuvaRing doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thromboembolie veineuse (TEV), ainsi que du risque de TEV associé à NuvaRing en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques «Contre-indications» et «Mises en garde et précautions»).
Posologie/Mode d’emploiLes CHC tels que NuvaRing ne devraient être prescrits que par des médecins ayant l'expérience de ces traitements et qui sont en mesure, d'une part, de fournir aux patientes toutes les explications requises sur les avantages et inconvénients de toutes les méthodes contraceptives disponibles et, d'autre part, de procéder à un examen général et gynécologique.
La prescription d'un CHC doit en principe se faire conformément aux dernières recommandations de la Société Suisse de Gynécologie et d'Obstétrique (SSGO).
Utilisation de NuvaRing
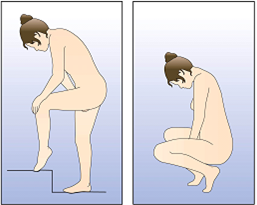
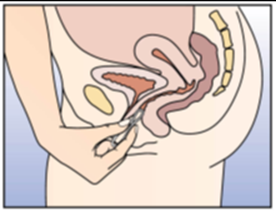
NuvaRing peut être placé dans le vagin par la femme elle-même. Le médecin doit expliquer à la femme les modalités d'insertion et de retrait de l'anneau vaginal. Pour l'insertion, la femme doit choisir la position qui lui semble la plus confortable, p.ex. debout avec une jambe surélevée, en position accroupie ou en position couchée. Il convient de comprimer NuvaRing entre les doigts et de l'enfoncer dans le vagin jusqu'à ce que son port soit confortable. La position exacte de NuvaRing dans le vagin n'affecte pas l'effet contraceptif (voir Figures 1-4).
Une fois que NuvaRing a été mis en place, il reste dans le vagin pendant les trois semaines suivantes. La femme peut à tout moment vérifier si NuvaRing se trouve effectivement dans le vagin. Il est conseillé de vérifier régulièrement que l'anneau vaginal est bien en place, par exemple après avoir fait du sport ou de la natation et éventuellement avant et après un rapport sexuel.
Si NuvaRing est expulsé accidentellement (par exemple lors du retrait d'un tampon), voir les instructions au chapitre «Anneau vaginal temporairement hors du vagin (expulsion de l'anneau vaginal)».
Trois semaines plus tard, il faut retirer NuvaRing le même jour de la semaine puis rester une semaine sans anneau vaginal, avant de mettre en place un nouvel anneau vaginal (si par exemple NuvaRing a été inséré un mercredi à 22 heures, il faut retirer l'anneau vaginal trois semaines plus tard, le mercredi vers 22 heures. Un nouvel anneau vaginal sera mis en place le mercredi suivant).
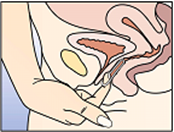
Pour retirer NuvaRing du vagin, il faut soit passer l'index sous le bord antérieur de l'anneau vaginal, soit maintenir le bord entre l'index et le majeur, avant de tirer (voir Figure 5). Il faut remettre l'anneau vaginal usagé dans le sachet refermable et le jeter (ne pas le jeter dans les toilettes). Il faut le tenir hors de la vue et de la portée des enfants et des animaux domestiques.
Pendant la phase de suspension de l'utilisation, il se produit généralement une hémorragie de privation qui débute habituellement 2-3 jours après le retrait de NuvaRing et peut persister alors que l'anneau vaginal suivant est déjà en place.
|
|
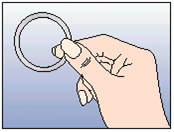
Figure 1:
Extraire NuvaRing du sachet.
|
|
|
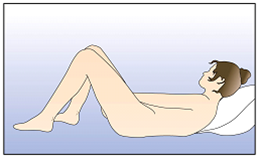
Figure 3:
Choisir une position confortable pour l'insertion de l'anneau vaginal.
| |
|
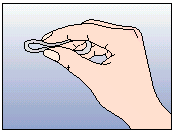
Figure 2:
Comprimer l'anneau vaginal entre les doigts.
| |
|
|
|
|
|
| |
Figure 4A:
D'une main, introduire l'anneau vaginal dans le vagin; au besoin, écarter les lèvres vulvaires de l'autre main.
|
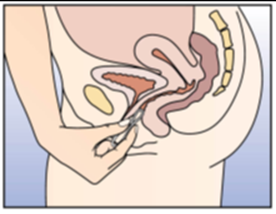
Figure 4B:
Enfoncer l'anneau vaginal profondément dans le vagin, jusqu'à ce que son port soit confortable.
|
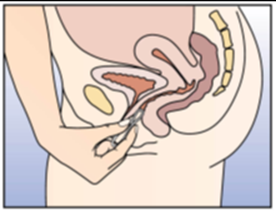
Figure 4C:
L'anneau vaginal reste en place pendant trois semaines.
| |
|
|
Figure 5:
Extraire NuvaRing soit en plaçant l'index en crochet sous le bord antérieur de l'anneau vaginal, soit en tirant en tenant le bord entre l'index et le majeur.
|
Début de l'utilisation
Femmes qui n'ont pas utilisé de contraceptif hormonal pendant le cycle précédent
Il faut insérer NuvaRing le premier jour du cycle naturel (c'est-à-dire le premier jour des règles). NuvaRing peut aussi être inséré les jours 2 à 5 du cycle. Toutefois, dans ce cas, il est recommandé d'utiliser, en plus, une méthode contraceptive de type mécanique (par exemple préservatif masculin) pendant les 7 premiers jours d'utilisation de NuvaRing.
Remplacement d'un contraceptif hormonal combiné (CHC) par NuvaRing
Insérer NuvaRing au plus tard le lendemain de la pause thérapeutique habituelle ou de la prise des comprimés de placebo du CHC précédent ou de la période de suspension de l'utilisation du patch.
Remplacement d'une contraception purement progestative (minipilule, implant, progestatif injectable ou dispositif intra-utérin libérant un progestatif) par NuvaRing
Le remplacement d'une minipilule par NuvaRing peut être effectué à tout moment (ne pas respecter de pause). En cas de remplacement d'un implant ou d'un dispositif intra-utérin (DIU), il faut insérer NuvaRing le jour du retrait de l'implant/du dispositif intra-utérin. En relais d'un progestatif injectable, insérer NuvaRing au moment prévu pour l'injection suivante. Dans tous ces cas, il faut utiliser, en plus, une méthode contraceptive mécanique pendant les 7 premiers jours.
Après un avortement au 1er trimestre de grossesse
La femme peut utiliser l'anneau vaginal immédiatement. Elle n'a pas besoin d'utiliser d'autres méthodes contraceptives. Si l'utilisation immédiate n'est pas souhaitée, l'utilisatrice doit se conformer aux instructions données au paragraphe «Femmes qui n'ont pas utilisé de contraceptif hormonal pendant le cycle précédent». Il faut lui conseiller d'utiliser, entre-temps, une méthode contraceptive de type mécanique.
Après un accouchement ou un avortement au 2ème trimestre de grossesse
La décision quant à la (ré)utilisation d'un CHC tel que NuvaRing après un avortement au 2ème trimestre de grossesse ou un accouchement doit tenir compte du risque accru d'accidents thromboemboliques veineux pendant la période puerpérale (jusqu'à 12 semaines après l'accouchement; cf. «Mises en garde et précautions»).
Dans tous les cas, après un accouchement ou un avortement au 2ème trimestre de grossesse, l'utilisation de NuvaRing doit débuter au plus tôt entre le 21ème et le 28ème jour. Si le traitement débute plus tard, il est recommandé d'appliquer des méthodes contraceptives supplémentaires non hormonales durant les 7 premiers jours de l'utilisation. Si des rapports sexuels ont eu lieu entre-temps, il convient d'exclure l'éventualité d'une grossesse ou d'attendre les premières règles naturelles avant de débuter le traitement.
Pour les mères qui allaitent (voir «Grossesse/Allaitement»).
Non-respect du mode d'emploi recommandé
Si la femme ne respecte pas le mode d'emploi recommandé, l'effet contraceptif et le contrôle du cycle peuvent être compromis. Afin d'éviter la perte de l'effet contraceptif, on peut donner les conseils suivants en cas d'utilisation non conforme aux recommandations:
Allongement de la pause d'utilisation
Dès qu'elle constate l'oubli, la femme doit utiliser un nouvel anneau vaginal. En outre, pendant les 7 jours suivants, il faut utiliser en plus une contraception mécanique. Si des rapports sexuels ont déjà eu lieu pendant la période sans anneau vaginal, il faut envisager l'éventualité d'une grossesse. Le risque de grossesse est d'autant plus grand que la durée écoulée sans anneau vaginal est longue.
Oubli de retrait de NuvaRing après la troisième semaine
Bien que cela ne corresponde pas à la recommandation posologique habituelle, l'effet contraceptif est encore suffisant aussi longtemps que NuvaRing est resté dans le vagin pendant un maximum de 4 semaines. La femme doit respecter l'interruption habituelle d'une semaine puis insérer un nouvel anneau vaginal. Par contre, si NuvaRing a été laissé en place pendant plus de 4 semaines, l'effet contraceptif peut être compromis. C'est pourquoi il faut exclure l'éventualité d'une grossesse avant l'insertion d'un nouveau NuvaRing.
Anneau vaginal temporairement hors du vagin (expulsion de l'anneau vaginal)
NuvaRing doit rester dans le vagin sans interruption pendant trois semaines. Si l'anneau vaginal a été expulsé accidentellement, on peut le rincer à l'eau froide ou tiède (jamais à l'eau chaude!), après quoi il faut le remettre en place immédiatement. Plus précisément:
Anneau vaginal en dehors du vagin pendant moins de 3 heures:
Si l'anneau vaginal est resté moins de 3 heures en dehors du vagin, son efficacité contraceptive n'est pas compromise. L'utilisatrice doit le remettre le plus rapidement possible (au plus tard trois heures après l'expulsion).
Anneau vaginal en dehors du vagin pendant plus de 3 heures ou pour une période d'une durée inconnue:
La conduite à tenir dépend du moment du cycle pendant lequel l'anneau vaginal ne s'est pas trouvé dans le vagin:
Pendant la 1ère ou 2ème semaine d'utilisation:
Si NuvaRing est resté plus de 3 heures en dehors du vagin, son effet contraceptif peut être compromis. Dès que la femme le constate, elle doit remettre l'anneau vaginal en place et utiliser en complément un contraceptif mécanique jusqu'à ce que NuvaRing ait été en place de façon continue pendant 7 jours. Plus NuvaRing est resté longtemps en dehors du vagin et plus la période sans anneau vaginal suivante est proche, plus le risque de grossesse est grand.
Pendant la 3ème semaine d'utilisation:
Si l'anneau vaginal est resté en dehors du vagin pendant plus de 3 heures au cours de la troisième semaine d'utilisation, son effet contraceptif peut être compromis. La femme doit jeter cet anneau vaginal et choisir l'une des deux options suivantes:
1.Insertion immédiate d'un nouvel anneau vaginal.L'insertion d'un nouvel anneau vaginal marque le début de la période suivante de 3 semaines. Il n'y aura probablement pas d'hémorragie de privation. Par contre, des suintements hémorragiques ou des hémorragies en cours de cycle sont possibles.
2.Attendre l'hémorragie de privation et ne pas insérer le nouvel anneau vaginal plus de 7 jours après le retrait ou l'expulsion (7x24 heures). Cette option ne doit être choisie que si l'anneau vaginal a été utilisé de façon continue pendant les 7 jours ayant précédé le retrait ou l'expulsion.
En particulier lorsqu'on ignore pendant combien de temps l'anneau vaginal est resté hors du vagin, il faudra envisager l'éventualité d'une grossesse et effectuer un test de grossesse avant d'insérer un nouvel anneau vaginal.
Rupture de l'anneau vaginal
Dans de rares cas, on a signalé une rupture de l'anneau vaginal pendant l'utilisation, ce qui peut entraîner des lésions vaginales. Il est recommandé de retirer l'anneau vaginal rompu le plus rapidement possible et d'en insérer un nouveau. Pendant les 7 jours suivants, il faut utiliser, en plus, un contraceptif mécanique (par exemple préservatif masculin). Il faut envisager l'éventualité d'une grossesse et consulter le médecin.
Si l'utilisatrice n'a pas respecté le mode d'emploi recommandé et n'a ensuite pas eu d'hémorragie de privation pendant l'intervalle sans anneau vaginal suivant, il faut exclure l'éventualité d'une grossesse avant l'insertion d'un nouveau NuvaRing.
Décalage du cycle menstruel
Pour retarder la date des règles (allongement du cycle)
Si, dans des situations exceptionnelles, les règles doivent être retardées, la femme doit utiliser immédiatement un nouvel anneau vaginal, sans respecter l'intervalle sans anneau vaginal habituel. L'anneau vaginal suivant peut à nouveau être utilisé pendant trois semaines au maximum. Ensuite, poursuivre l'emploi de NuvaRing comme d'habitude, après l'intervalle sans anneau vaginal habituel d'une semaine. Des suintements hémorragiques ou des hémorragies en cours de cycle sont possibles pendant une utilisation prolongée de l'anneau vaginal.
Pour avancer la date des règles
Pour avancer la date des règles à un jour différent du jour de la semaine habituel, on peut raccourcir la phase d'interruption selon les préférences. Plus la phase d'interruption est courte, plus le risque d'absence d'hémorragie de privation et de suintements hémorragiques ou d'hémorragies en cours de cycle pendant l'utilisation de l'anneau vaginal suivant est grand.
Anomalies des hémorragies
Des hémorragies anormales (suintements hémorragiques ou hémorragies en cours de cycle) sont possibles pendant l'utilisation de NuvaRing, en particulier pendant les premiers mois. Si les anomalies de l'hémorragie persistent ou s'il survient des hémorragies anormales après des cycles réguliers, alors que l'anneau vaginal est correctement utilisé, il faut envisager des causes non hormonales. Le médecin doit pratiquer un examen pour exclure l'éventualité d'affections malignes ou d'une grossesse. Cela peut impliquer un curetage.
Chez quelques femmes, l'hémorragie de privation peut ne pas se produire pendant la phase d'interruption. Si NuvaRing a été correctement utilisé, une grossesse est improbable. Par contre, si NuvaRing n'a pas été utilisé correctement avant la première aménorrhée ou s'il y a déjà eu deux épisodes d'aménorrhée, il faut exclure une grossesse avant de poursuivre l'utilisation.
Instructions spéciales de dosage
Patientes souffrant de troubles de la fonction hépatique
NuvaRing ne doit pas être utilisé chez les femmes souffrant d'insuffisance hépatique.
Patientes présentant des troubles de la fonction rénale
NuvaRing n'a pas été étudié chez les femmes souffrant d'insuffisance rénale et aucune recommandation posologique ne peut être formulée.
Patientes âgées
Après la ménopause, il n'y a pas d'indication pour NuvaRing.
Enfants et adolescentes
L'efficacité et la sécurité d'emploi de NuvaRing ont été étudiées chez des femmes âgées de 18 à 40 ans. Si NuvaRing est indiqué pour des adolescentes, on recommande la même posologie que chez l'adulte.
Contre-indications·Présence ou risque de thromboembolie veineuse (TEV)
·Thromboembolie veineuse (patiente traitée par des anticoagulants) ou antécédents de TEV (p.ex. thrombose veineuse profonde ou embolie pulmonaire);
·Facteurs de risque majeurs de thromboembolie veineuse tels que:
·Prédisposition connue, héréditaire ou acquise, telle qu'une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S;
·Présence simultanée de multiples facteurs de risque de thromboembolie veineuse, selon tableau sous la rubrique «Mises en garde et précautions»;
·Présence ou risque de thromboembolie artérielle (TEA)
·Thromboembolie artérielle, antécédents de TEA ou prodromes de TEA (p.ex. angine de poitrine, infarctus du myocarde, accident ischémique transitoire, accident vasculaire cérébral);
·Facteurs de risque majeurs de TEA comme:
·diabète avec complications vasculaires,
·hypertension artérielle sévère,
·dyslipoprotéinémie sévère,
·présence ou antécédents de migraine avec signes neurologiques focaux,
·prédisposition héréditaire ou acquise à la TEA, telle qu'une hyperhomocystéinémie ou la présence d'anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique);
·Présence simultanée de multiples facteurs de risque de TEA, selon tableau sous la rubrique «Mises en garde et précautions»;
·Affection hépatique sévère ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques;
·Utilisation concomitante de l'une des associations de principes actifs ombitasvir/paritaprévir/ritonavir, avec ou sans dasabuvir, glécaprévir/pibrentasvir et sofosbuvir/velpatasvir/voxilaprévir (médicaments pour le traitement de l'hépatite C) (voir «Mises en garde et précautions» et «Interactions»);
·Tumeur hépatique (bénigne ou maligne) ou antécédent de tumeur hépatique;
·Affections malignes ou prémalignes connues ou suspectées des organes génitaux ou des seins, si ces affections sont hormone-dépendantes;
·Saignements vaginaux d'origine inconnue;
·Présence ou antécédents connus de pancréatite associée à une hypertriglycéridémie sévère;
·Hypersensibilité aux principes actifs ou à l'un des excipients de NuvaRing.
Mises en garde et précautionsLe risque de thromboembolie veineuse (TEV) et de thromboembolie artérielle (TEA) est augmenté chez les femmes utilisant un CHC par rapport à celles qui n'en utilisent pas. Les mises en garde et précautions décrites ci-après doivent être prises en considération avant toute prescription (voir «Risque de thromboembolie veineuse [TEV]» et «Risque de thromboembolie artérielle [TEA]»). Il est en outre important d'informer la patiente des risques d'accidents thromboemboliques veineux et artériels, des facteurs de risques vasculaires et en particulier des symptômes de TEV et de TEA ainsi que des mesures à prendre en présence de ces symptômes et de suspicion de thrombose (voir «Symptômes de TEV [thrombose veineuse profonde et embolie pulmonaire]» et «Symptômes de TEA»).
Avant de prescrire un CHC tel que NuvaRing, les bénéfices associés à son utilisation doivent être évalués par rapport aux maladies/risques détaillés ci-dessous. Le degré de gravité de chaque facteur individuel ainsi que la présence concomitante de plusieurs facteurs de risque doivent être pris en compte et discutés avec la patiente (voir également «Contre-indications»). La patiente est en outre invitée à lire attentivement la notice d'emballage et à suivre les conseils qui y figurent.
Avant le début ou le renouvellement de l'utilisation d'un CHC tel que NuvaRing, il est nécessaire de procéder à une anamnèse personnelle et familiale minutieuse ainsi qu'à un examen général et gynécologique approfondi en prenant en compte les contre-indications et les mises en garde et précautions afin de dépister les affections nécessitant un traitement ainsi que les états à risque, et de pouvoir exclure l'éventualité d'une grossesse. Ces examens comprennent généralement une mesure de la tension artérielle, un examen des seins, de l'abdomen et des organes pelviens avec frottis cytologique du col et examens de laboratoire appropriés.
Les examens doivent être répétés à intervalle régulier pendant la durée d'utilisation des CHC. Le type et la fréquence des examens doivent toutefois être déterminés individuellement et se référer aux directives de la Société suisse de gynécologie et d'obstétrique (SSGO). Les contre-indications (p.ex. accident ischémique transitoire) et les facteurs de risque (p.ex. anamnèse familiale de thrombose veineuse ou artérielle; voir «Facteurs de risque de TEV» et «Facteurs de risque de TEA») peuvent apparaître pour la première fois en cours d'utilisation d'un CHC et doivent dès lors être recherchés lors de chaque contrôle.
Motifs imposant l'arrêt immédiat de l'utilisation du médicament
La patiente doit être informée qu'en cas d'apparition de l'une des contre-indications précitées ou de l'une des situations suivantes, elle doit consulter au plus vite un médecin, qui décidera de la poursuite ou de l'arrêt de la prise du CHC:
·épisode inaugural ou aggravation de céphalées de type migraineux ou augmentation de la fréquence de maux de tête d'intensité inhabituelle;
·apparition brutale de troubles de la vision, de l'audition, du langage ou d'autres troubles sensoriels;
·dès les premiers signes d'événements thromboemboliques (voir «Symptômes de TEV [thrombose veineuse profonde et embolie pulmonaire]» et «Symptômes de TEA)»);
·4 semaines au moins avant une intervention chirurgicale programmée et pendant une immobilisation p.ex. à la suite d'un accident ou d'une opération;
·augmentation cliniquement significative de la pression artérielle (confirmée par des mesures répétées);
·survenue d'un ictère, d'une hépatite ou d'un prurit généralisé;
·vives douleurs abdominales dans la région sus-ombilicale ou hépatomégalie;
·états dépressifs graves;
·grossesse.
Risque de thromboembolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes utilisant un CHC par rapport à celles qui n'en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque de TEV le plus faible. Le risque de TEV associé aux autres CHC, tels que NuvaRing, peut être jusqu'à deux fois plus élevé.
La décision d'utiliser le médicament doit être prise uniquement après un entretien approfondi avec la patiente, afin de s'assurer qu'elle comprenne:
·Le risque de TEV associé à NuvaRing;
·Comment ses facteurs de risque personnels influent sur ce risque?
·Le risque plus élevé de développer une TEV pendant la première année d'utilisation (et en particulier pendant les 3 premiers mois);
·Le risque accru de TEV aussi bien lors de la première prise d'un CHC que lors de la reprise du même ou d'un autre CHC après une interruption d'au moins 4 semaines ou plus;
·NuvaRing est un médicament. En cas d'accident ou d'intervention chirurgicale, la patiente doit informer le médecin traitant qu'elle utilise NuvaRing.
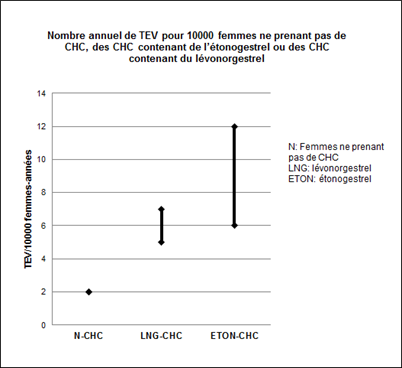
Environ 2 femmes sur 10'000 n'utilisant pas de CHC et qui ne sont pas enceintes développeront une TEV au cours d'une année. Le risque peut toutefois être considérablement plus élevé, selon les facteurs de risque individuels (voir ci-dessous).
A partir des données épidémiologiques, il est possible d'estimer que 6 à 12 femmes sur 10'000 utilisant un CHC contenant de l'étonogestrel développeront une TEV au cours d'une année. En comparaison, ce nombre est estimé à 5 à 7 par année pour 10'000 femmes utilisant un CHC contenant du lévonorgestrel.
Dans les deux cas, le nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2% des cas.
Très rarement, chez des utilisatrices de CHC, des cas de thrombose veineuse ont été signalés en dehors des membres (p.ex. thromboses des veines sinusales ou thromboses des veines hépatiques, mésentériques, rénales ou rétiniennes).
Facteurs de risque de TEV
Le risque de complications thromboemboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d'autres facteurs de risque sont présents, en particulier si ceux-ci sont multiples (voir le tableau ci-dessous). Lors de l'évaluation du rapport bénéfices/risques, il est important de prendre en considération l'augmentation particulière du risque d'accident thromboembolique veineux en présence de plusieurs facteurs de risques concomitants, augmentation qui peut être supérieure à la seule somme des risques pris individuellement. Dans ce cas, le risque global de TEV doit être pris en compte. NuvaRing est contre-indiqué chez les femmes présentant simultanément de multiples facteurs de risque qui les exposent globalement à un risque élevé de thrombose veineuse.
Tableau: Facteurs de risque de TEV
|
Facteur de risque
|
Commentaire
| |
Obésité (indice de masse corporelle supérieur à 30 kg/m²).
|
L'augmentation de l'IMC accroît considérablement le risque.
Il est particulièrement important d'en tenir compte si d'autres facteurs de risque sont présents.
| |
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur.
|
Dans ces situations, il est conseillé de suspendre l'utilisation de l'anneau vaginal (au moins quatre semaines à l'avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit éventuellement être utilisée afin d'éviter une grossesse non désirée.
Un traitement anti-thrombotique préventif devra être envisagé si NuvaRing n'a pas été interrompu à l'avance.
| |
Antécédents familiaux (thromboembolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans).
|
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l'utilisation de NuvaRing.
Si une thrombophilie est détectée, l'utilisation de NuvaRing est contre-indiquée.
| |
Autres affections médicales associées à un risque accru de TEV.
|
Lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique), drépanocytose, cancer.
| |
Âge
|
En particulier au-delà de 35 ans
|
Remarque: l'immobilisation temporaire, y compris les trajets aériens >4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d'autres facteurs de risque.
Il n'existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l'apparition ou la progression d'une thrombose veineuse.
Le risque accru de thromboembolie pendant la période puerpérale doit être pris en compte. Certaines données indiquent en effet que le risque peut être encore augmenté jusqu'à 12 semaines après l'accouchement.
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
La patiente doit être informée qu'en cas d'apparition d'un ou de plusieurs de ces symptômes, elle doit consulter un médecin en urgence et indiquer au personnel médical qu'elle utilise NuvaRing.
·Les symptômes de thrombose veineuse profonde des membres inférieurs peuvent inclure:
·gonflement unilatéral d'une jambe ou le long d'une veine de la jambe;
·douleur ou sensation de tension dans une jambe, pouvant n'être ressentie qu'en position debout ou lors de la marche;
·sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
·Les symptômes de l'embolie pulmonaire peuvent inclure
·essoufflement subit et inexpliqué, respiration rapide ou détresse respiratoire, intolérance à l'effort;
·toux d'apparition soudaine, éventuellement accompagnée d'expectorations sanglantes;
·douleur aiguë et soudaine dans la poitrine pouvant s'amplifier à la respiration profonde;
·obnubilation sévère, vertiges ou sensation d'angoisse;
·tachycardie ou arythmie.
Certains de ces symptômes (p.ex. «essoufflement», «toux») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d'événements plus fréquents ou moins sévères (infections respiratoires, p.ex.).
Risque de thromboembolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l'utilisation de CHC et l'augmentation du risque de thromboembolie artérielle (infarctus du myocarde, accident cérébrovasculaire ou accident ischémique transitoire). Avant de décider de prescrire NuvaRing, la patiente doit être informée de ce risque et, surtout, du fait que des facteurs de risque individuels préexistants sont susceptibles d'aggraver ce risque.
De très rares cas de thromboses dans d'autres vaisseaux sanguins (tels que les artères hépatiques, mésentériques, rénales ou rétiniennes) ont été observés.
Facteurs de risque de TEA
Le risque de complications thromboemboliques artérielles ou d'accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir tableau). Lors de l'évaluation du rapport bénéfices/risques, il est important de prendre en considération l'augmentation particulière du risque d'accident thromboembolique en présence de plusieurs facteurs de risques concomitants, augmentation qui peut être supérieure à la seule somme des risques pris individuellement. Dans ce cas, le risque global de TEA doit être pris en compte. NuvaRing est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle.
Tableau: Facteurs de risque de TEA
|
Facteur de risque
|
Commentaire
| |
Âge
|
En particulier au-delà de 35 ans
| |
Tabagisme
|
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC comme NuvaRing. Une méthode de contraception différente doit être fortement conseillée aux femmes de plus de 35 ans qui continuent de fumer.
| |
Hypertension artérielle
|
| |
Diabète
|
L'utilisation de CHC est contre-indiquée chez les femmes diabétiques qui présentent déjà des complications vasculaires.
| |
Dyslipoprotéinémie
|
| |
Valvulopathie cardiaque
|
| |
Fibrillation auriculaire
|
| |
Obésité (indice de masse corporelle supérieur à 30 kg/m²)
|
L'augmentation de l'IMC accroît considérablement le risque.
Il est particulièrement important d'en tenir compte si d'autres facteurs de risque sont présents.
| |
Antécédents familiaux (thromboembolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans).
|
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l'utilisation de NuvaRing.
Si une thrombophilie est détectée, l'utilisation de NuvaRing est contre-indiquée.
| |
Migraine
|
L'accroissement de la fréquence ou de la sévérité des migraines lors de l'utilisation de NuvaRing (qui peut être le prodrome d'un événement cérébrovasculaire) peut constituer un motif d'arrêt immédiat de NuvaRing.
| |
Autres affections médicales associées à un risque accru de TEA.
|
Hyperhomocystéinémie, lupus érythémateux disséminé, drépanocytose, cancer.
|
Symptômes de TEA
Les femmes doivent être informées qu'en cas d'apparition d'un ou de plusieurs de ces symptômes, elles doivent consulter un médecin en urgence et indiquer au personnel médical qu'elles utilisent NuvaRing.
·Les symptômes d'un accident cérébrovasculaire peuvent inclure
·perte soudaine de sensibilité ou de force au niveau du visage, d'un bras ou d'une jambe, touchant une moitié du corps;
·confusion soudaine;
·élocution incompréhensible ou difficulté de compréhension;
·troubles subits de la vision d'un ou des deux yeux;
·troubles subits de la marche;
·vertiges;
·troubles de l'équilibre ou de la coordination;
·céphalées soudaines et sévères, ou de durée inhabituelle, de cause inconnue;
·perte de connaissance ou évanouissement avec ou sans épisode convulsif.
·Les symptômes de l'infarctus du myocarde peuvent inclure
·douleurs, malaise, sensation de pression, sensation de pesanteur, sensation de serrement ou de tension dans la poitrine, le bras ou derrière le sternum;
·douleurs irradiant dans le dos, la mâchoire, le cou, le bras ou l'estomac;
·sensation de réplétion, troubles gastriques ou effort de vomissement;
·sueurs, nausées, vomissements ou vertiges;
·faiblesse, angoisse ou essoufflement extrêmes;
·tachycardie ou arythmies.
·L'occlusion d'un vaisseau peut engendrer d'autres symptômes
·douleur soudaine, tuméfaction ou cyanose discrète d'une extrémité;
·abdomen aigu.
Suspicion de prédisposition héréditaire ou acquise aux complications thromboemboliques
En cas de suspicion de prédisposition héréditaire ou acquise aux complications thromboemboliques, un examen de la coagulation sanguine doit être effectué par un spécialiste, qui peut le cas échéant demander une analyse de certains paramètres hémostatiques.
Maladies tumorales
Un risque augmenté de cancer du col de l'utérus a été rapporté lors d'une utilisation au long cours de CHC (>5 ans) dans quelques études épidémiologiques. Néanmoins, il fait toujours l'objet de discussions controversées dans la mesure où ce résultat est influencé par d'autres facteurs, comme une infection par des papillomavirus humains (HPV) (facteur de risque le plus puissant), par la fréquence de la participation au screening du col de l'utérus ou par le comportement sexuel.
Une méta-analyse de 54 études épidémiologiques montre que le risque relatif (RR) de diagnostic de cancer du sein est légèrement augmenté chez les femmes qui prennent des CHC (RR=1,24). Après l'arrêt de l'utilisation des CHC, ce risque, initialement augmenté, ne cesse de diminuer et il n'est plus décelable au bout de 10 ans. Etant donné que les cancers du sein sont rares avant l'âge de 40 ans, l'augmentation de la fréquence du diagnostic de cancer du sein chez les femmes qui utilisent un CHC ou en ont utilisé jusqu'à une date récente, est faible par rapport au risque de cancer du sein dans la population générale. Ces études ne prouvent pas de lien de causalité. L'augmentation du risque qui a été observée peut être liée à un dépistage plus précoce du cancer chez les utilisatrices de CHC, à des effets biologiques des CHC ou encore à la conjugaison de ces deux facteurs. D'une manière générale, les cancers du sein diagnostiqués étaient moins évolués, au moment du diagnostic, chez les femmes ayant utilisé un CHC que chez les femmes n'en ayant jamais utilisé.
Pendant l'utilisation de contraceptifs hormonaux, on a observé, rarement, des tumeurs hépatiques bénignes et, plus rarement encore, des tumeurs hépatiques malignes. Exceptionnellement, ces tumeurs ont induit des hémorragies intra-abdominales engageant le pronostic vital. Si une utilisatrice de NuvaRing présente des douleurs vives dans la partie haute de l'abdomen, une hépatomégalie ou des signes d'hémorragie intra-abdominale, il faut envisager l'éventualité d'une tumeur hépatique lors du diagnostic différentiel.
Troubles dépressifs
Les dépressions et humeurs dépressives sont connues comme étant des effets indésirables potentiels lors de l'utilisation d'hormones sexuelles, y compris de contraceptifs hormonaux (voir aussi «Effets indésirables»). De tels troubles peuvent survenir peu de temps après le début du traitement. Une dépression peut être grave et représente un facteur de risque de suicide ou de comportement suicidaire. Les utilisatrices de contraceptifs hormonaux doivent donc être informées des symptômes possibles de troubles dépressifs. Il faut impérativement conseiller à l'utilisatrice de s'adresser immédiatement à un médecin si elle remarque des fluctuations d'humeur ou d'autres symptômes de dépression lorsqu'elle utilise un contraceptif. Les utilisatrices ayant des antécédents de dépression sévère doivent être surveillées attentivement. En cas de réapparition d'états dépressifs graves au cours de l'utilisation de NuvaRing, le traitement doit être interrompu.
Risques localisés
Pendant l'utilisation de NuvaRing, on peut parfois noter une vaginite. Rien n'indique que le traitement d'une vaginite puisse perturber l'effet contraceptif de NuvaRing ou que NuvaRing influe sur l'effet du traitement de la vaginite.
On a rapporté de très rares cas d'incrustation de l'anneau vaginal dans le tissu vaginal, exigeant un retrait de l'anneau vaginal par un médecin. Dans de tels cas, un retrait peut être possible même sans incision du tissu vaginal recouvrant l'anneau vaginal par section de l'anneau vaginal à un endroit. Dans ce cas, on veillera à ce que l'anneau vaginal soit complètement retiré.
Dans de très rares cas, NuvaRing a été accidentellement introduit dans l'urètre et a parfois atteint la vessie. C'est pourquoi un positionnement incorrect doit être envisagé en présence de symptômes d'une cystite.
Si une femme présente l'une des affections suivantes, il est possible qu'elle ne parvienne pas à placer correctement NuvaRing ou qu'elle perde l'anneau vaginal: prolapsus du col utérin, cystocèle et/ou rectocèle, constipation intense ou chronique.
Syndrome du choc toxique (SCT)
Des cas de SCT affectant des utilisatrices de NuvaRing ont été rapportés. Le SCT a été mis en relation avec l'utilisation de tampons et de certains moyens contraceptifs formant barrière. Dans certains cas, les utilisatrices de NuvaRing en cause utilisaient également des tampons. Aucun lien de cause à effet n'a pu être établi entre l'utilisation de NuvaRing et le SCT. Ce diagnostic doit toutefois être évoqué si une patiente présente des symptômes du SCT, et les examens et traitements médicaux nécessaires doivent être pratiqués.
Il faut dire à la patiente que NuvaRing ne protège ni contre les infections par le VIH (sida) ni contre les autres maladies sexuellement transmissibles.
Effets de l'éthinylestradiol et de l'étonogestrel sur le partenaire sexuel masculin
Il n'existe pas d'études concernant l'intensité et l'impact pharmacologique éventuel d'une absorption d'éthinylestradiol et d'étonogestrel par le pénis sur le partenaire masculin.
Autres précautions
Des réactions d'hypersensibilité telles qu'un angio-œdème et des réactions anaphylactiques ont été rapportées pendant l'utilisation de NuvaRing. Des estrogènes exogènes peuvent induire ou aggraver les symptômes de l'angio-œdème chez les femmes atteintes d'un angio-œdème héréditaire et/ou acquis. En cas de soupçon d'une telle réaction, il faudrait arrêter NuvaRing et instaurer un traitement correspondant.
Les femmes utilisant un contraceptif hormonal ne doivent pas être traitées en même temps par des préparations contenant du millepertuis (Hypericum), car celui-ci peut diminuer l'action contraceptive. Des saignements intermenstruels et des cas isolés de grossesse non désirée lors de l'utilisation concomitante de contraceptifs hormonaux oraux et de préparations de millepertuis ont été rapportés (voir aussi «Interactions»).
Chez les femmes atteintes d'hypertriglycéridémie ou ayant des antécédents familiaux d'hypertriglycéridémie, l'utilisation de CHC peut augmenter le risque de pancréatite.
Bien qu'une légère augmentation de la tension artérielle pendant la prise de CHC ait été assez fréquemment rapportée, des valeurs élevées cliniquement significatives sont rares. Si la prise du CHC conduit à une augmentation cliniquement significative de la tension artérielle (confirmée par des mesures répétées), la prise du CHC devra être arrêtée. Dans les cas où l'indication semble justifiée, on pourra envisager la reprise d'un CHC, pour autant que la tension artérielle se soit normalisée (sous traitement).
Bien que l'utilisation de CHC puisse être associée à des effets sur la résistance périphérique à l'insuline et sur la tolérance au glucose, une modification du schéma thérapeutique ne semble pas nécessaire chez les femmes diabétiques utilisant des CHC faiblement dosés (contenant <0,05 mg d'éthinylestradiol). Les femmes diabétiques utilisant NuvaRing doivent cependant être surveillées attentivement, surtout pendant les premiers mois de l'utilisation.
Des troubles aigus ou chroniques de la fonction hépatique peuvent imposer un arrêt du CHC, jusqu'à ce que les valeurs hépatiques se soient normalisées. En cas de récidive d'un ictère et/ou prurit cholestatique apparu pour la première fois pendant une grossesse ou lors d'une prise antérieure d'hormones stéroïdiennes sexuelles, il faut arrêter de prendre le CHC.
Chez des patientes atteintes d'hépatite C qui utilisaient simultanément un CHC contenant de l'éthinylestradiol, on a observé, pendant l'utilisation de l'association de principes actifs employée dans les infections par le VHC ombitasvir/paritaprévir/ritonavir, avec ou sans dasabuvir, une élévation significativement plus fréquente de l'ALAT (y compris des cas d'élévation à des valeurs plus de cinq fois plus élevées, et dans des cas isolés, plus de vingt fois plus élevées que la limite supérieure de la normale) que chez des patientes qui étaient traitées exclusivement avec les principes actifs antiviraux (voir «Interactions»). Des élévations similaires de l'ALAT ont également été observées sous médicaments anti-VHC contenant du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir. L'utilisation de NuvaRing doit donc être suspendue avant le début d'un traitement avec ces associations de principes actifs. À condition que les valeurs hépatiques soient normales, NuvaRing peut à nouveau être utilisé au plus tôt 2 semaines ou, mieux encore, 4 semaines après l'arrêt des associations de principes actifs ombitasvir/paritaprévir/ritonavir, avec ou sans dasabuvir, glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir. Toutefois, lors d'une période de moins de 4 semaines, l'efficacité du CHC peut encore être compromise en raison des propriétés d'induction enzymatique du ritonavir. Une méthode barrière supplémentaire devrait donc être utilisée pendant 28 jours (voir ci-après sous «Interactions, Inducteurs enzymatiques»). Cela vaut en particulier lorsque l'association ombitasvir/paritaprévir/ritonavir est co-administrée avec la ribavirine, un principe actif potentiellement tératogène.
Les affections suivantes peuvent survenir ou être aggravées pendant la grossesse ou l'utilisation d'un CHC, même si les données actuellement disponibles ne permettent pas d'imputer une relation de causalité claire avec l'utilisation d'un CHC: ictère et/ou prurit cholestatique; cholélithiase; porphyrie; lupus érythémateux disséminé; syndrome hémolytique et urémique; chorée mineure; herpes gestationis; surdité due à une otosclérose. La prise de CHC a en outre été associée à des cas de maladie de Crohn et de colite ulcéreuse.
Chez les femmes prédisposées, l'utilisation de CHC peut occasionnellement provoquer un chloasma, qui est encore renforcé par une exposition intense aux rayons solaires. Les femmes présentant une tendance au chloasma ne devraient donc pas s'exposer à des rayonnements UV importants.
InteractionsNote: NuvaRing ne doit pas être utilisé en même temps qu'un diaphragme, une cape cervicale ou un préservatif féminin.
Remarque: les informations professionnelles concernant les médicaments utilisés en association devraient être consultées afin d'exclure d'éventuelles interactions.
Influence d'autres substances sur la pharmacocinétique des contraceptifs hormonaux
• Inducteurs enzymatiques
Des interactions entre contraceptifs hormonaux et médicaments induisant les enzymes microsomales (en particulier les enzymes du cytochrome P450), qui provoquent ainsi une clairance augmentée des hormones sexuelles, peuvent conduire à une diminution de l'effet contraceptif et à des saignements intermenstruels. Cela vaut par exemple pour les barbituriques, le bosentan, la carbamazépine, le felbamate, le modafinil, l'oxcarbazépine, la phénytoïne, la primidone, la rifabutine, la rifampicine et le topiramate ainsi que pour les médicaments contenant du millepertuis (Hypericum perforatum).
Une induction enzymatique peut déjà survenir au bout de quelques jours de traitement. L'induction enzymatique maximale est en général observée après 2 à 3 semaines et peut persister pendant au moins 4 semaines ou plus après l'arrêt.
Les femmes traitées sur une courte période par un des médicaments mentionnés doivent provisoirement utiliser une méthode de contraception non hormonale en complément au NuvaRing ou choisir une autre méthode contraceptive. La méthode barrière doit être poursuivie pendant toute la prise concomitante des médicaments mentionnés et pendant encore 28 jours après l'arrêt de leur prise.
Si l'utilisation concomitante d'un inducteur enzymatique est poursuivie au-delà du cycle de trois semaines de l'anneau vaginal, le prochain anneau vaginal doit être mis en place immédiatement, c'est-à-dire sans respecter la période sans anneau vaginal habituelle.
Dans le cas d'un traitement de longue durée avec des médicaments qui entraînent une induction enzymatique hépatique, il convient d'utiliser d'autres méthodes contraceptives non hormonales fiables.
On sait en outre que différents inhibiteurs de la protéase du VIH/VHC (p.ex. le nelfinavir, le bocéprévir, le télaprévir) et inhibiteurs non nucléosidiques de la transcriptase inverse (p.ex. l'éfavirenz [voir ci-dessous], la névirapine), ainsi que leurs associations, peuvent entraîner une baisse ou une augmentation des concentrations plasmatiques en estrogènes et progestatifs. Ces modifications peuvent être cliniquement significatives dans certains cas. Par exemple, une étude publiée a examiné l'effet d'un traitement contenant de l'éfavirenz sur la pharmacocinétique d'un implant sous-cutané contenant de l'étonogestrel. Chez les patientes séropositives pour le VIH sous traitement antirétroviral, la Cmax de l'étonogestrel était diminuée de 54% et l'AUC de 63% par rapport aux femmes qui ne recevaient pas une telle co-médication.
Les inhibiteurs des protéases en particulier, tels que le ritonavir ou le nelfinavir (y compris leurs associations) sont connus comme étant des inhibiteurs puissants du CYP3A4, mais en cas de co-administration avec des hormones stéroïdiennes, ils peuvent entraîner une induction enzymatique et provoquer une baisse des concentrations plasmatiques en estrogènes et progestatifs.
• Inhibiteurs enzymatiques
Les inhibiteurs puissants et modérés du CYP3A comme les antifongiques azolés (p.ex. itraconazole, voriconazole, posaconazole, fluconazole), les macrolides (clarithromycine, érythromycine), le cobicistat, le diltiazem, le vérapamil et le jus de pamplemousse peuvent augmenter les taux plasmatiques des estrogènes et/ou des progestatifs et entraîner des effets indésirables plus nombreux.
Interférence avec le métabolisme entéro-hépatique
En cas de prise simultanée et sur une courte durée (jusqu'à 10 jours) d'antibiotiques qui n'interagissent pas avec le système enzymatique du CYP3A4, aucune interaction pharmacocinétique n'est à prévoir. Il est cependant nécessaire d'avertir la patiente que dans certains cas, la maladie (p.ex. maladie vénérienne) contre laquelle l'antibiotique est utilisé peut nécessiter en complément l'utilisation d'une méthode de contraception non hormonale.
En cas de co-médication de longue durée avec des antibiotiques (p.ex. en cas d'ostéomyélite ou de borréliose), les données d'interaction actuellement disponibles sont insuffisantes. Pour exclure avec certitude toute grossesse, il est dans de tels cas recommandé d'utiliser en complément une méthode de contraception non hormonale pendant la durée de l'antibiothérapie et pendant les 7 jours qui suivent la fin de ce traitement.
Influence des contraceptifs hormonaux sur la pharmacocinétique d'autres médicaments
Les contraceptifs hormonaux peuvent, par différents mécanismes d'interaction, influer également sur la pharmacocinétique de certains autres médicaments: ils peuvent inhiber les enzymes hépatiques microsomaux ou induire la conjugaison hépatique, en particulier la glucuroconjugaison. Les concentrations plasmatiques ou tissulaires d'autres médicaments peuvent par conséquent être soit augmentées (p.ex. la cyclosporine) soit diminuées (p.ex. la lamotrigine, voir ci-dessous). Par ailleurs, l'effet pharmacologique des groupes médicamenteux suivants peut également être influencé: analgésiques, antidépresseurs, antidiabétiques, antimalariques, certaines benzodiazépines, certains bêtabloquants, corticostéroïdes, anticoagulants oraux et théophylline. Les modifications des taux plasmatiques résultant de ces interactions ne sont pas toujours cliniquement pertinentes.
Lamotrigine
Une étude sur l'interaction avec la lamotrigine, un antiépileptique, et un contraceptif oral combiné (30 µg d'éthinylestradiol/150 µg de lévonorgestrel) a montré une hausse cliniquement significative de la clairance de la lamotrigine et une diminution significative des taux plasmatiques de lamotrigine lorsque ces médicaments sont administrés en même temps. Une telle diminution des concentrations plasmatiques peut s'accompagner d'une réduction du contrôle des crises. On ignore cependant dans quelle mesure ces résultats sont transposables à d'autres contraceptifs combinés contenant un autre composant progestatif et/ou une autre dose d'estrogène ou une autre voie d'administration. Mais on peut partir du principe que ces préparations présentent un profil d'interactions comparable.
Lorsqu'un traitement par NuvaRing est nouvellement instauré chez une patiente prenant de la lamotrigine, une adaptation de la dose de lamotrigine peut donc être nécessaire, et les concentrations de lamotrigine devraient être surveillées étroitement au début du traitement. En l'occurrence, il peut y avoir une hausse significative du taux de lamotrigine (selon les cas jusqu'à un niveau toxique) lors de l'arrêt de l'utilisation du contraceptif hormonal (ainsi que dans certains cas pendant la période de 7 jours de suspension de l'utilisation).
Interactions dont les mécanismes ne sont pas connus
Dans des études cliniques, on a observé lors de l'utilisation concomitante d'un CHC contenant de l'éthinylestradiol et de l'association des principes actifs ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, utilisés pour traiter les infections par le VHC, une élévation significativement plus fréquente de l'ALAT (y compris des cas d'élévation à des valeurs plus de cinq fois, dans des cas isolés, plus de 20 fois plus élevées que la limite supérieure de la normale [LSN]) que chez des patientes qui étaient traitées exclusivement avec les principes actifs antiviraux. Des élévations similaires de l'ALAT ont également été observées sous médicaments anti-VHC contenant du glécaprévir/pibrentasvir ou du sofosbuvir/velpatasvir/voxilaprévir. L'utilisation de NuvaRing doit donc être suspendue avant le début d'un traitement avec une telle association antivirale (voir aussi «Contre-indications» et «Mises en garde et précautions»).
Interactions locales
Au vu des données pharmacocinétiques, il semble peu vraisemblable que les antifongiques et spermicides utilisés par voie vaginale puissent modifier l'efficacité ou la sécurité d'emploi de NuvaRing. Des cas de rupture de l'anneau vaginal ont cependant été rapportés lors de l'utilisation concomitante de médicaments par voie intravaginale (p.ex. des antifongiques) ou de lubrifiants (voir aussi «Posologie/Mode d'emploi», Rupture de l'anneau vaginal).
Utilisation en même temps que d'autres méthodes contraceptives vaginales
NuvaRing peut compromettre le placement et le positionnement corrects de certaines méthodes barrières féminines, tel qu'un diaphragme, une cape cervicale ou un préservatif féminin. Ces méthodes ne doivent pas être utilisées comme méthodes de recours avec NuvaRing.
Utilisation concomitante de tampons
Des données pharmacocinétiques montrent que l'utilisation de tampons n'a pas d'influence sur l'absorption systémique des hormones libérées. Dans de rares cas, NuvaRing peut être accidentellement expulsé lors du retrait d'un tampon (voir paragraphe «Posologie/Mode d'emploi» à la rubrique «Anneau vaginal temporairement hors du vagin (expulsion de l'anneau vaginal)»).
Grossesse, allaitementGrossesse
L'utilisation de NuvaRing n'est pas indiquée pendant la grossesse. Il faut donc exclure toute grossesse avant le début du traitement. Si une grossesse survient ou est suspectée lors de l'utilisation, NuvaRing doit être retiré immédiatement et le médecin consulté.
Des études expérimentales animales suggèrent des risques pour le fœtus (voir aussi «Données précliniques»). La plupart des études épidémiologiques réalisées jusqu'ici n'ont toutefois montré aucun indice clair en faveur d'un effet embryotoxique ou tératogène lors de l'utilisation accidentelle d'associations d'estrogènes et de progestatifs pendant la grossesse.
Allaitement
Le médicament ne doit pas être pris pendant l'allaitement, car il peut réduire la production de lait et modifier sa qualité; d'autre part, de faibles concentrations du principe actif peuvent être mesurées dans le lait. Des méthodes de contraception non hormonales devront si possible être utilisées jusqu'à ce que la mère ait complètement cessé d'allaiter.
Concernant le risque d'événements thromboemboliques chez la mère pendant la période puerpérale, voir la rubrique «Mises en garde et précautions».
Effet sur l’aptitude à la conduite et l’utilisation de machinesCompte tenu de son profil pharmacodynamique, NuvaRing ne devrait pas avoir d'influence sur l'aptitude à la conduite et à l'utilisation de machines.
Effets indésirablesLes effets indésirables les plus graves en rapport avec la prise de CHC sont décrits dans la rubrique «Mises en garde et précautions» (voir ci-dessus). Les effets indésirables sérieux incluent en particulier des thromboembolies artérielles et veineuses.
Les effets indésirables les plus fréquents qui ont été rapportés dans les études cliniques lors de l'utilisation de NuvaRing ont été les céphalées, la vaginite et les pertes vaginales (chacun chez 5-6% des utilisatrices). Les effets indésirables de l'utilisation de NuvaRing observés pendant les études cliniques et au cours de la surveillance du marché sont énumérés ci-dessous par système d'organes et par ordre d'incidence. Les catégories d'incidence sont définies comme suit:
Fréquents (≥1/100, <1/10); occasionnels (≥1/1000, <1/100); rares (≥1/10'000, <1/1000) et fréquence inconnue (essentiellement sur la base d'annonces spontanées issues de la surveillance du marché: la fréquence exacte ne peut pas être estimée sur la base des données disponibles).
Infections et infestations
Fréquents: candidose vaginale, infection mycotique vulvovaginale.
Occasionnels: cervicite, infection des voies urinaires, infection fongique, infection vaginale (p.ex. vaginite bactérienne).
Affections du système immunitaire
Rares: réactions d'hypersensibilité (y compris angio-œdème et réaction anaphylactique).
Troubles du métabolisme et de la nutrition
Fréquents: prise de poids.
Occasionnels: augmentation de l'appétit.
Affections psychiatriques
Fréquents: dépression, diminution de la libido.
Occasionnels: anxiété, modifications de l'humeur, fluctuations d'humeur.
Affections du système nerveux
Fréquents: maux de tête, migraine.
Occasionnels: vertiges, hypoesthésies.
Affections oculaires
Occasionnels: troubles visuels.
Affections vasculaires
Occasionnels: bouffée de chaleur, hypertension.
Rares: thromboembolie veineuse (p.ex. thrombose veineuse profonde, embolie pulmonaire), thromboembolie artérielle (p.ex. accident ischémique transitoire, accident vasculaire cérébral, infarctus du myocarde).
Affections gastro-intestinales
Fréquents: douleurs abdominales, nausées.
Occasionnels: vomissements, abdomen distendu, diarrhée, constipation.
Affections de la peau et du tissu sous-cutané
Fréquents: acné.
Occasionnels: exanthème, alopécie, eczéma, prurit, urticaire.
Affections musculosquelettiques et du tissu conjonctif
Occasionnels: douleurs dorsales, crampes musculaires, douleurs dans les extrémités.
Affections du rein et des voies urinaires
Occasionnels: dysurie, impériosité mictionnelle, pollakiurie.
Affections des organes de reproduction et du sein
Fréquents: douleurs au bas-ventre, sensibilité mammaire, dysménorrhée, pertes vaginales, prurit génital.
Occasionnels: troubles mammaires, ménorragie, métrorragie, aménorrhée, troubles vulvo-vaginaux (par ex. sécheresse vulvo-vaginale, sensation de brûlure dans le vagin, douleurs vaginales, odeur vaginale), crampes utérines, hypertrophie mammaire, syndrome prémenstruel, lésions fibrokystiques du sein, dyspareunie, saignements coïtaux, ectropion du col utérin, polypes cervicaux.
Rares: galactorrhée, troubles fonctionnels du pénis (y compris réactions locales du pénis) chez le partenaire.
Troubles généraux et anomalies au site d'administration
Fréquents: sensation de corps étranger, expulsion de l'anneau vaginal.
Occasionnels: malaise, asthénie, irritabilité, complications dues à l'anneau vaginal (par exemple, difficultés lors de l'introduction et/ou du retrait de l'anneau vaginal ), anneau vaginal rompu, œdèmes.
Fréquence inconnue: lésions vaginales en lien avec un anneau vaginal rompu.
L'annonce d'effets secondaires présumés après l'autorisation est d'une grande importance. Elle permet un suivi continu du rapport bénéfice-risque du médicament. Les professionnels de santé sont tenus de déclarer toute suspicion d'effet secondaire nouveau ou grave via le portail d'annonce en ligne ElViS (Electronic Vigilance System). Vous trouverez des informations à ce sujet sur www.swissmedic.ch.
SurdosageOn n'a jamais signalé de conséquences graves d'un surdosage en contraceptifs hormonaux. En cas de surdosage, on peut noter les symptômes suivants: nausées, vomissements et hémorragies vaginales. Ces dernières peuvent apparaître après une prise accidentelle de la préparation, même chez des jeunes filles qui n'ont pas encore eu leurs premières règles. Comme on ne connaît aucun antidote, le traitement doit être symptomatique.
Propriétés/EffetsCode ATC
G02BB01
Mécanisme d'action/pharmacodynamique
NuvaRing est un contraceptif hormonal à usage vaginal dont les principes actifs sont l'étonogestrel et l'éthinylestradiol. L'étonogestrel (ENG, 3-céto-désogestrel) est le métabolite biologiquement actif du désogestrel, un progestatif dérivé de la 19-nortestostérone, qui se lie avec une forte affinité aux récepteurs des progestatifs dans les organes cibles. L'éthinylestradiol (EE) est un estrogène qui entre dans la composition de nombreux contraceptifs.
Comme pour tous les contraceptifs hormonaux combinés (CHC), l'action contraceptive de NuvaRing repose sur différents facteurs dont les plus importants sont le blocage de l'ovulation et la modification de la glaire cervicale. En outre, l'endomètre offre des conditions défavorables à une nidation en raison des altérations morphologiques et enzymatiques qu'il subit. Enfin, du fait des modifications hormonales induites par le CHC, les cycles deviennent plus réguliers et les saignements moins abondants.
Efficacité clinique
Des études cliniques ont été menées chez des femmes âgées de 18 à 40 ans dans le monde entier. Dans ces études, l'indice de Pearl (IP) moyen s'élevait, compte tenu des erreurs d'utilisation et des erreurs de méthode, à 0,96 (IC à 95%: 0,64-1,39). Compte tenu uniquement des erreurs de méthode, l'IP est de 0,64 (IC à 95%: 0,35-1,07). L'indice de Pearl de NuvaRing est donc comparable à celui des contraceptifs oraux combinés.
Caractéristiques des hémorragies
Une vaste étude comparative de contraceptifs oraux contenant 150/30 µg de lévonorgestrel/éthinylestradiol (n=512 vs n=518) destinée à évaluer les caractéristiques des hémorragies pendant 13 cycles a montré une faible incidence des suintements hémorragiques ou des hémorragies en cours de cycle (2,0-6,4%) pendant l'utilisation de NuvaRing. En outre, chez la plupart des femmes (58,8-72,8%), les hémorragies vaginales sont survenues exclusivement pendant la période sans anneau vaginal.
Effets sur la densité osseuse
L'influence de NuvaRing sur la densité osseuse (n=76) a été comparée à celle d'un DIU non hormonal (n=31) pendant deux ans. Aucun effet indésirable sur la densité osseuse n'a été observé.
PharmacocinétiqueAbsorption
Étonogestrel (ENG)
L'ENG libéré par NuvaRing est rapidement absorbé par la muqueuse vaginale. Des concentrations sériques maximales d'environ 1700 pg/ml d'ENG sont atteintes environ 1 semaine après la mise en place de l'anneau vaginal. Il existe de légères fluctuations des taux sériques, ces derniers diminuent lentement à 1600 pg/ml après 1 semaine, 1500 pg/ml après 2 semaines et 1400 pg/ml au bout de 3 semaines. La biodisponibilité absolue de l'ENG est d'environ 100% et est donc plus élevée qu'après l'administration orale de désogestrel.
Chez quelques utilisatrices (n=8) de NuvaRing ou d'un contraceptif combiné oral contenant 0,15 mg de désogestrel et 0,02 mg d'éthinylestradiol, on a déterminé les concentrations cervicales et intra-utérines d'étonogestrel. Ces concentrations étaient comparables entre les deux produits.
Éthinylestradiol (EE)
L'EE libéré par NuvaRing est rapidement absorbé par la muqueuse vaginale. Les concentrations sériques maximales, d'environ 35 pg/ml, ont été atteintes trois jours après la mise en place de l'anneau vaginal. Après 1 semaine, les concentrations sont tombées à 19 pg/ml; au moment du retrait de l'anneau vaginal, après trois semaines, elles étaient encore de 18 pg/ml environ. L'aire sous la courbe sur un mois a été calculée à 10,9 ng×h/ml.
La biodisponibilité absolue est d'environ 56%, et comparable à celle obtenue après l'administration orale d'EE.
Chez quelques utilisatrices (n=8) de NuvaRing ou d'un contraceptif combiné oral contenant 0,150 mg de désogestrel et 0,020 mg d'éthinylestradiol, on a déterminé des concentrations cervicales et intra-utérines d'éthinylestradiol. Les concentrations trouvées étaient comparables.
Distribution
ENG
L'ENG se lie à la sérumalbumine et à la SHBG (globuline fixant les hormones sexuelles). Seuls 2 à 4% de la concentration sérique totale se trouvent sous forme de stéroïde libre, 40-70% sont spécifiquement liés à la SHBG, avec une forte affinité. L'augmentation de la concentration de SHBG induite par l'éthinylestradiol modifie le taux relatif de liaison aux protéines sériques, ce qui conduit à une augmentation de la liaison à la SHBG, à une diminution de la liaison à l'albumine et à une diminution de la fraction libre. Le volume de distribution apparent de l'ENG est de 2,3 l/kg.
EE
L'EE est très fortement lié à la sérumalbumine (environ 98,5%), mais de façon non spécifique, et il induit une augmentation de la concentration sérique de SHBG. Le volume apparent de distribution est d'environ 15 l/kg.
Métabolisme
ENG
Dans le foie, l'étonogestrel est hydroxylé et réduit par l'iso-enzyme CYP3A4 et conjugué à des sulfates et des glucuronides. Les métabolites sont inactifs. Aucune interaction métabolique n'a été observée lors de l'administration concomitante d'éthinylestradiol (EE).
EE
L'EE est essentiellement métabolisé par hydroxylation aromatique, ce qui aboutit à la formation de nombreux métabolites hydroxylés et méthylés. Ces derniers se trouvent sous forme libre ou sous forme de sulfo- et glucuronoconjugués. Le cytochrome 3A4 joue un rôle déterminant dans le métabolisme.
Elimination
ENG
Les taux sériques d'ENG diminuent selon un processus biphasique, avec une demi-vie terminale d'environ 29 heures. La clairance plasmatique apparente est d'environ 3,5 l/h. L'ENG et ses métabolites sont excrétés dans les urines et les selles dans une proportion d'environ 1,7:1. La demi-vie d'élimination des métabolites est d'environ 6 jours.
EE
Les taux sériques d'EE diminuent selon un processus biphasique, avec une demi-vie terminale moyenne d'environ 34 heures (importantes variations individuelles). La clairance apparente est d'environ 35 l/h. L'éthinylestradiol est totalement métabolisé et n'est pas excrété sous forme inchangée; les métabolites sont excrétés par voies rénale et biliaire dans la proportion de 1,3:1. La demi-vie des métabolites est d'environ 1,5 jour. Les conjugués sont métabolisés selon un cycle entéro-hépatique.
Cinétique pour certains groupes de patients
Troubles de la fonction hépatique
Aucune étude n'a été effectuée sur les répercussions éventuelles d'une insuffisance hépatique sur la pharmacocinétique de NuvaRing. On sait toutefois que les hormones stéroïdiennes sont métabolisées plus lentement chez les patients atteints d'insuffisance hépatique.
Troubles de la fonction rénale
Aucune étude n'a été menée sur les effets éventuels d'une insuffisance rénale sur la pharmacocinétique de NuvaRing.
Enfants et adolescents
La pharmacocinétique de NuvaRing a été étudiée exclusivement chez les adultes.
Données précliniquesLes études précliniques visant à évaluer la toxicité de doses répétées de contraceptifs oraux combinés, la génotoxicité et le potentiel cancérogène ainsi que les études de la toxicité sur la reproduction n'ont révélé aucun signe clair de risques particuliers pour l'espèce humaine.
Chez l'animal, l'éthinylestradiol a eu un effet embryolétal, même à des doses relativement faibles; on a observé des malformations urogénitales et une féminisation des fœtus mâles. Chez l'animal, les substances de type progestatif ont un effet embryolétal; à fortes doses, elles ont un effet virilisant sur les fœtus femelles. Les études de toxicité sur la reproduction menées chez le rat, la souris et le lapin n'ont montré aucun signe d'effet tératogène. Pour les risques dans l'espèce humaine, voir le paragraphe «Grossesse, Allaitement».
Remarques particulièresInfluence sur les méthodes de diagnostic
Les stéroïdes contraceptifs peuvent influer sur les résultats de certains examens de laboratoire, tels que paramètres biochimiques de la fonction hépatique, thyroïdienne, surrénalienne et rénale, taux plasmatiques des protéines (de transport) et lipides/fractions de lipoprotéines et paramètres du métabolisme glucidique, de la coagulation et de la fibrinolyse. En général, ces modifications restent comprises dans les limites de la fourchette normale.
Stabilité
Le médicament ne doit pas être utilisé au-delà de la date figurant après la mention «EXP» sur l'emballage.
Au moment de la remise: le médecin ou le pharmacien note la date de la vente sur la boîte. Ne pas utiliser NuvaRing au-delà de 4 mois après la date de vente ou au-delà de la date de péremption (respecter la première de ces deux dates).
Conservation par l'utilisatrice: utiliser le produit dans les 4 mois suivant la remise et avant la date de péremption.
Remarques particulières concernant le stockage
À conserver dans l'emballage d'origine.
Avant la remise à l'utilisatrice: conserver au réfrigérateur (2-8°C).
Conservation par l'utilisatrice: conserver à 2-30°C, dans l'emballage d'origine et à l'abri de la lumière.
Conserver hors de portée des enfants.
Remarques concernant la manipulation
Après le retrait, il faut replacer le NuvaRing dans le sachet refermable et le jeter ainsi dans les ordures ménagères afin d'éviter que des personnes puissent entrer en contact avec lui accidentellement. Ne pas jeter NuvaRing dans les toilettes.
Numéro d’autorisation56038 (Swissmedic).
PrésentationNuvaRing est emballé dans un sachet refermable et imperméable à l'eau.
Emballage de 1 anneau vaginal [B].
Emballage de 3 anneaux vaginaux [B].
Titulaire de l’autorisationOrganon GmbH, Lucerne
Mise à jour de l’informationJuillet 2024
OG8342A-NuvaRing-072024-HMV4+removal-contraindication-pregnancy-RCN100002628-CH+RCN100004172-CH
|









